-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Feochromocytom a paragangliom: stručný souhrn pro praxi
Autoři: prof. MUDr. Zelinka Tomáš, CSc.
Působiště autorů: Centrum pro diagnostiku a léčbu hypertenze, 3. interní klinika – klinika endokrinologie a metabolismu, 1. LF UK a VFN, Praha
Vyšlo v časopise: Svět praktické medicíny, 2, 2021, č. 5, s. 80-83
Kategorie: Medicína v ČR: přehledový článek
Souhrn
Feochromocytom a paragangliom jsou vzácné nádory vycházející z chromafinních buněk. Typická je pro ně produkce katecholaminů a s ní související klinické symptomatologie, a to včetně život ohrožujících stavů. Nejdůležitější částí diagnostiky je vůbec na možnost těchto nádorů pomyslet. Základním diagnostickým nástrojem je stanovení metanefrinů, ze zobrazovacích metod pak CT a případně i nukleární medicína. Základním léčebným opatřením je chirurgické odstranění nádorů. Po operaci mají být všichni pacienti sledováni pro možnost recidivy či metastatického postižení a mělo by jim být nabídnuto genetické vyšetření.
Feochromocytom a paragangliom jsou vzácné nádory, které vychází z chromafinních buněk. V případě feochromocytomu jsou to buňky dřeně nadledviny, v případě paragangliomu buď buňky sympatických paraganglií břicha, malé pánve a zadního mediastina, nebo buňky parasympatických paraganglií hlavy, krku a předního mediastina. Feochromocytomy a sympatické paragangliomy (PPGL) bývají sekrečně aktivní, kdežto parasympatické bývají sekrečně němé.1 V našem přehledu se budeme věnovat PPGL s ohledem na jejich klinické příznaky a projevy, i když v některých případech budeme brát v úvahu oba druhy paragangliomů.
Výskyt
PPGL jsou poměrně vzácné nádory, i když jejich prevalence v poslední době mírně stoupá. Je to v důsledku širokého použití zobrazovacích metod, jako je ultrazvuk nebo výpočetní tomografie (CT) (méně pak magnetická rezonance [MR]). Nedávno byly publikovány dvě práce z Nizozemska a Dánska, ukazující podobnou incidenci asi 0,5 případu feochromocytomu na 100 000 obyvatel a asi 0,11 případu sympatického paragangliomu. Navýšení jejich počtu je doprovázeno zmenšením velikosti nádorů a také výrazným zmírněním symptomatologie pacientů. S tím souvisí postupné navyšování věku pacientů s diagnostikovaným PPGL. Dá se tedy shrnout, že většina PPGL bude dnes diagnostikována nejdříve pomocí morfologického vyšetření jako tzv. náhodně zjištěný tumor („incidentalom“) buď nadledviny, nebo retroperitonea (méně hrudníku nebo malé pánve).
PPGL jsou nádory zajímavé z mnoha pohledů. Jedním z nich je i jeho biologické chování – nikdy bychom v souvislosti s PPGL neměli použít výraz „benigní“ pro možnost recidivy nebo výskyt metastáz v pozdějším sledování. V souvislosti s PPGL by se také neměl používat výraz „maligní“, neboť jediným kritériem pro malignitu je nález metastáz (= přítomnost chromafinních buněk ve tkáních, kde se normálně nevyskytují) v lymfatických uzlinách, kostech, játrech nebo v plicích. Samotný histologický popis s nálezem znaků, které u jiných nádorů znamenají malignitu, může v případě PPGL znamenat jen vyšší riziko rozvoje metastáz v dalším sledování.2 K dispozici je také již pro PPGL klasifikace TNM.
Genetika
Dalším aspektem, který činí PPGL zajímavé, je jeho genetické pozadí. Dodnes bylo popsáno více než 20 genů, které mohou být zodpovědné za vznik PPGL. PPGL mohou být součástí známých genetických syndromů (Tab. 1). Všechny geny zodpovědné za vznik PPGL můžeme rozdělit do 2 (3) základních skupin – pseudohypoxické (cyklus trikarboxylových skupin nebo VHL/EPAS) a kinázové (a zcela vzácné WNT).
Tab. 1. Charakteristika feochromocytomu a paragangliomu u jednotlivých syndromů 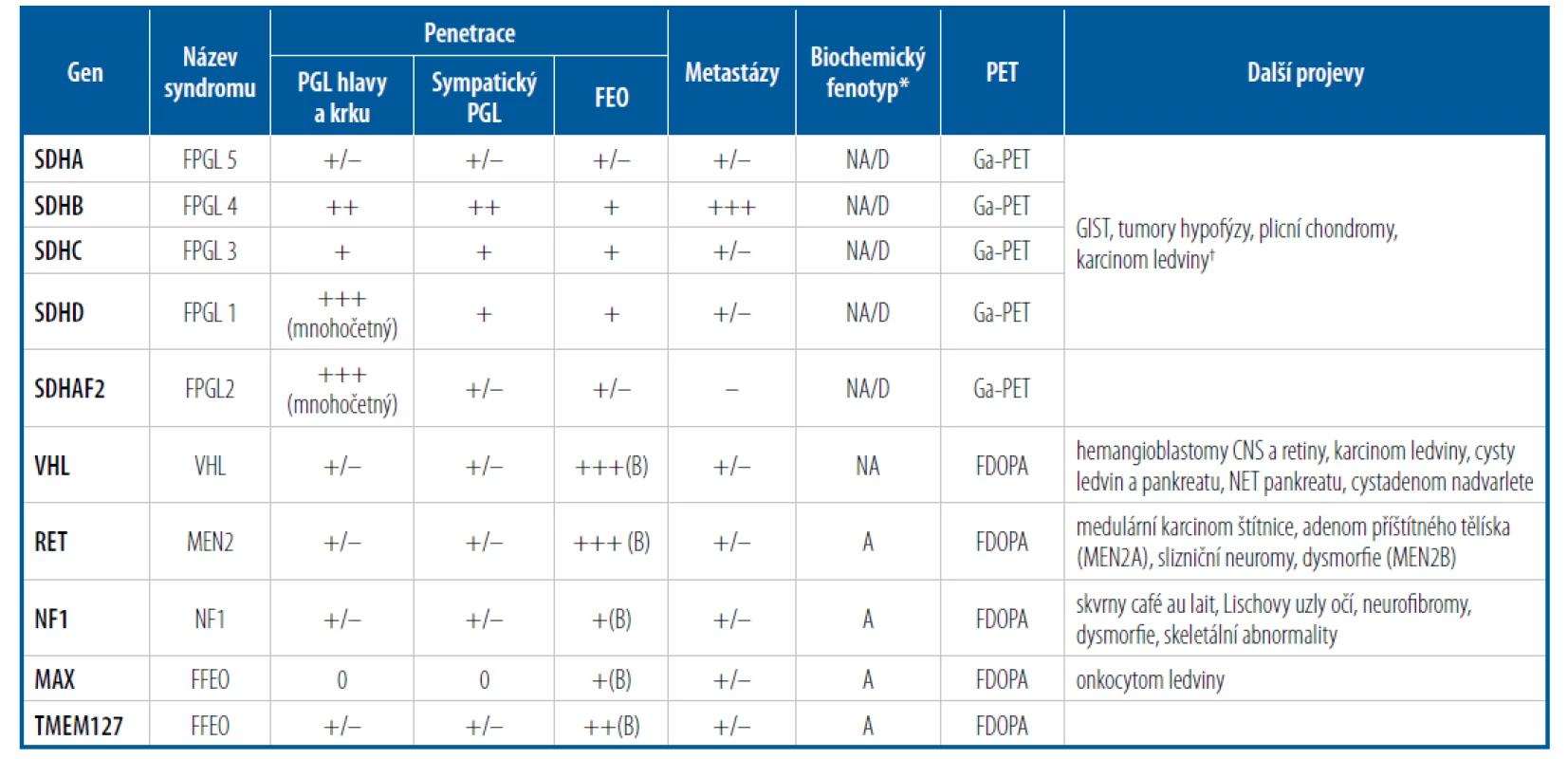
A – adrenalin nebo metanefrin, B – bilaterální, CNS – centrální nervový systém, D – dopamin nebo metoxytyramin;
FEO – feochromocytom, FFEO – familiární feochromocytom, FPGL – syndrom familiární paragangliomatózy, GIST – gastrointestinální stromální nádor, MEN – mnohočetná endokrinní neoplazie, NA – noradrenalin nebo normetanefrin, NET – neuroendokrinní nádor, NF1 – neurofibromatóza 1. typu, PGL – paragangliom, VHL – von Hippel-Lindau;
+/– vzácný, + nízký, ++ střední, +++ vysoký;
*Týká se jen sympatických PGL a FEO.
†U pacientů s mutacemi genu SDHA-SDHD se kombinace GIST a PGL nazývá Carneyův-Stratakisův syndrom a kombinace GIST, PGL a plicního chondromu Carneyův syndrom.Genetické vyšetření by mělo být dnes nabídnuto všem pacientům, kteří mají diagnostikovaný tento nádor. Mělo by být provedeno pomocí sekvenování nové generace, jež umožňuje vyšetřit všechny geny v rámci jednoho vyšetření. Vyšetření je možné provést buď z periferní krve, nebo také ze tkáně nádoru. O genetickém pozadí může také napovědět imunohistochemické vyšetření na přítomnost sukcinátdehydrogenázy.3
Klinická prezentace
Projevy a příznaky PPGL jsou způsobeny na jedné straně sekrecí katecholaminů – adrenalinem a noradrenalinem (a případně dalších látek, jako může být například interleukin 6, adrenokortikotropní hormon [ACTH] či jiné látky), na straně druhé pak i vlastním růstem tumoru. PPGL mohou totiž dosahovat velkých rozměrů – nádory větší než 10 cm nejsou vzácností a mohou vážit i přes 1 kg (u nás vážil největší tumor 1,25 kg).
Katecholaminy mohou být vylučovány nádorovou buňkou buď trvale, nebo paroxysmálně. Způsob vylučování může být podmíněn i geneticky – trvalé vylučování katecholaminů je typické pro von Hippelův-Lindauův syndrom, a naopak záchvatovité pro syndrom mnohočetné endokrinní neoplazie 2. typu. K setrvalým projevům můžeme řadit především arteriální hypertenzi, kdežto záchvatovité příznaky mohou být již velmi rozmanité – typicky jsou to bolesti hlavy, pocení a palpitace (tzv. feochromocytomová triáda), dále pak i zblednutí a jiné (Tab. 2). Je velmi důležité mít na paměti, že odpověď organismu na nadbytek katecholaminů je velmi individuální a že neexistuje korelace mezi množstvím vylučovaných katecholaminů a klinickými projevy. Klinický obraz je totiž modifikován i různou mírou desenzitizace katecholaminových receptorů – můžeme se tedy setkat jak se zcela asymptomatickými pacienty na jedné straně a na straně druhé s takovými, jež mohou záchvatovité projevy významně omezovat na životě. Feochromocytomové záchvaty mohou být vyvolány i různými podněty, jako je např. úvod do anestezie nebo manipulace s tumorem, případně močení. Jsou známé i některé látky, které mohou vyvolat katecholaminovou krizi, jako jsou glukagon, histamin, tricyklická antidepresiva, kortikoidy, sympatomimetika, opioidy, inhibitory monoaminooxidázy nebo metoklopramid.
Tab. 2. Klinické příznaky a projevy typické pro pacienty s feochromocytomem a sympatickým paragangliomem (PPGL) 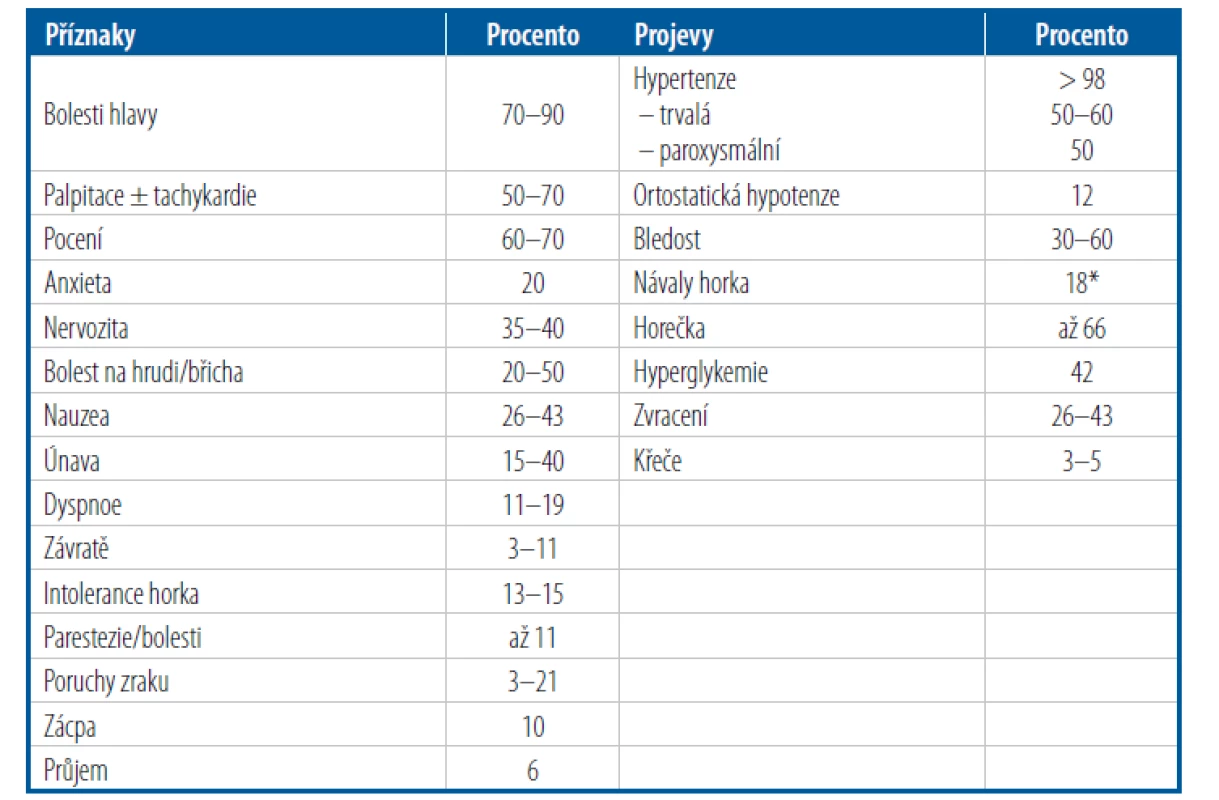
* Pro PPGL je typická změna barvy kůže zblednutí. Zčervenání se naopak vyskytuje u PPGL mnohem méně, a tedy samotné záchvatovité zčervenání nebývá projevem PPGL. V některých případech může vést akutní sekrece katecholaminů až k život ohrožujícím stavům, jako jsou náhlá smrt, akutní srdeční selhání až v podobě kardiogenního šoku (typicky pod obrazem takotsubo kardiomyopatie), arytmie (brady - i tachyarytmie), akutního infarktu myokardu II. typu (feochromocytomový záchvat je často doprovázen bolestmi na hrudi a může být doprová zen i zvýšením troponinů, ačkoliv není přítomná významnější stenóza koronárního řečiště), cévní mozkové příhody nebo disekujícího aneurysmatu aorty.4 K nekardiálním akutním situacím patří paralytický ileus (u metastatických PPGL může být i příčinou úmrtí) nebo diabetická ketoacidóza.
Metabolické působení katecholaminů může být spojeno jak s hmotnostním úbytkem (ale pacienti s PPGL mohou být i výrazně obézní), tak i s poruchami metabolismu glukózy.5, 6
Samotná hypertenze může být u PPGL velmi proměnlivá – tedy od velmi lehké až po velmi těžkou. Setrvalá hypertenze může být kombinovaná se záchvaty, ale také nemusí. Pacienti mohou mít mezi záchvaty normální i nižší krevní tlak. A ne zcela vzácně se můžeme setkat s pacienty, kteří mohou mít i těžkou arteriální hypertenzi v kombinaci s život velmi omezujícími ortostatickými poklesy TK.7 Působení katecholaminů je doprovázeno i zhoršením funkce myokardu.8
Stavy, u nichž bychom měli myslet na PPGL, jsou uvedeny v Tabulce 3.1
Tab. 3. Stavy, u nichž by měl být proveden screening feochromocytomu a sympatického paragangliomu 
*Může platit i pro náhodně zjištěné tumory retroperitonea, jejichž morfologický obraz připouští možnost paragangliomu.
BMI – body mass index, FEO – feochromocytom, HU – Hounsfieldovy jednotky, PGL – paragangliomy,
PPGL – feochromocytom a sympatické paragangliomyDiagnostika
Laboratorní diagnostika
Vyloučit či potvrdit diagnózu PPGL můžeme jedině příslušným laboratorním testem. Protože je PPGL vzácná a současně život ohrožující diagnóza, potřebujeme test s vysokou senzitivitou a také specificitou. Ta je důležitá i z důvodu, že často potřebujeme vyloučit PPGL u pacientů s panickými atakami, pro něž by mohlo opakování vyšetření představovat zbytečnou zátěž. Testem, který tento požadavek splňuje, je vyšetření metanefrinů v plazmě nebo v moči. Výhodou metanefrinů ve srovnání s mateřskými katecholaminy je ta skutečnost, že jsou produkovány nádorovou buňkou kontinuálně na rozdíl od mateřských katecholaminů. Není tedy nutné provádět odběry v době obtíží pacienta. Stanovení metanefrinů v plazmě je výhodnější nejen z důvodu absence močového sběru (sběr moči za 24 hodin vyžaduje velkou spolupráci pacienta), ale také z důvodu jejich lepší specificity. Pokud to podmínky dovolí, měli bychom preferovat odběr plazmatických metanefrinů za standardních podmínek – vleže asi 20 minut po zavedení intravenózní kanyly. Jak samotný vpich, tak i poloha pacienta mohou konečný výsledek ovlivnit. I v případě PPGL musíme myslet na možnost jejich ovlivnění medikací – v tomto případě se jedná o psychofarmaka interagující s vychytáváním noradrenalinu nebo případně i antiparkinsonika. Konečný výsledek metanefrinů může být ovlivněn i hemodynamickým stavem pacienta – vždy bychom měli dbát na to, aby byl pacient ve stabilním stavu. Ve specifických případech může být výhodné stanovení metoxytyraminu – jeho zvýšení je typické pro pacienty s mutací genu SDHB.9 Ten ale stanovují jen specializované laboratoře. Zvýšený bývá také u PPGL chromogranin, marker neuroendokrinních nádorů. Jeho nevýhodou je ve srovnání s metanefriny nižší senzitivita. Pokud pacient užívá inhibitory protonové pumpy nebo má atrofickou gastritidu, může být chromogranin výrazně zvýšený, aniž má pacient PPGL či jiný neuroendokrinní nádor. I tato skutečnost použití chromograninu limituje. V některých případech může být chromogranin jediným zvýšeným markerem – i v tomto případě se může jednat o tumory na podkladě mutace genu SDHB.10
Morfologická diagnostika
S ohledem na skutečnost, že dnes už ve valné většině případů předchází morfologická diagnostika laboratorní, může být vlastně diskuse o použití určité zobrazovací metody spíše akademická. Základním morfologickým vyšetřením při podezření na PPGL by mělo být CT vyšetření, ideálně břicha a malé pánve. U pacientů s izolovanou sekrecí normetanefrinu či noradrenalinu (= noradrenergní biochemický fenotyp) je vhodné současně doplnit i zobrazení hrudníku, neboť u těchto pacientů můžeme očekávat i možnost sympatického paragangliomu v oblasti hrudníku. Feochromocytom má relativně typické znaky na CT – nejtypičtějším je pak to, že nikdy nemá denzitu nižší než 10 HU (Hounsfieldovy jednotky).11 Z toho tedy vyplývá, že u nádorů s nižší denzitou než 10 HU nemusíme laboratorně vylučovat feochromocytom.12 Magnetická rezonance neposkytuje prakticky žádné výhody ve srovnání s CT – přednost by měla mít jen u mladých žen, dětí a u pacientů alergických na jodovou kontrastní látku. Morfologická diagnostika vlastních sympatických paragangliomů je ještě složitější – často jsou diagnostikovány až při operaci, kdy anesteziology překvapí neočekávaná hemodynamická nestabilita, nebo až při patologickém vyšetření.
Ve stagingu PPGL je vhodné využít i možnosti funkční medicíny – ve své podstatě ji nemusíme využít jen u drobných feochromocytomů menších než 4 cm, které neprodukují metanefrin (adrenalin). U těch ostatních je vyšší riziko buď metastatického rozsevu, nebo také mnohočetného postižení. Dnes už dáváme přednost metodám založeným na pozitronové emisní tomografii (PET) pomocí radiofarmak specifických pro PPGL – pro feochromocytomy to je 18F-DOPA a pro paragangliomy to je 68Ga-DOTATATE. 123I-metajodbenzylguanidin (MIBG) dnes použijeme jen v případě úvahy o terapeutickém využití MIBG nebo při nedostupnosti FDOPA. Druhé zmíněné radiofarmakum již může mít přímé terapeutické konsekvence.13
Terapie
Medikamentózní
Základním opatřením, jak omezit působení katecholaminů, je blokáda katecholaminových receptorů. Nejdůležitějším receptorem pro blokádu je vazokonstrikčně působící alfa1-receptor. Klinické obtíže i krevní tlak snížíme nejlépe pomocí alfablokátorů – buď nespecifickým fenoxybenzaminem (ten ale není u nás k dispozici), nebo specifickým alfa1-blokátorem, nejčastěji doxazosinem. Be tablokátory nasazujeme jen v případě tachykardie po nasazení alfablokátorů. V některých případech pak podáváme dávky alfablokátoru, které mohou výrazně přesahovat dávky doporučené v SPC. U feochromocytomové krize je nutné podávat intravenózní léky – v ČR nejčastěji urapidil. Podle současných doporučení by měl každý pacient dostat před operací alfablokátory, byť se ukazuje, že i tato léčba nedokáže zabránit hemodynamické instabilitě při operaci.
Chirurgická
Základní léčebným nástrojem u PPGL je operace – u feochromocytomů adrenalektomie, u paragangliomů pak jejich exstirpace. S ohledem na vzácnost nádoru na jedné straně a na druhé straně i složitost vedení operace (výrazné vzestupy TK při manipulace tumorem nebo při úvodu do anestezie či výrazný pokles TK po uvolnění tumoru) je nutné, aby tito pacienti byli operováni v centrech s dostatečnou zkušeností. Metodou volby je u feochromocytomů minimálně invazivní přístup (v našich podmínkách většinou laparoskopický, méně pak i retroperitoneoskopický), u paragangliomů je přístup volen podle lokalizace nádorů. Minimálně invazivní přístup je možný i u větších až velkých feochromocytomů. U bilaterálního postižení by měla být vždy zvážena i možnost kůru nadledvin šetřící operace.
Pooperační sledování
Po operaci je nutné všechny pacienty zkontrolovat, zda došlo k normalizaci předoperačně zvýšených parametrů. V ideálním případě by mělo dojít k vymizení záchvatovitých obtíží, zácpy, normalizaci hodnot TK a také glykemie. Z tohoto důvodu je nutné pacientům po operaci ihned upravit jejich předoperační léčbu. V dlouhodobém horizontu je nutné pacienty po operaci dále sledovat pro možnost recidivy nebo založení metastáz. V pětiletém horizontu můžeme očekávat asi 5% pravděpodobnost vzniku metastáz. Větší riziko je u pacientů s většími nádory, s extraadrenálním postižením a dalšími histologickými znaky. Nejvyšší riziko je u nosičů mutace genu SDHB. Minimální délka sledování by měla být 10 let, u mladých pacientů nebo těch s vyšším rizikem pak až doživotní. Interval pro sledování by měl být půl roku u rizikových pacientů (typicky pacienti s mutací genu SDHB, kteří mají nejvyšší riziko metastatického postižení), u méně rizikových pacientů může dostačovat roční interval. Základním nástrojem pro dlouhodobé sledování je stanovení metanefrinů. U pacientů s genetickými syndromy musíme doplňovat i zobrazovací vyšetření. To má přednost u afunkčních nádorů.1
Metastatické postižení
Také v tomto případě je nejlepší nabídkou pro pacienta operační řešení. I pouhý debulking může zlepšit jeho prognózu. Vlastní léčba je u těchto pacientů složitá – jedná se o vzácné nádory s velmi rozdílným průběhem onemocnění. Můžeme se setkat s pacienty, kteří i bez léčby přežívají roky bez výraznějších známek progrese onemocnění, i s těmi, u nichž onemocnění progreduje před očima. U pacientů, kteří mají pozitivní Ga-PET, můžeme použít PRRT (peptide receptor radionuclide therapy), která má pravděpodobně lepší účinnost než léčebné podání MIBG. U rychle progredujících tumorů je namístě chemoterapie, byť jsou její výsledky omezené. Ale i v této oblasti se objevují již určité známky naděje.14
Závěr
Feochromocytomy a paragangliomy jsou velmi vzácné nádory s velmi proměnlivou symptomatologií. Z tohoto důvodu je důležité na ně nejen myslet, ale také zajistit, aby byly léčeny v centrech s dostatečnou zkušeností.
Zdroje
1. Lenders JWM, Kerstens MN, Amar L, Prejbisz A, Robledo M, Taieb D, et al. Genetics, diagnosis, management and future directions of research of phaeochromocytoma and paraganglioma: a position statement and consensus of the Working Group on Endocrine Hypertension of the European Society of Hypertension. J Hypertens 2020;38 : 1443–1456.
2. Wachtel H, Hutchens T, Baraban E, Schwartz LE, Montone K, Baloch Z, et al. Predicting metastatic potential in pheochromocytoma and paraganglioma: a comparison of PASS and GAPP Scoring Systems. J Clin Endocrinol Metab 2020;105:e4661–e4670.
3. Nolting S, Bechmann N, Taieb D, Beuschlein F, Fassnacht M, Kroiss M, et al. Personalized management of pheochromocytoma and paraganglioma. Endocrine reviews 2021.
4. Zelinka T, Petrák O, Turková H, Holaj R, Štrauch B, Kršek M, et al. High incidence of cardiovascular complications in pheochromocytoma. Horm Metab Res 2012;44 : 379–384.
5. Petrak O, Klimova J, Mraz M, Haluzikova D, Dolezalova RP, Kratochvilova H, et al. Pheochromocytoma with adrenergic biochemical phenotype shows decreased GLP-1 secretion and impaired glucose tolerance. J Clin Endocrinol Metab 2020;105 : 1878–1887.
6. Petrák O, Haluzíková D, Kaválková P, Štrauch B, Rosa J, Holaj R, et al. Changes in energy metabolism in pheochromocytoma. J Clin Endocrinol Metab 2013;98 : 1651–1658.
7. Petrák O, Rosa J, Holaj R, Štrauch B, Krátká Z, Kvasnička J, et al. Blood pressure profile, catecholamine phenotype, and target organ damage in pheochromocytoma/paraganglioma. J Clin Endocrinol Metab 2019;104 : 5170–5180.
1 8. Kvasnička J, Zelinka T, Petrák O, Rosa J, Štrauch B, Krátká Z, et al. Catecholamines induce left ventricular subclinical systolic dysfunction: a speckle-tracking echocardiography study. Cancers 2019;11 : 318.
1 9. Eisenhofer G, Prejbisz A, Peitzsch M, Pamporaki C, Masjkur J, Rogowski-Lehmann N, et al. Biochemical diagnosis of chromaffin cell tumors in patients at high and low risk of disease: plasma versus urinary free or deconjugated o-methylated catecholamine metabolites. Clin Chem 2018;64 : 1646–1656.
10. Zuber S, Wesley R, Prodanov T, Eisenhofer G, Pacak K, Kantorovich V. Clinical utility of chromogranin A in SDHx-related paragangliomas. Eur J Clin Invest 2014;44 : 365–371.
11. Čtvrtlík F, Tudos Z, Szasz P, Sedláčková Z, Hartmann I, Schovánek J, et al. Characteristic CT features of pheochromocytomas – probability model calculation tool based on a multicentric study. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub 2019;163 : 212–219.
12. Canu L, Van Hemert JAW, Kerstens MN, Hartman RP, Khanna A, Kraljevic I, et al. CT characteristics of pheochromocytoma: relevance for the evaluation of adrenal incidentaloma. J Clin Endocrinol Metab 2019;104 : 312–318.
13. Taieb D, Hicks RJ, Hindie E, Guillet BA, Avram A, Ghedini P, et al. European Association of Nuclear Medicine Practice Guideline/Society of Nuclear Medicine and Molecular Imaging Procedure Standard 2019 for radionuclide imaging of phaeochromocytoma and paraganglioma. Eur J Nucl Med Mol Imaging 2019;46 : 2112–2137.
14. Granberg D, Juhlin CC, Falhammar H. Metastatic pheochromocytomas and abdominal paragangliomas. J Clin Endocrinol Metab 2021;106:e1937–e1952.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Úvodní slovoČlánek Domácí měření krevního tlakuČlánek Nové evropské registraceČlánek Hypertenze a fibrilace síníČlánek DoporučujemeČlánek Chronická žilní insuficience
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2021 Číslo 5- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Úvodní slovo
- Komentář k článku Post-JIP péče v ambulantním prostředí
- Komentář k článku Post-JIP péče v ambulantním prostředí
- Top 20 výzkumných studií roku 2020 pro lékaře primární péče
- Komentář k článku Top 20 výzkumných studií roku 2020 pro lékaře primární péče
- Komentář k článku Top 20 výzkumných studií roku 2020 pro lékaře primární péče
- Terapie budoucnosti – CAR-T terapie
- Kombinační léčba hypertenze a změny kalemie
- Léčba hypertenze u nemocných s diabetes mellitus
- MUDr. Marie Svatošová: V hospici se dá zažít radost tak intenzivní, že člověku brání usnout
- Indapamid – kardioprotektivní přístup v léčbě hypertenze
- Postavení telmisartanu a candesartanu v léčbě arteriální hypertenze
- Léčba hypertenze v perioperačním období
- Domácí měření krevního tlaku
- 24hodinové ambulantní monitorování krevního tlaku: základní informace
- Jsou nové přístupy k měření krevního tlaku vhodné pro klinickou praxi?
- Diagnostika a léčba hypertenze u mladých lidí
- Erektilní dysfunkce u hypertenze a dalších kardiovaskulárních onemocnění
- Nové evropské registrace
- Hypertenze a fibrilace síní
- Primární hyperaldosteronismus
- Doporučujeme
- Feochromocytom a paragangliom: stručný souhrn pro praxi
- Profil léčivého přípravku Isoprinosine 500 mg tablety
- Chronická žilní insuficience
- Post-JIP péče v ambulantním prostředí
- Léčba nadváhy a obezity – významný nástroj v optimálním managementu diabetu
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Léčba hypertenze v perioperačním období
- Primární hyperaldosteronismus
- Diagnostika a léčba hypertenze u mladých lidí
- Profil léčivého přípravku Isoprinosine 500 mg tablety
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



