-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Zánětlivá střevní onemocnění u dětí
Autoři: MUDr. Mitrová Katarína, PhD.
Působiště autorů: Pediatrická klinika, FN Motol a 2. LF UK, Praha
Vyšlo v časopise: Svět praktické medicíny, 2, 2021, č. 4, s. 53-58
Kategorie: Medicína v ČR: přehledový článek
Souhrn
Zánětlivá střevní onemocnění (idiopatické střevní záněty, inflammatory bowel diseases, IBD) představují skupinu chronických imunitně podmíněných chorob trávicího traktu, ke kterým řadíme Crohnovu nemoc (CD) a ulcerózní kolitidu (UC). V případě, že není možné zařazení ani do jedné ze zmiňovaných skupin, mluvíme o tzv. nezařaditelném zánětu neboli IBD un-classified (IBDU), někdy označovaném také jako indeterminovaná kolitida. Nicméně i tyto tři jednotky mají řadu fenotypově odlišných podtypů.
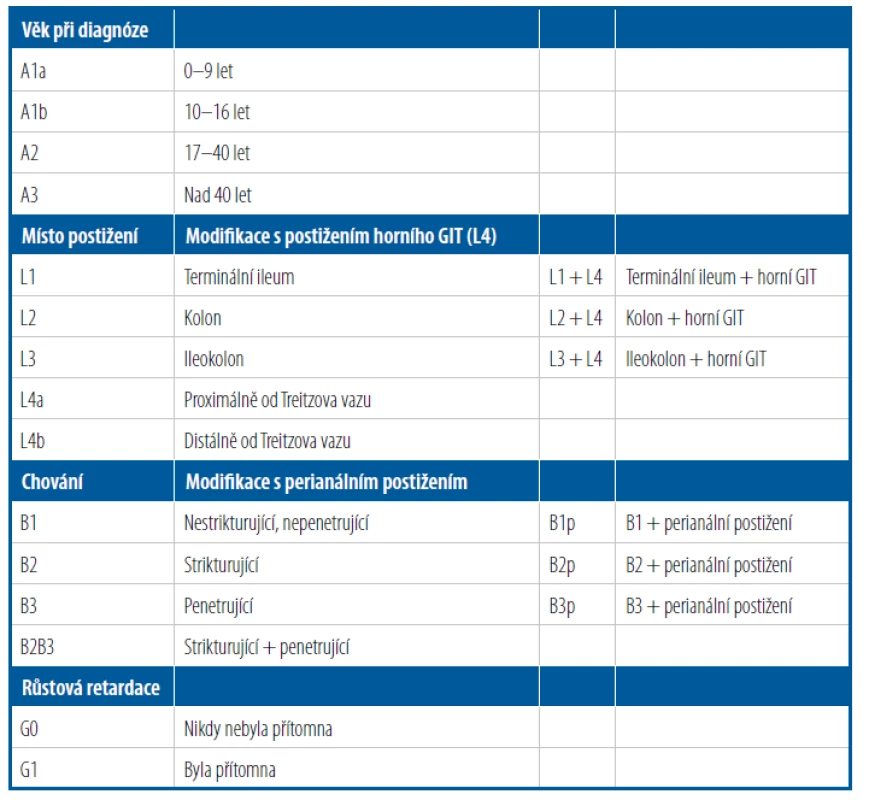
Zatímco CD je charakterizovaná transmurálním segmentálním zánětem postihujícím kteroukoliv část trávicího traktu, pro UC je typický slizniční zánět kolon, postupující kontinuálně proximálním směrem od rekta a postihující různě velkou část tlustého střeva. Jelikož se u CD jedná o zánět transmurální, častými komplikacemi jsou píštěle a abscesy. U dětí může být určení typu nemoci někdy obtížné, jelikož se jednotlivé fenotypy, jak již bylo zmíněno, mohou prolínat. Klasifikace usnadňující přesnější zařazení nemoci a zohledňující některá specifika dětského věku je označována jako tzv. Pařížská klasifikace (Tab. 1).1
Výskyt
Incidence IBD v posledních letech narůstá zejména v rozvinutých zemích, podobně jako je tomu i u jiných imunitně podmíněných onemocnění. Nejméně u 10 % pacientů dojde k manifestaci IBD již před 17. rokem věku. Ta se navíc posouvá do stále nižších věkových kategorií, výjimkou již není ani výskyt IBD v kojeneckém nebo batolecím věku. V případě, že dojde k manifestaci IBD před 6. rokem věku, mluvíme o tzv. very early-onset IBD (VEO-IBD). Podle posledních údajů se incidence IBD u dětí celosvětově pohybuje kolem 4/100 000, přičemž incidence CD roste rychleji než u UC.2
Etiopatogeneze
Přestože přesný mechanismus vzniku těchto onemocnění nebyl zatím zcela objasněn, jako nejpravděpodobnější se jeví porucha imunotolerance střevní sliznice vůči některým alergenům ve střevě u geneticky predisponovaných osob. Na vzniku IBD se tak podílí jak faktory genetické, tak i faktory zevního prostředí. Za nejvýznamnější rizikový faktor vzniku IBD je považován výskyt IBD v rodině. V posledních letech se hodně mluví o interakci střevní sliznice se střevním mikrobiomem. Za standardních podmínek je střevní bariéra tvořena mukózní vrstvou, epiteliálními buňkami a těsnými spoji, tzv. tight junctions, což činí střevní sliznici relativně nepropustnou pro bakterie. Při IBD však dochází k narušení této střevní permeability a spolu s vrozeným defektem imunity tak dochází i ke změnám mikrobiomu. V důsledku těchto změn může dojít k bakteriální translokaci a následně ke stimulaci imunitní odpovědi vedoucí k poškození tkáně. Přestože je dědičnost těchto onemocnění vesměs polygenní, u některých forem a IBD-like onemocnění manifestovaných již v raném dětském věku byl prokázán monogenní typ dědičnosti. Některé primární imunodeficiencie svým průběhem připomínají refrakterní typ IBD. Patří sem například chronická granulomatóza, X-vázaný lymfoproliferativní syndrom typu 2 (deficience XIAP), deficience IL-10/IL-10R, CTLA-4 a LRBA a syndrom IPEX.
Diagnostika
Diagnostika IBD se opírá o tzv. Portská kritéria, která celý diagnostický proces usnadňují a sjednocují.3 Každé dítě s podezřením na IBD by tedy mělo absolvovat kompletní diagnostický algoritmus. Diagnóza se tak opírá nejen o klinické symptomy a typické laboratorní nálezy, ale hlavně o zobrazovací vyšetření, jako je endoskopie s histologií a zobrazení tenkého střeva.3, 4, 5, 6, 7, 8
K typickým střevním projevům u dětí s CD patří bolest břicha, nechutenství, úbytek na váze, časté bývá také perianální postižení, a to jak ve formě tzv. skin tags (strážných hrbolků, které bývají mylně označovány za hemoroidy), tak i ve formě perianálních píštělí nebo abscesů. Pro UC jsou typické četné krvavé průjmovité stolice, doprovázené bolestivými tenesmy. Neméně časté jsou ale i mimostřevní projevy, nejčastěji kožní (erythema nodosum, pyoderma gangraenosum), oční (uveitida) nebo kloubní. Velmi často může být jediným příznakem (zejména u pacientů s CD) porucha růstu, která může předcházet manifestaci střevních symptomů až o několik let. Hodnocení růstové aktivity pomocí percentilových grafů je tedy u dětských pacientů nevyhnutelné.
V laboratorních nálezech bývá typický nález urychlené sedimentace, anemie a trombocytózy. V séru často nalézáme pozitivitu některých autoprotilátek, u UC to bývají typicky protilátky proti cytoplazmě neutrofilů (ANCA), u CD pak protilátky proti Saccharomyces cerevisiae (ASCA), nicméně jejich přítomnost či nepřítomnost diagnózu IBD nevylučuje. V současné době se stalo již rutinní záležitostí vyšetření fekálního kalprotektinu, který je velice validním a citlivým markerem zánětu ve střevě.5 Opakovaně vysoké hodnoty by měly pacienta nasměrovat k endoskopickému vyšetření. Je potřeba však myslet i na to, že u malých dětí (zejména kojenců) bývají hodnoty fyziologicky vysoké, stejně tak jako i u jiných typů střevních zánětů (např. infekčních).
V diagnostickém procesu mají své nezastupitelné místo zobrazovací vyšetření. Vzhledem k dobré dostupnosti je v diagnostice stále více využívána ultrasonografie (USG). Vyšetření je neinvazivní, nevyžaduje žádnou speciální přípravu a je dětským pacientem dobře tolerované. Je velmi vhodné jak v prvním kontaktu, tak i v rámci sledování aktivity nemoci a odpovědi na terapii.5 Jedná se o výbornou metodu k posouzení zánětlivých změn v oblasti terminálního ilea, ale i kolon, stejně jako při detekci komplikací – píštělí a abscesů.
Jednoznačně nejdůležitějším vyšetřením je však vyšetření endoskopické, bez kterého není možné stanovení diagnózy. Provedena musí být jak koloskopie s intubací terminálního ilea, tak i ezofagogastroduodenoskopie, která bývá u dětských pacientů často opomíjená. Ze všech endoskopovaných částí střeva by měly být odebrány bioptické vzorky a odeslány k histologickému vyšetření. Vyšetření v dětském věku probíhá v celkové anestezii a mělo by být provedeno na pracovišti dětské gastroenterologie endoskopistou zkušeným v dané problematice. Jelikož se fenotyp a podtypy jednotlivých forem IBD mohou v dětském věku prolínat, je důležité znát jistá specifika daného věku, a předejít tak často špatné diagnostice a zařazení nemoci, a tudíž následně i zahájení neadekvátní terapie. U každého pacienta s IBD je pak také doporučováno provedení kontrastního zobrazení tenkého střeva, u dětí je vzhledem ke snaze eliminovat rtg záření doporučována MR enterografie, která může odhalit nejen zánětlivé změny na tenkém střevě, ale také již známky poškození střeva, jako jsou striktury, dilatace, píštěle nebo abscesy.
Sledování aktivity nemoci
Na rozdíl od dospělých pacientů využíváme u dětí k hodnocení aktivity validované indexy aktivity. Index aktivity CD (Pediatric Crohn’s Disease Activity Index, PCDAI) zohledňuje klinické symptomy (bolesti břicha, počet a charakter stolic, celkovou aktivitu onemocnění v uplynulém týdnu), laboratorní parametry (hematokrit, sedimentace, albumin), antropometrická data (vývoj hmotnosti, růst), fyzikální nález na břiše, perianální nález a přítomnost extraintestinálních projevů. Nicméně jeho hodnota neodpovídá zcela tíži endoskopického nálezu.5 U dětí s UC je v klinické praxi i samotnými pacienty běžně využíván tzv. PUCAI index (Pediatric Ulcerative Colitis Activity Index) (Tab. 2), který je již zakomponován i v aktuálních terapeutických algoritmech. Bylo totiž prokázáno, že hodnota PUCAI indexu velmi dobře koreluje s tíží endoskopického nálezu. Je tak využíván nejen za účelem zhodnocení aktivity, ale také odpovědi na zavedenou terapii.6,9
Tab. 2. Pediatrický index aktivity UC (PUCAI) 
Upraveno podle: Turner et al., 2007 Terapie
Terapie IBD se liší podle typu zánětu a v dětském věku má svá specifika. Cílem terapie je navození remise onemocnění (indukční terapie) a následně její udržení (tzv. udržovací terapie), tak aby došlo nejen k vymizení symptomů, ale také k prevenci vzniku komplikací a k zajištění podmínek umožňujících optimalizaci růstu a vývoje dětského organismu.
Plán léčby by měl být individualizován a zohledňovat faktory, jako je věk, lokalizace a chování nemoci, opoždění růstu, potenciální vedlejší účinky léků a kvalitu života. Klíčovým bodem při rozhodování o optimální terapii je identifikace pacientů s vysokým rizikem komplikovaného průběhu onemocnění. K prediktorům komplikovaného průběhu se řadí penetrující nebo strikturující onemocnění, perianální postižení, ale také neadekvátní odpověď na indukční terapii. Takzvaná step-up strategie, tj. postupné zavádění účinnějších léků při selhání těch méně účinných, bývá v posledních letech stále častěji nahrazována tzv. akcelerovaným step-up přístupem, nebo dokonce „top-down“ strategií, kdy bývá nejintenzivnější terapie zahájena hned v době diagnózy.5
Indukční terapie
Crohnova nemoc
Léčbou první volby v terapii CD u dětí je exkluzivní enterální výživa (EEV) podávaná po dobu 6–8 týdnů. Výlučné podávání přípravků enterální výživy (EV) vede při vyloučení veškeré stravy k vyhojení sliznice a zlepšení nutričního stavu pacienta. Efektivita této léčebné modality byla již opakovaně prokázána, navíc bylo prokázáno, že účinnost EEV je srovnatelná s kortikoidy (KS). Navzdory srovnatelné efektivitě má však EEV nespornou výhodu v tom, že její použití vede ve srovnání s KS ve vyšším procentu k dosažení slizničního hojení, postrádá závažné nežádoucí účinky, a navíc vede ke zlepšení nutričního stavu pacientů.4, 5, 7, 8 Tento fakt favorizuje EEV, jelikož právě dosažení slizničního hojení je jedním z hlavních cílů celého terapeutického managementu IBD, což by mohlo pozitivně predikovat dlouhodobou prognózu.
EV může být podávána buď pomalým popíjením (tzv. sippingem), nebo cestou enterální sondy (primárně cestou nazogastrické sondy [NGS], v indikovaných případech cestou nazojejunální sondy [NJS]). V současné době je dostupná široká škála přípravků EV určených k sippingu, významně se zlepšily chuťové vlastnosti, k dispozici jsou přípravky izokalorické i hyperkalorické, s vlákninou nebo bez ní, s vyšším obsahem proteinů apod. Navzdory výborné efektivitě může být někdy problémem adherence. Nicméně pouze parciální EV v kombinaci s běžnou stravou nebyla efektivní a nevedla k dosažení remise. Naproti tomu podávání parciální EV v kombinaci se speciální eliminační dietou, která by na sliznici vyvolala podobné změny jako EEV, se v dosavadních pracích jeví jako efektivní a vede ke zlepšení tolerance i adherence. Nejvíce dat je v současné době k dispozici o tzv. Crohn’s disease exclusion diet (CDED). Tato dieta vychází z předpokladu, že vyloučení některých potravin nebo jejich složek ze stravy zajistí zachování střevní homeostázy, a to tím, že zabrání narušení optimálního složení střevního mikrobiomu a následně vzniku dysbiózy, čímž přispěje k udržení optimální střevní permeability a zachování bariérové funkce střeva.10 Jedná se o tzv. vylučovací neboli eliminační dietu, která nepovoluje ve stravě např. žádný lepek, mléčné výrobky, žádné pečivo (lepkové i bezlepkové), živočišný tuk, průmyslově zpracované maso, výrobky obsahující emulgátory, konzervované zboží a všechny balené produkty s vyznačeným datem spotřeby. Obsahuje seznam zakázaných a povolených potravin, její složení je přísně definováno a musí být vedena pod dohledem zkušeného nutricionisty zaškoleného v dané problematice.
V případě intolerance nebo neefektivity EEV, ev. PEV + CDED, lze použít v indukční terapii i kortikoidy. Lékem volby je v tomto případě prednison, v dávce 1 mg/kg (max. 40 mg denně, výjimečně více). Během kortikoterapie je pak potřebné zajistit adekvátní dávku kalcia a vitaminu D.4, 7
U těžkých forem s vysokým rizikem komplikovaného průběhu lze již v době diagnózy zahájit rovnou i léčbu biologickou (viz dále).5
Ulcerózní kolitida
V indukční terapii mírné a středně těžké UC je indikováno perorální podání aminosalicylátů, nejčastěji mesalazinu v dávce 60–80 mg/kg/den.6,7,8 Pokud dětští pacienti tolerují i lokální léčbu klyzmaty nebo čípky, lze využít i kombinované terapie, která je účinnější než monoterapie.11 Monoterapie lokálními aminosalicyláty je možná u izolované proktitidy, která je ale v dětském věku vzácná. U některých pacientů s kloubními symptomy lze použít sulfasalazin v dávce 40–60 mg/kg/den. Vzácně se lze setkat i s intolerancí aminosalicylátů, která může klinicky připomínat akutní relaps UC. Odpověď na terapii je hodnocena pomocí PUCAI indexu. Pokud nedojde k adekvátnímu poklesu PUCAI indexu, je indikována terapie kortikoidy. Kortikoidy mají stále své místo v indukční terapii středně těžké a těžké UC a stejně tak u pacientů, u kterých nebylo při terapii aminosalicyláty dosaženo remise nemoci. Lékem volby v případě kortikoterapie bývá prednison v dávce 1 mg/kg až do maximální dávky 40 mg (výjimečně více) v jedné denní dávce. Někteří pacienti s vysokou aktivitou UC musí být hospitalizováni a KS jsou pak podávány parenterálně. Přestože jsou KS stále používány v indukční terapii, nelze je však tolerovat v léčbě udržovací. U dětských pacientů se relativně často setkáváme s tzv. kortikodependencí, tj. situací, kdy pacienti sice odpověděli na léčbu KS, ale je patrný relaps po snížení dávky nebo po jejich vysazení. I z tohoto důvodu bývá u dětských pacientů časně zahajována i imunosupresivní terapie.
Podání kalcineurinových inhibitorů (CsA nebo takrolimu) lze využít u refrakterních nebo fulminantních forem UC, které nereagují na léčbu intravenózními KS.6
Rutinní použití probiotik nebo antibiotik v indukční terapii středně těžké nebo těžké formy UC se v současné době nedoporučuje. Probiotika lze použít v některých případech mírné formy UC.6
U těžkých forem UC a akutní těžké UC (ACS) může být rovnou v době stanovení diagnózy zahájena i biologická terapie (viz dále).5,6
Udržovací terapie
V udržovací terapii IBD u dětí jsou nejčastěji používány thiopuriny.4–8 Dlouholeté zkušenosti s jejich užíváním prokázaly jejich bezpečnost a efektivitu v terapii IBD. Hlavními představiteli jsou azathioprin a 6-merkaptopurin. Optimální dávka azathioprinu činí 2–2,5 mg/kg/den v jedné denní dávce, u 6-merkaptopurinu je to dávka 1–1,5 mg/kg/den. Terapii lze zahajovat rovnou v plné dávce, bez nutnosti postupného navyšování. Hematotoxicita bývá pozorována u zhruba 2–14 %, většinou hned během prvních měsíců léčby. Proto je v úvodu léčby namístě častější kontrola krevního obrazu. Pacienti s velmi nízkou nebo chybějící aktivitou thiopurinmetyltransferázy (TPMT) mají v případě použití standardních dávek významně vyšší riziko rozvoje myelotoxicity. U některých pacientů musí být dávka redukována, u těch se zcela chybějící aktivitou je použití thiopurinů kontraindikováno. Z dalších nežádoucích účinků se může objevit elevace aminotransferáz nad dvojnásobek normálních hodnot, v takovém případě musí být dávka redukována nebo i zcela vysazena, znovuzahájení terapie je pak možné teprve po jejich normalizaci. U pacientů může v průběhu prvních týdnů léčby thiopuriny dojít k rozvoji pankreatitidy (většinou se jedná o idiosynkratický účinek), která je pak důvodem k jejich vysazení. Terapeutický efekt thiopurinů lze očekávat přibližně za 8–16 týdnů od zahájení terapie. V praxi bývá proto terapie thiopuriny u středně těžkých a těžkých forem IBD zahajována již rovnou s indukční léčbou, aby po jejím vysazení již bylo dosaženo terapeutického efektu imunosupresiv.
Dalším imunosupresivem používaným v udržovací léčbě CD je metotrexát (MTX), který bývá většinou podáván subkutánně v dávce 15 mg/m2 tělesného povrchu 1x týdně. Následující den bývá podávána kyselina listová v dávce 10 mg. K nejčastějším nežádoucím účinkům patří hepatotoxicita a hematotoxicita. Použití MTX je kontraindikováno v období gravidity.4, 5, 7, 8
Aminosalicyláty lze použít v monoterapii pouze u mírné formy UC. U většiny pacientů jsou aminosalicyláty používány v kombinaci s imunosupresivní terapií.
U některých pacientů s rizikem komplikovaného průběhu nemoci bývá rovnou v době diagnózy zahájena biologická terapie. Ta musí být podávána v Centru biologické léčby. Časné zahájení anti-TNF terapie bylo spojeno se signifikantně nižším rizikem rozvoje penetrujícího onemocnění.5 V současné době jsou k léčbě IBD u dětí oficiálně schváleny dva přípravky z řady anti-TNF protilátek – infliximab a adalimumab.
Infliximab (IFX) je chimérická protilátka proti anti-TNF-alfa, je podávána formou intravenózní infuze v dávce 5 mg/kg, ve třech indukčních dávkách – 0., 2. a 6. týdnu – a následně je pokračováno v udržovací terapii každých 8 týdnů. Jeho použití je schváleno jak v indikaci středně těžké a těžké formy CD, tak i UC. Jasnou indikací k zahájení biologické terapie je pak perianální postižení, ztráta odpovědi na konvenční terapii nebo kortikodependence. Bylo prokázáno, že kombinovaná imunosuprese vedla k signifikantně lepším výsledkům, a u dětí je tak velmi často využívána. V indikovaných případech při dostupné monitoraci sérových koncentrací je možné dávku biologika optimalizovat. Dávku infliximabu lze navýšit až na 10 mg/kg, ev. je také možné zkrácení intervalu podávání na čtyři týdny. Použití IFX v terapii akutní závažné kolitidy se řídí specifickými, jasně definovanými pravidly, v tomto případě je možné již v počátku terapie podávat vyšší dávky v kratších intervalech.
Adalimumab (ADA) je plně humanizovaná anti-TNF protilátka, aplikovaná formou subkutánních injekcí v intervalu dvou týdnů. ADA lze použít také u fistulující formy CD. Stejně tak je možná i konkomitantní terapie imunosupresivy, nicméně dat týkajících se efektivity kombinované terapie je méně a u pacientů naivních k ADA lze léčbu zahájit v monoterapii. Iniciální dávka ADA představuje 100–160 mg/m2, za dva týdny pak následuje dávka 50–80 mg/m2 a poté 25–40 mg/m2 každý druhý týden. U pacientů s hmotností nad 40 kg se dávky neliší od dospělých pacientů, tj. v indukčním režimu bývá podáno 160–80–40 mg s. c. a poté je pokračováno v dávce 40 mg každé dva týdny. Podobně jako v případě IFX je možné i u adalimumabu v případě potřeby léčbu intenzifikovat, a to buď zkrátit interval podávání na 1 týden, nebo ponechat 14týdenní interval, ale navýšit dávku na dvojnásobek. Stejně tak je možné farmakokinetické sledování sérových koncentrací.
Použití biosimilárních léčiv se řídí indikacemi schválenými Evropskou lékovou agenturou a Státním ústavem pro kontrolu léčiv (SÚKL). Jejich použití je preferováno u pacientů naivních k biologické léčbě.
V případě, že dojde k selhání anti-TNF terapie, je možné použít další dvě biologika, která jsou již běžně používána u dospělých pacientů. Jelikož se jedná o off-label podání, je podmínkou schválení revizním lékařem. Jedním z nich je plně humanizovaná antiintegrinová protilátka proti alfa4beta7 – vedolizumab, která působí selektivně v gastrointestinálním traktu a kterou lze použít zejména v terapii UC, ale i CD u pacientů, u nichž selhala anti-TNF terapie. Dalším používaným biologikem je ustekinumab, monoklonální protilátka proti interleukinu 12 a 23, který je již delší dobu u dětí používán v terapii psoriázy.5
IBD a COVID
U pacientů na biologické nebo imunosupresivní terapii není možné očkování živými vakcínami. Naproti tomu neživé vakcíny lze aplikovat jako u zdravé populace, lze však očekávat nižší protilátkovou odpověď. Situace je podobná i v případě vakcinace proti COVID-19. Očkování je možné i u pacientů na biologické nebo imunosupresivní terapii, dávku imunosupresiv přitom není nutné nijak upravovat. Jako rizikové faktory těžkého průběhu infekce virem COVID-19 (pobyt na JIP nebo úmrtí) byly popsány vyšší věk, systémová kortikoterapie a přidružené komorbidity.12 Odborná společnost vzhledem ke komplikacím, které mohou infekci COVID-19 doprovázet, se přiklání k očkování.12,13
Zdroje
1. Levine A, Griffiths A, Markowitz J, Wilson DC, Turner D, Russell RK, Fell J, Ruemmele FM, Walters T, Sherlock M, Dubinsky M, Hyams JS. Pediatric modification of the Montreal classification for inflammatory bowel disease: the Paris classification. Inflamm Bowel Dis 2011;17(6):1314–21.
2. Malaty HM, Fan X, Opekun AR, Thibodeaux C, Ferry GD. Rising incidence of inflammatory bowel disease among children: a 12-year study. J Pediatr Gastroenterol Nutr 2010;50(1):27–31.
3. IBD Working Group of the European Society for Paediatric Gastroenterology, Hepatology and Nutrition (ESPGHAN). Inflammatory bowel disease in children and adolescents: Recommendations for diagnosis-The Porto Criteria. J Pediatr Gastroenterol Nutr 2005;41 : 1–7.
4. Ruemmele FM, Veres G, Kolho KL, et al.; European Crohn’s and Colitis Organisation; European Society of Paediatric Gastroenterology, Hepatology and Nutrition. Consensus guidelines of ECCO/ESPGHAN on the medical management of paediatric Cro hn’s disease. J Crohns Colitis 2014;8 : 1179–207.
5. van Rheenen PF, Aloi M, Assa A, Bronsky J, Escher JC, Fagerberg UL, Gasparetto M, Gerasimidis K, Griffiths A, Henderson P, Koletzko S, Kolho KL, Levine A, van Limbergen J, Martin de Carpi FJ, Navas-López VM, Oliva S, de Ridder L, Russell RK, Shouval D, Spinelli A, Turner D, Wilson D, Wine E, Ruemmele FM. The medical management of paediatric Crohn’s disease: an ECCO-ESPGHAN Guideline Update. J Crohns Colitis. 2020 Oct 7:jjaa161. doi: 10.1093/ecco-jcc/jjaa161.
6. Turner D, Levine A, Escher JC, et al. Management of pediatric ulcerative colitis: joint ECCO and ESPGHAN evidence-based consensus guidelines. J Pediatr Gastroenterol Nutr 2012;55 : 340–361.
7. Bronský J, Adamcová M, Bajer M, Bajerová K, Dědek P, Hradský O, et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu nespecifických střevních zánětů u dětí. Českoslov Pediatr 2012;67(Suppl. 2):5–47.
8. Bronský J, Beránková K, Černá Z, Čopová I, Ďuricová D, Durilová M, et al. Doporučení Pracovní skupiny dětské gastroenterologie a výživy ČPS pro diagnostiku a léčbu idiopatických střevních zánětů u dětí – doplněk k 1. vydání. Gastroenterol Hepatol 2017;71(1):11–8.
9. Turner D, Otley AR, Mack D, et al. Development, validation, and evaluation of a pediatric ulcerative colitis activity index: a prospective multicenter study. Gastroenterology 2007;133 : 423–432.
10. Levine A, Wine E, Assa A, et al. Crohn’s disease exclusion diet plus partial enteral nutrition induces sustained remission in a randomized controlled trial. Gastroenterology 2019;157 : 440–50.e8.
11. Ford AC, Khan KJ, Achkar JP, et al. Efficacy of oral vs. topical, or combined oral and topical 5-aminosalicylates, in ulcerative colitis: systematic review and meta-analysis. Am J Gastroenterol 2012;107 : 167–176.
12. Brenner EJ, Ungaro RC, Gearry RB, Kaplan GG, Kissous-Hunt M, Lewis JD, Ng SC, Rahier JF, Reinisch W, Ruemmele FM, Steinwurz F, Underwood FE, Zhang X, Colombel JF, Kappelman MD. Corticosteroids, but not TNF antagonists, are associated with adverse COVID-19 outcomes in patients with inflammatory bowel diseases: results from an international registry. Gastroenterology 2020;159(2):481–491.e3.
13. Stanovisko pracovní skupiny pro IBD při ČGS ČLS JEP k vakcinaci proti onemocnění COVID-19 u pacientů s Crohnovou nemocí a ulcerózní kolitidou. www.ibd-skupina.cz.
14. https://www.pediatrics.cz/stanovisko-cps-k-ockovani-deti-a-adolescentu-od-12-let--proti-covid-19-1/.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Úvodní slovoČlánek Nové lékové registraceČlánek Hypoglykemie u dětíČlánek Vitamin D v dětském věkuČlánek Komentář k článku Vliv liraglutidu na viscerální a ektopický tuk u dospělých s nadváhou či obezitouČlánek Tyreopatie u dětíČlánek Psoriáza v dětském věkuČlánek Deprese dětí a dospívajících
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2021 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Úvodní slovo
- Komentář k článku Vliv liraglutidu na viscerální a ektopický tuk u dospělých s nadváhou či obezitou
- Nové lékové registrace
- Bolest kyčlí u dospělých: hodnocení a diferenciální diagnostika
- Komentář k článku Bolest kyčlí u dospělých: hodnocení a diferenciální diagnostika
- Informovaný souhlas v asistované reprodukci aneb pokrok nezastavíš?
- Komplexní systém výživy u novorozenců – cesta pro budoucnost
- Hypoglykemie u dětí
- Vitamin D v dětském věku
- Virové infekce a možnosti využití inosin pranobexu v ordinaci PLDD
- MUDr. Alena Šebková: Obávám se o budoucnost primární pediatrické péče
- Mikrobi a lidé – běžná kolonizace, nebo invazivní infekce?
- Novinky v léčbě dětského astmatu
- Zánětlivá střevní onemocnění u dětí
- Tyreopatie u dětí
- Infantilní hemangiomy novorozenců a kojenců
- Nové možnosti léčby metabolických onemocnění skeletu v dětském věku
- Psoriáza v dětském věku
- Deprese dětí a dospívajících
- Je dítě pouze zlobivé, nebo má ADHD?
- Nastavení v B modu diagnostického ultrazvukového přístroje – čas, do kterého se vyplatí investovat
- Přerušení léčby vede k progresi chronického žilního onemocnění
- Vliv liraglutidu na viscerální a ektopický tuk u dospělých s nadváhou či obezitou
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Bolest kyčlí u dospělých: hodnocení a diferenciální diagnostika
- Hypoglykemie u dětí
- Mikrobi a lidé – běžná kolonizace, nebo invazivní infekce?
- Novinky v léčbě dětského astmatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání