-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infantilní hemangiomy novorozenců a kojenců
Autoři: MUDr. Mališ Josef; MUDr. Mišove Adéla
Působiště autorů: Klinika dětské hematologie a onkologie 2. LF UK, a FN Motol, Praha
Vyšlo v časopise: Svět praktické medicíny, 2, 2021, č. 4, s. 63-69
Kategorie: Medicína v ČR: přehledový článek
Souhrn
Infantilní hemangiomy (IH) představují nejčastější nádory dětského věku. Naprostá většina z nich nevyžaduje žádnou léčbu, protože nepůsobí žádné obtíže nebo komplikace a v průběhu měsíců až let spontánně involují, 10–15 % infantilních hemangiomů může způsobit komplikace: obstrukce, ulcerace nebo závažné kosmetické vady, které vyžadují správnou terapii.1
Prevalence IH u zralých novorozenců a kojenců se pohybuje mezi 4–5 % a jsou až 3x častější u dívek. Incidence stoupá se snižujícím se gestačním věkem a porodní hmotností, kdy novorozenci s porodní hmotností pod 1000 g mají IH až ve 23 %.2 Celkově postihují IH 10–12 % kojenců. Mezi další rizikové faktory patří opakované těhotenství, vyšší věk matky, in vitro fertilizace, preeklampsie a placentární anomálie. V diferenciální diagnóze u novorozenců musíme uvažovat o kongenitálních hemangiomech, jež zahrnují RICH (rapi dly involuting congenital hemangioma) a NICH (noninvoluting hemangioma), mezi které patří kaposiformní hemangioendoteliom, tufted angioma, pyogenní angiom a multifokální lympfangioendoteliomatóza.
Patogeneze
Infantilní hemangiom je výsledkem dysregulace vaskulogeneze. Ovšem jaké impulzy tento proces aktivují, je předmětem hypotéz. Nejpravděpodobnějším spouštěcím signálem je hypoxický stres, který indukuje zvýšenou expresi angiogenních faktorů. Výsledkem nadměrné exprese VEGF (vaskulární endoteliální růstový faktor) je proliferace nezralých endoteliálních buněk (exprimujících CD 31), ale také dendritických a mezenchymálních buněk. Endoteliální buňky exprimují GLUT1 (erytrocytární glukózu transportující protein), který je přítomen ve všech fázích proliferace he mangiomu.3
Klinické projevy a přirozený vývoj
IH se obvykle objevují v prvním až druhém týdnu života, ovšem nikoliv po 12. týdnu života. Výjimečně jsou patrné již při narození. Nicméně prekurzorové léze jsou při narození patrné až v 65 % případů (tzn. změny na kůži, které ještě nelze označit jednoznačně jako IH, ale při retrospektivním hodnocení představují počínající stadium IH). Každý infantilní hemangiom má tři stadia: proliferace, stagnace a involuce. Nejrychlejší růst (fáze proliferace) je patrný v prvních 12 týdnech života a tato rychlost postupně klesá mezi 4. až 6. měsícem života. Až 80 % IH dosahuje své definitivní velikosti koncem 4. měsíce věku. Avšak některé segmentární a hluboké hemangiomy, např. v oblasti parotis, vykazují růstovou aktivitu i ve druhém, případně ve třetím roce života. Po proliferační fázi následuje klidové stadium (stagnace) trvající několik měsíců, které postupně přechází v involuci (Obr. 1).
Obr. 1. Vývoj hemangiomu v čase. 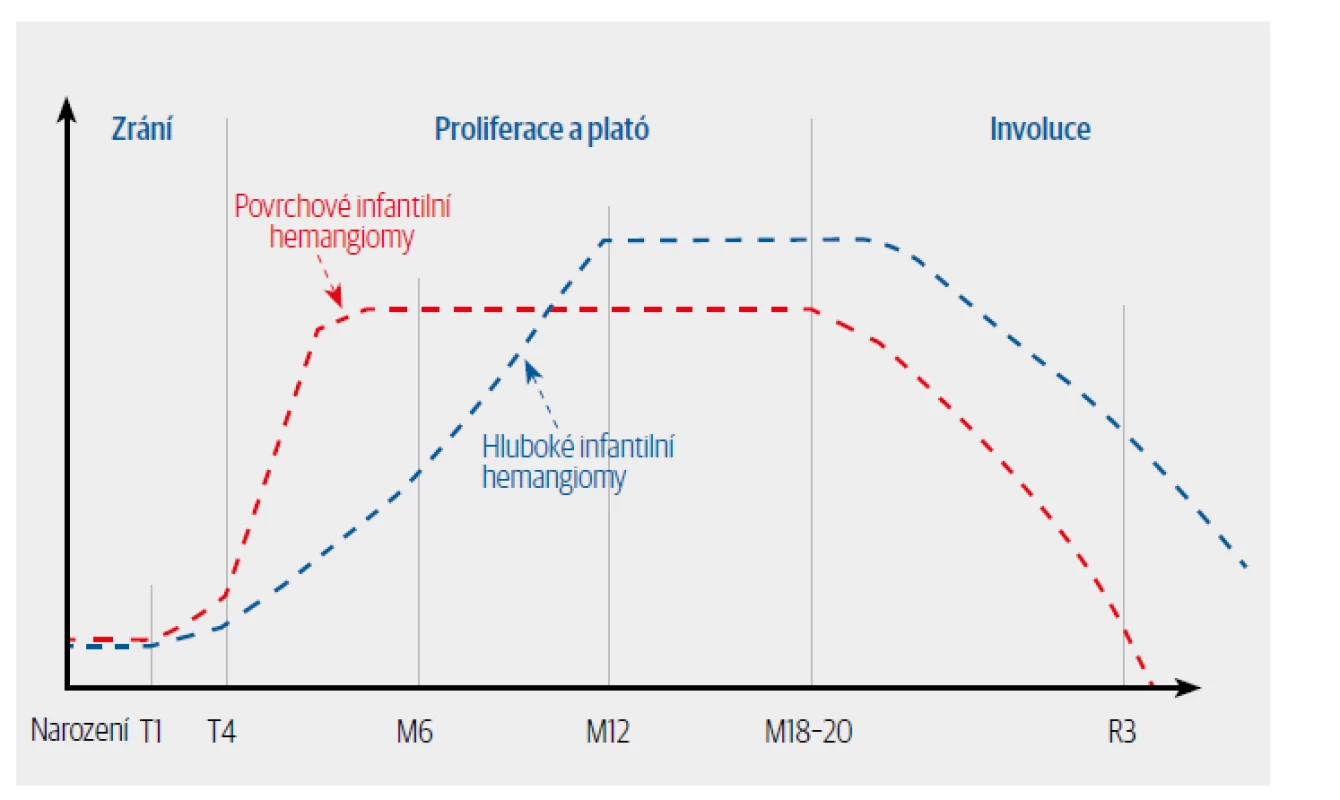
Až 90 % IH spontánně involuje mezi 2. až 6. rokem života. Některé hluboké nebo smíšené hemangiomy involují pomaleji a delší dobu, a to až do 8. nebo 9. roku života. Involuce ovšem neznamená, že hemangiom vymizí bez jakéhokoliv rezidua, zůstávají většinou teleangiektazie, fibrózní nebo ztukovatělá kůže aj. Největší šanci na bezreziduální involuci mají superficiální IH (Obr. 2), ale i tak se jedná pouze o 30 % všech he mangiomů. Smíšené nebo hluboké hemangiomy zanechávají rezidua mnohem častěji, po segmentárních hemangiomech zůstává více či méně závažné reziduum téměř vždy.4
Při mnohočetném výskytu hemangiomů na kůži (5 až 10 ložisek) nebo hemangiomatóze (nad 10 ložisek) bývají postiženy také některé viscerální orgány, nejčastěji játra. Jindy postihují sliznice dutiny ústní nebo horních a dolních cest dýchacích.
Hemangiomy mohou být součástí závažnějších syndromů:
• PHACE (Tab. 1): kombinace hemangiomů intrakraniálních, očních a kardiovaskulárních cévních anomálií, u dívek je 9x častější než u chlapců.5
• PELVIS (Tab. 2): představuje přítomnost infantilního hemangiomu na perineu a současně kongenitální malformace genitálu, konečníku, vylučovacího traktu a páteře.6
Klasifikace hemangiomů
IH jsou charakterizovány značnou variabilitou ve smyslu velikosti, počtu ložisek i jejich tvaru a postižení jednotlivých vrstev kůže nebo podkoží (Obr. 2–8). Tyto projevy jsou východiskem pro jejich klasifikaci.7
Obr. 2. Superficiální hemangiom.
[Foto: archiv autorů]![Superficiální hemangiom.<br>
[Foto: archiv autorů]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/bab892d6c8c02d3c92c8dc32691913da.png)
Obr. 3. Hluboký hemangiom na kořeni nosu.
[Foto: archiv autorů]![Hluboký hemangiom na kořeni nosu.<br>
[Foto: archiv autorů]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/dafe08ae4d496af15c2a26523e666e17.png)
Obr. 4. Adnátní smíšený hemangiom bérce.
[Foto: archiv autorů]![Adnátní smíšený hemangiom bérce.<br>
[Foto: archiv autorů]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/523ccf8a48d80330e6750060c99a6a2d.png)
Obr. 5. Rozsáhlý superficiální hemangiom, který neumožní otevřít pravé oko. [Foto: archiv autorů] ![Rozsáhlý superficiální hemangiom, který
neumožní otevřít pravé oko. [Foto: archiv autorů]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/9cba3d5432745a8c20e8b214456de440.png)
Obr. 6. Exulcerovaný hemangiom.
[Foto: archiv autorů]![Exulcerovaný hemangiom.<br>
[Foto: archiv autorů]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/bdf15e8d530b2876e89be965d2b32bea.png)
Obr. 7. Drobný, ale klinicky významný hemangiom horního víčka. [Foto: archiv autorů] ![Drobný, ale klinicky významný hemangiom
horního víčka. [Foto: archiv autorů]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/02fbd81370ab0dca90f0f6f7d02ca0ff.png)
Obr. 8. Smíšený IH v oblasti parotis. [Foto: archiv autorů] ![Smíšený IH v oblasti parotis. [Foto: archiv autorů]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ea7069df880e917a86b0b3af88df9f56.png)
Dělení podle typu, tzn. je-li postižen jen povrch, nebo i hlubší vrstvy kůže, klasifikuje IH na superficiální (povrchové), hluboké (v podkoží, zcela překryty kůží) a smíšené, kdy je na povrchu viditelná pouze část hemangiomu a v podkoží je skrytý další podíl.
Dělení podle distribuce: segmentární, lokalizovaný a multifokální. Nejvíce je lokalizovaných (67 %), segmentárních je asi 13 % a nejméně je multifokálních (3 %) hemangiomů. Léze, které nelze jednoznačně zařadit do jednotlivých kategorií podle distribuce, se označují jako neurčité (neurčitelné) a je jich až 17 %.
Podle anatomické lokalizace je nejvíce IH na hlavě a krku (60 %), zbývajících 40 % se vyskytuje na ostatních částech těla.
Podle počtu lézí se IH dělí na vícečetné hemangiomy (více než 5, ale méně než 10 ložisek) a hemangiomatózy (nad 10 lézí).
Segmentární IH na obličeji se rozdělují podle postižené části na frontotemporální, maxilární, mandibulární a frontonazální.
Vyšetření a diferenciální diagnostika
Většina IH je diagnostikována klinicky. Hemangiomy jsou obvykle jasně červené, při doteku teplejší než okolní kůže. Zpočátku jsou v úrovni kůže, mohou se však plasticky měnit a vystupovat nad úroveň okolní kůže. S postupující stagnací a involucí sytá červeň ustupuje a objevují se šedobělavé ostrůvky, které začínají později převažovat a splývat. Pokud hemangiom involuje úplně, může zanechat kůži v normálním stavu. Naprostá většina IH postihuje kůži, ale mohou přestupovat na sliznice (rty, nosní otvory, perianálně).
V některých lokalizacích je potřeba indikovat zobrazovací metody k posouzení rozsahu hemangiomu a jeho vztahu k okolí. Mezi takové patří velké podkožní hemangiomy, především v oblasti parotis, subglotické a paratracheální oblasti. Vhodným vyšetřením je ultrazvuk (UZ), případně magnetická rezonance (MR). Středočarové hemangiomy na hlavě (čelo, vlasatá část) je vhodné vyšetřit u malých kojenců ultrazvukem přes neuzavřenou fontanelu. V situacích nejasného nálezu nebo podezření na intrakraniální šíření je nezbytná magnetická rezonance. Ultrazvukem vyšetřujeme také hluboké a smíšené hemangiomy (parotis, oblast krku). Při postižení orbit, hlubokých struktur krku je magnetická rezonance jednoznačně indikovaná.
V některých situacích je potřeba vyšetření dalších orgánů, např. UZ vyšetření jater u hemangiomatóz. Echokardiografické vyšetření je vhodné doplnit u dětí s mnohočetnými a objemnými nádory pro možnost oběhového selhání či nedostatečnosti. U těchto dětí by měl být proveden také screening na hypotyreózu. Segmentární hemangiomy na krku a na obličeji mohou být asociovány s cerebrovaskulárními nebo kardiovaskulárními anomáliemi, proto je u těchto lokalizací indikována MR mozku bez ohledu na to, zda jsou nebo nejsou přítomny známky PHACE syndromu.
Většinu hemangiomů lze snadno odlišit od vaskulárních malformací především podle věku manifestace. Cévní malformace jsou patrné již při narození a s věkem se dále nemění. IH mají většinou v době narození jen drobné prekurzorové léze, které v prvních týdnech života proliferují a poté následně regredují.
Klasifikaci vaskulárních anomálií řeší Mezinárodní společnost pro studium cévních anomálií (International Society for Study of Vascular Anomalies – ISSVA) z roku 2014 (Tab. 3).8
Tab. 3. Klasifikace kožních cévních anomálií
[Mezinárodní společnost pro studium cévních anomálií (International Society for Study of Vascular Anomalies – ISSVA) z roku 2014]![Klasifikace kožních cévních anomálií<br>
[Mezinárodní společnost pro studium
cévních anomálií (International Society for
Study of Vascular Anomalies – ISSVA) z roku
2014]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/8db5196c8e6bf246378205edb4f52d27.png)
Asi 10–15 % IH (podle některých studií i 20 % IH) má komplikovaný průběh, kdy tyto komplikace lze rozdělit do tří skupin: ulcerace, postižení funkčních schopností (často život ohrožující) a kosmeticky nepřijatelný rozsah.
1. Ulcerace – nejčastější komplikace IH, vznikne až u 10 % všech IH a až 25 % z nich vyžaduje léčbu. Predilekční místa jsou dolní ret, krk, anogenitální oblast. Častěji se ulcerace objevují u velkých segmentárních IH v průběhu růstové fáze (medián 4 měsíce věku) a mohou být doprovázeny krvácením z povrchu IH, zánětem a bolestí.
2. Postižení funkčních schopností – periorbitální lokalizace může postihnout zrakové funkce až se vznikem amblyopie, astigmatismu nebo strabismu. Nazální IH mohou působit obstrukci dýchacích cest, velké hemangiomy na krku mohou omezovat po hyblivost krku a je možný i vznik tortikolis. Kojenci s mnohočetnými hemangiomy (nad 5 – mnohočetné hemangiomy, nad 10 – hemangiomatózy) by měli podstoupit vyšetření jater ultrazvukem k vyloučení event. viscerálních hemangiomů. Rozsáhlé a objemné IH mohou způsobovat městnání v srdečním oběhu, stejně tak mohou být přítomny známky dysfunkce štítné žlázy.
3. Kosmeticky závažné, někdy znetvořující hemangiomy – postihují jakoukoliv oblast na obličeji, především nos, rty, čelo, tváře, ušní boltce. Asi 70 % z nich zanechá kosmeticky závažné následky – jizvy, znehodnocený kožní povrch nebo teleangiektazie.
Léčba hemangiomů
Jak bylo uvedeno v předcházejícím textu, 10–15 % infantilních hemangiomů může způsobovat závažné komplikace, a proto je potřeba tyto hemangiomy léčit. Podle některých studií vyžaduje terapii až 20 % IH.
Spontánní involuce, bez jakéhokoli rezidua, je nejčastější u drobných superficiálních hemangiomů. Tyto hemangiomy nevyžadují žádnou léčbu, jsou malé rozsahem a nezávažné lokalizací. Naopak smíšené nebo hluboké IH nemusí nikdy zcela vymizet.9,10
Rizikové lokalizace malých hemangiomů vyžadují pečlivou monitoraci. Jsou sice velikostí nevýznamné, ale jsou umístěny nepříznivě a při dalším růstu mohou způsobit závažné komplikace: jde především o oblast rtů, víček, nosních průduchů. Některé mohou ulcerovat a krvácet: oblast krku, anogenitální malformace. Ostatní mohou ohrožovat pozdější fyziologický vývoj, např. mléčná žláza. Ve všech takových situacích se děti sledují v častějších intervalech. Obvyklé doporučení je, že intervaly doporučených vyšetření (v týdnech) se rovnají věku dítěte (v měsících). Fotodokumentace může jednoznačně dokumentovat případný růst a podpořit rozhodování o zahájení terapie.
Systémová terapie
V minulosti bylo v léčbě hemangiomů používáno mnoho léčebných prostředků, především kortikoidy podávané po dobu několika týdnů až měsíců, ale také interferon, někdy i cytostatika (vinkristin), později sirolimus. V roce 2008 publikovala Cristine Labreze překvapivě účinnou terapii hemangiomů propranololem a ten se posléze stal lékem první volby ve všech situacích, které přirozený vývoj hemangiomů komplikují – postižení životně důležitých funkcí, ulcerace a rozsáhlé kosmeticky závažné léze.
Propranolol není novým lékem v klinické praxi, používá se při léčbě kardiomyopatie, hypertyreoidismu nebo migréně. Podávat se začal v roce 1964 a v uvedených indikacích se dávky pohybovaly mezi 6–8 mg/den. Právě při jeho použití pro léčbu kardiomyopatie bylo poprvé pozorováno, že dokáže příznivě ovlivnit i vývoj hemangiomu. C. Labreze tento efekt prezentovala na 9 dětech s IH, které se podařilo pomocí perorální léčby propranololem vyléčit.11 Od té doby bylo publikováno množství prací, které tento první, náhodný terapeutický efekt potvrdilo.12 Retrospektivní komparativní studie prokázaly, že propranolol je v porovnání s kortikoidy účinnější, je lépe tolerován, následné chirurgické odstranění reziduí je méně časté a spektrum nežádoucích účinků léčby je užší a jejich četnost významně nižší. V porovnání s kortikoidy vykazuje propranolol rychlejší terapeutický efekt.13, 14
Mechanismus účinku propranololu
Jsou známy tři podstatné patofyziologické kroky, které vysvětlují příznivý účinek na infantilní hemangiomy. Vazokonstrikce je prvním patrným efektem po zahájení terapie, který klinicky pozorujeme jako vyblednutí hemangiomu. Druhý nejpodstatnější krok je ten, že je zablokována produkce VEGF, který podporuje novotvorbu cévních kapilár. Posledním krokem je podpora přirozené smrti buněk drobných kapilár. Klinickým výsledkem je přestavba progredujícího hemangiomu na vazivové reziduum, které je v porovnání s přirozeným vývojem hemangiomu nepoměrně menší a méně výrazné.
První zprávy o použití propranololu uvádějí používání různých dávek v rozmezí od 1 do 4 mg/kg/den podávaných ve 2–3 denních dávkách s celkovou dobou léčby od 2 měsíců až do jednoho roku. Navazující randomizované studie doložily, že optimální denní dávka je 3 mg/kg/den, podávaná ve dvou dílčích dávkách po dobu 6 měsíců. Při této dávce je incidence vedlejších účinků terapie minimální a v případě, že se objeví, jsou nezávažné, je možné je dobře zvládnout.
Nejčastější pozorované nežádoucí účinky léčby jsou poruchy spánku, somnolence a podrážděnost vyskytující se u 15 % až 25 % dětí. Ostatní vedlejší projevy jsou velmi vzácné (bronchospasmus, snížená tepová frekvence, průjmy nebo zácpa, hypoglykemie). Všechny nežádoucí účinky jsou dobře saturovatelné.
Terapeutická doporučení
Propranolol je dnes používán rozmanitým způsobem v různých formách dermatology, pediatry, hematology, onkology a jinými odbornostmi. Pro léčbu IH je často podáván v nesprávné formě, dávce i délce léčby, případně pak u dětí v nevhodném věku. Proto vznikly mezinárodní doporučené léčebné postupy, které stanovují, kdy, kde a za jakých podmínek by se měly děti s infantilními hemangiomy léčit. Při tvorbě těchto doporučených postupů spolupracovali dermatologové, pediatři, hematologové, onkologové, kardiologové a radiologové. Cílem vytvořených doporučení je, aby byla léčba racionální a účinná a podávala se v jednoznačně indikovaných situacích. Propranolol je dnes k dispozici ve formě originálního přípravku vyvinutého právě pro léčbu infantilních hemangiomů. Ostatní magistraliter formy, případně tabletové formy, jsou již dnes v indikaci infantilního hemangiomu považovány za obsoletní.
Vstupní vyšetření před zahájením léčby propranololem
Cílem je odhalit případné kontraindikace terapie betablokátory. Základem je vyšetření klidové tepové frekvence. Vstupní EKG a kardiologické vyšetření je vhodné, i když někteří autoři nutnost těchto vyšetření zpochybňují. Patologie srdečního rytmu mohou u kojenců probíhat skrytě, proto je kardiologické vyšetření vhodné u všech dětí s uvažovanou systémovou léčbou. V případě nejasných nálezů nebo podezření na anatomickou či funkční vadu srdce je indikováno echokardiografické vyšetření.15
Věk vhodný pro zahájení léčby propranololem
Nejpodstatnějším faktorem, který dokáže zastavit růst hemangiomu a navodit jeho involuci, je blokáda VEGF a ostatních růstových faktorů, které podporují novotvorbu cévních kapilár, tzn. růst hemangiomu. Tato proliferativní fáze dosahuje nejvyšší rychlosti mezi 2. až 3. měsícem věku, pak zpomaluje a na konci 5. měsíce dosahuje přibližně 80 % hemangiomů své finální velikosti a tvaru. Proto je prvních 5 měsíců života nejvhodnějším okamžikem k zahájení tera pie. Pozdější zahájení léčby se může uplatnit snad jen u hlubokých a smíšených hemangiomů, které dosahují fáze stagnace později. Nasazení propranololu až v druhé polovině prvního roku života kojence je schopno navodit spíše jen vazokonstrikci, ale již nespustí proces involuce.
Iniciace terapie a dávkování
Cílové dávky 3 mg/kg/den lze dosáhnout dvěma režimy – při několikadenní hospitalizaci, kde lze dosáhnout cílové dávky v průběhu 4 až 5 dnů, nebo ambulantně, kdy se dávka zvyšuje vždy o 1 mg/kg/den v týdenních intervalech. Po zahájení podávání propranololu se obvykle objeví mírné asymptomatické snížení krevního tlaku a tepové frekvence, které trvá většinou kolem 3 dnů a v průběhu další terapie není již patrné. Z těchto důvodů je nutná monitorace tepové frekvence a krevního tlaku za 1 a 2 hodiny po podání propranololu a při každém dalším navýšení dávky. V případě bradykardie nebo hypotenze je vhodné dávku nenavyšovat, případně snížit a potřebné navýšení dávky odložit až do úpravy sledovaných parametrů. Hypoglykemie a hypoglykemické křeče jsou nejzávažnější komplikací při této léčbě, ale jsou v praxi extrémně vzácné. Opatrnost je nezbytná zejména u pacientů se sklonem k hypoglykemii, jako jsou například nedonošení novorozenci. Jako nejúčinnější prevence hypoglykemie se jeví podávání léku s jídlem. V případě, že dítě má opakované zvracení, průjmy nebo jiné poruchy vstřebávání potravy a zažívání, je vhodné terapii přerušit.
V některých situacích je však při zahájení terapie nutná hospitalizace, protože se v průběhu eskalace dávek mohou objevit některé nepředpokládané komplikace. Hospitalizaci k zahájení terapie vyžadují:
1. Všechny děti mladší 3 měsíců (věk korigované prematurity) a kojenci pod 3,5 kg pro nutnou monitoraci krevního tlaku a tepové frekvence v průběhu eskalace dávky.
2. Kojenci s IH, které ohrožují vitální funkce – subglotické, útlak dýchacích cest.
3. Kojenci s přidruženými závažnými chorobami kardiovaskulárního nebo respiračního systému či poruchami glukózového metabolismu.
4. Děti ze špatných sociálních poměrů.
Počet dávek byl v některých studiích 3× denně. Farmakokinetické studie ovšem ukázaly, že při podávání propranololu 2× denně je jeho plazmatická hladina vyšší po jednotlivé dávce jen o 12 % v porovnání s hladinou po podání stejné denní dávky rozdělené do tří dávek. Denní podávání ve dvou dávkách se ukazuje jako stejně účinné a bezpečné, a především pohodlnější pro rodiče z hlediska dlouhodobého užívání.
Délka terapie propranololem
Standardní doba terapie je 6 měsíců, ale některé situace vyžadují delší trvání léčby, a to až 12 měsíců. Například pokud hemangiom pozvolna ustupuje, ale involuce se ještě zcela nezastavila. Dávku je nutné upravovat podle hmotnosti dítěte v intervalu 4–8 týdnů, častější intervaly jsou vhodné u nižších váhových kategorií. Léčbu je nezbytné přerušit při respiračních infektech, zvláště jsou-li indikována bronchodilatační farmaka. Stejně tak je vhodné léčbu přerušit při gastrointestinálních obtížích – u zvracení, průjmů, kdy by mohlo dojít k poruše vstřebávání a většímu sklonu k hypoglykemiím.
Terapii propranololem je vhodné zakončit postupným snižováním denních dávek v průběhu asi 2 týdnů, byť některá doporučení toto pozvolné vysazování nezdůrazňují. Po skončení léčby je vhodné dítě vyšetřit v odstupu 3 a 6 měsíců pro detekci případného relapsu.16
Lokální (topická) aplikace propranololu
Po prvních zprávách o příznivém efektu propranololu na infantilní hemangiomy se začal propranolol používat lokálně (topicky) v podobě masti nebo gelu. Účinek této terapie nebyl hodnocen žádnou kontrolovanou randomizovanou studií. Při topické aplikaci je nepředvídatelné množství účinné látky, která se může vstřebat do krevního oběhu. Toto riziko se zvyšuje především u rozsáhlých lézí hemangiomu, u hemangiomů lokalizovaných na sliznici, na krku, hýždích a intergluteu v kožních záhybech. V literatuře můžeme dohledat jednotlivé kazuistiky závažné bradykardie zaznamenané po topické aplikaci propranololu na kůži. Z farmakokinetického hlediska nelze pominout fakt, že při lokální aplikaci je vyřazen důležitý metabolický krok v játrech, kterým se následně dostává do řečiště vlastní účinný metabolit propranololu. Lokální aplikaci propranololu můžeme připustit u drobných superficiálních hemangiomů v nerizikových oblastech, ovšem pouze za pravidelné monitorace srdeční frekvence. Objeví-li se nekontrolovaná progrese onemocnění, je nutné přejít k systémové terapii okamžitě.
Ostatní terapeutické možnosti
Chirurgická léčba je v současnosti doporučována pouze pro řešení reziduálních lézí po systémové terapii a k řešení závažných komplikací. K těmto patří například neztišitelné krvácení, některá velká rezidua přetrvávající u neléčených involvovaných hemangiomů nebo vzácné stopkaté hemangiomy.
Fotoselektivní lasery jsou doporučovány pouze k doléčení zbytkových lézí po systémové terapii. Dále mohou být použity jen u velmi drobných lézí v nerizikových oblastech, které lze s jistotou jedním ošetřením odstranit. Pracoviště, které je pro takovou léčbu vhodné, musí být vybaveno celou škálou laserů. Použití jednotlivých typů laserů se řídí velikostí a uložením lézí hemangiomu. Na povrchu zasahujeme typicky pulzním barvivovým laserem (585 nm apod.), hlouběji alexandritovým (755 nm) a nejhlouběji Nd:YAG laserem (1064 nm). Pro intersticiálně uložené léze je potřebná laserová intersticiální hypertermie, obvykle diodovým laserem (1470 nebo 980 nm). Lasery indikujeme až po ukončení systémové léčby propranololem nebo při její kontraindikaci (typicky např. pro jinou diagnózu – naevus flammeus). Laser by mohl při nevhodném použití po parciálním zjizvení znemožnit průnik účinné látky do léze. U drtivé většiny pacientů se tak jedná o terapii druhé linie. Po úspěšné systémové léčbě propranololem používáme k doléčení zbytkových lézí lasery ablativní, typicky frakční, kterými jsme schopni korigovat některé následky, např. po ulceracích, a následně tak zvýšit kvalitu života pacienta.17
Závěr
Propranolol ve formě perorálního roztoku je lékem volby k léčbě rozsáhlých a komplikovaných infantilních hemangiomů. Podstatným faktorem je správná diagnóza hemangiomů a vyloučení všech lézí, které se mohou IH podobat. Dále pak odhalení všech faktorů, jež by mohly léčbu betablokátory kontraindikovat, jakož i nutná monitorace pacienta v průběhu eskalace na cílovou denní dávku, ale i po celou dobu jeho léčby. Z uvedených důvodů by měla léčba probíhat na pracovištích, která disponují všemi potřebnými specialisty (dětský dermatolog, dětský onkolog, pediatr, kardiolog, radiolog, chirurgové potřebného zaměření).
Zdroje
1. Munden A, Butschek R, Tom WL, et al. Prospective study of infantile haemangiomas: Incidence, clinical characteristics and association with placental anomalies. Br J Dermatol 2014;170(4):907–913. doi: 10.1111/bjd.12804.
2. Goelz R, Poets CF. Incidence and treatment of infantile haemangioma in preterm infants. Arch Dis Child – Fetal Neonatal Ed. 2015;100(1):F85 LP–F91. doi: 10.1136/archdischild-2014-306197.
3. Smith CJF, Friedlander SF, Guma M, Kavanaugh A, Chambers CD. Infantile hemangiomas: an updated review on risk factors, pathogenesis, and treatment. Birth Defects Res 2017;109(11):809–815. doi:10.1002/bdr2.1023.
4. Chen XD, Ma G, Chen H, Ye XX, Jin YB, Lin XX. Maternal and perinatal risk factors for infantile hemangioma: A case-control study. Pediatr Dermatol 2013;30(4):457–461. doi: 10.1111/pde.12042.
5. Kurlak LO, Mistry HD, Cindrova-Davies T, Burton GJ, Pipkin FB. Human placental renin-angiotensin system in normotensive and pre-eclamptic pregnancies at high altitude and after acute hypoxia-reoxygenation insult. J Physiol 2016;594(5):1327–1340. doi: 10.1113/JP271045.
6. Drolet BA, Swanson EA, Frieden IJ. Infantile Hemangiomas: an emerging health issue linked to an increased rate of low birth weight infants. J Pediatr 2008;153(5). doi: 10.1016/j.jpeds.2008.05.043.
7. Przewratil P, Sitkiewicz A, Andrzejewska E. Local serum levels of vascular endothelial growth factor in infantile hemangioma: Intriguing mechanism of endothelial growth. Cytokine 2010;49(2):141–147. doi: 10.1016/j.cyto.2009.11.012.
8. Léauté-Labrèze C, Prey S, Ezzedine K. Infantile haemangioma: Part I. Pathophysiology, epidemiology, clinical features, life cycle and associated structural abnormalities. J Eur Acad Dermatology Venereol 2011;25(11):1245–1253. doi: 10.1111/j.1468-3083.2011.04102.x.
9. Metry DW, Dowd CF, Barkovich AJ, Frieden IJ. The many faces of PHACE syndrome. J Pediatr 2001;139(1):117–123. doi: https://doi.org/10.1067/mpd.2001.114880
10. Girard C, Bigorre M, Guillot B, Bessis D. PELVIS Syndrome. Arch Dermatol 2006;142(7):884–888. doi: 10.1001/archderm.142.7.884.
11. Haggstrom AN, Drolet BA, Baselga E, et al. Prospective study of infantile hemangiomas: Clinical characteristics predicting complications and treatment. Pediatrics 2006;118(3):882 LP – 887. doi: 10.1542/peds.2006-0413.
12. Merrow AC, Gupta A, Patel MN, Adams DM. 2014 Revised Classification of Vascular
12. Lesions from the International Society for the Study of Vascular Anomalies: radiologic-pathologic update. RadioGraphics 2016;36(5):1494–1516. doi: 10.1148/rg.2016150197.
13. Huang SA, TU HM, Harney JW, et al. Severe hypothyroidism caused by type 3 iodothyronine deiodinase in infantile hemangiomas. N Engl J Med 2000;343(3):185–9. doi: 10.1056/NEJM200007203430305.
14. Konrad D, Ellis G, Perlman K. Spontaneous regression of severe acquired infantile hypothyroidism associated with multiple liver hemangiomas. Pediatrics 2003;112(6 Pt 1):1424–1426. doi: 10.1542/peds.112.6.1424.
15. Léaute-Labrèze C, Boccara O, Degrugillier-Chopinet C, et al. Safety of oral propranolol for the treatment of infantile hemangioma: a systematic review. Pediatrics 2016;138(4):e20160353. doi: 10.1542/peds.2016-0353.
16. Menapace D, Mitkov M, Towbin R, Hogeling M. The changing face of complicated infantile hemangioma treatment. Pediatr Radiol 2016;46(11):1494–1506. doi: 10.1007/s00247-016-3643-6.
17. Léauté-Labrèze C, de la Roque ED, Hubiche T, Boralevi F, Thambo J-B, Taïeb A. Propranolol for severe hemangiomas of infancy. N Engl J Med 2008;358(24):2649–2651. doi: 10.1056/NEJMc0708819.
18. Hermans DJJ, Bauland CG, Zweegers J, van Beynum IM, van der Vleuten CJM. Propranolol in a case series of 174 patients with complicated infantile haemangioma: indications, safety and future directions. Br J Dermatol 2013;168(4):837–843. doi: 10.1111/bjd.12189.
19. Bosemani T, Puttgen KB, Huisman TAGM, Tekes A. Multifocal infantile hepatic hemangiomas – imaging strategy and response to treatment after propranolol and steroids including review of the literature. Eur J Pediatr 2012;171(7):1023–1028. doi: 10.1007/s00431-011-1671-7.
20. Xu S-Q, Jia R-B, Zhang W, Zhu H, Ge S-F, Fan X-Q. Beta-blockers versus corticosteroids in the treatment of infantile hemangioma: an evidence-based systematic review. World J Pediatr 2013;9(3):221–229. doi: 10.1007/s12519-013-0427-z.
21. Blei F, McElhinney DB, Guarini A, Presti S. Cardiac screening in infants with infantile hemangiomas before propranolol treatment. Pediatr Dermatol 2014;31(4):465–470. doi: 10.1111/pde.12344.
22. Mališ J, Stará V, Bláhová K, et al. Infantilní hemangiomy. Současné léčebné postupy. Ces Pediatr 2017;(December).
23. Chinnadurai S, Sathe NA, Surawicz T. Laser treatment of infantile hemangioma: A systematic review. Lasers Surg Med 2016;48(3):221–233. doi: 10.1002/lsm.22455.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Úvodní slovoČlánek Nové lékové registraceČlánek Hypoglykemie u dětíČlánek Vitamin D v dětském věkuČlánek Tyreopatie u dětíČlánek Komentář k článku Vliv liraglutidu na viscerální a ektopický tuk u dospělých s nadváhou či obezitouČlánek Psoriáza v dětském věkuČlánek Deprese dětí a dospívajících
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2021 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Úvodní slovo
- Komentář k článku Vliv liraglutidu na viscerální a ektopický tuk u dospělých s nadváhou či obezitou
- Nové lékové registrace
- Bolest kyčlí u dospělých: hodnocení a diferenciální diagnostika
- Komentář k článku Bolest kyčlí u dospělých: hodnocení a diferenciální diagnostika
- Informovaný souhlas v asistované reprodukci aneb pokrok nezastavíš?
- Komplexní systém výživy u novorozenců – cesta pro budoucnost
- Hypoglykemie u dětí
- Vitamin D v dětském věku
- Virové infekce a možnosti využití inosin pranobexu v ordinaci PLDD
- MUDr. Alena Šebková: Obávám se o budoucnost primární pediatrické péče
- Mikrobi a lidé – běžná kolonizace, nebo invazivní infekce?
- Novinky v léčbě dětského astmatu
- Zánětlivá střevní onemocnění u dětí
- Tyreopatie u dětí
- Infantilní hemangiomy novorozenců a kojenců
- Nové možnosti léčby metabolických onemocnění skeletu v dětském věku
- Psoriáza v dětském věku
- Deprese dětí a dospívajících
- Je dítě pouze zlobivé, nebo má ADHD?
- Nastavení v B modu diagnostického ultrazvukového přístroje – čas, do kterého se vyplatí investovat
- Přerušení léčby vede k progresi chronického žilního onemocnění
- Vliv liraglutidu na viscerální a ektopický tuk u dospělých s nadváhou či obezitou
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Bolest kyčlí u dospělých: hodnocení a diferenciální diagnostika
- Hypoglykemie u dětí
- Mikrobi a lidé – běžná kolonizace, nebo invazivní infekce?
- Novinky v léčbě dětského astmatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





