-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Tyreopatie u dětí
Autoři: MUDr. Dvořáková Marcela, Ph.D.
Působiště autorů: Endokrinologický ústav, Praha
Vyšlo v časopise: Svět praktické medicíny, 2, 2021, č. 4, s. 59-62
Kategorie: Medicína v ČR: přehledový článek
Souhrn
Tyreopatie dětí i dospělých patří mezi nejčastější endokrinní onemocnění a zaplňují více než 80 % činnosti endokrinologických pracovišť v České republice. Podle odhadu založeného na nesystematických epidemiologických sledováních u nás postihují asi 5 % obyvatelstva. Jejich výskyt se liší, u některých věkových skupin je několikanásobně vyšší než u jiných. Prevalence onemocnění štítné žlázy, podobně jako u řady dalších endokrinopatií, je vyšší u ženské populace než u mužské.
Článek předkládá ucelený přehled vrozených i získaných tyreopatií včetně klinického obrazu spolu s diagnosticko-terapeutickými přístupy.
Etiologie tyreopatií je velice pestrá od geneticky podmíněných onemocnění v důsledku vývojové vady až po poškození vnějšími nebo vnitřními vlivy, jako jsou chemické a fyzikální noxy, nutriční vlivy, deficit jodu, léky, traumata, infekce, autoimunitní onemocnění, krvácení, iatrogenní vlivy nebo nádorové bujení. Tyto příčiny mají různé klinické projevy od změny velikosti štítné žlázy – strumy až k její porušené funkci vyžadující další terapii a dispenzarizaci.
Struma vzniká na podkladě nedostatku hormonů, který je nejčastěji následkem:
1. nedostatku jodu v potravě,
2. autoimunitních onemocnění,
3. přítomnosti strumigenů,
4. vrozených enzymatických defektů při syntéze hormonů štítné žlázy.
Etiologie strumy se různí podle věku. U novorozenců je způsobena dyshormonogenezí štítné žlázy a těžším jodovým deficitem matky v těhotenství, u dětí do 10 let je struma způsobena jodovým deficitem a na významnosti nabývají autoimunitní tyreopatie – juvenilní lymfocytární tyreoiditida a vzácnější juvenilní Gravesova-Basedowova tyreotoxikóza. U starších dětí a adolescentů převažuje autoimunitní onemocnění štítné žlázy s větší prevalencí u dívek než hochů (6 : 1).
Pro posouzení velikosti štítné žlázy existují normy volumů k věku, ale nezohledňují pohlavní diferenciaci a mohou se regionálně lišit. Přesnější jsou normy volumů štítné žlázy k povrchu těla vytvořené pro dětskou populaci České republiky, zvlášť pro hochy a dívky.
1. Jodový deficit – význam jodu ve vztahu k tyreopatiím
Nezbytný prvek pro tvorbu hormonů štítné žlázy je biogenní prvek jod, vyskytující se v přírodě značně nehomogenně. Mořská voda je jeho hlavním rezervoárem. Přímořské oblasti mají obecně jodu dostatek, oblasti vzdálené od moře trpí nedostatkem jodu v geologickém podloží, následně i v půdě a ve zdrojích pitné vody, s čímž souvisí jeho nedostatek v potravinách živočišného a rostlinného původu. Česká republika byla dříve svojí vnitrozemskou polohou na většině svého území kromě oblastí nížin s naplaveninami (Polabí, jižní Morava) postižena různým stupněm jodového deficitu, až po nejtěžší formu endemický kretenismus.
Jod se do organismu dostává potravou, dobře se vstřebává z trávicího traktu a ve formě jodidu se krevním oběhem dostává po aktivním transportu do buněk štítné žlázy, kde probíhá složitý cyklus jeho přeměny na neutrální jod za přítomnosti systému peroxidáz, následovaný jodací aminokyselin, syntézou hormonů štítné žlázy a jejich konečným uvolněním do krevního oběhu.
Vylučování jodu se děje převážně močovou exkrecí (80–90 % přijaté dávky). Stanovení močové exkrece (jodurie) je běžně používaným zlatým standardem pro hodnocení příjmu jodu (Tab. 1). Optimální přísun jodu se liší ve věkových obdobích, je závislý na růstu, vývoji a fyziologických změnách organismu při přechodně zvýšených nárocích organismu na tvorbu hormonů štítné žlázy např. v pubertě, v těhotenství a při kojení (Tab. 2).
Tab. 1. Hodnocení stavu jodového zásobení školáků v Evropě pomocí jodurie [podle Delange F. WHO, ICCIDD, 2002] ![Hodnocení stavu jodového zásobení
školáků v Evropě pomocí jodurie [podle
Delange F. WHO, ICCIDD, 2002]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3644777925d400d6a73af3dc306a24e0.png)
Tab. 2. Doporučené denní dávky jodu [podle WHO, ICCIDD, UNICEF z roku 2001] ![Doporučené denní dávky jodu
[podle WHO, ICCIDD, UNICEF z roku 2001]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/33519a5a1d0df4ab450cf21424b89e4b.png)
Při nedostatku jodu v organismu dochází k poruchám somatického i psy chického vývoje a poruše řady generačních funkcí. Jeho projevy jsou komplexní a liší se stupněm vývoje organismu, odkdy nedostatek jodu působil (Tab. 3).
Tab. 3. Onemocnění z nedostatku jodu [modifikováno podle Hetzela] ![Onemocnění z nedostatku jodu [modifikováno podle Hetzela]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/58031e5b3f1ddd4f21f817129da8169f.png)
Nejrizikovějšími skupinami ohledně nedostatečného přísunu jodu jsou plody, novorozenci, kojenci, děti do tří let věku, těhotné a kojící matky a starší populace.
Kritérii hodnocení závažnosti jodového deficitu, stejně jako kritérii jeho úspěšného zvládnutí jsou hodnoty jodurie a objemu štítné žlázy. Pro odstranění jodového deficitu platí, že průměrná jodurie v průměrné populaci dosahuje 100–200 μg/l, pouze u 1,3 % populace nedosahuje jodurie 50 μg/l a prevalence strumy u školních dětí klesne pod 5 %.
Získané poznatky a výsledky systematického epidemiologického výzkumu vedeného Endokrinologickým ústavem od 90. let minulého století byly podkladem k realizaci celého komplexu opatření k odstranění jodového deficitu u nás: zlepšení jodace kuchyňské soli zvýšeným obsahem v jedlé soli 27 ± 7 mg jodu v 1 kg soli a nahrazení jodidu stabilnějším jodičnanem, obohacování nápojů, kojenecké výživy a potravin jodem, používání jodované soli v potravinářském průmyslu. Dále byly podle doporučení České endokrinologické společnosti ČLS JEP a České pediatrické společnosti ČLS JEP doporučeny optimální denní dávky jodu pro jednotlivé dětské věkové kategorie a zvýšení přívodu jodu rizikovým skupinám (těhotným, kojícím a adolescentům) užíváním tablet 100 µg jodidu draselného.
Na základě těchto kritérií došlo od roku 2002 v České republice k odstranění jodového deficitu, a tím se Česká republika zařadila mezi několik zemí v Evropě, kde byl v posledních letech jodový deficit vyřešen.
Situaci jodového zásobení je nezbytné soustavně monitorovat a působit preventivně doporučením konzumace mořských produktů, pití mléka 0,2 l denně u dětí. K léčbě nepřistupujeme paušálně, ale po vyšetření jodurie při hodnotách nižších než 100 μg/l, po vyloučení autoimunitního onemocnění štítné žlázy. Volbou je Jodid nebo Jodthyrox 100 μg podávaný 1x denně.
2. Kongenitální hypotyreóza
Odhalení genetické podstaty kongenitální hypotyreózy (KH) u některých pacientů objasnilo mechanismus účinku genů podílejících se na vývoji štítné žlázy a její funkci. Výzkumem odhalené mutace genů pro transkripční faktory (např. NKX2.1, TTF 2, PAX 8) mají rozhodující úlohu v časných fázích vývoje štítné žlázy při morfogenezi, diferenciaci a migraci, ale i v regulaci funkce štítné žlázy, neboť ovlivňují expresi tyreoglobulinu, tyreoidální peroxidázy, natrium-jodidového symportéru a receptoru pro tyreotropin. Tyto faktory se exprimují též v CNS, a tím mohou dát odpověď na otázku, proč u některých dětí přes včasnou a adekvátní léčbu KH dojde přesto k opoždění psychomotorického vývoje.
Ve 12. týdnu intrauterinního života je štítná žláza plodu plně funkční tvorbou a sekrecí T4 i T3, v CNS je přítomna sekrece TRH i TSH. Od druhé poloviny gravidity je plně funkční hypotalamo-hypofýzo-tyreoidální osa a teprve od 3. měsíce postnatálního života je plně funkční zpětnovazebný regulační systém CNS–štítná žláza–krevní oběh–CNS. Nezbytnou podmínkou správné regulace je zvýšený přísun jodu během gravidity až na 250 μg Jodidu denně.
Nejčastější příčiny kongenitální hypotyreózy jsou v 80 % dysgeneze štítné žlázy s incidencí 1 : 3–4000 a v 20 % dyshormonogeneze s incidencí 1 : 30 000. Postupné odhalování jednotlivých genů odpovědných za tvorbu tyreoidálních enzymů a hormonů štítné žlázy skýtá do budoucna velké možnosti pro diagnostiku poruch daných genů, ale i pro novou terapii.
Od roku 1996 je zaveden celoplošný screening vrozené hypotyreózy na stanovení hladiny TSH fluoroimunometricky v suché krevní kapce získané po vpichu do patičky novorozence 48–72 hodin po porodu. Hladina TSH > 15 mIU/l svědčí pro záchyt vrozené hypotyreózy a následuje okamžité vyšetření TSH a fT4 z venózní krve. Prevalence kongenitální hypotyreózy v ČR vzrostla, od roku 2010 je 1 : 2766, příčinou může být vrozená hypotyreóza se štítnou žlázou in situ, mírnější tranzientní formy a dále vyšší podíl předčasně narozených dětí.
Na druhé straně v určitých situacích může dojít k maskování vrozené hypotyreózy „proklouznutím novorozence“ při prvozáchytu u předčasně narozených dětí s nízkou porodní hmotností, nevyzrálostí hypotalamo-hypofyzární osy nebo při podání glukokortikoidů vedoucích k supresi TSH. S cílem eliminovat falešně negativní výsledky se od roku 2002 provádí rescreening 8. až 14. den po narození nebo po dosažení požadované hmotnosti u vybraných rizikových novorozenců podle metodiky ve Věstníku MZ ČR z roku 2016.
Klinické projevy kongenitální hypotyreózy jsou nenápadné, během nitroděložního života je hypotyreóza kompenzovaná transplacentárním přenosem mateřského tyroxinu. U novorozence může být protrahovaný ikterus, perzistující malá fontanela, později kolem 3. měsíce může dominovat hmotnostní neprospívání, makroglosie, zpomalené krmení, obstipace, svalová hypotonie, pupeční kýla, porucha kostního zrání. Znalost klinického obrazu je důležitá hlavně u centrální kongenitální hypotyreózy, která může uniknout při novorozeneckém screeningu i při rescreeningu založeném na zvýšeném TSH. Možné úniky ze screeningů mohou být u domácích porodů, u dětí migrantů.
U mírných forem dysgeneze nebo dyshormonogeneze může být screening negativní a hypotyreóza se vyvíjí časně postnatálně. Celoplošný novorozenecký screening kongenitální hypotyreózy je též nástrojem monitorování jodového zásobení populace. Pro normální zásobení populace jodem svědčí výskyt TSH > 5 mIU/l u méně než 3 % novorozenecké populace.
Děti s prokázanou kongenitální hypotyreózou jsou podrobně vyšetřeny s cílem včasného odhalení dalších vrozených vad. Nejčastější sdruženou poruchou je senzorineurální porucha sluchu přítomná asi u 10 % dětí s kongenitální hypotyreózou, proto je u těchto dětí povinný screening vrozených sluchových vad do tří měsíců vyšetřením otoakustických emisí.
Léčba vrozené hypotyreózy vyžaduje okamžitou léčbu vyššími dávkami levotyroxinu 10–15 μg/kg/den v jedné denní dávce, rozdrcené v malém množství mléka za stejných podmínek bez nutnosti lačnění (Tab. 4).
Tab. 4. Doporučené substituční dávky tyroxinu u hypotyreózy 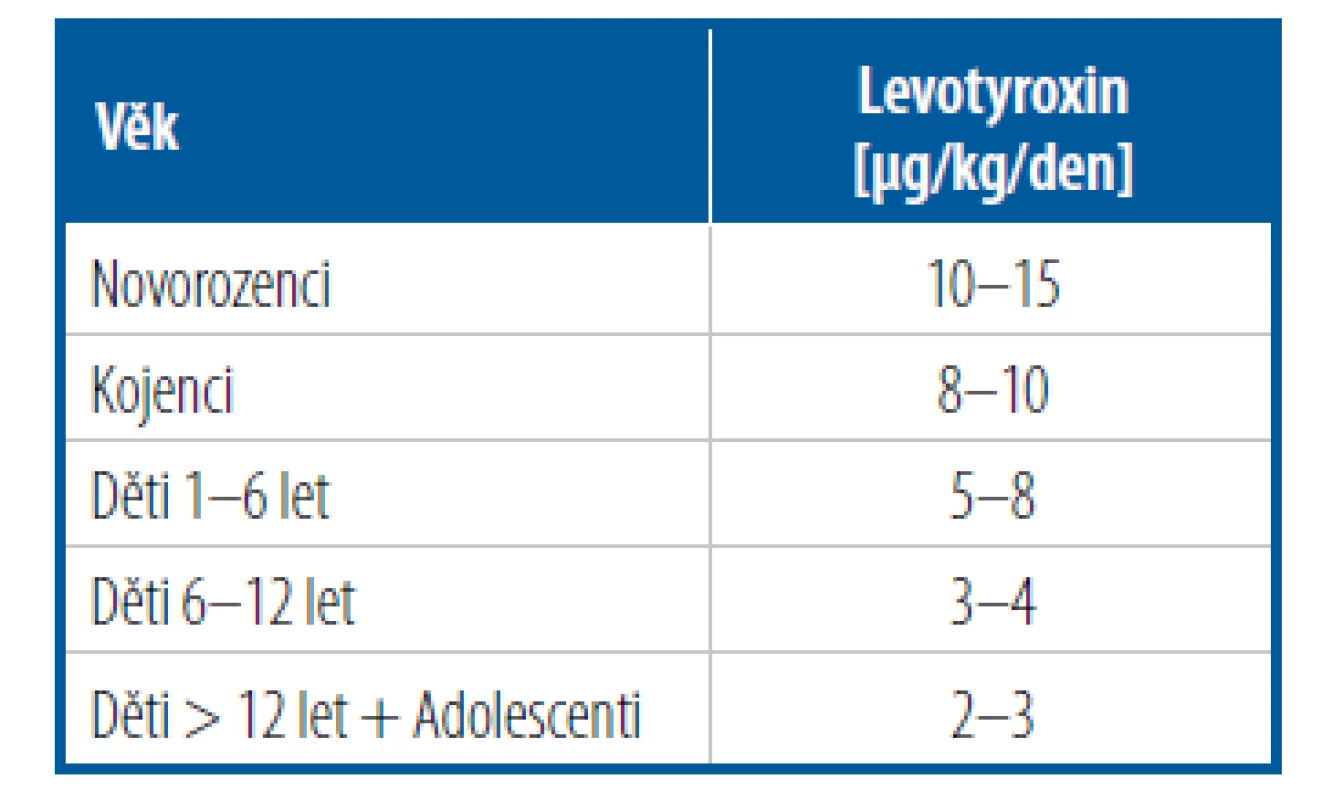
3. Autoimunitní tyreopatie
Nejčastější příčinou poruch funkce štítné žlázy jsou autoimunitní tyreopatie (chronická lymfocytární tyreoiditida [CLT] a Gravesova-Basedowova toxikóza), na jejichž vzniku a rozvoji se podílejí faktory genetické a exogenní (virové infekce, stres, léky).
U CLT poškozují protilátky proti tyreoidální peroxidáze (AbTPO) a protilátky proti tyreoglobulinu (AbTg) tyreocyty, z nichž se v počáteční fázi může přechodně vyplavit velké množství tyreoidálních hormonů do krevního oběhu (Hashitoxikóza) s postupným metabolizováním a následnou sníženou tvorbou. U Gravesovy-Basedowovy toxikózy obsadí protilátky receptory pro TSH na povrchu tyreocytu a stimulují je k vyšší činnosti s produkcí velkého množství hormonů trijodtyroninu a tyroxinu. Není-li diagnostika a léčba včasná, může mít dysfunkce nepříznivý vliv na tělesný a duševní vývoj.
Poruchy funkce štítné žlázy se u mladších dětí neprojevují tak typicky jako u starších dětí a dospělých. Nejčastějšími příznaky jsou nevýkonnost a horší koncentrace, děti bývají liknavé, nesoustředěné a pomaleji chápou. Dysfunkce štítné žlázy může zhoršit prospěch ve škole. Poruchy postihují kognitivní funkce a symptomy se podobají některým jiným obtížím jako u dětí s poruchou pozornosti a hyperaktivitou u syndromu ADHD.
Výskyt může být izolovaný nebo může dojít ke sdružování s jinými autoimunitami v rámci polyglandulárního syndromu (například juvenilní revmatoidní artritida, celiakie, diabetes mellitus 1. typu, vitiligo, sclerosis multiplex). Screening na imunopatie by měl být cíleně zaměřen na rizikové jedince – dívky s Turnerovým syndromem a děti s Downovým syndromem pro jejich častou incidenci.
Diagnostika CLT je založena na klinickém obraze, ale především na laboratorním stanovení fT4, TSH a aktivity AbTPO a AbTg. Nezastupitelnou úlohu ve vyšetřovacím algoritmu má sonografie štítné žlázy – zjištěním velikosti objemu a změn její struktury. Scintigrafie štítné žlázy se u dětí neprovádí. CLT je celoživotní onemocnění s trvalou léčbou. V průběhu vývoje dítěte se postupně dodávka levotyroxinu zvyšuje v závislosti na růstu a vývoji dítěte. Průměrná dávka je 1,5 μg/kg/den s cílem normalizace TSH i fT4 (Tab. 5). Lék se užívá ráno nalačno nejlépe 30 minut před snídaní, zapíjí se vodou. Některé léky (soli železa, inhibitory protonové pumpy), nápoje (grapefruitový džus, rozpustná káva), potraviny (vláknina) mohou negativně ovlivňovat vstřebávání levotyroxinu, proto je nutná pečlivá monitorace hladin TSH i fT4.
Tab. 5. Referenční meze fT4 a TSH
(Roche Diagnostics, Mannheim, SRN)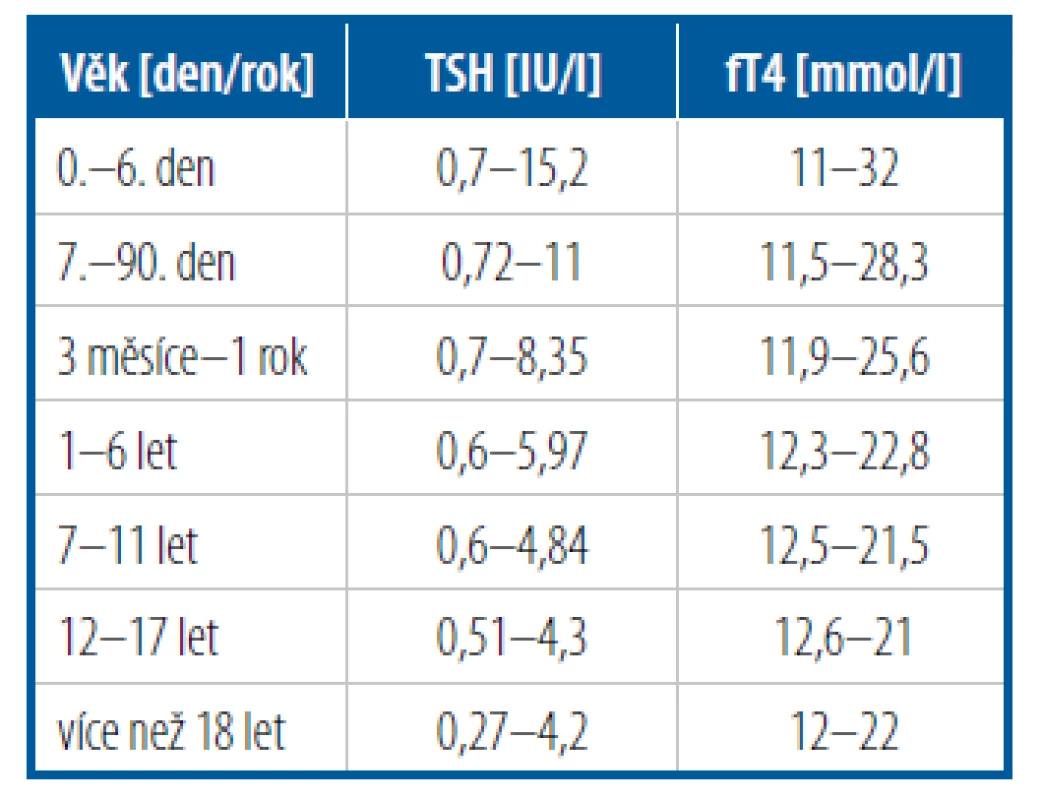
Při terapii Hashitoxikózy sledujeme dynamiku hladin fT4 a TSH, pouze přechodně blokujeme vliv velkého množství tyreoidálních hormonů na kardiovaskulární aparát podáním selektivních ß2 - blokátorů. Není důvod nasazovat tyreostatika zasahující do tvorby tyreoidálních hormonů, neboť ta není porušena.
Gravesova-Basedowova toxikóza u dětí má v klinickém obraze na rozdíl od dospělých některé zvláštnosti. Jejím dominujícím příznakem je struma, dále časté poruchy chování, spánku, nesoustředěnost, poruchy koncentrace ve škole, bolesti břicha, zřídka i zvracení, třes a bušení srdce, úbytek hmotnosti, ev. nárůst hmotnosti způsobený zvýšenou chutí k jídlu.
V laboratoři nacházíme snížené TSH, zvýšené fT4 a fT3, pozitivní AbTPO, AbTg a TRAK. Na rozdíl od dospělých se u malých dětí prakticky nevyskytuje endokrinní orbitopatie, její výskyt stoupá s věkem.
Lékem první volby u hyperfunkce štítné žlázy dětí je pouze tyreostatikum Thyrozol v dávce 0,5 mg/kg/den rozděleně na tři dávky denně po dobu 4–8 týdnů. T4 a T3 klesají nejdříve, TSH zůstává déle suprimované. Po normalizaci hladin se snižuje dávka Tyrozolu za pečlivého monitorování fT4 a fT3 v odstupu 6 týdnů, poté po 2–3 měsících. Nedoporučuje se snižovat dávku tyreostatik při normalizaci fT4 a trvalé supresi TSH pro možný relaps onemocnění. Pokud eutyreóza nastane do tří měsíců od zahájení léčby, je větší naděje na remisi. Malá šance na remisi je při prodlouženém podávání tyreostatik, při 2,5x větším objemu štítné žlázy, než je norma, zvýšeném TRAK při léčbě a fT4 větším než 50 nmol/l.
Definitivní řešení v léčbě je totální tyreoidektomie na specializovaném dětském pracovišti pro chirurgii v oblasti krku a hlavy. Radioterapie jako léčba tyreotoxikózy u dětí je v našich podmínkách kontraindikována. Po operaci následuje celoživotní substituční léčba levotyroxinem „šitá na míru“.
Druhá nejčastější tyreopatie u dětí je subklinická hypotyreóza. Jedná se o laboratorní pojem zvýšeného TSH > 5 mIU/l při normální hladině fT4. U obézních dětí je hladina TSH fyziologicky vyšší a neléčí se. Při TSH 5–10 mIU/l panuje v léčbě názorová rozdílnost, při TSH > 10 mIU/l je shoda a vždy se léčí. Důvodem léčby je přímý vliv levotyroxinu na syntézu růstového hormonu, příznivé ovlivnění růstu a vývoje, zlepšení růstové rychlosti, a zejména prevence progrese do manifestní hypotyreózy.
Léčba je otázkou názorů a klinických zkušeností jednotlivých lékařů „state of art “, nikoli „evidence-based medicine“.
4. Nádory štítné žlázy
U dětí do 15 let jsou nádory štítné žlázy vzácné, nad 15 let patří k pěti nejčastějším karcinomům. Vzestup incidence v posledních letech je dán především zlepšením diagnostiky díky sonografickému vyšetření štítné žlázy, cytologickému a genetickému vyšetření punktovaného vzorku s cílem odhalit biologickou podstatu vyšetřovaného útvaru.
Palpačně nebo náhodně zjištěný solitární uzel při sonografickém vyšetření štítné žlázy je indikován k vyšetření punkce tenkou jehlou pod sonografickou kontrolou s následným cytologickým vyšetřením punktátu. Podle hodnocení klasifikace Bethesda 2010 – kategorie I–VI se posoudí závažnost nálezu a další postup: buď jen sledováním dynamiky uzlu (klasifikace I–II), opakováním punkce (kategorie III), nebo její totální odstranění (kategorie IV–VI). Většinu nádorů tvoří diferencované papilární nádory s velmi dobrou prognózou, s pomalým růstem a nejlepší prognózou ze všech typů. Šíří se do lymfatických uzlin, plic (miliární rozsev) a jejich výskyt souvisí se zlepšením jodového zásobení naší populace.
Výrazný rozvoj genetické diagnostiky medulárního karcinomu štítné žlázy napomáhá nálezy mutací genů u agresivních forem k rozhodnutí o rychlosti operace a též při nálezu rizikových genů u familiárních forem o profylaktickém odstranění štítné žlázy u rodinných příslušníků z preventivních důvodů.
Léčba nádorů štítné žlázy je vždy chirurgická, spočívá v odstranění celé štítné žlázy a dalším terapeutickém postupu podle histologického vyšetření s možností doléčení radioaktivním jodem na pracovišti nukleární medicíny při extratyreoidálním invazivním růstu bez ohledu na věk. Pacienti po operacích štítné žlázy jsou celoživotně dispenzarizováni a pravidelně kontrolováni endokrinologem, 1x za šest měsíců v prvních dvou letech a 1x ročně na klinice nukleární medicíny.
Sledovaným onkomarkerem po totálním odstranění štítné žlázy je tyreoglobulin (Tg), který by měl být nulový. Cílem léčby u tyreoonkologických pacientů je suprese TSH (TSH u dolní hranice normy a fT4 u horní hranice) vyššími dávka levotyroxinu.
Závěr
Tyreopatie při včasné diagnóze a léčbě mají příznivou prognózu, nezastupitelnou úlohu má sonografie, cytologické vyšetření punktátu a stanovení tyreoglobulinu, parathormonu a kalcitoninu v punktátu.
Vzhledem ke složité problematice je zásadní týmová mezioborová spolupráce – pediatr, praktický lékař pro děti a dorost, dětský endokrinolog, dětský otorinolaryngolog, chirurg erudovaný v operacích štítné žlázy a pracoviště nukleární medicíny.
Seznam použitých zkratek:
AbTg – protilátky proti tyreoglobulinu
AbTPO – protilátky proti tyreoidální peroxidáze
ADHD – attention deficit hyperactivity disorder
fT3 – volný trijodtyronin
fT4 – volný tyroxin
ICCIDD – International Committee for Control of Iodine Deficiency Disorders
Tg – tyreoglobulin
TRAK – protilátky proti TSH receptoru
TSH – tyreotropin
TRH – thyrotropin-releasing hormone
WHO – World Health Organization
Zdroje
1. Al Taji E. Diagnostika, léčba a prognóza vrozené hypotyreózy. Čes Slov Pediat 2018;73(3):158–164.
2. Delange F. Iodine deficiency in Europe and its consequences: an update. Eur J Nucl Med Mol Imaging 2002;29 (Suppl. 2):S404–16.
3. Dvořáková M. Struma u dětí a její léčba. Čes Slov Pediat 2004;59(11):566–572.
4. Dvořáková M, Čeřovská J, Zamrazil V, Zikmund J, et al. Stanovení vlastních norem objemů štítné žlázy u dětí a dorostu v České republice. Čes Slov Pediat 2003;3 : 115–120.
5. Metodický návod k zajištění novorozeneckého laboratorního screeningu a následné péče. In: Věstník Ministerstva zdravotnictví České republiky 2016; částka 6 : 2–12.
6. Zamrazil V, Bilek R, Cerovska J, Delange F. The elimination of iodine deficiency in the Czech Republic: the steps toward success. Thyroid 2004;14 : 49–56.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Úvodní slovoČlánek Nové lékové registraceČlánek Hypoglykemie u dětíČlánek Vitamin D v dětském věkuČlánek Komentář k článku Vliv liraglutidu na viscerální a ektopický tuk u dospělých s nadváhou či obezitouČlánek Psoriáza v dětském věkuČlánek Deprese dětí a dospívajících
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2021 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Úvodní slovo
- Komentář k článku Vliv liraglutidu na viscerální a ektopický tuk u dospělých s nadváhou či obezitou
- Nové lékové registrace
- Bolest kyčlí u dospělých: hodnocení a diferenciální diagnostika
- Komentář k článku Bolest kyčlí u dospělých: hodnocení a diferenciální diagnostika
- Informovaný souhlas v asistované reprodukci aneb pokrok nezastavíš?
- Komplexní systém výživy u novorozenců – cesta pro budoucnost
- Hypoglykemie u dětí
- Vitamin D v dětském věku
- Virové infekce a možnosti využití inosin pranobexu v ordinaci PLDD
- MUDr. Alena Šebková: Obávám se o budoucnost primární pediatrické péče
- Mikrobi a lidé – běžná kolonizace, nebo invazivní infekce?
- Novinky v léčbě dětského astmatu
- Zánětlivá střevní onemocnění u dětí
- Tyreopatie u dětí
- Infantilní hemangiomy novorozenců a kojenců
- Nové možnosti léčby metabolických onemocnění skeletu v dětském věku
- Psoriáza v dětském věku
- Deprese dětí a dospívajících
- Je dítě pouze zlobivé, nebo má ADHD?
- Nastavení v B modu diagnostického ultrazvukového přístroje – čas, do kterého se vyplatí investovat
- Přerušení léčby vede k progresi chronického žilního onemocnění
- Vliv liraglutidu na viscerální a ektopický tuk u dospělých s nadváhou či obezitou
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Bolest kyčlí u dospělých: hodnocení a diferenciální diagnostika
- Hypoglykemie u dětí
- Mikrobi a lidé – běžná kolonizace, nebo invazivní infekce?
- Novinky v léčbě dětského astmatu
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



