-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Stanovení DNA metylace v BRCA2 genu na elektrodových biočipech
Analysis of DNA Methylation in BRCA2 Gene Using Electrode Biochips
Background:
Since DNA methylation results in gene silencing, it plays an important role in cell proliferation and differentiation. Abnormal DNA methylation is often associated with carcinogenesis, and therefore its analysis could be an interesting option in early diagnostics of cancer, determination of tumour invasiveness, progression or metastatic potential. One of the methods for DNA analysis could be also electrochemistry, which offers inexpensive instrumentation, short measurement times and parallel detection of samples.Material and Methods:
We have analyzed methylation status of a DNA site within BRCA2 gene promoter sequence, which is associated with breast cancer. We hybridized this sequence at magnetic beads and then we incubated them with methylation-sensitive restriction endonuclease BstUI, which specifically cleaves non-methylated restriction site CGCG, but not methylated one. After addition of labeled DNA probe and peroxidase, we monitored enzymatic reaction at the electrode chip.Results:
First, we tested suitability of designed DNA probes and effectiveness of BstUI cleavage using gel electrophoresis. Afterwards, we applied these probes and the enzyme to the magnetic beads, with the final detection at the electrode chip. We show good correlation of electrochemical and electrophoresis results, i.e. that labelled DNA probe was removed only when DNA containing non-methylated restriction site was incubated with BstUI. When this restriction site was methylated, no cleavage occurred and the resulting signal was high. We also show good reproducibility of the measurement.Conclusion:
Electrochemical detection, in combination with magnetic beads and restriction enzymes, could be a potentially useful tool for determination of methylation status of a specific DNA sequence.Key words:
DNA methylation – DNA restriction enzymes – electrochemistry – nucleic acid hybridization
This work was supported by MEYS – NPS I – LO1413.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
6. 3. 2017Accepted:
26. 3. 2017
Autoři: M. Bartošík 1; D. Bartáková 2
Působiště autorů: Masarykova univerzita, Brno 2
Vyšlo v časopise: Klin Onkol 2017; 30(Supplementum1): 149-152
Kategorie: Článek ve sborníku
Souhrn
Úvod:
DNA metylace tlumí expresi genů, a hraje tak důležitou roli v proliferaci nebo diferenciaci buněk. Abnormální metylace DNA, zejména promotorů genů, je často asociována se vznikem nádorových onemocnění, a proto se analýza metylace DNA jeví jako zajímavá možnost při včasné diagnostice nádorů, případně při určení jejich invazivity, progrese nebo metastatického potenciálu. Jednou z metod analýzy by mohla být i elektrochemie, která nabízí finančně nenáročné přístrojové vybavení, rychlé měření a paralelní detekci více vzorků.Materiál a metody:
Analyzovali jsme metylační status konkrétního místa promotoru genu BRCA2 hrajícího roli při vzniku karcinomu mléčné žlázy. Tuto sekvenci jsme hybridizovali na magnetické kuličky a štěpili pomocí metyl senzitivní restriktázy BstUI, která štěpí restrikční místo CGCG u nemetylované DNA, nikoli však u metylované DNA. Po přidání značené DNA sondy a peroxidázy jsme sledovali enzymatickou reakci na elektrodovém čipu.Výsledky:
Nejdřív jsme pomocí gelové elektroforézy ověřili vhodnost navržených sond a efektivitu štěpení restriktázy BstUI. Následně jsme tyto sondy a BstUI enzym použili v kombinaci s magnetickými kuličkami a s výslednou detekcí na elektrodovém čipu. Ukázali jsme, že výsledky dobře korelují s gelem, tj. že značená sonda byla na magnetických kuličkách restriktázou odštěpena pouze u nezametylovaného restrikčního místa. V případě, že restrikční místo bylo zametylováno, ke štěpení nedošlo a výsledný signál byl vysoký. Ukázali jsme i dobrou reprodukovatelnost měření.Závěr:
Elektrochemická detekce se jeví jako potenciálně zajímavý nástroj, který by společně s magnetickými kuličkami a restrikčními enzymy mohl jednoduchým způsobem určit metylační status konkrétního místa v DNA.Klíčová slova:
DNA metylace – DNA restrikční enzymy – elektrochemie – hybridizace nukleových kyselinÚvod
Epigenetická modifikace DNA v podobě metylace cytozinů (C) na 5-uhlíku (u CpG dinukleotidů) za vzniku metylcytozinu (mC) hraje důležitou roli při tlumení genové exprese, a ovlivňuje tak řadu biologických procesů vč. diferenciace nebo proliferace buněk. Při nadměrné metylaci (hypermetylaci) promotorů tumor supresorových genů může docházet ke snížení aktivity tumor supresorových proteinů, a tak i k nižší ochraně před nádorovým bujením [1]. Známým příkladem jsou geny BRCA1 a BRCA2, které se podílí na stabilitě chromozomů a při opravě poškození DNA, a u kterých bylo prokázáno, že jejich hypermetylace může vést až ke vzniku karcinomu mléčné žlázy nebo vaječníků [2]. Analýza metylace DNA proto skýtá výrazný potenciál aplikovatelný např. pro včasnou diagnostiku nádorů a případné určení jejich invazivity, progrese, metastatického potenciálu nebo chemosenzitivity [3].
Jedna z možností, jak analyzovat DNA metylaci, je aplikace tzv. metyl senzitivních restrikčních endonukleáz, které štěpí DNA v restrikčním místě obsahujícím nemetylovaný cytozin, např. enzym BstUI (štěpí CG|CG) nebo HpaII (C|CGG). Přítomnost mC v restrikčním místě štěpení blokuje. Na tomto principu vzniklo několik technik pro rozlišení metylované a nemetylované DNA [4]. Rozhodli jsme se v této práci vyvinout elektrochemickou metodu v kombinaci s magnetickými kuličkami a restrikčními enzymy pro rozlišení C a mC v restrikčním místě promotoru genu BRCA2.
Materiál a metody
Při vývoji metody jsme použili komerčně dostupnou cílovou DNA se sekvencí identickou s částí promotoru genu BRCA2, dlouhou 75 nukleotidů (nt), přičemž restrikční místo CGCG pro restriktázu BstUI bylo jak nemetylováno (NEM; 5’-GGC TTG TGG CGCG AGC TTC TGA AAC TAG GCG GCA GAG GCG GAG CCG CTG TGG CAC TGC TGC GCC TCT GCT GCG CC-3’), tak metylováno (MET; 5’-GGC TTG TGG mCGmCG AGC TTC TGA AAC TAG GCG GCA GAG GCG GAG CCG CTG TGG CAC TGC TGC GCC TCT GCT GCG CC-3‘). K oběma vláknům bylo kvůli vytvoření duplexu (pro potřeby gelové elektroforézy) k dispozici i komplementární vlákno COMP (rovněž 75 nt).
Streptavidinové magnetické kuličky jsme nejdřív modifikovali DNA vazební sondou obsahující biotin na 5’-konci (CP; 5’-biotin-TTT GGC GCA GCA GAG GCG CAG CAG TGC CAC AGC GG-3’) se sekvencí komplementární k NEM i MET (15 min/25 °C), a jakákoli volná vazební místa streptavidinu jsme následně zablokovali inkubací s 1 mM biotinem (15 min/25 °C). Takto modifikované kuličky jsme hybridizovali s cílovou DNA a s detekční DNA sondou značenou biotinem na druhém konci (DP; 5’-GCC GCC TAG TTT CAG AAG CTC GCG CCA CAA GCC TTT-3’-biotin) po dobu 30 min při 25 °C. Na kuličkách tak vznikl DNA duplex složený ze tří vláken, který byl následně štěpen metylačně senzitivní restriktázou BstUI pouze v případě, že restrikční místo nebylo metylováno. Detekční sonda značená biotinem tak byla odmyta pryč, což vedlo k poklesu signálu. Pokud byl duplex metylován, BstUI duplex nerozštěpil, značená sonda zůstala navázána na kuličkách, a mohla být inkubována se streptavidinem konjugovaným s peroxidázou. Na elektrodovém čipu jsme pak monitorovali proudovou odezvu peroxidázové reakce (obr. 1).
Obr. 1. Schéma protokolu na magnetických kuličkách a měření na elektrodovém čipu. Metylovaná DNA je chráněna před štěpením, což se projeví vyšším signálem v porovnání s nemetylovanou DNA, u které je značka (biotin) štěpením odstraněna. 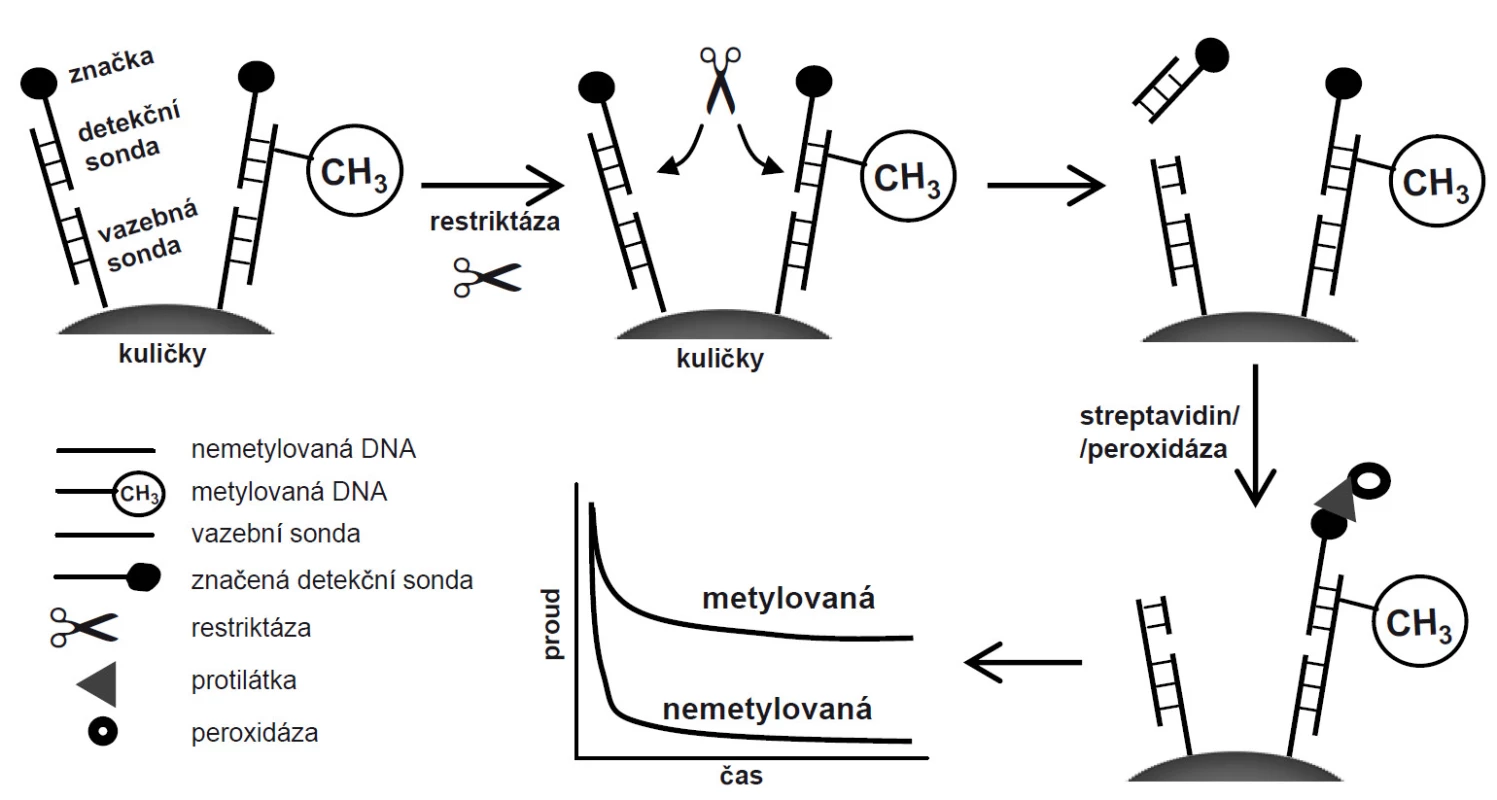
Výsledky
Pomocí agarozové gelové elektroforézy jsme ověřili metylačně specifickou aktivitu enzymu BstUI na restrikční místo DNA (obr. 2A). Nejdřív bylo provedeno štěpení duplexu složeného ze dvou stejně dlouhých komplementárních vláken (75 nt), a to buď NEM + COMP (dráhy 2, 4 a 6) nebo MET + COMP (dráhy 3, 5 a 7). Úspěšné štěpení proběhlo pouze u nemetylovaného vzorku po inkubaci s BstUI (dráha 4), protože došlo k posunu původního duplexu (75 párů bazí, 75 bp) k nižším molekulovým hmotnostem (vznikly dva fragmenty o kratší délce). Metylace restrikčního místa (dráha 5) štěpení blokovalo. Jako negativní kontrolu jsme použili DNA duplexy bez restriktázy (dráhy 2 a 3), u kterých dle očekávání k posunu signálu nedošlo. Specificitu štěpení jsme ověřili použitím jiné restriktázy, konkrétně HpaII (dráhy 6 a 7), která štěpí nemetylovanou DNA v místě CCGG. Protože toto restrikční místo se v našem duplexu nenachází, ke štěpení taktéž nedošlo. Ověřili jsme rovněž štěpení metylované a nemetylované DNA v duplexu s CP/DP (obr. 2B), což lépe vystihuje podmínky při štěpení na kuličkách. Úspěšné štěpení proběhlo pouze u duplexu NEM + DP, který jako jediný obsahuje nemetylované restrikční místo CGCG.
Obr. 2A. Gelová elektroforéza pro nemetylované a metylované DNA duplexy před a po štěpení restriktázami BstUI a HpaII. B. Štěpení restriktázou BstUI pro DNA vzorky obsahující buď vazební sondu (CP) anebo detekční sondu (DP). Dráha 1 v obou případech zobrazuje žebříček DNA (znázorněny jsou fragmenty 100, 200 a 300 bp). 
Výsledek elektrochemického měření je zobrazen na obr. 3. Na magnetické kuličky jsme navázali buď nemetylovanou nebo metylovanou DNA a každý z těchto vzorků jsme rozdělili na dvě stejné části. První polovina byla inkubována s restriktázou BstUI, druhá sloužila jako kontrolní vzorek bez restriktázy. Z obr. 3 je zřejmé, že k výraznému snížení signálu došlo pouze u nemetylované DNA při použití restriktázy BstUI, přesně dle výsledků z elektroforézy (obr. 2). Ostatní vzorky byly neštěpené, a tudíž přítomnost (neodštěpeného) biotinu na detekční sondě vedla k vazbě streptavidin/peroxidázy a ke generování signálu. Měření bylo prováděno opakovaně kvůli reprodukovatelnosti (n = 2), a relativní směrodatná odchylka byla v řádu jednotek procent.
Obr. 2. Elektrochemická detekce na čipu s využitím magnetických kuliček a restriktázy BstUI pro nemetylovanou (NEM + + BstUI) a metylovanou DNA (MET + + BstUI), i s negativní kontrolou bez restriktázy (NEM; MET). 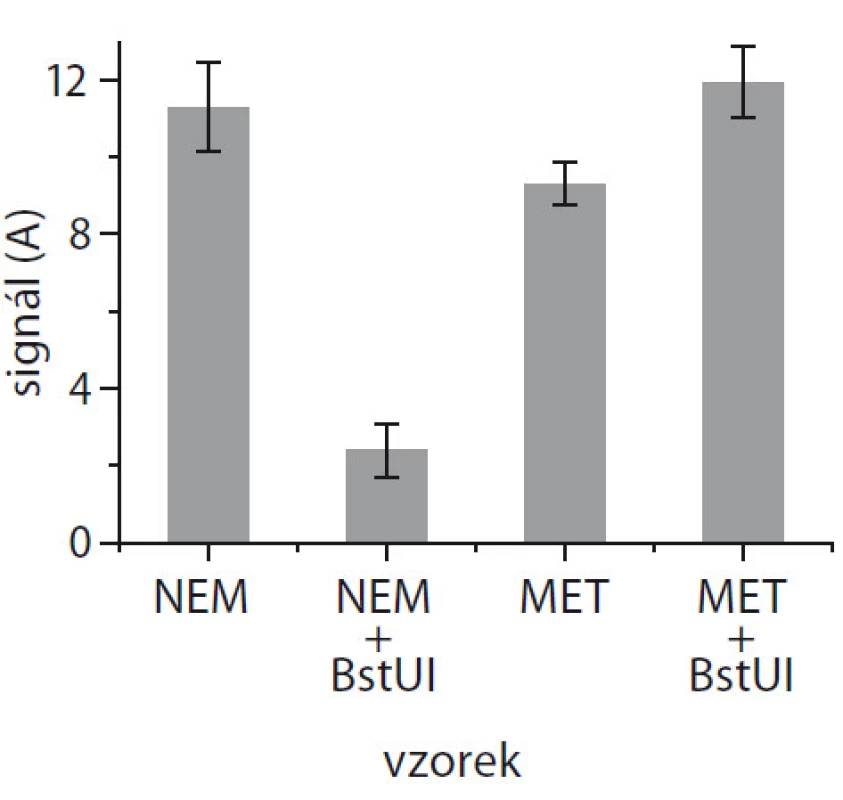
Diskuze
Cílem této metodologické práce bylo vyzkoušet a optimalizovat elektrochemický protokol pro rozlišení metylovaného a nemetylovaného úseku vybrané DNA, a to pomocí hybridizace s komplementárními sondami na magnetických kuličkách a následném štěpení vhodnou restrikční endonukleázou. Prvotní výsledky naznačují, že tento postup by mohl být užitečný při určení metylačního statusu daného restrikčního místa DNA. Měření bylo prováděno na elektrodových čipech umožňujících paralelní detekci až osmi vzorků současně, a proto je teoreticky možné určit metylační status více restrikčních míst v rámci DNA. Dále se chceme zaměřit na zvýšení citlivosti metody, jelikož PCR amplifikace v tomto případě není vhodná, protože stírá rozdíl mezi C a mC. Nabízí se např. použití detekční sondy označené více molekulami biotinu, čímž se dosáhne toho, že na jeden DNA duplex připadne víc molekul peroxidázy. Metodu pak bude nutné ověřit na biologickém materiálu.
Závěr
Studium metylace DNA je důležitou oblastí současného onkologického výzkumu, a to zejména poznatek, že abnormální metylace promotorů důležitých nádorových supresorů je spojena se vznikem různých nádorových onemocnění. Vývoj nových, časově i finančně nenáročných metod pro analýzu metylace DNA tak může vést k jejich efektivnější diagnostice či k lepší predikci odpovědí na léčbu. Elektrochemická detekce se jeví jako potenciálně zajímavý nástroj, který by v kombinaci s magnetickými kuličkami a restrikčními enzymy mohl jednoduchým způsobem určit metylační status konkrétního místa v DNA.
Práce byla podpořena grantem MŠMT – NPU I – LO1413.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Martin Bartošík, Ph.D.
RECAMO
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: martin.bartosik@mou.cz
Obdrženo: 6. 3. 2017
Přijato: 26. 3. 2017
Zdroje
1. Herman JG, Baylin SB. Mechanisms of disease: Gene silencing in cancer in association with promoter hypermethylation. New Engl J Med 2003; 349 (21): 2042–2054.
2. Esteller M, Silva JM, Dominguez G et al. Promoter hypermethylation and BRCA1 inactivation in sporadic breast and ovarian tumors. J Natl Cancer Inst 2000; 92 (7): 564–569.
3. Delpu Y, Cordelier P, Cho WC et al. DNA methylation and cancer diagnosis. Int J Mol Sci 2013; 14 (7): 15029–15058. doi: 10.3390/ijms140715029.
4. Bartošík M, Ondroušková E. Nové metody studia metylace DNA – MS-HRM analýza a elektrochemie. Klin Onkol 2016; 29 (Suppl 4): 64–71.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek XXIII. UroonkologieČlánek XXV. HematoonkologieČlánek Jmenný rejstříkČlánek XII. Psychosociální péčeČlánek EditorialČlánek XIV. Nádory prsuČlánek XVI. Nádory jícnu a žaludkuČlánek XX. Nádory hlavy a krku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2017 Číslo Supplementum1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- XXI. Nádory plic, průdušek a pleury
- XXII. Gynekologická onkologie
- XXIII. Uroonkologie
- XXIV. Nádory nervového systému
- XXV. Hematoonkologie
- XXVI. Nádory dětí, adolescentů a mladých dospělých
-
XXVII. Varia
(ostatní, jinde nezařaditelné příspěvky) - XXVIII. Vývoj nových léčiv, farmakoekonomika, klinická farmacie v onkologii
- XXIX. Základní a aplikovaný výzkum v onkologii
- Stanovení DNA metylace v BRCA2 genu na elektrodových biočipech
- Molekulární patologie kolorektálního karcinomu, mikrosatelitová nestabilita – způsob detekce, vztah k patofyziologii a prognóze
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- Využití metody PLA pro detekci komplexů p53/p63/p73 in situ v nádorových buňkách a nádorové tkáni
- Význam deregulace mikroRNA v molekulární patogenezi a histologické transformaci folikulárního lymfomu
- Cirkulující myeloidní supresorové buňky a jejich úloha v nádorové imunologii
- Je možné pozorovat etnickou diferenci v základních krevních testech? Údaje z programu onkologické prevence v komplexním onkologickém centru v České republice
- Zinečnatými ionty modifikovaný nanotransportér antracyklinových antibiotik pro cílenou terapii nádoru prsu
- Fullerenový nanotransportér doxorubicinu pro cílenou interakci s mutovaným genem BRCA2
- Analýza mikroRNA u epiteliálního karcinomu vaječníku
- Využití porózního hydrogelu jako 3D scaffoldu pro růst leukemických B lymfocytů
- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Diagnostický a terapeutický potenciál membránového HSP90
- Everolimus v denní klinické praxi se zaměřením na problematiku postižení sliznice dutiny ústní – zkušenost onkologického centra v průběhu roku 2016
- Jmenný rejstřík
- I. Onkologická prevence a screening
- II. Organizace a financování zdravotní péče
- III. Epidemiologie nádorů, klinické registry, zdravotnická informatika
- IV. Vzdělávání, kvalita, bezpečnost a právní otázky v onkologické praxi
- V. Diagnostické metody v onkologii
- VI. Onkochirurgie, lokální aplikace protinádorových léčiv
- VII. Radioterapeutické metody
- VIII. Nežádoucí účinky protinádorové léčby
- IX. Paliativní péče, podpůrná a symptomatická léčba
- X. Nutriční podpora v onkologii
- XI. Ošetřovatelská péče a rehabilitace
- XII. Psychosociální péče
- XIII. Hereditární nádorové syndromy
- Editorial
- XIV. Nádory prsu
- XV. Nádory kůže a maligní melanom
- XVI. Nádory jícnu a žaludku
- XVII. Nádory tlustého střeva a konečníku
- Organizační a programový výbor BOD a KNZP v roce 2017
- XVIII. Nádory slinivky, jater a žlučových cest
- XIX. Nádory skeletu a sarkomy
- XX. Nádory hlavy a krku
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- VIII. Nežádoucí účinky protinádorové léčby
- XVII. Nádory tlustého střeva a konečníku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



