-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
Lactate Dehydrogenase – Old Tumour Marker in the Light of Current Knowledge and Preanalytic Conditions
With the development and subsequent clinical applications of anticancer immuno-and angiomodulatory therapies and expanded knowledge on significance of tumor microenvironment for disease prognosis and treatment outcome, a classical blood analyte, lactate dehydrogenase (LDH), gains in importance as a tumor marker reflecting to some extent immunosupressive and angiogenic tumour milieu. Physical extravascular hemolysis due to complicated or inaccurate blood sampling interferes strongly with quantification of LDH in serum/plasma samples. Upon correlating circulating hemoglobin level with LDH catalytic activities in 99,937 plasma samples we quantified hemolysis interference with LDH plasma levels. An increment of LDH (μkat/l) caused by hemolysis is equal to 0.002 times circulating hemoglobin level (mg/l). Thus, hemolysis interference can be mathematically subtracted from measured LDH using a formula: [LDH (measured) (μkat/l) – 0.002 × circulating hemoglobin (mg/l) ]. In other words, each increment of hemolysis equal to 100 mg/l of circulating hemoglobin will result to LDH increase equal to 0.2 μkat/l. As one of the emerging predictors of treatment outcome, a cancer prognostic biomarker and dynamic tumor marker, serum/plasma LDH concentration needs to be interpreted with respect to reported hemolysis level. Also, for these purposes, quantitative determination of serum/plasma levels of free circulating hemoglobin has to be routinely performed.
Key words:
lactate dehydrogenase – hemolysis – preanalytical error
This work was supported by MEYS via NPS I for RECAMO2020 (LO1413).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.Submitted:
13. 3. 2017Accepted:
26. 3. 2017
Autoři: K. Greplová 1; I. Selingerová 2; D. Valík 1,2; K. Pilátová 1,2; M. Češková 1; L. Zdražilová Dubská 1,2
Působiště autorů: Oddělení laboratorní medicíny, Masarykův onkologický ústav, Brno 1; RECAMO, Masarykův onkologický ústav, Brno 2
Vyšlo v časopise: Klin Onkol 2017; 30(Supplementum1): 156-158
Kategorie: Článek ve sborníku
Souhrn
S postupným rozvojem a klinickou aplikací imuno-a angiomodulační protinádorové terapie a získáváním poznatků o významu nádorového mikroprostředí nabývá laktátdehydrogenáza (LDH) jako nádorový marker znovu na klinickém významu. Zásadním preanalytickým interferentem se stanovením LDH je fyzikální extravaskulární hemolýza, k níž dochází při komplikovaném či nesprávném odběru krve. Vztažením hodnot volného hemoglobinu k hladinám LDH stanoveným v plazmě u 99 937 vzorků jsme popsali míru interference hemolýzy se stanovením LDH. Přírůstek katalytické aktivity LDH způsobený hemolýzou vzorku je 0,002násobkem koncentrace volného hemoglobinu v plazmě; tedy jako kompenzovanou hodnotu LDH „očištěnou“ od hemolýzy uvažujeme [(LDH (změřené) (μkat/l) – 0,002 × volný hemoglobin (mg/l)]. Zjednodušeně řečeno, každý nárůst hemolýzy ekvivalentní 100 mg/l volného hemoglobinu v plazmě zvýší koncentraci LDH o cca 0,2 μkat/l. Z pohledu predikce léčebné odpovědi, prognózy maligního onemocnění i sledování dynamiky sérové/plazmatické hladiny LDH je zásadní klinicky interpretovat hladinu biomarkeru bez zatížení preanalytickou chybou. V tomto ohledu je třeba, aby laboratoř míru hemolýzy ve vzorku vyjadřovala kvantitativně.
Klíčová slova:
laktátdehydrogenáza – hemolýza – preanalytická chybaÚvod
Laktátdehydrogenáza (LDH) je enzym účastnící se metabolizmu glukózy, kde při glykolýze katalyzuje redoxní interkonverzi laktátu a pyruvátu. Skládá se ze čtyř podjednotek, které jsou dvojího typu – H „srdeční“ a M „svalová“ a podle jejich zastoupení existuje pět izoenzymů.
Stanovení LDH v tělních tekutinách se využívá jako nespecifický test, kdy elevace hladiny LDH poukazuje na výskyt řady patologických či abnormálních stavů. Diagnostickou informaci poskytuje LDH stanovená v séru/plazmě, mozkomíšním moku, výpotcích atd. V onkologii se hladina LDH v séru/plazmě uplatňuje jako nádorový marker u některých typů maligních onemocnění, kde je vhodným doplňkovým markerem zejména pro monitorování nemocných s diferencovanými lymfocytárními i histiocytárními typy nehodgkinských lymfomů, leukemií, ale i solidních nádorů (testikulárních, melanomů aj.) [1]. Pro tento účel se zpravidla nevyužívá hladina cut-off, ale spíše posouzení změny katalytické koncentrace LDH mezi dvěma časově odlišenými odběry [1].
Zásadním preanalytickým interferentem se stanovením LDH je fyzikální extravaskulární hemolýza, k níž dochází při komplikovaném či nesprávném odběru krve. Ideálně by se hladina LDH měla hodnotit pouze ve vzorcích séra či plazmy bez hemolýzy, což není vždy slučitelné s praxí klinické onkologie. Vztažením hodnot volného hemoglobinu k hladinám LDH stanoveným v plazmě jsme popsali míru interference hemolýzy se stanovením LDH. Kvantifikace této závislosti pomůže spolehlivěji sledovat dynamiku LDH v krvi i v případě hemolytických vzorků.
Metody
LDH a hemolýza (kvantitativně stanovený volný hemoglobin) jsou stanoveny v Li-heparin plazmě na biochemickém analyzátoru cobas c501 (Roche). Stanovení indexu hemolýzy je založeno na výpočtu z měření absorbance plazmy při dvou vlnových délkách. Hodnota hemolytického indexu odpovídá koncentraci volného hemoglobinu v mg/l.
Pro analýzu interference hemolýzy a LDH jsme hodnotili všechny vzorky obsahující hodnoty LDH a volného hemoglobinu za období od 1. ledna 2015 do 31. prosince 2016 odebrané v Masarykově onkologickém ústavu.
Průzkumovou analýzu uvažovaných vzorků jsme provedli běžnými nástroji deskriptivní statistiky. Pro stanovení závislosti LDH na hodnotách volného hemoglobinu jsme využili kvantilovou lineární regresi s konzervativním přístupem modelování 10% kvantilu. Regresní přímka byla stanovena na hemolytických vzorcích (volný hemoglobin nad 0 mg/l).
Výsledky
Z 99 373 analyzovaných vzorků bylo 12,3 % nehemolytických a 10 % mělo koncentraci volného hemoglobinu nad 120 mg/l. Přírůstek katalytické aktivity LDH způsobený hemolýzou vzorku je 0,002násobkem koncentrace volného hemoglobinu. Pro výpočet „očištěné“ hodnoty LDH od hemolýzy tedy uvažujeme vzorec: [LDH (změřené) (μkat/l) – 0,002 × volný hemoglobin (mg/l) ]. Zjednodušeně řečeno, každý nárůst hemolýzy ekvivalentní 100 mg/l volného hemoglobinu falešně zvýší katalytickou aktivitu LHD o 0,2 μkat/l.
Obr. 1. Nárůst LDH v plazmě s narůstající hemolýzou. Krabicové diagramy hodnot koncentrací LDH pro různé intervaly koncentrací volného hemoglobinu. 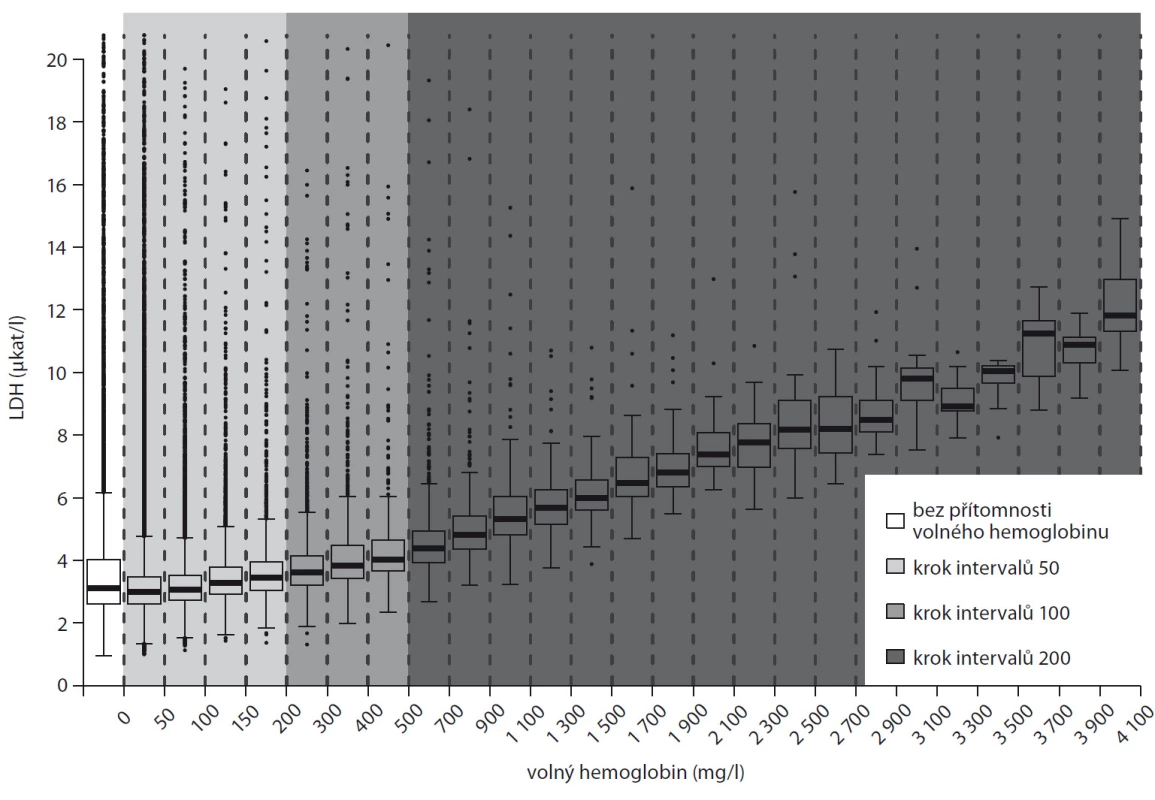
Diskuze
LDH cirkulující v plazmě u pacientů se solidními malignitami pochází z cytoplazmy maligních buněk a je především důsledkem rychlé proliferace, rozpadu maligních buněk a zvýšené produkce LDH v metabolickém prostředí aerobní glykolýzy nádoru. Do určité míry se podílí pravděpodobně také produkce LDH buňkami imunitního systému při jeho aktivaci nádorem a v souvislosti s protinádorovou léčbou pak také elevace LDH doprovázející anémii především s megaloblastovou přestavbou. Elevace LDH pak doprovází rychlý rozpad maligních buněk navozený protinádorovou léčbou při TLS (tumour lysis syndrom) [2]. Obecně tedy míra LDH u neléčeného onkologického pacienta reflektuje rozsah maligního onemocnění a rychlost jeho růstu. Horší prognóza spojená s vysokou hladinou LDH před léčbou byla popsána u řady solidních malignit [3–7].
S renesancí imunoterapie v léčbě onkologických onemocnění, která je zaměřena na imunoresponzivní zhoubné nádory, jako jsou maligní melanom či nemalobuněčný karcinom plic, nabývá LDH coby nádorový marker, ale také modulátor nádorového mikroprostředí, opět na významu.
Hladina LDH před zahájením léčby anti-CTLA-4 protilátkou ipilimumabem u pacientů s pokročilým maligním melanomem se ukazuje být významným ukazatelem klinického výsledku léčby; pacienti s vysokou LDH mají významně horší celkové přežití [8–11] a efekt imunoterapie ipilimumabem je limitovaný či žádný [8,9,12]. Nárůst LDH po dvou cyklech terapie ipilimumabem je také indikátorem špatné klinické odpovědi [12]. Vysoká LDH a absence její normalizace po zahájení léčby je také negativním prognostickým faktorem u pacientů s maligním melanomem léčeným vemurafenibem [13].
Vysoká intratumorální a potažmo sérová hladina LDH je asociována s imunosupresivním nádorovým mikroprostředím [14]. Imunosupresivně nepůsobí přímo tento enzym, ale laktát, resp. acidické nádorové mikroprostředí. Laktát stimuluje imunosupresivní cytokin TGF-β [15]. Nízké pH vede k degradaci acidolabilního IFN-γ [16] a ke snížené produkci TNF [17], což vede k posunu směrem pronádorovému Th2/M2 fenotypu intratumorálních buněk imunitního systému. Obecně imunosupresivní efekt má také samotný switch k anaerobní glykolýze, kdy se v nádorovém mikroprostředí nedostává nutrientů pro klonální expanzi aktivovaných T lymfocytů [18].
Hypoxie nádoru vede na jednu stranu ke glykolytickému fenotypu a zvýšené expresi LDH [19] a na druhou stranu prostřednictvím up-regulace HIF-1α ke stimulaci nádorové angiogeneze [20]. Elevace LDH pak může být známkou aktivace nádorové angiogeneze. U pacientů s vysokou LDH se pak dá očekávat klinický benefit z léčby anti-VEGF terapií, což bylo potvrzeno na klinických pozorováních, kdy vysoká LDH byla prediktorem efektu u pacientů s metastatickým kolorektálním karcinomem léčených bevacizumabem [21,22]. Na druhou stranu po progresi na bevacizumabu je nízká LDH ukazatelem benefitu z pokračování léčbou bevacizumabem oproti chemoterapii samotné [23].
LDH se ve světle nových poznatků ukazuje být biomarkerem či přímo odrazem imunosupresivního a angiogenního nádorového mikroprostředí, což následně ovlivňuje efekt moderních protinádorových léčebných postupů. Z pohledu predikce léčebné odpovědi i sledování dynamiky sérové/plazmatické hladiny LDH je zásadní klinicky interpretovat hladinu biomarkeru bez zatížení preanalytickou chybou.
Práce byla podpořena MŠMT cestou NPU I pro RECAMO2020 (LO1413).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. RNDr. Lenka Zdražilová Dubská, Ph.D.
Oddělení laboratorní medicíny
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: dubska@mou.cz
Obdrženo: 13. 3. 2017
Přijato: 26. 3. 2017
Zdroje
1. Valík D, Nekulová M, Zdražilová-Dubská L et al. Doporučení k využití nádorových markerů v klinické praxi. Klin Biochem Metab 2014; 22 (43): 22–39.
2. Mirrakhimov AE, Voore P, Khan M et al. Tumor lysis syndrome: a clinical review. World J Crit Care Med 2015; 4 (2): 130–138. doi: 10.5492/wjccm.v4.i2.130.
3. Zhuo Y, Lin L, Wei S et al. Pretreatment elevated serum lactate dehydrogenase as a significant prognostic factor in malignant mesothelioma: a meta-analysis. Medicine (Baltimore) 2016; 95 (52): e5706. doi: 10.1097/MD.0000000000005706.
4. Connell LC, Boucher TM, Chou JF et al. Relevance of CEA and LDH in relation to KRAS status in patients with unresectable colorectal liver metastases. J Surg Oncol 2016. doi: 10.1002/jso.24536.
5. Duffy MJ, Crown J. A personalized approach to cancer treatment: how biomarkers can help. Clin Chem 2008; 54 (11): 1770–1779. doi: 10.1373/clinchem.2008.110056.
6. Martens A, Wistuba-Hamprecht K, Geukes Foppen M et al. Baseline peripheral blood biomarkers associated with clinical outcome of advanced melanoma patients treated with ipilimumab. Clin Cancer Res 2016; 22 (12): 2908–2918. doi: 10.1158/1078-0432.CCR-15-2412.
7. Fědorová L, Poprach A, Lakomy R et al. Baseline peripheral blood biomarkers predict clinical outcome of advanced melanoma patients treated with ipilimumab: single institution real-life data experience. J Immunother Cancer 2017; abstract accepted.
8. Krajsova I, Arenberger P, Lakomy R et al. Long-term survival with ipilimumab: experience from a national expanded access program for patients with melanoma. Anticancer Res 2015; 35 (11): 6303–6310.
9. Dick J, Lang N, Slynko A et al. Use of LDH and autoimmune side effects to predict response to ipilimumab treatment. Immunotherapy 2016; 8 (9): 1033–1044. doi: 10.2217/imt-2016-0083.
10. Seifert H, Fisher R, Martin-Liberal J et al. Prognostic markers and tumour growth kinetics in melanoma patients progressing on vemurafenib. Melanoma Res 2016; 26 (2): 138–144. doi: 10.1097/CMR.0000000000000218.
11. Blank CU, Haanen JB, Ribas A et al. CANCER IMMUNOLOGY. The “cancer immunogram”. Science 2016; 352 (6286): 658–660. doi: 10.1126/science.aaf2834.
12. Seliger C, Leukel P, Moeckel S et al. Lactate-modulated induction of THBS-1 activates transforming growth factor (TGF) -beta2 and migration of glioma cells in vitro. PLoS One 2013; 8 (11): e78935. doi: 10.1371/journal.pone.0078935.
13. Ruffell B, DeNardo DG, Affara NI et al. Lymphocytes in cancer development: polarization towards pro-tumor immunity. Cytokine Growth Factor Rev 2010; 21 (1): 3–10. doi: 10.1016/j.cytogfr.2009.11.002.
14. Heming TA, Dave SK, Tuazon DM et al. Effects of extracellular pH on tumour necrosis factor-alpha production by resident alveolar macrophages. Clin Sci (Lond) 2001; 101 (3): 267–274.
15. Fox CJ, Hammerman PS, Thompson CB. Fuel feeds function: energy metabolism and the T-cell response. Nat Rev Immunol 2005; 5 (11): 844–852.
16. Warburg O. On the origin of cancer cells. Science 1956; 123 (3191): 309–314.
17. Langhammer S, Najjar M, Hess-Stumpp H et al. LDH-A influences hypoxia-inducible factor 1alpha (HIF1 alpha) and is critical for growth of HT29 colon carcinoma cells in vivo. Targeted oncology 2011; 6 (3): 155–162. doi: 10.1007/s11523-011-0184-7.
18. Scartozzi M, Giampieri R, Maccaroni E et al. Pre-treatment lactate dehydrogenase levels as predictor of efficacy of first-line bevacizumab-based therapy in metastatic colorectal cancer patients. Br J Cancer 2012; 106 (5): 799–804. doi: 10.1038/bjc.2012.17.
19. Passardi A, Scarpi E, Tamberi S et al. Impact of pre-treatment lactate dehydrogenase levels on prognosis and bevacizumab efficacy in patients with metastatic colorectal cancer. PLoS One 2015; 10 (8): e0134732. doi: 10.1371/journal.pone.0134732.
20. Marmorino F, Salvatore L, Barbara C et al. Serum LDH predicts benefit from bevacizumab beyond progression in metastatic colorectal cancer. Br J Cancer 2017; 116 (3): 318–323. doi: 10.1038/bjc.2016.413.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek XXIII. UroonkologieČlánek XXV. HematoonkologieČlánek Jmenný rejstříkČlánek XII. Psychosociální péčeČlánek EditorialČlánek XIV. Nádory prsuČlánek XVI. Nádory jícnu a žaludkuČlánek XX. Nádory hlavy a krku
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2017 Číslo Supplementum1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- XXI. Nádory plic, průdušek a pleury
- XXII. Gynekologická onkologie
- XXIII. Uroonkologie
- XXIV. Nádory nervového systému
- XXV. Hematoonkologie
- XXVI. Nádory dětí, adolescentů a mladých dospělých
-
XXVII. Varia
(ostatní, jinde nezařaditelné příspěvky) - XXVIII. Vývoj nových léčiv, farmakoekonomika, klinická farmacie v onkologii
- XXIX. Základní a aplikovaný výzkum v onkologii
- Stanovení DNA metylace v BRCA2 genu na elektrodových biočipech
- Molekulární patologie kolorektálního karcinomu, mikrosatelitová nestabilita – způsob detekce, vztah k patofyziologii a prognóze
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- Využití metody PLA pro detekci komplexů p53/p63/p73 in situ v nádorových buňkách a nádorové tkáni
- Význam deregulace mikroRNA v molekulární patogenezi a histologické transformaci folikulárního lymfomu
- Cirkulující myeloidní supresorové buňky a jejich úloha v nádorové imunologii
- Je možné pozorovat etnickou diferenci v základních krevních testech? Údaje z programu onkologické prevence v komplexním onkologickém centru v České republice
- Zinečnatými ionty modifikovaný nanotransportér antracyklinových antibiotik pro cílenou terapii nádoru prsu
- Fullerenový nanotransportér doxorubicinu pro cílenou interakci s mutovaným genem BRCA2
- Analýza mikroRNA u epiteliálního karcinomu vaječníku
- Využití porózního hydrogelu jako 3D scaffoldu pro růst leukemických B lymfocytů
- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Diagnostický a terapeutický potenciál membránového HSP90
- Everolimus v denní klinické praxi se zaměřením na problematiku postižení sliznice dutiny ústní – zkušenost onkologického centra v průběhu roku 2016
- Jmenný rejstřík
- I. Onkologická prevence a screening
- II. Organizace a financování zdravotní péče
- III. Epidemiologie nádorů, klinické registry, zdravotnická informatika
- IV. Vzdělávání, kvalita, bezpečnost a právní otázky v onkologické praxi
- V. Diagnostické metody v onkologii
- VI. Onkochirurgie, lokální aplikace protinádorových léčiv
- VII. Radioterapeutické metody
- VIII. Nežádoucí účinky protinádorové léčby
- IX. Paliativní péče, podpůrná a symptomatická léčba
- X. Nutriční podpora v onkologii
- XI. Ošetřovatelská péče a rehabilitace
- XII. Psychosociální péče
- XIII. Hereditární nádorové syndromy
- Editorial
- XIV. Nádory prsu
- XV. Nádory kůže a maligní melanom
- XVI. Nádory jícnu a žaludku
- XVII. Nádory tlustého střeva a konečníku
- Organizační a programový výbor BOD a KNZP v roce 2017
- XVIII. Nádory slinivky, jater a žlučových cest
- XIX. Nádory skeletu a sarkomy
- XX. Nádory hlavy a krku
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Ascitická tekutina u nádoru vaječníků může poskytnout informace vhodné pro diagnostiku
- Laktátdehydrogenáza – starý nádorový marker ve světle současných poznatků a v preanalytických souvislostech
- VIII. Nežádoucí účinky protinádorové léčby
- XVII. Nádory tlustého střeva a konečníku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



