-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Možnosti antidiabetické léčby v roce 2020 – důvod ke skepsi, či optimismu?
Autoři: prof. MUDr. Škrha Jan, DrSc.
Působiště autorů: 1. LF UK a VFN v Praze ; 3. interní klinika – klinika endokrinologie a metabolismu
Vyšlo v časopise: Svět praktické medicíny, 1, 2020, č. 3-4, s. 30-34
Kategorie: Medicína v ČR: přehledový článek
Souhrn
V posledních deseti letech byla klinicky ověřena bezpečnost a výhody nových skupin antidiabetik, které změnily přístup k léčbě diabetu. V tomto období byla proto upravena doporučení farmakoterapie diabetu 2. typu, jež jsou zaměřena nejen na individuálně volenou terapii, ale současně i na prognózu pacienta. Zároveň se využívají pozitivní účinky jednotlivých léků, které se vyznačují kardiální a renální protektivitou. Současné možnosti terapie tudíž zlepšují perspektivu našich diabetiků.
Vývoj farmakoterapie diabetu se pomalu blíží stému výročí. Právě před sto lety probíhaly pokusy Nicolae Paulesca, který si ve své experimentální práci všiml rozhodující úlohy pankreatu v regulaci glykemie. Nezávisle na něm v létě 1921 Frederick Banting a jeho student Charles Best prováděli též pokusy na psech a s pomocí chemika Colipa přenesli původní zvířecí experimenty do klinické medicíny. Čtrnáctiletý Thomson se tak stal prvním zachráněným diabetikem hned zkraje roku 1922, neboť dostal inzulin. Dostavují se nové zkušenosti, vedle jasné záchrany života diabetika 1. typu se projevují i vedlejší účinky. Hypoglykemie se stávají od počátku neradostnou komplikací, a to jak v případě krátce působících inzulinů, tak o něco později i déle působících preparátů.
Dvacátá léta však současně přinášejí i první perorální antidiabetika. V roce 1922 Werner s Bellem v Trinity College v Dublinu provedli první syntézu dimetylbiguanidu, tedy metforminu. V následujících letech bylo syntetizováno devět biguanidů, ale metformin se ukázal jako nejúčinnější. Nicméně teprve v roce 1957 uvádí Jean Sterne v Paříži metformin do klinické praxe. Ve stejné době se objevily i první deriváty sulfonylurey. V následujících třech desetiletích zůstaly tyto dvě skupiny perorálních antidiabetik vedle inzulinu jako jediné v léčbě diabetiků 2. typu. Přitom deriváty sulfonylurey tvořily hlavní antidiabetikum, byť provázené četnými hypoglykemiemi.
Patofyziologické poznámky vedoucí k farmakoterapii
S celosvětově přibývajícím počtem diabetiků je tomuto onemocnění věnována stále větší pozornost. Řada objevů o B-buňce, o syntéze a sekreci inzulinu a jeho působení v cílových tkáních vede k vytvoření komplexního obrazu o metabolické a hormonální regulaci, kterou zajišťuje B-buňka (Obr. 1). Normální funkce celého systému se promítá do homeostázy metabolismu glukózy, kdežto jakákoli porucha ve znázorněných vztazích se může projevit vzestupem glykemie. Závisí zejména na B-buňce, od níž se odvíjí porucha glykoregulace. Organismus totiž vystavuje B-buňku různým vlivům, které vedou ke zvýšeným nárokům na syntézu a sekreci inzulinu a které se ve svých důsledcích mohou projevit prediabetem nebo diabetem.
Obr. 1. Mnohotné vztahy B-buňky s dalšími orgány jako možné cesty vedoucí k rozvoji diabetu. 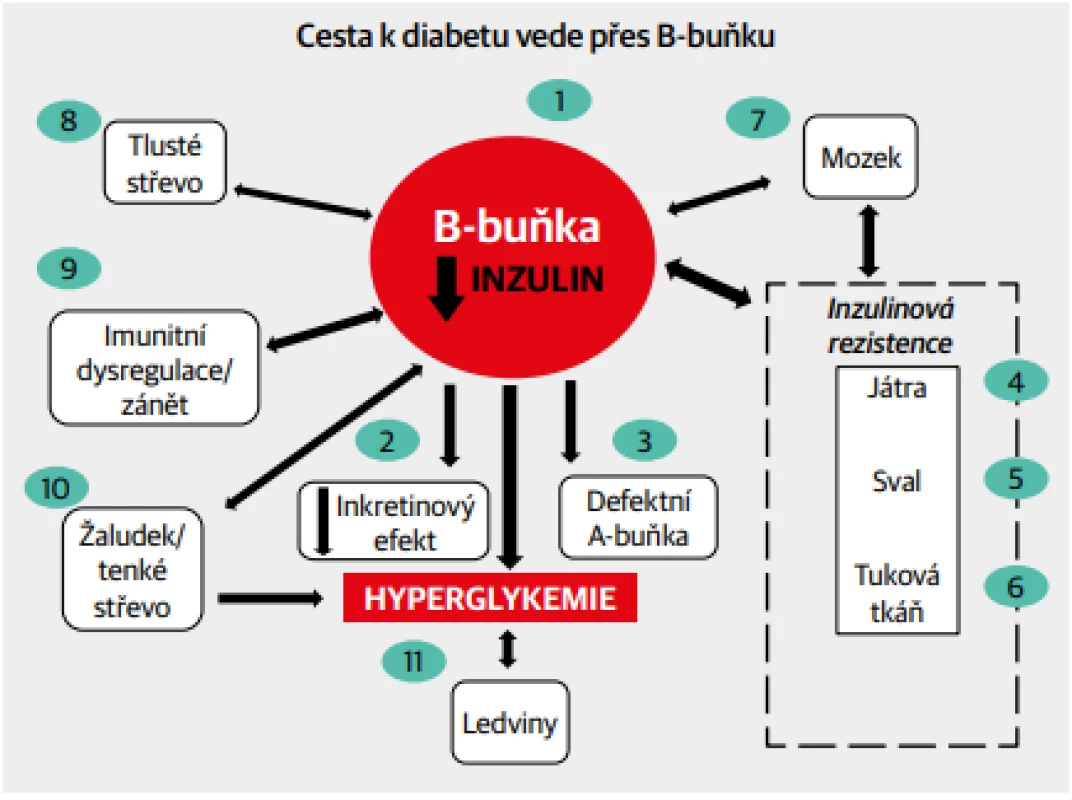
Studium molekulárních mechanismů poruchy B-buňky ukázalo, že různé podněty se nakonec promítají do jednotného systému reakcí vedoucích k postižení B-buňky s následnou apoptózou, a tedy jejím zánikem.1 Ačkoli vyvolávající příčina u diabetu 1. a 2. typu je na první pohled rozdílná, nitrobuněčné děje vedoucí k apoptóze B-buňky jsou prakticky identické (Obr. 2). Zvýšený oxidační stres endoplazmatického retikula je společným jmenovatelem, od něhož se odvíjejí další reakce. A podobně reaguje B-buňka i na nikotin, neboť na svém povrchu obsahuje acetylcholinové receptory, které dovedou vázat nikotin. To podporuje pozorování o vlivu kouření na vyšší výskyt diabetu v porovnání s nekuřáky.2
Obr. 2. Jednotící model patogeneze diabetu 1. a 2. typu na úrovni B-buňky. Aktivace B-buňky cytokiny a dalšími faktory zánětlivé reakce (diabetes 1. typu) nebo mastnými kyselinami (diabetes 2. typu) vede k nitrobuněčnému oxidačnímu stresu přes aktivaci endoplazmatického retikula, k poškození mitochondrií, aktivaci kaspáz a následné apoptóze B-buňky 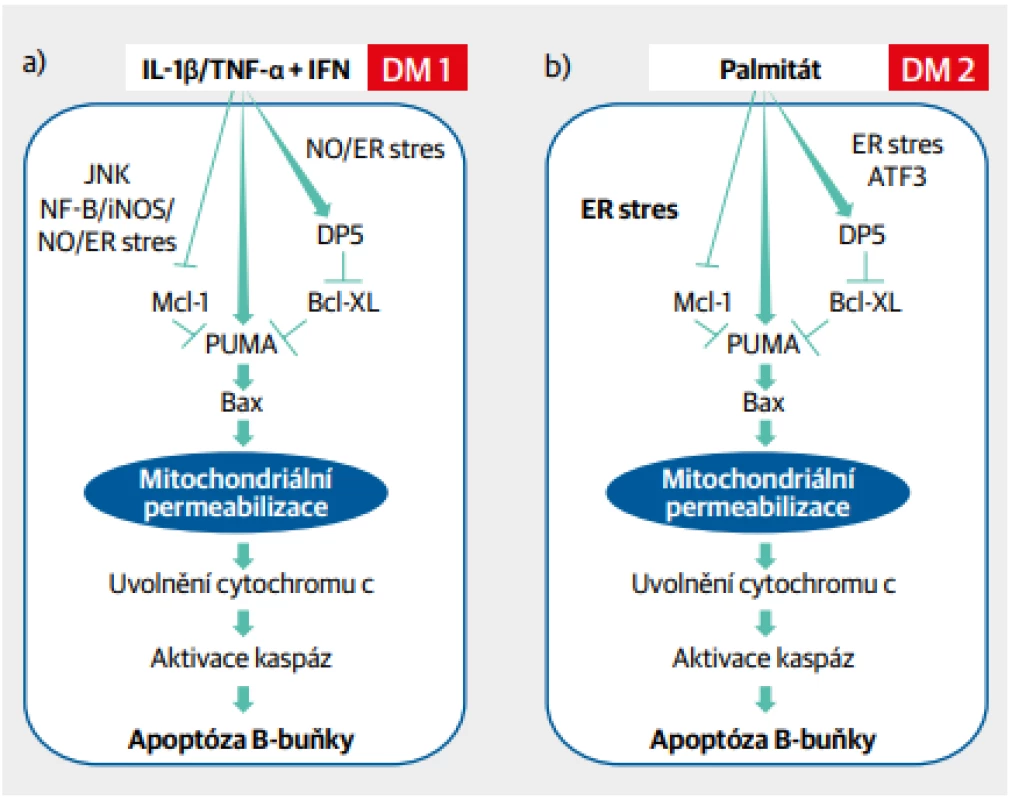
Cílem tohoto sdělení není primárně rozbor patofyziologických mechanismů, ale pohled na aktuální stav farmakologické léčby diabetu. Přitom kauzální léčba každého onemocnění, tedy i diabetu, vedoucí k obnově nebo aspoň přiblížení k fyziologickým regulacím musí vycházet z poznání příčin patologických dějů. Samotný obrázek 1 dokládá složitost vztahů mezi B-buňkou a jednotlivými orgány, z nichž však vyplývají možnosti pro terapeutická ovlivnění. Proto přibývá skupin preparátů, které mohou postihnout různé děje vedoucí k diabetu.
Inzuliny a návrat k fyziologickým vztahům
Zvířecí inzuliny byly prvním milníkem, který vedl od jejich objevu k záchraně života mnoha diabetiků. Desítky let trvající zkušenosti vedly postupně k jejich náhradě humánními inzuliny a velmi rychle poté i inzulinovými analogy. Požadavek, aby se denní glykemický profil diabetika přiblížil co nejvíce profilu zdravého člověka, se postupně daří naplňovat, i když ještě nedospěl k naprosté dokonalosti. A to i přesto, že inzulinová analoga vytvářejí stále lepší předpoklady. Cesta „rychlých inzulinů“ směřuje jak k rychlejšímu nástupu účinku, tak i ke kratšímu působení, což se více přibližuje fyziologické regulaci. S tím souvisí i potřeba zajistit bazální hladinu inzulinu, která se fyziologicky udržuje permanentně probíhající sekrecí inzulinu z B-buňky. Tu ovlivňuje úroveň inzulinové senzitivity neboli citlivost tkání na inzulin, takže u osob s inzulinovou rezistencí je tato bazální hladina inzulinu i několikrát vyšší než u osob senzitivních. Inzuliny déle působící, jejichž hladina se měnila s dobou působení, prošly vývojem k preparátům umožňujícím nastavení vyrovnané hladiny se zcela zanedbatelnou fluktuací. A tak se podařilo od zvířecího Interdep inzulinu dostat až k dlouze působícímu glarginu nebo k degludeku. Také aplikace se stala jednodušší, když skleněné stříkačky byly nahrazeny inzulinovými stříkačkami a posléze inzulinovými pery. Vedle klasické aplikace vedl výzkum k substituci inzulinu pomocí inzulinových pump, s nimiž od počátku souvisela potřeba monitorování glykemií. V současné době jsme svědky propojení obou systémů, tedy analytického a aplikačního s vývojem pump s uzavřeným systémem. O něm se uvažovalo před čtyřiceti lety, ale teprve současné technologie jej uvádějí k dokonalosti. A právě od analytické části se odvíjí úspěšnost terapie, neboť se ukázalo, že dosahované výsledky jsou závislé na intenzitě monitorování glykemií, a to bez většího rozdílu mezi aplikací inzulinu pery nebo pumpou.3
Ke kvalitní terapii inzulinem tudíž patří i kvalitní parametry informující o kompenzaci diabetu. K posunu došlo s objevem glykovaného hemoglobinu, který poskytl data o dlouhodobé kompenzaci diabetu. Jeho výpověď je správná z hlediska dlouhodobého sledování, a tedy opakovaných hodnot u daného jedince, kdežto interindividuální rozdíly neumožňují, aby byl považován za srovnatelný parametr mezi jedinci. To je podmíněno rozdíly v dynamice jeho tvorby i odbourávání. S vývojem intenzivního monitorování glykemií včetně kontinuálního systému vedoucího k dalšímu přiblížení k fyziologickému kolísání glykemií se zavedl další parametr, „time in range“ (TIR) neboli podíl doby ze 24 hodin, po kterou je diabetik v rozmezí glykemií 3,9–10,0 mmol/l. Potřeba minimalizace doby s hypoglykemiemi, a naopak co nejdelší setrvání v uvedeném rozpětí současně umožňuje snižovat rozptyl glykemií neboli glykemickou variabilitu. Tyto cíle se daří realizovat vhodnou volbou kombinace inzulinů spolu s intenzivní monitorací glykemií. To je i zásadní posun v terapii některých diabetiků 1. typu s větší labilitou glykemií.
Od sulfonylurey k bezpečným antidiabetikům
Více než tři desetiletí byly pro diabetiky 2. typu k dispozici z perorálních antidiabetik deriváty sulfonylurey jako základní preparáty. Hlavním nežádoucím účinkem byly četné hypoglykemie, které nezřídka přivedly pacienty k hospitalizaci. Neřízená stimulace sekrece inzulinu založená na efektu sulfonylurey bez zřetele na aktuální potřeby organismu byla hlavní nevýhodou této skupiny antidiabetik. V současné době se z této skupiny používá gliklazid a glimepirid. Vedle toho byla k dispozici skupina biguanidů zastoupená třemi deriváty, fenforminem, buforminem a metforminem. Fenformin a později i buformin byly opuštěny pro výskyt nežádoucí laktátové acidózy a jediný metformin přetrval do současné doby, kdy jsou velmi pozitivně hodnoceny i jeho další účinky.
Metformin
V rámci doporučených postupů se stal metformin lékem volby, kterým se začíná terapie diabetu 2. typu. Dlouholeté zkušenosti ukázaly, že se jedná o bezpečný lék, který nevyvolává hypoglykemie a nezpůsobuje vzestup tělesné hmotnosti. Jeho účinek začíná již ve střevě, odkud se uplatňuje jeho inhibiční efekt na glukoneogenezi v játrech. Touto cestou snižuje i potřebu inzulinu a zlepšuje jeho působení v cílových tkáních. Velmi dobře se snáší, jen u části pacientů (asi do 10 %) nejčastěji vyvolává průjmy. Je třeba respektovat jeho kontraindikaci při renální insuficienci s poklesem glomerulární filtrace pod 0,5 ml/s. Nově se nenasazuje při poklesu glomerulární filtrace pod 1,0 ml/s. Pravidelné kontroly renálních funkcí jsou proto nezbytnou součástí péče.
Vedle diabetu se v posledních letech ukazuje pozitivní působení metforminu i u dalších stavů. Velmi příznivý efekt metforminu byl pozorován u neurodegenerativních a nádorových onemocnění. Rozsáhlá studie ukázala, že populace diabetiků léčená metforminem má méně než poloviční výskyt neurodegenerativních onemocnění, demence či manifestní Parkinsonovy nemoci v porovnání s diabetiky neléčenými metforminem.4 Efekt podávaného metforminu se zvyšuje s délkou užívání, přičemž po 2–4 letech se riziko blíží k polovině (HR: 0,52–0,62) a po více než čtyřech letech léčby je průměrný výskyt nižší dokonce až o 80 %.
Druhou perspektivní oblastí je ovlivnění nádorů. V experimentálních studiích působil metformin inhibičně na růst nádoru např. u prostaty a pankreatu, v klinických studiích se dosáhl příznivý efekt u hepatocelulárního a kolorektálního karcinomu a dále u karcinomu pankreatu, plic, prsu, ale i dalších nádorů.5 Tento efekt se zesílil při kombinaci metforminu s aspirinem či statinem. Na molekulární úrovni se daří vysvětlit mechanismus působení metforminu na nádorový proces cestou aktivace AMP-aktivované proteinkinázy (AMPK), která inhibuje mTOR protein regulující řadu procesů, jako je energetická homeostáza buňky, angiogeneze, ale též progrese tumoru či rezistence na farmakoterapii.5 Proto se metformin stává perspektivní látkou i pro onkology.
Také příznivé působení metforminu na autonomní dysfunkci při hypertenzní kardiomyopatii otevírá nové možnosti využití i se zřetelem na častou kombinaci těchto stavů při diabetu.6 Je tedy zřejmé, že i při zavedení nových antidiabetik si metformin zachovává u diabetu pozici velmi perspektivního léku.
Inkretinová antidiabetika
Výzkum patofyziologických mechanismů řízení sekrece a působení inzulinu vedl k využití ještě jiné cesty, která ovlivňuje glykoregulaci. Od roku 1986 se intenzivně studovaly inkretiny, k nimž patří dva hormony, glukagon-like peptid 1 (GLP-1) a glukózo -dependentní inzulinotropní peptid (GIP), které se uvolňují z buněk tenkého střeva účinkem potravy. Jejich existence byla zjištěna při studiu sekrece inzulinu, u níž se uplatňoval tzv. inkretinový efekt. Spočívá ve větší sekreci inzulinu z B-buněk ovlivněných stimulací těmito hormony po požití glukózy v porovnání s podáním stejného množství glukózy intravenózně, při kterém tato stimulace chybí. Biologický poločas obou hormonů je jen 3–5 minut, neboť je inaktivuje enzym dipeptidylpeptidáza 4 (DPP-4). Proto byla syntetizována analoga, která jsou vůči enzymu odolná, a tím je jejich působení prodlouženo. Mohou se podávat buď jednou denně, nebo jednou týdně. Tato skupina se označuje jako agonisté receptoru GLP-1 (GLP-1 RA) nebo též inkretinová mimetika. Vedle nich byly syntetizovány inhibitory enzymu DPP-4, označované též jako gliptiny, jejichž působením se prodlouží efekt endogenních hormonů. Předností celé skupiny těchto léků je, že nevyvolávají hypoglykemii, neboť regulují sekreci inzulinu v závislosti na výši glykemie. Jejich efekt se tudíž neuplatní, pokud je glykemie v normálním rozmezí. Pozitivní vlastnosti této skupiny, podobně jako gliflozinů, podmínily jejich významné místo v doporučeném postupu léčby diabetu 2. typu.7
Agonisté receptoru pro GLP-1
Agonisté receptoru pro GLP-1 (GLP-1 RA) jsou injekční preparáty, ale již se začíná uplatňovat i první perorální agonista (semaglutid). Do této skupiny patří z dostupných preparátů exenatid, liraglutid, lixisenatid, dulaglutid, albiglutid a semaglutid.
V organismu působí velmi široce na různé reakce či pochody. Vedle regulované sekrece inzulinu inhibují sekreci glukagonu a tím i produkci glukózy v játrech. Působí na řadu orgánů, zpomalují vyprazdňování žaludku a zvyšují pocit sytosti efektem v CNS. Zlepšují také inzulinovou senzitivitu v cílových tkáních. Hlavními nežádoucími účinky jsou gastrointestinální obtíže, zejména nauzea, zvracení či průjem, které jsou největší při zahájení léčby a po několika prvních týdnech mizí. Výjimečně byla pozorována pankreatitida. Vedle zlepšené kompenzace diabetu vedou GLP-1 RA k poklesu tělesné hmotnosti a mírnému poklesu systolického krevního tlaku (o 2–4 mmHg). Klinické studie doložily jejich bezpečnost a současně výhody projevující se kardiovaskulární protektivitou. Snížení kardiovaskulární i celkové mortality popsané u liraglutidu (studie LEADER8 ) a následně u semaglutidu (studie SUSTAIN 69) jsou velmi pozitivní. Dulaglutid (studie REWIND10), podobně jako předchozí dvě inkretinová analoga, snížil kardiovaskulární riziko. Pacient s diabetem 2. typu s kardiovaskulárním onemocněním je proto vhodným kandidátem pro kombinovanou terapii metforminem a GLP-1 RA. Při netoleranci metforminu lze volit přímo inkretinové mimetikum. U déletrvajícího diabetu 2. typu, kde je zapotřebí podávat inzulin, může kombinovaný preparát (např. liraglutid s inzulinem degludek nebo lixisenatid s glarginem) podávaný jednou denně poskytnout i lepší výsledky než intenzivní léčba samotným inzulinem.
Inhibitory DPP-4 (gliptiny)
Působení těchto perorálních antidiabetik na regulaci sekrece inzulinu je shodné s inkretinovými mimetiky, ale dosahuje se jinou cestou. Inhibicí enzymu DPP-4 se zvýší dostupnost endogenního hormonu a tím se zajistí jeho regulační působení. Enzym DPP-4 však štěpí i jiné molekuly, a tudíž jeho působení v organismu je širší než u mimetik. Ovlivňuje imunitní děje a také i některé neoplastické procesy, a proto je při jeho inhibici třeba pamatovat i na tyto okolnosti. Gliptiny jsou dobře tolerované léky s minimem nežádoucích účinků. Nevyvolávají hypoglykemie, a jsou tudíž bezpečné. Kardiovaskulárně jsou neutrální (sitagliptin, studie TECOS11), ale u saxagliptinu bylo pozorováno více hospitalizací pro srdeční selhání (studie SAVOR-TIMI 5312) a hraniční trend byl hodnocen u alogliptinu (studie EXAMINE13). Linagliptin se téměř nevylučuje ledvinami, takže je vhodným preparátem u diabetiků s renální insuficiencí. Obecně se gliptiny dobře kombinují s metforminem a antidiabetiky ostatních skupin, a proto se indikují zejména u diabetiků bez kardiovaskulárního onemocnění, u nichž jsou vhodné i v monoterapii při netoleranci metforminu na počátku terapie.
Inhibitory SGLT2 (glifloziny)
Další významnou skupinou určenou primárně pro diabetiky 2. typu, ale nověji i pro diabetiky 1. typu, jsou inhibitory glukózového transportéru SGLT2 (přesněji sodíko -glukózového kotransportéru). Inhibují zpětnou resorpci glukózy v ledvinách, kde jsou tyto transportéry umístěny v proximálním tubulu. Tím dochází ke zvýšenému výdeji glukózy močí, současně k osmotické diuréze, ale také i ke ztrátám sodíku. Působí více při vyšších glykemiích, kdy je zvýšena zpětná resorpce glukózy. Větší nálož glukózy u diabetiků podmiňuje zvýšenou expresi transportérů, než je tomu u nediabetiků. Účinkem inhibitorů SGLT2 dochází nejen k poklesu glykemií, ale též k hmotnostnímu úbytku a mírnému poklesu krevního tlaku, což je žádoucí u řady diabetiků s obezitou a vyšším krevním tlakem. Glifloziny nestimuluji sekreci inzulinu, a nevedou tedy k hypoglykemii. Některé preparáty ovlivňují vedle SGLT2 také transportéry SGLT1, které jsou lokalizovány jednak v distální části tubulů v ledvinách a jednak ve střevě, takže mohou ovlivnit i vstřebávání glukózy ze střeva. S každým přípravkem byly provedeny klinické studie, které doložily jejich protektivní efekt na kardiovaskulární systém. Empagliflozin (studie EMPA -REG OUTCOME14), kanagliflozin (studie CANVAS15) a dapagliflozin (studie DECLARE16) shodně ukázaly velmi pozitivní efekt na snížení rizika srdečního selhání s výrazným snížením hospitalizací pro srdeční selhání a dále i snížení progrese renálního postižení, což jsou dvě hlavní indikace těchto léků u diabetiků 2. typu.7 Dalšími velmi pozitivními výsledky bylo například snížení kardiovaskulární mortality a rizika komplikací (empagliflozin). Výsledky klinických studií u jednotlivých preparátů byly významně ovlivněny výběrem pacientů podle toho, zda jedinec již prodělal kardiovaskulární příhodu, anebo zda byl „jen“ nositelem rizikových faktorů.
Přes nesporně velmi pozitivní efekty je třeba pamatovat u této skupiny i na vedlejší účinky. U vnímavých osob se mohou dostavit mykotické infekce genitálu (vulvovaginitidy či balanitidy), takže pak nezbývá než preparát vysadit. Dalším rizikem je euglykemická ketoacidóza, k níž může dojít zejména při interkurentním onemocnění (pneumonii, uroinfekci, septických stavech apod.), kdy je třeba přerušit léčbu gliflozinem. U starších diabetiků je třeba dát pozor na dehydrataci, neboť osmotická diuréza podmiňuje ztráty tekutin s nutností substituce. Snížený pocit žízně ve stáří pak nemusí vést k vyrovnané bilanci tekutin a v letních měsících se pak rychleji vyvine dehydratace.
Glifloziny jsou perspektivní skupinou u pacientů s kardiovaskulárním onemocněním a jejich kombinace s metforminem tvoří další vhodnou kombinaci u diabetiků 2. typu, u nichž monoterapie metforminem nevede k požadované cílové kompenzaci diabetu. Jejich využití je možné i v monoterapii, pokud není tolerován metformin jako lék volby. Druhou oblastí je léčba pacientů s renálním postižením, u něhož se účinky gliflozinů promítnou protektivně se zpomalením progrese. Je třeba pamatovat na přítomnost zachované funkce ledvin, glifloziny nejsou indikovány při poklesu glomerulární filtrace pod 0,5 ml/s. V současné době se dostávají pro svoje účinky do popředí zájmu kardiologů a nefrologů a lze očekávat jejich využití i u nediabetiků.
Pioglitazon
Glitazony jsou skupinou, jejíž mechanismus účinku spočívá v aktivaci receptorů gama peroxisomálními proliferátory (PPAR-gama), které ovlivňují řadu pochodů, ale ve vztahu k diabetu se promítají do snížení inzulinové rezistence, tedy zlepšení inzulinového působení. Mobilizují viscerální tukovou tkáň, vedou k redistribuci tuku a k jeho ukládání do periferie (podkoží). Působí na pluripotentní mezenchymovou buňku, což může mít vliv na menší diferenciaci těchto buněk na osteocyty. V současné době se využívá pioglitazon, kdežto dříve rozšířený rosiglitazon byl stažen pro zhoršení srdečního selhání, nicméně vesměs šlo o pacienty s NYHA III a IV. Vedlejším efektem glitazonů je retence tekutin, proto se nedoporučuje používat glitazon u diabetiků se srdečním selháním. Pioglitazon se dobře kombinuje s metforminem, ale i ostatními antidiabetiky, a to hlavně u pacientů s přítomnou inzulinovou rezistencí. Vede ke zvýšení tělesné hmotnosti a k někdy pozorovaným otokům dolních končetin. Nezpůsobuje hypoglykemii, takže je bezpečným lékem, jak doložila studie PROACTIVE.17 Zcela ojediněle byl popsán karcinom močového měchýře, a to zejména u kuřáků.
Jak mění současná antidiabetika filozofii léčby pacienta?
Současná paleta farmak přináší nový pohled na možnosti léčby pacienta s diabetem. Před dvaceti lety bylo hlavním cílem léčby diabetu dosáhnout fyziologických hodnot glykemií nebo se jim co nejvíce přiblížit. Tento požadavek vyplýval z výsledků dvou velkých studií, DCCT u diabetu 1. typu a UKPDS u diabetu 2. typu. Jejich poselstvím bylo, že lepší (nižší) glykemie snižují rozvoj mikrovaskulárních komplikací. Následně probíhající studie (např. ACCORD či VADT) však ukázaly, že intenzivnější léčba může vést k hypoglykemiím, které jsou provázeny vyšším výskytem nežádoucích kardiovaskulárních komplikací, např. dysrytmií. Vedle toho bylo popsáno i zhoršení srdečního selhání. Proto začaly být nové skupiny léků testovány s ohledem na kardiovaskulární bezpečnost a zároveň i se zřetelem na možné benefity. Tím se v posledních deseti letech mění pohled na antidiabetika z čistě glukocentrické orientace na orientaci kardiovaskulární. Tato potřeba ostatně vyplývá i z faktu, že velká část diabetiků umírá na kardiovaskulární komplikace. Vedle efektu léků na kompenzaci diabetu se tudíž hodnotí i jejich působení na ischemickou chorobu srdeční, cévní mozkové příhody a dále na rozvoj onemocnění ledvin, a to v randomizovaných kontrolovaných studiích.
Jednotlivá farmaka ze skupiny inkretinových antidiabetik i gliflozinů prošla kontrolovanými studiemi (viz výše), které doložily jejich velmi příznivé působení na kombinovaný kardiovaskulární výstup (endpoint) (MACE) zahrnující nefatální infarkt myokardu, nefatální cévní mozkovou příhodu a úmrtí z kardiovaskulárních příčin. U gliflozinů bylo prokázáno vysoce významné snížení hospitalizace pro kardiální selhání a dále nefroprotektivní efekt charakterizovaný zpomalením progrese albuminurie a renálního selhání.
Tyto výsledky podnítily i nové pojetí doporučeného algoritmu léčby diabetu 2. typu. Zatímco předchozí algoritmy vycházely prakticky z možnosti různých kombinací antidiabetik, které by vedly ke zlepšení kompenzace diabetu, nová doporučení vycházejí právě ze zjištěných benefitů jednotlivých farmak vybíraných podle aktuálního hodnocení stavu diabetika.7 Realizuje se tak cíleně personalizovaná medicína orientovaná na pacienta. Zůstává metformin jako výchozí antidiabetikum u pacienta s diabetem 2. typu, pokud jej toleruje a nevede ke gastrointestinálním nežádoucím účinkům. V případě jeho netolerance máme rozhodnutí mezi inkretinovými antidiabetiky nebo glifloziny. Volba by měla vycházet z anamnézy pacienta, neboť nepřítomnost kardiovaskulárního onemocnění nebo dalších rizikových faktorů může podpořit volbu gliptinu, kdežto u pacienta s prodělaným kardiovaskulárním onemocněním lze použít GLP-1 RA nebo gliflozin. V případě kardiálního selhávání je indikován gliflozin.
Současný algoritmus tudíž umožňuje využít kardioprotektivní nebo i nefroprotektivní antidiabetikum do kombinace s metforminem nebo i samostatně. Tím se farmakologická rozvaha posouvá více i k očekávané prognóze diabetika než jen k diabetu a jeho kompenzaci v užším slova smyslu.
Ovlivnění metabolismu glukózy na úrovni transportérů SGLT2 v ledvinách, případně i ve střevech (SGLT1), se dostává logicky i k jejich využití u diabetu 1. typu. V tom případě jde o adjuvantní, tedy doplňkovou léčbu vedle léčby inzulinem, ale přitom je třeba zachovávat patřičná opatření z hlediska možných nežádoucích účinků (např. diabetické ketoacidózy).18
Současná terapie diabetu jako cesta k optimismu?
Terapeutické možnosti u diabetu vedou v posledních letech stále k většímu přemýšlení nad pacientem, jaká farmaka by jeho stavu nejvíce prospěla. Dostáváme se úplně jinam, než bylo obvyklé před dvaceti lety, ale znamená to i větší nároky na znalosti a individuální posuzování každého pacienta. Přitom se posouváme k nové kvalitě života včetně prodlužování průměrné doby dožití diabetika. Kardiologové zvládají akutní stavy, ale přibývá chronické ischemické choroby srdeční se známkami srdečního selhávání. Prodlužuje se i život pacientů s chronickým onemocněním ledvin. Diabetik se dožívá stále častěji sedmého a osmého decennia. Křivka dožití se blíží nediabetické populaci, ale současně s tím se objevují nemoci, které dříve nebyly u diabetiků tak časté, neboť tomu bránila jejich kratší doba dožití. Jde zejména o neurodegenerativní a onkologická onemocnění, která zásadně ovlivní i kvalitu jejich života. Pro pečujícího lékaře to bude znamenat intenzivní sledování stavu diabetika, neboť řada těchto nemocí přichází plíživě, a to zejména v počátečních stadiích. Přitom časné odhalení např. nádorových nemocí má a bude mít zásadní význam pro život pacienta. Další významná nemoc vedle diabetu je komplikací jejich životní dráhy, ale i léčby diabetu. Jistě se nabízí myšlenka určité skepse, neboť moderní intenzivnější nebo cílenější léčba s lepšími výsledky diabetu vytváří terén k cestě za další nemocí. Péče o diabetika bude tudíž stále více provázána s řadou odborností a mezioborová spolupráce bude získávat nový rozměr. I přes tyto znaky však možnosti současné terapie diabetu jsou optimistické, neboť přinášejí novou naději pacientům s diabetem.
prof. MUDr. Jan Škrha, DrSc.
3. interní klinika – klinika endokrinologie a metabolismu
1. LF UK a VFN v Praze
Zdroje
1. Škrha J. Patogeneze diabetes mellitus 1. a 2. typu v roce 2011 – jednotící model poruchy glykoregulace. Vnitř Lék 2011;57 : 949–953.
2. Bhattacharjee A, Prasad SK, Banerjee O, et al. Targeting mitochondria with folic acid and vitamin B12 ameliorates nicotine mediated islet cell dysfunction. Environ Toxicol 2018;33 : 988–1000.
3. Šoupal J, Petruželková L, Grunberger G, et al. Glycemic outcomes in adults with T1D are impacted more by continuous glucose monitoring than by insulin delivery method: 3 years of follow-up from the COMISAIR study. Diabetes Care 2020;43 : 37–43.
4. Shi Q, Liu S, Fonseca VA, et al. Effect of metformin on neurodegenerative disease among elderly adult US veterans with type 2 diabetes mellitus. BMJ Open 2019;9:art e024954.
5. Mallik R, Chowdhury TA. Metformin in cancer. Diab Res Clin Pract 2018;143 : 409 –419.
6. Oliveira PWC, de Sousa GJ, Birocale AM, et al. Chronic metformin reduces systemic and local inflammatory proteins and improves hypertension-related cardiac autonomic dysfunction. Nutr Metabolism Cardiovasc Dis 2020;30 : 274–281.
7. Škrha J, Pelikánová T, Kvapil M. Doporučený postup péče o diabetes mellitus 2. typu. www.diab.cz.
8. Marso SP, Daniels GH, Brown-Frandsen K, et al. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016;375 : 311–322.
9. Leiter LA, Bain SC, Hramiak I, et al. Cardiovascular risk reduction with once-weekly semaglutide in subjects with type 2 diabetes: a post hoc analysis of gender, age, and baseline CV risk profile in the SUSTAIN 6 trial. Cardiovasc Diabetol 2019;18:art. 3.
10. Gerstein HC, Colhoun HM, Dagenais GR, et al.; for the REWIND Investigators. Dulaglutide and cardiovascular outcomes in type 2 diabetes (REWIND): a double-blind, randomised placebo-controlled trial. Lancet 2019;394 : 121–130.
11. Green JB, Bethel MA, Armstrong PW, et al. Effect of sitagliptin on cardiovascular outcomes in type 2 diabetes. N Engl J Med 2015;373 : 232–242.
12. Scirica BM, Bhatt DL, Braunwald E, et al. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013;369 : 1317–1326.
13. White WB, Cannon CP, Heller SR, et al. Alogliptin after acute coronary syndrome in patients with type 2 diabetes. N Engl J Med 2013;369 : 1327–1335.
14. Zinman B, Wanner C, Lachin JM, et al. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015;373 : 2117–2128.
15. Perkovic V, de Zeeuw D, Mahaffey KW, et al. Canagliflozin and renal outcomes in type 2 diabetes: results from the CANVAS Program randomised clinical trials. Lancet Diab Endocrinol 2018;9 : 691–704.
16. Wiviott SD, Raz I, Bonaca MP, et al.; DECLARE-TIMI 58 Investigators. Dapagliflozin and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2019;380 : 347–357.
17. Dormandy JA, Charbonnel B, Eckland DJ, et al. Secondary prevention of macrovascular events in patients with type 2 diabetes in the PROactive Study (PROspective pioglitAzone Clinical Trial In macroVascular Events): a randomised controlled trial. Lancet 2005;366 : 1279–1289.
18. Škrha J. Inhibitory SGLT2 v léčbě pacientů s diabetes mellitus 1. typu. Farmakoterapie 2019;15 : 564–569.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek Úvodní slovoČlánek Nový Etický kodex AIFP
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
2020 Číslo 3-4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Úvodní slovo
- Léčba depresí a dalších psychických nemocí nejen s ohledem na COVID-19
- Vši a svrab: Aktualizace léčby
- Komentář ke článku Vši a svrab: Aktualizace léčby
- Diagnostika a terapie těžké akutní pankreatitidy v intenzivní medicíně
- Komentář k článku Diagnostika a terapie těžké akutní pankreatitidy v intenzivní medicíně
- Možnosti antidiabetické léčby v roce 2020 – důvod ke skepsi, či optimismu?
- Bezpečnost antidiabetik v léčbě diabetu 2. typu
- Inhibitory SGLT2 v léčbě diabetu 2. typu GLIFLOZINY a jeho komplikací
- Hypoglykemie jako stále obávaná komplikace léčby diabetu a její prevence
- Profesor Miroslav Souček: Hypertenzi mám, jak jinak?
- Současná a perspektivní léčba obezity u diabetiků
- Nealkoholová tuková jaterní choroba a diabetes mellitus
- Testosteron u mužů s metabolickým syndromem, prediabetem a diabetem 2. typu Pozitivní účinky terapie testosteronem
- Nový Etický kodex AIFP
- Nemoci přenášené klíšťaty – jsou pacienti dostatečně informováni?
- Chřipka a její komplikace. Co nás čeká?
- Horké aktuality v registracích EMA
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vši a svrab: Aktualizace léčby
- Diagnostika a terapie těžké akutní pankreatitidy v intenzivní medicíně
- Testosteron u mužů s metabolickým syndromem, prediabetem a diabetem 2. typu Pozitivní účinky terapie testosteronem
- Chřipka a její komplikace. Co nás čeká?
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



