-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití PET/CT v diagnostice nádorů plic
The Use of PET/CT in the Diagnostics of Lung Cancer
More than 6,000 new cases of lung cancer are diagnosed annually in the Czech Republic. While incidence in men remains stagnant in recent years, incidence in women steadily grows. Combined imaging modality positron-emission tomography (PET) and computed tomography (CT) becomes the imaging method of choice for an increasing number of oncology indications, including lung cancer. With this integrated PET/CT device, accurately registered anatomic and functional images can be acquired in a single examination. Having such aligned image sets available has been shown to increase the accuracy of the interpretation of pulmonary nodules and pulmonary masses.
Key words:
lung cancer, positron-emission tomography PET, computed tomography CT, 18F-FDG, diagnostics, oncology, staging.
Autoři: J. Votrubová
Působiště autorů: PET centrum Nemocnice Na Homolce, Praha
Vyšlo v časopise: Čas. Lék. čes. 2008; 147: 131-135
Kategorie: Přehledový článek
Souhrn
V České republice je každoročně diagnostikováno více než 6000 nových pacientů s diagnózou bronchogenního karcinomu. Zatímco u mužů incidence v posledních letech stagnuje, u žen vykazuje mírně rostoucí tendenci. Včasná a správná diagnóza zvyšuje pravděpodobnost radikální léčby a prodlužuje dobu přežití. Kombinovaná vyšetřovací modalita pozitronová emisní tomografie (PET) a počítačová tomografie (CT) je nová metoda, která získává uplatnění u mnohých onkologických indikací, mezi jinými i u karcinomu plic. Díky hybridnímu přístroji PET/CT lze získat funkční i anatomicko-morfologické informace od jednoho pacienta během jednoho vyšetření. Hybridní zobrazení prokazatelně zvyšuje diagnostickou přesnost v interpretaci plicních nodulů a plicních mas.
Klíčová slova:
karcinom plic, pozitronová emisní tomografie PET, počítačová tomografie CT, 18F‑FDG, diagnostika, onkologie, staging.Epidemiologie bronchogenního karcinomu (BCA)
Bronchogenní karcinom (BCA) je nejčastějším maligním nádorem a nejčastější příčinou smrti na maligní onemocnění na světě. V roce 2004 byla v České republice incidence BCA 94,2/100 000 mužů a 29,8/100 000 žen. Incidence u mužů stagnuje, u žen má mírně vzrůstající tendenci. Maximum výskytu je mezi 60. a 70. rokem života (1).
Již desítky let je známý vliv inhalace tabákového dýmu na zvýšený výskyt karcinomu plic, trachey, laryngu a rtů. V této souvislosti dnes umírají na celém světě 4 miliony lidí a očekává se, že do roku 2020 tento počet vzroste na 8,4 milionů (2).
Klasifikace
V roce 1999 byla publikována revidovaná klasifikace nádorů plic dle WHO a IASLC (International Association for the Study of Lung Cancer). Dle zjednodušené klasifikace se dle WHO epitelové maligní nádory plic dělí na následující typy (3):
- dlaždicobuněčný (epidermoidní) karcinom (SCC-squamous cell cancer: 33–64 %),
- malobuněčný karcinom plic a jeho varianty (SCLC – small cell lung cancer: 19–35 %),
- adenokarcinom (15–35 %) – acinární, papilární, bronchioloalveolární, mucinózní, smíšený,
- velkobuněčný karcinom a jeho varianty včetně velkobuněčného endokrinního karcinomu (5–20 %),
- smíšený karcinom obsahující buňky dlaždicobuněčného karcinomu a adenokarcinomu,
- karcinom s pleomorfními sarkomatózními elementy.
Dlaždicobuněčný karcinom je spolu s adenokarcinomem a velkobuněčnými karcinomy zahrnován do skupiny nemalobuněčných karcinomů (NSCLC - non-small cell lung cancer). Mezi NSCLC a SCLC je zásadní rozdíl. Tyto dvě hlavní skupiny se liší v biologických vlastnostech a v odlišné strategii léčby.
Diagnostika
Obraz bronchogenního karcinomu v konvenčních zobrazovacích metodách je rozmanitý a kolísá od formy solitárního plicního nodulu až po segmentální, lobární až alární konsolidaci plicní tkáně. Metodou volby v diagnostice BCA je výpočetní tomografie, zpravidla doplněná o vyšetření s vysokým rozlišením (HRCT), popřípadě vyšetření magnetickou rezonancí. Vlastní diagnóza nádoru je potvrzena cytologickým a/nebo histologickým vyšetřenímz bronchoskopického, thorakoskopického či transkutánního odběru vzorku tkáně. Vyšetření mediastinálních lymfatických uzlin upřesní endobronchiální ultrasonografie či mediastinoskopie.
K nejmodernějším vyšetřovacím metodám patří 18F-FDG PET (pozitronová emisní tomografie používající analog glukózy značený izotopem 18F) využívající k diagnostice karcinomu plic změn metabolismu glukózy v nádorových buňkách. Kombinovaná vyšetřovací modalita pozitronová emisní tomografie (PET) a počítačová tomografie (CT), tzv. PET/CT sdružuje výhody obou metod do jednoho vyšetření a zároveň minimalizuje nevýhody obou metod prováděných samostatně.
Technické poznámky
Principem zobrazování pozitronovou emisní tomografií je možnost detekce a následné registrace změn metabolismu v patologicky změněné tkáni. V současnosti je při PET/CT prakticky vždy vyšetřován metabolismus glukózy, jehož intenzita je u většiny maligních nádorů včetně karcinomu plic nápadně vysoká. Před vyšetřením je do krevního oběhu pacienta podána deoxyglukóza značená fluorem 18F. Ta je v buňce metabolizována až na glukózo-6-fosfát, následné defosforylaci již nepodléhá a hromadí se v tkáni. Ložiska vyšší radioaktivity potom označují struktury, ve kterých je metabolická potřeba glukózy vysoká. Většina neoplazií intenzivně akumuluje FDG a přibližně po hodině od podání je dosahováno takového kontrastu vůči krevnímu pozadí, že lze zobrazit zhoubné nádory o průměru kolem 5 mm (4, 5).
CT má v hybridním systému dvě funkce. Slouží jednak k morfologicko-anatomickému zobrazování, jednak registruje informace o úbytku RTG záření při průchodu vyšetřovanou oblastí. Informaci lze užít ke korekci absorpce emitovaného anihilačního záření, registrovaného PET kamerou. Podáním kontrastní látky intravenózně lze CT vyšetření doplnit ještě o informaci o cévních strukturách, vaskularizaci patologického procesu a o vztahu patologického ložiska k velkým cévám. Při hybridním zobrazení jsou tak funkční údaje o metabolismu glukózy doplněny o anatomické a strukturální informace, které nelze pomocí samotného radiofarmaka získat.
Akumulace FDG v BCA
Charakteristické změny metabolismus glukózy v primárních i sekundárních ložiscích bronchogenního karcinomu činí toto maligní onemocnění vhodným k funkčnímu vyšetření. Vysoká kozumpce FDG v nádoru vyniká na ideálním pozadí provzdušněné plíce. Intenzita akumulace FDG v atelektáze je mírná až střední a je přibližně shodná s intenzitou akumulace v mediastinu, tedy v prostředí měkké tkáně. Velmi intenzivní metabolismus glukózy v plicním karcinomu zpravidla vyniká nad metabolismem v kolabovaném plicním okrsku a nádor bývá dobře odlišitelný i v terénu nevzdušné plíce.
Vzhledem k horší prostorové rozlišovací schopnosti nelze často na PET skenu nalézt drobné plicní noduly, které jsou dobře viditelné na CT skenu, zvláště při použití metody speciálního protokolu HRCT („high resolution computed tomography)“. Senzitivita FDG PET ve vyhledávání maligních plicních uzlů je oproti anatomickým zobrazovacím metodám nižší.
Diferenciálně diagnostickým problémem zůstává bronchioloalveolární karcinom a karcinoid, které vykazují variabilní konzumpci glukózy a mohou mít pozitivní i negativní PET obraz.
Jelikož 18F-FDG není nádorově specifickým radiofarmakem a ve zvýšené míře jej akumulují i léze zánětlivé, je nutné korelovat samotný PET nález s morfologickým obrazem a klinickým stavem pacienta. Potom lze správně odlišit ložisko s vysokou akumulací 18F-FDG odpovídající nádoru od ložiska abscesového či pneumonického (6, 7).
CT obraz BCA
Typickým obrazem primárního ložiska bronchogenního karcinomu je solitární plicní uzel. Většinou se však jedná o kombinaci obrazů, jejichž charakteristika je stručně popsána v následujících odstavcích.
Jako solitární plicní uzel je v radiodiagnostice označováno denzní ohraničené ložisko o průměru do 3 cm obklopené vzdušnou plící. Ložisko větší než 3 cm odpovídá plicní mase. Ačkoliv většina plicních uzlů bývá benigní, je nutné ke každému přistupovat jako k možnému malignímu nádoru a podrobně jej prozkoumat. Ohraničení ložiska oproti plicnímu parenchymu, které koreluje s pravděpodobností malignity, může být rovné, polycyklické, nepravidelné a hvězdicovité (spikulární). Hvězdicovitá neboli spikulární ložiska vykazují vysokou pravděpodobnost malignity na rozdíl od hladce a rovně ohraničených plicních uzlů. U periferního typu adenokarcinomu plic je často patrná reakce okolní tkáně spolu s retrakcí pleury. Tato jemná fibróza odpovídá desmoplastické reakci hostitele na neoplazma. Popisovány jsou i adenokarcinomy plic vzniklé v místě fibrózní jizvy, jejichž dia gnostika je velmi obtížná. Zde hraje nezastupitelnou úlohu FDG PET.
CT s vysokým rozlišením (HRCT – high resolution computed tomography) s 1–1,25 mm šíří vrstvy umožňuje odhalit maligní plicní uzly v časném stadiu a podrobně je zhodnotit.
Atelektáza – plicní nevzdušnostvzniká na podkladě endobronchiální obstrukce nebo exobronchiální komprese bronchu nádorem nebo lymfatickou uzlinou. Na podkladě snížené ventilace dochází k typickému zmenšení postiženého okrsku, k elevaci stejnostranné poloviny bránice a k přesunu mediastina ke stejné straně.
Vlastní nádor potom v CT obrazu splývá s kolabovanou plící.
Typické alveolární opacity, imitující zánětlivé postižení plic, jsou projevem bronchioloalveolárního karcinomu. Vyskytuje se ve formě fokálního (nodulárního) postižení nebo ve formě difuzního postižení. Difuzní forma zahrnuje lobární nebo alární konsolidaci plicní tkáně a/nebo vícečetná drobná ložiska charakteru „mléčného skla“. Obraz je z pohledu zobrazovacích metod neodlišitelný od bronchopneumonie včetně vzduchového bronchogramu, ale na rozdíl od zánětu se obraz nemění po podání antibiotik.
Pancoastův tumor
Pancoastův tumor tvoří necelých 5 % všech plicních malignit. Na rozdíl od většiny ostatních plicních nádorů má zcela typický klinický i morfologický obraz. Roste v plicním vrcholu a per continuitatem se šíří do parietální pleury a do hrudní stěny, někdy do žeber či obratlů. Záhy infiltruje brachiální plexus a sympatický provazec.
Primární nádory a staging
Primární nádor
Anatomické zobrazení primárního nádoru, jeho vztah k mediastinu, pleuře a bránici, určující možnou resekabilitu, je díky vynikajícímu prostorovému rozlišení doménou CT. Vztah nádoru k velkým cévám, srdci, brachiálnímu plexu a mediastinu ještě upřesní zobrazení magnetickou rezonancí, která však ve stagingu NSCLC není zlatým standardem. Typicky vysoký metabolismus glukózy u BCA je důležitým diferenciálně diagnostickým vodítkem v hodnocení biologické povahy ložiska v případě nejasného nálezu z běžných vyšetřovacích metod. Vzhledem k nižšímu prostorovému rozlišení ale nelze samotné PET vyšetření užít pro vyhledávání a určení lokálního rozsahu primárního tumoru a k hodnocení T stadia.
Lymfatické uzliny
Z primárního ložiska se NSCLC šíří lymfogenní i hematogenní cestou.
První etáží sběrných lymfatických uzlin jsou uzliny podél segmentálních a lobárních bronchů (N1), dále ipsilaterální mediastinální (N2) nebo kontralaterální mediastinální (N3) uzliny, supraklavikulární a skalenické lymfatické uzliny (N3). Na základě metaanalytických studií bylo prokázáno, že hodnocení hilových a mediastinálních lymfatických uzlin pomocí FDG PET vyšetření je ve srovnání s CT vyšetřením přesnější. Dietlein et al. v rozsáhlé metaanalýze dokladují spolehlivost samostatného FDG-PET a CT vyšetření ve vztahu k volbě léčebné strategie (tab. 1).
Tab. 1. BCA – pravděpodobnost metastaticky postižených LU v mediastinu dle PET/CT obrazu (8) 
Vzdálené metastázy
Systémové metastázy se objevují kdekoliv v těle. Nejčastější metastázuje BCA do mozku, kostí, jater, nadledvin a plic. Přítomnost vzdálených metastáz odpovídá IV. stadiu choroby, které je radikálně neléčitelné a výrazně zkracuje očekávanou délku přežití. Konvenční zobrazovací metody mají u bezpříznakových pacientů velmi nízkou výtěžnost. V cíleném vyhledávání mozkových metastáz je metodou volby MR, ve vyhledávání metastáz do jater a nadledvin ultrasonografie (USG) a CT. Pro vyšetření celého skeletu s ohledem na možné metastázy je vhodná kostní scintigrafie, metoda senzitivní, i když málo specifická (zvýšená akumulace radiofarmaka je patrná jak při metastatickém postižení, tak při degenerativních, zánětlivých či traumatických změnách skeletu; citlivost metody je nižší u čistě lytických lézí bez reaktivních změn v okolní kosti). Signifikantně vysoký výskyt vzdálených metastáz po radikální resekci primárního nádoru (> 20 %) vyžaduje zařazení nových vyšetřovacích metod. Ukazuje se, že pozitronová emisní tomografie v kombinaci s CT by mohla být metodou volby. Díky rutinnímu celotělovému snímání je schopna během jednoho vyšetření zobrazit jak primární tumor, tak další ložiska v plicích i vzdálené metastázy. U 10–25 % pacientů mění pozitivní výsledek FDG PET stadium M0 na M1.
Hodnocení stagingu nemalobuněčného bronchogenního karcinomu vychází z TNM klasifikace. Pacienti s postižením ve stadiu T1 (nádorový uzel do 3 cm v průměru, bez invaze do hlavního bronchu – obr. 1) mají ve srovnání s nemocnými ve stadiu T2 (nádorový uzel přes 3 cm v průměru a/nebo infiltrující hlavní bronchus, viscerální pleuru a/nebo způsobující atelektázu či obstruktivní pneumonitidu) téměř dvojnásobnou naději na 5leté přežití. Primárně jsou k resekci indikováni pacienti ve stadiu I–IIIA. Stadium IIIB je indikováno k resekci až dle výsledků restagingu po neoadjuvantní terapii. U stadia IV se vzdálenými metastázami bez ohledu na velikost primárního tumoru a stav lymfatických uzlin je indikována pouze léčba paliativní.
Obr. 1. Primární ložisko drobného BCA dolního plicního laloku vlevo s typicky spikulárními okraji na transverzálním CT skenu (a) vykazující vysoký metabolismus glukózy (b, c). Další ložiska vzbuzující suspekci na nádorovou infiltraci lymfatických uzlin či vzdálené metastázy nebyla prokázána (d, e). 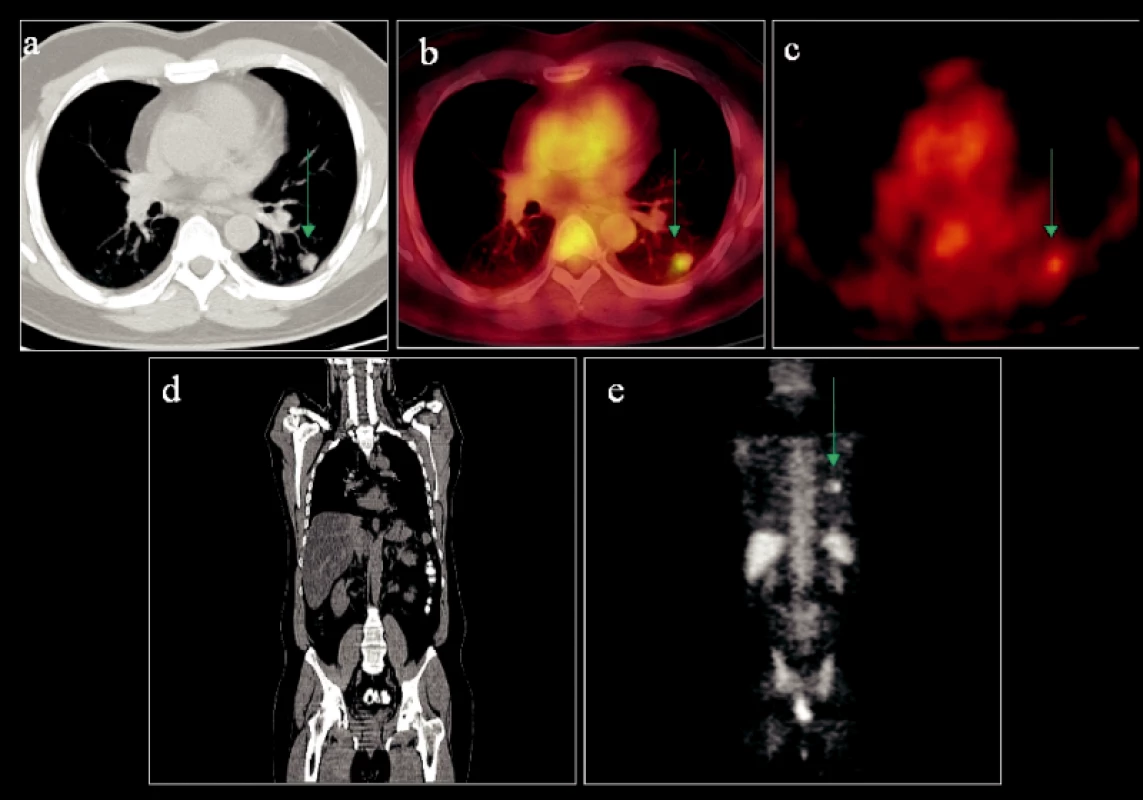
Staging SCLC
S ohledem na nápadně rychlý růst a časné metastazování je malobuněčný bronchogenní karcinom považován za samostatnou jednotku.
Úkolem iniciálního celotělového vyšetření je stanovit stadium nemoci a vyčlenit pacienty s lokálním nádorem, kteří jsou indikováni ke kurativní radioterapii po předchozí léčbě chemoterapií. FDG PET/CT se uplatní ve stagingu TNM jako metoda potvrzující místo a rozsah primárního nádoru (obr. 2).
Obr. 2. a) PET vyšetření – koronární obraz Vysoká akumulace FDG v oblasti mediastina a drobné ložisko vysoké akumulace FDG lokalizované do levého plicního křídla představuje primární SCLC. b) Hybridní PET/CT vyšetření u téhož pacienta – axiální obrazy Objemná masa se zřetelně zvýšenou akumulací FDG odpovídá zvětšeným LU v mediastinu. 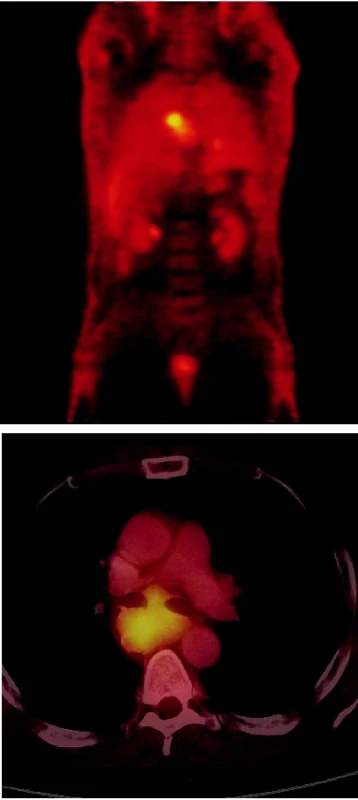
Kontrola terapeutického efektu a restaging
Pooperační jizevnaté změny a postiradiační fibróza změní anatomické vztahy a snižují přesnost anatomických zobrazovacích metod (typicky obtížný průkaz adenokarcinomu v jizvě). Metabolická aktivita tkání se dynamicky mění v závislosti na odstupu od operace či iradiace a je citlivým ukazatelem biologické aktivity onemocnění. Proto se metabolická vyšetření stávají v daném případě metodou volby a FDG PET zvyšuje senzitivitu i specificitu CT vyšetření. Včasné odhalení perzistujícího či recidivujícího nádoru umožní změnu terapie či aplikaci terapie nové.
Falešně pozitivní nálezy při FDG PET se objevují v ozařovaném terénu někdy již krátce po ukončení radioterapie. Tyto změny ovšem bývají difuzního charakteru a při znalosti ozařovaného pole a doplňující strukturální informace z CT obvykle nečiní velké diagnostické rozpaky. Při hojení operačních ran nebo při zánětlivých komplikacích (absces) bývá konzumpce glukózy ložiskově zvýšena. U pacientů po pleurodéze talkáží přetrvává pozitivita PET vyšetření několik let; v případě chronického zánětu může být pozitivita i trvalá. Naopak falešně negativní FDG PET nález vídáme u pacientů těsně po chemoterapii, kdy je celková metabolická aktivita nádoru pouze utlumena. Za spolehlivou hranici průkazu neviability se považuje 6 měsíců od chemoterapie. Po této lhůtě je nové hypermetabolické ložisko suspektní z recidivy neoplazie. Zbytnělé měkké tkáně nevykazující hypermetabolismus glukózy odpovídají fibróze (7, 9–11).
Indikace k FDG PET/CT
Na základě současných poznatků v diagnostice plicních tumorů je možno vyčlenit následující hlavní indikační skupiny:
- diferenciální diagnostika solitárních plicních ložisek,
- staging NSCLC,
- restaging primárně neresekabilních NSCLC po neoadjuvantní terapii (stadium IIIB),
- kontrola efektivity terapeutického účinku,
- vyhledávání primárního nádoru u metastáz do jiných orgánů s vysokou prevalencí karcinomu plic (typicky solitární metastáza v mozku).
MUDr. Jana Votrubová, CSc.
PET centrum Nemocnice Na Homolce
Roentgenova 2, 150 30 Praha 5
fax: +420 257 272 163, e-mail: jana.votrubova@homolka.cz
Zdroje
1. Zdravotnická ročenka ČR 2006 Praha, ÚZIS, 2007.
2. Klener, P.: Klinická onkologie. Praha, Galén, 2002.
3. Trawis, W. D., Colby, T. V., Corrin, B. et al.: Histological typing of lung and pleural tumours. WHO international classification of lung tumours, 3rd edn. Berlin Heidelberg New York, Springer, 1999.
4. Rigo, P., Hustings, R., Bury, T.: PET imaging in lung cancer. In: Valk, P. E., Bailey, D. L., Townsend, D. W., Maisey, M. N.: Positron emission tomography: Basic science and Clinical practice. London, Springer Verlag, 2003.
5. Bělohlávek, O., Fencl, P.: Hybridní zobrazování výpočetní a pozitronovou emisní tomografií. Interní medicína pro praxi, 2004, 6, s. 61–63.
6. Votrubová, J., Fencl, P.: Hybridní zobrazování PET/CT. Čes. Radiol., 2004, 58, s. 333–337.
7. Vansteenkiste, J. F., Stroobants, S. S.: Lung cancer. In: Oehr, P., Biersack, H. J., Coleman, R. E.: PET and PET/CT in oncology. Berlin Heidelberg, Springer, 2004.
8. Dietlein, M., Weber, K., Gandjour, A.: Cost-effectiveness of FDG-PET for the management of potentially operable non-small cell lung cancer: priority for a PET-based strategy after nodal-negative CT results. Eur. J. Nucl. Med., 2000, 27/11, s. 1598–1609.
9. Zatloukal, P., Petruželka, L.: Karcinom plic. Praha, Grada Publishing, 2001.
10. Oehr, P., Biersack, H. J., Coleman, R. E.: PET and PET/CT in oncology. Springer Verlag Berlin, 2004, 350 s.
11. Hansen, H. H.: Textbook of lung cancer. London, Martin Dunitz, 2000.
Štítky
Adiktologie Alergologie a imunologie Angiologie Audiologie a foniatrie Biochemie Dermatologie Dětská gastroenterologie Dětská chirurgie Dětská kardiologie Dětská neurologie Dětská otorinolaryngologie Dětská psychiatrie Dětská revmatologie Diabetologie Farmacie Chirurgie cévní Algeziologie Dentální hygienistka
Článek vyšel v časopiseČasopis lékařů českých
Nejčtenější tento týden
- Psilocybin je v Česku od 1. ledna 2026 schválený. Co to znamená v praxi?
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejčastější nežádoucí účinky venlafaxinu během terapie odeznívají
-
Všechny články tohoto čísla
- Využití PET/CT v diagnostice nádorů plic
- Nový krok ve výzkumu pigmentového transferu
- Rubinstein-Taybi syndrom nebo-li syndrom širokých palců
- Nový pohled na lupy a seboroickou dermatitidu
- Problematika náhradního rozhodování o dalším léčebném postupu inkompetentního pacienta I. část – absence závazného pokynu pro další léčebný postup
- Problematika náhradního rozhodování o dalším léčebném postupu inkompetentního pacienta II. část – existence závazného pokynu pro další léčebný postup
- Spirituální jevy vyskytující se u každého člověka a zdraví*
- Tuberkulóza u cizinců v České republice v letech 2003–2006
- Ultrazvukové vyšetření žil dolních končetin
- Hrozí zneužití – diskreditace lékařské genetiky
- Kawasakiho choroba a její oční příznaky
- Sto let od narození neurochirurga Zdeňka Kunce – vzpomínka jeho žáka
- A complex interaction between drug allergy and viral infection
- Epidemiologic and clinical features of anaphylaxis in Korea
- Jedenáctá celostátní konference DNA diagnostiky Praha, 6.–7. prosince 2007
- Význam vybraných molekulárně-genetických markerů pro predikci léčebné odpovědi a odhadu prognózy u pacientů s nemalobuněčným karcinomem plic
- CLL a www.ericll.cz
- CytoChip
- Současný stav DNA diagnostiky u neuronálních ceroidlipofuscinos (NCL) v České republice a na SlovenskuNově charakterizovaný typ NCL7
- Význam molekulárně genetické analýzy genu CYP2D6 a metody detekce
- Možnosti stanovení minimální zbytkové choroby pomocí RQ-PCR u B-CLL pacientů
- Informovaný souhlas v molekulární genetice
- APEX-nový přístup v molekulárně genetické diagnostice Wilsonovy choroby
- Výskyt rizikových trombofilních faktorů v české populaci
- Neinvazivní prenatální diagnostika na bázi přítomnosti fetálních extracelulárních nukleových kyselin v mateřské cirkulaci a její současné možnosti
- Analýza genomu B-CLL pacientů pomocí array CGH
- Možnosti DNA diagnostiky u dívek s karyotypem 46,XY
- Vyšetření genu pro LMNA A/C u českých pacientů s CMT2 a AD EDMD
- Přestavba IgVH subgenů a význam stanovení v diagnostice B-CLL
- Projekt Eurogentest: přehled výsledků ve druhé polovině řešení tohoto projektu
- Využití populační DNA banky ve výzkumu komplexních geneticky podmíněných chorob: nové možnosti a nová úskalí
- Genotyping of MTHFR 677 C>T and 1298 A>C polymorphisms by High Resolution Melting of Small Amplicons
- Molekulární diagnostika RB1 genu u pacientů s retinoblastomem
- Preimplantační genetická diagnostika monogenních chorob
- Frekvence alel genu TPMT v populaci České republiky
- Léčba imatinibem u pacientů s chronickou myeloidní leukémií a vyšetřování příčin vznikajících rezistencí
- Korelace genotypu, fenotypu a hladiny mRNA u vybraných nervosvalových poruch
- Hereditární spastická paraparesa typ SPG4 – první výsledky z České republiky
- From Biobanking to Biomarkers in Vascular and Metabolic Disease
- Mutační analýza genu PKD1 u pacientů s autozomálně dominantní polycystickou chorobou ledvin
- Validace molekulárně genetické metody – vyšetření mutace F508del genu CFTR pomocí PCR reakce s fluorescenčně značeným párem primerů
- Genomická analýza reakce štěpu proti hostiteli u leukemických pacientů po alogenní transplantaci krvetvorných buněk
- CADASIL: analýza mutací v genu Notch3
- Etické aspekty DNA testování otcovství
- XI. kongres o aterosklerózeŠpindlerův Mlýn, 6.–8. prosince 2007
- Spolek lékařů českých v Praze
- Praxis der Psychoonkologie (Psychoedukation, Beratung und Therapie)
- Laureáti Nobelovy ceny
- Časopis lékařů českých
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rubinstein-Taybi syndrom nebo-li syndrom širokých palců
- Využití PET/CT v diagnostice nádorů plic
- Hereditární spastická paraparesa typ SPG4 – první výsledky z České republiky
- CADASIL: analýza mutací v genu Notch3
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



