-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Idiopatický střevní zánět u pacientů s primární sklerozující cholangitidou – samostatný fenotyp IBD
Inflammatory bowel disease in patients with primary sclerosing cholangitis – a unique phenotype of IBD
Inflammatory bowel disease associated with primary sclerosing cholangitis (PSC-IBD) can be understood as a unique phenotype of IBD due to its specific characteristics. The highest prevalence can be found in north European and American countries which also have the highest prevalence of PSC. Both IBD and PSC are multifactorial diseases, in the development of which genetic predispositions play a decisive role. A pathogenetic association between these two diseases is almost undeniable but their precise causal relationship remains unclear. An important role is probably played by secondary bile acids, intestinal microflora, intestinal barrier malfunction, and regulatory T-lymphocytes. In spite of all the relations mentioned, the origin of these two diseases is usually metachronous – PSC can manifest many years after a total proctocolectomy and, on the contrary, colitis appears de novo in liver transplant patients in as many as 30% of cases. In most patients, however, the onset of IBD precedes the development of PSC. PSC-IBD typically manifest as a relatively mild pancolitis with the predominant involvement of the right-side colon. Typical manifestations include simultaneous affection of the terminal ileum (“backwash” ileitis) and “rectal sparing”. From the histological point of view, in the vast majority of cases it is referred to as ulcerative colitis (79–91.2%), and only rarely as Crohn's disease (6.3–7 %). Due to its mild progression, colitis is most often treated with aminosalicylate monotherapy. As regards thiopurines, it is necessary to consider the increased occurrence of adverse effects, especially hepatotoxic ones. There are no sufficient data on the use of biological treatment in this group of patients. The first-choice method in surgical treatment is proctocolectomy with ileal pouch-anal anastomosis (IPAA). PSC patients displayed a higher rate of pouchitis (63–75%), both acute and chronic. Considering the increased risk of colorectal carcinoma in this group of patients, it is recommended to perform a total colonoscopy once a year. A single focus of non-lipoid lesions with low-grade dysplasia verified by two pathologists should lead to considering prophylactic colectomy, with a view to a high risk of progression to colorectal carcinoma (up to 50% within five years). As regards chemoprevention of colorectal carcinoma in PSC-IBD patients, good results are achieved by administering ursodeoxycholic acid in low doses (8–15 mg/kg/day).
Key words:
primary sclerosing cholangitis – inflammatory bowel disease – ulcerative colitis – colorectal carcinoma
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
16. 12. 2013Accepted:
17. 1. 2014
Autoři: L. Bajer 1; D. Kamenář 1; E. Sticová 2; P. Wohl 1; J. Špičák 1; P. Drastich 1
Působiště autorů: Klinika hepatogastroenterologie, IKEM, Praha 1; Pracoviště klinické a transplantační patologie, IKEM, Praha 2
Vyšlo v časopise: Gastroent Hepatol 2014; 68(1): 24-35
Kategorie: IBD: přehledová práce
Souhrn
Idiopatický střevní zánět doprovázející primární sklerozující cholangitidu (PSC-IBD) lze pro jeho četná specifika chápat jako samostatný fenotyp IBD. Nejvyšší prevalenci nacházíme v zemích severní Evropy a Ameriky, kde je i největší prevalence PSC. IBD i PSC jsou multifaktoriálně podmíněná onemocnění, na jejichž rozvoji mají zásadní podíl genetické predispozice. Patogenetická souvislost mezi oběma chorobami je takřka nezpochybnitelná, nicméně přesný kauzální vztah zůstává neobjasněn. Důležitou roli zde pravděpodobně sehrávají sekundární žlučové kyseliny, střevní mikroflóra, porucha střevní bariéry a regulační T lymfocyty. Přes všechny popsané vazby bývá vznik obou onemocnění metachronní – PSC se může projevit mnoho let po totální proktokolektomii a naopak kolitida vzniká v až 30 % případů de novo po transplantaci jater. U většiny pacientů však vznik IBD předchází rozvoji PSC. PSC-IBD se zpravidla manifestuje jako relativně mírná pankolitida s predominantním postižením pravostranného kolon. Typickými znaky jsou současné postižení terminálního ilea („back-wash“ ileitida) a ušetření rekta („rectal sparing“). Z histologického hlediska bývá v drtivé většině případů popsán jako ulcerózní kolitida (79–91,2 %), jen výjimečně pak jako Crohnova nemoc (6,3–7 %). Vzhledem k mírnému průběhu kolitidy je nejčastěji používanou léčbou monoterapie aminosalicyláty. U thiopurinů je třeba mít na paměti zvýšený výskyt nežádoucích, zejména hepatotoxických účinků. Stran použití biologické léčby u této skupiny nemocných zatím neexistují dostatečná data. Metodou volby v chirurgické léčbě je proktokolektomie se zhotovením ileopouch-anální anastomózy (IPAA). U pacientů s PSC byla popsána vyšší frekvence pouchitidy (63–75 %), a to jak akutní, tak chronické. Pro zvýšené riziko vzniku kolorektálního karcinomu u této skupiny pacientů je doporučeno provádět totální koloskopické vyšetření v ročním intervalu. Již jediné ložisko nepolypoidní léze s low-grade dysplazií, verifikované dvěma patology, by mělo vést k úvaze o profylaktické kolektomii vzhledem k vysokému riziku progrese do kolorektálního karcinomu (až 50 % do pěti let). Z hlediska chemoprevence kolorektálního karcinomu u pacientů s PSC-IBD má dobré výsledky podávání kyseliny ursodeoxycholové v nízkých dávkách (8–15 mg/kg/den).
Klíčová slova:
primární sklerozující cholangitida – idiopatický střevní zánět – ulcerózní kolitida – kolorektální karcinomPrimární sklerozující cholangitida (PSC) je chronické cholestatické onemocnění charakterizované zánětem a fibrózou intra - a/nebo extrahepatálních žlučovodů vedoucí k cirhóze a jaternímu selhání. Jako samostatná klinická jednotka byla definována Delbetem již v roce 1924 a v průběhu posledních desetiletí se stala jednou z nejčastějších indikací k ortotopické transplantaci jater (OTJ), obzvláště pak v severoevropských zemích, USA a Kanadě. Choroba bývá ve většině případů doprovázena idiopatickým střevním zánětem (IBD). Toto propojení onemocnění dvou různých orgánů trávicího systému bylo poprvé popsáno Warrenem v roce 1966.
Pro svá četná etiologická a klinická specifika se střevní zánět doprovázející PSC v posledních letech stále častěji vymezuje jako samostatná klinická jednotka – tzv. „PSC-IBD.“ Doplňuje tak rodinu doposud lépe definovaných onemocnění – Crohnovy nemoci (CD) a zejména pak ulcerózní kolitidy (UC). Ve velké většině případů totiž bývá PSC-IBD histologicky klasifikován právě jako UC. Taková diagnóza se pak zpravidla označuje zkratkou „PSC-UC“, obdobně jako méně často se vyskytující PSC – asociovaná Crohnova choroba (PSC-CD). Bez ohledu na histologickou klasifikaci je však PSC-IBD vázán takřka výhradně na tlusté střevo (nepostihuje vyšší etáže GIT tak jako Crohnova nemoc) [1–3].
Patogenetické dráhy jaterního (PSC) a střevního onemocnění (IBD) mají pravděpodobně mnoho průsečíků, přesná souvislost však zatím popsána nebyla, stejně jako samotná etiologie obou onemocnění.
Mimo mnohých specifik v klinických projevech a jejich managementu se PSC-IBD vyznačuje zvýšeným rizikem vzniku kolorektálních neoplazií (LGD a HGD – low - a high-grade dysplazie či KRK – kolorektální karcinom), což ovlivňuje diagnostické a screeningové postupy.
Z těchto a mnoha dalších důvodů se idiopatický střevní zánět u pacientů s PSC stává svébytnou problematikou, kterou je třeba mít na paměti nejen v souvislosti s transplantační medicínou, ale i v běžné gastroenterologické praxi.
Demografická data
Incidence PSC je v různých částech světa až 0,9–1,3/100 000 obyvatel za rok, prevalence 8,5–16,2/100 000 obyvatel a dle dostupných dat mají stále narůstající tendenci [2]. Onemocnění se dvakrát častěji vyskytuje v mužské populaci [4]. Typickým nemocným je muž mezi 30. a 40. rokem věku. V rámci evropské populace je nejvyšší prevalence zaznamenávána v severských zemích (obr. 1) [5].
Obr. 1. Prevalence PSC a PSC-IBD ve vybraných zemích světa. Fig. 1. Prevalence of PSC and PSC-IBD in selected countries of the world. 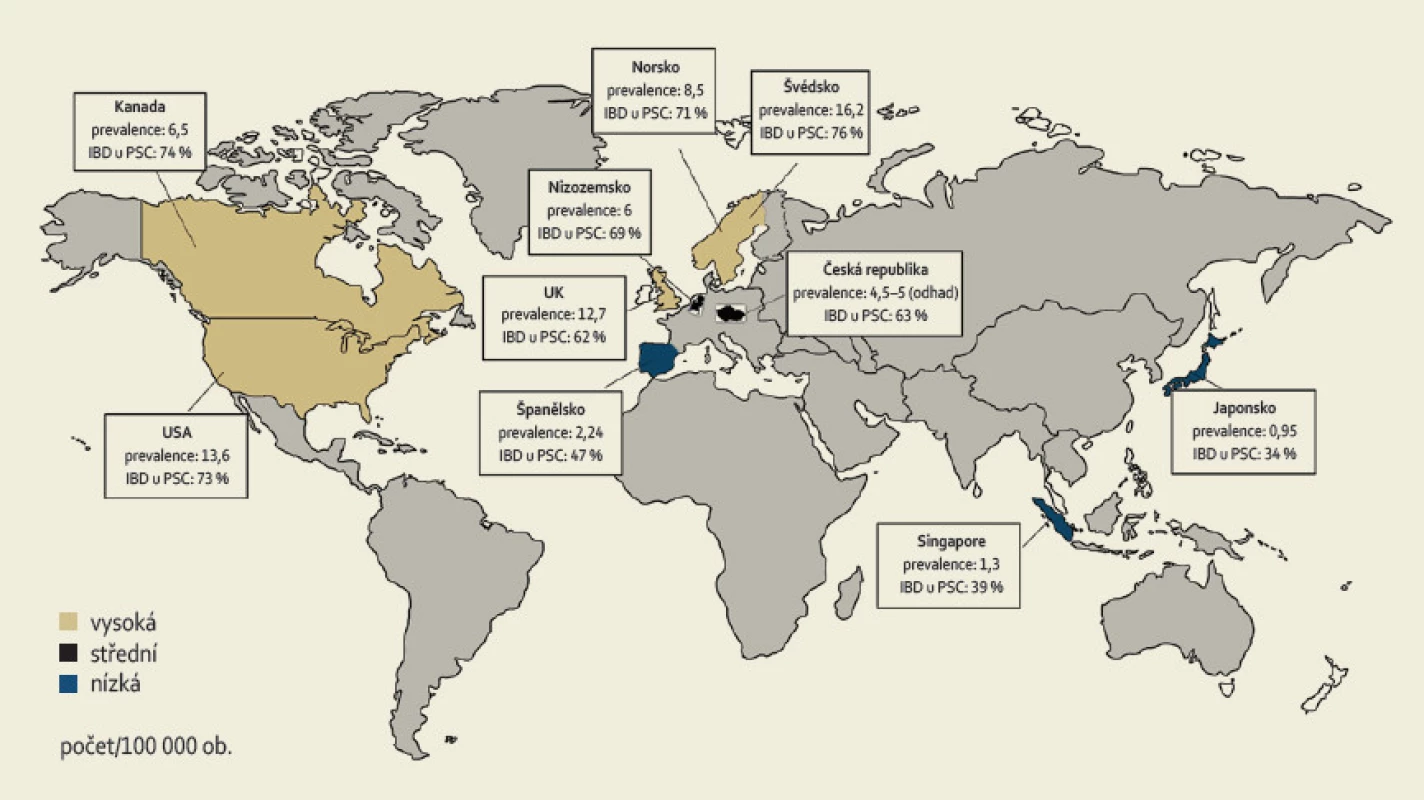
Prevalence IBD (typicky UC) u pacientů s PSC se dle různých literárních pramenů pohybuje mezi 35 a 84 % a je nejvyšší v zemích s vysokou prevalencí PSC. Na severní polokouli je nejvyšší výskyt obou nemocí zaznamenán v severní Evropě a Americe (80 %) [6]; v jižní Evropě je to 50 % [7], zatímco v Asii jen 35 % [8]. Naproti tomu pouze 2–7,5 % nemocných s UC onemocní také PSC. Toto číslo je pravděpodobně ve skutečnosti mnohem vyšší, neboť u mnoha pacientů s UC může PSC probíhat subklinicky [4,9–11]. U CD je výskyt PSC výrazně menší, přesto některé studie uvádějí prevalenci až 3 %, což je ovšem zároveň výrazně více, než se dříve očekávalo [12].
Medián věku diagnózy PSC a přidruženého zánětu tlustého střeva se pohybuje v rozmezí 34–42, resp. 26–32 let, což je zhruba stejný věk jako u prvozáchytu UC (asi 31 let). U většiny pacientů se tedy střevní zánět manifestuje dříve než postižení žlučovodů. PSC se navíc u pacientů s IBD zpravidla projevuje v mladším věku, než je tomu u pacientů s intaktním kolon. Fakt, že se doba mezi stanovením jednotlivých diagnóz stále více zkracuje, můžeme nejspíše připsat mimo jiné i větší dbalosti lékařů na souvislost mezi oběma nemocemi. Ta spočívá především v pravidelné kontrole jaterních testů (zejména elevace ALP) se zřetelem na to, že se PSC může v iniciální fázi prezentovat zcela asymptomaticky. Obdobný princip platí i naopak – pacientům s PSC by měla být provedena endoskopická kontrola v ročním intervalu, a to ideálně s vícestupňovým odběrem bioptických vzorků vzhledem ke zvýšenému riziku vzniku neoplazií [2,13,14].
Doba přežití pacientů s PSC (od stanovení diagnózy do OTJ nebo smrti) je zhruba 12–18 let [15]. Příznivější čísla ukazují statistiky nejen u mladších pacientů, ale neočekávaně právě také u pacientů s IBD (u jiných koincidujících onemocnění taková souvislost popsána nebyla) [2]. Vliv IBD na průběh jaterního onemocnění prognosticky pozitivního nálezu se může zdát překvapivým, z logiky věci je ale pravděpodobně opět dán důslednějším a hlavně pravidelným sledováním jaterních funkcí u pacientů s IBD.
Etiopatogenetické souvislosti
Navzdory významnému pokroku na poli vědeckého výzkumu zůstávají etiopatogenetické souvislosti u obou onemocnění stále málo objasněné. To se týká i jejich vzájemného propojení, o kterém na základě doposud získaných poznatků již není pochyb. Klíčovou roli zde hrají genetické faktory, což potvrzují četné recentní studie provedené na rozsáhlých souborech pacientů a jejich příbuzných. Dle těchto lze definovat PSC a IBD jako multifaktoriálně podmíněná onemocnění.
Příbuzní I. stupně pacientů s PSC mají signifikantně vyšší riziko vzniku jaterní nemoci oproti zbylé populaci. Pro společné faktory genetické vnímavosti PSC a UC svědčí fakt, že příbuzní pacientů s PSC (ale bez postižení střeva) jsou ohroženi asi osminásobně vyšší pravděpodobností vzniku UC, což je dle studie Bergquist et al srovnatelné s rizikem pro příbuzné pacientů s PSC i IBD. Riziko vzniku CD není naproti tomu, alespoň dle dosavadních dat, pro příbuzné pacientů s PSC statisticky významné [16].
Jak pacienti s PSC, tak jejich příbuzní jsou ve zvýšené míře ohroženi vznikem dalších, imunologicky podmíněných chorob [17]. Mimo IBD jsou častými takto sdruženými onemocněními sarkoidóza, diabetes I. typu, autoimunitní thyreoiditida a autoimunitní pankreatitida, psoriáza aj. [18].
HLA-systém
U PSC i UC byly opakovaně popsány asociační vazby na různé genetické varianty hlavního histokompatibilního systému (HLA) na lokusu 6p21 [19]. U UC byla nejvýraznější pozitivní asociace s alelami DRB1*0103 a DRB1*1502 a negativní asociace s DRB1*0401 [20]. U PSC bývá zdůrazňována pozitivní vazba na haplotypy HLA-A*01-C*07-B*08--DRB1*0301-DQB1*0201 a DRB1**1301-DQB1*0603 a naopak negativní vazba s DRB1*04 [21]. Z uvedeného vyplývá, že protektivní efekt alel DRB1*04 byl popsán u obou onemocnění. Otázkou je, zda tento nález u PSC nejde na vrub souběžně (byť i klinicky němě) probíhající UC. Frekvence této alely je navíc znatelně nižší u PSC-UC v porovnání s UC izolovanou. Není také bez zajímavosti, že zvýšený výskyt DRB1*0301 byl popisován zejména u pacientů s extenzivní kolitidou [22], která je charakteristickým znakem PSC-UC. Fakt, že se HLA znaky u UC liší v závislosti na souběžném výskytu PSC, je dalším argumentem pro definici PSC-UC (resp. PSC-IBD) jako samostatného subtypu IBD [23]. Překvapivým, před časem publikovaným poznatkem je popisovaný mírnější průběh kolitidy u těhotných s PSC, které měly odlišnou genetickou výbavu v HLA-DR a HLA-DQ než jejich budoucí potomek [24]. Patofyziologickou souvislost povzbuzuje obdobný nález mírnější kolitidy u PSC pacientů transplantovaných štěpem taktéž s disparitou v HLA-DR a HLA-DQ znacích [25].
Non-HLA systém
Dvě přelomové genomové asociační studie (GWAS) identifikovaly několik rizikových lokusů pro PSC mimo HLA systém (2q13, 2q35, 3p21, 10p15 a 13q31). Lokusy 2q35 (uchovávající gen pro biliární receptor TGR5) a 3p21 jsou navíc spjaty také s UC. Pro tu bylo v posledním desetiletí objeveno již asi 30 rizikových lokusů v početných genomových asociačních studiích a studiích zkoumajících kandidátní geny. Žádná z nich ale nenašla genetickou asociaci s PSC [26,27]. Rozsáhlá recentní severská studie však tři lokusy genetické vnímavosti pro UC (ovlivňující expresi REL, CARD9 a IL-2) asociované s primární sklerozující cholangitidou identifikovala [28], což je bezesporu dalším krokem k lepšímu pochopení problematiky patogeneze PSC a IBD. Související kandidátní geny totiž podtrhují jak klíčovou roli imunity přirozené (REL, CARD9), tak adaptivní (dráha IL2-IL2R). Diskrepance v lokusech vnímavosti u pacientů s UC a pacientů PSC nahrává PSC-IBD jakožto samostatnému podtypu [13].
Role buněčné imunity
Důležitou roli v patogenezi PSC ve vazbě na IBD pravděpodobně hraje aktivace slizničních T lymfocytů a následné zvýšení počtu monocytů v portální krvi. To je výsledkem aberantní exprese endoteliálních adhezních molekul a chemokinů, jež jsou za fyziologických okolností omezeny na střevní sliznici [29]. Fakt, že se PSC může objevit po totální proktokolektomii, implikuje úlohu střevem derivovaných paměťových lymfocytů, které setrvávají v krevním oběhu po mnoho let. Tuto teorii navíc podporuje exprese klíčových substancí v oblasti střeva a jater, konkrétně VAP 1 (vaskulární adhezní protein) a MAdCAM-1 (mukozální adresinová buněčná adhezní molekula-1) [3]. V periferní krvi pacientů s PSC-IBD byla také popsána signifikantní elevace CD4+CD25+ regulačních T lymfocytů, které mají ústřední úlohu v řadě imunopatologických stavů včetně autoimunity, zánětu a vzniku neoplazií. Jejich role v patogenezi PSC-IBD však zatím nebyla objasněna a bude vyžadovat podrobnější budoucí analýzu [30].
Mikrobiota
Další navržený mechanizmus v patogenezi PSC je založen na aberantní bakteriální translokaci skrze zánětlivou střevní stěnu. V důsledku bariérové poruchy dochází k portální bakteriemii a k úniku široké škály toxických substancí. Buněčné stěny mikrobů pak interagují s toll-like receptory (TLR) a jinými receptory rozpoznávajícími vzory jaterních makrofágů či dokonce biliárního epitelu [31]. Může tak vznikat zánět žlučovodů s jejich následnou destrukcí a tvorbou striktur. Významu zvýšené permeability zánětlivě změněné střevní stěny nahrává skutečnost, že většina PSC-IBD pacientů trpí pankolitidou, u níž se dá předpokládat extenzivní porucha střevní bariéry. Přeměnou primárních žlučových kyselin navíc mikrobiota zvyšují podíl sekundárních žlučových kyselin, jež se zvýšenou měrou reabsorbují do portálního oběhu skrze porušenou střevní bariéru, a mohou tak uplatnit svůj hepatotoxický potenciál [32]. To vše jen podporuje silnou patogenetickou vazbu na ose střeva-játra.
Protilátky jako potenciální markery onemocnění (ANCA, IgG4)
U PSC i IBD často detekujeme (mimo jiných, méně obvyklých, jako např. ANA a ASMA) protilátky proti cytoplazmě neutrofilů (ANCA). Zvýšenou hladinu cirkulujících ANCA lze považovat za výsledek prolongované G-bakteriální stimulace B lymfocytů (prostřednictvím TLR) způsobené již zmíněnou poruchou střevní bariéry [33,34]. Dle některých autorů je prevalence výskytu ANCA vyšší u PSC-UC než u UC, a to zejména ve spektru multispecifických ANCA, typicky se současnou přítomností ANA a ASMA [35]. Jiní autoři zase popsali vyšší hladinu u PSC-IBD v porovnání s „pouhou“ PSC [36]. Vysoký titr ANCA může být u PSC-IBD spjat s vyšší frekvencí relapsu střevního zánětu a se zvýšenou nutností indikovat ortotopickou transplantaci jater (OTJ) [37].
U části pacientů (9–20 %) s PSC nacházíme elevaci sérové hladiny IgG4 [38,39]. Studie z Mayo kliniky [38] zaznamenala nižší výskyt IBD oproti pacientům bez elevace IgG4. Jiná recentní studie [39] však charakterizuje tuto skupinu jako pacienty mající většinou asociovanou UC, navíc mladé v době diagnózy PSC, se sklonem k vyššímu výskytu „back-wash ileitidy“ (vyjádřené makro - i mikroskopicky), většímu počtu exacerbací a častější potřebě kolektomií pro refrakterní průběh IBD. Nabízí se tak úvaha o využití IgG4 jakožto markeru aktivity onemocnění u PSC-IBD. To však bude v budoucnu vyžadovat prospektivní průzkum na početné kohortě pacientů. Jednotlivé studie se rozcházejí v tom, zda je možné zvýšenou sérovou hladinu IgG4 považovat za negativní prediktivní faktor ve smyslu zkrácení doby přežívání či nutnosti OTJ. O IgG4 se dokonce uvažovalo jako o potenciálním markeru k vzájemnému odlišení CD od UC. U UC byl totiž sledován zvýšený podíl IgG4-pozitivních plazmatických buněk s tím, že kvantita dokonce korelovala s histologickou aktivitou zánětu [40]. Elevace IgG4 v séru byla navíc prokázána u pacientů s ileopouchanální anastomózou (IPPA), u kterých probíhala pouchitida refrakterní na antibiotickou léčbu [41].
Zvýšenou hladinu IgG4 u pacientů s verifikovanou PSC však nesmíme zaměňovat s jinou, samostatnou klinickou jednotkou – IgG4-asociovanou sklerozující cholangitidou (IgG4-SC). Ta představuje zcela odlišnou problematiku z hlediska prognózy a možností terapie, a po boku PSC a sekundární sklerozující chlangitidy (SSC) je tak třetí nejmladší klinickou entitou v této skupině onemocnění. Typické pro ni je časté multiorgánové postižení (např. sialadenitida, retroperitoneální fibróza a mediastinalní lymfadenopatie) společně s konkomitantní autoimunní pankreatitidou. Pro IgG4-SC dále svědčí (kromě nezbytné elevace IgG4) především dobrá léčebná odpověď na podávání kortikoidů (terapeutický test) a vyšší věk v době první manifestace. Diagnóza často bývá stanovena po provedení jaterní biopsie; na zobrazovacích metodách (ERCP, MRCP) ji od PSC spolehlivě nerozeznáme, přestože jsou u ní ve zvýšené míře vyjádřeny určité znaky [42]. Na IgG4-SC je vždy třeba myslet v diferenciální diagnostice pro PSC.
Patogeneze kolorektálních neoplazií
Vzájemný vztah PSC a IBD s sebou navíc nese četné komplikace na podkladě aberantních imunologických reakcí, jež mohou přispívat ke vzniku neoplazií [43,44]. Přesně definovaná patogenetická dráha mezi chorobami však zatím popsána nebyla. Významnou roli pravděpodobně sehrávají sekundární žlučové kyseliny, zejména pak kyselina deoxycholová a litocholová. Tento mechanizmus spočívá v narušení rovnováhy mezi proliferací, diferenciací a apoptózou kolorektálních krypt [43]. Mimo poškození DNA enterocytů se na patogenezi patrně podílí schopnost hydrofobních žlučových kyselin vyvolat oxidativní stres v dysplastických buňkách. Tato hypotéza koreluje s predominancí výskytu v pravém kolon z důvodu vysoké koncentrace sekundárních žlučových kyselin [45]. Dalšími v úvahu přicházejícími patogenetickými mechanizmy jsou např. stimulace exprese střevních HLA antigenů [46], modulace metabolizmu kyseliny arachidonové v mukóze [47] či narušení změn karcinogeny indukovaných izoforem proteinkinázy C [48]. V nedávné české studii [49] se navíc prokázala vyšší exprese tumor-supresorového genu p53 v nedysplastické sliznici PSC-UC oproti samotné UC. Korelaci nadměrné exprese p53 s přítomností PSC zde navíc podtrhoval fakt, že se nevyskytovala u pacientů s již transplantovanými játry.
Klinický průběh a diagnostika
Klinický průběh idiopatického střevního zánětu má v porovnání s doposud popsanými nozologickými jednotkami (UC, CDF a indeterminovaná kolitida) svá specifika. Dle současných poznatků je proto jej třeba vnímat jako samostatný fenotyp idiopatického střevního zánětu [13]. Z histologického hlediska je však v naprosté většině případů onemocnění klasifikováno jako UC (79–91,2 %), méně často pak jako CD (6,3–7 %) či jako indeterminovaná kolitida (2,5–4,8 %) [8,13,14,50].
Rozsah a lokalizace postižení
Onemocnění se nejčastěji manifestuje jako pankolitida (85–94 %) s mírným průběhem a dominantním postižením pravostranného kolon v případě aktivní formy. Mikroskopický obraz u PSC-IBD je obdobný jako u UC (bez postižení žlučového stromu) a ve většině případů se odlišuje pouze menší intenzitou. U obou typů jsou přítomny známky chronické kolitidy s narušením slizniční architektoniky a s ložiskově vyjádřenou bazální plazmocytózou. Ve srovnání s non-PSC-UC však pacienti s PSC vykazují tendenci k nižší aktivitě zánětlivých změn s řídkou neutrofilní celulizací v lamina propria střevní sliznice, případně s mírnou kryptitidou. Vysoce aktivní kolitida s tvorbou četných kryptových pseudoabscesů a se zánětlivými defekty se u PSC-IBD vyskytuje výjimečně (obr. 2) [51].
Obr. 2. Histologický obraz PSC-IBD. Narušená slizniční architektonika s větvením a zkrácením Lieberkühnových krypt (bílá šipka), s nečetnými neutrofilními leukocyty mezi epiteliemi povrchové výstelky (černá šipka), chronický zánětlivý infiltrát v lamina propria mucosae (hematoxylin-eozin, původní zvětšení ×100). Fig. 2. Histopathological features of PSC-IBD. Mild chronic active colitis characterized by architectural distortion of the intestinal mucosa with branched and shortened crypts (white arrow); neutrophils are focally present within the lamina propria and surface epithelium (black arrow); the lamina propria is expanded by chronic inflammatory infiltrate (hematoxylin-eosin, original magnification ×100). 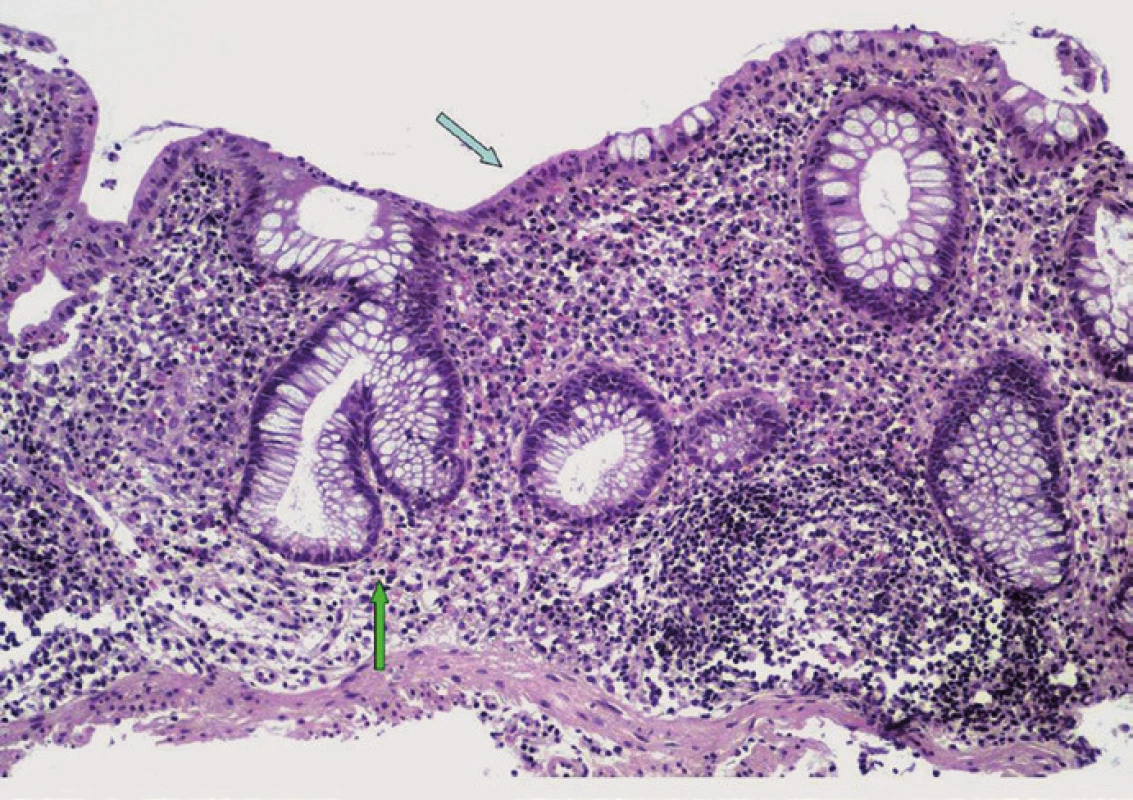
Frekvence pankolitidy u non-PSC-UC je výrazně nižší (okolo 62 %) a na rozdíl od těchto u PSC-IBD téměř nevidíme izolovanou kolitidu levostrannou. Pravostranné postižení kolon bývá u PSC-IBD vyjádřeno až v 85 % případů. Esenciální význam navíc může mít informace, která z chorob pacienta postihne jako první (zpravidla to však bývá postižení střeva, jak již bylo uvedeno). Kolitida předcházející PSC (IBD → PSC) se totiž zřejmě manifestuje převážně pankolitidou, zatímco izolované postižení pravostranné je spíše doménou opačného, méně obvyklého pořadí vzniku nemocí (PSC → IBD) [1,3,51].
Endoskopie a patologie – specifika
Mezi další, a to relativně častěji vyjádřené rysy (tab. 1) v porovnání s non-PSC pacienty patří tzv. „back-wash“ ileitida, ušetření rekta (tzv. „rectal sparing“), dlouhodobě nižší aktivita a menší tendence k relapsu onemocnění [2,11,14,52]. „Back-wash“ ileitida je charakterizována jako inflamace ilea při zánětlivém postižení céka. Některé studie však její zvýšený výskyt u PSC nepotvrzují. O rectal sparing efektu mluvíme, pokud zánět zcela chybí anebo je markantně mírnější než v sigmatu. Nález však takto nehodnotíme, pokud pacient v průběhu šesti měsíců před koloskopií užíval lokální přípravky – léčebná klyzmata nebo čípky (obr. 3). Právě díky těmto zvláštnostem mohou občas vznikat rozpaky stran klasifikace onemocnění a nesourodost dat z různých klinických pracovišť. Například široce používaná Montrealská klasifikace IBD [53] totiž pojmy jako „back-wash“ ileitida, segmentální kolitida nebo „rectal sparing“ vůbec nedefinuje; v případě UC totiž vychází z tradiční představy ascendentní klasifikace vůči rektu, tedy: proktitida → levostranná kolitida → extenzivní kolitida. U CD pak rozlišuje postižení ileální, kolické, ileokolické a postižení horních částí GIT. Její použití u PSC-IBD je tedy značně problematické. Normální makroskopický nález nebo obraz mírné či klidové kolitidy bez klinického vyjádření symptomů může být zavádějící. Například švédská studie publikovaná v roce 1995 prokázala histologické známky zánětu u sedmi z devíti pacientů s PSC bez klinických projevů IBD [54]. To dokládá nejen nutnost odběru bioptických vzorků při kolonoskopii, ale také nezastupitelnou roli patologů v procesu hodnocení stavu nemocného. Adekvátním postupem pro stanovení diagnózy je dle doporučení ECCO (European Crohn´s and Colitis Organisation) [55] provedení alespoň dvou reprezentativních biopsií ze šesti střevních segmentů (terminální ileum, cékum, colon ascendens, transversum, sigmoideum a rektum), a to včetně těch bez makroskopického postižení. Uvedená specifika jasně ukazují, že pouhé sigmoideoskopické vyšetření je pro vyšetření charakteru a aktivity onemocnění zcela nedostatečné – zcela klidný nález v rektosigmatu může doprovázet těžkou alteraci pravostranného kolon. U pacientů s PSC-IBD je navíc provedení sigmoideoskopie namísto totálního kolonoskopického vyšetření hrubou chybou pro vysoké riziko přehlédnutí neoplastického procesu lokalizovaného predominantně v céku či colon ascendens [3].
Obr. 3. Endoskopický nález u PSC-IBD: pravostranná kolitida. Aktivní zánět v céku (nahoře) s úbytkem zánětlivých změn distálním směrem (dole) u 20letého pacienta. Fig. 3. Endoscopic finding of PSC-IBD: right-sided colitis. Active inflammation of the caecum (upper image) with a decrease of inflammatory alteration (bottom image) in the distal colon in 20-year-old patient. 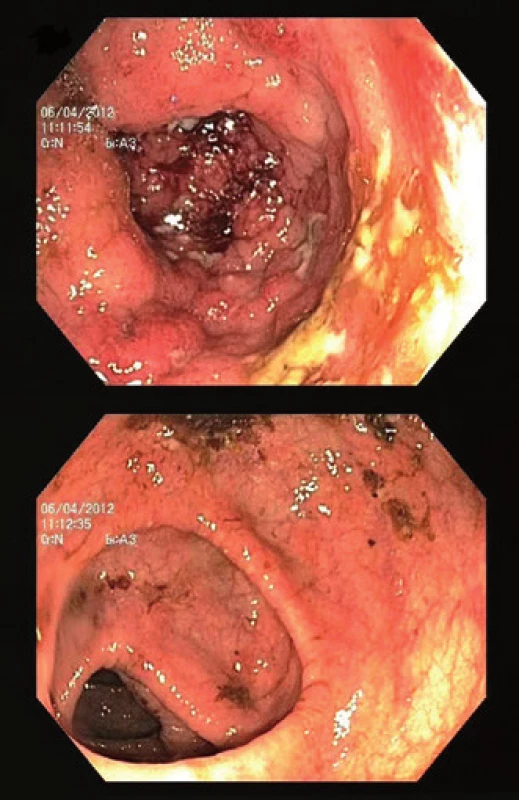
Tab. 1. Typické klinické a endoskopické rysy PSC-IBD. Tab. 1. Typical clinical and endoscopic features of PSC-IBD. 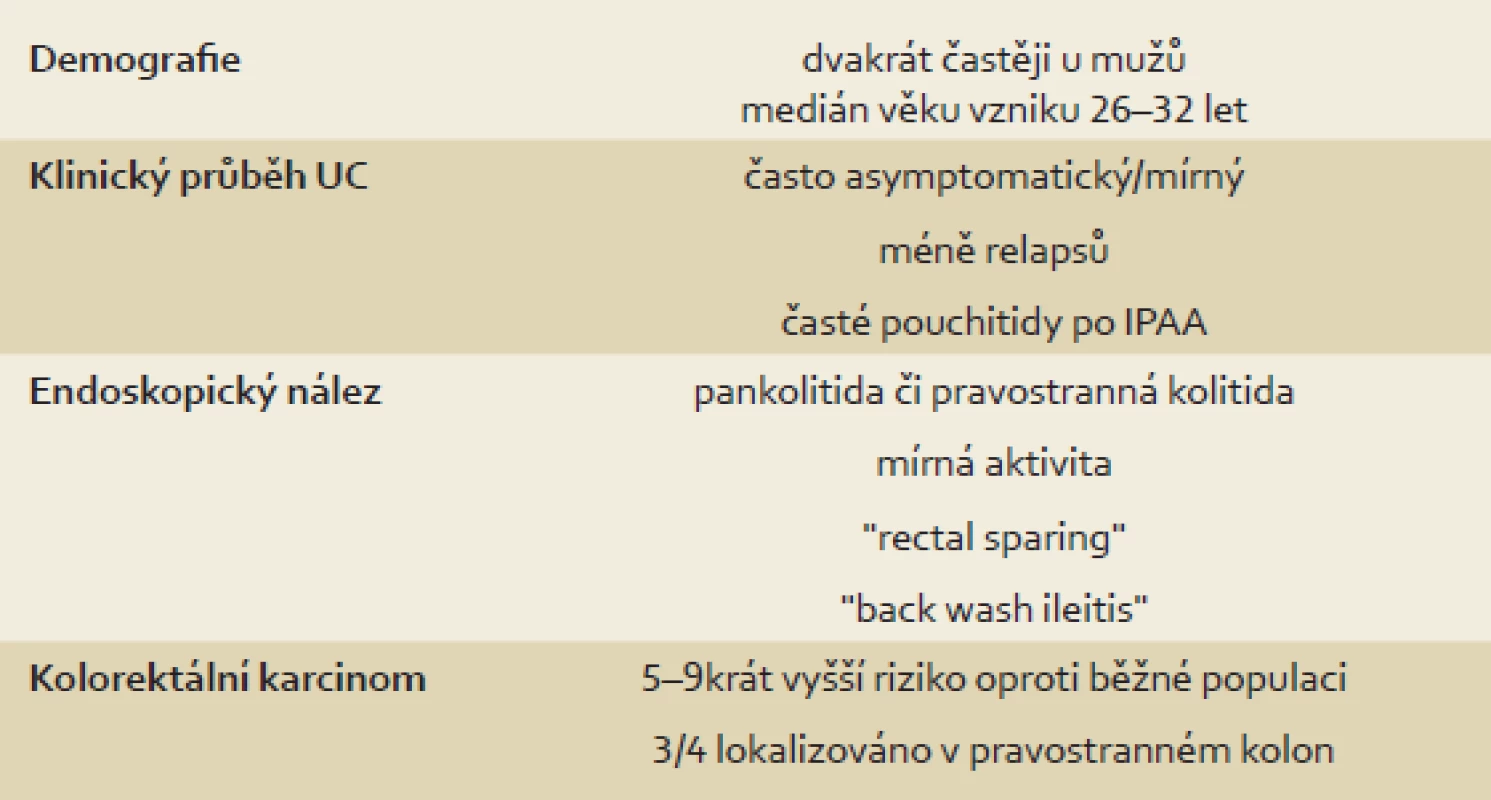
Extraintestinální manifestace
U PSC-IBD se vyskytují stejné extraintestinální manifestace (EIM) jako u UC, avšak s nižší frekvencí. Jde zejména o EIM kožní (pyoderma gangrenosum, erythema nodosum, Sweet´s syndrome), kloubní (artritida, ankylozující spondylitida), oční (uveitida a episkleritida) a mukokutánní (aftózní stomatitida). Samotná PSC představuje extraintestinální (v tomto případě hepatobiliární) komplikaci IBD [56].
Crohnova choroba u pacientů s PSC
Diagnóza CD je u pacientů s PSC relativně málo obvyklou a střevní zánět bývá v průběhu nemoci nezřídka překlasifikován na UC. Obdobně ani indeterminovaná kolitida nebývá zpravidla konečnou diagnózou. CD u PSC se takřka výhradně omezuje na tlusté střevo. U pacientů vedených jako PSC-CD se totiž postižení kolon manifestuje až v 96 %. Izolované postižení tenkého střeva či horních částí GIT se u PSC-CD prakticky nevyskytují [1,57]. Diagnóza CD bývá dána především přítomností některých typických histologických znaků. Tři nejpodstatnější jsou diskontinuální postižení zánětem (tzv. „skip lesions“), fokální nepravidelnosti krypt a zejména přítomnost granulomů (LD5). V porovnání s PSC-UC je zde srovnatelný výskyt u obou pohlaví (u UC dvakrát častěji muži). PSC-CD má obecně lepší prognózu stran přežívání, nutnosti OTJ a výskytu maligního zvratu. Tíže střevního zánětu zde navíc nevykazuje zásadní rozdíl v porovnání s CD. Výrazná je také negativní asociace s nikotinizmem – kuřáci s CD mají výrazně nižší riziko vzniku PSC. U PSC-CD najdeme také vyšší frekvenci (3–4krát) výskytu PSC malých žlučovodů, tzv. „small-duct“ formy onemocnění [11]. Tímto je podtržena důležitost zvážení jaterní biopsie u pacientů s IBD a cholestázou, ale s normálním cholangiografickým nálezem.
Obr. 4. Schematické znázornění vztahu PSC, IBD, EIM a KRK. PSC – primární sklerozující cholangitida, IBD – idiopatický střevní zánět, KRK – kolorektální karcinom, EIM – extraintestinální manifestace IBD. Fig. 4. Diagram of the relationship between PSC, IBD, EIM and CRC. PSC – primary sclerosing cholangitis, IBD – inflammatory bowel disease, CRC – colorectal carcinoma, EIM – extraintestinal manifestation of IBD. 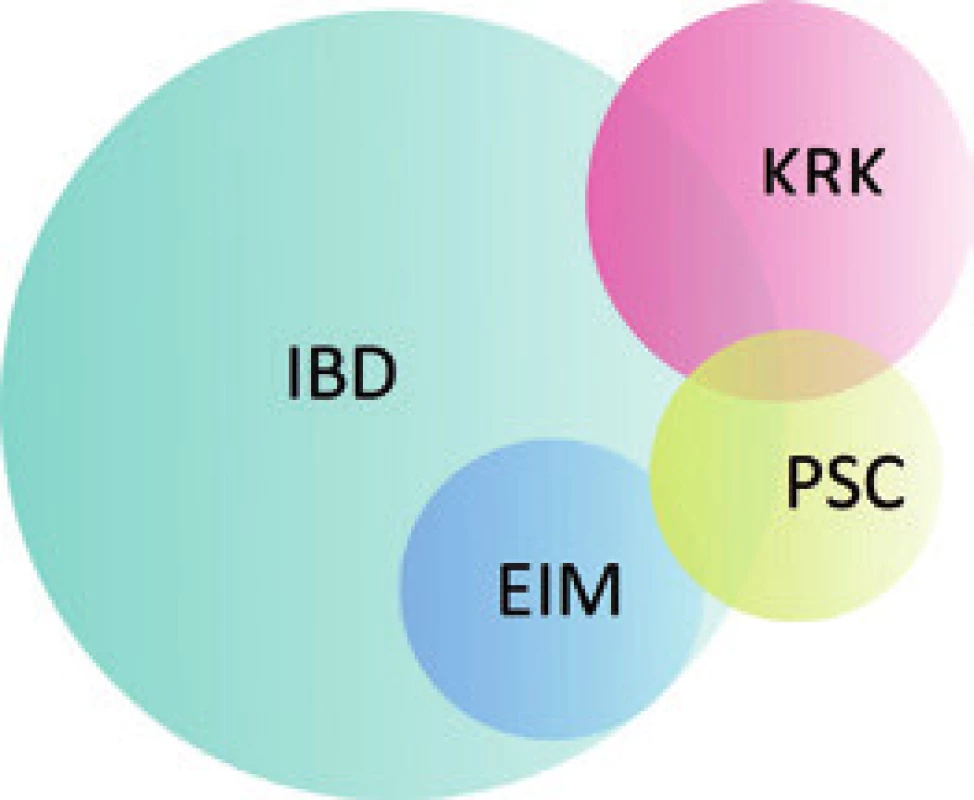
Léčba
Medikamentózní léčba a její specifika
Předpokladem léčby PSC-IBD je fakt, že zánět většinou probíhá poměrně mírně. V porovnání s UC je zde tedy výrazně vyšší podíl pacientů dlouhodobě užívajících 5-ASA (5-aminosalicylová kyselina) v monoterapii jakožto dostatečný prostředek pro udržení klinické remise střevního zánětu [14]. U dalších přípravků užívaných v terapii IBD je v případě pacientů s PSC třeba být na pozoru především vůči jejich potenciálnímu hepatotoxickému efektu.
Aminosalicyláty
Na poli indukce a udržovací terapie u mírně až středně probíhající UC je základním farmakem mesalazin. U pacientů s PSC-IBD většinou (až v 77 %) postačí k dlouhodobému udržení střevního zánětu pod kontrolou [58]. Vzhledem k typické pravostranné lokalizaci a event. ušetření rekta se lokální léčba (čípky, klyzmata) prakticky nepoužívá. Chemopreventivní účinek mesalazinu a jeho derivátů v prevenci KRK nebyl doposud jednoznačně prokázán, ale jeví se jako vysoce pravděpodobný [59].
Kortikosteroidy
Systémové kortikoidy slouží u UC zejména ke zvládnutí středně těžkých a těžkých atak, k udržování dlouhodobé remise pak nejsou, zvláště ve vyšších dávkách, zcela vhodné pro četné nežádoucí efekty. U PSC-IBD se jejich podávání řídí obdobnými pravidly jako u CD a UC. Na postižení žlučovodů základní chorobou nemají kortikoidy zásadní pozitivní či negativní vliv. Přesto mohou mít nepříznivý dopad na stav pacienta vzhledem k možným septickým stavům (akutní cholangitida, cholangiogenní sepse). Jejich dlouhodobé podávání u pacientů s PSC také může významně zhoršit průběh osteoporózy, jež často doprovází cholestatická jaterní onemocnění a nutně vyžaduje adekvátní podpůrnou terapii [60].
Thiopuriny
Azathioprin a jeho metabolit 6-merkaptopurin jsou purinová analoga používaná u IBD především k indukci a udržení stadia remise za účelem minimalizovat dávku kortikosteroidů. U pacientů s PSC vídáme azathioprin v medikaci poměrně často, jeho nasazení by však měla vždy předcházet důkladná rozvaha. Dlouho známý toxický efekt na játra a slinivku je dle recentní studie Pallavicina et al [61] u PSC-IBD až desetinásobný (41,7 %) ve srovnání s IBD bez PSC (4 %). Toxický vliv azathioprinu je ale špatně hodnotitelný; z případné elevace jaterních testů se dá jen stěží dešifrovat její původ, tedy zda jde o progresi onemocnění, zmiňovanou toxicitu či jiný inzult. Tuto otázku může pomoci zodpovědět jaterní biopsie, a ve sporných případech by proto měla být indikována. Před zahájením terapie thiopuriny je vždy vhodné stanovit hladinu thiopurin S-metyltransferázy (TPMT) a během léčby samotné pravidelně sledovat jaterní testy, obzvláště pak v prvních měsících.
Metotrexát
Hlavní indikací metotrexátu u IBD je udržování remise u kortikodependentních pacientů s CD při nedostatečné efektivitě thiopurinů či při závažném výskytu jejich nežádoucích účinků. U pacientů s pokročilým jaterním onemocněním je však kontraindikován pro svou silnou, na dávce závislou hepatotoxicitu [58,62].
Biologická léčba
V revmatologii, dermatologii a gastroenterologii se ve vzrůstající míře používají monoklonální anti-TNFα protilátky infliximab a adalimumab. V praxi bývají nejčastěji indikovány u kortikodependentních či kortikorezistentních pacientů refrakterních k imunosupresivní terapii. V tuto chvíli neexistují dostatečná data, která by mohla podpořit podávání biologické léčby u pacientů s PSC-IBD, avšak dosavadní publikace na dané téma (jednotlivé kazuistiky či pozorování na malých souborech pacientů) popisují její příznivý efekt. Závažná hepatotoxicita je u této skupiny léčiv vzácnou situací a jako vedlejší účinek byla popsána spíše u infliximabu [58,63,64]. U biologické léčby nebyl zatím prokázán pozitivní, ale ani negativní vliv na průběh PSC [64]. Do budoucna by bylo užitečné definovat, jaký má biologická léčba u PSC vliv na dynamiku morfologických změn na žlučovém stromu a zda svým reparačním efektem nepřispívá k akceleraci onemocnění a tvorbě dominantních stenóz.
Chirurgická léčba a její komplikace, pouchitida
Frekvence střevních resekcí (kolektomie nebo ileocékální resekce) je u PSC-IBD 2–5 %, dle některých studií dokonce 19 % z dlouhodobě sledovaných pacientů. Nejčastějším důvodem kolektomie bývá refrakterní průběh nemoci. Následuje přítomnost dysplazií či obě situace najednou. Zlatým standardem chirurgické léčby u pacientů s PSC-IBD je proktokolektomie se zhotovením ileopouchanální anastomózy (IPAA). Druhým nejčastějším používaným výkonem je kolektomie se založením ileostomie, u které jsou však pacienti s portální hypertenzí ohroženi krvácením z peristomálních varixů. Ileorektální anastomóza je pak jako chirurgická metoda v tomto případě zcela nevhodná [1,3,17,43,44].
Klíčovým faktorem v problematice chirurgické léčby PSC-IBD je nicméně správné načasování intervence. Případné komplikace výkonu jsou totiž značně odvislé od pokročilosti jaterního onemocnění a pro pacienty ve stadiu jaterní cirhózy s portální hypertenzí věští výrazně horší prognózu. U pacientů vyžadujících kolektomii a zároveň transplantaci pro pokročilou formu PSC je na místě uvažovat o kombinovaném výkonu v jedné době s následnou odloženou ileopouchanální rekonstrukcí po reparaci jaterních funkcí [65].
U pacientů s PSC-IBD je typická výrazně vyšší frekvence pouchitidy. Vyskytuje se u 63–75 % pacientů po kolektomii s IPAA a její projevy (průjmy, krev ve stolici, teploty, urgentní nucení, bolesti břicha) do jisté míry připomínají původní kolitidu. Pouchitida může probíhat akutně i chronicky, a to se setrvalým průběhem či střídáním relapsů a remise [14,25,65]. V terapii akutní pouchitidy jsou jedinou zatím spolehlivě prokázanou účinnou modalitou antibiotika (především ciprofloxacin a metronidazol). Aminosaliciláty a topické steroidy pak lze považovat za léčiva druhé linie (při nedostatečné účinnosti antibiotik), jelikož jejich pozitivní efekt se prozatím neopírá o žádnou studii na dostatečně početném souboru pacientů. Základem léčby chronické pouchitidy, jež je nejčastější příčinou selhání IPAA, jsou opět antibiotika a/nebo budesonid v perorální formě [56,66,67]. K udržení remise či prevenci pouchitidy se pak jako velice vhodná alternativa ukázalo podávání probiotické směsi VSL #3, což stvrzuje i doporučení ECCO [56,68].
Transplantace jater a PSC-IBD
Prakticky jediným kurativním přístupem pro pacienty s PSC de facto zůstává transplantace jater. Těžký průběh PSC vyžadující transplantaci jater je většinou spojen s klidovým průběhem střevního zánětu. Naopak u pacientů se stabilizovaným onemocněním žlučovodů byla ve studii Marelliho et al detekována histologicky výrazně vyšší aktivita v porovnání s pacienty indikovanými k OTJ [69].
Po transplantaci bývá klinický průběh IBD spíše závažnější. Důvodem exacerbace kolitidy či jejího vzniku de novo (14–30 %) mohou být potransplantační změny imunitního systému [3,70] nebo, podle recentní studie [71], cytomegalovirová (CMV) infekce nastoupivší na imunosupresivní terapii. Pacienti, kteří před OTJ prodělali kolektomii, mají výrazně nižší sklon k rekurenci PSC ve štěpu [69]. Právě i na tom lze demonstrovat nesporný imunopatologický vztah mezi játry a střevem.
PSC-IBD a kolorektální neoplazie
Celková prevalence KRK u PSC je přibližně 4,1 %, zatímco u pacientů se současným IBD až 5,8 % [72]. Stejně tak u pacientů s IBD je PSC nezávislým rizikovým faktorem pro vznik KRK. Kolon postižené IBD totiž vykazuje 2–5násobné riziko maligního zvratu oproti běžné populaci, v případě PSC-IBD je riziko dokonce 5–9násobné [73]. Klíčový je i vztah k délce trvání onemocnění. Kumulativní riziko vzniku KRK u PSC-UC v horizontu 10, 20 a 25 let trvání nemoci je 9 %, 31 %, resp. 50 %. U izolované UC je riziko znatelně nižší – 2 %, 5 % a 10 % [74]. Na to, že je PSC rizikovým faktorem pro vývoj kolorektální neoplazie i u pacientů s CD, neexistují zatím dostatečně obsáhlá data. Nedávná studie Bradena et al však naopak překvapivě deklaruje, že přítomnost PSC u pacientů s CD riziko maligního zvratu nezvyšuje. Za rizikový faktor se však dá téměř s jistotou považovat vyšší věk v době prvozáchytu PSC [75].
U pacientů s PSC je medián intervalu mezi diagnózou IBD a detekcí dysplazie či adenokarcinomu kolon přibližně 18 let, medián věku pacientů je asi 42 let. Zároveň se předpokládá, že samostatným rizikovým faktorem je OTJ, po které dle statistik stoupá výskyt kolorektálních neoplazií. Ty bývají u pacientů s PSC lokalizovány povětšinou v pravém kolon, a to až ve ¾ případů, zatímco zbytek připadá na kolon levostranné. U non-PSC-UC je tento poměr přibližně obrácený [3,13,76].
Se zajímavou hypotézou přišla nedávná, nicméně zatím ojedinělá studie z německého Heidelbergu. Ta připisuje zvýšenou pravděpodobnost vzniku kolorektální neoplazie pacientům s nálezem dominantní stenózy žlučovodů při PSC. Toto riziko by ještě umocňoval synchronní výskyt IBD. Kombinace dvou rizikových faktorů by také mohla být kruciální pro rozvoj cholangiocelulárního karcinomu a karcinomu žlučníku [72]. S takovou představou by se však dalo s úspěchem polemizovat už proto, že nemalá část dominantních stenóz vzniká již primárně na maligním podkladě. Hypotéza o významu nálezu dominantní stenózy u rizika kolorektální neoplazie bude v budoucnu nepochybně vyžadovat další podrobnou analýzu.
Míra adherence k současným doporučením v prevenci KRK u pacientů s PSC je různá a vykazuje značné interexpertní rozdíly [77]. V prevenci KRK u pacientů s PSC se obvykle doporučují koloskopie s odběrem biopsií v intervalu jednoho roku [3,13,56]. Metodou volby dle doporučení ECCO je panchromoendoskopie (metoda využívající tkáňová barviva, nejčastěji metylenovou modř a indigokarmín) s cílenými biopsiemi podezřelých lézí. Tato metoda je však pro účely rutinního vyšetření časově značně náročná a obvykle nebývá hrazena pojišťovnami. Jinou doporučovanou alternativou je koloskopie s etážovým odběrem biopsií („random biopsy“) ze čtyř kvadrantů po každých cca 10 cm a s cíleným bioptováním jakýchkoli strukturálních anomálií nápadných i v bílém světle. Spolehlivost této metody v detekci neoplazií je přibližně 90 %, její používání je však poněkud kontroverzní [56]. Několik nedávných studií prokázalo, že většinu intraepiteliálních neoplazií lze zobrazit high-resolution endoskopií s následnými cílenými odběry. Zpracování a vyhodnocování bezmála 50 vzorků při zmíněných etážových biopsiích je navíc velkou zátěží pro tým patologů. Nález dysplazie by měl potvrdit další odborník, než bude uzavřen jako definitivní diagnóza [55].
Již dříve publikovaná data poukazovala na více než 50% riziko progrese LGD do HGD či dokonce KRK v pětiletém horizontu. Názory jednotlivých oborníků nejsou však stran managementu LGD zcela konsenzuální, a vždy proto velmi záleží na rozhodnutí pacienta, s kterým by měly být důkladně probrány všechny v úvahu přicházející terapeutické modality. Už pacientům s unifokální plochou lézí s LGD by měla být nabídnuta (resp. doporučena) profylaktická kolektomie vzhledem k vysoké pravděpodobnosti progrese do stadia karcinomu. V horizontu pěti let je její riziko totiž prakticky srovnatelné s pacienty s mnohočetnými lézemi. Vyvýšené (polypoidní) léze charakteru adenomů s low-grade dysplazií je možné řešit „pouze“ endoskopickou polypektomií, pokud je polyp kompletně odstraněn (R0 resekce – při resekčních okrajích již nejsou žádné reziduální dysplastické změny). Nález HGD je však vždy indikací k časné profylaktické proktokolektomii, případná další neodhalená ložiska HGD či dokonce KRK nelze totiž v takovém případě nikdy s jistotou vyloučit [56,77].
Význam kyseliny ursodeoxycholové u pacientů s PSC
Často diskutovaným tématem je chemoprotektivní účinek kyseliny ursodeoxycholové (UDCA) v prevenci kolorektálních neoplazií. Ten teoreticky spočívá ve zvýšení poměru primárních žlučových kyselin vůči sekundárním (hlavně kyseliny deoxycholové), což podporují mimo jiné i testy na animálních modelech [78]. Zatímco některé studie udávají protektivní efekt UDCA [79,80], jiné benefit v tomto směru neprokázaly [81]. Nejlepší výsledky prokázaly studie s dávkami UDCA mezi 8 a 15 mg/kg/den [79,80]. Co se týče postižení jater PSC, UDCA může zlepšit laboratorní parametry, ale nepředchází vzniku dominantních stenóz vyžadujících endoskopickou intervenci [82]. Právě přítomnost dominantní stenózy výrazně snižuje dobu přežívání, obzvláště pak se současným výskytem IBD [72].
Vysoké dávky UDCA (28–30 mg/kg//den) mohou vést k rozvratu jaterních funkcí, a jsou tedy v léčbě PSC kontraindikovány [83]. Recentní studie navíc prokázala, že vysoké dávky UDCA jsou spojeny také se zvýšeným rizikem vzniku kolorektálního karcinomu, typicky po dvou letech „léčby“ [43]. Zásadní roli v tom pravděpodobně hrají mikrobiota schopná metabolizovat UDCA na sekundární žlučové kyseliny včetně kyseliny litocholové. Nedávná metanalýza z Mayo kliniky [50] předpokládá protektivní efekt v procesu vzniku a progrese pokročilých kolorektálních neoplazií (HGD a KRK), zatímco u LGD dostatečně povzbudivá čísla chybějí. I dle této metaanalýzy se jako optimálními jeví nízké dávky (8–15 mg/kg/den).
Lze konstatovat, že k chemoprotektivnímu účinku UDCA se přiklání většina aktuálních literárních pramenů. Žádná dosavadní data však nebyla vysloveně konkluzivní, a proto tato hypotéza zatím nebyla akceptována paušálně. To dokládá i fakt, že Evropská asociace pro studium jaterních chorob (EASL) u vybraných rizikových skupin užívání UDCA v prevenci KRK doporučuje [84], zatímco Americká asociace (AASLD) nikoli [85].
Závěr
PSC-IBD lze pro jeho mnohá specifika považovat za samostatný fenotyp IBD. Typicky se manifestuje jako pankolitida s dominantním postižením pravostranného kolon a relativně mírným průběhem. Pro udržení remise onemocnění většinou postačují aminosalicyláty. Podávání azathioprinu zde musí být pečlivě zvažováno vzhledem ke zvýšené míře hepatotoxicity. V klinické praxi je významný vysoký neoplastický potenciál onemocnění. Pacienti s PSC-IBD by měli každoročně absolvovat totální kolonoskopické vyšetření s odběrem biopsií. Již u pacientů s nepolypoidní lézí s LGD by měla být zvážena profylaktická kolektomie.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 16. 12. 2013
Přijato: 17. 1. 2014
MUDr. Lukáš Bajer
Klinika hepatogastroenterologie, IKEM
Vídeňská 1958/9, 140 21 Praha 4
lukasbajer1@gmail.com
Zdroje
1. Boonstra K, van Erpecum KJ, van Nieuwkerk KM et al. Primary sclerosing cholangitis is associated with a distinct phenotype of inflammatory bowel disease. Inflamm Bowel Dis 2012; 18(12): 2270–2276. doi: 10.1002/ibd.22938.
2. Lamberts LE, Janse M, Haagsma EB et al. Immune-mediated diseases in primary sclerosing cholangitis. Dig Liver Dis 2011; 43(10): 802–806. doi: 10.1016/j.dld.2011.05.009.
3. Drastich P, Bajer L, Wohl P et al. Transplantace jater pro primární sklerozující cholangitidu. Gastroent Hepatol 2013; 67(5): 413–420.
4. Boonstra K, Weersma RK, van Erpecum KJ et al. Population-based epidemiology, malignancy risk, and outcome of primary sclerosing cholangitis. Hepatology 2013; 58(6): 2045–2055. doi: 10.1002/hep.26565.
5. Krones E, Graziadei I, Trauner M et al. Evolving concepts in primary sclerosing cholangitis. Liver Int 2012; 32(3): 352–369. doi: 10.1111/j.1478-3231.2011.02607.x.
6. Broomé U, Olsson R, Loof L et al. Natural history and prognostic factors in 305 Swedish patients with primary sclerosing cholangitis. Gut 1996; 38(4): 610–615.
7. Escorsell A, Parés A, Rodés J et al. Epidemiology of primary sclerosing cholangitis in Spain. Spanish association for the study of the liver. J Hepatol 1994; 21(5): 787–791.
8. Takikawa H, Takamori Y, Tanaka A et al. Analysis of 388 cases of primary sclerosing cholangitis in Japan; presence of subgroup without pancreatic involvement in older patients. Hepatol Res 2004; 29(3): 153–159.
9. Loftus EV Jr, Sandborn WJ, Lindor KD et al. Interactions between chronic liver disease and inflammatory bowel disease. Inflamm Bowel Dis 1997; 3(4): 288–302.
10. Jorgensen KK, Grzyb K, Lundin KE et al. Inflammatory bowel disease in patients with primary sclerosing cholangitis: clinical characterization in liver transplanted and nontransplanted patients. Inflamm Bowel Dis 2012; 18(3): 536–545. doi: 10.1002/ibd.21699.
11. Halliday JS, Djordjevic J, Lust M et al. A unique clinical phenotype of primary sclerosing cholangitis associated with Crohn’s disease. J Crohns Colitis 2012; 6(2): 174–181. doi: 10.1016/j.crohns.2011.07.015.
12. Lee YM, Kaplan MM. Primary sclerosing cholangitis. N Engl J Med 1995; 332(14): 924–933.
13. Loftus EV Jr, Harewood GC, Loftus CG et al. PSC-IBD: a unique form of inflammatory bowel disease associated with primary sclerosing cholangitis. Gut 2005; 54(1): 91–96.
14. Sinakos E, Samuel S, Enders F et al. Inflammatory bowel disease in primary sclerosing cholangitis: a robust yet changing relationship. Inflamm Bowel Dis 2013; 19(5): 1004–1009. doi: 10.1097/MIB.0b013e3182802893.
15. Ponsioen CY, Vrouenraets SM, Prawirodirdjo W et al. Natural history of primary sclerosing cholangitis and prognostic value of cholangiography in a Dutch population. Gut 2002; 51(4): 562–566.
16. Bergquist A, Montgomery SM, Bahmanyar S et al. Increased risk of primary sclerosing cholangitis and ulcerative colitis in first-degree relatives of patients with primary sclerosing cholangitis. Clin Gastroenterol Hepatol 2008; 6(8): 939–943. doi: 10.1016/j.cgh.2008.03.016.
17. Bergquist A, Lindberg G, Saarinen S et al. Increased prevalence of primary sclerosing cholangitis in patients with ulcerative colitis. Gastroenterology 1991; 100: 1319–1323.
18. Saarinen S, Olerup O, Broomé U. Increased frequency of autoimmune diseases in patients with primary sclerosing cholangitis. Am J Gastroenterol 2000; 95(11): 3195–3199.
19. Yap LM, Ahmad T, Jewell DP. The contribution of HLA genes to IBD susceptibility and phenotype. Best Pract Res Clin Gastroenterol 2004; 18(3): 577–596.
20. Ahmad T, Marshall SE, Jewell D. Genetics of inflammatory bowel disease: the role of the HLA complex. World J Gastroenterol 2006; 12(23): 3628–3635.
21. Donaldson PT, Norris S. Evaluation of the role of MHC class II alleles, haplotypes and selected amino acid sequences in primary sclerosing cholangitis. Autoimmunity 2002; 35(8): 555–564.
22. Satsangi J, Welsh KI, Bunce M et al. Contribution of genes of the major histocompatibility complex to susceptibility and disease phenotype in inflammatory bowel disease. Lancet 1996; 347(9010): 1212–1217.
23. Karlsen TH, Boberg KM, Vatn M et al. Different HLA class II associations in ulcerative colitis patients with and without primary sclerosing cholangitis. Genes Immun 2007; 8(3): 275–278.
24. Kane S, Kisiel J, Shih L et al. HLA disparity determines disease activity through pregnancy in women with inflammatory bowel disease. Am J Gastroenterol 2004; 99(8): 1523–1526.
25. Cholongitas E, Papatheodoridis G, Zappoli P et al. Combined HLA-DR and -DQ disparity is associated with a stable course of ulcerative colitis after liver transplantation for primary sclerosing cholangitis. Liver Transpl 2007; 13(4): 552–557.
26. Karlsen TH, Franke A, Melum E et al. Genome-wide association analysis in primary sclerosing cholangitis. Gastroenterology 2010; 138(3): 1102–1111. doi: 10.1053/j.gastro.2009.11.046.
27. Melum E, Franke A, Schramm C et al. Genome-wide association analysis in primary sclerosing cholangitis identifies two non-HLA susceptibility loci. Nat Genet 2011; 43(1): 17–19. doi: 10.1038/ng.728.
28. Janse M, Lamberts LE, Franke L et al. Three ulcerative colitis susceptibility loci are associated with primary sclerosing cholangitis and indicate a role for IL2, REL, and CARD9. Hepatology 2011; 53(6): 1977–1985. doi: 10.1002/hep.24307.
29. Miao XP, Sun XN, Wei H et al. Crohn’s disease and primary sclerosing cholangitis: a case report and review of the literature. Intern Med 2012; 51(16): 2077–2081.
30. Kekilli M, Tunc B, Beyazit Y et al. Circulating CD4+CD25+ regulatory T cells in the pathobiology of ulcerative colitis and concurrent primary sclerosing cholangitis. Dig Dis Sci 2013; 58(5): 1250–1255. doi: 10.1007/s10620-012-2511-y.
31. Harada K, Ohira S, Isse K et al. Lipopolysaccharide activates nuclear factor-kappaB through toll-like receptors and related molecules in cultured biliary epithelial cells. Lab Invest 2003; 83(11): 1657–1667.
32. Terjung B, Söhne J, Lechtenberg B et al. p-ANCAs in autoimmune liver disorders recognise human beta-tubulin isotype 5 and cross-react with microbial protein FtsZ. Gut 2010; 59(6): 808–816. doi: 10.1136/gut.2008.157818.
33. Roozendaal C, Pogány K, Horst G et al. Does analysis of the antigenic specificities of anti-neutrophil cytoplasmic antibodies contribute to their clinical signifikance in the inflammatory bowel diseases? Scand J Gastroenterol 1999; 34(11): 1123–1131.
34. Hurtado PR, Jeffs L, Nitschke J et al. CpG oligodeoxynucleotide stimulates production of anti-neutrophil cytoplasmic antibodies in ANCA associated vasculitis. BMC Immunol 2008; 9 : 34. doi: 10.1186/1471-2172-9-34.
35. Dobric S, Popovic D, Nikolic M et al. Anti-neutrophil cytoplasmic antibodies (ANCA) specific for one or several antigens: useful markers for subtypes of ulcerative colitis and associated primary sclerosing cholangitis. Clin Chem Lab Med 2011; 50(3): 503–509. doi: 10.1515/CCLM.2011.797.
36. Hov JR, Boberg KM, Karlsen TH. Autoantibodies in primary sclerosing cholangitis. World J Gastroenterol 2008; 14(24): 3781–3791.
37. Lombardi G, Annese V, Piepoli A et al. Antineutrophil cytoplasmic antibodies in inflammatory bowel disease: clinical role and review of the literature. Dis Colon Rectum 2000; 43(7): 999–1007.
38. Mendes FD, Jorgensen R, Keach J et al. Elevated serum IgG4 concentration in patients with primary sclerosing cholangitis. Am J Gastroenterol 2006; 101(9): 2070–2075.
39. Navaneethan U, Venkatesh PG, Choudhary M et al. Elevated immunoglobulin G4 level is associated with reduced colectomy-free survival in patients with primary sclerosing cholangitis and ulcerative colitis. J Crohns Colitis 2013; 7(2): e35–e41. doi: 10.1016/j.crohns.2012.04.006.
40. Virk RK, Lauwers GY, Deshpande V. The significance of IgG4 in inflammatory bowel disease. United States and Canadian Academy of Pathology 2011; [Abstract].
41. Navaneethan U, Venkatesh PG, Kapoor S et al. Elevated serum IgG4 is associated with chronic antibiotic-refractory pouchitis. J Gastrointest Surg 2011; 15(9): 1556–1561. doi: 10.1007/s11605-011-1587-6.
42. Nakazawa T, Naitoh I, Hayashi K et al. Diagnosis of IgG4-related sclerosing cholangitis. World J Gastroenterol 2013; 19(43): 7661–7670. doi: 10.3748/wjg.v19.i43.7661.
43. Eaton JE, Silveira MG, Pardi DS et al. High-dose ursodeoxycholic acid is associated with the development of colorectal neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis. Am J Gastroenterol 2011; 106(9): 1638–1645. doi: 10.1038/ajg.2011.156.
44. Lindström L, Lapidus A, Ost A et al. Increased risk of colorectal cancer and dysplasia in patients with Crohn´s colitis and primary sclerosing cholangitis. Dis Colon Rectum 2011; 54(11): 1392–1397. doi: 10.1097/DCR.0b013e31822bbcc1.
45. Wolf JM, Rybicki LA, Lashner BA. The impact of ursodeoxycholic acid on cancer, dysplasia and mortality in ulcerative colitis patients with primary sclerosing cholangitis. Aliment Pharmacol Ther 2005; 22(9): 783–788.
46. Ikegami T, Matsuzaki Y, Shoda J et al. The chemopreventive role of ursodeoxycholic acid in azoxymethane-treated rats: suppressive effects on enhanced group II phospholipase A2 expression in colonic tissue. Cancer Lett 1998; 134(2): 129–139.
47. Tung BY, Emond MJ, Haggitt RC et al. Ursodiol use is associated with lower prevalence of colonic neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis. Ann Intern Med 2001; 134(2): 89–95.
48. Wali RK, Frawley BP Jr, Hartmann S et al. Mechanism of action of chemoprotective ursodeoxycholate in the azoxymethane model of rat colonic carcinogenesis: potential roles of protein kinase C-alpha, -beta II, and -zeta. Cancer Res 1995; 55(22): 5257–5264.
49. Wohl P, Hucl T, Drastich P et al. Epithelial markers of colorectal carcinogenesis in ulcerative colitis and primary sclerosing cholangitis. World J Gastroenterol 2013; 19(14): 2234–2241. doi: 10.3748/wjg.v19.i14.2234.
50. Singh S, Khanna S, Pardi DS et al. Effect of ursodeoxycholic acid use on the risk of colorectal neoplasia in patients with primary sclerosing cholangitis and inflammatory bowel disease: a systematic review and meta-analysis. Inflamm Bowel Dis 2013; 19(8): 1631–1638. doi: 10.1097/MIB.0b013e318286fa61.
51. Schaeffer DF, Win LL, Hafezi-Bakhtiari S et al. The phenotypic expression of inflammatory bowel disease in patients with primary sclerosing cholangitis differs in the distribution of colitis. Dig Dis Sci 2013; 58(9): 2608–2614. doi: 10.1007/s10620-013-2697-7.
52. Sokol H, Cosnes J, Chazouilleres O et al. Disease activity and cancer risk in inflammatory bowel disease associated with primary sclerosing cholangitis. World J Gastroenterol 2008; 14(22): 3497–3503.
53. Silverberg MS, Satsangi J, Ahmad T et al. Toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a Working Party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005; 19 (Suppl A): 5–36.
54. Broomé U, Löfberg R, Lundqvist K et al. Subclinical time span of inflammatory bowel disease in patients with primary sclerosing cholangitis. Dis Colon Rectum 1995; 38(12): 1301–1305.
55. Annese V, Daperno M, Rutter MD et al. European evidence based consensus for endoscopy in inflammatory bowel disease. J Crohns Colitis 2013; 7(12): 982–1018. doi: 10.1016/j.crohns.2013.09.016.
56. Van Assche G, Dignass A, Bokemeyer B et al. Second European evidence-based consensus on the diagnosis and management of ulcerative colitis part 3: special situations. J Crohns Colitis 2013; 7(1): 1–33. doi: 10.1016/j.crohns.2012.09.005.
57. O´Toole A, Alakkari A, Keegan D et al. Primary sclerosing cholangitis and disease distribution in inflammatory bowel disease. Clin Gastroenterol Hepatol 2012; 10(4): 439–441. doi: 10.1016/j.cgh.2011.11.010.
58. Rojas-Feria M, Castro M, Suárez E et al. Hepatobiliary manifestations in inflammatory bowel disease: the gut, the drugs and the liver. World J Gastroenterol 2013; 19(42): 7327–7340. doi: 10.3748/wjg.v19.i42.7327.
59. Stolfi C, Pallone F, Monteleone G. Colorectal cancer chemoprevention by mesalazine and its derivatives. J Biomed Biotechnol 2012; 980458. doi: 10.1155/2012/980458.
60. Angulo P, Batts KP, Jorgensen RA et al. Oral budesonide in the treatment of primary sclerosing cholangitis. Am J Gastroenterol 2000; 95(9): 2333–23337.
61. Pallavicino F, Pellicano R, Reggiani S et al. Inflammatory bowel diseases and primary sclerosing cholangitis: hepatic and pancreatic side effects due to azathioprine. Eur Rev Med Pharmacol Sci 2013; 17(1): 84–87.
62. Barbero-Villares A, Mendoza J, Trapero-Marugan M et al. Evaluation of liver fibrosis by transient elastography in methotrexate treated patients. Med Clin (Barc) 2011; 137(14): 637–639. doi: 10.1016/j.medcli.2010.12.024.
63. Ghabril M, Bonkovsky HL, Kum C et al. Liver injury from tumor necrosis factor-α antagonists: analysis of thirty-four cases. Clin Gastroenterol Hepatol 2013; 11(5): 558–564. doi: 10.1016/j.cgh.2012.12.025.
64. Hommes DW, Erkelens W, Ponsioen C et al. A double-blind, placebo-controlled, randomized study of infliximab in primary sclerosing cholangitis. J Clin Gastroenterol 2008; 42(5): 522–526. doi: 10.1097/MCG.0b013e3181662426.
65. Poritz LS, Koltun WA. Surgical management of ulcerative colitis in the presence of primary sclerosing cholangitis. Dis Colon Rectum 2003; 46(2): 173–178.
66. Pardi DS, D'Haens G, Shen B et al. Clinical guidelines for the management of pouchitis. Inflamm Bowel Dis 2009; 15(9): 1424–1431. doi: 10.1002/ibd.21039.
67. Gionchetti P, Rizzello F, Poggioli G et al. Oral budesonide in the treatment of chronic refractory pouchitis. Aliment Pharmacol Ther 2007; 25(10): 1231–1236.
68. Gionchetti P, Rizzello F, Venturi A et al. Oral bacteriotherapy as maintenance treatment in patients with chronic pouchitis: a double-blind, placebo-controlled trial. Gastroenterology 2000; 119(2): 305–309.
69. Marelli L, Xirouchakis E, Kalambokis G et al. Does the severity of primary sclerosing cholangitis influence the clinical course of associated ulcerative colitis? Gut 2011; 60(9): 1224–1228. doi: 10.1136/gut.2010.235408.
70. Ho GT, Seddon AJ, Therapondos G et al. The clinical course of ulcerative colitis after orthotopic liver transplantation for primary sclerosing cholangitis: further appraisal of immunosuppression post transplantation. Eur J Gastroenterol Hepatol 2005; 17(12): 1379–1385.
71. Verdonk RC, Haagsma EB, Van Den Berg AP et al. Inflammatory bowel disease after liver transplantation: a role for cytomegalovirus infection. Scand J Gastroenterol 2006; 41(2): 205–211.
72. Rudolph G, Gotthardt D, Kloeters-Plachky P et al. In PSC with dominant bile duct stenosis, IBD is associated with an increase of carcinomas and reduced survival. J Hepatol 2010; 53(2): 313–317. doi: 10.1016/j.jhep.2010.02.030.
73. Jess T, Rungoe C, Peyrin-Biroulet L. Risk of colorectal cancer in patients with ulcerative colitis: a meta-analysis of population-based cohort studies. Clin Gastroenterol Hepatol 2012; 10(6): 639–645. doi: 10.1016/j.cgh.2012.01.010.
74. Broomé U, Löfberg R, Veress B et al. Primary sclerosing cholangitis and ulcerative colitis: evidence for increased neoplastic potential. Hepatology 1995; 22(5): 1404–1408.
75. Braden B, Halliday J, Aryasingha S et al. Risk for colorectal neoplasia in patients with colonic Crohn’s disease and concomitant primary sclerosing cholangitis. Clin Gastroenterol Hepatol 2012; 10(3): 303–308. doi: 10.1016/j.cgh.2011.10.020.
76. Jørgensen KK, Lindström L, Cvancarova M et al. Colorectal neoplasia in patients with primary sclerosing cholangitis undergoing liver transplantation: a Nordic multicenter study. Scand J Gastroenterol 2012; 47(8–9): 1021–1029. doi: 10.3109/00365521.2012.685754.
77. Velayos FS, Liu L, Lewis JD et al. Prevalence of colorectal cancer surveillance for ulcerative colitis in an integrated health care delivery system. Gastroenterology 2010; 139(5): 1511–1518. doi: 10.1053/j.gastro.2010.07.039.
78. Batta AK, Salen G, Holubec H et al. Enrichment of the more hydrophilic bile acid ursodeoxycholic acid in the fecal water-soluble fraction after feeding to rats with colon polyps. Cancer Res 1998; 58(8): 1684–1687.
79. Tung BY, Emond MJ, Haggitt RC et al. Ursodiol use is associated with lower prevalence of colonic neoplasia in patients with ulcerative colitis and primary sclerosing cholangitis. Ann Intern Med 2001; 134(2): 89–95.
80. Pardi DS, Loftus EV Jr, Kremers WK et al. Ursodeoxycholic acid as a chemopreventive agent in patients with ulcerative colitis and primary sclerosing cholangitis. Gastroenterology 2003; 124(4): 889–893.
81. Wolf JM, Rybicki LA, Lashner BA. The impact of ursodeoxycholic acid on cancer, dysplasia and mortality in ulcerative colitis patients with primary sclerosing cholangitis. Aliment Pharmacol Ther 2005; 22(9): 783–788.
82. Stiehl A, Rudolph G, Klöters-Plachky P et al. Development of dominant bile duct stenoses in patients with primary sclerosing cholangitis treated with ursodeoxycholic acid: outcome after endoscopic treatment. J Hepatol 2002; 36(2): 151–156.
83. Lindor KD, Knowdley KV, Luketic VA et al. High-dose ursodeoxycholic acid for the treatment of primary sclerosing cholangitis. Hepatology 2009; 50(3): 808–814. doi: 10.1002/hep.23082.
84. Chapman R, Fevery J, Kalloo A et al. Diagnosis and management of primary sclerosing cholangitis. Hepatology 2010; 51(2): 660–678. doi: 10.1002/hep.23294.
85. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of cholestatic liver diseases. J Hepatol 2009; 51(2): 237–267. doi: 10.1016/j.jhep.2009.04.009.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Trochu IBD na úvodČlánek Projekt RISING STARSČlánek Gastrofórum 2014Článek Správná odpověď na kvízČlánek Autodidaktický test: IBD
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2014 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Fekální kalgranulin C u nemocných s idiopatickými střevními záněty
- Infliximab nezvyšuje riziko časných pooperačních komplikací po trojdobé restorativní proktokolektomii s ileoanálním J-pouchem u nemocných s ulcerózní kolitidou
- Potenciálne škodlivá expozícia radiačnému žiareniu u pacientov s nešpecifickými zápalovými ochoreniami liečenými biologickou liečbou
- Idiopatický střevní zánět u pacientů s primární sklerozující cholangitidou – samostatný fenotyp IBD
- Tuberkulózní ileokolitida – popis případu
- Leading Change in IBD 2014 – konference zaměřená na zlepšení péče o IBD pacienty ukázala perspektivy dalšího vývoje
- Kvíz – plicní komplikace u pacienta s Crohnovou chorobou
- Zlepšuje aplikace probiotik klinické výsledky v kolorektální chirurgii?
- Projekt RISING STARS
- Standardy chirurgické léčby IBD – Karlovy Vary, 6.–9. 11. 2013
- Gastrofórum 2014
-
Gastrofórum 2014, XIX. ročník 28.–31. január 2014
Ochorenia hornej časti tráviaceho traktu – abstrakty - Několik slov k novému ročníku
- Z XIX. Gastrofóra vzhůru do jubilejního výročí v roce 2015
- Trochu IBD na úvod
- Správná odpověď na kvíz
- Životní jubileum profesora Jana Bureše
- Autodidaktický test: IBD
- Karboxymaltóza železa: vysoce efektivní a bezpečná léčba nedostatku železa
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Karboxymaltóza železa: vysoce efektivní a bezpečná léčba nedostatku železa
- Tuberkulózní ileokolitida – popis případu
- Životní jubileum profesora Jana Bureše
-
Gastrofórum 2014, XIX. ročník 28.–31. január 2014
Ochorenia hornej časti tráviaceho traktu – abstrakty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



