-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Eozinofilní ezofagitida
Autoři: MUDr. Vanková Marie 1; MUDr. Klozar Jiří 2
Působiště autorů: Interní oddělení, Klatovská nemocnice a. s. 1; Oddělení TRN, Klatovská nemocnice a. s. 2
Vyšlo v časopise: Svět praktické medicíny, 5, 2023, č. 3, s. 46-50
Kategorie: Medicína v ČR: přehledový článek
Souhrn
Eozinofilní ezofagitida je onemocnění jícnu, které nebylo známo příliš dlouho. Teprve na počátku 90. let 20. století ji poprvé nezávisle na sobě popsali dva lékaři, profesor Stephen Attwood z Anglie a Alex Straumann ze Švýcarska. Od té doby se v celém průmyslovém světě objevilo mnoho případů eozinofilní ezofagitidy – a trend je stoupající. Jde o chronické autoimunitní onemocnění jícnu, které vede k zánětu jícnu s převahou eozinofilů a může způsobovat příznaky podobné refluxu, dysfagii a uvíznutí sousta. Výzkum stále probíhá a pravděpodobně povede k revizi diagnostiky a léčby eozinofilní ezofagitidy. Diagnóza se stanoví endoskopicky pomocí biopsie. Léčba zahrnuje inhibitory protonové pumpy, lokální kortikosteroidy, změnu stravy a někdy i pneumatickou dilataci jícnu.
Eozinofilní ezofagitida je stále častěji diagnostikovaným onemocněním, které může začít kdykoli v dětství až mladé dospělosti; příležitostně se projevuje i u starších dospělých. Nazývá se také „jícnové astma“. Častěji se vyskytuje u mužů. Podle kvalifikovaných odhadů trpí eozinofilní ezofagitidou přibližně jeden člověk z každých 2500 až 4000 obyvatel. Počet nehlášených případů je však pravděpodobně ještě vyšší, protože ne u každého člověka postiženého eozinofilní ezofagitidou je stanovena diagnóza.
Předpokládá se, že příčinou eozinofilní ezofagitidy je imunitní reakce na potravinové antigeny u pacientů s genetickou náchylností, ale roli mohou hrát i alergeny z prostředí. Neléčený chronický zánět jícnu může nakonec vést ke stenóze jícnu. Jde o stav považovaný za pozdní projev tzv. alergického pochodu, tj. procesu, který má počátek v důsledku výskytu alergických onemocnění v časném dětském věku, obvykle do prvních pěti let. Typicky se nejprve objeví kožní alergie jako atopická dermatitida, následovaná potravinovou alergií a respirační alergií jako například astmatem. Eozinofilní ezofagitida je také popsána jako možná komplikace perorální imunoterapie podávané v léčbě potravinových alergií nebo sublingvální imunoterapie aplikované při léčbě astmatu či alergické rýmy.
Výchozím bodem onemocnění jsou nediferencované T-buňky, které se nacházejí ve sliznici jícnu (Obr. 1). Ty jsou u postižených jedinců přítomny ve (značně) zvýšeném počtu. Když antigeny jako potravinové alergeny, alergeny z prostředí nebo imunogenní noxy zasáhnou sliznici, aktivují se antigen prezentující buňky.
Obr. 1. Histologický snímek eozinofilní ezofagitidy – nediferencované T-buňky, ve sliznici jícnu. 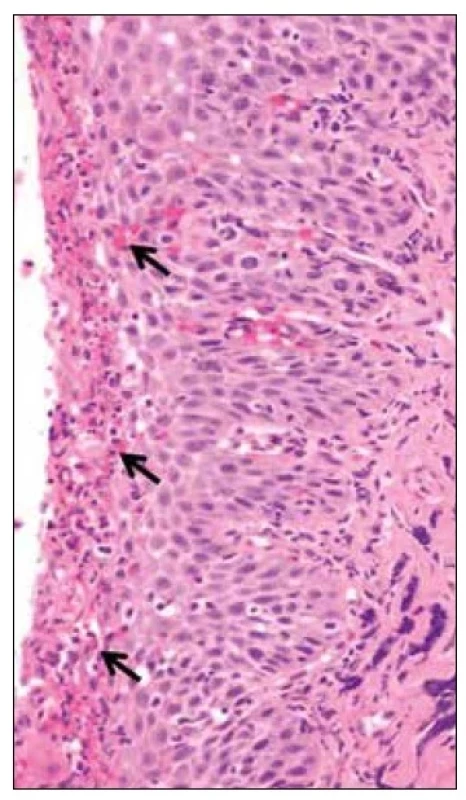
[Foto: archiv autorů] Skutečnost, že je tato interakce možná, je pravděpodobně způsobena změněnými vlastnostmi propustnosti jícnového epitelu. Antigen prezentující buňky vylučují zejména IL-1, a tím aktivují klidové T-lymfocyty, které proliferují v pomocné T-lymfocyty. Ty vylučují IL-4, IL-5 a IL-13, čímž přitahují eozinofilní granulocyty, bazofilní granulocyty a žírné buňky. Kromě toho IL-4 a IL-13 zajišťují prodloužené přežívání T-buněk a snadnější migraci eozinofilních granulocytů do sliznice.
Migrující buňky nepocházejí z jícnu, ale z CD34 pozitivních prekurzorových buněk kostní dřeně. Jícen je ve fyziologickém stavu bez eozinofilních granulocytů. Uvolnění eozinofilních granulocytů má různé důsledky: Za prvé samy vylučují cytokiny, které přitahují další eozinofilní granulocyty. Tento mechanismus je zprostředkován MAdCAM-1 (adhezivní molekula 1 slizničních vaskulárních adhezivních buněk)*. Za druhé se uvolňuje TGF-ß, což vede k fibróze a remodelaci tkáně. Tato permanentní zánětlivá reakce vede k remodelaci, která v důsledku změny morfologie způsobuje dysfagii. U kojenců a dětí se může objevit odmítání potravy, zvracení, úbytek hmotnosti, bolesti břicha a/nebo bolesti na hrudi. U dospělých je občas prvním projevem uvíznutí potravy v jícnu a většina pacientů má dysfagii. Mohou se objevit příznaky gastroezofageální refluxní choroby (GERD). Pacienti mají často projevy dalších atopických onemocnění (např. astma, ekzém, alergická rýma).
Typický pacient s eozinofilní ezofagitidou má dysfagii při příjmu pevné potravy a v anamnéze atopii. O diagnóze eozinofilní ezofagitidy se uvažuje také tehdy, když se refluxní příznaky nezlepší při inhibici sekrece kyseliny. Mělo by se o ní uvažovat také u dospělých s projevy jícnové impakce potravy nebo u dospělých s nekardiální bolestí na hrudi.
Diagnostika
Ústřední roli v diagnóze zaujímají endoskopie s biopsií. Pro stanovení diagnózy je nutná endoskopie s biopsií prokazující eozinofilní infiltraci (≥ 15 eozinofilů/ zorné pole). Přestože při endoskopii mohou být patrné viditelné změny (např. lineární brázdy, striktury, naskládané kruhové prstence, ztráta cévních značek, bílé exsudáty) (Obr. 2), makroskopický vzhled může být normální, proto je biopsie nezbytná. Vzhledem k tomu, že GERD může způsobovat také eozinofilní infiltráty, měly by být u pacientů s dominancí refluxní symptomatologie vzorky z proximálního a středního jícnu zpracovávány odděleně od vzorků z distálního jícnu.
Obr. 2. Endoskopický snímek eozinofilní ezofagitidy. 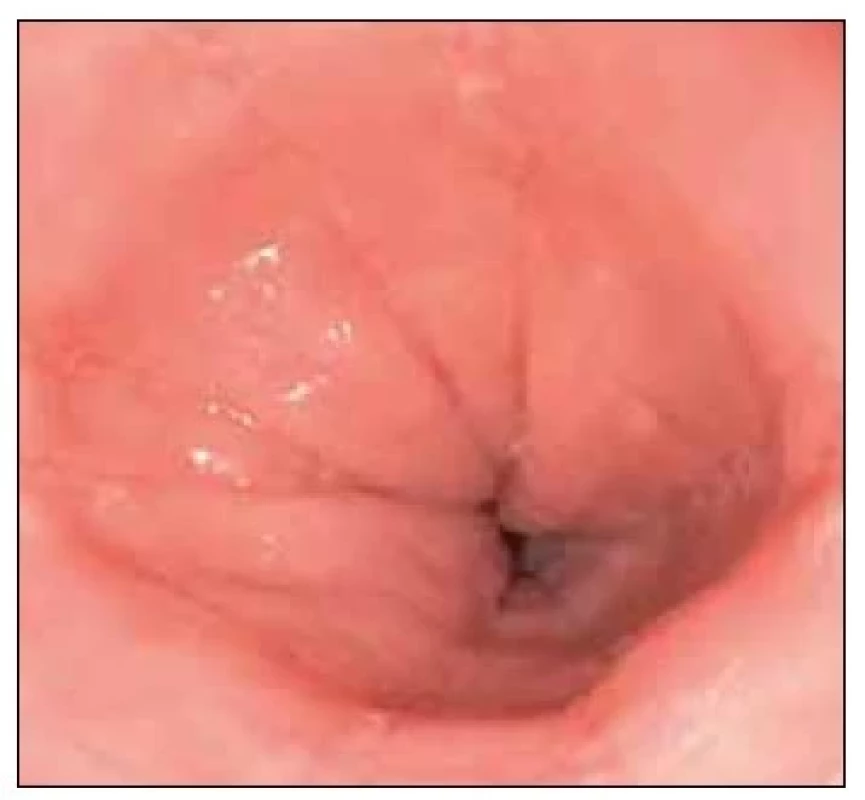
[Foto: archiv autorů] V případě jícnové dysfagie je prvním diagnostickým krokem horní endoskopie. Biopsie jícnu by měla být odebrána u všech osob s dysfagií, i když se endoskopie jeví bez pozoruhodností. Vzhledem k tomu, že eozinofilní zánět je často nerovnoměrný, doporučuje se odebrat alespoň tři biopsie z distálního jícnu a tři biopsie z proximálního jícnu – nejlépe z oblastí s lézemi typickými pro eozinofilní ezofagitidu. Při této strategii biopsie je pravděpodobnost odhalení EoE až 95 %. V rámci endoskopie při počáteční diagnóze by měly být odebrány také biopsie ze žaludku a duodena, které by měly být vyšetřeny na přítomnost eozinofilní infiltrace, Helicobacter pylori a celiakie. Vzhledem k tomu, že eozinofilní infiltrace sama o sobě je nespecifická, měly by být zvažovány i následující stavy: gastroezofageální refluxní choroba, infekce jícnu (Candida, herpes simplex), celiakie, achalázie, postižení jícnu v souvislosti s Crohnovou chorobou a parazitózy.
V klinické praxi je důležité zejména odlišení od gastroezofageální refluxní choroby (GERD). GERD je nejen velmi častá a spojená s alespoň částečně se překrývajícím klinickým obrazem, ale je pravděpodobně zdaleka nejdůležitější příčinou a diferenciální diagnózou vysoké hustoty eozinofilů v biopsiích jícnu. Proto ne každé zvýšení eozinofilů lze ztotožňovat s eozinofilní ezofagitidou. Zejména v případě distálně zvýrazněné eozinofilie ve spojení s typickým klinickým fenotypem pro GERD je tato diagnóza pravděpodobnější. Situaci dále komplikuje skutečnost, že EoE a GERD se nevylučují a nezřídka se mohou vyskytovat jako souběžné stavy. Přestože endoskopické změny jsou často působivé, nejsou zatím součástí diagnostických kritérií. Pro EoE jsou však typické následující endoskopické příznaky:
• edém sliznice (snížené cévní označení),
• kruhové prstence („trachealizace“),
• bílé exsudáty (mikroskopicky odpovídají granulocytárním infiltrátům a nesmí být zaměňovány se soorem),
• protáhlé brázdy,
• striktury.
Laboratorní analýzy mají v diagnostice EoE pouze podružný význam – v zásadě nejsou pro stanovení diagnózy ani nezbytné: diferenciální rozpočet ukazuje mírnou eozinofilii asi v 50 % případů a celková hladina IgE je zvýšená v důsledku alergických komorbidit asi u 70 % postižených. Zobrazovací vyšetření (např. výpočetní tomografie, pasáž jícnem) a funkční vyšetření (např. manometrie, pH-metrie, měření distenzibility) jsou indikována pouze v případech nejasné diagnózy a v rámci studií.
Terapeutické možnosti
V léčbě EoE existují dva důležité terapeutické cíle:
• kontrola příznaků, a tím zlepšení kvality života,
• kontrola zánětu s prevencí komplikací a remodelace.
K dosažení těchto cílů jsou k dispozici tři hlavní terapeutické pilíře:
1. léky:
• lokální kortikosteroidy,
• inhibitory protonové pumpy (u mírnějších forem),
• biologika,
2. dieta – jako kauzální terapeutický přístup,
3. „dilatace“ (rozšíření jícnu) – v případě striktur.
EoE lze obvykle úspěšně léčit oběma výše uvedenými léky a dietami. Obojí představuje základní terapii EoE. Dilatace je další možností terapie v pokročilém stadiu onemocnění se strikturami, pokud příznaky přetrvávají i přes úspěšnou protizánětlivou léčbu léky nebo dietou. Která z metod by měla být použita, záleží na přání a možnostech postiženého a jeho ošetřujícího lékaře. Podrobné informace, společné rozhodnutí o terapii a dobrý vztah mezi lékařem a pacientem jsou základními předpoklady úspěchu dlouhodobé terapie, která je obvykle nezbytná.
pozn. pod čarou
* U zánětlivých střevních onemocnění může být MAdCAM-1 zvýšeně exprimován na endoteliálních buňkách střevní sliznice a střevní lymfatické tkáni, což vede k nadměrnému zánětu ve střevě. Potenciálním terapeutickým cílem pro léčbu těchto onemocnění by mohly být molekuly MAdCAM-1, které jsou exprimovány na těchto buňkách a přivádějí lymfocyty. Jedním z příkladů potenciální terapie je plně humánní monoklonální protilátka ontamalimab, která se zaměřuje na MAdCAM-1 a váže se na něj, čímž mu brání v interakci s integriny na povrchu lymfocytů.
Kortikosteroidy
Lokálně působící kortikosteroidy se ukázaly být nejúčinnějšími léky pro léčbu eozinofilního zánětu. Pomocí těchto přípravků lze velmi spolehlivě léčit příznaky, zánět i dlouhodobé komplikace EoE. I přes svůj status off-label jsou proto lokálně působící kortikoidní přípravky již několik let léky první volby pro léčbu EoE. Jako účinné se v léčbě EoE ukázaly jak polykaný flutikason-propionát (500–1000 μg/den), tak perorální viskózní budesonid (1000 až 2000 μg/den). Tyto čistě lokálně působící kortikoidní preparáty jsou naštěstí přinejmenším stejně účinné jako klasické perorální kortikosteroidy, ale mají výrazně méně nežádoucích účinků.
Prvním a zatím jediným schváleným lokálně působícím přípravkem pro léčbu EoE na světě je budesonid ve formě dispergovatelných tablet (schválen pro užívání od 18 let věku). Má speciální galeniku a byl vyvinut speciálně pro léčbu EoE u dospělých. Tající tableta se rozpouští v ústech a šumivé částice, které obsahuje, stimulují tok slin. Sliny se svými mucinovými složkami mají adhezivní vlastnosti, a jsou tak ideálním prostředkem pro účinnou látku, která může rozvinout svůj léčebný účinek na sliznici jícnu. Díky této nové formě podání lze dosáhnout vysoké míry remise – až 90 % při indukční léčbě a 75–80 % při udržovací léčbě. Stejně jako u všech lokálně aplikovaných kortikoidních přípravků by se po dobu nejméně 30 minut po podání neměly přijímat žádné tekutiny ani potrava. Pokud je však lokální léčba léky po dosažení cílů terapie přerušena, obvykle dojde během několika týdnů až měsíců k relapsu. Je proto třeba plánovat dlouhodobou léčbu. Naštěstí zatím nic nenasvědčuje tomu, že by lokálně účinné kortikosteroidy po letech užívání ztrácely svůj účinek nebo vedly k systémovým nežádoucím účinkům, jako je potlačení osy nadledvin nebo osteoporóza. Na tyto nežádoucí účinky je však třeba se speciálně zaměřit u zranitelných postižených jedinců, jako jsou děti ve fázi růstu, a také při dlouhodobém užívání vysokých dávek. Hlavním nežádoucím účinkem, s četností asi 15 % případů, je soor.
Inhibitory protonové pumpy
Přibližně třetina všech pacientů s EoE také klinicky i histologicky reaguje na léčbu inhibitory protonové pumpy (PPI). Vzhledem k tomu, že neexistují studie, ve kterých by byla tato léčba porovnávána s placebem, nelze se přesněji vyjádřit k účinnosti při dlouhodobé léčbě. IPP jsou schváleny jako antisekretorika, ale nikoliv pro terapii EoE. Přesto lze PPI u EoE používat díky jejich příznivému bezpečnostnímu profilu a účinnosti, ale v případě absence účinnosti nebo nedostatečné účinnosti je třeba přejít na spolehlivější terapeutické možnosti.
Biologika
Vzhledem k tomu, že malou část osob s EoE nelze uspokojivě léčit výše uvedenými konvenčními léky, hledají se další nekortikoidní léky. Nejslibnější výsledky zatím vykazuje blokování působků, jako jsou interleukin-13 (IL-13) a interleukin-4 (IL-4), které hrají klíčovou roli při rozvoji eozinofilního zánětu, pomocí monoklonálních protilátek (biologik), např. dupilumabu (protilátka proti IL-4/anti-IL-13), cendakimabu (protilátka proti IL-13).
Diety
Dietní léčba EoE je teoreticky atraktivní, protože je kauzální a dosahuje dvou terapeutických cílů – kontroly symptomů a omezení zánětu bez léků.
Elementární strava – zcela bezbílkovinná dieta s použitím vyvážených roztoků aminokyselin je velmi účinnou léčbou EoE s dobrou 90% mírou remise. Tento léčebný přístup poskytuje důkaz, že EoE je v naprosté většině případů vyvolána bílkovinami z potravy. Bohužel tyto nutriční roztoky nejsou právě chutné a jsou také drahé. Elementární diety se proto používají především u těžkých forem EoE. Vzhledem k tomu, že dlouhodobé užívání je obtížné, jakmile je EoE pod kontrolou, podává se následně kontrolovaná dieta.
Eliminační dieta založená na alergologickém testu
Pokud jde o eliminační diety založené na alergologických testech, jak bylo uvedeno výše, v současné době bohužel nemáme k dispozici žádné spolehlivé alergologické testy, které by umožnily identifikovat vyvolávající alergeny. Proto se v současné době alergologické testy před plánovanou dietou nedoporučují.
Empirická eliminační dieta
Při empirické eliminační dietě se vynechávají hlavní alergizující potraviny, aniž by pacient nejprve podstoupil alergologické vyšetření. Na základě studií víme, že nejčastějšími spouštěči EoE jsou mléko (bílkoviny) (60 %), pšenice/lepek (50 %), ořechy (10 %), vejce (10 %) a méně často sója a ryby/mořské plody. Pokud se všech šest těchto kategorií potravin vynechá, nazývá se dieta 6-FED (six-food elimination diet), tato dieta má dobrou 70% úspěšnost u dětí i dospělých. Pokud je EoE touto relativně náročnou dietou úspěšně vyléčena, je následně učiněn pokus o opětovné zavedení jednotlivých kategorií potravin pod endoskopickou kontrolou. Tímto principem step-down se nakonec podaří identifikovat alergizující potraviny. Tento postup je však časově náročný a vyžaduje opakované endoskopie. Další možností je často upřednostňovaný princip step-up, při kterém se vynechává pouze jedna nebo dvě kategorie potravin (1-FED, resp. 2-FED), přičemž se vybírají nejčastěji alergizující potraviny (mléko nebo pšenice). Studie ukazují, že účinnost 1-FED a 2-FED se pohybuje mezi 20 a 50 %.
Vzhledem k tomu, že kritickými potravinami jsou většinou základní potraviny, je dietní léčba EoE pro nemocné i lékaře náročná. Měla by se proto zavádět pouze vyškolenými dietology u zvláště motivovaných jedinců. Doporučuje se vhodné sledování účinnosti pomocí endoskopických a histologických metod. EoE bohužel nelze vyléčit ani pomocí diety, protože k recidivám pravidelně dochází během několika dní po požití vyvolávající potraviny.
Endoskopická dilatační léčba
Neléčená EoE často časem vede k zúžení jícnu (striktuře). Pokud příznaky přetrvávají i přes protizánětlivou léčbu léky nebo dietou, lze jícen během endoskopie opatrně rozšířit pomocí bougie nebo balonku. Zánětlivý proces obvykle postihuje celou délku jícnu, dilatace musí být prováděna s opatrností a ve více sezeních. Dilatační léčba by však měla být vždy kombinována se základní protizánětlivou léčbou.
Dlouhodobá léčba a compliance
EoE zatím nelze vyléčit ani léky, ani dietou. Bohužel pokud se protizánětlivá terapie přeruší, zánět se obvykle po několika dnech až týdnech znovu objeví s následnými potížemi. Po úspěšné indukční léčbě je proto nutná udržovací léčba. Korelace mezi příznaky a histologickou/ endoskopickou aktivitou je špatná, takže i asymptomatičtí pacienti s EoE vyžadují pravidelné endoskopické sledování. Po potvrzení remise by měla být endoskopická kontrola prováděna každý jeden až dva roky.
Závěr
Eozinofilní ezofagitida je vzácnou, ale velmi pravděpodobně i poddiagnostikovanou skupinou onemocnění. Zejména u pacientů s atopickými projevy (astma, atopický ekzém, senná rýma, potravinové alergie) je třeba vždy pomýšlet na tuto diagnózu, dále i u pacientů se zvažovanou diagnózou GERD bez reakce na podávání PPI.
I výrazná dysfagie může zpočátku zůstat skrytá kvůli adaptačním strategiím (vyhýbání se špatně tolerovaným potravinám, zvýšené pití při jídle, dlouhé žvýkání) a individuálním návykům. Velký význam má proto pečlivá anamnéza s cíleným dotazováním. Endoskopické nálezy jsou často nespecifické, a proto mohou být přehlédnuty! Při podezření na eozinofilní ezofagitidu u lékaře, který není endoskopista, je třeba zjistit, zda při předchozích gastroskopiích byla odebrána biopsie jícnu. Pokud klinické podezření přetrvává, je třeba zvážit reendoskopii se specifickým dotazem na eozinofilní ezofagitidu (EoE). Přítomnost eozinofilní ezofagitidy by měla být zvážena také v případě nejasných retrosternálních příznaků (křeče, tlak, bolest, pálení), které obvykle souvisejí s jídlem a zřídka s námahou, ale vyskytují se i v klidu, zejména u osob trpících atopií.
Jedinci s typickou anamnézou dysfagie, ale bez histologického průkazu eozinofilie nebo jiných organických příčin dysfagie (např. achalázie), by měli být odesláni do specializovaného centra se zkušeností v diagnostice imunitně zprostředkované ezofagitidy.
MUDr. Marie Vanková
Interní oddělení, Klatovská nemocnice a.s.
MUDr. Jiří Klozar
Oddělení TRN, Klatovská nemocnice a.s.
Zdroje
1. Attwood SE, Smyrk TC, Demeester TR, et al. Esophageal eosinophilia with dysphagia. A distinct clinicopathologic syndrome. Dig Dis Sci 1993;38 (1):109–116. doi: 10.1007/BF01296781.
2. Arias Á, Pérez-Martínez I, Tenías JM, et al. Systematic review with meta - -analysis: the incidence and prevalence of eosinophilic oesophagitis in children and adults in population-based studies. Aliment Pharmacol Ther 2016;43(1):3–15.
3. Cello JP. Eosinophilic gastroenteritis – a complex disease entity. Am J Med 1979;67 : 1097–1104.
4. Children’s Hospital of Philadelphia. „Children with existing allergies should be screened for an emerging, severe chronic food allergy: Eosinophilic esophagitis joins the ‚allergic march‘ of early childhood.“ ScienceDaily. ScienceDaily, 25 June 2018. Dostupné na: https://www.sciencedaily.com/releases/ 2018/06/180625122431.htm.
5. Jensen ET, Martin CF, Kappelman MD, et al. Prevalence of eosinophilic gastritis, gastroenteritis, and colitis: estimates from a national administrative database. J Pediatr Gastroenterol Nutr 2016;62 : 36–42.
6. Kinoshita Y, et al. Eosinophilic gastrointestinal diseases – Pathogenesis, diagnosis, and treatment. Allerg Int 2019;68 : 420–429.
7. Lucendo AJ, Molina-Infante J, Arias Á, et al. Guidelines on eosinophilic esophagitis: Evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterol J 2017;124 : 205064061668952.
8. Menclová A, et al. Nové možnosti léčby eozinofilní ezofagitidy pomocí magistraliter připravovaného léčiva. Prakt Lékáren 2016;12(1):26–28. doi: 10.36290/lek.2016.006.
9. Molina-Infante J, Lucendo AJ. Dietary therapy for eosinophilic esophagitis. J Allergy Clin Immunol 2018;142(1):41–7.
10. Noel RJ, Putnam PE, Rothenberg ME. Eosinophilic esophagitis. N Engl J Med 2004;351 : 940–941.
11. Safroneeva E, Saner C, Rossel JB, et al.; Swiss EoE Cohort Study Group. Cohort Profile: The Swiss Eosinophilic Esophagitis Cohort Study (SEECS). Inflamm Intest Dis 2018;2(3):163–70.
12. Spergel JM, Book WM, Mays E, et al. Variation in prevalence, diagnostic criteria, and initial management options for eosinophilic gastrointestinal diseases in the United States. J Pediatr Gastroenterol Nutr 2011;52 : 300–306.
13. Straumann A, Katzka DA. Diagnosis and treatment of eosinophilic esophagitis. Gastroenterology 2018;154(2):346–59.
14. Straumann A, Lucendo AJ, Miehlke S, et al. Budesonide orodispersible tablets maintain remission in a randomized, placebo-controlled trial of patients with eosinophilic esophagitis. Gastroenterology 2020;159 (5):1672–85.e5.
15. Votto M, De Filippo M, Caminiti L, et al. Eosinophilic gastrointestinal disorders and allergen immunotherapy: Lights and shadows. Pediatr Allergy Immunol 2021;32(5):814–823. doi: 10.1111/pai.13458. Epub 2021 Feb 27. PMID: 33503273. Dostupné na https://pubmed.ncbi.nlm.nih. gov/33503273/
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Úvodní slovo
- Osteoporóza: nejčastější otázky a odpovědi
- Komentář k článku Osteoporóza: nejčastější otázky a odpovědi
- Hemoroidální onemocnění ve zkratce
- Chronická žilní insuficience jako podceňovaná diagnóza
- Současná diagnostika a léčba chronického žilního onemocnění dolních končetin
- Endotel a mikrocirkulace v klinické praxi
- Současnost chirurgie štítné žlázy
- Cholecystolitiáza, komplikace a aktuální pohled z hlediska chirurgie
- Eozinofilní ezofagitida
- Adrenalin je součástí každého operačního výkonu
- Chronická pankreatitida
- Postavení léčivého přípravku Gaspan v léčbě gastrointestinálních obtíží
- Ultrazvuk plic při akutních stavech – kazuistiky
- Rimegepant v léčbě migrenózních stavů
- Co vyplývá ze studií s inklisiranem?
- Ten správný čas na fixní kombinaci ramipril/amlodipin
- Rybelsus: nejúčinnější perorální antidiabetikum mohou použít lékaři všech specializací
- Vakcinace dospělých v ČR: Co brání vyšší proočkovanosti?
- Nové registrace EMA
- Znalostní test: 2 kredity ČLK
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rybelsus: nejúčinnější perorální antidiabetikum mohou použít lékaři všech specializací
- Eozinofilní ezofagitida
- Chronická pankreatitida
- Cholecystolitiáza, komplikace a aktuální pohled z hlediska chirurgie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



