-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Osteoporóza: nejčastější otázky a odpovědi
Autoři: Kira Harris, PharmD 1; Christopher A. Zagar, MD 1; Kelley V. Lawrence, MD 2
Působiště autorů: University of North Carolina School of Medicine Novant Health Charlotte Campus, Charlotte, North Carolina ; Campbell University Jerry M. Wallace School of Osteopathic Medicine, Lillington, North Carolina ; University of North Carolina School of Medicine, Chapel Hill, North Carolina ; Atrium Health One Health, Huntersville, North Carolina 1; Novant Health Family Medicine Residency Program, Cornelius, North Carolina 2
Vyšlo v časopise: Svět praktické medicíny, 5, 2023, č. 3, s. 10-17
Kategorie: Medicína ve světě: Překladový článek s komentářem
Souhrn
Osteoporóza postihuje 10,2 % dospělých starších 50 let a očekává se nárůst na 13,6 % do roku 2030. Osteoporotické zlomeniny, konkrétně zlomeniny proximálního femuru, významně ovlivňují morbiditu, mortalitu a kvalitu života. U všech žen ve věku 65 let a starších nebo u žen po menopauze s rizikovými faktory by měl být zvážen screening osteoporózy pomocí celotělové kostní denzitometrie (DXA). Bone Health and Osteoporosis Foundation doporučuje provádět screening mužů ve věku 70 let a starších a mužů s klinickými rizikovými faktory; U.S. Preventive Services Task Force (USPSTF) však nenašla dostatečné důkazy na podporu rutinního screeningu u mužů. Diagnóza osteoporózy je definována buď T-skóre ≤ −2,5 nebo podle přítomnosti osteoporotické zlomeniny.
Všem pacientům s osteoporózou by mělo být doporučeno cvičení s vlastní vahou těla, střídmý příjem alkoholu a doplnění vápníku a vitaminu D. Volba léčby osteoporózy závisí na riziku zlomeniny u pacienta, efektu léků a snížení rizika zlomenin a bezpečnosti léčby. U pacientů s vysokým rizikem zlomenin je třeba zvážit léčbu antiresorpčními přípravky, to jest bisfosfonáty a denosumabem. Anabolické látky jako teriparatid, abaloparatid a romosozumab by měly být zváženy u pacientů s velmi vysokým rizikem nebo s předchozími zlomeninami obratlů.
Za článkem následuje komentář
V roce 2010 byla incidence osteoporózy 10,2 % u lidí starších 50 let a na základě předpokládaného demografického vývoje populace se očekává, že do roku 2030 dosáhne 13,6 %.1 Ve Spojených státech se ročně objeví přibližně 2 až 3 miliony osteoporotických zlomenin, což může významně ovlivnit nemocnost, úmrtnost a kvalitu života.2
Zlomeniny proximálního femuru mohou být obzvláště devastující a jsou spojeny s jednoročním rizikem úmrtí 21 až 24 %.3 Vhodná detekce a léčba může snížit rizika a související komorbidity.
Jaká jsou současná doporučení pro screening osteoporózy?
Celotělová kostní denzitometrie založená na principu dvouenergiové rentgenové absorpciometrie (DXA) se doporučuje všem ženám ve věku 65 let a starším nebo ženám mladším 65 let, které mají po menopauze a mají klinické rizikové faktory pro vznik osteoporotických zlomenin.
Přestože USPSTF (U.S. Preventive Services Task Force) nedoporučuje rutinní screening u mužů, Bone Health and Osteoporosis Foundation doporučuje screening u mužů ve věku 70 let a starších.
Shrnutí důkazů
USPSTF, Bone Health and Osteoporosis Foundation a American Association of Clinical Endocrinologists/American College of Endocrinology (AACE/ ACE) doporučují měření denzity kostního minerálu (BMD) pomocí DXA pro všechny ženy ve věku 65 let a starší (Tab. 1).4–6 Ženy mladší než 65 let, které jsou po menopauze, by měly podstoupit posouzení rizika vzniku osteoporózy, včetně vyhodnocení klinických rizikových faktorů a posouzení rizika zlomenin, k rozhodnutí o indikaci k DXA4–6 (Tab. 24–5). Nejpoužívanějším nástrojem hodnocení je Fracture Risk Assessment Tool (FRAX; https://www.sheffield. ac.uk/FRAX); existuje však určitá kontroverze o podcenění rizika u některých ras (černošské, asijské, hispánské) a relativně nízké citlivosti. FRAX odhaduje 10leté riziko závažných osteoporotických zlomenin a zlomenin proximálního femuru a měl by být použit jako součást celkového hodnocení rizika.7–10
Tab. 1. Doporučení pro testování denzity kostního minerálu 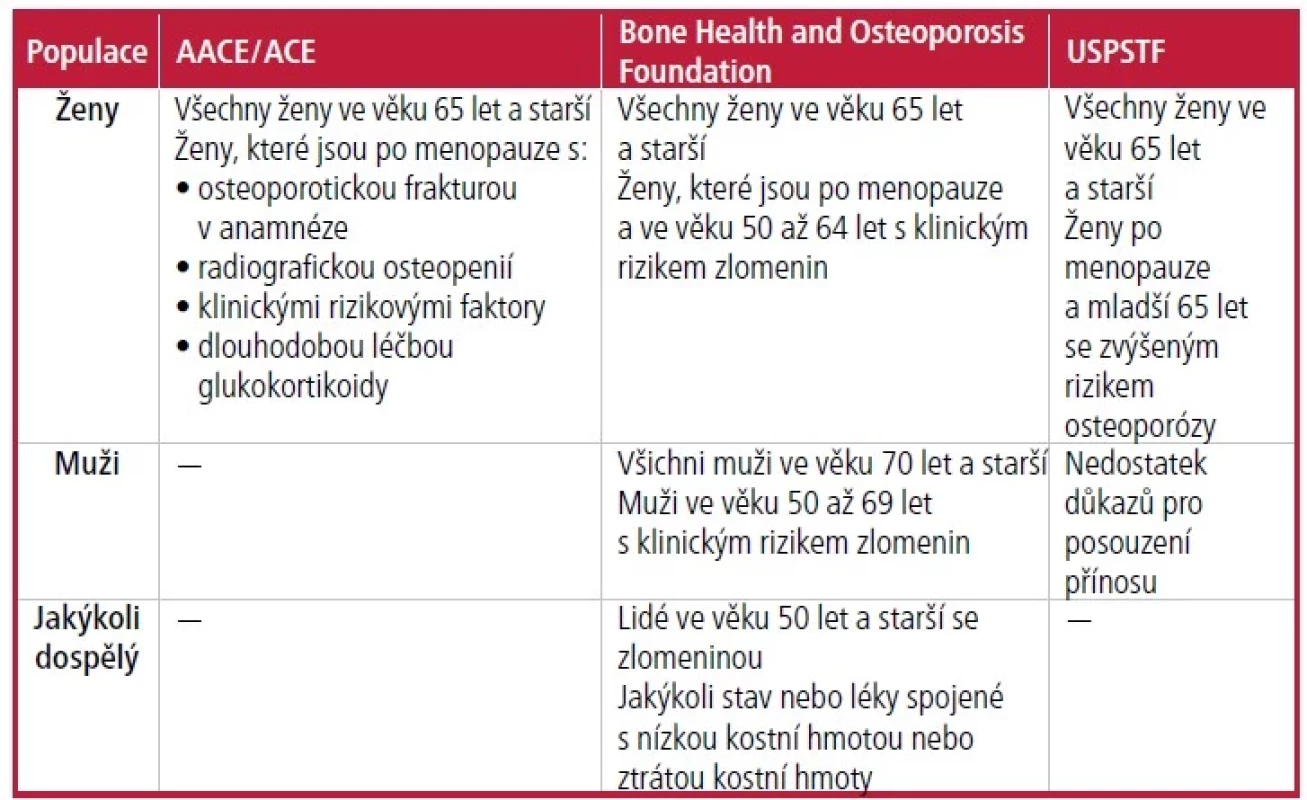
Poznámka: Doporučení na základě pohlaví se týkají pohlaví přiřazeného při narození.
AACE/ACE = Americká asociace klinických endokrinologů/Americká vysoká škola endokrinologie; USPSTF = US Preventive Services Task Force.
Informace z odkazů 4–6.Nejlepší postupy v preventivní medicíně 
DXA – dvojitá rentgenová absorpciometrie
Zdroj: Další informace o Choosing Wisely najdete na https://www.choosingwisely.org.
Podporu citací a vyhledávání doporučení Choosing Wisely relevantních pro primární péči naleznete na https://www. aafp.org/afp/recommendations/search.htm.Tab. 2. Rizikové faktory primární a sekundární osteoporózy 
Informace z odkazů 4 a 5. V klinické studii použití skóre FRAX ke stanovení potřeby DXA zlepšilo procento pacientů léčených po jednom roce a snížilo počet fraktur kyčle o 28 % (p = 0,002).11 USPSTF neshledal přínos rutinního screeningu BMD u mužů; nadace Bone Health and Osteoporosis Foundation však doporučuje provádět screening mužů ve věku 70 let a starších a mužů s vysokým klinickým rizikem.5, 6 Skóre odhadu rizika osteoporózy u mužů používá k posouzení rizika věk, hmotnost a anamnézu chronické obstrukční plicní nemoci; určuje potřebu DXA u mužů a je citlivější, ale méně specifické než skóre FRAX.10
Jak se stanoví diagnóza osteoporózy
Osteoporóza je diagnostikována na základě BMD (T-skóre −2,5 nebo méně na DXA) nebo přítomnosti osteoporotické zlomeniny.
Shrnutí důkazů
Osteoporóza je diagnostikována na základě DXA stanovením BMD proximálního femuru a bederní páteře.6 BMD by se měla měřit na předloktí (⅓ radius), pokud nelze přesně změřit kyčelní a bederní páteř kvůli strukturálním změnám (tj. osteofytům). 5 U žen po menopauze a u mužů ve věku 50 let a starších je BMD klasifikována pomocí diagnostických kritérií T-skóre Světové zdravotnické organizace (World Health Organization, WHO) na základě referenční populace mladých dospělých (Tab. 3). Mezinárodní společnost pro klinickou denzitometrii (International Society of Clinical Densitometry) doporučuje, aby se u pacientů ve věku 20 až 50 let, u nichž je Z-skóre −2,0 nebo nižší pro očekávané věkové rozmezí diagnostikující osteoporózu, používalo Z-skóre upravené podle etnické nebo rasové příslušnosti (rovněž upravené podle věkových nebo pohlavních norem).5
Tab. 3. WHO definice osteoporózy založené na BMD 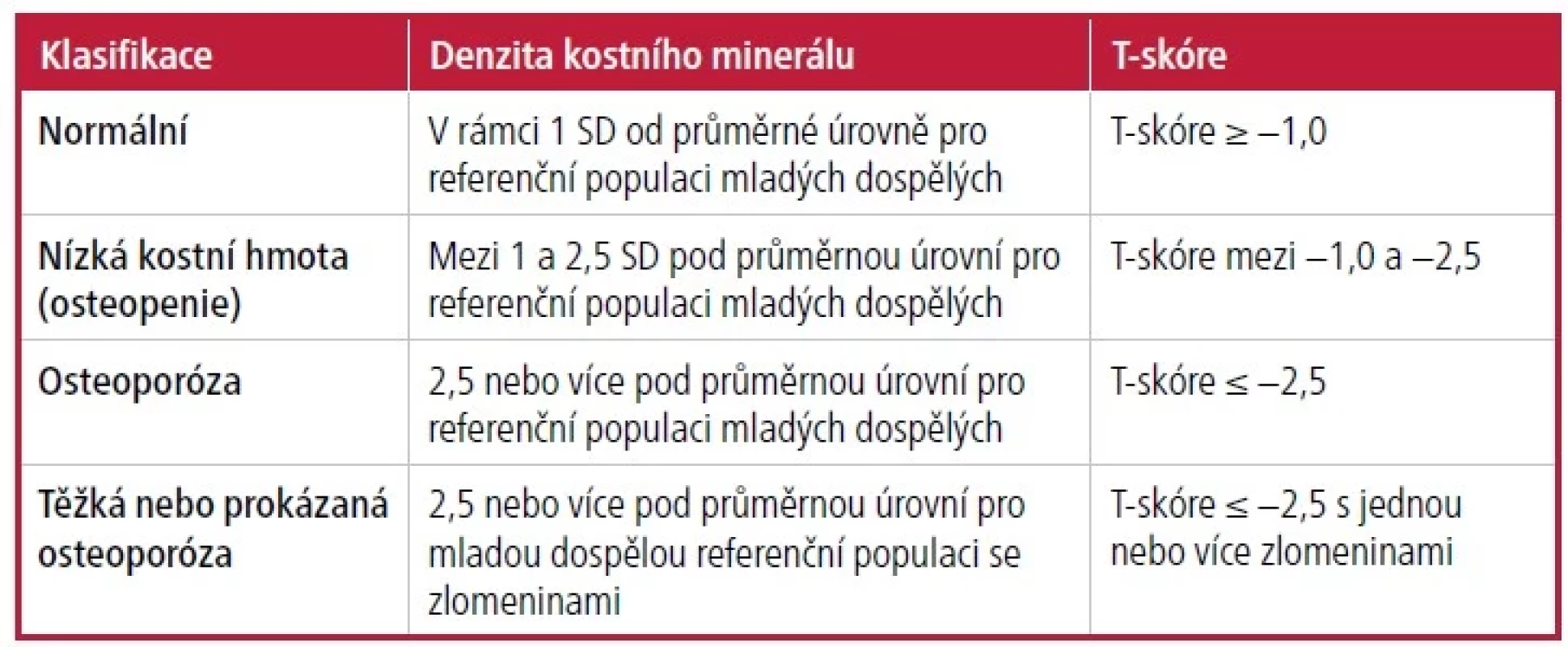
WHO – Světová zdravotnická organizace; BMD – denzita kostního minerálu; SD – standardní odchylka
Upraveno podle: Kanis JA. Assessment of osteoporosis at the primary health-care level. Technical Report. http://www. shef. ac. uk/FRAX, 2008.Osteoporóza je také diagnostikována na základě přítomnosti osteoporotické zlomeniny nebo zlomeniny obratle, a to i bez diagnózy BMD.4, 5 AACE/ACE a National Bone Health Alliance rozšiřují diagnostická kritéria osteoporózy na pacienty s osteopenií a 10letým rizikem určeným skóre FRAX, které činí alespoň 20 % pro vznik hlavních osteoporotických zlomenin nebo alespoň 3 % pro zlomeniny proximálního femuru.4
Jaké hodnocení by mělo být provedeno po diagnóze osteoporózy?
Aby bylo možné identifikovat možné sekundární příčiny osteoporózy, počáteční vyšetření u většiny pacientů obvykle zahrnuje kompletní krevní obraz, kompletní metabolický panel, měření 25-hydroxyvitaminu D, parathormonu a fosfátu a 24hodinový sběr moči pro vylučování vápníku.
Shrnutí důkazů
Sekundární osteoporóza může být přítomna u zdravých žen, které jsou po menopauze, proto AACE/ACE a Bone Health and Osteoporosis Foundation doporučují standardní vyšetření, které zahrnuje kompletní krevní obraz, kompletní metabolický panel, 25-hydroxyvitamin D, parathormon, fosfát a 24hodinový sběr moči pro vylučování vápníku a kreatininu.4, 5 Další hodnocení sekundárních příčin může být rozsáhlé a mělo by být individualizováno na základě pacientovy anamnézy, vyšetření a komorbidit (Tab. 2).4, 5
Zlomeniny obratlů ukazují na vysoké riziko budoucích zlomenin a mohou změnit individuální riziko, diagnostickou klasifikaci a klinickou léčbu. Pacienti splňující indikace pro zobrazení obratlů by měli být odesláni na vysoce kvalitní zobrazení se specializovanou rentgenografií páteře nebo posouzením zlomenin obratlů provedených současně s DXA.4, 5
Markery kostního obratu mohou monitorovat léčbu a mohou předpovídat rychlost úbytku kostní hmoty a riziko zlomenin u pacientů, kteří nebyli léčeni. 4, 5 Tyto testy jsou často drahé a vyžadují konzistentní načasování laboratorních odběrů, což omezuje jejich použitelnost pro rutinní použití.
Jaké nefarmakologické intervence jsou účinné pro osteoporózu?
U pacientů s diagnostikovanou osteopenií nebo osteoporózou by (na základě jejich věku a hladin vitaminu D) měly být suplementovány vápník a vitamin D. Doporučuje se také cvičení s vlastní vahou těla, fyzikální terapie, prevence pádů, odvykání kouření a střídmá konzumace alkoholu.
Shrnutí důkazů
V jedné metaanalýze suplementace samotným vápníkem nebo samotným vitaminem D nesnížila riziko zlomeniny proximálního femuru, jejich kombinace však prokázala 19% snížení počtu těchto fraktur.13 Guidelines doporučují vápník a vitamin D jako doplňkovou terapii s jinými léky na osteoporózu.4, 5, 1 Dietní poradenství může podpořit dostatečný příjem vápníku (1000 mg denně u mužů ve věku 50 až 70 let; 1200 mg denně pro ženy starší 50 let a muže starší 70 let).5 Doporučený příjem vitaminu D je alespoň 800 až 1000 IU denně pro osoby starší 50 let.5 Nedostatek vitaminu D by měl být léčen tak, aby se udržovala hladina alespoň 30 ng/ml (75 nmol/L).4, 5 Zátěžové cvičení a fyzikální terapie mohou zlepšit BMD a zabránit pádům. Užívání tabáku a alkoholu může snižovat BMD a zvyšovat riziko zlomenin, proto by pacienti měli být poučeni o strategiích odvykání.4, 5 U pacientů se zlomeninami se doporučuje koordinace multidisciplinární péče s kontaktní službou pro zlomeniny nebo podobným programem, aby se zajistily odpovídající hodnocení a léčba.5
Kteří pacienti by měli dostávat farmakologickou léčbu osteoporózy?
Pacienti s vysokým nebo velmi vysokým rizikem zlomeniny profitují z farmakologické léčby. Patří sem pacienti s předchozí osteoporotickou zlomeninou, osteoporózou podle DXA nebo osteopenií s vysokým rizikem zlomeniny.
Shrnutí důkazů
Rozhodnutí o léčbě je určeno na základě posouzení rizika zlomenin (Tab. 44, 14, 15). Pokyny pro klinickou praxi od Endokrinologické společnosti (Endocrine Society, ES), AACE/ACE a Bone Health and Osteoporosis Foundation podporují použití farmakologické léčby u pacientů s předchozí zlomeninou proximálního femuru nebo obratle, pacientů s T-skóre −2,5 nebo méně v krčku stehenní kosti, celé kyčli nebo bederní páteři nebo u pacientů s T-skóre mezi −1 a −2,5 a 10letým rizikem alespoň 20 % pro hlavní osteoporotické zlomeniny nebo alespoň 3 % pro zlomeninu proximálního femuru na základě nástroje FRAX.4, 5, 14, 15 Pacienti s nedávnými nebo mnohočetnými zlomeninami jsou ve velmi vysokém riziku a mohou vyžadovat agresivnější léčbu.
Tab. 4. Stratifikace rizika pro zlomeniny dle ES a AACE/ACE 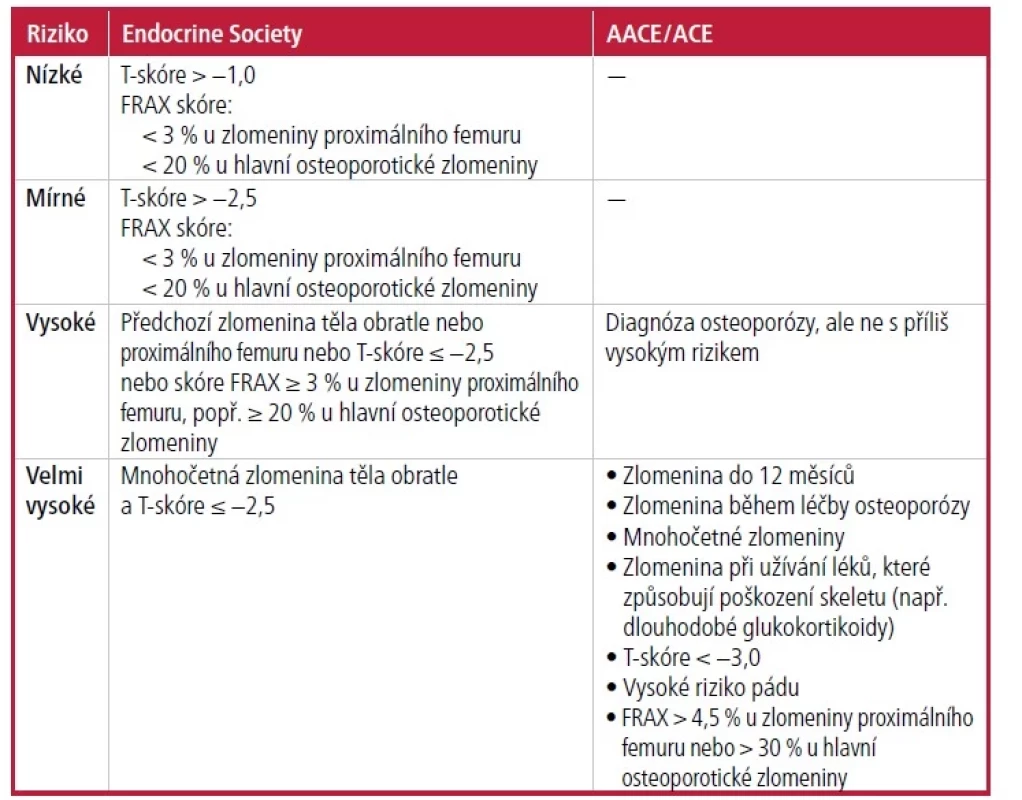
AACE/ACE – Americká asociace klinických endokrinologů/Americká vysoká škola endokrinologie; FRAX – Fracture Risk Assessment Tool
Informace z odkazů 4, 14 a 15.Jaké jsou preferované možnosti léčby osteoporózy první linie a jaká jsou jejich rizika a výhody?
Riziko zlomeniny u pacienta určuje počáteční terapii. Pacienti s vysokým rizikem zlomeniny by měli dostávat antiresorpční léčbu s prokázanými účinky na redukci zlomenin proximálního femuru. Patří sem bisfosfonáty, konkrétně alendronát, risedronát nebo kyselina zoledronová a denosumab. Pacienti s velmi vysokým rizikem zlomeniny, zejména pacienti s nedávnou zlomeninou, by měli zvážit léčbu anabolickými látkami.
Shrnutí důkazů
Nedávné metaanalýzy ukázaly, že většina léků používaných k léčbě osteoporózy významně snižuje riziko zlomenin obratlů u žen po menopauze (Tab. 54, 5, 13–16). Kyselina zoledronová (intravenózní bisfosfonát; Reclast [pozn. překl.: u nás prodávaná pod obchodním názvem Aclasta]) a denosumab (inhibitor RANK ligandu) prokázaly významně nižší riziko zlomenin obratlů ve srovnání s perorálními bisfosfonáty, bez rozdílu v riziku zlomeniny proximálního femuru.13, 16 Riziko nevertebrálních zlomenin bylo sníženo bisfosfonáty, denosumabem, analogy parathormonu a romosozumabem (Evenity, inhibitor sklerostinu). Látky, u kterých bylo trvale prokázáno, že významně snižují riziko zlomeniny kyčle, byly bisfosfonáty (alendronát, risedronát, kyselina zoledronová) a denosumab.13, 16 Na základě své účinnosti při snižování zlomenin proximálního femuru jsou tyto antiresorpční přípravky léčbou první volby u většiny pacientů s vysokým rizikem zlomenin.4,14 American College of Physicians provedla systematický přehled, který podobně potvrdil účinnost bisfosfonátů a denosumabu při redukci zlomenin kyčle a obratlů, a doporučuje bisfosfonáty jako léčbu první linie a inhibitory ligandů RANK jako léčbu druhé linie.17, 18
Tab. 5. Souhrn možností léčby osteoporózy 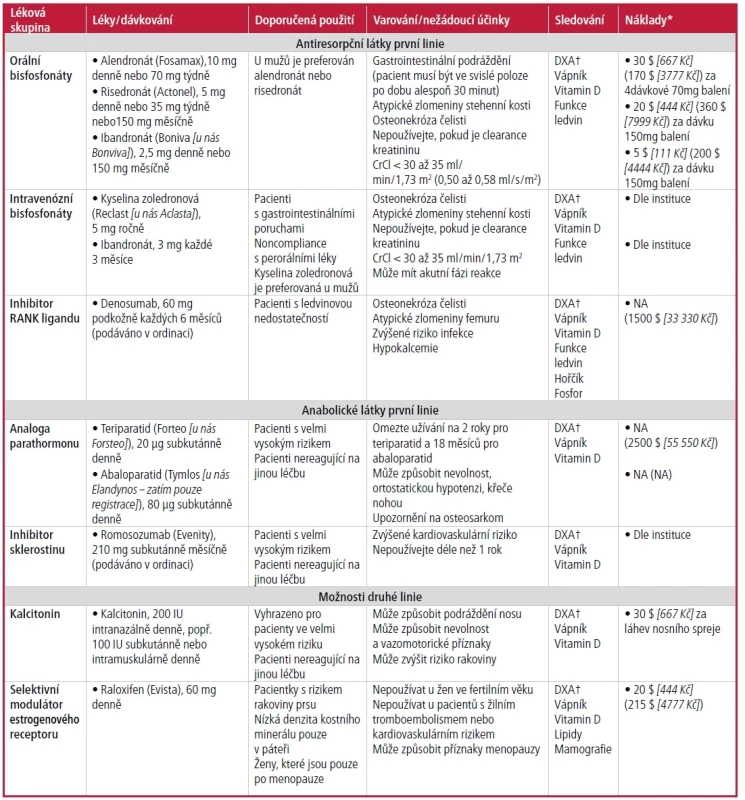
DXA – dvojitá rentgenová absorpciometrie; NA – není k dispozici
* – Odhadovaná nejnižší cena GoodRx za 1 měsíc léčby. Skutečná cena se bude lišit podle pojištění a regionu. Obecná cena v USA uvedená jako první; cena konkrétního léku v USA v závorce.
V hranatých závorkách kurzívou uveden přepočet na Kč při kurzu 22,22 Kč za dolar. Informace o cenách léků získané na https://www.goodrx.com (přístup 12. února 2023).
† —AACE/ACE a Bone Health and Osteoporosis Foundation doporučují opakovat DXA vždy po 1 až 2 letech, dokud nebudou nálezy stabilní, a poté podle klinického opodstatnění.
Endocrine Society doporučuje opakovat DXA každé 1 až 3 roky.
Informace z odkazů 4, 5 a 13–16.Anabolické látky podporují rychlý růst kostí u pacientů s nízkým T-skóre (méně než –3,0) a mohou být přínosem pro pacienty s velmi vysokým rizikem zlomenin, konkrétně zlomenin obratlů. Nedávné metaanalýzy naznačují, že analoga parathormonu (teriparatid [Forteo; pozn. překl.: u nás prodávaný pod obchodním názvem Forsteo], abaloparatid [Tymlos; pozn. překl.: u nás registrovaný pod obchodním názvem Eladynos]) významně snížila počet vertebrálních fraktur ve srovnání s perorálními bisfosfonáty.13, 16 Romosozumab je nejnovější lék a poskytuje anabolické a antiresorpční vlastnosti. Kromě významného snížení počtu vertebrálních a klinických zlomenin jedna metaanalýza naznačila, že romosozumab významně snížil riziko zlomenin proximálního femuru o 56 % ve srovnání s placebem.13 Ve srovnávací studii s alendronátem vedl romosozumab u pacientů s anamnézou zlomenin obratlů k 48% snížení počtu zlomenin obratlů, 27% snížení počtu klinických zlomenin a 38% snížení počtu zlomenin kyčle.19 K potvrzení tohoto přínosu je třeba provést další studie, nicméně aktualizace léčebných doporučení doporučuje romosozumab pro pacienty s velmi vysokým rizikem zlomenin.4, 15
Důležitými faktory jsou komfortnost užívání a nežádoucí účinky. Perorální bisfosfonáty mohou být podávány týdně nebo měsíčně, ale vyžadují, aby je pacienti užívali nalačno a zůstali ve vzpřímené poloze po dobu alespoň 30 minut. Intravenózní bisfosfonáty mohou být preferovány u pacientů s rizikem eroze jícnu v důsledku komorbidních stavů nebo při neschopnosti dodržovat doporučení pro podávání. Denosumab se podává každých šest měsíců, ale je dražší. Obě antiresorpční třídy nesou při dlouhodobé léčbě riziko atypických zlomenin femuru a osteonekrózy čelisti. Analoga parathormonu se podávají subkutánně denně, zatímco romosozumab se podává jednou za měsíc v ordinaci. V jedné klinické studii s romosozumabem bylo zjištěno malé zvýšení srdečních ischemických příhod u pacientů s kardiovaskulárními rizikovými faktory (0,8 % vs. 3 % u alendronátu).19 Pacienti s kardiovaskulárním onemocněním nebo s rizikem kardiovaskulárního onemocnění by měli zvážit alternativní léčbu. Obrázek 1 uvádí algoritmus pro léčbu osteoporózy.4, 5, 14, 15
Obr. 1. Algoritmus pro léčbu osteoporózy. Informace z odkazů 4, 5, 14 a 15 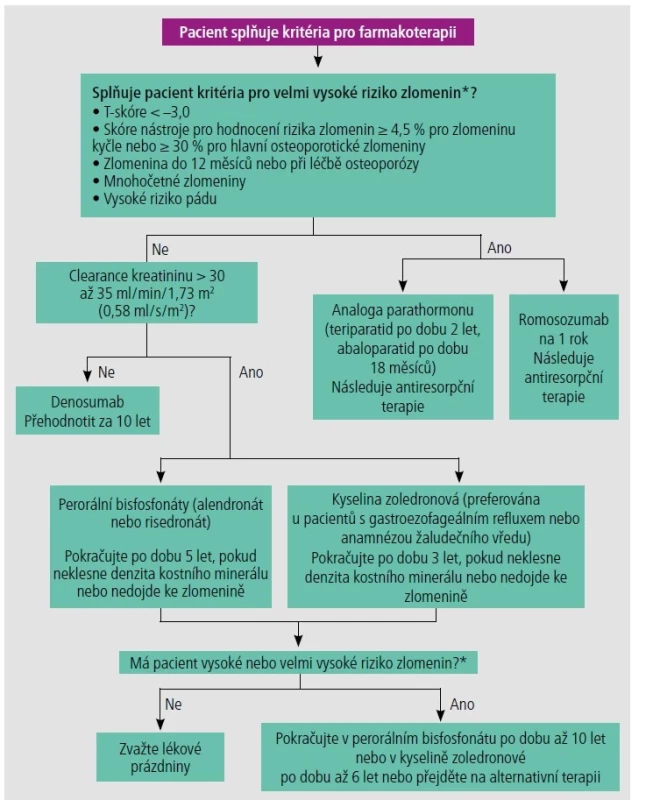
* – Podle AACE/ACE guidelines Jak dlouho by se měli léčit pacienti s osteoporózou?
U pacientů, kteří užívají perorální nebo intravenózní bisfosfonáty, by mělo být provedeno přehodnocení léčby po pěti, resp. po třech letech, aby se určilo, zda je vhodné přerušit léčbu. Pacienti s vysokým rizikem zlomenin mohou pokračovat až 10 let v perorální léčbě nebo až 6 let v případě intravenózní léčby. Léčba denosumabem by měla být přehodnocena po 5 a 10 letech. Teriparatid, abaloparatid a romosozumab by měly pokračovat po dobu dvou let, 18 měsíců a jednoho roku, po nichž by následovala obvyklá antiresorpční terapie.
Shrnutí důkazů
Léčba bisfosfonáty je spojena s rizikem atypických zlomenin femuru, které se s dobou léčby zvyšuje. Prospektivní kohortová studie v roce 2020 zjistila, že u žen užívajících bisfosfonáty se atypické zlomeniny stehenní kosti vyskytly ve výrazně nižší míře, 1,74 na 10 000 osoboroků, ve srovnání s přirozeným rizikem zlomenin proximálního femuru v této populaci (58,9 na 10 000 osoboroků). 20 Riziko atypické fraktury femuru se však při dlouhodobé léčbě zvyšovalo. Ve srovnání s léčbou bisfosfonáty po dobu kratší než tři měsíce byl multivariační poměr rizik atypické zlomeniny femuru významně vyšší u žen léčených bisfosfonáty po dobu tří až pěti let (8,86; 95% CI: 2,79–28,2), pět až osm let (19,88; 95% CI: 6,32–62,49) a více než osm let (43,51; 95% CI: 13,7–138,15).20 Další rizikové faktory spojené s atypickou zlomeninou stehenní kosti zahrnovaly asijskou rasu (jak uvádějí pacienti), klesající výšku, zvyšující se hmotnost, věk 65 až 74 let a více než jeden rok užívání glukokortikoidů. 20 Celkově lze říci, že přínos pro snížení osteoporotických zlomenin výrazně převažoval nad rizikem atypické zlomeniny stehenní kosti po dobu pěti let léčby.20 Přerušení léčby bisfosfonáty může snížit riziko atypické zlomeniny stehenní kosti a zároveň zachovat snížení rizika osteoporotických zlomenin.
Klíčová doporučení pro praxi (SORT) 
USPSTF – Pracovní skupina pro preventivní služby USA (U.S. Preventive Services Task Force)
A – konzistentní a kvalitní důkazy zaměřené na pacienta; B – nekonzistentní nebo omezená kvalita důkazů orientovaných na pacienta; C – konsenzus, důkazy zaměřené na nemoci, obvyklá praxe, znalecký posudek nebo série případů
Informace o systému hodnocení důkazů SORT naleznete na stránce https://www.aafp.org/afpsort.Předchozí studie ukázaly, že BMD a riziko zlomenin se po pěti letech perorální léčby a tříleté intravenózní léčbě kyselinou zoledronovou několik let nezměnily;21,22 systematický přehled však našel určité důkazy, že delší léčba alendronátem může snížit počet klinických zlomenin u žen s nižší BMD.23 Kohortová studie z roku 2020 ukázala, že při ukončení léčby bisfosfonáty se riziko atypické zlomeniny stehenní kosti snížilo o 48 %, po třech až 15 měsících a o 74 % a až o 78 % po tomto období.20 Tato studie podporuje dřívější zjištění retrospektivní studie, která naznačuje, že poměr rizika atypické zlomeniny femuru po čtyřech až pěti letech užívání bisfosfonátů klesá každý rok po ukončení užívání o 70 %.24 Některé organizace doporučují, aby pacienti po pěti letech perorálního (nebo po třech letech intravenózního) užívání léků zvážili jejich vysazení – lékové prázdniny. Ty jsou definovány jako období do pěti let, kdy pacienti nedostávají žádnou léčbu.4, 14, 25 U pacientů s vysokým rizikem zlomenin lze zvážit podávání perorálních bisfosfonátů po dobu až 10 let, intravenózních bisfosfonátů až šest let nebo alternativní léčbu.4, 14, 25
Léčba denosumabem byla také spojena s atypickou zlomeninou femuru; po přerušení léčby však BMD klesá a zvyšuje se riziko zlomenin. Pacienti užívající denosumab by neměli praktikovat lékové prázdniny,4,14 ale měli by být po pěti až deseti letech léčby přehodnoceni, aby bylo možné zvážit alternativní léčbu.
Anabolické látky mají optimální trvání pro maximalizaci účinnosti a snížení rizik. Obě analoga parathormonu – teriparatid a abaloparatid – jsou schválena na dobu až dvou let, nicméně klinické studie s abaloparatidem prokazující zlepšení BMD a rizika zlomenin trvaly pouze 18 měsíců.26 Romosozumab je schválen na jeden rok léčby, protože další přínos při prodloužení léčby byl omezený. Vzhledem k rychlé ztrátě BMD po vysazení anabolických látek by po dokončení terapie měla být zahájena antiresorpční léčba.4, 14, 15
Tento článek aktualizuje předchozí články na toto téma od autorů: Jeremiah a kol.;27 Sweet a kol;2 South-Paul;29 a Ullom-Minnich.30
Zdroje dat: Vyhledávání publikací PubMed a Ovid bylo dokončeno s použitím klíčových pojmů osteoporosis, diagnosis, and treatment (osteoporóza, diagnóza a léčba). Vyhledávání zahrnovalo metaanalýzy, randomizované kontrolované studie, klinické studie a recenze. V únoru 2022 bylo také dokončeno vyhledávání Essential Evidence Plus pro osteoporózu.
Termíny vyhledávání: leden 2022, květen 2022 a 5. říjen 2022.
Informace o autorech:
Kira Harris, PharmD, BCPS, CPP, CDCES, FCCP, je ředitelkou služeb klinické farmacie v Atrium Health One Health Family Medicine, Huntersville, NC, a asistentkou klinického profesora na katedře rodinného lékařství na University of North Carolina School, Chapel Hill. V době, kdy byl napsán tento článek, byla specialistkou na klinickou farmacii v rezidenčním programu pro rodinné lékařství Novant Health, Cornelius, NC.
Christopher A. ZAGAR, MD, FAAFP, je hlavním akademickým ředitelem Atri um Health One Health, Charlotte, NC, a klinickým odborným asistentem na katedře rodinného lékařství Lékařské fakulty University of North Carolina.
Kelley V. Lawrence, MD, IBCLC, FA AFP, FABM, je přidruženým programovým ředitelem v rezidenčním programu pro rodinné lékařství Novant Health; asistent děkana Lékařské fakulty University of North Carolina Novant Health, Charlotte; klinický odborný asistent na katedře rodinného lékařství na lékařské fakultě University of North Carolina a odborný asistent na katedře rodinného lékařství na Campbell University Jerry M. Wallace School of Osteopathic Medicine, Lillington, NC.
Článek v původním znění:
Am Fam Physician 2023;107(3):23–246.
Překlad: J. Široký
Odborná korektura: MUDr. Richard Pikner, Ph.D.; místopředseda Společnosti pro metabolická onemocnění skeletu ČLS JEP.
Publikováno se souhlasem AAFP.
Kira Harris, PharmD
Atrium Health One Health, Huntersville,
North Carolina; University of North Carolina
School of Medicine, Chapel Hill, North Carolina
Christopher A. Zagar, MD
Atrium Health One Health, Charlotte,
North Carolina; University of North Carolina
School of Medicine, Chapel Hill, North Carolina
Kelley V. Lawrence, MD
Novant Health Family Medicine Residency
Program, Cornelius, North Carolina;
University of North Carolina School of Medicine
Novant Health Charlotte Campus, Charlotte,
North Carolina; University of North Carolina
School of Medicine, Chapel Hill, North Carolina;
Campbell University Jerry M. Wallace School of
Osteopathic Medicine, Lillington,
North Carolina
Zdroje
1. Wright NC, Looker AC, Saag KG, et al. The recent prevalence of osteoporosis and low bone mass in the United States based on bone mineral density at the femoral neck or lumbar spine. J Bone Miner Res 2014;29(11): 2520–2526.
2. Burge R, Dawson-Hughes B, Solomon DH, et al. Incidence and economic burden of osteoporosis-related fractures in the United States, 2005-2025. J Bone Miner Res 2007;22(3):465–475.
3. Brauer CA, Coca-Perraillon M, Cutler DM, et al. Incidence and mortality of hip fractures in the United States. JAMA 2009;302(14):1573–1579.
4. Camacho PM, Petak SM, Binkley N, et al. American Association of Clinical Endocrinologists/American College of Endocrinology clinical practice guidelines for the diagnosis and treatment of postmenopausal osteoporosis – 2020 update. Endocr Pract 2020;26(Suppl. 1):1–46.
5. LeBoff MS, Greenspan SL, Insogna KL, et al. The clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int April 28, 2022. Accessed May 25, 2022. https:// link.springer.com/content/pdf/10.1007/s00198 - 021-05900-y.pdf.
6. Curry SJ, Krist AH, Owens DK, et al.; US Preventive Services Task Force. Screening for osteoporosis to prevent fractures: US Preventive Services Task Force recommendation statement. JAMA 2018;319(24):2521–2531.
7. Kanis JA, Cooper C, Dawson-Hughes B, et al.; International Osteoporosis Foundation. FRAX and ethnicity. Osteoporos Int 2020;31(11): 2063–2067.
8. Vyas DA, Eisenstein LG, Jones DS. Hidden in plain sight – reconsidering the use of race correction in clinical algorithms. N Engl J Med 2020;383(9): 874–882.
9. Pecina JL, Romanovsky L, Merry SP, et al. Comparison of clinical risk tools for predicting osteoporosis in women ages 50-64. J Am Board Fam Med 2016;29(2):233–239.
10. Cass AR, Shepherd AJ, Asirot R, et al. Comparison of the Male Osteoporosis Risk Estimation Score (MORES) with FRAX in identifying men at risk for osteoporosis. Ann Fam Med 2016;14(4):365–369.
11. Shepstone L, Lenaghan E, Cooper C, et al.; SCOOP Study Team. Screening in the community to reduce fractures in older women (SCOOP): a randomised controlled trial. Lancet 2018;391(10122):741–747.
12. Cass AR, Shepherd AJ. Validation of the Male Osteoporosis Risk Estimation Score (MORES) in a primary care setting. J Am Board Fam Med 2013; 26(4):436–444.
13. Barrionuevo P, Kapoor E, Asi N, et al. Efficacy of pharmacological therapies for the prevention of fractures in postmenopausal women: a network meta - analysis [published correction appears in J Clin Endocrinol Metab 2021;106(3):e1494]. J Clin Endocrinol Metab 2019;104(5):1623–1630.
14. Eastell R, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2019;104(5):1595–1622.
15. Shoback D, Rosen CJ, Black DM, et al. Pharmacological management of osteoporosis in postmenopausal women: an Endocrine Society guideline update. J Clin Endocrinol Metab 2020;105(3):587–594.
16. Albert SG, Wood E. Meta-analysis of clinical fracture risk reduction of antiosteoporosis drugs: direct and indirect comparisons and meta-regressions. Endocr Pract 2021;27(11):1082–1092.
17. Qaseem A, Hicks LA, Etxeandia-Ikobaltzeta I, et al.; Clinical Guidelines Committee of the American College of Physicians. Pharmacologic treatment of primary osteoporosis or low bone mass to prevent fractures in adults: a living clinical guideline from the American College of Physicians. Ann Intern Med 2023. Accessed February 10, 2023. https://www.acpjournals. org/doi/full/10.7326/M22-1034.
18. Ayers C, Kansagara D, Lazur B, et al. Effectiveness and safety of treatments to prevent fractures in people with low bone mass or primary osteoporosis: a living systematic review and network meta-analysis for the American College of Physicians [published online January 3, 2023]. Ann Intern Med. 2023. Accessed February 10, 2023. https://www.acpjournals. org/ doi/10.7326/M22-0684.
19. Saag KG, Petersen J, Brandi ML, et al. Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med 2017;377 (15):1417–1427.
20. Black DM, Geiger EJ, Eastell R, et al. Atypical femur fracture risk versus fragility fracture prevention with bisphosphonates. N Engl J Med 2020;383(8):743–753.
21. Black DM, Schwartz AV, Ensrud KE, et al.; FLEX Research Group. Effects of continuing or stopping alendronate after 5 years of treatment: the Fracture Intervention Trial Long-term Extension (FLEX): a randomized trial. JAMA 2006;296(24):2927–2938.
22. Black DM, Reid IR, Boonen S, et al. The effect of 3 versus 6 years of zoledronic acid treatment of osteoporosis: a randomized extension to the HORIZON - Pivotal Fracture Trial (PFT). J Bone Miner Res 2012;27(2): 243–254.
23. Fink HA, MacDonald R, Forte ML, et al. Long-term drug therapy and drug holidays for osteoporosis fracture prevention: a systematic review. Agency for Healthcare Research and Quality; 2019. AHRQ Publication no.: 19-EHC016-EF.
24. Schilcher J, Koeppen V, Aspenberg P, et al. Risk of atypical femoral fracture during and after bisphosphonate use. Acta Orthop 2015;86(1):100–107.
25. Adler RA, El-Hajj Fuleihan G, Bauer DC, et al. Managing osteoporosis in patients on long-term bisphosphonate treatment: report of a task force of the American Society for Bone and Mineral Research [published correctionappears in J Bone Miner Res. 2016; 31(10):1910]. J Bone Miner Res. 2016;31(1):16–35.
26. Leder BZ, Mitlak B, Hu MY, et al. Effect of abaloparatide vs. alendronate on fracture risk reduction in postmenopausal women with osteoporosis published corrrection appears in J Clin Endocrinol Metab 2020;105(8):e3053]. J Clin Endocrinol Metab 2020;105(3):938–943.
27. Jeremiah MP, Unwin BK, Greenawald MH, et al. Diagnosis and management of osteoporosis. Am Fam Physician 2015;92(4):261–268.
28. Sweet MG, Sweet JM, Jeremiah MP, et al. Diagnosis and treatment of osteoporosis. Am Fam Physician 2009;79(3):193–200.
29. South-Paul JE. Osteoporosis: part I. Evaluation and assessment. Am Fam Physician 2001;63(5):897–908.
30. Ullom-Minnich P. Prevention of osteoporosis and fractures. Am Fam Physician 1999;60(1):194–202.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé Endokrinologie Gynekologie a porodnictví Interní lékařství Ortopedie Revmatologie
Článek Úvodní slovoČlánek Nové registrace EMAČlánek Eozinofilní ezofagitidaČlánek Chronická pankreatitida
Článek vyšel v časopiseSvět praktické medicíny
Nejčtenější tento týden
- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
-
Všechny články tohoto čísla
- Úvodní slovo
- Osteoporóza: nejčastější otázky a odpovědi
- Komentář k článku Osteoporóza: nejčastější otázky a odpovědi
- Hemoroidální onemocnění ve zkratce
- Chronická žilní insuficience jako podceňovaná diagnóza
- Současná diagnostika a léčba chronického žilního onemocnění dolních končetin
- Endotel a mikrocirkulace v klinické praxi
- Současnost chirurgie štítné žlázy
- Cholecystolitiáza, komplikace a aktuální pohled z hlediska chirurgie
- Eozinofilní ezofagitida
- Adrenalin je součástí každého operačního výkonu
- Chronická pankreatitida
- Postavení léčivého přípravku Gaspan v léčbě gastrointestinálních obtíží
- Ultrazvuk plic při akutních stavech – kazuistiky
- Rimegepant v léčbě migrenózních stavů
- Co vyplývá ze studií s inklisiranem?
- Ten správný čas na fixní kombinaci ramipril/amlodipin
- Rybelsus: nejúčinnější perorální antidiabetikum mohou použít lékaři všech specializací
- Vakcinace dospělých v ČR: Co brání vyšší proočkovanosti?
- Nové registrace EMA
- Znalostní test: 2 kredity ČLK
- Svět praktické medicíny
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Rybelsus: nejúčinnější perorální antidiabetikum mohou použít lékaři všech specializací
- Eozinofilní ezofagitida
- Cholecystolitiáza, komplikace a aktuální pohled z hlediska chirurgie
- Chronická pankreatitida
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



