-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV) – aktualizace
Autoři: P. Urbánek; P. Husa; J. Galský; J. Šperl
; V. Hejda; P. Kümpel; V. Němeček
; S. Plíšek; M. Volfová
Působiště autorů: Pracovní skupina pro virové hepatitidy České hepatologické společnosti ČLS JEPPracovní skupina pro virové hepatitidy Společnosti infekčního lékařství ČLS JEP
Vyšlo v časopise: Gastroent Hepatol 2013; 67(2): 95-97
Kategorie: Hepatologie: doporučené postupy
V roce 2012 byl v časopise Gastroenterologie a hepatologie publikován Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV) (Gastroent Hepatol 2012; 66(3): 214–229), který reflektuje do té doby publikované zkušenosti s kombinační léčbou chronické HCV infekce používající první přímo působící virostatika boceprevir a telaprevir. V nedávné době byly publikovány výsledky studie PROVIDE hodnotící účinnost a bezpečnost podání trojkombinace u pacientů, jejichž předchozí odpověď na protivirovou léčbu byla klasifikována jako null response. Jedná se o studii velmi významnou, protože její výsledky umožnily jednoznačné rozšíření indikací bocepreviru i o tuto kategorii pacientů. Vzhledem k této skutečnosti se pracovní skupiny pro virové hepatitidy ČHS ČLS JEP a SIL CLS JEP rozhodly aktualizovat příslušnou kapitolu standardů z roku 2012. Nové znění kapitoly 8 proto předkládáme nyní. Kompletní text aktuálních guidelines je k dispozici na www.ces-hep.cz.
8. Opakovaná léčba pacientů s genotypem HCV 1 a předchozí neúspěšnou protivirovou terapií
8.1.1 Publikované studie s použitím BOCEPREVIRU
Studie RESPOND-2: schéma uspořádání studie ukazuje obr. 7 a výsledky obr. 8. Pro srovnání s jinými studiemi je nutné si uvědomit, že skupina zde označená jako předchozí „non-responders“ byla definována jako skupina osob, u nichž při předchozí terapii došlo ve 12. týdnu léčby k poklesu HCV RNA ≥ 2 log proti výchozím hodnotám, ale nikdy nebyla HCV RNA negativní. Z výsledků je patrno významné navýšení odpovědi ve smyslu SVR u obou skupin pacientů při použití fixního léčebného trojkombinačního schématu s boceprevirem proti opakování standardní protivirové léčby PEG-IFN + RBV.
Obr. 1. Schéma uspořádání studie RE SPOND-2. Fig. 7. RESPOND-2 study design. 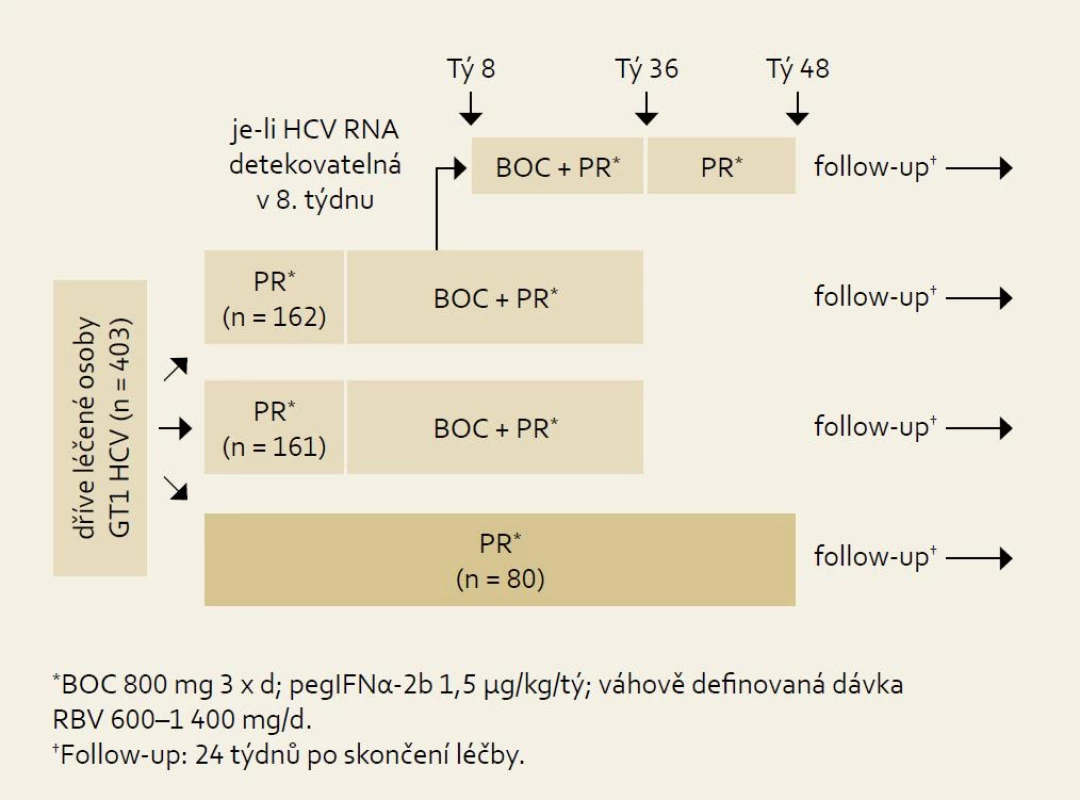
Obr. 2. Výsledky studie RE SPOND-2: % SVR podle terapeutické větve a efektu předchozí léčby. Fig. 8. RESPOND-2 study results: SVR % by therapeutic arm and effect of previoustreatment. 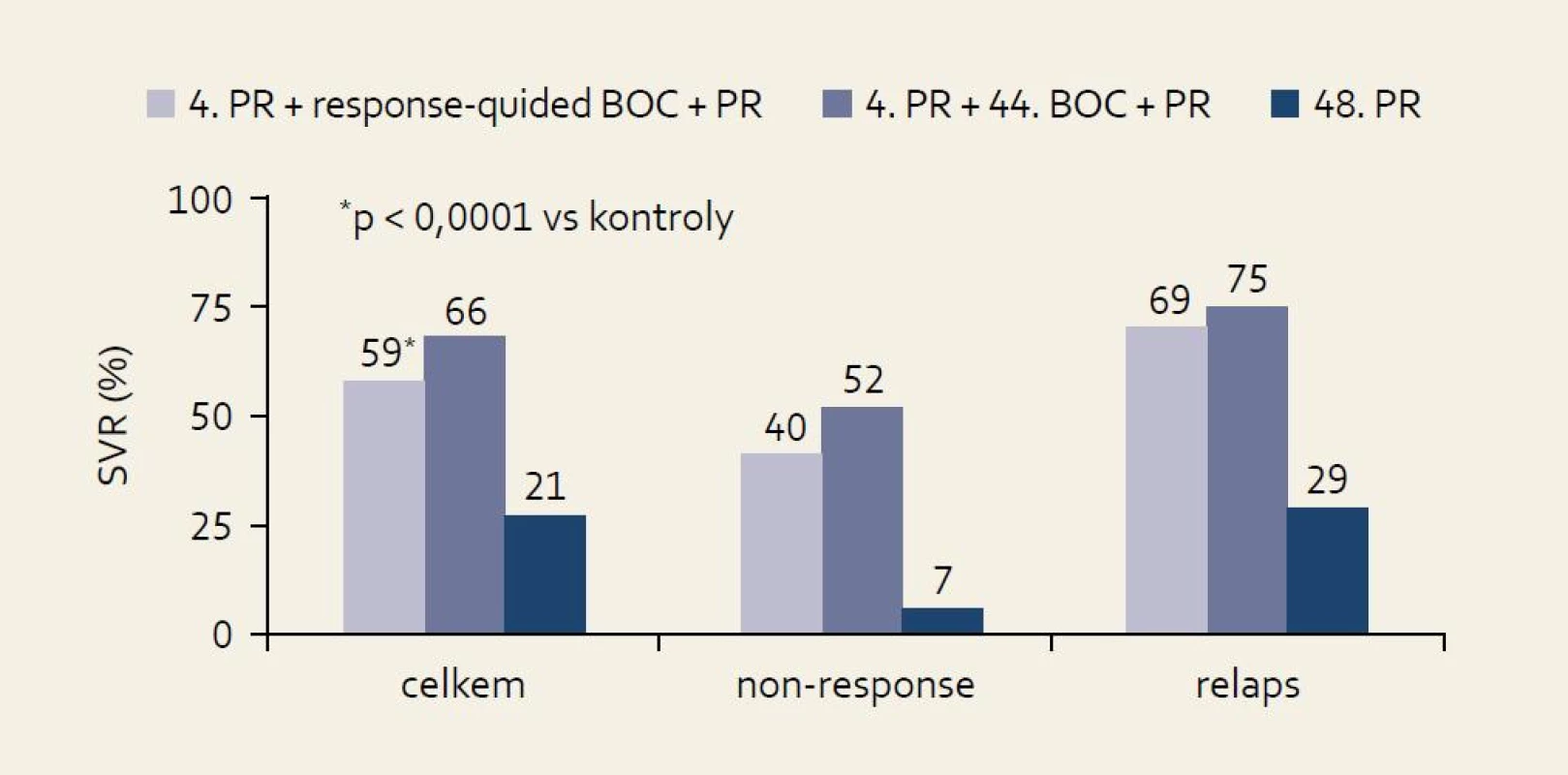
Studie PROVIDE: do této otevřené nerandomizované jednoramenné studie vstoupily osoby, které byly ve studiích nižších fází zkoušení bocepreviru randomizovány do kontrolních větví a byly léčeny standardní kombinací PEG-IFN + RBV, a to po dobu alespoň 12 týdnů. Do studie tedy mohli vstoupit pacienti relabující (po dokončení 48 týdnů léčby s „end of treatment response“), pacienti s předčasně ukončenou léčbou pro null response (HCV RNA ≥ LLD ve 12. týdnu léčby u dosud neléčených osob nebo ve 24. týdnu u opakované léčby) nebo pacienti s breakthrough fenoménem. Výhodou studie je přesná definice typu odpovědi v každém jednotlivém případě. Všichni pacienti byli léčeni trojkombinací s boceprevirem v typickém schématu: lead-in fáze čtyři týdny PEG-IFN 1,5 µg/kg + RBV 600–1 400 mg denně, následně PEG-IFN + RBV (v nezměněném dávkování) + boceprevir 800 mg 3× denně do 48. týdne. Výsledky studie v jednotlivých kategoriích podle typu odpovědi na léčbu PEG-IFN + RBV ukazuje obr. 9. Je patrno, že ve skupině null responderů bylo dosaženo tímto postupem SVR ve 40 % případů.
Obr. 3. Výsledky studie PROVI DE podle kategorie odpovědi na předchozí léčbu. Fig. 9. PROVIDE study results by the effect of the previous treament. 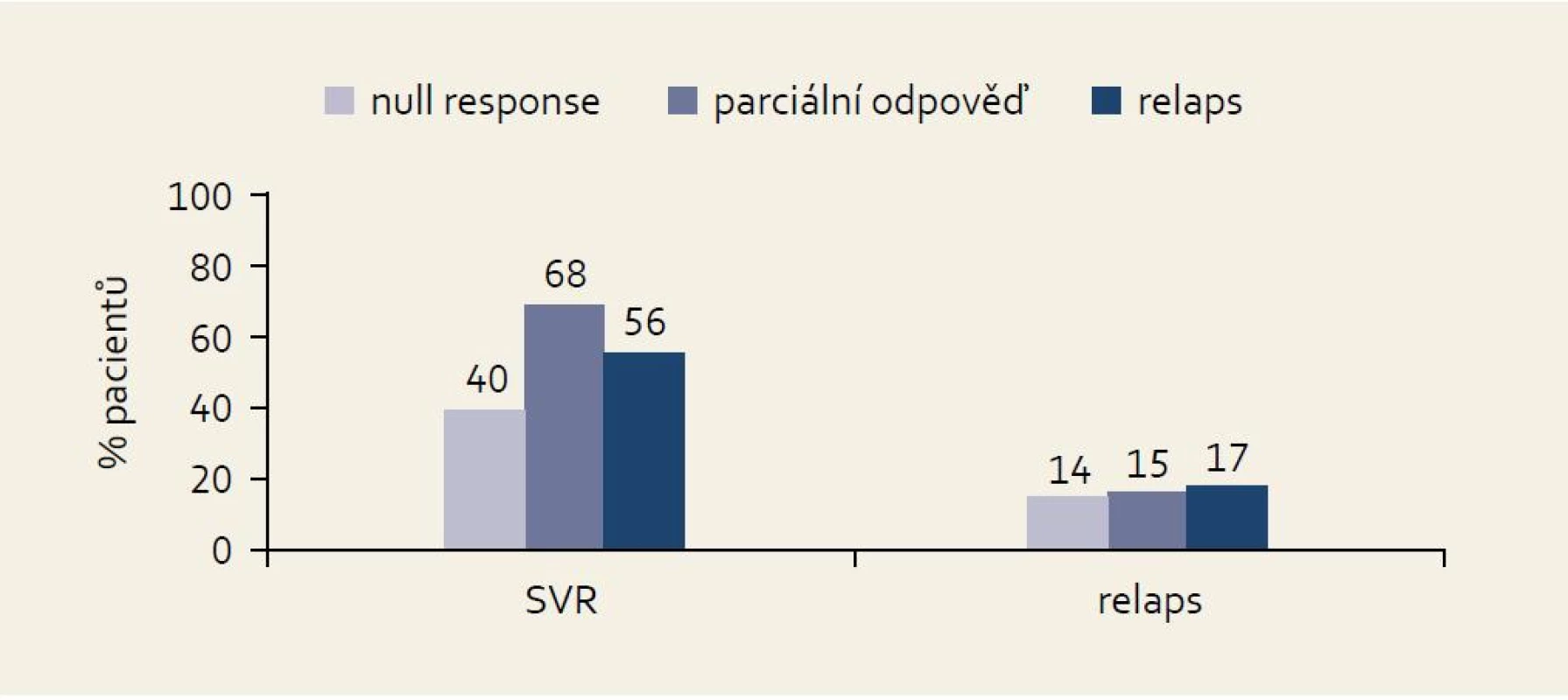
8.1.2 Publikované studie s použitím TELAPREVIRU
Studie REALIZE: schéma studie ukazuje obr. 10. Při hodnocení všech skupin pacientů bylo dosaženo SVR v 65 % při použití trojkombinace PEG-IFN/RBV + TVR. V kontrolní větvi (Standard of Care, SOC) bylo SVR dosaženo pouze v 17 % případů. Zajímavější jsou přirozeně výsledky v jednotlivých skupinách podle odpovědi na předchozí protivirovou léčbu, které ukazuje obr. 11. Je patrno, že i ve skupině osob rezistentních na předchozí léčbu (null response) je dosahováno přibližně šestkrát vyšší účinnosti (% SVR) než při použití opakované standardní léčby kombinací PEG-IFN a RBV.
Obr. 4. Schéma uspořádání studie REALI ZE. Fig. 10. REALIZE study design. 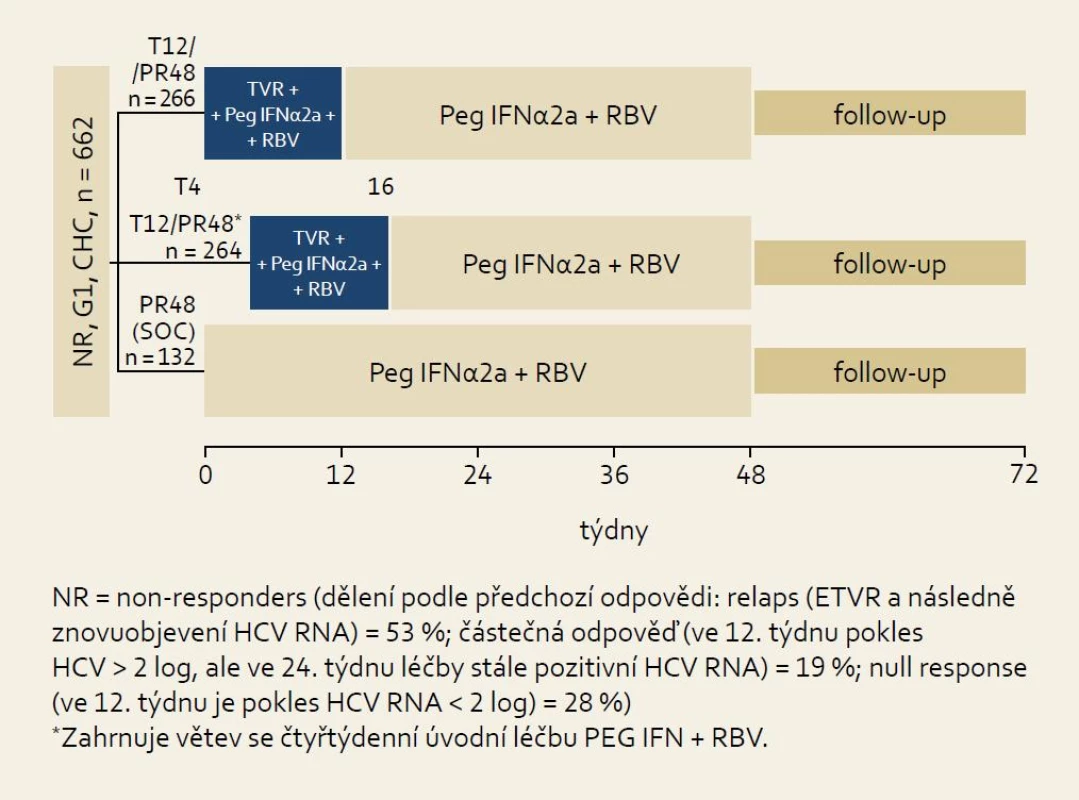
Obr. 5. SVR ve studii REALI ZE ve skupinách podle účinku předchozí protivirové léčby. Fig. 11. SVR in the REALIZE study in groups by effect of previous antiviral treatment. 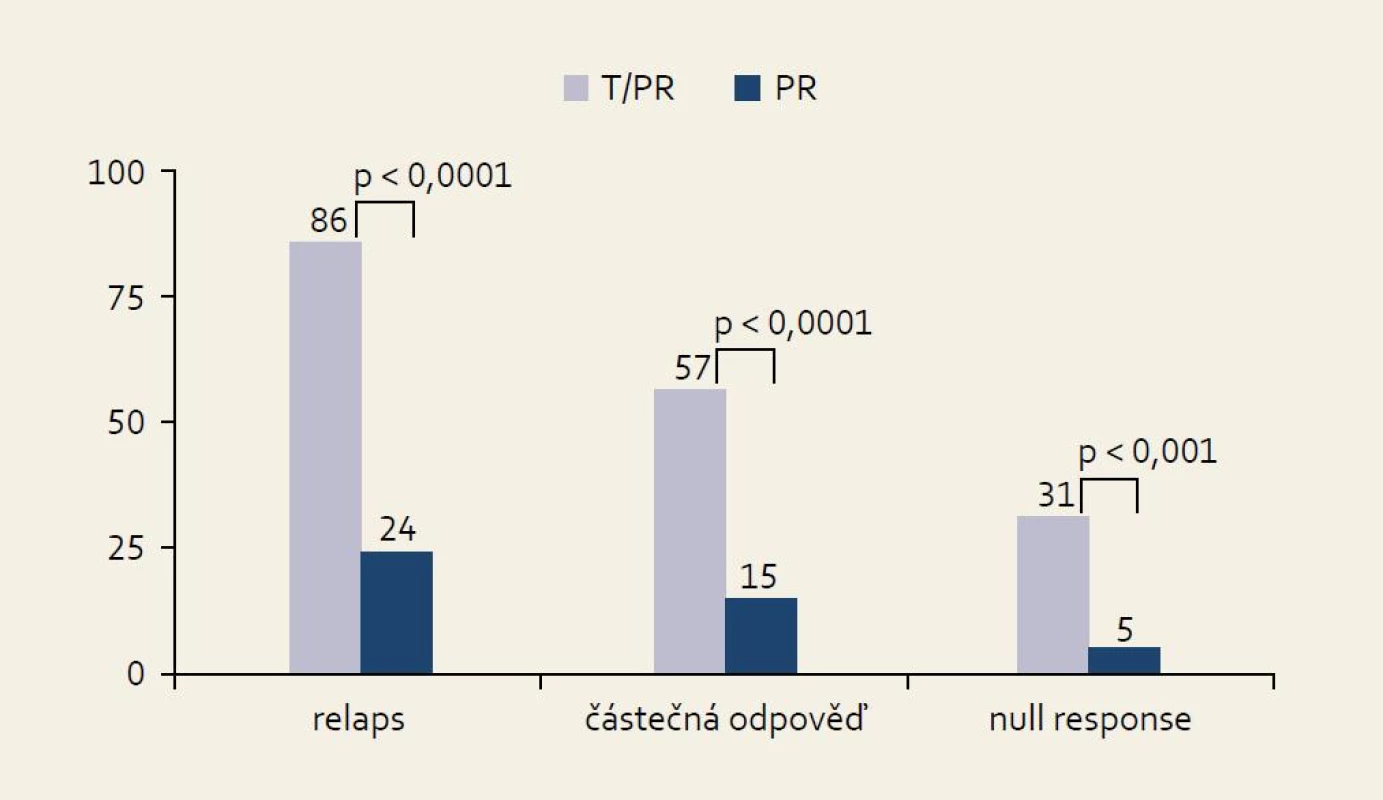
8.1.3 Pravidla opakované léčby s použitím BOCEPREVIRU nebo TELAPREVIRU
- Opakovaná léčba s boceprevirem nebo telaprevirem v kombinaci s PEG-IFN a RBV je doporučena pro pacienty, u kterých došlo k selhání protivirové léčby (null response, relaps, breakthrough, částečná odpověď).
- Léčba vedená podle odpovědi (Response Guided Therapy, RGT) s použitím bocepreviru nebo telapreviru v kombinaci s PEG-IFN a RBV může být použita u pacientů s částečnou odpovědí a relapserů.
- U pacientu s null response není RGT indikována.
- Léčba by měla být ukončena u pacientů s opakovanou léčbou vedenou trojkombinací s boceprevirem, pokud mají ve 12. týdnu léčby HCV RNA > 100 IU/ml. Důvodem je vysoká pravděpodobnost rozvoje virové rezistence při dalším pokračování léčby.
- Léčba by měla být také ukončena u pacientů s opakovanou léčbou vedenou trojkombinací s telaprevirem, pokud mají ve 4. nebo 12. týdnu léčby HCV RNA > 1 000 IU/ml. Důvodem je opět vysoké riziko vzniku virové rezistence.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Petr Urbánek, CSc.
Interní klinika 1. LF UK a ÚVN Praha
U Vojenské nemocnice 1200
169 01 Praha 6
petr.urbanek@uvn.cz
Datum schválení výborem ČHS ČLS JEP: 12. 3. 2013
Datum aktualizace: 23. 2. 2013
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2013 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Mozkový natriuretický peptid je markerem horší prognózy při dekompenzaci jaterní cirhózy
- Multifokální hepatocelulární karcinom imitující jaterní cirhózu
- Chirurgická léčba metastáz hepatocelulárního karcinomu do nadledvin
- Kolonoskopie ve vodní imerzi s „capem“ – prospektivní, randomizovaná studie
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Metastatické postižení tenkého střeva jako první projev generalizace kožního melanomu
- Endoskopická léčba Zenkerova divertiklu
- Doporučené postupy Evropské společnosti pro gastrointestinální endoskopii (ESGE): profylaxe pankreatitidy po provedené ERCP
- Invazivní léčba chronické pankreatitidy je indikována pro bolesti, podezření na malignitu, biliární obstrukci, leak a cystoid
- Zdravotní stav a karcinom pankreatu
- Prevence pankreatitidy po ERCP
- 3rd Prague Endoscopy Workshop (and 14th Endoscopy Workshop in IKEM)
- Životní jubileum prof. MUDr. Marie Brodanové, DrSc.
-
Správná odpověď na kvíz
Intramurální hematom ve stěně rekta při antikoagulační terapii - Autodidaktický test: hepatologie
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Co nového v hepatologii?
-
Kvíz – případ z klinické praxe
Nečekaná příčina akutní renální insuficience vycházející z rekta - Doporučení České gastroenterologické společnosti pro podávání antiagregační terapie kyselinou acetylsalicylovou
- Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV) – aktualizace
- Danišův jícnový stent v terapii varikózního krvácení
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Danišův jícnový stent v terapii varikózního krvácení
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Prevence pankreatitidy po ERCP
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



