-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Doporučení České gastroenterologické společnosti pro podávání antiagregační terapie kyselinou acetylsalicylovou
Autoři: M. Lukáš 1
; J. Špičák 2; R. Keil 3
Působiště autorů: Klinické a výzkumné centrum pro střevní záněty, ISCARE a 1. LF UK v Praze a Ústav klinické biochemie a laboratorní diagnostiky, 1. LF UK v Praze 1; Klinika hepato-gastroenterologie, IKEM, Praha 2; Interní klinika FN Motol a 2. LF UK v Praze 3
Vyšlo v časopise: Gastroent Hepatol 2013; 67(2): 90-94
Kategorie: Klinická a experimentální gastroenterologie: doporučené postupy
Syntézu kyseliny acetylsalicylové (ASA) uskutečnil Felix Hoffman v Bayerových laboratořích již na konci 19. stol. (1899) a záhy se tento medikament stal nejrozšířenějším léčivem (AspirinR) v historii medicíny vůbec. Stále se využívá pro jeho antiflogistické a antipyretické vlastnosti. V 80. letech minulého století se postavení ASA v klinické praxi ještě významně posílilo. Důvodem byl prokázaný silný antiagregační efekt ASA na krevní destičky vyvolaný ireverzibilní acetylací trombocytární cyklooxygenázy-1.
Současné indikace k podání antigragačních dávek ASA představují: a) léčba akutního infarktu myokardu a nestabilní anginy pectoris; b) dlouhodobá sekundární prevenci u nemocných s manifestním aterosklerotickým onemocněním tepenného řečiště; c) dlouhodobá primární prevence u osob bez manifestního aterosklerotického onemocnění tepenného řečiště s vysokým rizikem vzniku kardiovaskulárního onemocnění; d) v kombinaci s jinými protidestičkovými léčivy u nemocných po cévních operacích či cévních intervencích [1,2].
Od 30. let minulého století se začaly objevovat v odborné literatuře zprávy o nežádoucích účincích ASA na trávicí trakt. Podávání vyšších dávek ASA (1–2 g denně) bylo spojeno se vznikem žaludečních obtíží, vředu nebo vředových komplikací, jakými jsou perforace do trávicí trubice nebo masivní krvácení gastrointestinálního traktu. Až mnohem později se ukázalo, že také další léčiva označovaná dnes jako nesteroidní antirevmatika (NSA) mohou způsobovat podobné trávicích obtíže a indukovat vznik žaludečních a dvanáctníkových vředů a jejich komplikací [3]. Peptické vředy v žaludku a v duodenu, které byly indukované užíváním ASA nebo NSA, zařazujeme do skupiny chorob označovaných jako gastropatie z nesteroidních antirevmatik – zkráceně NSA-gastropatie. Patří sem poškození žaludeční sliznice a orálního duodena. Jde o pestrou škálu slizničních odchylek od erytému přes eroze až po hluboké a mnohočetné vředové defekty, výjimečně může dojít ke vzniku difuzního poškození sliznice žaludku s větším krvácením (hemoragická gastropatie). Komplikace vředů, jako je masivní krvácení z arodované podslizniční cévy nebo perforace žaludku či duodena bezprostředně ohrožují postiženého na životě. Klinické symptomy (bolest, nauzea, zvracení), které jsou vyvolány podáváním ASA nebo NSA léčiv a nejsou spojeny s poškozením sliznice žaludku, jako NSA-gastropatie neoznačujeme. V těchto případech jde o projevy intolerance, nejspíše lokálním působením ASA na sliznici žaludku a duodena. NSA-gastropatie se objevuje především u starších pacientů, nejčastěji v sedmém a osmém deceniu. Zrádné a zavádějící může být, že u většiny seniorů probíhá NSA-gastropatie bez nápadné klinické symptomatologie. Gastroskopická vyšetření u těchto nemocných ukázala, že 80 % nemocných s prokázaným vředem, který byl indukován užíváním nesteroidních antirevmatik nemá žádné bolestivé nebo dyspeptické projevy. Není proto překvapující, že dramatická příhoda, jakou je masivní krvácení do trávicí trubice, je často prvním projevem NSA-gastropatie [6,26,27].
1. Patofyziologie NSA-gastropatie
Toxické působení ASA na sliznici GIT je zprostředkováno dvěma rozdílnými mechanizmy. První představuje inhibice aktivity enzymatického komplexu cyklooxygenázy (COX). Tento systém se vyskytuje ubikviterně ve všech savčích buňkách a řídí metabolizmus kyseliny arachidonové a tvorbu biologicky aktivních substancí ze skupiny prostaglandinů a tromboxanů. Potlačení aktivity izoenzymu COX-1 je spojeno se snížením syntézy některých působků (prostacyklin – PGI2 a prostaglandiny E1,2 – PGE1,2), které jsou zásadní pro udržení integrity sliznice žaludku a duodena. Tyto látky řídí adekvátní perfuzi sliznice krví, stimulují tvorbu ochranné vrstvy hlenu a dostatečnou obnovu epiteliálních buněk [4]. Nedostatečná sekrece cytoprotektivních prostaglandinů vede ke snížení obranyschopnosti sliznice žaludku a následné převahy agresivních složek, kterými jsou kyselina solná, pepsin a žlučové kyseliny. Výsledkem je porušení sliznice v epiteliální vrstvě a v krajním případě vznik peptického vředu. Některé NSA indukované peptické vředy probíhají bezpříznakově, a proto není včas zahájena adekvátní terapie. To je pravděpodobný důvod, proč se často objevují u těchto pacientů mnohočetné a objemné vředy, často s vyvýšenými okraji (kalózní vředy).
Druhým mechanizmem, který je odpovědný za vznik slizniční lézí v oblasti žaludku, je lokální účinek kyseliny acetylsalicylové a některých nesteroidních antirevmatik. Jedná se o slabé kyseliny, které po perorálním podání v silně kyselém žaludečním prostředí (pH ≈ 1,5) nemohou disociovat a zůstávají v elektroneutrálním stavu. V této podobě však velmi dobře prostupují podle koncentračního gradientu přes membrány epiteliálních buněk žaludeční sliznice, které jsou tvořeny především fosfolipidy. Kumulace slabých kyselin v cytosolu epiteliálních buněk a jejich následná disociace ve fyziologicky neutrálním pH ≈ 7,0 vede k uvolnění kyselé valence, což indukuje intracelulární acidózu. Intracytosolická acidóza způsobuje zástavu všech metabolických procesů a nakonec vede k zániku buňky. Tento fenomén označovaný patofyziology jako „ion trapping“ se zdá být významnějším u kyseliny acetylsalicylové než u nesteroidních antirevmatik [4,5].
Výsledkem „duálního“ systémového a lokálního toxického působení je vznik peptického vředu, erozí nebo petechií v žaludeční sliznici (NSA-gastropatie) nebo projevů intolerance. Jde o pocity dyskomfortu, tlaku nebo bolestí v epigastriu, o nauzeu, zvracení a říhání. Uvedené symptomy nemají žádný morfologický podklad na sliznici žaludku a duodena. Zda se jedná o projevy porušené motility, peristoly nebo viscerální hypersenzivity v oblasti horní části trávicí trubice zůstává zatím nevyřešenou otázkou. V každém případě jsou projevy nesnášenlivosti při terapii ASA relativně častým důvodem pro ukončení terapie nebo jsou příčinou nízké adherence k podávané antiagregační terapii. Nonadherence může být u rizikových pacientů spojena s potenciálně závažnými zdravotními důsledky.
1.1 Mechanizmus antigregačního působení ASA
Antiagregační působení nízkodávkované ASA (75–150 mg denně) je založeno na biologické selektivitě inhibičního působení na destičkovou COX-1. Nízké dávky ASA inhibují preferenčně destičkovou COX-1, kdežto cyklooxygenáza v endoteliálních buňkách, kde je vytvářen vazodilatačně působící prostacyklin (PGI2), není výrazněji ovlivněna. Druhý princip vychází z toho, že ASA způsobuje ireverzibilní blokádu destičkové cyklooxygenázy-1 a vede k trvalému snížení schopnosti krevních destiček agregovat. Navzdory krátkému plazmatickému poločasu ASA (cca 20 min) přetrvává farmakodynamický efekt na krevní destičky 7–10 dnů. Po perorálním podání podléhá ASA rychlému metabolizmu a po prvém průchodu játry je téměř většina vstřebaného léčiva přeměněna na kyselinu salicylovou, která již významné ovlivnění metabolizmu prostaglandinů nevykazuje. Nejvyšší koncentrace ASA je proto v portální krvi, kdežto v systémové cirkulaci je koncentrace léčiva při podávání antiagregačních dávek velmi nízká. Navíc endoteliální buňky, na rozdíl od krevních destiček, jsou schopny resyntetizovat novou cyklooxygenázu během několika hodin.
1.2 Rizikové faktory pro vznik NSA-gastropatie
Epidemiologické studie ze západní Evropy a z USA ukázaly, že nejméně u 1 % nemocných, kteří užívají NSA nebo ASA, vykazují závažné komplikace ze strany trávicího traktu. Vzniklé komplikace jsou spojeny nejen se značnými finančními náklady na jejich léčbu, ale především s vysokou úmrtností, která se u nemocných s masivním krvácením pohybuje stále kolem 10–15 % [6]. Ve Velké Británii je v důsledku komplikací indukovaných užíváním NSA během jednoho roku hospitalizováno přes 12 000 osob, z toho více než polovina z nich pro krvácení do trávicí trubice. Protože symptomatologie NSA-gastropatie je nespolehlivá a nelze na ní postavit žádnou strategii lečby ani volbu preparátu, je žádoucí, aby u všech pacientů s nově nasazovanými NSA nebo ASA byla zhodnocena anamnéza s ohledem na výskyt peptického vředu nebo krvácení do trávicí trubice. Frekvence krvácení do trávicího traktu způsobené podáváním nízkých antiagregačních dávek ASA se v posledních letech významně zvyšuje. Ve Skotsku bylo zaznamenáno několikanásobné zvýšení hospitalizací pro krvácení do GIT; v roce 1996 to bylo 15 nemocných na 100 000 obyvatel a v roce 2005 již 40 případů na 100 000 obyvatel [7,8]. Rozsáhlé užívání nízkých dávek ASA přináší dva rozdílné výsledky. Významně snižuje riziko kardiovaskulárních příhod a také snižuje výskyt nádorových onemocnění, a to nejen gastrointestinálního traktu. Na druhou stranu přináší signifikantní riziko komplikací, především ze strany trávicí trubice [15–21]. Kombinace ASA s NSA preparáty toxicitu na sliznici horní části GIT nápadně zvyšuje (tab. 1) [22]. Zavedení gastroprotektivní léčby u rizikových pacientů snížilo v průběhu posledních deseti let frekvenci krácení do GIT po NSA. Naproti tomu incidence masivního krvácení po ASA o 46 % zvýšila. Retrospektivní analýza ukázala, že 39 %, resp. 75 % nemocných s krvácením do traktu po NSA, resp. ASA patřilo podle klasifikačních kritérií do skupiny s vysokým rizikem vzniku gastrotoxicity. Preskripce profylaktické léčby (většinou inhibitory protonové pumpy) byla zaznamenána pouze u 42 %, resp. 31 % krvácejících pacientů, jenž užívali NSA nebo ASA. Někteří soudí, že zavedení gastroprotektivní léčby snížilo celkově riziko krvácení do GIT o 50 %, avšak daleko větší účinnost profylaktické léčby IPP by byla dosažena až při významném zlepšení adherence ze strany pacientů [23–25,27].
Tab. 1. Riziko vzniku NSA gastropatie při monoterapii ASA a při kombinované léčbě s NSA. Tab. 1. The risk for NSAID-gastropathy development due to ASA therapy itself and on combination therapy by NSAIDs. 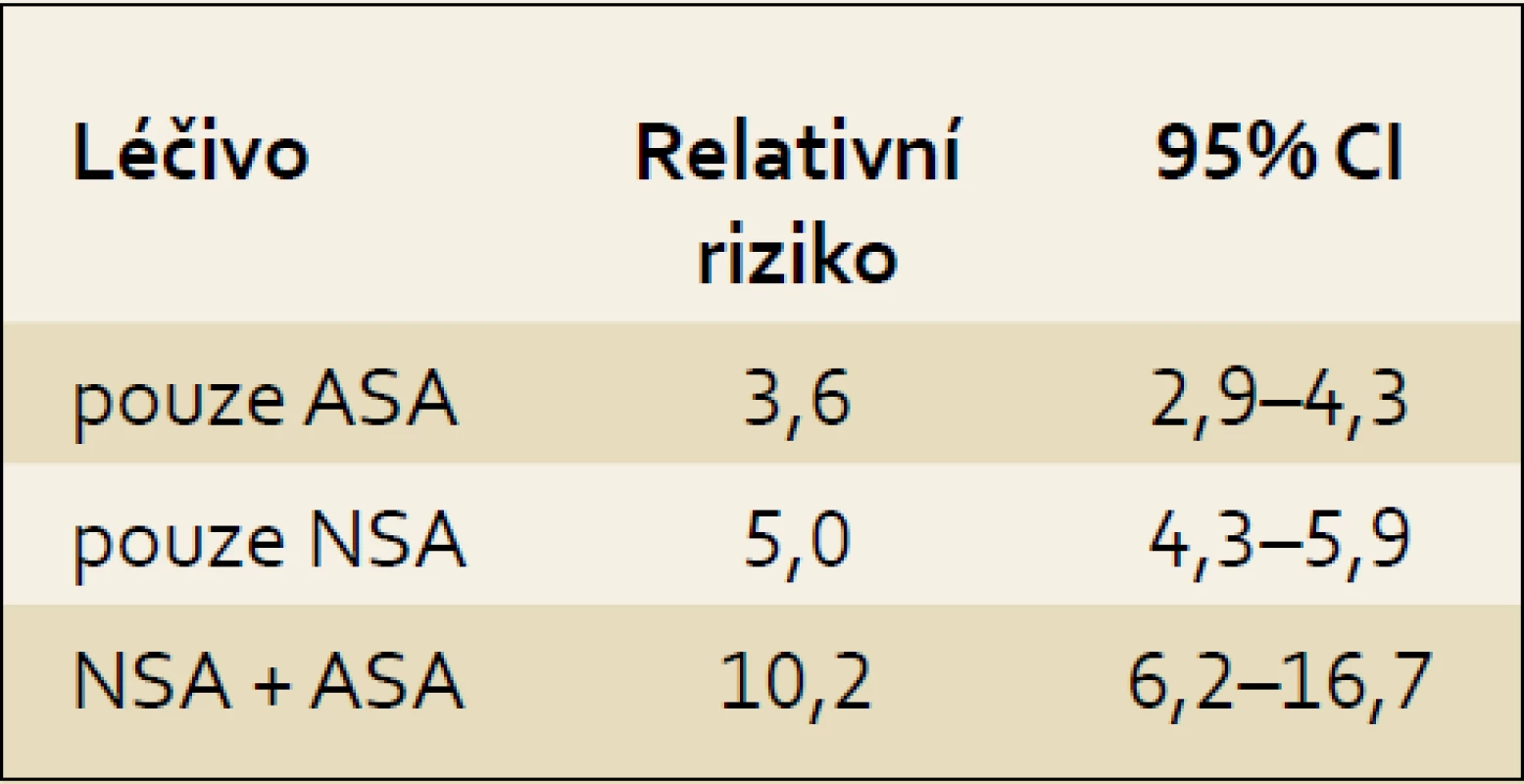
V poslední době byly definovány rizikové skupiny nemocných, u kterých je léčba ASA nebo NSA zatížena zvýšeným rizikem komplikací (tab. 2). Mezi nejrizikovější patří nemocní, kteří měli v minulosti peptický vřed s komplikací, jako je masivní krvácení nebo perforace trávicí trubice. V porovnání s osobami s negativní anamnézou mají tyto osoby patnáctinásobné riziko krvácení při nově zavedené terapii NSA nebo ASA. Dalšími rizikovými faktory pro vznik gastrointestinálních komplikací představují nemocní vyššího věku (> 65 let), užívání několika NSA a ASA současně, souběžná terapie kortikoidy nebo antikoagulancii a přítomnost významného kardiovaskulárního onemocnění. Vyššímu riziku komplikací jsou vystaveni také nemocní s revmatoidní artritidou. Přídatným faktorem pro vznik komplikací je pravidelná konzumace alkoholu.
Tab. 2. Rizikové faktory pro vznik NSA-gastropatie. Tab. 2. Risk factors for NSAIDs-gastropathy development. 
U nemocných, u kterých je plánována dlouhodobá léčba s kyselinu acetylsalicylovou, je důležité pátrat po přítomnosti helikobakterové infekce v žaludku. Současná evropská i severoamerická doporučení nabádají k eradikaci helikobakterové infekce pouze u těch osob na léčbě ASA, které jsou ve vysokém riziku recidivy vředu. Recentně publikovaná desetiletá prospektivní studie z Hong-Kongu se snažila odpovědět, zda eradikace infekce Helicobacter pylori (HP) u vysoce rizikových pacientů také sníží riziko masivního krvácení v dalším průběhu. Studie sledovala tři kohorty pacientů, první měla krvácející vřed při terapii ASA s prokázanou infekcí HP, druhá kohorta zahrnovala pacienty s krvácejícím vředem při ASA terapii bez prokázané HP infekce a třetí kohorta nemocné s průměrným rizikem bez předcházejícího krvácení. Práce ukázala, že u vysoce rizikových pacientů s potvrzenou helikobakterovou infekcí následná eradikace infekce osminásobně snížila riziko recidivy krvácení z peptické léze v dalších deseti letech a dosáhla frekvence krvácení, jako měli pacienti s průměrným rizikem. U pacientů, kteří byli ve vysokém riziku recidivy krvácení a neměli prokázanou HP infekci, bylo další podávání ASA spojeno s vysokou četností recidiv krvácení. Nálezy této práce implikují představu, že trvalá konkomitantní terapie IPP u nemocných užívajících ASA s vysokým rizikem recidivy krvácení a pozitivitou HP infekce by měla být striktně realizována pouze u těch nemocných, kteří užívají ještě jiné NSA, antiagregacia, kortikosteroidy nebo antikoagulacia. U ostatních pacientů, pakliže eradikace byla efektivní, není podávání IPP nezbytné [12,13].
2. Postupy snižující riziko NSA-gastropatie a projevy ASA-intolerance
V prevenci i léčbě NSA-gastropatie jsou u osob vysokého rizika doporučovány inhibitory protonové pumpy. Dávka v preventivním režimu by měla být v případě omeprazolu 20 mg denně, dávka při terapii již vniklé NSA-gastropatie dvojnásobná (40 mg denně). Podobně je upraveno dávkování také u ostatních inhibitorů protonové pumpy. Důležité je, že není nutné při léčbě IPP vysazovat NSA nebo ASA, protože ke zhojení slizničních změn dojde i při pokračující aplikaci těchto léčiv [9,10].
U nemocných, kteří nemají zvýšené riziko vzniku NSA-gastropatie, je vhodným postupem z hlediska minimalizace gastrointestinální toxicity podávat enterosolventní formu kyseliny acetylsalicylové (ecASA). Jedná se o léčivo dostupné v zemích západní Evropy již několik let, kdežto na domácím trhu se ecASA objevil teprve před několika měsíci. Jde o speciální lékovou formu, ve kterém je účinná látka (ASA) obalena polyakrylátovou pryskyřicí Eudragit L-100, která je rezistentní vůči kyselému prostředí žaludku. K uvolnění účinné látky z tohoto acidorezistentního obalu dochází až v tenkém střevě po zvýšení hodnoty pH intraluminálního obsahu nad 6. Z tohoto důvodu je resorpce ecASA z trávicího ústrojí proti standardní ASA tabletě o 3–6 hod opožděna a také jsou zaznamenány nižší vrcholové hodnoty léčiva po jednorázovém podání. Acidorezistentní obal v lékové formě ecASA znemožňuje uvolnění ASA v žaludku, a tak je potlačen nepříznivý lokální toxický efekt léčiva na sliznici žaludku („ion trapping fenomén“). Nemocní na terapii s enterosolventním preparátem (ecASA) vykazují také významně lepší toleranci při dlouhodobém podávání.
Tab. 3. Doporučení pro podávání ASA nebo NSA terapie. Tab. 3. Recommendation for ASA or NSAIDs therapy. 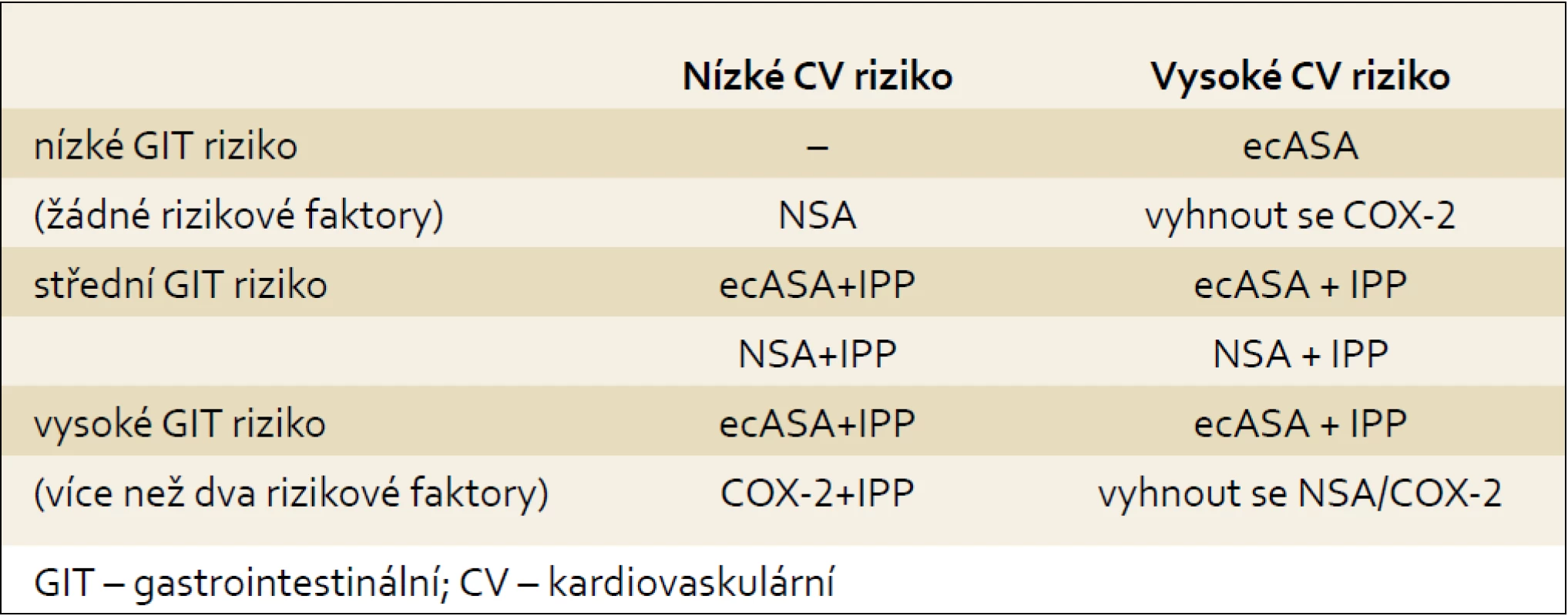
2.1 Farmakodynamický efekt ecASA
Použití ecASA preparátu, ze kterého nedochází k uvolnění účinné látky (ASA) v žaludku, indukovalo otázku, zda farmakodynamický efekt takto upraveného léčiva je srovnatelný se standardní (neenterosolventní) formulí ASA. Již před více než deseti lety byla provedena studie na zdravých dobrovolnících, která monitorovala změny v produkci tromboxanu B2 (TXB2) a agregaci trombocytů po sedmidenní terapii ecASA v dávce 100 mg denně v porovnání s podáváním stejných dávek standardní lékové formy ASA. Oba léčivé přípravky v dávce 100 mg denně měly významně silnější farmakodynamický efekt posuzovaný stupněm inhibice tvorby TXB2 a 6-ketoPGF1 v porovnání s dávkou 40 mg ASA v neenterosolventním obalu. Agregace destiček byla snížena při podávání standardní ASA o 69 %, po léčbě ecASA o 59 % , po léčbě ASA v dávce 40 mg o 24 %. Tvorba TXB2 byla snížena o 90 % v případě ASA, o 85 % ecASA. Navíc bylo v této studiu potvrzeno, že nízké dávky ASA nemají vliv na tvorbu prostacyklinu (PGI2) [4].
2.2 Klinické zkušenosti s ecASA
Rozsáhlé zkušenosti s dlouhodobým podáváním ecASA byly demonstrovány na velkém souboru probandů ve studii Dariuse [5]. Prospektivní observační studie se účastnilo celkem 577 německých internistů nebo praktických lékařů. Do sledovaného souboru bylo zařazeno celkem 2 739 pacientů, kteří byli indikováni k dlouhodobě antiagregační terapii z důvodů sekundární prevence kardiovaskulárních chorob. Nejčastější indikací k zahájení terapie byl stav po akutním infarktu myokardu (32,9 %), nestabilní angina pectoris (30,8 %), stav po tranzitorní mozkové příhodě (24,1 %) a sekundární profylaxe po dokonané cévní mozkové příhodě (12,7 %) a perkutánní intrakoronární angioplastice (8,9 %) nebo po operaci na periferním arteriálním cévním řečišti (12,9 %). Celkem 1 152 (42,7 %) nemocných dostalo ecASA jako první volbu a u 1 570 nemocných (57,3 %) byla terapie ecASA jako druhá, po předchozím podávání standardní lékové formy neenterosolventní ASA. Hlavní důvody pro změnu ze standardní lékové formule ASA na ecASA byly projevy nesnášenlivosti, především ze strany trávicího ústrojí. U 2,7 % pacientů byly obtíže natolik závažné, že vedly k pracovní neschopnosti. Nemocní byli sledování po dobu dvou let a během této doby absolvovali celkem osm návštěv u svých ošetřujících lékařů, kteří zaznamenávali výskyt trávicích obtíží nebo přerušení léčby. Po celé dvouleté období vykazovali nemocní velmi dobrou snášenlivost a na konci sledování bylo 83 % z nich na uvedené medikaci. Zajímavé je, že si 37 % pacientů na začátku sledování stěžovalo na trávicí problémy, především pyrózu při terapii ASA. Tři měsíce od převedení terapie z neenterosolventní formy ASA na ecASA byla frekvence pyrózy jen 19 % a po dvou letech se ještě snížila na 10,5 %. V průběhu sledování po převedení na terapii ecASA se zmírnila také intenzita pyrózy. Podobně příznivě byl zaznamenán vývoj žaludečních obtíží charakterizovaných pocitem dyskomfortu v epigastriu, nauzeou a říháním. Na začátku studie byly žaludeční obtíže detekovány u poloviny všech probandů na standardní terapii ASA, kdežto pouze u 8 % z nich byly uváděny na konci dvouletého podávání při terapii ecASA. Projevy závažného krvácení do trávicího ústrojí byly pozorován u 1,6 % nemocných na standardní terapii ASA, při léčbě ecASA byl výskyt 0,3 % po třech měsících léčby a pouze u 0,1 % probandů na konci dvouletého sledování [5]. V průběhu 90. let minulého století bylo provedeno několik studií na zdravých dobrovolnících, které hodnotily mikrokrvácení do trávicího ústrojí na základě měření aktivity erytrocytů značených radioizotopem Cr51 ve stolici. Celkem ve třinácti studiích bylo zhodnoceno více než 2 400 probandů. Dávkování ecASA se pohybovalo od 300–3 900 mg denně. Ve všech těchto zkouškách se ukázalo, že mikrokrvácení do trávicího ústrojí při podávání ecASA je srovnatelné s efektem placeba. Ztráty krve do trávicího ústrojí po stejných dávkách standardní lékové formule ASA byly několikanásobně vyšší. Endoskopické monitorování osob léčených ecASA a standardním ASA ukázalo, že enterosolventní obal ASA zaručuje významně nižší frekvenci výskytu slizničních změn na žaludku. V několika endoskopických studiích bylo sledováno celkem 409 dobrovolníků s průměrnou denní dávkou ASA 2,5 g denně. U žádného z probandů léčených ecASA nebyla prokázána komplikace v podobě krvácejícího vředu [11].
3. Doporučení
Na základě zkušeností z klinické praxe a výsledků provedených studií považujeme ecASA za nejvhodnější antiagregační v sekundární prevenci kardiovaskulárních chorob. U pacientů s vysokým rizikem gastrointestinální toxicity by měla být antiagregační terapie nízkodávkovanou kyselinou acetylsalicylovou doplněna o profylaktické podávání IPP a provedena eradikace helikobakterové infekce.
- U nemocných s vysokým rizikem gastrointestinální toxicity (NSA--gastropatie/komplikace nebo více než dva rizikové faktory) je podávání ecASA vždy nutné doplnit o antisekreční terapii inhibitory protonové pumpy (IPP), v případě nutnosti podávat NSA přichází v úvahu COX-2 společně s IPP.
- U pacientů se střední rizikem gastrointestinální toxicity (1–2 rizikové faktory) je vhodné antigregační terapie ecASA nebo v případě potřeby aplikace NSA podat terapii IPP.
- U nemocných bez většího rizika gastrontestinální toxicity není potřeba antiagregační terapii ASA nebo antiflogistickou léčbu NSA dopňovat žádnou gastroprotektivní léčbou. Vzhledem k lepší snášenlivost je doporučována jak první volba antiagregační terapie v podobě ecASA.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 27. 3. 2013
Přijato: 5. 4. 2013
prof. MUDr. Milan Lukáš, CSc.
ISCARE Lighthouse, a. s.
Jankovcova 1569/2c, 170 00 Praha 7
milan.lukas@email.cz
Zdroje
1. Graham GB. Antithrombotics trialist corporation. Lancet 2009; 373(9678): 1849–1860.
2. Hradec J, Býma S. Ischemická choroba srdeční, Doporučený diagnostický a léčebný postup pro všeobecné praktické lékaře,CDP-PL, 2009.
3. Douthweit H, Lintott GAM. Gastroscopic observation of effect of aspirin and certein ather substances on the stomach. Lancet 1938; 2 : 1222–1225.
4. Bode-Boger SD, Boger RH, Schubert M et al. Effects of very low dose and enteric--coated acetylsalicyc acid on prostacycline and thromboxane formation on bleeding time in healthy subjects. Eur J Clin Pharmacol 1998; 54(9–10): 707–714.
5. Darius H. Anwendungsbeobachtung dokumentiert gute Vertraglichkeit. Pharmazie 2006; 34 : 3090–3098.
6. Lukáš M, Chalupná P. Masivní krvácení z horní části trávicí trubice, indukované nesteroidními antirevmatiky. Endoskopie 2001; 10(2): 32–38.
7. Taha AS, Angerson WJ, Knill-Jones RP et al. Upper gastrointestinal haemorrhage associated with low-dose aspirin and anti-thrombotic drugs–a 6-year analysis and comparison with non-steroidal anti-inflammatory drugs. Aliment Pharmacol Ther 2005; 22(4): 285–289.
8. Taha AS, Angerson WJ, Prasad R et al. Upper gastrointestinal bleeding and the changing use of COX-2 non-steroidal anti-inflammatory drugs and low-dose aspirin. Aliment Pharmacol Ther 2007; 26(8): 1171–1178.
9. Martínek J, Lukáš M. Inhibitory protonové pumpy „up to date“. Gastroenterol Hepatol 2011; 65(6): 331–342.
10. Lanza FL, Chan FK, Quigley EM; Practice Parameters Committee of the American College of Gastroenterology. Guidelines for prevention of NSAID-related ulcer complications. Am J Gastroenterol 2009; 104(3): 728–738.
11. Dammann HG. Gastroduodenal tolerability profile of low enteric coated ASA. Gastroenterology International 1998; 11(4): 205–216.
12. Chan FKL, Ching JYL, Suen BY et al. Effects of Helicobacter pylori infection on long--term risk of peptic ulcer bleeding in low-dose aspirin users. Gastro 2013; 144(3): 528–535.
13. Malfertheiner P, Megraud F, O’Morain C et al. Management of Helicobacter pylori infection: the Maastricht IV/Florence Consensus Report. Gut 2012; 61(5): 646–664.
14. Lanas A, Perez-Aisa MA, Feu F et al. A nation study of mortality associated with hospital admission due to severe gastrointestinal events and those associated with nonsteroidal anti-inflammatory drug use. Am J Gastroenterol 2005; 100(8): 1685–11693.
15. Steering Committee of the Physicians Health Study Research Group . Final report on the aspirin component of the ongoing Physician’s Health Study. N Engl J Med 1989; 321(3): 129–135.
16. Slattery J, Warlow CP, hSorrock CJ et al. Risks of gastrointestinal bleeding during secondary prevention of vascular events with aspirin – analysis of gastrointestinal bleeding during the UK-TIA trial. Gut 1995; 37(4): 509–511.
17. Naschitz JE, Yeshurun B, Odeh M et al. Overt gastrointestinal bleeding in the course of chronic low dose aspirin administration for secondary prevention of arterial occlusive disease. Am J Gastroenterol 1990; 85(4): 408–411.
18. Kurata JH, Abbey DE. The effect of chronic aspirin use on duodenal and gastric ulcer hospitalizations. J Clin Gastroenterol 1990; 12(3): 260–266.
19. McQuaid KR, Laine L. Systemic review and meta-analysis of adverse events of low-dose aspirin and clopidogrel in randomized controlled trials. Am J Med 2006; 119(8): 624–638.
20. Serrano P, Lanas A, Arroyo MT et al. Risk of upper gastrointestinal bleeding in patients taking low-dose aspirin for the prevention of cardiovascular diseases. Aliment Pharmacol Ther 2002; 16(11): 1945–1953.
21. Laine L. Review article: gastrointestinal bleeding with low-dose aspirin — what’s the risk? Aliment Pharmacol Ther 2006; 24(6): 897–908.
22. Van Soest EM, Valkhoff VE, Mazzaglia G et al. Suboptimal gastroprotective coverage of NSAID use and the risk of upper gastrointestinal bleeding and ulcers: an observational study using free European databases. Gut 2011; 60(12): 1650–1659.
23. Valkhoff VE, van Soest EM, Sturkenboom MC et al. Time-trends in gastroprotection with nonsteroidal antiinflammatory drugs (NSAIDs). Aliment Pharmacol Ther 2010; 31(11): 1218–1228.
24. Lopez-Pintor E, Lumbreras B. Use of gastrointestinal prophylaxis in NSAID patients: a cross sectional study in community pharmacies. Int J Clin Pharm 2011; 33(2): 155–164.
25. Wong GL, Wong VW, Chan Y et al. High incidence of mortality and recurrent bleeding in patients with Helicobacter pylori--negative idiopathic bleeding ulcers. Gastroenterology 2009; 137(2): 525–531.
26. Ng SC, Chan FK. NSAID-induced gastrointestinal and cardiovascular injury. Curr Opin Gastroenterol 2010; 26(6): 611–617.
27. Ho CW, Tse YK, Wu B et al. The use of prophylactic gastroprotective therapy in patients with nonsteroidal anti-inflammatory drug - and aspirin-associated ulcer bleeding: a cross-sectional study. Aliment Pharmacol Ther 2013; 37(8): 819–824.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2013 Číslo 2- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Mozkový natriuretický peptid je markerem horší prognózy při dekompenzaci jaterní cirhózy
- Multifokální hepatocelulární karcinom imitující jaterní cirhózu
- Chirurgická léčba metastáz hepatocelulárního karcinomu do nadledvin
- Kolonoskopie ve vodní imerzi s „capem“ – prospektivní, randomizovaná studie
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Metastatické postižení tenkého střeva jako první projev generalizace kožního melanomu
- Endoskopická léčba Zenkerova divertiklu
- Doporučené postupy Evropské společnosti pro gastrointestinální endoskopii (ESGE): profylaxe pankreatitidy po provedené ERCP
- Invazivní léčba chronické pankreatitidy je indikována pro bolesti, podezření na malignitu, biliární obstrukci, leak a cystoid
- Zdravotní stav a karcinom pankreatu
- Prevence pankreatitidy po ERCP
- 3rd Prague Endoscopy Workshop (and 14th Endoscopy Workshop in IKEM)
- Životní jubileum prof. MUDr. Marie Brodanové, DrSc.
-
Správná odpověď na kvíz
Intramurální hematom ve stěně rekta při antikoagulační terapii - Autodidaktický test: hepatologie
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Co nového v hepatologii?
-
Kvíz – případ z klinické praxe
Nečekaná příčina akutní renální insuficience vycházející z rekta - Doporučení České gastroenterologické společnosti pro podávání antiagregační terapie kyselinou acetylsalicylovou
- Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV) – aktualizace
- Danišův jícnový stent v terapii varikózního krvácení
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Danišův jícnový stent v terapii varikózního krvácení
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Prevence pankreatitidy po ERCP
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



