-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Multifokální hepatocelulární karcinom imitující jaterní cirhózu
Multifocal hepatocellular carcinoma imitating hepatal cirrhosis
In this article, we describe a case of a 40-year-old man admitted to hospital with icterus. During the examination process, liver cirrhosis was suspected. Metabolic liver diseases and autoimmune hepatitis were excluded by examination. Because of alcohol abuse and negative results of the examinations, the etiology of liver cirrhosis was concluded as toxonutritive. After consultation with the Institute of Clinical and Experimental Medicine, liver transplantation was contraindicated due to assumed toxonutritive etiology of cirrhosis. During hospitalization, acute liver failure developed. The patient was urgently transferred to the intensive care unit, where a few days later he died of liver failure with multi-organ damage. The autopsy revealed multifocal hepatocellular carcinoma.
Key words:
hepatal cirrhosis – terminal liver failure – multifocal hepatocellular carcinoma
Autoři: M. Horvatová 1; R. Keil 1; M. Roznětinská 1; J. Chudý 1; M. Grega 2; A. Mazáková 3
Působiště autorů: Interní klinika – oddělení gastroenterologie 2. LF UK a FN v Motole 1; Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole 2; Klinika zobrazovacích metod 2. LF UK a FN v Motole 3
Vyšlo v časopise: Gastroent Hepatol 2013; 67(2): 111-114
Kategorie: Hepatologie: kazuistika
Souhrn
V našem sdělení popisujeme případ 40letého pacienta, který byl přijat na interní kliniku pro nově vzniklý ikterus. V průběhu vyšetřovacího procesu byla vyslovena suspekce na jaterní cirhózu. Provedenými vyšetřeními byly vyloučeny metabolické choroby i autoimunitní etiologie. Vzhledem k abúzu alkoholu a negativitě provedených vyšetření byla etiologie jaterní cirhózy uzavřena jako toxonutritivní. Indikace pacienta k transplantaci jater byla konzultována s Institutem klinické a experimentální medicíny. Pacient byl kontraindikován pro zvažovanou toxonutritivní etiologii. V dalším průběhu hospitalizace došlo k fulminantnímu jaternímu selhání. Pacient byl urgentně přeložen na metabolickou jednotku, kde během několika dnů v listopadu 2011 zemřel pod obrazem jaterního selhání s multiorgánovým poškozením. Při patologicko-anatomické pitvě byl odhalen multifokální hepatocelulární karcinom.
Klíčová slova:
jaterní cirhóza – terminální jaterní selhání – multifokální hepatocelulární karcinom
Hepatocelulární karcinom je páté nejčastější nádorové onemocnění ve světě a třetí nejčastější příčina úmrtí na nádorové nemocnění [1]. V ČR se jedná o vzácnější nádorové onemocnění. Rozlišujeme standardní formu hepatocelulárního karcinomu (HCC) s jeho cytologickými a architektonickými variantami a fibrolamelární typ, který je častější u mladých lidí a bez asociace s jaterní cirhózou [10]. Příznaky onemocnění závisí na velikosti nádoru a funkčním stavu jater. Buď pozorujeme nespecifické příznaky jako nechutenství, váhový úbytek, břišní dyskomfort nebo u necirhotických jater může být prvním příznakem cholangoitida při invazi nádoru do žlučových cest. S vysokým rizikem vzniku HCC se spojuje alkoholická jaterní cirhóza, cirhóza při virové hepatitidě B a C, cirhóza vyvolaná hereditární hemochromatózou.
Volba typu léčebné metody a její úspěšnost závisí na rozsahu nádorového onemocnění a funkčním postižení ostatního parenchymu. Mezi kurativní metody patří chirurgická resekce, radiofrekvenční ablace a transplantace jater. K paliativním metodám s prokázaným efektem patří transarteriální chemoembolizace (TACE), alkoholizace (PEI) a systémová léčba sorafenibem [9].
Obr. 1. Přechod normální jaterního parenchymu a nádorové tkáně (označeno šipkou). Fig. 1. Transition between normal liver parenchyma and tumour tissue (marked with an arrow). 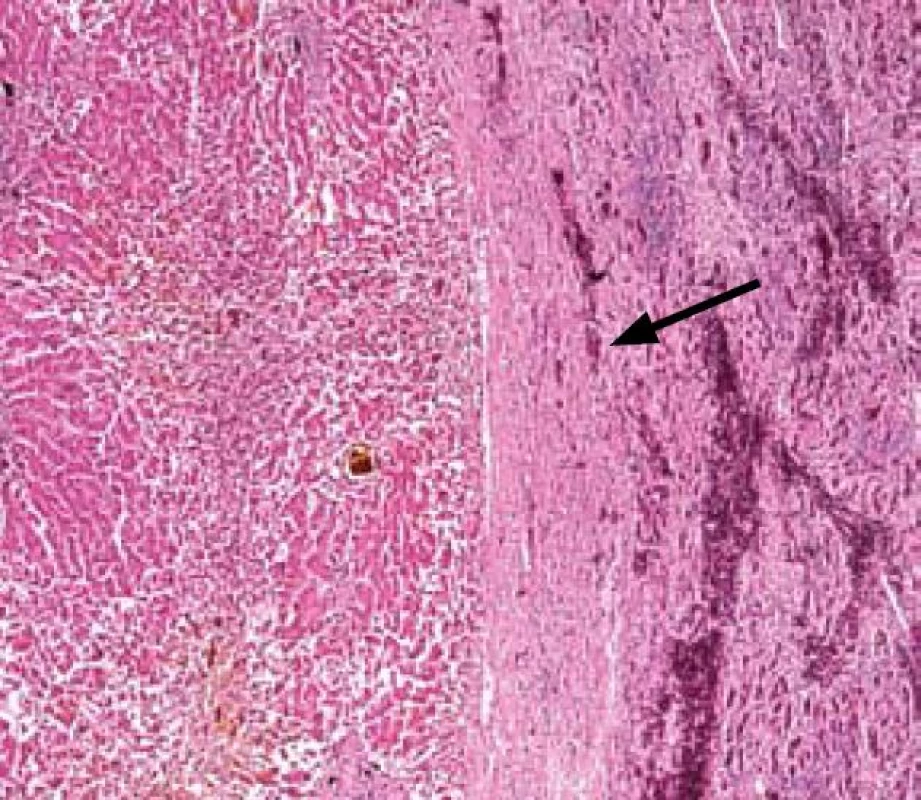
BCLC klasifikace (Barcelona Clinic Liver Cancer staging system) dělí pacienty podle prognózy do pěti skupin. V časných stadiích (skupina 0 a A) je zvažována terapie s kurativním záměrem, tj. resekce, transplantace jater a radiofrekvenční ablace (RFA). U pacientů ve středně pokročilém stadiu (skupina B) je metodou volby transarteriální chemoembolize, která prodlužuje celkové přežití pacienta. Pacienti s pokročilým karcinomem (skupina C) je účinná systémová léčba tyrozinkinázovým inhibitorem sorafenibem.
V případě možnosti pouze symptomatické léčby u pacientů s pokročilým HCC s celkově špatným stavem se neliší terapie od terapie pacienta s pokročilou jatení cirhózou [2].
Popis případu
V této kazuistice uvádíme případ 40letého pacienta, který byl dovyšetřován pro ikterus.
Anamnesticky pacient prodělal již v r. 2002 boreliózu, poté byla v kontrolních laboratorních odběrech patrná elevace jaterních testů, dle sonografie břicha byl nález difuzní jaterní léze, klinicky nebyl pozorován vznik ikteru. V roce 2009 vznikl poprvé u pacienta ikterus po větším alkoholovém excesu (v té době celkový bilirubin 50 µmol/l). Tehdy byl stav řešen podáním hepatoprotektiv bez dalšího dovyšetření a dispenzrizace. Pacient abúzus alkoholu nevylučoval, jak požívání pravidelné, tak nárazové. Od září roku 2011 pozoroval pacient asi tři týdny trvající silný ikterus, zvýšenou únavu, tlak v pravém podžebří, proto byl vyšetřen v ÚVN v Praze. Bilirubin byl již při vyšetření 260 µmol/l. V Nemocnici na Bulovce byly vyloučeny akutní virové hepatitidy A, B, C.
Na sonografii břicha byla patrná hraniční velikost jater, difuzně nehomogenní mapovité struktury, žlučové cesty bez patologie, bez nálezu ložiskových změn v oblasti dutiny břišní.
Pacient byl přijatý na Interní kliniku 2. LF UK a FN v Motole v říjnu roku 2011 k celkovému dovyšetření.
V úvodu hospitalizace bylo zahájeno dovyšetření etiologie hepatopatie. Hepatotropní viry byly negativní (možná nedávná reaktivace EBV). Z imunologických odběrů byla zjištěna slabě pozitivita ASMA. Pro výraznou patologii v metabolizmu železa (železo 53,7 µmol/l, saturace transferinu 92,9 %, feritin 4 596 µg) zvažována hemochromatoza, o kterou se dle provedených vyšetření nejednalo. Byla pouze mírná elevace AFP (93,8 µg/l).
Na kontrolním UZ jater byla játra nerovných okrajů, uzlovité echostruktury, nešlo vyloučit přestavbový proces charakteru cirhózy. Při gastroskopickém vyšetření byly přítomny jícnové varixy 1. stupně a známky mírné portální hypertenzní gastropatie, pacient nikdy v minulosti nekrvácel. Dle CT byla hrbolatá kontura jater, nepravidelná struktura a několik denzních uzlů postkontrastně nediferencovatelných. Již od začátku hospitalizace se pacient cítil celkem dobře. V průběhu laboratorních kontrol došlo k poklesu jaterních testů (ALT 36…25…20, AST 31……28…24, GMT 10…6…4), naopak došlo ke vzestupu bilirubinu (264…370……350…390 µmol/l). Docházelo k mírnému poklesu albuminu a vzestupu spontánní koagulace (INR 1,26…2,24……2,8). Proto jsme indikovali transjugulární biopsii jater, vzorek byl jen omezeně reprezentativní. Při provedení biopsie nebylo měření transjugulárího gradientu z jaterní žíly provedeno. Speciálním barvením bez průkazu zvýšené akumulace železa v hepatocytech vyloučil nález hemochromatózu. Architektonika parenchymu byla obtížně hodnotitelná, portální pole byla vazivovitě rozšířená, z limitovaného odběru šlo uvažovat o cirhotické přestavbě, Malloryho hyalin nebyl jednoznačně prokázán. Steatohepatitida byla etiologicky slučitelná s abúzem alkoholu. V průběhu další hospitalizace došlo náhle ke zhoršení stavu pacienta, s rozvojem jaterní encefalopatie, která byla s částečným ústupem na infuzní terapii s obsahem esenciálních rozvětvených aminokyselin. I když byl uváděn abúzus alkoholu a nadále jsme měli podezření na toxonutritivní etiologii hepatopatie, konzultujeme pacienta a následně překládáme na Kliniku hepatogastroenterologie Institutu klinické a experimentální medicíny ke zvážení transplantace jater. Časná transplantace jater nebyla u pacienta indikována, protože na konzervativní terapii docházelo k poklesu bilirubinu a ostatních jaterních testů. Pacient byl přeložen zpět na Interní kliniku FN v Motole. Krátce po překladu došlo k rozvoji jaterního kómatu, rozvoji hepatorenálního syndromu, selhání spontánní ventilace a objevily se křeče s abnormálním nálezem na elektroencefalografii. Pacient byl urgentně přeložen na monitorované lůžko jednotky intenzivní péče. Opakovaně bylo kontaktováno transplantační centrum Institutu klinické a experimentální medicíny, možnost akutní transplantace byla zamítnuta, požadována byla několikaměsíční doložená abstinence. Pacient zemřel pod obrazem neřešitelného jaterního selhání. U pacienta byla provedena patologicko-anatomická pitva. Játra vážila 1 080 g. Dle makroskopického sekčního nálezu byly v jaterním parenchymu nalezeny uzle žlutohnědé barvy průměru 20–30 mm, místy splývající (obr. 2). Uzle mikroskopicky odpovídaly splývajícím ložiskům hepatocelulárního karcinomu. Nádorové struktury tvoří trámce a pruhy nádorových buněk, které se střídají s pruhy kolagenního vaziva. Nádor je v okraji ohraničený vazivem, které vytváří až naznačené opouzdření. Okolní nenádorový jaterní parenchym byl s mírnou fibrotizací portálních polí, s centrilobulárními nekrózami a s těžkou cholestázou, ale bez jednoznačných známek cirhotické přestavby. Vzhledem k morfologii a architektonice nádorových struktur, částečnému opouzdření a nepřítomnosti cirhotické přestavby v okolním jaterním parenchymu byl zvažován fibrolamelární typ HCC. Pitva byla provedena po více než 40 hod od úmrtí pacienta. Vzhledem k pokročilému stupni autolýzy nebylo možné provést speciální imunohistochemické vyšetření a tato diagnóza nebyla jednoznačně potvrzena. Nádorové metastázy nebyly při pitvě zastiženy ani v lymfatických uzlinách ani v jiných orgánech. V pitevním nálezu bylo v korelaci s klinickým obrazem stanoveno jaterní selhání jako příčina smrti pacienta.
Obr. 2. Multifokální hepatocelulární karcinom. Na řezu jsou patrny uzly žlutohnědé barvy místy splývající. Fig. 2. Multifocal hepatocellular carcinoma. In the section there are visible nodes of yellow-brown colour, confluent at some places. 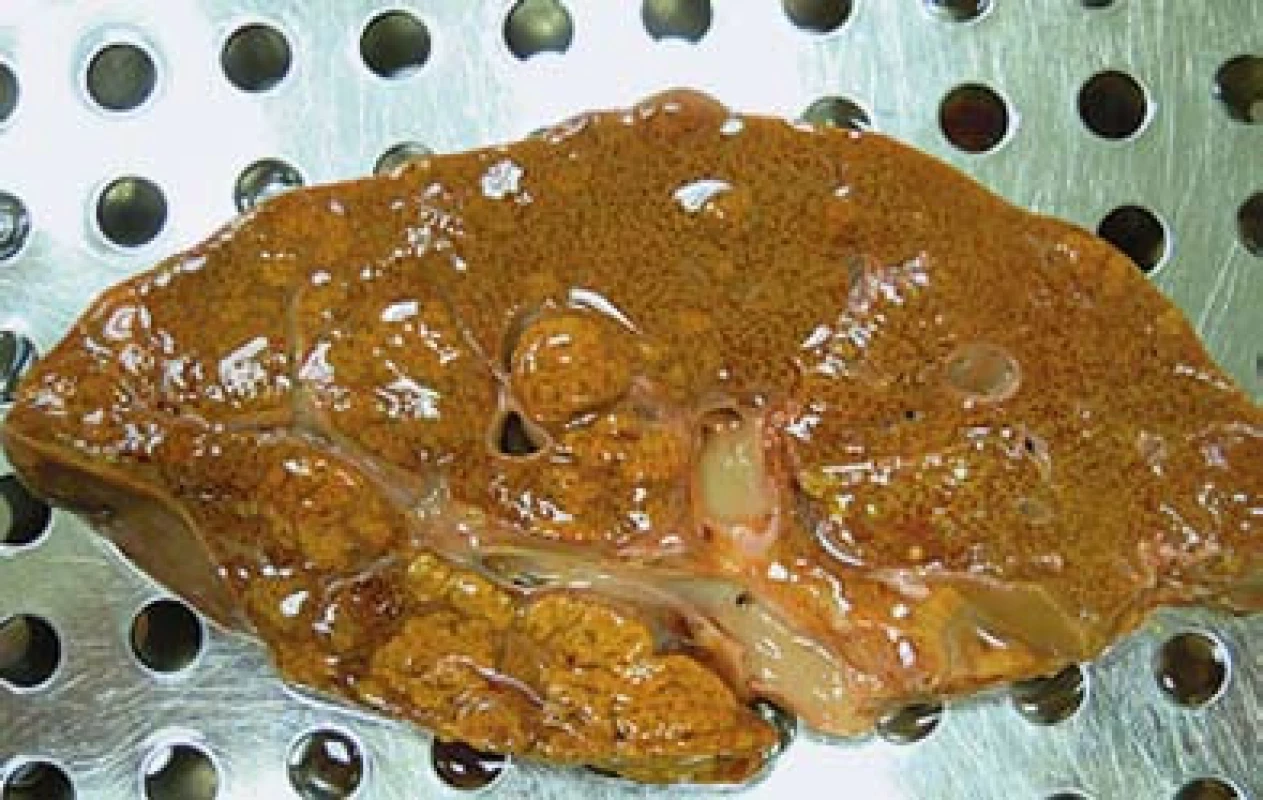
Obr. 3. Tranzverzální řez pravého laloku jaterního v nativní fázi. Fig. 3. Transversal cut of right liver lobe in native phase. 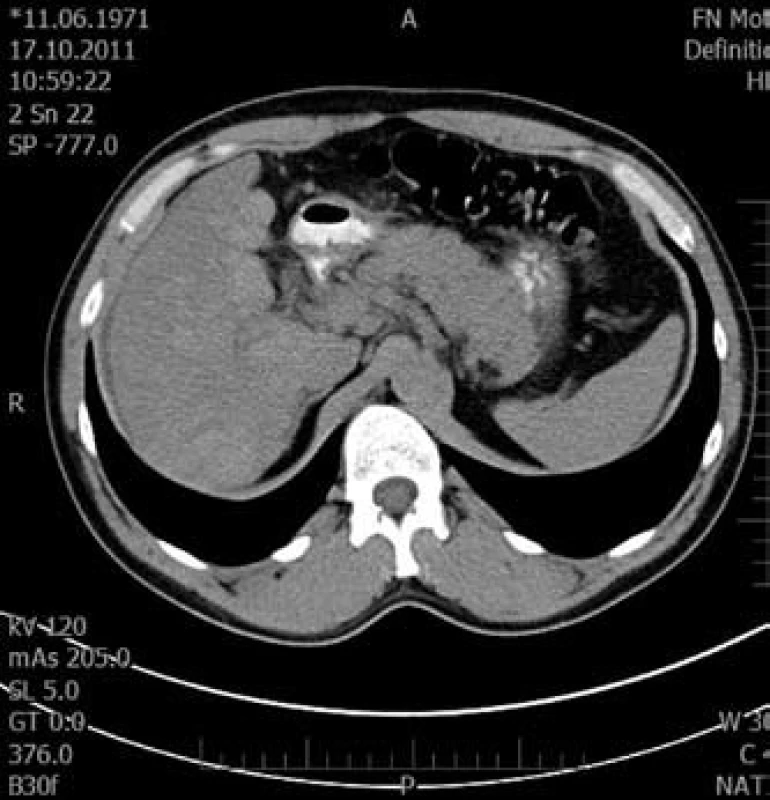
Obr. 4. Tranzverzální řez pravého laloku jaterního v arteriální fázi. Fig. 4. Transversal cut of right liver lobe in arterial phase. 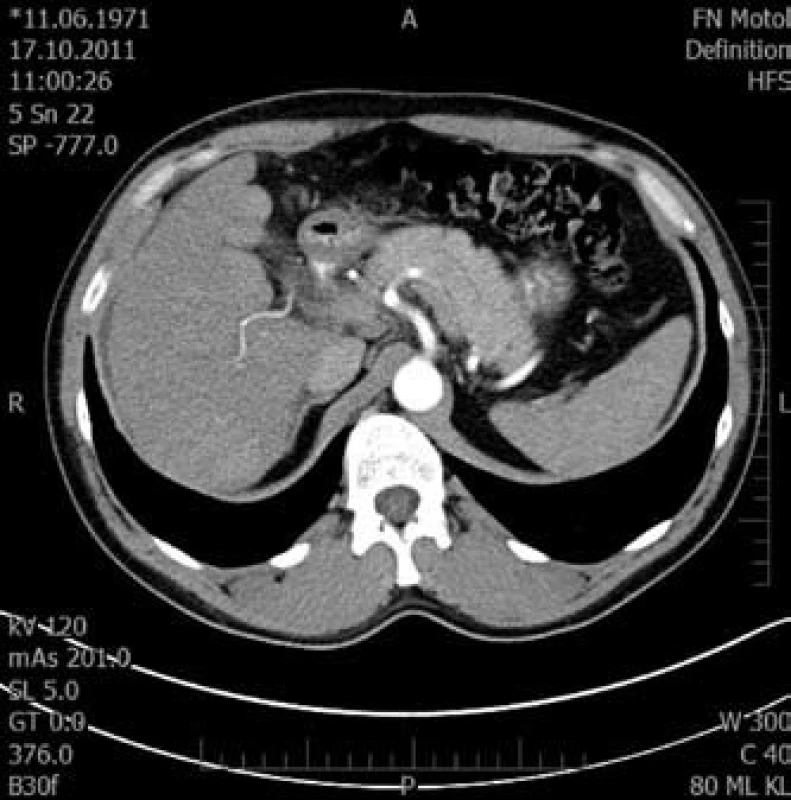
Diskuze
V našem případě uvádíme případ nemocného s fulminantním selháním jater na podkladě multifokálního HCC, u kterého stav dospěl k hepatorenálnímu selhání a rozvoji šokového stavu. V průběhu vyšetřovacího procesu nic nenasvědčovalo tomu, že by příčinou vzniklého stavu mohlo být nádorové onemocnění. To bylo zjištěno až při pitvě pacienta. V histologickém vyšetření byla zvažována diagnóza fibrolamelárního typu HCC, která ale byla podpořena pouze morfologickým obrazem (intra - a peritumorozní fibrotizace tvořící částečné opouzdření, nepřítomnost cirhotické přestavby) a základními barvicími metodami (PAS, modrý trichrom, barvení na železo). Imunohistochemické vyšetření nebylo provedeno a vzhledem k pokročilé autolýze tkání je jednoznačné posouzení tohoto typu nádoru velmi obtížné. V diferenciální diagnóze přichází v úvahu také intrahepatální cholangiocelulární karcinom, pro který zcela nesvědčila architektonika a cytologie nádoru a těžká zejména intracelulární cholestáza.
S výsledkem pitvy při zpracování této kazuistiky jsme postoupili CT nález k druhému čtení. Na CT nebyl obraz typický pro fibrolamelární karcinom. V případě fibrolamelárního karcinomu se jedná o objemný tumor, dochází k nehomogennímu sycení po podání kontrastní látky v arteriální fázi, které přetrvává i v portální fázi. V námi zmiňovaném případě byla již nativně patrná uzlovitá struktura jater. V arteriální fázi postkontrastně ale žádné výraznější sycení nebylo. Ve venózní fázi se jen zvýraznila nehomogenní struktura pravého laloku, hypodenzní změny byly zhodnoceny jako mapovitá steatóza.
Obr. 5. Tranzverzální řez pravého laloku jaterního ve venozní fázi. Fig. 5. Transversal cut of right liver lobe in venous phase. 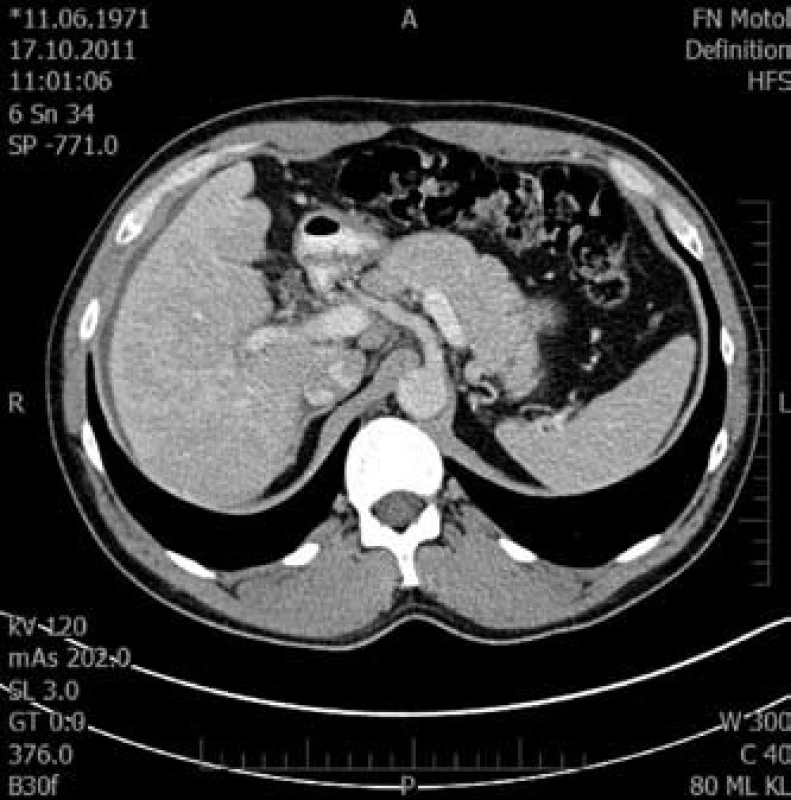
Obr. 6. Venózní fáze v koronární rovině. Fig. 6. Venous phase in the coronal plane. 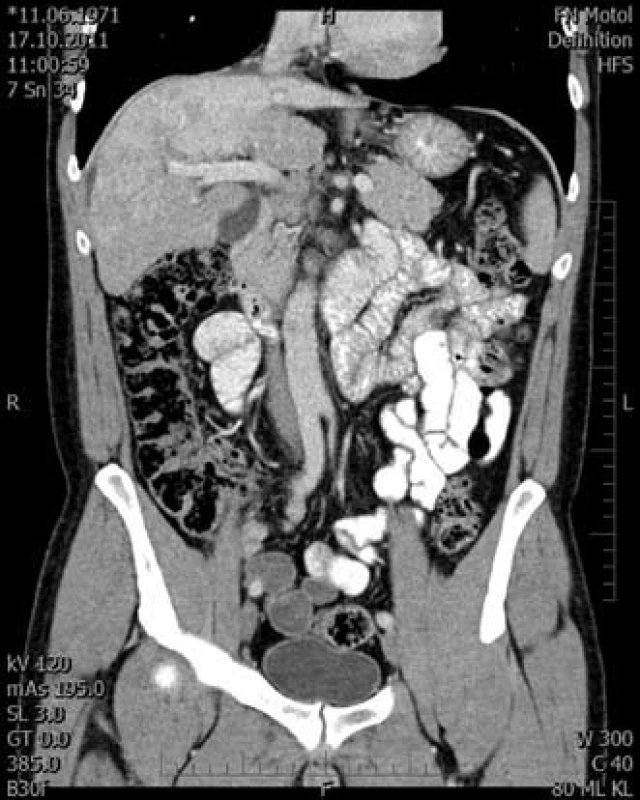
Otázkou zůstává, jestli by dřívější diagnostika nádoru vedla ke zlepšení prognózy pacienta vzhledem k mnohaložiskovému postižení jater.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 26. 2. 2013
Přijato: 19. 3. 2013
MUDr. Marta Horvátová
Interní klinika – oddělení gastroenterologie
2. LF UK a FN v Motole
V Úvalu 84, 150 06 Praha 5
m.horvatova@gmail.com
Zdroje
1. Bosch FX, Ribes J, Diaz M et al. Primary liver cancer: worldwide incidence and trends. Gastroenterology 2004; 127 (5 Suppl 1): S5–S16.
2. Yuen MF, Hou JL, Chutaputti A. Hepatocellular carcinoma in the Asia pacific region. J Gastroenterol Hepatol 2009; 24(3): 346–353.
3. Umemura T, Ichijo T, Yoshizawa K et al. Epidemiology of hepatocellular carcinoma in Japan. J Gastroenterol 2009; 44 (Suppl 19): 102–107.
4. Yang JD, Harmsen WS, Slettedahl SW et al. Factors that affect risk for hepatocellular carcinoma and effects of Hepatology Research 2012; 42 : 1–14 HCC in NASH 9 © 2011.
5. Kensler TW, Qian GS, Chen JG et al. Translational strategies for cancer prevention in liver. Nat Rev Cancer 2003; 3(5): 321–329.
6. Mendizabal M, Reddy KR. Current management of hepatocellular carcinoma. Med Clin North Am 2009; 93(4): 885–900.
7. Bosch FX, Ribes J, Díaz M et al. Primary liver cancer: worldwide incidence and trends. Gastroenterology 2004; 127 (5 Suppl 1): S5–16.
8. Cao H, Phan H, Yang LX. Improved chemotherapy for hepaocellular carcinoma. Anticancer Res 2012; 32(4): 1379–1386.
9. Brůha R, Šperl J, Urbánek P et al. Doporučené postupy v diagnostice a léčbě hepatoocelulárního karcinomu. Gastroenterol Hepatol 2012; 66(2): 83–92.
10. Hamilton SR, Aaltonen LA (Eds.). World Health Organization Classificatin of Tumours. Pathology and Genetics of Tumours of the Digestive Systém. IARC Press: Lyon 2000.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná Interní lékařství Nutriční terapeut Obezitologie
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2013 Číslo 2- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Magnosolv a jeho využití v neurologii
-
Všechny články tohoto čísla
- Mozkový natriuretický peptid je markerem horší prognózy při dekompenzaci jaterní cirhózy
- Multifokální hepatocelulární karcinom imitující jaterní cirhózu
- Chirurgická léčba metastáz hepatocelulárního karcinomu do nadledvin
- Kolonoskopie ve vodní imerzi s „capem“ – prospektivní, randomizovaná studie
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Metastatické postižení tenkého střeva jako první projev generalizace kožního melanomu
- Endoskopická léčba Zenkerova divertiklu
- Doporučené postupy Evropské společnosti pro gastrointestinální endoskopii (ESGE): profylaxe pankreatitidy po provedené ERCP
- Invazivní léčba chronické pankreatitidy je indikována pro bolesti, podezření na malignitu, biliární obstrukci, leak a cystoid
- Zdravotní stav a karcinom pankreatu
- Prevence pankreatitidy po ERCP
- 3rd Prague Endoscopy Workshop (and 14th Endoscopy Workshop in IKEM)
- Životní jubileum prof. MUDr. Marie Brodanové, DrSc.
-
Správná odpověď na kvíz
Intramurální hematom ve stěně rekta při antikoagulační terapii - Autodidaktický test: hepatologie
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Co nového v hepatologii?
-
Kvíz – případ z klinické praxe
Nečekaná příčina akutní renální insuficience vycházející z rekta - Doporučení České gastroenterologické společnosti pro podávání antiagregační terapie kyselinou acetylsalicylovou
- Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV) – aktualizace
- Danišův jícnový stent v terapii varikózního krvácení
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Danišův jícnový stent v terapii varikózního krvácení
- Mutaflor – Escherichia coli kmen Nissle 1917, sérotyp O6:K5:H1
- Cholangiopankreatoskopie pomocí SpyGlassTM direct visualization system: seznámení s metodou a první vlastní zkušenosti
- Prevence pankreatitidy po ERCP
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



