-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Virulentný profil a rezistencia Escherichia coli izolovaných od imunokompromitovaných pacientov pri urosepse
Virulent profile and resistance of Escherichia coli isolated in immunocompromised patients with urosepsis
We have been studying the characteristics of E. coli strains isolated from blood of immunocompromised patients suffering from urosepsis. In each patient (n = 25) a different strain has been tested. In the tested strains we have most often found gene adherence fimA (96%) and pap (56%). From the genes coding toxin production we have found cnf (20%), α-hly (16%), lt (12%), and st (8%) in our set of strains. The incidence of aer and iucC genes supporting the survival of E. coli in host extracellular space and associated with Fe2+ utilization was 84% and 80%, respectively. From the phylogenetic perspective the studied E. coli strains most often belon-ged to phylogenetic groups B2 and D (53% and 32%, respectively). The highest resistance against antibacterial agents we have found against trimethoprim/sulfamethoxazol and ciprofloxacin (32%) and against ampicillin/ /sulbaktam (20%). All the strains were sensitive to piperacillin/tazobactam, colistin, amikacin and meropenem.
Key words:
Escherichia coli - urosepsis - virulence - resistance - phylogenetic group
Autoři: M. Kmeťová; E. Kendrovská; V. Takáčová; M. Sabol; L. Siegfried
Vyšlo v časopise: Urol List 2012; 10(4): 37-40
Souhrn
Študovali sme vlastnosti kmeňov E. coli izolovaných z krvi imunokompromitovaných pacientov pri urosepse. Od každého pacienta (n = 25) bol testovaný jeden kmeň. U kmeňov sme najčastejšie zaznamenali prítomnosť génov adherencie fimA (96 %) a pap (56 %). Z génov, kódujúcich produkciu toxínov, sme v našom súbore kmeňov dokázali prítomnosť cnf (20 %), α-hly (16 %), lt (12 %) a st (8 %). Výskyt génov aer a iucC, podporujúcich prežívanie E. coli v extracelulárnych priestoroch hostiteľa a spojených z utilizáciou Fe2+, bol potvrdený v 84 % a 80 %. Fylogeneticky boli študované E. coli najčastejšie zatriedené k fylogenetickým skupinám B2 a D (53 %, 32 %). Najvyššiu rezistenciu proti antibakteriálnym látkam sme zaznamenali proti trimetoprim/sulfamethoxazolu a ciprofloxacinu (32 %) a proti ampicilin/sulbaktamu (20 %). Všetky kmene boli citlivé voči piperacilín/tazobactamu, kolistínu, amikacínu a meropenemu.
Klíčová slova:
Escherichia coli - urosepsa - virulencia j - rezistencia - fylogenetická príslušnosťEscherichia coli je súčasťou fyziologickej mikroflóry hrubého čreva. Patrí k oportúnnym patogénom, ktoré sa za určitých okolností uplatňujú v etiológii črevných a mimočrevných infekcií. S izoláciou patogénnych E. coli sa v našich podmienkach najčastejšie stretávame pri infekciách urinárneho traktu (UTI), pyogénnych infekciách, sporadicky sa vyskytuje pri gastrointestinálnych infekciách. Infekcie E. coli môžu byť sprevádzané komplikáciami, ktoré vyúsťujú do vážnych klinických stavov, spojených s bakteriémiou, neonatálnou meningitídou, ascendentnou cholangitídou, spontánnou peritonitídou, nozokomiálnou pneumóniou, resp. inými klinickými prejavmi [1,2].
Na základe klinických príznakov u pacienta, vyšetrovaného klinického materiálu, fenotypových vlastností izolovaných kmeňov E. coli a spektra dokázaných génov virulencie sa kmene E. coli ozdeľujú na enterovirulentné (EVEC) a extraintestinálne (ExPEC). Medzi enterovirulentné patotypy patria enteropatogénne E. coli (EPEC), enterotoxigénne (ETEC), enteroinvazívne (EIEC), enteroagregatívne (EAggEC), šigatoxigénne (syn. verotoxigénne, enterohemoragické) (STEC, VTEC, EHEC), difúzno--adherentné E. coli (DAEC), adherentno-invazívne (AIEC) a E. coli spôsobujúce odlupovanie buniek na tkanivových kultúrach (CDEC) [3]. V roku 2011 pribudol nový patotyp enteroagregatívnych hemoragických E. coli (EAHEC) [4]. Z extraintestinálnych sú najvýznamnejšie uropatogénne E. coli (UPEC), neonatálnu meningitídu vyvolávajúce (NMEC) a septikémiu vyvolávajúce E. coli (SEPEC) [5,6].
Širokú ekologickú diverzitu patogénnych E. coli umožňuje ich genomová plasticita. Patogénne kmene obsahujú o 10–20 % viac genetickej informácie ako nepatogénne referenčné kmene E. coli K-12. Každý kmeň izolovaný pri infekciách sa môže vyznačovať unikátnou kombináciou génov virulencie, pričom niektoré sú jedinečné a vyskytujú sa iba u virulentných kmeňov [7,8]. Faktory virulencie v konečnom dôsledku poškodzujú hostiteľa a prispievajú k vzniku a klinickej manifestácii ochorenia [9,10]. Najväčšiemu riziku nákazy sú vystavení novorodenci, deti, starší ľudia a pacienti po operačnom zákroku. Zvýšené riziko nákazy je u ľudí so zavedeným močovým katétrom, transplantovanou obličkou, poškodenou chrbticou, diabetes mellitus a u pacientov s nádorovým ochorením, zvlášť v období ťažkej neutropénie, ktorá vzniká ako následok chemoterapie či celkovej imunodeficiencie [11,12].
Cieľom našej práce bolo otestovať kmene E. coli izolované z krvi pacientov pri urosepse. Pre pacientov s urosepsou bola charakteristická prítomnosť UTI (Urinary Tract Infection), sprevádzaná celkovou systémovou reakciou organizmu na infekciu.
PACIENTI A POUŽITÉ METÓDY
Pacienti
V štúdii boli zahrnuté kmene E. coli izolované od 25 pacientov hospitalizovaných v Univerzitnej nemocnici L. Pasteura v Košiciach, u ktorých došlo k diseminácii E. coli do krvného riečišťa po primárnej infekcii urinárneho traktu. Údaje o primárnej klinickej diagnóze, pohlaví a veku pacientov sú v tab. 1.
Tab. 1. Základné informácie o pacientoch, od ktorých boli izolované vyšetrované kmene <em>E. coli</em>. 
Testované kmene
Študovali sme vlastnosti 25 kmeňov E. coli izolovaných z hemokultúr (od každého pacienta bol testovaný jeden kmeň). U kmeňov sme vyhodnotili prítomnosť faktorov virulencie, fylogenetickú príslušnosť, prevalenciu virulentných patotypov a citlivosť voči pôsobeniu antibakteriálnych látok.
V práci sme použili tieto referenčné kmene: E. coli C 600RIF (hly -, cnf1 -, pap -, sfa -, afa -, aer -, ial -, ipaH -, iucC -, pCVD432 -, eaeA -, bfpA -, lt, st -) -, E. coli 248/65 (ial+, ipaH+, iucC+), E. coli 378/80 (lt+, st+), E. coli O29/A (eaeA+, bfpA+), E. coli F46 (pCVD432+), E. coli EB 28 (hly+, cnf1+, pap+, sfa+, aer+), E. coli KS 52 (afa+, aer+, pap+, fimA+), E. coli Nissle 1917 (fimA+, aer+, iucC+).
Hemokultivácia
Na hemokultiváciu sme použili automatizovaný hemokultivačný systém (Bactec 9050). Kmene E. coli z pozitívnej hemokultúry boli izolované a identifikované štandardnými mikrobiologickými postupmi.
Dôkaz génov virulencie
K detekcii génov virulencie u E. coli bola použitá reakcia PCR. Metodické postupy sú popísané v prácach Kmeťová et al [13], Čurová et al [14]. Z génov, ktoré sú zodpovedné za schopnosť prichytenia E. coli na mukózne povrchy, sme metódou PCR dokazovali prítomnosť: fimA (fimbrie typu 1), bfpA (zväzky tvoriace fimbrie), pap (P fimbrie), sfa (S fimbrie), eae (intimín), pCVD (agregatívny typ adherencie), afa (afimbriálny adhezín). Z génov, kódujúcich tvorbu toxínov, boli detegované gény: α-hly (α-hemolyzín), cnf1 (cytotoxický nekrotizujúci faktor), lt a st (produkcia enterotoxínov). Invazivitu sme posudzovali na základe detekcie génov invazivity ipaH. Z ďalších génov virulencie sme sledovali výskyt génov iucC (aerobaktínsyntetáza) a aer (produkcia aerobaktínu), ktoré súvisia so schopnosťou baktérií utilizovať železo viazané v telových tekutinách:
- Fylogenetické zatriedenie – kmene izolované od pacientov sme zatriedili do fylogenetických skupín B2, D, B1 a A na základe identifikácie génov chuA, yjaA a fragmentu TSPE4 C podľa Clermonta et al [15].
- Rezistenciu proti antibiotikám – rezistenciu proti antibakteriálnym látkam (ampicilin, piperacilin/tazobactam, trimetoprim/sulfam, cefepim cefotaxim, ceftazidim, cefuroxim, ciprofloxacin, aztreonam, tobramycin) sme zisťovali štandardnou mikrodilučnou metódou. Rezistenciu proti cefoperazónu a imipenemu sme určili difúznou metódou.
VÝSLEDKY
Na Oddelení klinickej mikrobiológie Ústavu lekárskej a klinickej mikrobiológie Lekárskej fakulty UPJŠ a Univerzitnej nemocnice L. Pasteura v Košiciach sa E. coli izoluje z hemokultúr ako druhý najčastejší gramnegatívny patogén (po Klebsiella pneumoniae) (tab. 1). Prítomnosť génov virulencie a rezistenciu sme študovali u 25 klinických izolátov E. coli. Až 24 kmeňov E. coli (96 %), bolo vybavených fimbriami typu 1, ktoré sme detegovali na základe prítomnosti génov fimA. U 14 z testovaných kmeňov boli prítomné P fimbrie, ktoré sú kódované pap génmi (56 %). Výskyt ďalších génov, asociovaných so schopnosťou adherencie, klesal v poradí sfa 7 kmeňov (28 %) a afa 4 kmene (16 %), bfpA 5 kmeňov (20 %) a gén eae u jedného kmeňa (4 %). Z génov kódujúcich produkciu toxínov sme dokázali v našom súbore kmeňov prítomnosť cnf (5 kmeňov), α-hly (4 kmene), lt (3 kmene) a st (2 kmene). Výskyt génov aer a iucC, podporujúcich prežívanie E. coli v extracelulárnych priestoroch hostiteľa a spojených z utilizáciou Fe2+, bol potvrdený u 21 kmeňov (84 %) a 20 kmeňov (80 %). Gény, kódujúce invazívne vlastnosti ipaH neboli v študovanom súbore dokázané (obr. 2). Fylogeneticky boli študované E. coli najčastejšie zatriedené k skupinám B2 a D (53 %, 32 %). Príslušnosť k fylogenetickej skupine B1 bola zistená v 11 % a k skupine A v 4 %. Desať z testovaných kmeňov bolo na základe spektra dokázaných faktorov virulencie zatriedených medzi typické uropatogénne patotypy, 5 patrilo k EPEC patotypu, 1 kmeň k ETEC a 1 kmeň bol EIEC patotypu. Sedem kmeňov nebolo na základe charakteristických génov zatriedených k známym patotypom E. coli. Najvyššiu rezistenciu proti antibakteriálnym látkam sme zaznamenali proti trimetoprim/sulfamethoxazolu a ciprofloxacinu (32 %) a proti ampicilin/sulbaktamu (20 %). Všetky kmene boli citlivé voči piperacilín/tazobactamu, kolistinu, amikacínu a meropenemu (tab. 3).
Tab. 2. Najčastejšie gramnegatívne baktérie izolované z hemokultúr (%). 
Tab. 3. Rezistencia kmeňov <em>E. coli</em> izolovaných pri urosepse. 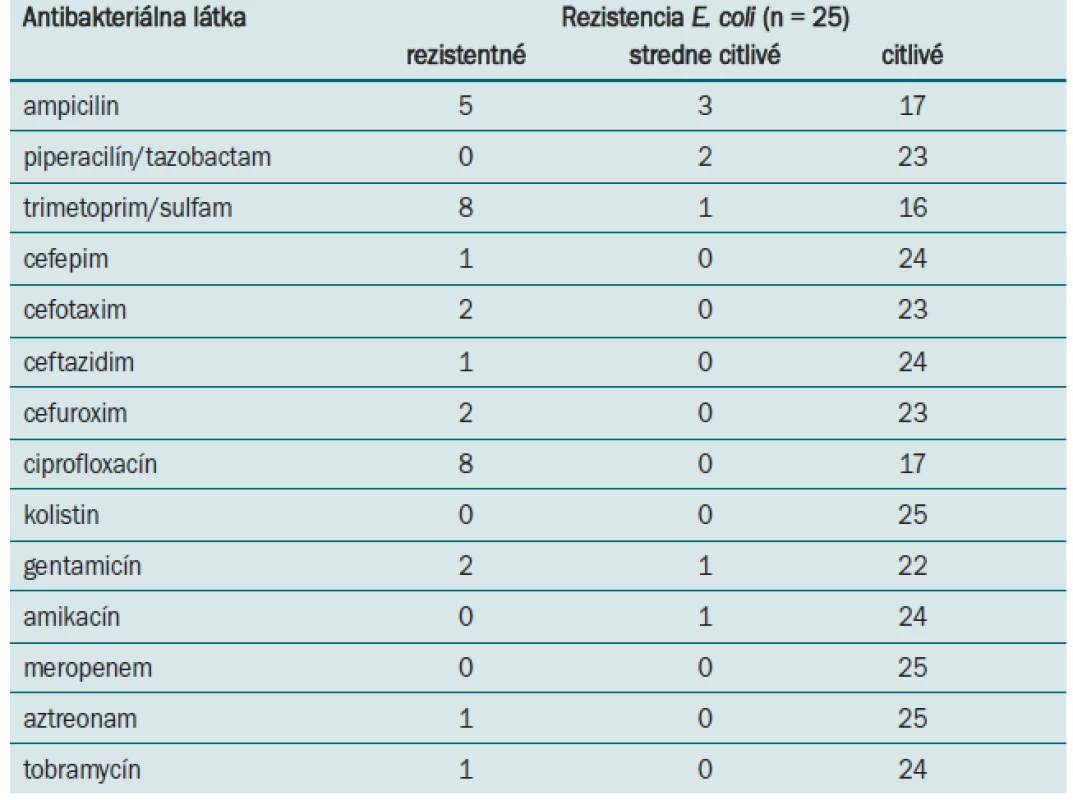
DISKUSIA
Urosepsa je ochorenie spojené s vysokou morbiditou a mortalitou u imunokompromitovanej populácie [16]. Vzniká na podklade ťažkej močovej infekcie hematogénnym rozsevom pôvodcu ochorenia [17]. Pre E. coli, vyvolávajúce urosepsu, je typická prítomnosť génov virulencie, ktoré im umožnia uplatniť sa v patogenéze [18]. Nešpecifické a špecifické adhezíny umožňujú uropatogénnym kmeňom E. coli adherovať na epitel urinárneho traktu a kolonizovať ho. Prítomnosť špecifických adhezínov je jedným z najdôležitejších kritérií pri patotypovom zatrieďovaní E. coli. V našom súbore kmeňov, izolovaných z hemokultúr, sme nezaznamenali žiadny kmeň bez prítomnosti aspoň jedného z génov adherencie. Prítomnosť špecifických génov adherencie sme využili ako charakteristický dominantný gén pri patotypovom zatriedení E. coli. Najčastejšie detegované špecifické gény adherencie boli pap gény (56 %), kódujúce tvorbu P fimbrií. Tieto fimbrie sú primárne asociované s kmeňmi vyvolávajúcimi pyelonefritídu. Ich prítomnosť svedčí o urinárnom pôvode sepsy [19]. V skupine patotypovo nezatriedených kmeňov sme najčastejšie dokázali prítomnosť fimbrií typu 1 (fimA), ktoré sa môžu vyskytovať tak u kmeňov fyziologickej mikroflóry, ako aj u patogénnych kmeňov (96 % výskyt). Tieto kmene však patrili k fylogenetickej skupine B. Podľa literárnych údajov už samotné zaradenie k fylogenetickej skupine B2 postačuje k uplatneniu E. coli v patogenetickom procese [20]. Prítomnosť ďalších génov virulencie môže byť pri sepse alternatívna a je ovplyvňovaná rôznymi faktormi, napr. štádiom infekcie. Počet faktorov virulencie bol pri jednotlivých kmeňoch jedinečný, pohyboval sa od jedného do ôsmich. V asociácii s rezistenciou kmeňov proti antibiotikám môže táto skutočnosť ovplyvniť stupeň infekčného procesu a terapeutické možnosti. Aj keď niekoľko kmeňov z nášho súboru mohlo byť potenciálne toxinogénnych, o čom svedčí detekcia génov pre produkciu toxínov (lt, st, cnf1), tieto gény nie sú, podľa autorov Mokady et al [16], rozhodujúce pri rozvoji sepsy. Vyšetrované kmene E. coli, ktoré boli pôvodcami urosepsy, sme na základe fylogenetickej analýzy najčastejšie zatriedili do fylogenetických skupín B2 a D (53 %, 32 %), ktoré sa vyznačujú najvyššou virulenciou. Zistenie genetického profilu E. coli na základe detekcie génov virulencie prispieva k epidemiologickým štúdiám a zisteniu podstaty ich patogenetického pôsobenia [21]. Patogenézu ovplyvňuje tiež veľkosť infekčnej dávky a lokalizácia infekcie. Naše výsledky rezistencie proti antibakteriálnym látkam korelujú so zisteniami autorov Beerepoot et al [22].
Graf 1. Dôkaz génov virulencie v študovanom súbore kmeňov E. coli (%). 
Práca bola riešená s podporou projektu Centrum excelentnosti CEMIO, ITMS: 26220120058 (100 %).
doc. RNDr. Marta Kmeťová, CSc., mim. prof.
Univerzita Pavla Jozefa Šafárika
Ústav lekárskej a klinickej mikrobiológie LF a UN L. Pasteura
Trieda SNP 1, 040 11 Košice
Zdroje
1. Wiles TJ, Kulesus RR, Mulvey MA. Origins and virulence mechanisms of uropathogenic Escherichia coli. Exp Molec Pathol 2008; 85(1): 11–19.
2. Jadhav S, Hussain A, Devi S et al. Phylogenetic and genomic diversity of human bacteremic Escherichia coli strains. BMC Genomics 2008; 9 : 560–574.
3. Nataro JP, Kaper JB. Diarrheagenic Escherichia coli. Clin Microbiol Rew 2008; 11(1): 142–201.
4. Brzuszkiewicz E, Thürmer A, Schuldes J et al. Genome sequence analyses of two isolates from the recent Escherichia coli outbreak in Germany reveal the emergence of a new pathotype: Entero-Aggregative-Haemorrhagic Escherichia coli (EAHEC). Arch Microbiol 2011; 193(12): 883–889.
5. Oliveira FA, Paludo KS, Arend LN et al. Virulence characteristics and antimicrobial susceptibility of uropathogenic Escherichia coli strains. Genet Mol Res 2011; 10(4): 4114–4125.
6. Li G, Kariyawasam S, Tivendale KA et al. tkt1, located on a novel pathogenicity island, is prevalent in avian and human extraintestinal pathogenic Escherichia coli. BMC Microbiology 2012; 12 : 51–69.
7. Ananias M, Yano T. Serogroups and virulence genotypes of septicaemic E. coli. Brazilian J Med Biol Res 2008; 41(10): 877-883.
8. Kmeťová M, Frankovičová L, Molokáčová M et al. Molekulárno-biologický dôkaz faktorov virulencie a fylogenetických skupín u klinických izolátov Escherichia coli. Zborník príspevkov. Využitie experimentálnych metód pri ochrane a podpore zdravia obyvateľstva, Košice 2010 : 241–245.
9. Siegfried L, Kmeťová M. Role of virulence factors in pathogenesis of Escherichia coli infections. Biologia 1997; 52(6): 697–705.
10. Gudiol C, Calatayud L, Garcia-Vidal C et al. Virulence Plasmid Harbored by Uropathogenic Escherichia coli Functions in Acute Stages of Pathogenesis. Infect Immun 2010; 78(4): 1457–1467.
11. Hilali F, Ruimy R, Saulnier P et al. Prevalence of Virulence Genes and Clonality in Escherichia coli Strains That Cause Bacteremia in Cancer Patients. Infect Immun 2000; 68(7): 3983–3889.
12. Köhler DC, Dobrindt U. What defines extraintestinal pathogenic Escherichia coli? Internat J Med Microbiol 2011; 3(1): 642–647.
13. Kmeťová M, Havrišová K, Sabol M et al. Escherichia coli strains isolated from patients with Crohn’s disease and ulcerative colitis. Biologia 2005; 60 : 717–721.
14. Čurová K, Kmeťová M, Sabol M et al. Enterovirulent E. coli in inflammatory and noninflamma-tory bowel diseases. Folia Microbiol 2009; 54(1): 81–86.
15. Clermont O, Bonacorsi S, Bingen E. Rapid and simple determination of the Escherichia coli phylogenetic group. Appl Environ Microbiol 2000; 66(10): 4555–4558.
16. Mokady D, Gophna U, Ron E. Virulence factors of septicemic Escherichia coli strains. Internat J Med Microbiol 2005; 295(6–7): 455–462.
17. Worth L, Slavin MA. Bloodstream infections in haematology: Risks and new challenges for prevention. Blood Reviews 2009; 23(3): 113–122.
18. Jaureguy F, Landreau L, Passet V et al. Phylogenetic and genomic diversity of human bacteremic Escherichia coli strains. BMC Genomics 2008; 9 : 560–574.
19. Kmeťová M, Frankovičová L, Molokačová M et al. Resistance to antibiotics, phylogeny group and virulence genes in Escherichia coli isolated from blood in critically diseased patients. 7 th World Congress of the Pediatric Infectious Diseases (WSPID), Melbourne, Australia 2011, 782.
20. Cooke NM, Smith SG, Kelleher M et al. Major Differences Exist in Frequencies of Virulence Factors and Multidrug Resistance between Community and Nosocomial Escherichia coli Bloodstream Isolates. J Clin Microbiol 2010; 48(4): 1099–1104.
21. Kmeťová M, Frankovičová L, Hrabovský V et al. Vplyv probiotík na virulenciu E. coli izolovaných pri ulceróznej kolitíde. Správy klin mikrobiol 2011; XI: 2–10.
22. Beerepoot MAJ, den Heijer CDJ, Penders J et al. Predictive value of Escherichia coli susceptibility in strains causing asymptomatic bacteriuria for women with recurrent symptomatic urinary tract infections receiving prophylaxis. Clin Microbiol Infect 2012; 18: E84–E90.
Štítky
Dětská urologie Urologie
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2012 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Vedlejší účinky hormonální substituční léčby testosteronem
- Vývoj chirurgického odběru spermií u mužů s azoospermií
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
- Vaporizace prostaty pomocí zeleného laseru (GreenLight laser) – zkušenost z jednoho centra po provedení více než 1 000 výkonů
- Syntetický miduretrální sling při léčbě močové inkontinence u žen: analýza 1 000 případů z jednoho centra
- Slovo úvodem
- Virulentný profil a rezistencia Escherichia coli izolovaných od imunokompromitovaných pacientov pri urosepse
- Sekvence léčby a sledování pacienta s metastatickým kastračně rezistentním karcinomem prostaty
-
Guidelines EAU pro léčbu mužské infertility
1. Metodologie -
Guidelines EAU pro léčbu mužské infertility
2. Vyšetření -
Guidelines EAU pro léčbu mužské infertility
3. Testikulární nedostatečnost (selhání spermatogeneze) -
Guidelines EAU pro léčbu mužské infertility
4. Genetické poruchy u infertilních mužů -
Guidelines EAU pro léčbu mužské infertility
5. Obstrukční azoospermie - Nádory penisu spojené s výskytem dalších novotvarů
-
Guidelines EAU pro léčbu mužské infertility
6. Varikokéla -
Guidelines EAU pro léčbu mužské infertility
7. Hypogonadizmus -
Guidelines EAU pro léčbu mužské infertility
8. Kryptorchizmus -
Guidelines EAU pro léčbu mužské infertility
9. Idiopatická mužská infertilita -
Guidelines EAU pro léčbu mužské infertility
10. Mužská antikoncepce -
Guidelines EAU pro léčbu mužské infertility
11. Infekce mužských přídatných žláz -
Guidelines EAU pro léčbu mužské infertility
12. Maligní onemocnění ze zárodečných buněk a testikulární mikrokalcifikace -
Guidelines EAU pro léčbu mužské infertility
13. Poruchy ejakulace -
Guidelines EAU pro léčbu mužské infertility
14. Kryoprezervace ejakulátu -
Guidelines EAU pro léčbu mužské infertility
15. Zkratky užité v textu
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vedlejší účinky hormonální substituční léčby testosteronem
- Adenomatoidní tumor varlete – diagnostika a doporučené operační postupy
-
Guidelines EAU pro léčbu mužské infertility
13. Poruchy ejakulace -
Guidelines EAU pro léčbu mužské infertility
5. Obstrukční azoospermie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



