-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neuroendokrinní a endokrinní tumory
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 1): 105-110
Kategorie: Neuroendokrinní a endokrinní tumory
XVIII. Neuroendokrinní a endokrinní tumory
XVIII/ 39. Diferenciální diagnostika uzlů štítné žlázy
Krátký J., Jiskra J.
III. interní klinika 1. LF UK a VFN v Praze
Tyreoidálním uzlem se rozumí jakékoliv ložisko ve štítné žláze bez ohledu na jeho biologickou povahu či etiologii. Prevalence tyreoidálních uzlů je v neselektované populaci 19–76 % (podle oblastí, kdy byly průřezové studie prováděny). Prevalence hmatných uzlů se uvádí asi 4–7 %. Naprostá většina z nich (90–95 %) je benigních. Klasifikace tyreoidálních uzlů podle etiologie je uvedena v tab. 1. Podle recentních dat bylo v Evropě a v jod-deficitních oblastech riziko malignity mírně nižší u pacientů s mnohočetnými uzly oproti solitárnímu uzlu, naopak v USA v oblastech s dostatečným jodovým zásobením bylo riziko stejné. Kromě etiologie můžeme klasifikovat uzly z funkčního hlediska a podle zobrazení při scintigrafii štítné žlázy. Rozlišujeme uzly horké, teplé a studené. Riziko malignity v horkém uzlu je velmi nízké ve srovnání s teplými a studenými uzly. Vyšetřovací postup zahrnuje zhodnocení anamnézy a subjektivních obtíží pacienta, fyzikální vyšetření krku a celkové vyšetření, vyšetření tyreoidálního stimulačního hormonu (TSH) v krvi a ultrazvuk štítné žlázy a krku (UZ). S výjimkou retrosternální strumy je výpovědní hodnota UZ štítné žlázy mnohem vyšší než CT i než PET-CT. Na základě UZ kritérií (tab. 2) a klinických kritérií (tab. 3) je rozhodnuto o aspirační biopsii tenkou jehlou (FNAB). Tu provádí většinou endokrinolog. Interpretaci cytologických nálezů zjednodušil systém pro hlášení tyreoidálních cytopatologií – tzv. Bethesda klasifikace. Uzly Bethesda I (nediagnostický nález) mají být rebioptovány a v případě opakovaně nediagnostických nálezů musí být ověřeny histologicky (většinou operací, výjimečně core cut biopsií). Uzly Bethesda II (benigní nález) musí být kontrolovány klinicky a UZ. U uzlů Bethesda III (atypie nejasného významu) není další postup jednoznačně určen (je možné uzly kontrolovat UZ, provést rebiopsii nebo rovnou operovat). U uzlů Bethesda IV (folikulární neoplazie) nelze z cytologie určit, zda jde o folikulární adenom nebo karcinom, proto je indikována operace s histologickým vyšetřením (hemityreoidektomie). Uzly Bethesda V (suspekce za malignity) a VI (maligní nález) jsou indikovány k operaci (totální tyreoidektomie). Výjimečně, pokud je z FNAB podezření na anaplastický nebo nediferencovaný karcinom nebo lymfom, se zvažuje core cut biopsie. Při podezření na medulární karcinom se vyšetřuje kalcitonin v séru. Dříve hojně užívaná supresní léčba levotyroxinem se dnes rutinně u eutyroidních osob nedoporučuje.
Tab. 1. Klasifikace tyreoidálních uzlů. 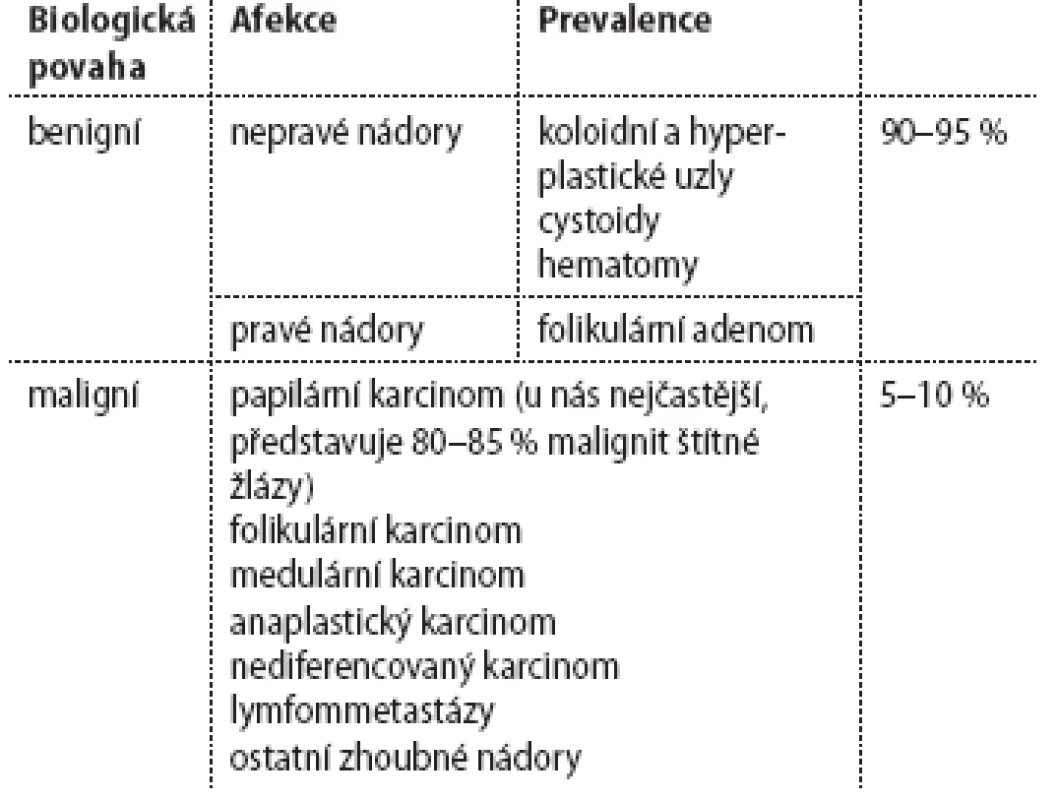
Tab. 2. Ultrazvuková (UZ) kritéria uzlu rizikového z tyreoidálního karcinomu a indikace k FNAB. 
1Centrální vaskularizace se vyskytuje i u benigních uzlů a v poslední době se nepovažuje za spolehlivý marker. 2Elastografi e je dosud experimentální metoda, jejíž diagnostický přínos není dostatečně ověřen. 3Ačkoliv jde o hodnocení subjektivní, měl by sonografi sta na základě výše uvedených kritérií uvést, zda je uzel „rizikový“ nebo není (je „obvyklý“). Tab. 3. Klinické rizikové faktory tyreoidálního karcinomu. 
XVIII/ 40. Diagnostika karcinomu štítné žlázy prostřednictvím sonogarfie a SW elastografie
Starý K.
Interní gastroenterologická klinika LF MU a FN Brno
Nález uzlu ve štítné žláze je považován za běžný. Incidence významně stoupá s věkem. Při ultrazvukovém vyšetření nacházíme uzel u více než 50 % lidí starších 65 let. Riziko malignity přitom nijak nesouvisí s velikostí uzlu. Někteří autoři uvádějí nutnost provedení aspirační cytologie u všech uzlů, u kterých je to technicky možné. Klasifikace dle Bethesda systému dává jasná pravidla pro komunikaci mezi cytopatologem a klinikem. Biologická povaha však není určena cytologickým vyšetřením zcela spolehlivě a nález tzv. benigního uzlu nás nezbavuje povinnosti pečlivého sledování velikosti i charakteru uzlu v čase. Existují určitá sonografická kritéria suspektního uzlu, senzitivita i specificita těchto znaků však není příliš vysoká. Elastografie je relativně nová metoda, která umožňuje hodnocení tuhosti (elasticity) tkáně. Vycházíme přitom z předpokladu, že tuhost uzlu je vázána na jeho biologickou povahu. Shear wave elastografie (SWE) je v současné době poslední generací metody a je předmětem řady studií, které přinášejí slibné výsledky. SWE je velmi jednoduše reprodukovatelná a není tolik závislá na zkušenostech vyšetřujícího. V reálném čase se dynamicky vytváří barevně kódovaná mapa elasticity, ve které je každý „bod“ samostatně kalkulován, a získáme tak údaj o elasticitě (kPa) v libovolném měřeném okrsku. Přínos elastografie je nadále zkoumán a postavení metody v diagnostickém algoritmu tyreoidálního uzlu není doposud přesně určeno. Výsledky ukazují efektivní využití metody při výběru podezřelých uzlů k cytologickému vyšetření a k cílení punkce u větších nehomogenních uzlů.
XVIII/ 41. Zhoubné nádory štítné žlázy z pohledu patologa
Ryška A.1, Čáp J.2, Hovorková E.1, Nová M.1
1 Fingerlandův ústav patologie, LF UK a FN Hradec Králové, 2 IV. interní hematologická klinika LF UK a FN Hradec Králové
Mezi maligní nádory z folikulárních buněk patří folikulární karcinom, papilokarcinom, nádory s nejistým biologickým potenciálem a dále nízce diferencovaný (poorly differentiated) a anaplastický karcinom. Diagnostika nádorů štítné žlázy naráží na limity čistě morfologického hodnocení, pro spolehlivé zhodnocení biologické povahy je v případech diferencovaných karcinomů nutné sledování v řádu desítek let. Velká část papilárních mikrokarcinomů nikdy nemetastazuje a vyvolává otázku, zda je vhodné je klasifikovat jako skutečné karcinomy. I u větších nádorů je ale obtížné odhadnout na základě TNM klasifikace jejich biologické chování. 10leté přežití u nemocných s papilokarcinomem dosahuje 90 %. Některé morfologické varianty papilokarcinomu (tall-cell, columnar-cell, solidní a difuzní sklerozující papilokarcinom) se chovají klinicky agresivněji. Byť nemá diagnóza žádné z těchto agresivnějších variant dopad na volbu odlišného terapeutického postupu, je zde statisticky pravděpodobnější recidiva či metastazování nádoru. U klasické varianty papilokarcinomu neexistuje prediktor biologického chování v rámci jednotlivých stadií. U papilokarcinomu je nejčastější genetickou změnou bodová mutace onkogenu BRAF (BRAFV600E). S touto mutací se lze setkat v asi 70 % všech papilokarcinomů, zastoupení mezi jednotlivými variantami je však různé – zatímco u tall-cell papilokarcinomu se vyskytuje u > 80 %, tak u nádorů dětského věku, opouzdřené folikulární varianty či difuzního sklerozujícího karcinomu je vzácná. Mutace je významným ukazatelem agresivity nádoru – vyskytuje se častěji ve vyšším věku, u nádorů infiltrativně rostoucích, s extratyreoidálním šířením, agresivnějším fenotypem, uzlinovými metastázami a celkově vyšším stadiem nádoru. Další genetickou změnou v papilokarcinomu je přestavba RET/ PTC, která se vyskytuje u 10–20 % všech papilokarcinomů. Bylo popsáno několik variant této přestavby, přičemž nejčastější jsou RET/ PTC1 a RET/ PTC3 – obojí se vyskytují zejména v dětském věku (u 40–70 % papilokarcinomů) a u nádorů souvisejících s předchozím ozářením (u 50–80 % případů). Zatímco klasická varianta papilokarcinomu obsahuje nejčastěji přestavbu RET/ PTC1, tak u nádorů se solidním uspořádáním dominuje RET/ PTC3. Z molekulárně genetického hlediska je nejzajímavější folikulární varianta papilokarcinomu, neboť u těchto nádorů se vyskytují kromě mutací typických pro papilokarcinom rovněž mutace běžné ve folikulárních nádorech. Jedná se zejména o bodové mutace v kodonech 12, 13, 61 v genech NRAS, KRAS a HRAS. Ty lze prokázat v 10–20 % případů folikulární varianty papilokarcinomu.
XVIII/ 42. Operační řešení zhoubných nádorů štítné žlázy
Smutný S.1, Kalát F.2, Bavor P.1, Svoboda J.3, Vošmíková K.1
1 Chirurgické oddělení, Oblastní nemocnice Příbram, 2 Chirurgická klinika 2. LF UK a FN v Motole, Praha, 3 Klinika nukleární medicíny a endokrinologie 2. LF UK a FN v Motole, Praha
Východiska: Ročně je v ČR odoperováno zhruba 900 karcinomů štítné žlázy, většina je podle TNM klasifikace hodnocena jako T1 nebo T2. V naprosté většině případů se jedná o diferencované karcinomy. Podezření na karcinom může být vysloveno již předoperačně (z progresivního růstu, z typického sonografického nálezu, z pozitivní punkční cytologie atd.). Pooperační histologie (parafín) případnou malignitu potvrdí. Někdy je však pozitivní výsledek histologie spíše překvapením, když byla očekávána nezhoubná uzlová přestavba, která je celosvětově nejčastější indikací k operaci štítné žlázy. V současné době je v ČR nejčastějším výkonem na štítné žláze TTE (úplné odstranění štítné žlázy). Tím bývá obvykle pro chirurga, nikoliv pacienta, karcinom štítné žlázy vyřešen. Někdy je správně (jeden uzel v jednom laloku) provedena „jen“ lobektomie a překvapením histologický nález malignity. Cíl: Autoři rozdělují pacienty podle skupin TNM a popisují vhodný léčebný postup. Probírají otázku radikality a pooperačních komplikací. Nejčastější, papilární karcinom štítné žlázy bývá po operaci (TTE) indikován k podání radiojodu (tzv. radioeliminaci), v závislosti na přiřazení k podskupině TNM klasifikace. V příspěvku hledáme odpověď na otázku, kdy pokračovat a doporučit další operaci na štítné žláze a kdy předat nemocné na nukleární medicínu k další léčbě. Závěr: Operace je standardním a spolehlivým příspěvkem do algoritmu léčby zhoubných nádorů štítné žlázy.
Práce byla podpořena grantovým projektem IGA MZČR č. NT/ 11455-5.
XVIII/ 51. Taktika chirurgické léčby tumorů příušní žlázy
Gál B., Kostřica R., Hložek J., Veselý M., Hložková T.
Klinika ORL a chirurgie hlavy a krku LF MU a FN u sv. Anny v Brně
Východiska: Salivární tumory příušní žlázy představují heterogenní skupinu nádorů vykazující výraznou histologickou a biologickou variabilitu. Příušní žláza je nejčastější lokalizací salivárních tumorů a představuje přibližně 80–85 % těchto nádorů, z nichž cca 75 % jsou nádory benigní a 25 % maligní. Základní modalitou léčby salivárních tumorů je chirurgie, jejímž cílem je bezpečné odstranění tumoru příušní žlázy s negativními okraji při současné kontrole lícního nervu. Cílem sdělení je na podkladě retrospektivní analýzy a fotodokumentace demonstrovat a prezentovat doporučené chirurgické postupy u pacientů s benigními a maligními tumory příušní slinné žlázy. Soubor pacientů a metody: Na Klinice otorinolaryngologie a chirurgie hlavy a krku FN u sv. Anny v Brně bylo v průběhu let 2007–2011 operováno celkem 154 pacientů se salivárními tumory příušní žlázy. Poměr mužů a žen: 79/ 93, průměrný věk: 57 let (17–84 let). Benigní tumory: n = 142. Histologické typy: pleomorfní adenom 66 (46 %), cystický adenolymfom 62 (44 %), ostatní benigní tumory 14 (10 %). Typy operací: extrakapsulární exstirpace 33 (23 %), parciální parotidektomie (PE): 86 (61 %), totální konzervativní PE: 23 (16 %). Maligní tumory: n = 12. Histologické typy: adenokarcinom: 4, spinocelulární karcinom: 3, myopepiteliální karcinom: 2, karcinom v pleomorfním adenomu: 2, adenoidně cystický karcinom: 1. Typy operací: parciální/ totální konzervativní PE: 8 (66 %), totální semiradikální PE: 2 (17 %), totální radikální PE: 2 (17 %). Všechny operace malignit byly prováděny s disekcí regionálních krčních uzlin. Závěr: Cílem operací příušní žlázy je bezpečná resekce tumoru s negativními okraji za současné kontroly a šetření lícního nervu. Rozsah resekce žlázového parenchymu parotidy je určen biologickými vlastnostmi tumoru, jeho velikostí a lokalizací. Pouze pro malé benigní tumory při zadním okraji žlázy je vyhrazena extrakapsulární exstirpace bez nutnosti preparace větvení n.VII. Pro naprostou většinu tumorů parotidy je indikována parciální či totální konzervativní parotidektomie, tzn. částečná či úplná resekce žlázového parenchymu příušní žlázy v bloku s tumorem a preparací ramifikace n.VII. U maligních tumorů, zejména u high-grade nádorů, může být přítomna invaze do nervu a nutná buďto částečná resekce větvení n.VII (semiradikální parotidektomie) či kompletní resekce ramifikace n.VII (totální radikální parotidektomie) s následnou rekonstrukcí nervu. Standardem u maligních nádorů je současné provedení elektivní (N0) či kurativní (N+) disekce regionálních krčních uzlin.
XVIII/ 43. Možnosti léčby karcinomu štítné žlázy metodami nukleární medicíny
Vlček P.
Klinika nukleární medicíny a endokrinologie 2. LF UK a FN v Motole, Praha
Karcinom štítné žlázy patří k poměrně vzácným lidským zhoubným nádorům, vyskytuje se u 1,5 % populace, patří k nejčastějším malignitám žláz s vnitřní sekrecí. Postihuje přibližně 5 % uzlů štítné žlázy, s celkovou prevalencí 20–50 %, v závislosti na věku pacientů a je čtyřikrát častější u žen než u mužů. V posledních třech desetiletích jsme svědky rychlého nárůstu nově diagnostikovaných diferencovaných karcinomů štítné žlázy (DTC), a to převážně jeho papilárních forem. V současné době je DTC považován za nejrychleji rostoucí neoplazii a z dosavadních statistik lze očekávat, že za 15 let v ČR bude ročně diagnostikováno okolo 1 000 nových případů. Hledání příčin tohoto celosvětového zvýšení výskytu rakoviny štítné žlázy je stále bohatou náplní odborných diskuzí. Někteří autoři se domnívají, že zvýšený počet nových případů karcinomu štítné žlázy je ovlivněn především intenzitou prováděných diagnostických vyšetření, zavedením nových zobrazovacích metod (sonografie, počítačové tomografie) a lepší léčbou a intenzivnějším sledováním, což vede k včasnějšímu záchytu dosud klinicky němých, indolentních, zejména papilárních mikrokarcinomů a nízkorizikových karcinomů. Diferencované karcinomy štítné žlázy (DTC) jsou papilární (PTC), folikulární (FTC) či karcinom z Hurthleho buněk a tvoří více než 90 % případů rakoviny štítné žlázy. Přibližně 85 % pacientů s DTC se léčí chirurgicky, radioaktivním jodem (RAI) a supresí TSH. Prognózu onemocnění ovlivňují i další faktory: závisí na věku pacienta, histologii, lokalizaci a velikosti vzdáleného metastatického postižení, na schopnosti tkáně vychytávat radiojod. U mladších pacientů (< 40 let) s mikrokarcinomy (< 1 cm) i při nálezu metastatického postižení plic bývá 10leté přežití 95 %, zatímco starší pacienti s nálezem plicních metastáz mají 10leté přežití pouze 14 %. Radiojod refrakterní karcinomy štítné žlázy jsou poměrně vzácné, s odhadovaným výskytem do čtyř případů na milion obyvatel, u 5 % pacientů s aktivní rakovinou. Jako radiojod refrakterní jsou definováni pacienti s pokročilým onemocněním při chybění akumulace radioaktivního jodu nebo při nálezu progrese onemocnění v průběhu roku poté, co byl podán léčebný radioaktivní jód; u pacientů s přetrvávajícím onemocněním po podání kumulativní aktivity 22 GBq (600 mCi) radiojodu. Vyskytuje se častěji u starších pacientů, u pacientů s velkými metastázami nebo s málo diferencovaným karcinomem štítné žlázy a tam, kde je vysoká kumulace FDG na PET/ CT skenu. Ve sdělení bude podán přehled o současných léčebných možnostech u nemocných s DTC.
XVIII/ 44. Genetika zhoubných nádorů štítné žlázy
Bendlová B.
Endokrinologický ústav, Praha
Východiska: Nádory štítné žlázy jsou nejčastější malignitou endokrinního systému, jejich incidence celosvětově vzrůstá. Karcinomy štítné žlázy tvoří nehomogenní skupinu nádorů, lišících se morfologicky i biologickým chováním. Mezi nádory vznikající z folikulárního epitelu patří dobře diferencované karcinomy – DTC (papilární – PTC a folikulární – FTC), málo diferencované karcinomy a velmi agresivní nediferencované karcinomy (anaplastické – ATC). Od parafolikulárních buněk (C-buněk) je odvozen medulární karcinom štítné žlázy (MTC). Cíl: Je známo, že tyto karcinomy vznikají v důsledku genetických změn vedoucích k aktivaci proteinkináz zapojených do dvou signálních drah – MAPK (mitogen-activated protein kinase), která je důležitá v buněčné proliferaci, diferenciaci a programované buněčné smrti, a PI3K-AKT, která hraje roli v regulaci glukózového metabolizmu, v přežívání, adhezi a motilitě buněk. Uplatňují se zde především dva molekulární mechanizmy – bodové mutace a chromozomální přeskupení. Většina těchto mutací je somatických, zárodečné mutace RET protoonkogenu jsou příčinou familiárního medulárního karcinomu. Hlavní geny zapojené v karcinogenezi štítné žlázy uvádí tab. 1. Odhalování dalších kauzálních či modifikujících genů je předmětem intenzivního výzkumu. U každého nádoru je nezbytné studovat genetické alterace v jejich komplexnosti, protože ta determinuje výsledný fenotyp. Závěr: Nádory štítné žlázy vznikají v důsledku akumulace různých genetických změn, které jsou důležitými diagnostickými, prognostickými a prediktivními biomarkery. Poznatky začínají být aplikovány i v léčbě, především v podobě rozvíjející se molekulárně cílené terapie.
Literatura: [1] Bendlová B et al. Čas Lék čes 2012; 151(3): 123–127. [2] Dvořáková Š et al. Cesk Patol 2014; 50(2): 81–83.
Naše práce je podporována projekty IGA MZ ČR NT 13901-4 a MZ ČR RVO 00023761 (Endokrinologický ústav).
XVIII/ 45. Karcinomy štítné žlázy z pohledu onkologa – systémová léčba
Jurečková A.
Klinika komplexní onkologické péče, MOÚ, Brno
Východiska: Nádory štítné žlázy jsou poměrně vzácné, jejich incidence však vykazuje stoupající trend. Tvoří velmi mnohotvarou skupinu s variabilní biologickou aktivitou. Dělíme je na diferencované karcinomy (papilární, folikulární, z Hürthleho buněk), medulární karcinom a nediferencovaný (anaplastický) karcinom. Léčba diferencovaných karcinomů je chirurgická s následnou terapií radiojódem 131I, která vede ke snížení výskytu lokoregionálních relapsů a zlepšuje celkové přežití. Chemoterapie má u diferencovaných karcinomů velmi omezenou účinnost a jen okrajový význam; lze ji zvážit zejména jako paliativní u pacientů s rychlou progresí onemocnění, pokud nádor neakumuluje radiojód. Nejlepší odpovědi bylo dosaženo při léčbě na bázi doxorubicinu. U pacientů s lokálně pokročilým nebo metastazujícím diferencovaným karcinomem rezistentním na radiojód je k dispozici cílená léčba multikinázovým inhibitorem sorafenibem. V terapii medulárního karcinomu se používá léčba chirurgická, dále zevní radioterapie, léčba MIBG. Chemoterapii lze použít v adjuvantní nebo kurativní indikaci, event. konkomitantně s radioterapií. Paliativní chemoterapie má velmi omezenou účinnost, je založena zejména na režimech s dakarbazinem. V současné době jsou k dispozici dva preparáty pro cílenou léčbu pacientů s inoperabilním lokálně pokročilým nebo metastatickým onemocněním – cabozantinib a vandetanib. Jedná se o inhibitory tyrozinkináz. Anaplastický karcinom je jedním z nejagresivnějších lidských nádorů. Neexistuje žádná dlouhodobě efektivní léčba ani jednotné léčebné schéma, prognóza pacientů je velmi nepříznivá. V léčbě anaplastického karcinomu se používá zejména chemoterapie a zevní radioterapie. Chirurgická léčba mívá spíše paliativní charakter k úlevě symptomů. Cíl: Cílem sdělení je prezentovat současné možnosti systémové léčby jednotlivých typů karcinomů štítné žlázy z pohledu klinického onkologa, včetně přehledu cílené léčby. Závěr: Nádory štítné žlázy lze podle agresivity seřadit v pořadí papilární karcinom jako biologicky nejpříznivější, folikulární karcinom, medulární karcinom a vysoce maligní anaplastický karcinom. Léčba těchto nádorů vyžaduje multidisciplinární spolupráci.
Tab.1 Hlavní geny zapojené v karcinogenezi štítné žlázy. 
XVIII/ 321. Nové možnosti cílené léčby karcinomu štítné žlázy
Kubáčková K.1, Prausová J.1, Cibulková J.2, Vlček P.3
1 Onkologická klinika 2. LF UK a FN v Motole, Praha, 2 Klinika zobrazovacích metod LF UK a FN Plzeň, 3 Klinika nukleární medicíny a endokrinologie 2. LF UK a FN v Motole, Praha
Východiska: Nádory štítné žlázy představují tumory s nejvyšším nárůstem incidence ve vyspělých státech. Základem léčby pro diferencované karcinomy vedle chirurgického přístupu je aplikace diagnostického a léčebného radioaktivního jódu (RAI). Nádory nejčastěji metastazují do plic (50 %), skeletu (25 %), u 20 % jsou přítomny simultánně jak plicní, tak kostní metastázy. Primárně metastatická choroba je diagnostikována asi u 50 % nemocných a během 5 let od diagnózy nádory metastazují u více než 80 % pacientů. Refrakterní karcinomy k RAI jsou diagnostikovány asi u 25–50 % nemocných s lokálně pokročilou či metastatickou chorobou. U těchto nemocných byla metodou volby chemoterapie. Nové poznatky v oblasti nádorové biologie a genetiky otevřely možnosti vývoje nových léčebných molekul cílené terapie i pro tento vzácný typ nádorů. U papilárního karcinomu byla identifikována mutace BRAF V 600E u 40–50 % nemocných, RET/ PTC u 30–40 %, PI3KCA mutace u 15 %, u folikulárního karcinomu je nejčastější RAS mutace u 40–50 %, BRAF u 35 %, PI3KCA u 28 % a Pax8/ PPARPy u 35 %. Klinické studie s multikinázovými inhibitory byly zahájeny před 10 lety. Prvními cílenými molekulami, které byly schváleny pro karcinom štítné žlázy, byly vandetanib a cabozantinib pro medulární karcinom a sorafenib pro diferencovaný karcinom štítné žlázy. Velmi slibných výsledků bylo dosaženo v publikované studii fáze III s lenvatinibem pro pokročilé diferencované karcinomy. Popis případu: 55letému muži byla provedena strumektomie pro medulární karcinom štítné žlázy s metastázami do plic a uzlin krku a mediastina. Následně byla provedena aplikace diagnostického a terapeutického MIBG bez výrazného terapeutického efektu, proto byla aplikována paliativní chemoterapie DTIC, která byla též bez léčebné odpovědi. V únoru 2015 byla zahájena terapie cabozantinibem, prvních 14 dnů provázená bolestmi svalů, kloubů stupně 2, bolesti v oblasti metastatického postižení krčních uzlin ustoupily. Nemocný dále pokračuje v terapii bez redukce dávky, pracuje na plný úvazek. Budou prezentovány výsledky léčby a aktualizován výskyt nežádoucích účinků. Závěr: Cabozantinib představuje novou léčebnou modalitu pro medulární karcinom štítné žlázy.
NF-CZ11-PDP-3-003-2014. Podpořeno grantem z Norska. Supported by grant from Norway.
XVIII/ 255. Ki-67 and/ or Mitotic Count in the Czech Neuroendocrine Tumour Registry
Sedláčková E.1, Barkmanová J.1, Tomášek J.2, Šiffnerová H.3, Malúšková D.4, Mužík J.4
1 Department of Oncology, First Faculty of Medicine, Charles University and General University Hospital, Prague, 2 Department of Comprehensive Cancer Care, Masaryk Memorial Cancer Institute, Brno, 3 Department of Oncology, Hospital České Budějovice, 4 Institute of Biostatistics and Analyses, Masaryk University, BrnoOn Behalf of the Czech Cooperative Neuroendocrine Tumours Group
Background: The aim of this study is correlation of proliferation index Ki-67 and/ or mitotic count (MC) in a group of gastroenteropancreatic and lung neuroendocrine neoplasmas in the Czech Neuroendocrine Tumour Registry with median overall survival of the patients according to the origin of the primary tumour, regardles to the stage of the disease. Materials and Methods: In April 2014 data of 1,151 patients in the Czech Neuroendocrine Registry have been collected from hospital records, including demography, details of histology, staging, treatment and its outcome. 802 patients had information about Ki-67 and/ or MC status. They were divided into 3 groups: Ki-67/ MC < 2, Ki-67/ MC 2–20, Ki-67/ MC > 20. The retrospective analysis of proliferation index/ mitotic count influence on median overall survival (OS) according to the origin of the primary tumour was done. Results: 316 pts (39.4%) had Ki-67/ MC < 2, 385 pts (48%) had Ki-67/ MC between 2 and 20 and 101 pts (12.6%) had Ki-67/ MC > 20 (Fig. 1). According to topography Ki-67/ MC < 2 was most frequent in colorectal NENS, Ki-67/ MC between 2 and 20 was most frequent in stomach, small bowell and pancreatic NENS. The highest frequency of Ki-67/ MC > 20 was in lung and pancreatic NENS (Fig. 2). Median overall survival in all patients with Ki-67/ MC > 20 was 2.0 years (1.5; 2.6), in two other groups wasn’t reached (Fig. 3). Individual figures for small bowel (Fig. 4), lung (Fig. 5) and pancreatic NENS (Fig. 6) strongly support the influence of Ki-67/ MC on median OS. Conclusion: Ki-67 index/ MC is an essential predicting parameter. Findings from the Czech Neuroendocrine Registry confirmed the highest frequency of Ki-67/ MC > 20 in lung and pancreatic NENs. Median OS in this group of patients in lung was 2.7 years (0.0; 5.8), median OS in pancreatic NENs 1.4 year (0.6; 2.1) in contrast to groups with Ki-67 < 20, where median OS was not reached. We strongly support the idea for using Ki-67 in classification of lung neuroendocrine tumours. Cut-off between G1 and G2 tumours in GEPNETs is also the important question for future discussion.
XVIII/ 256. Kazuistika pacienta s inoperabilním neuroendokrinním tumorem pankreatu léčeným everolimem
Lukešová L., Melichar B., Beneš P., Vrána D.
Onkologická klinika LF UP a FN Olomouc
Východiska: NET reprezentují 2–10 % všech nádorů pankreatu. Postihují stejně často muže i ženy. Většina (68–80 %) je nefunkčních, tzn. neprojevujících se syndromem hormonální nadprodukce. Histologická diagnóza NET pankreatu je podmíněná imunohistochemickou detekcí chromograninu A (CgA) a synaptofyzinu. Průkaz exprese hormonů (inzulinu, gastrinu, somatostatinu, serotoninu a dalších) není pro diagnostiku nutný. Naopak stěžejní pro grading, odrážející biologickou agresivitu nádoru, jsou mitotický index a proliferační index Ki-67. Prognóza závisí na stagingu, gradingu a přítomnosti angioinvaze. Většina nefunkčních NET pankreatu jsou G2 nádory. Celkové pětileté přežití je v tomto případě udáváno mezi 30 a 63 %, s mediánem přežití 72 měsíců. Nádory větší než 2 cm jsou indikovány k radikální resekci. U generalizovaných metastazujících nádorů je snaha o maximální chirurgickou cytoredukci, RFA, embolizaci nebo chemoembolizaci jaterních metastáz. U funkčních nádorů (karcinoidový syndrom, glukagonomový syndrom, pankreatická cholera, Zollinger-Ellisonův syndrom, méně u inzulinomu) je indikována bioterapie analogy somatostatinu. Chemoterapii je vhodné rezervovat pouze pro rychle progredující nádory. K léčbě neresekovatelných nebo metastazujících, dobře nebo středně diferencovaných pankreatických NET u dospělých pacientů s progresí onemocnění je indikován everolimus. Popis případu: V naší kazuistice prezentujeme případ 60leté pacientky léčené everolimem od května 2012 pro inoperabilní hormonálně nefunkční, dobře diferencovaný tumor pankreatu s metastázami v játrech (v době zahájení terapie na žádost pojišťovny dle § 16). V lednu roku 2012 byla pro bolesti břicha vyšetřována na gastroenterologii, kde byla sonograficky a na CT zjištěna metastatická ložiska v játrech, difuzně zvětšený pankreas, postižení těla a kaudy. Následně pomocí FNAB z těla pankreatu cytologicky ověřen NET, G2. Provedena biopsie jater pod kontrolou CT, jež prokázala v jaterním metastatickém ložisku NET; primární tumor vychází z pankreatu. Pacientka klinicky bez známek flushe, palpitací či dušnosti. Vzhledem k radiologické progresi byla u pacientky zahájena terapie everolimem v dávce 10 mg/ den per os. V pravidelných intervalech bylo prováděno přešetření pomocí CT s výsledkem SD. Pacientka nadále snáší terapii dobře, bez výraznější toxicity plynoucí z terapie. Subjektivně jen občasné potíže s aftózní stomatitis. Léčbu podstupuje nyní 57 měsíců. Závěr: Při léčbě everolimem lze u NET pankreatu dosáhnout paliativního účinku s cytoredukcí nádoru a poklesu nádorových markerů, což bylo potvrzeno studií RADIANT-3.
XVIII/ 258. Generalizovaný NET u mladé pacientky
Zábojníková M., Kohoutek M.
Oddělení klinické onkologie, Komplexní onkologické centrum, Krajská nemocnice T. Bati, Zlín
Východisko: Neuroendokrinní tumory (NET) představují heterogenní skupinu poměrně vzácných nádorů, které se liší od běžných epitelových nádorů histogenetickým původem, mikroskopickým obrazem i biologickým chováním. Charakteristickou vlastností NET je endokrinní diferenciace nádorových buněk spojená se schopností produkovat, hromadit a uvolňovat biologicky aktivní látky hormonální povahy. Incidence 23 případy na 100 000 obyvatel. Volba léčebné strategie závisí na rozsahu onemocnění, histologii (gradingu) a funkčním stavu (přítomnost/ absence klinických příznaků v důsledku nadprodukce hormonálně aktivních látek). Úloha chemoterapie není jednoznačná. Nejlepší odpověď lze očekávat u nádorů nízce diferencovaných. Tyto nádory jsou obvykle sekrečně neaktivní, nezpůsobují výrazné hormonální příznaky. Odpověď je u těchto pacientů až u 70 %. Popis případu: 46letá pacientka byla od 12/ 2007 vyšetřována pro bolesti břicha, zvracení. Dle sonografie a CT vícečetná ložiska v jaterním parenchymu. Na MRI páteře mnohočetná ložiska obratlových těl osteolyticko-sklerotického charakteru. Biopsie z jater s nálezem maligního karcinoidu. V 2/ 2008 PET/ CT s nálezem postižení jater, levého acetabula a kostrče. Octreosken s nálezem tří ložisek v játrech, postižením skeletu Th1, levé retabulum a dále colon ascendens, descendens a rekta. Kolonoskopie negativní. Pacientka s karcinoidovým syndromem, proto od 2/ 2008 zahájena léčba analogy – do 10/ 2008 Sandostatin LAR 30, se zlepšením obtíží, ukončeno pro nová ložiska v játrech dle CT. Od 11/ 2008 léčba Somatulinem 90 mg a od 3/ 2009 přidán Intron A 6 MIU s.c. 3krát týdně pro progresi velikosti ložisek jater, pokračováno s efektem regrese metastáz v játrech do 3/ 2013, kdy pro progresi ve skeletu a v játrech zahájena terapie kyselinou zolendronovou se stabilizací dle scintigrafie skeletu a od 25. 4. 2013 první linie paliativní chemoterapie v kombinaci temozolomid a kapecitabin s parciální odpovědí na játrech, nyní pacientka absolvuje 23 sérií, bez závažnější toxicity. Závěr: Pacientka s generalizovaným NET do skeletu a hepar již 7 let profituje z kombinované léčby analogy somatostatinových receptorů, následně z chemoterapie při výborné snášenlivosti.
XVIII/ 352. Patient-reported outcomes (PROs) associated with lanreotide Autogel (LAN-ATG) for symptom control of carcinoid syndrome in gastroenteropancreatic neuroendocrine tumour (GEP-NET) patients: results of SYMNET, a large international multicentre observational study
Holubec L., Fiala O., Fínek J.
Department of Oncology and Radiotherapeutics, Faculty of Medicine, Charles University and University Hospital, Pilsen
Background: Somatostatin analogues are widely used to reduce the incidence and severity of carcinoid syndrome symptoms. However, their impact on patients’ satisfaction with symptom control needs further investigation. SYMNET was a large international multicentre observation study that assessed PROs during LAN-ATG treatment of carcinoid syndrome in GEP-NET patients. Methods: At routine clinic visit, patients with diarrhoea related to carcinoid syndrome and receiving LAN-ATG for > 3 months were asked to complete PRO questionnaires on satisfaction and symptoms associated with their treatment. Investigators also assessed patients’ medical records to identify patient characteristics that were potential predictors of treatment satisfaction. Results: Of 273 patients enrolled, 56% were male, 57% were aged > 60 years, 66% had small bowel primary tumours, and 80% had liver metastases. Prior to the study, 66% had surgery and 23% other anti-tumour therapy within last three months. Mean time since diagnosis was 4.4 years. Mean LAN-ATG treatment duration was 21.7 months and median dose 120 mg/ month on study day. Most patients (76%) were satisfied with diarrhoea control, and flushing control (73%). More patients indicated no, minimal, or mild diarrhoea at study visit (75%) than did before treatment (33%). Most (79%) patients reported diarrhoea was improved overall with LAN-ATG. Investigators identified a clinically relevant decrease in stool frequency since treatment initiation (median: 4 to 2 episodes/ day). Statistically significant decreases (McNemar paired tests, p < 0.001) were seen in the proportion of patients with urgency (73 to 41%), leakage (21 to 9%), and associated pain (37 to 4%). Predictors of satisfaction with diarrhoea control were initial stool leakage and non-small bowel primary localization. Conclusion: GEP-NET patients reported favourable symptom control with LAN-ATG treatment. Improvements in PROs were consistent with those on investigators’ medical assessments. Patients’ satisfaction with symptom control on LAN-ATG may be supported by associated factors.
Supported by the project CZ 1.05/ 2.1.00/ 03.0076 from European Regional Development Fund.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Radioterapeutické metodyČlánek Nutriční podpora v onkologiiČlánek Psychosociální péčeČlánek EditorialČlánek Nádory prsuČlánek Nádory jícnu a žaludkuČlánek SOUTĚŽ O NEJLEPŠÍ PRÁCIČlánek SarkomyČlánek Nádory hlavy a krkuČlánek Gynekologická onkologieČlánek UroonkologieČlánek Nádory nervového systémuČlánek HematoonkologieČlánek Jmenný rejstříkČlánek Sborník abstrakt
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo Supplementum 1- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
-
Všechny články tohoto čísla
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Nádory slinivky, jater a žlučových cest
- Neuroendokrinní a endokrinní tumory
- Sarkomy
- Nádory hlavy a krku
- Nádory hrudníku, plic, průdušek a pleury
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Gynekologická onkologie
- Uroonkologie
- Nádory nervového systému
- Hematoonkologie
- Nádory dětí, adolescentů a mladých dospělých
- Jiné malignity (ostatní, jinde nezařazené malignity)
- Varia (ostatní, jinde nezařazené příspěvky)
- Vývoj nových léčiv, farmakoekonomika, klinická farmacie v onkologii
- Základní a aplikovaný výzkum v onkologii
- Jmenný rejstřík
- Onkologická prevence a screening
- Organizace a financování zdravotní péče
- Epidemiologie nádorů, klinické registry, zdravotnická informatika
- Vzdělávání, kvalita a bezpečnost v onkologické praxi
- Diagnostické metody v onkologii
- Radioterapeutické metody
- Sborník abstrakt
- Nežádoucí účinky protinádorové léčby
- Paliativní péče a symptomatická léčba
- Nutriční podpora v onkologii
- Psychosociální péče
- Pacientské organizace a spolupráce s veřejností
- Hereditární nádorové syndromy
- Editorial
- Nádory prsu
- Nádory kůže a maligní melanom
- Nádory jícnu a žaludku
- Nádory tlustého střeva a konečníku
- Organizační a programový výbor BOD a KNZP v roce 2015
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nádory tlustého střeva a konečníku
- Paliativní péče a symptomatická léčba
- Nádory prsu
- Nádory jícnu a žaludku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





