-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vývoj nových léčiv, farmakoekonomika, klinická farmacie v onkologii
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 1): 142-144
Kategorie: Vývoj nových léčiv, farmakoekonomika, klinická farmacie v onkologii
XXIX. Vývoj nových léčiv, farmakoekonomika, klinická farmacie v onkologii
XXIX/ 153. Nové trendy ve vývoji protinádorových léčiv. Od inhibitorů tyrozinkináz k nové skupině epigenetických léčiv
Král V.1, Martásek P.2, Králová J.3, Čupka J.4, Bouška L.4
1 Zentiva, Praha, 2 Ústav molekulární genetiky AV ČR, v. v. i., útvar BIOCEV, Praha, 3 Ústav molekulární genetiky AV ČR, v. v. i., Praha, 4 Epigentest, Praha
Východiska: Vedle tradičních a dlouhodobě využívaných léčiv existují nové trendy ve vývoji protinádorových léčiv. Velký pokrok byl dosažen v oblasti biologických léčiv. V posledních letech dochází k rychlému vývoji také v případě nové generace cytostatik, malých molekul. To vyústilo v širokou aplikaci nové rodiny tyrozinkinázových inhibitorů, což začalo komerčním úspěchem imatinibu. V současnosti je na trhu již více než 20 tyrozinkinázových inhibitorů s širokým spektrem terapeutické účinnosti. Nejnovějším trendem pro terapii nádorových onemocnění je vývoj epigenetických léčiv. Tradičně je vývoj rakoviny popisován z velké části jako důsledek hromadění genetických vad, jako jsou mutace, amplifikace, delece a translokace. Ty mají vliv na rakovinné buňky a poskytují jim výhodu přežít a metastazovat. Kromě toho interakce mezi rakovinnými buňkami a jejich mikroprostředím vytváří další podporu těchto procesů. Stejný význam má druhý systém, který určuje, kdy a kde se konkrétní gen projeví v průběhu vývoje. Tento systém je manifestován na DNA ve formě epigenetických značek, které jsou dědičné během buněčného dělení, ale nemění sekvenci DNA. Epigenetiku tak můžeme chápat jako široký soubor mechanizmů, které dědičně ovlivňují genovou expresi beze změny primární genetické informace. Nejvíce studované epigenetické modifikace jsou metylace DNA. Nicméně existují další molekulární mechanizmy, jako je např. modifikace histonů. Deregulace genové exprese způsobená kombinací genetických a epigenetických změn má úzkou souvislost s řadou onkologických onemocnění. Hlubší studium epigenetiky je tedy velice důležité pro možné nalezení epigenetických terapeutik, které mohou v procesu epigenetických změn působit jako účinné inhibitory. Klinicky nejvíce ověřeným použitím epigenetických agentů je v současnosti případ hematologických malignit. Cíl: Tento příspěvek bude probírat epigenetické změny a to, jak jsou spojeny s rakovinou. Uvede stručný přehled o klinickém použití epigenetických změn jako biomarkerů a zaměří se podrobněji na vývoj a aplikaci epigenetických léčiv a jejich použití pro terapii nádorových onemocnění. K dnešnímu dni existují čtyři FDA-schválené léky s epigenetickým mechanizmem účinku. Závěr: Epigenetika se zaměřením na vývoj nových léčiv pracuje s porozuměním epigenetických regulátorů maligních buněk a poskytuje nové cíle pro efektivnější použití epigenetických přístupů k léčbě rakoviny s vysokou specificitou.
Tab. 1. Classification of epigenetic drugs with therapeutic potential. 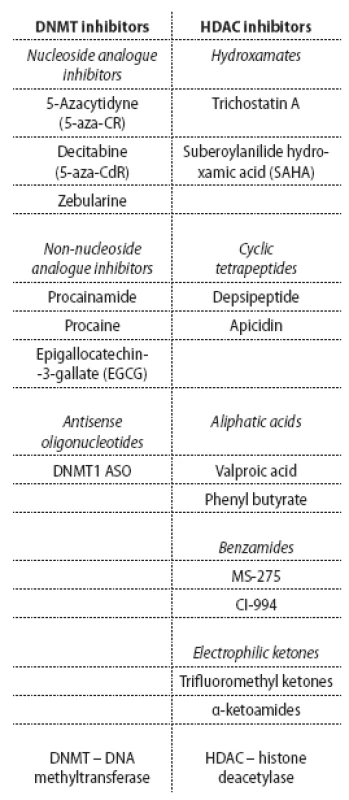
XXIX/ 245. Nové molekuly v klinických hodnoceních u vybraných onkologických diagnóz
Horová R., Hanáková M., Haičmanová J., Reviľáková L., Skoupá M., Jenerálová M., Holešovská A., Vavrouchová K., Ševelová P., Demlová R.
Oddělení klinických hodnocení, MOÚ, Brno
Oddělení klinických hodnocení poskytuje v MOÚ kompletní zázemí provádění klinických hodnocení všech fází vývoje. Bylo založeno již v roce 2000 a od té doby stálo u zahájení více než 200 klinických hodnocení pro solidní nádory. Nejčastěji zastoupené diagnózy v klinických hodnoceních jsou karcinom prsu, maligní melanom, karcinomy trávicí trubice, prostaty a gynekologické karcinomy. V posledních letech, díky rozvoji molekulární biologie, jsme svědky obrovského rozmachu cílené onkologické léčby (targeted therapy), která působí výlučně na nádorovou buňku a na rozdíl od cytostatik nepoškozuje genetickou informaci buňky. Cílená léčiva působí v oblasti proteinů s regulačními a signálními účinky, a tím zasahují přímo do klíčových mechanizmů karcenogeneze. Mezi základní typy cílené léčby patří tyrozinkinázové inhibitory (malé molekuly) a monoklonální protilátky. Trendem je rovněž imunoterapeutická léčba a využití „protinádorových vakcín“. Řada léků této nové generace je již registrována a používána v praxi, např. tyrozinkinázové inhibitory imatinib mesylát, erlotinib, sorafenib, lapatinib nebo vemurafenib a monoklonální protilátky trastuzumab, bevacizumab nebo ipilimumab, další jsou však teprve v klinických hodnoceních fází I–III. Posterové sdělení je věnováno vybraným neregistrovaným molekulám v klinických hodnoceních především pro diagnózy karcinomu prsu a maligního melanomu, která probíhaly v MOÚ v letech 2013–2015. V případě studií pro karcinom prsu stojí za zmínku zejména PARP inhibitory (veliparib, olaparib), CDK inhibitory (ribociclib) a PI3K inhibitory (buparlisib, pictociclib). Ve studiích pro pacienty s maligním melanomem máme příležitost vyzkoušet BRAF inhibitory (encorafenib), MEK inhibitory (trametinib, dabrafenib, binimetinib, cobimetinib) a PD-1 monoklonální protilátky nivolumab a pembrolizumab. Poster se věnuje nejen základním charakteristikám cílené léčby, ale především postřehům z praktického provádění klinických hodnocení nových molekul z pohledu studijního koordinátora. Mezi specifika těchto klinických hodnocení patří např. náročnější pre-screeninig nebo odlišné hodnocení léčebné odpovědi v oblasti protinádorové imunoterapie.
XXIX/ 409. Hyperthermic Intraperitoneal Chemotherapy – Oncology Pharmacy Point of View
Netíková I.1, Vočka M.2
1 Department of Clinical Pharmacology and Pharmacy, General University Hospital, Prague, 2 Department of Oncology, 1st Fakulty of Medicine, Charles University in Prague, General University Hospital, Prague
Hyperthermic intraperitoneal chemotherapy (HIPEC) involves perfusion the abdominal cavity with cytostatics, heated to 42 °C, for approximately 90 min. HIPEC is often performed after cytoreductive surgery. Mainly used cytostatics are cisplatin, carboplatin, less oxaliplatin, doxorubicin etc. The heat makes the drug more effective in killing cancer cells, and it also increases blood flow to the area. HIPEC is performed when standard systemic chemotherapy has limited efficacy because of the IV administered concentration of cytostatics in the abdomen is too low to destroy all present tumour cells. HIPEC is used to treat soft tissue sarcoma, appendix cancer, mesotelioma, colorectal carcinoma and ovarian cancer at stage of peritoneal carcinomatosis and other cancers in the abdominal cavity. HIPEC has comparatively serious side effects. Patients can develop hematological toxicity, CINV and renal failure. It is due to cytostatic penetration into the bloodstream. Detected plasmatic concentration are usually around lower limit of a therapeutic range. From oncology pharmacy point of view we shall think about suitable infusion solution and drug concentration with good stability in hypertermic conditions. We have to take care about an appropriate premedication and hydration. Handling cytostatic solution in operating room should follow standard oncology pharmacy procedure.
I haven’t any conflict of interest.
XXIX/ 410. MONITOROVÁNÍ HLADIN EVEROLIMU Z POHLEDU ONKOLOGA A KLINICKÉHO FARMACEUTA
Holečková P.1, Gregorová J.2
1 Ústav radiační onkologie, Nemocnice Na Bulovce, Praha, 2 Oddělení klinické farmacie, Nemocnice Na Bulovce, Praha
Východiska: V onkologii je everolimus v současné době schválen v kombinaci s exemestanem k léčbě hormonálně pozitivního HER2 negativního pokročilého karcinomu prsu postmenopauzálních žen po předchozí léčbě nesteroidním inhibitorem aromatáz; k léčbě neresekovatelných nebo metastazujících, dobře nebo středně diferencovaných pankreatických neuroendokrinních tumorů u dospělých pacientů s progresí onemocnění; k léčbě pokročilého renálního karcinomu pacientů, u kterých došlo k progresi onemocnění během VEGF-cílené terapie nebo po ní. U pacientů léčených everolimem po transplantaci byla pozorována velká interindividuální farmakokinetická variabilita a vyšší plazmatické hladiny byly úzce spojeny s výskytem závažných nežádoucích účinků. Proto bylo v transplantologii na základě studií stanoveno rozpětí účinných a bezpečných hodnot Cmin (minimální plazmatická hladina). Jejich kontrola a individualizované dávkování se stalo v tomto oboru standardním postupem. V onkologii takto jednoznačně stanovené rozmezí plazmatických hladin everolimu zatím chybí. Interindividuální variabilitu plazmatických hladin everolimu jsme pozorovali i u pacientů s metastatickým renálním karcinomem. Zpočátku důvodem pro stanovení plazmatických hladin byl pouze výskyt závažného nežádoucího účinku nebo reakce – hyperglykemie a triglyceridemie (grade 3, common terminology criteria for adverse events – CTCAE) atd. Metody a výsledky: Metodika monitorování hladin everolimu byla převzata z transplantologie. Vyšetření je prováděno z 2 ml nesrážlivé krve v EDTA odebrané ráno před užitím everolimu. Vyšetření podstoupilo osm pacientů (šest mužů, dvě ženy) s mRCC (metastatický renální karcinom) léčeným everolimem 10 mg/ den, případně po redukci dávky 5 mg/ den. Na základě monitorace došlo u čtyř pacientů k úpravě dávkování, čtyřem pacientům byla ponechána doporučená dávka 10 mg/ den. Postup při úpravě dávkování v těchto případech jsme založili na výsledcích studií, které sledovaly vztah farmakokinetiky a farmakodynamiky everolimu, resp. vztah mezi Cmin a inhibicí mTOR (mammalian target of rapamycin) signální dráhy. Tolerance preparátu v souboru se výrazně zlepšila. Závěr: Na podkladě vlastních zkušeností a kritického zhodnocení nově publikovaných údajů k této problematice jsme si stanovili postup individualizovaného dávkování už v době zahájení terapie a management nežádoucích účinků a lékových interakcí everolimu jsme opřeli o měření jeho plazmatických hladin, jejichž stanovení by také mělo být základem pro správnou interpretaci terapeutického přínosu everolimu.
XXIX/ 411. Protokol alkalizace moči při podání vysokodávkovaného metotrexátu z pohledu klinického farmaceuta a lékaře
Rychlíčková J.1, Tuček Š.2, Goněc R.3, Navrátil J.2
1 Oddělení klinické farmacie, Nemocnice Na Bulovce, Praha, 2 Klinika komplexní onkologické péče, MOÚ, Brno, 3 Úsek klinických hodnocení, MOÚ, Brno
Východiska: Léčebné použití metotrexátu je široké. Ve vysokých, gramových dávkách má své uplatnění v léčbě osteosarkomu a u některých hematologických malignit. Jde o léčbu náročnou pro všechny zúčastněné – jak pro pacienty, tak pro ošetřující personál, lékaře, lékárníky i sestry. Vysoké dávky metotrexátu mohou mít pro pacienta závažné nežádoucí účinky, zejména poškození ledvin precipitací metotrexátu v tubulech ledvin, pokud se správně neprovede hydratace alkalizace moči, podání antidota leukovorinu, a pokud personál včas a adekvátně nezareaguje na případné projevy zpomalené exkrece metotrexátu. Protokol podávání vysokodávkovaného metotrexátu má svá specifika a úskalí. Metotrexát má řadu významných interakcí s běžně užívanými léky i potravinami. Významné jsou především léky a potraviny prodlužující exkreci metotrexátu, a tím potenciálně zvyšující závažnost toxicity slizniční a hepatální. Jedná se zejména o penicilin, cotrimoxazol, inhibitory protonové pumpy, allopurinol, nesteroidní analgetika/ antiflogistika včetně metamizolu, vitamin C a maso. Po celou dobu expozice metotrexátu je třeba uměle udržovat pH tubulární tekutiny, a tím i moče, zásadité, tj. > 7, dosáhnout a udržet adekvátní hydrataci a diurézu. Otázkou je použití optimálního nosného roztoku, iontového složení, rychlosti podání a způsobu monitorace. Cíl: Diskuze nad spornými body a sdílení zkušeností z rozdílných pracovišť z pohledu klinického farmaceuta a lékaře. Definice vyhovujícího znění alkalizačního protokolu. Probrána a prodiskutována budou různá složení nosného roztoku, různá množství přidaných elektrolytů, různé rychlosti podání a možných důsledků na vnitřní prostředí a klinický stav pacienta a možnosti monitorace. Závěr: Pro úspěšné zvládnutí léčby metotrexátem ve vysokých dávkách je třeba pečlivé respektování jeho interakcí, sledování vnitřního prostředí a klinického stavu pacienta, nutná je spolupráce celého ošetřujícího personálu – lékaře, klinického farmaceuta i sester a ošetřovatelek.
Literatura: [1] Widemann BC et al. Oncologist 2006; 11 : 694–703. [2] Whelan JS et al. Ann Oncol 2015; 26(2): 407–414. [3] www.euramos.org.
Podpořeno MZ ČR – RVO (MOÚ, 00209805).
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek SarkomyČlánek Nádory hlavy a krkuČlánek Gynekologická onkologieČlánek UroonkologieČlánek Nádory nervového systémuČlánek HematoonkologieČlánek Radioterapeutické metodyČlánek Sborník abstraktČlánek Nutriční podpora v onkologiiČlánek Psychosociální péčeČlánek EditorialČlánek Nádory prsuČlánek Nádory jícnu a žaludkuČlánek SOUTĚŽ O NEJLEPŠÍ PRÁCIČlánek Jmenný rejstřík
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo Supplementum 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Nádory slinivky, jater a žlučových cest
- Neuroendokrinní a endokrinní tumory
- Sarkomy
- Nádory hlavy a krku
- Nádory hrudníku, plic, průdušek a pleury
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Gynekologická onkologie
- Uroonkologie
- Nádory nervového systému
- Hematoonkologie
- Nádory dětí, adolescentů a mladých dospělých
- Jiné malignity (ostatní, jinde nezařazené malignity)
- Varia (ostatní, jinde nezařazené příspěvky)
- Vývoj nových léčiv, farmakoekonomika, klinická farmacie v onkologii
- Základní a aplikovaný výzkum v onkologii
- Jmenný rejstřík
- Onkologická prevence a screening
- Organizace a financování zdravotní péče
- Epidemiologie nádorů, klinické registry, zdravotnická informatika
- Vzdělávání, kvalita a bezpečnost v onkologické praxi
- Diagnostické metody v onkologii
- Radioterapeutické metody
- Sborník abstrakt
- Nežádoucí účinky protinádorové léčby
- Paliativní péče a symptomatická léčba
- Nutriční podpora v onkologii
- Psychosociální péče
- Pacientské organizace a spolupráce s veřejností
- Hereditární nádorové syndromy
- Editorial
- Nádory prsu
- Nádory kůže a maligní melanom
- Nádory jícnu a žaludku
- Nádory tlustého střeva a konečníku
- Organizační a programový výbor BOD a KNZP v roce 2015
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nádory tlustého střeva a konečníku
- Paliativní péče a symptomatická léčba
- Nádory prsu
- Nádory jícnu a žaludku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání






