-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Nádory tlustého střeva a konečníku
Vyšlo v časopise: Klin Onkol 2015; 28(Supplementum 1): 89-99
Kategorie: Nádory tlustého střeva a konečníku
XVI. Nádory tlustého střeva a konečníku
XVI/ 169. Půl století léčby nádorů kolorekta, úvodní sdělení
Mechl Z.
Interní hematologická a onkologická klinika LF MU a FN Brno
Cílem následujícího pojednání je podat náhled na současný stav léčby nádorů kolorekta. Multimodální přístup, tj. chirurgie, systémová léčba a radioterapie, je v léčbě nádorů kolorekta dnes samozřejmostí. Léčba nádorů této oblasti byla ale po dlouhou dobu doménou pouze chirurgů. Lokoregionálně pokročilý karcinom kolorekta byl potenciálně kurabilní chirurgickou resekcí, metastatické onemocnění bylo nevyléčitelné. V průběhu posledního půl století se hodně změnilo. Nové poznatky o etiologii, genetice, pochopení rizikových faktorů, potenciálně protektivních faktorů, časné detekci a prevenci vedlo k redukci incidence a mortality. Výsledky klinických studií v roce 1977 daly podnět k zahájení léčby pro kolon a rektum odlišně. Za nejvýznamnější pokrok se považuje popsání molekulární evoluce kolorektálního karcinomu od normální mukózy přes polyp ke karcinomu. Došlo k výraznému rozvoji vzájemných vztahů všech tří léčebných postupů. Pokrok v léčbě CRC během posledních 50 let lze shrnout do následujících bodů: popsání syndromu familiárního karcinomu kolon; sigmoidoskopie a včasné odstranění polypů; zavedení screeningu ke snížení incidence a mortality; v prevenci byl ověřen negativní vliv obezity, fyzické aktivity a dalších faktorů; adjuvantní chemoterapie a chemoradioterapie vede k prodloužení přežití ve stadiu II a III; radioterapie je aplikována mnohem přesněji; systémová terapie se zlepšila a rozšířila o biologickou terapii; výrazně se zlepšila prognóza pro pacienty s oligometastázami v jednom orgánu; prognóza odvisí především od TNM, významná je molekulární charakteristika, některé mutace predikují odpověď na systémovou terapii; testování přítomnosti mutací genu KRAS nebo jiných členů RAS je dnes standardní praxe pro zvažování anti-EGFR protilátek u metastatických karcinomů kolorekta. I když bylo v léčbě karcinomu kolorekta dosaženo velkého pokroku, je stále ještě mnoho co objasňovat. Nádory této lokalizace jsou heterogenním onemocněním a v současné době je pouze RAS mutace schopná predikce léčebné odpovědi pro malou frakci postižené populace.
XVI/ 123. Mechanizmy vzniku a vývoje kolorektálního karcinomu
Němeček R., Svoboda M.
Klinika komplexní onkologické péče, MOÚ, Brno
Východiska: Kolorektální karcinom (CRC) je heterogenní onemocnění, na jehož vzniku a vývoji se podílejí změny genetické i epigenetické. Hereditární formy (Lynchův syndrom, familiární adenomatózní polypóza a další) zaujímají méně než 5 % CRC, naopak více než 95 % všech CRC tvoří formy sporadické. Na základě morfologicko-molekulárních korelací lze popsat tři základní typy kancerogeneze sporadického CRC: 1) model vzniku z konvenčních lézí (tubulární a tubulovilózní adenom), 2) model vzniku ze serátních lézí (sesilní serátní adenom, tradiční serátní adenom) a 3) model vzniku ze zánětlivých lézí (dysplastické nepolypózní změny). Základními patogenetickými mechanizmy kolorektální kancerogeneze jsou chromozomální instabilita (CIN) a mikrosatelitní instabilita (MSI), resp. s ní související hypermetylace promotorových oblastí určitých genů (tzv. CpG-island methylator phenotyp – CIMP). Pro každý z těchto mechanizmů je do jisté míry charakteristický určitý fenotypový obraz, který se liší lokalizací primárního nádoru, věkem a pohlavím pacientů, stupněm diferenciace nádoru a především molekulárně genetickými změnami, resp. zastoupením mutací onkogenů RAS, BRAF, PIK3CA a dalších. Důležitou roli hrají i nekódující RNA, které regulují expresi cílových genů na transkripční i post-transkripční úrovni. Několik výzkumných projektů se pokusilo o rozčlenění CRC do podskupin se společnými molekulárně genetickými i fenotypovými vlastnostmi. Dle výsledků celogenomových analýz realizovaných v rámci projektu TCGA (The Cancer Genome Atlas Network) byl CRC rozdělen na skupinu nádorů hypermutovaných (16 %) a nehypermutovaných (84 %). Tyto podskupiny svými charakteristikami nápadně korelovaly s charakteristikami nádorů s MSI (resp. CIMP) a nádorů s CIN. Při porovnání počtu detekovaných somatických mutací na jeden nádor byl CRC v pořadí šestou malignitou s mediánem 76 detekovaných mutací na jeden případ CRC. Molekulární klasifikaci CRC se věnovala i práce CRCSC (Colorectal Cancer Subtyping Consortium), dle které lze CRC rozčlenit na pět základních molekulárních podtypů s konkrétními klinickými a prognostickými konsekvencemi. Závěr: Pochopení molekulárních mechanizmů kancerogeneze a z něj vycházející podrobná molekulárně genetická analýza nádorové tkáně by měly v budoucnosti vést k začlenění nádoru do některého z definovaných molekulárních subtypů a umožnit onkologům nejen lépe odhadnout prognózu onemocnění, ale i řídit jejich terapeutická rozhodnutí s cílem co nejpřesnějšího tailoringu onkologické léčby.
Práce byla podpořena grantovým projektem MZ ČR – RVO (MOÚ, 00209805) a IGA MZ ČR NT/ 13860-4/ 2012.
XVI/ 174. Endoskopie v diagnostice prekanceróz tlustého střeva
Šachlová M., Novotný I.
Gastroenterologické oddělení, MOÚ, Brno
Východiska: Prekancerózní léze představují ohraničená ložiska tkáňových změn, jejichž základem jsou známky nádorové transformace buněk, které je možné mikroskopicky zachytit jako cytologické a strukturální nepravidelnosti. Zdaleka nejčastější prekancerózní lézi kolorektálního karcinomu představují sporadické adenomy. Makroskopicky se jedná o stopkaté, přisedlé (sesilní) a plošné až vhloubené léze, které se manifestují jako různě rozsáhlé slizniční nerovnosti. Mikroskopicky vykazují buňky adenomů vždy obraz dysplazie, histologicky se adenomy dělí podle převažující komponenty na tubulární, vilózní a tubulovilózní. Zvláštní jednotku představuje tzv. pilovitý adenom (serrated adenoma). Cíl: Kolonoskopie je metoda, která je schopná odhalit a také odstranit prekancerózy a karcinomy v časném stadiu. Efektivita kolonoskopie je závislá na dokonalé přípravě k vyšetření a velký význam má i zkušenost a pečlivost vyšetřujícího. Základní endoskopickou terapii představuje polypektomie, případně endoskopická mukózní resekce EMR. Léze postihující aborální část rekta může řešit chirurg metodou transrektální endoskopické mikrochirurgie (TEM). Závěr: Záchyt onkologického onemocnění v časném klinickém stadiu nebo ještě lépe ve fázi prekancerózy výrazně zvyšuje naději na dobrý výsledek léčby a na dlouhodobé přežití. Endoskopická pracoviště zapojená do screeningu musí splňovat kritéria kvality. Jejich seznam naleznete na www.kolorektum.cz. Screening asymptomatických osob bez výskytu nádoru střeva v rodině: 1) Klient ve věku od 50 do 54 let má právo na bezplatný test na okultní krvácení (TOKS) 1krát ročně, test dostane u svého praktického lékaře nebo gynekologa. Při pozitivitě následuje kolonoskopie. 2) V 55 letech si může klient zvolit TOKS 1krát za 2 roky nebo primární screeningovou kolonoskopii. V případě negativní kolonoskopie je další vyšetření provedeno za 10 let.
Práce byla podpořena grantovým projektem MZ ČR – RVO (MOÚ, 00209805).
XVI/ 175. Diagnostika pacientů s nádory tlustého střeva
Tomášek J.
Klinika komplexní onkologické péče, MOÚ, Brno
Nejčastějším zhoubným nádorem tlustého střeva je kolorektální karcinom (CRC), který je v časném stadiu vyléčitelný. Vyhledávání nádorů u lidí, kteří nemají žádné potíže, se věnuje kolorektální screening. Ten je zaměřen na plošné vyšetřování populace ve věku 50 let a výše. Nádor v časném stadiu a také přednádorové změny střeva se mohou projevit drobným krvácením do stolice v množství, které není zrakem patrné (skryté = okultní). I malé množství krve ve stolici lze ale detekovat laboratorně. Test na okultní krvácení ve stolici (TOKS) je screeningová metoda určená pro lidi ve věku 50–55 let, v rámci screeningu probíhá jednou ročně a od 55 let jednou za dva roky. Je to vyšetření nenáročné a je běžně dostupné u praktických lékařů, případně gynekologů. Po dovršení 55 let se lze rozhodnout místo TOKS pro screeningovou kolonoskopii, kterou lze absolvovat jednou za 10 let. Kolonoskopie je přesnější než test okultního krvácení. Během vyšetření lze odstranit polypy, ze kterých by nádor mohl vzniknout, a umožní odběr biopsie z podezřelých útvarů ve střevě. Pokud pacient sám pozoroval krev ve stolici, je nesmyslné prokazovat následně krev pomocí TOKS a pacient by měl absolvovat rovnou diagnostickou kolonoskopii. Kromě krve ve stolici patří k dalším symptomům nádorů tlustého střeva sideropenická anémie (anémie z nedostatku železa), bolesti břicha při obstrukci střeva, změna charakteru stolice. Základem diagnózy je histologická verifikace, tedy mikroskopický průkaz nádoru z odebraného vzorku tkáně. Molekulární vyšetření nádorové tkáně má význam u pacientů s pokročilým onemocněním ve stadiu metastáz. Stanovujeme mutační stav onkogenů RAS, případně BRAF, výsledek pomůže při volbě chemoterapie a cílené léčby. Vstupní vyšetření zahrnuje laboratorní vyšetření, kam patří krevní obraz, základní biochemické vyšetření krve a stanovení nádorových markerů CEA a Ca 19-9. Ke zjištění pokročilosti nádoru a případných metastáz (staging) slouží soubor zobrazovacích metod. Základem je CT břicha a pánve a CT hrudníku nebo minimálně RTG hrudníku. V případě, že jde o nádor konečníku (rektum), je k diagnostice lokálního rozsahu nádoru vhodné provedení MR pánve a/ nebo transrektálního ultrazvuku. Cílem těchto vyšetření je zjištění rozsahu nádoru ve stěně konečníku a stav okolních uzlin. Precizní provedení stagingu je předpokladem stanovení optimálního léčebného plánu pro konkrétního pacienta.
XVI/ 176. Náplň multidisciplinární komise
Ostřížková L.
Interní hematologická a onkologická klinika LF MU a FN Brno
Kolorektální karcinom je druhým nejčastějším nádorovým onemocněním ve vyspělých zemích světa. ČR patří na přední místa v incidenci tohoto onemocnění, a to jak u mužů, tak i u žen. Ročně je v ČR hlášeno 8 000 nových případů, 4 000 nemocných s tímto onemocněním zemře. V době stanovení diagnózy má 20–25 % nemocných založené vzdálené metastázy. Více než 50 % nemocných III. klinického stadia zprogreduje do dvou let od operace. Systémová chemoterapie v kombinaci s cílenou léčbou prodloužila přežití nemocných s metastatickým kolorektálním karcinomem na 30 měsíců. Ale naději na dlouhodobé přežití či úplné vyléčení pacientů s metastatickým kolorektálním karcinomem je možné pouze v případě resekce metastáz. Při metastatickém postižení jater je možnost primární resekce jaterních metastáz u 30 % nemocných. Použití všech dostupných metod multimodální léčby umožní kurativní resekci jaterních metastáz u dalších 30 % nemocných primárně neresekabilních. Více než 50 % nemocných po kurativní resekci nebo termoablaci jaterních metastáz přežívá déle než 5 let. Multidisciplinární přístup k léčbě těchto nemocných v centrech s přístrojovým a profesním vybavením vede k prodloužení přežití nemocných a zlepšuje kvalitu života. V týmu, který se podílí na terapii pacientů, spolupracuje klinický onkolog, onkochirurg, radiodiagnostik, radioterapeut, patolog, hepatolog, gastroenterolog. Rozhodování o léčebném postupu vždy cestou multidisciplinární komise pro digestivní onkologii.
XVI/ 177. Možnosti chirurgické léčby nádoru tlustého střeva
Eber Z.1, Šefr R.1, Ondrák M.1, Sirotek L.1, Fiala L.1,2
1 Oddělení chirurgické onkologie, MOÚ, Brno, 2 Gastroenterologické oddělení, MOÚ, Brno
V ČR je ročně diagnostikováno 8 000 pacientů s CRC a současně 4 000 pacientů na kolorektální karcinom umírá. Řadíme se tak ve výskytu tohoto onemocnění u obou pohlaví na páté místo v Evropě. Stále přetrvává vysoký počet nově diagnostikovaných nemocných ve III. a IV. klinickém stadiu. Tato skutečnost nás stimuluje nejen k vytváření preventivních programů, umožňujících záchyt CRC v časnějších stadiích, ale i ke koncentraci těchto pacientů do specializovaných center, v nichž je zaručena multidisciplinární zdravotnická péče. Jedinou kurativní léčbou solidních nádorů tračníku je jejich chirurgické odstranění s příslušnou radikalitou. Což v praxi znamená odstranění jak příslušných cévních kmenů, tak i spádové lymfatické oblasti. Lokalizace nádoru samozřejmě určuje, která část střeva bude odstraněna. Kontinuita tračníku je následně zajištěna střevní anastomózou. Tato je zvolena dle aktuální situace, většinou se ale jedná o end to end anastomózy. Strategie operačního výkonu u akutní revize pro ileózní stav, kdy tumor plně obturuje lumen střeva, se liší od elektivního výkonu na připraveném střevě. Elektivní operace je možno provádět jednak klasicky otevřenou metodou nebo laparoskopicky. Miniinvazivní operační metody jsou v současné době trendem i v onkochirurgii. Včasná diagnostika nádorového onemocnění s dostatečně radikálním operačním řešením ve smyslu R0 resekce je pro mnohé život zachraňujícím výkonem.
XVI/ 354. Minimálně invazivní možnosti léčby časných stadií kolorektálního karcinomu
Martínek J.
Klinika hepatogastroenterologie, IKEM, Praha
Endoskopie hraje v terapii časných stadií kolorektálního karcinomu důležitou roli. Tradiční technikou řešení premaligní léze je endoskopická polypektomie. K polypektomii se používá endoskopické kličky a nejčastěji jsou takto odstraňovány stopkaté polypy. Mnohé premaligní či maligní léze však mají tvar plošných nebo přisedlých lézí různé velikosti. Z hlediska hloubky invaze se jedná o léze časné. Endoskopicky lze tyto typy lézí (nazývají se laterally spreading tumors – LST) řešit buď konvenční endoskopickou resekcí (ER), kombinující podpich léze roztokem a řez kličkou, nebo tzv. endoskopickou submukózní disekcí (ESD), která kombinuje podpich a disekci léze endoskopickým nožem. Výhodou disekce je možnost odstranění i velkých lézí en-blok, což umožňuje přesný histopatologický staging. ER, na rozdíl od ESD, může en-blok odstranit léze do maximální velikosti 20 mm, léze větší se musí technikou konvenční ER odstraňovat po částech (tj. piece-meal). Bylo prokázáno, že po piece-meal ER se lokální recidivy vyskytují častěji oproti ESD. Na druhou stranu je ER technicky mnohem jednodušší. Riziko přítomnosti karcinomu (event. karcinomu s již submukózní invazí) se u jednotlivých makroskopických typů lézí liší. Léze typu IIc a IIa + IIc mají při velikosti nad 2 cm téměř 100% pravděpodobnost přítomnosti karcinomu, zatímco léze typu IIa mají při velikosti nad 2 cm pouze 50% pravděpodobnost přítomnosti karcinomu. Stejně tak se dělí LST na typ granulární a typ non-granulární. Riziko karcinomu se submukózní invazí je u granulárních lézí menší oproti lézím non-granulárním. Ke konvenční ER jsou indikovány léze menší než 2 cm. Piece-meal konvenční ER lze použít u LST granulárních homogenních lézí. ESD by měla být preferována u velkých LST non-granulárního typu a u všech velkých lézí sugestivních z přítomnosti invazivního karcinomu (např. podle hodnocení rizikového pit-pattern). Za kurativní lze označit resekce R0, pokud je u karcinomu přítomna submukózní invaze do maximální hloubky 1 000 µm. Při náhodném nalezení ploché léze by se neměly odebírat biopsie, v důsledku následné fibrózy je endoskopická léčba komplikovaná. Takový pacient by měl být odeslán na specializované pracoviště bez biopsie. Po provedení ER nebo ESD se na základě definitivního stagingu (hodnotí se okraje léze, grading, angioinvaze atd.) rozhodne, zda byla endoskopická léčba dostačující (kurativní), nebo nikoliv.
XVI/ 356. Transanální endoskopická mikrochirurgie rekta – současnost a perspektiva
Ondrák M.1,2, Fiala L.1
1 Oddělení chirurgické onkologie, MOÚ, Brno, 2 Gastroenterologické oddělení, MOÚ, Brno
Východiska: Vzrůstající zájem populace, ale především zdravotních pojišťoven o preventivní vyšetření tlustého střeva a konečníku s sebou přináší nárůst záchytů prekanceróz a časných stadií tohoto nádorového onemocnění. Cíl: Chirurgická léčba zůstává jedinou potenciálně kurabilní modalitou. V léčbě prekanceróz a časných stadií nádorového onemocnění rekta musíme zvolit takový rozsah výkonu, který bude z onkologického hlediska radikální, a tedy kurabilní a zároveň co nejméně mutilující pro pacienta. Operační rektoskop je nástroj, který již čtvrt století tento kompromis umožňuje. Lokální excize v rozsahu celé stěny rekta ve zdravé tkáni je obecně uznávaným postupem pro veškeré patologické procesy, které postihují sliznici a podslizniční vazivo. Konstrukce operačního rektoskopu umožňuje operovat i v perirektálním prostoru. Své uplatnění tedy nalézá i při provádění totální mezorektální excize transanálním přístupem (TransAnal Endoscopic Proctectomy – TAEP). Tubus operačního rektoskopu může být použit k extrakci preparátu jako přirozený otvor při laparoskopických resekcích rekta použitím operační techniky NOTES. Limitující faktory použití operačního rektoskopu jsou z technického hlediska vzdálenost od anokutánní linie, průměr rekta umožňující zavést tubus o průměru 4 cm a anatomické poměry v malé pávi. V současné době celosvětově uznávaným limitujícím faktorem pro onkologickou radikalitu lokální excize metodou transanální endoskopické mikrochirurgie (TEM) je infiltrace lamina muscularis propria. Pokud zhoubný nádor infiltruje tuto vrstvu, není lokální excize považována za onkologicky radikální, i když je vedena ve zdravé tkáni. Závěr: Potenciál operačního rektoskopu spočívá především v možnosti transanálních lokálních excizí různého rozsahu v oblasti cca 20 cm aborálního rekta a anu. Vzhledem k narůstající incidenci především časných stadií CRC v souvislosti se systematickým screeningem je možné předpokládat větší počty zákroků touto operační technikou. Některá pracoviště publikují výsledky vyhodnocení souboru pacientů operovaných metodou TEM po absolvované předoperační chemoradioterapii u pokročilejších stadií zhoubného nádoru rekta. Jedná se o ojedinělé publikace s malým počtem pacientů, výsledky však ukazují, že u vybraných pacientů by tato kombinovaná léčba mohla být přínosná. Přínos operačního rektoskopu se jeví i u pacientů s kompletní klinickou odpovědí na neadjuvantní léčbu zhoubného nádoru konečníku původně plánovaných k radikálnímu resekčnímu výkonu. Alternativou k tomuto radikálnímu operačnímu výkonu může být lokální transmurální resekce rekta v místě nádoru a sledování v případě histologicky prokázané kompletní remise. Technické zdokonalení instrumentária může umožnit rychlejší erudici v této náročné operační technice.
Práce byla podpořena grantovým projektem MZ ČR – RVO (MOÚ, 00209805).
XVI/ 357. Praktické aspekty léčby časných stadií z pohledu onkologa a gastroenterologa
Kiss I.1, Hep A.2
1 Klinika komplexní onkologické péče, MOÚ, Brno, 2 Interní gastroenterologická klinika LF MU a FN Brno
Kolorektální karcinom (KRK) stejně jako většina nádorů zažívacího traktu je typickým příkladem mezioborové spolupráce. V úvodu diagnostiky je spolupráce praktického lékaře a gastroenterologa jak pro asymptomatické klienty v rámci screeningového programu KRK, tak i pro symptomatické pacienty v rámci vyšetření jejich potíží. Účast klientů ve screeningovém programu postupně v jednotlivých letech narůstala, až dle posledních informací za rok 2012 dosáhla již 25 % z cílové populace klientů. Dvě třetiny onemocnění KRK diagnostikovaných ve screeningovém programu je v časných stadiích (stadium 0–2), kde se jako léčebná intervence uplatňuje endoskopická či chirurgická léčba, s výbornými dlouhodobými výsledky přežití. Neinvazivní karcinomy jsou omezeny pouze na sliznici (karcinoma in situ nebo karcinom intramukózní). Pacienti s diagnostikovaným neinvazivním karcinomem pTis mají jako alternativu léčby endoskopickou excizi, jednoduchou polypektomii či chirurgickou resekci. Následně je takový pacient dispenzarizován na gastroenterologickém pracovišti, které výkon provedlo. Pokud na základě rizika byla indikována resekce, většinou se takový pacient dostane na onkologické pracoviště. Karcinom rostoucí infiltrativně přes lamina muscularis mucosae do submukózy se označuje jako karcinom invazivní. Tento invazivní karcinom může metastazovat, a proto by měl nejlépe předoperačně pacient absolvovat stagingová vyšetření k vyloučení lokálně pokročilého nebo metastatického stadia onemocnění, což by mohlo vést ke změně algoritmu léčby a léčebné strategie. V klinické praxi se setkáváme s několika problémy: Pacient věkově starší, např. 75 let, s četnými komorbiditami, chce screeningové vyšetření KRK. Nicméně jeho aktuální zdravotní stav a komorbidity ani v případě pozitivního vyšetření TOKS a následného potvrzení na kolposkopickém vyšetření radikální chirurgické vyšetření pro nepřiměřené riziko neumožňuje. Pacienti sledovaní pro jiné nádorové onemocnění na onkologii vypadávají z hledáčku praktických lékařů k ustanoveným screeningovým programům, např. pacientka sledovaná pro karcinom prsu není odeslána ke screeningu KRK praktickým lékařem – „jste sledovaná na onkologii“. Je nutný aktivní přístup ošetřujícího onkologa s cílenými dotazy v rámci anamnézy na absolvování screeningových vyšetření mimo indikaci onemocnění, pro které je již sledovaný. Co pacienti v léčbě pro onkologické onemocnění? Jistě záleží na prognóze onemocnění a očekávané délce přežití po ukončení léčby jedné malignity.
XVI/ 55. Pět let zkušeností s metodou TEM v MOÚ
Ondrák M.1,2, Fiala L.1
1 Oddělení chirurgické onkologie, MOÚ, Brno, 2 Gastroenterologické oddělení, MOÚ, Brno
Východiska: Operační rektoskop je přístroj transanální endoskopické mikrochirurgie (TEM), operační techniky umožňující chirurgickou léčbu prekanceróz a časných stadií zhoubného nádoru konečníku. Materiál a metody: Retrospektivně jsme vyhodnotili soubor průběžně zaznamenávaných dat pacientů operovaných metodou TEM a následně dispenzarizovaných minimálně 12 měsíců. Výsledky: V MOÚ jsme za posledních 5 let odoperovali celkem 169 pacientů s průměrným věkem 64 let. Operační rektoskop byl využit k léčbě především polyploidních tumorů s různým stupněm dysplazie a časných stadií zhoubného nádoru konečníku. Jako rozhodující indikační kritérium je hloubka invaze do stěny rekta předoperačně diagnostikovaná transrektálním ultrazvukem. V 9 případech jsme museli přistoupit k radikalizaci operačního výkonu buď pro nedostatečný rozsah resekce, nebo ve většině případů pro pokročilejší postižení stěny rekta. Co se týče lokalizace patologických útvarů, žádná z lokalizací na cirkumferenci rekta výrazně nepřevažovala. Od anodermální linie byla uložena průměrně v 80 mm a velikost resekované plochy se pohybovala v průměru kolem 9 cm2. Operační výkon v průměru nepřesáhl 60 minut a délka hospitalizace 8 dnů. Z peroperačních komplikací jsme se nejčastěji potýkali s krvácením v 8 případech, vždy byla krevní ztráta do 50 ml a byla ošetřena bez nutnosti konverze. V bezprostředním pooperačním období jsme zaznamenali u 6 pacientů přetrvávající bolesti vyžadující vyšší než běžné dávky analgetik, v 9 případech krvácení z resekční linie vždy bez nutnosti reoperace a 7 pacientů udávalo inkontinenci větrů a stolice. Z dlouhodobého hlediska si 4 pacienti stěžovali na přetrvávající inkontinenci plynů. Pro recidivu onemocnění jsme operovali celkem 14 pacientů, a to jak lokální excizí metodou TEM, tak metodami radikálními, jako jsou LAR nebo APR. Závěr: Pacienti operovaní metodou TEM byli zatížení kratší dobou operačního výkonu v průměru do 60 minut a kratší dobou hospitalizace v průměru 7 dní s prakticky okamžitým obnovením funkcí gastrointestinálního traktu. Peroperační komplikace jsme zaznamenali v 7,2 % případů, do 30 dnů po operaci jsme pozorovali komplikace v 12,6 % případů a z dlouhodobého hlediska evidujeme pouze 4,2 % komplikací. Pro lokální recidivu jsme operovali 8,97 % pacientů. Pravděpodobnost, že pacient v daný okamžik nemá lokální recidivu onemocnění, sice s časem klesá, v 40 měsících od primární operace se ale stále pohybuje kolem 85 %.
Práce byla podpořena grantovým projektem MZ ČR – RVO (MOÚ, 00209805).
XVI/ 56. Transanální totální mezorektální excize – rok poté
Grolich T.1, Kala Z.1, Procházka V.1, Kyclová J.2, Frola L.2, Marek F.1, Hemmelová B.1
1 Chirurgická klinika LF MU a FN Brno, 2 Ústav patologie, LF MU a FN Brno
Východiska: Transanální mezorektální excize často spojená s intersfinkterickou disekcí představuje novou alternativu amputace rekta pro karcinom u velmi nízkých tumorů rekta, event. alternativu ultranízké resekce v případě špatných anatomických poměrů v malé pánvi. Důvodem jejího zavádění je snaha o sfinkter záchovné operace při zajištění onkochirurgické bezpečnosti výkonu lepší vizualizací v operačním poli distálního mezorekta v oblasti pánevního dna. Autoři prezentují na vlastním souboru roční zkušenosti s touto metodou z hlediska komplikací, histologicky hodnocené kvality mezorektální excize a dostupných informací o funkčním výsledku. Soubor pacientů a metody: K transanální mezorektální excizi byly indikováni pacienti s nízce uloženými tumory po i bez neoadjuvatní léčby bez anamnézy poruchy kontinence. Výška tumoru byla stanovena rektoskopicky vzhledem k ano-kutánnímu přechodu. Výsledky: Na Chirurgické klinice FN Brno bylo od září 2013 do února 2015 operováno 20 pacientů metodou transanální mezorektální excize. Demografická data pacientů a perioperační výsledky viz tab. 1 a 2. Operace byla zahájena u 18 pacientů transanálně. Břišní fáze byla provedena laparoskopicky v 17 případech, dvakrát byla indikována konverze pro suspekci na prorůstání tumoru ventrálně a deserozaci tenké kličky. U všech pacientů byla kompletně mobilizována lienální flexura s vysokým podvazem AMI a VMI. Kvalita mezorektální excize byla hodnocena jako u kompletní, téměř kompletní a nekompletní u 5 %, 58 %, resp. 37 %. Cirkumferentní okraj byl negativní v 95 % případů. Distální resekční okraj měřený patologem byl pod 2 mm u 1 pacienta, nádorové buňky v distální resekční linii nebyly pozorovány. Medián zisku uzlin byl 17 (rozpětí 3–36). Funkční výsledek byl hodnocen Wexnerovým dotazníkem. U 10 pacientů po destomizaci 3, 6 a 12 měsíců byl medián 20, 15, resp. 15. Plně spokojeno s výsledkem operace bylo šest pacientů, čtyři pozorovali zlepšení funkce. Žádný pacient by při stejné operaci nepreferoval trvalou stomii. Závěr: Dle naší roční zkušenosti nabízí transanální mezorektální excize pacientům s velmi nízce uloženými tumory rekta, kteří preferují sfinkter záchovný výkon, vhodnou alternativu amputace rekta. Perioperační výsledky odpovídají výsledkům resekcí dolního rekta. Funkční výsledky v ročním odstupu vykazují tendenci ke zlepšení od pooperačního stavu a jsou většinou pacientů vnímány pozitivně. Všichni naši pacienti by po ročním odstupu opět preferovali tento typ výkonu.
Práce byla podpořena grantovým projektem IGA MZ ČR č. NT13726-4/ 2012.
Tab. 1. Charakteristika souboru pacientů indikovaných k TAMIS – TME. 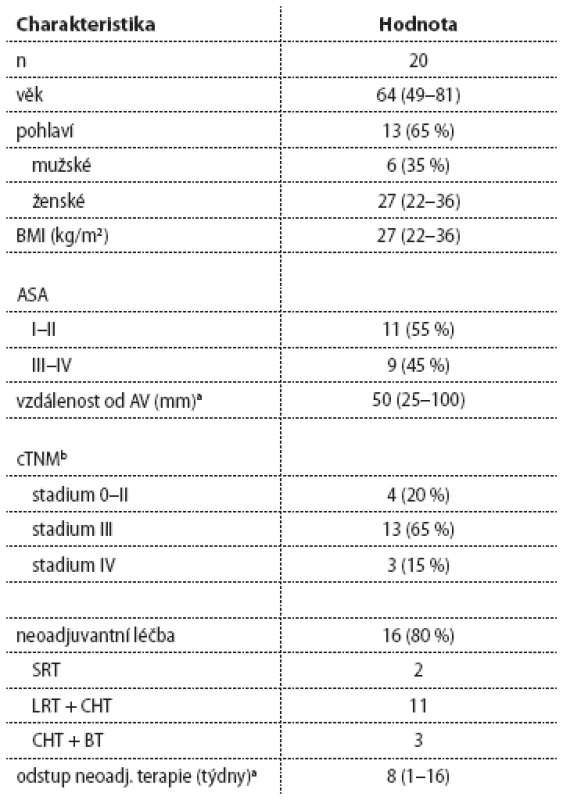
n – celkový počet pacientů, BMI – body mass index, ASA – American Society of Anesthesiologists risk skóre a hodnoty uvedeny jako medián (rozsah), b stadium dle UICC 7.verze Tab. 2. Perioperační charakteristika a časné pooperační výsledky pacientů po TAMIS – TME (n = 20). 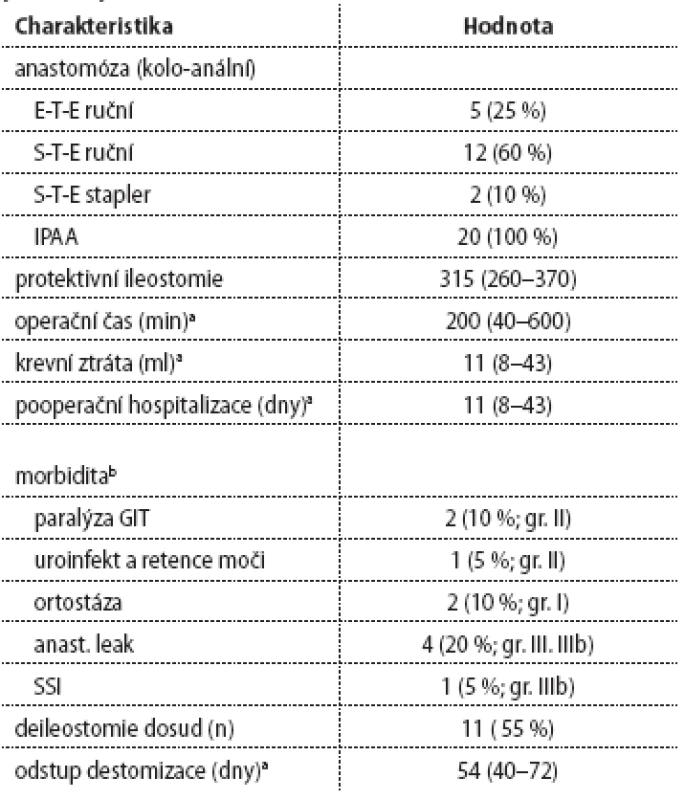
n – počet a hodnoty uvedeny jako medián (rozsah), b klasifikace komlikací dle Dindo-Claviena XVI/ 57. Chirurgické aspekty resekce rekta u pacientů po neoadjuvatní chemoradioterapii
Sirotek L.1, Šefr R.2, Eber Z.1, Ondrák M.1,2
1 Oddělení chirurgické onkologie, MOÚ, Brno, 2 Gastroenterologické oddělení, MOÚ, Brno
Východiska: Kolorektální karcinom je vzhledem ke své vysoké incidenci stále v centru pozornosti chirurgů zabývajících se onkologickou problematikou. Péče o pacienty s karcinomem rekta je pak obvykle soustřeďována do komplexních onkologických center, a to vzhledem k nutnosti úzké mezioborové spolupráce při léčbě těchto pacientů. To platí zejména pro lokálně pokročilé nádory, u kterých je indikována kombinovaná neoadjuvantní onkologická léčba. Ta přináší zvýšení lokální kontroly onemocnění, zlepšení operability a rovněž zvýšení četnosti kontinenci zachovávajících výkonů. V otázkách vlivu neoadjuvance na samotný operační výkon a volbu nezbytných chirurgických postupů při resekčním výkonu stále chybějí jednoznačná doporučení. Soubor a metody: V našem souboru hodnotíme retrospektivně 220 pacientů s lokálně pokročilým karcinomem rekta, kteří byli v letech 2006–2014 léčeni v MOÚ neoadjuvantní chemoradioterapií a následně podstoupili kontinenci zachovávající resekční výkon. Zaměřujeme se zejména na závažné pooperační komplikace, nutnost konstrukce protektivní ileostomie, rozsah lymfadenektomie, typ konstruované anastomózy, kompletnost resekčních okrajů a četnost lokálních recidiv. Dosažené výsledky jsou konfrontovány s recentně publikovanými daty. Výsledky: V našem souboru jsme při hodnocení závažných chirurgických komplikací nezaznamenali statisticky významný rozdíl ve srovnání se skupinou našich pacientů, kteří nepodstoupili neoadjuvantní léčbu. Ke klinicky významné dehiscenci anastomózy došlo v 6,3 % případů. U 90 % sledovaných pacientů bylo sekvencí neoadjuvantní chemoradioterapie, chirurgický výkon a adjuvantní chemoterapie dosaženo remise onemocnění. Lokální recidivu jsme zaznamenali v 1,8 % případů. Závěr: Prezentovaná data v souladu s dostupnými publikacemi potvrzují absenci vlivu neoadjuvantní léčby na četnost závažných chirurgických komplikací při kontinentních resekčních výkonech na rektu. Institucionární standardizace chirurgických postupů v součinnosti s individualizovanou onkologickou léčbou minimalizuje chirurgické komplikace a přináší dobré dlouhodobé výsledky. Tvorba chirurgických guidelines pro pacienty s pokročilým karcinomem rekta bude vyžadovat provedení dalších randomizovaných prospektivních studií.
Práce byla podpořena grantovým projektem MZ ČR – RVO (MOÚ, 00209805).
XVI/ 58. Diagnostika a léčba pacienta s CRC, standardní a nestandardní postupy – kazuistiky
Diviš P.1, Divišová K.2, Zajíc J.3, Vokurka J.1
1 SurGal Clinic, Brno, 2 Ambulance klinické onkologie a stacionář, Kroměřížská nemocnice, 3 Radioterapie Holešov
Východiska: Péče o pacienty s CRC by měla být z větší části zcela standardní. Metodika diagnostiky a léčby je důkladně rozpracovaná, síť onkologických pracovišť s návazností na KOC je poměrně široká. Důkladně propracovaná je i metodika sledování pacientů léčených, vyléčených a sledovaných, včetně zpracování statistických dat. Obecně je kladen velký důraz na dodržování standardních postupů včetně využití významné úlohy multioborových komisí. V rámci tohoto algoritmu je však velmi snadné dosáhnout v péči o onkologického pacienta určitého stereotypu, který v důsledku může být pro pacienta spíše kontraproduktivní. Ve dvou kazuistikách chceme především upozornit na některé chyby v diagnostice a zejména léčbě popsaných případů. V obou případech se jedná především o oddalování léčby po jasné diagnostice onemocnění. Řešení komplikované diagnózy s nejednoznačným či komplikovaným řešením je „problémem“, který vede k prodlužování intervalu mezi diagnostikou a léčbou nádorového onemocnění. V těchto případech poté algoritmus léčby onemocnění selhává. Popis případů: 1) Žena 69 let. Rektoragie – kolonoskopie, polypózní infiltrace v 8 cm, mukozektomie, histologicky adenokarcinom, R1 resekce TEM – snesení oblasti polypu, adenokarcinom T2, resekce R1. Ambulantní kontrola celkem 3krát v průběhu 1,5 měsíce, při poslední kontrole doporučení operačního řešení (resekce + TME), další kontrola za 3 měsíce. Operační řešení měsíc po poslední kontrole – resekce rekta s TME, histologicky perirektálně dvě ložiska adenokarcinomu (uzliny), uzliny 2+/ 20. Adjuvantní CHRT. 2) Muž 54 let. Rektoragie, rektoskopie, kolonoskopie – polyp ve 4 cm, snesen, histologicky středně diferencovaný adenokarcinom s výraznou hlenotvorbou, nádor dosahuje okrajů vyšetřovaných řezů. Sigmoideoskopie – nález jizvy s pseudopolyp. změnami v okolí, odběr histologie 10 vzorků, výsledek – lehčí forma chronické neaktivní kolitidy, žádné známky nádorového bujení. Doporučeno sledování, kontrola za půl roku; TRUS – ve vzdálenosti 6–9 cm, ohraničení ztluštění stěny do 11,4 mm, invazi mimo stěnu neprokazuje, jedna uzlina 12,9 mm. Amputace rekta – Miles, histol. adenokarcinom rekta, pT1 pN2b (12+/ 22) M0, st. IIIb, R0 resekce CHRT. Závěr: Oba popsané případy ukazují na nutnost mezioborové spolupráce v léčbě pacienta s onkologickým onemocněním. Je nutné hodnocení nálezu komplexně, ne pouze z hlediska jednotlivých odborností. Proto je nutné hodnocení nálezů nejlépe multioborovou komisí, důležitý je též výstup takové komise, který musí být jednoznačný, i když není vždy jednoznačný léčebný postup.
XVI/ 358. Víceorgánové postižení metastázami nejen u kolorektálního karcinomu – komplexní přístup k léčbě – pohled onkologa
Tomášek J.
Klinika komplexní onkologické péče, MOÚ, Brno
Pro pacienta s metastatickým kolorektálním karcinomem je jedinou potenciálně kurativní léčbou chirurgické odstranění primárního nádoru a metastáz. Nejčastěji jsou takto resekovány metastázy jaterní. Moderní protinádorová léčba vede u velké části pacientů k regresi metastáz a dosažení technické resekability onemocnění. Pokrok v chirurgické léčbě je rychlý, stejně tak existuje pokrok a větší dostupnost ablačních a embolizačních technik. U významného počtu pacientů je technicky možné tímto multimodálním přístupem dosáhnout zničení všech makroskopicky patrných ložisek. Nemáme mnoho dat, která by stanovila všeobecně akceptovanou hranici počtu metastáz a hodnotu jiných parametrů, kdy ještě má pacient prospěch z intenzivní multimodální léčby a kdy jej tento postup spíše poškozuje a agresivní léčba ukrajuje ze zbývajícího času života v dobré kvalitě. Důležitá jsou data randomizované německé studie CELIM (Folprecht G et al, Ann Oncol 2014; 25 : 1018–1025). Do studie byli randomizováni pacienti s neresekabilními metastázami v játrech nebo pacienti s ≥ 5 metastázami v játrech. Léčeni byli kombinací FOLFOX/ cetuximab nebo FOLFIRI/ cetuximab. Resekabilita byla posuzována každé dva měsíce. Primárním cílem studie byl response rate, sekundárním cílem bylo dosažení resekability, přežití bez progrese, celkové přežití a molekulární markery a bezpečnost. Ukázalo se, že oba režimy jsou obdobně účinné. U pacientů s dosažením resekce R0 byl medián přežití 53,9 měsíce (pětileté přežití 45 %), u pacientů bez resekce 21,9 měsíce. Jako negativní prognostický faktor se ukázala vysoká hladina CEA před zahájením léčby, synchronní metastázy a počet metastáz. U pacientů s více než 10 metastázami byl medián doby přežití bez známek nemoci po resekci (DFS) 3–4 měsíce. K relapsu tedy u této skupiny pacientů dochází velmi časně a hovořit o kurativním významu zákroku nelze. Resekabilita metastáz by měla být dána jak posouzením technické proveditelnosti, tak zohledněním prognostických parametrů. Je odpovědností členů multioborového týmu, aby byly dobře zváženy všechny aspekty a volena optimální léčebná varianta. Pro pacienta s mnohočetnými metastázami (> 10) a víceorgánovým postižením to nemusí být technicky proveditelná radikální resekce/ ablace. Lepší variantou může být dobře volená systémová léčba a důraz na dobrou kvalitu života.
XVI/ 359. Resekce metastáz při vícečetném orgánovém postižení (játra, plíce) – pohled chirurga
Třeška V.
Chirurgická klinika LF UK a FN Plzeň
Východiska: Jaterní a plicní metastázy kolorektálního karcinomu se vyvinou přibližně u 20–70 %, resp. u 10–22 % nemocných s kolorektálním karcinomem. Otázka jejich optimální léčby je stále předmětem mnoha diskuzí. Cílem práce proto bylo zhodnocení výsledků chirurgické léčby v rámci multimodálního léčebného postupu. Materiál a metody: V letech 2002 až 1/ 2015 jsme řešili celkem 37 nemocných s oběma typy metastáz kolorektálního karcinomu. Průměrný věk nemocných byl 62,8 ± 10,7 let. U 26 nemocných se jednalo o metachronní a u 11 pak o synchronní metastázy. U metachronních metastáz předcházely jaterní metastázy ve 20 případech plicním a plicní metastázy pak byly diagnostikovány před jaterními u 6 nemocných. U 7 nemocných se oba typy metastáz vyskytly současně. Jaterní resekci jsme provedli u 29, radiofrekvenční ablaci (RFA) u 8 nemocných. U 17 nemocných byla provedena laserová metastasektomie, u 19 pak plicní resekce a u 1 nemocného RFA ložisek. U 31 nemocných jaterní výkon předcházel výkonu plicnímu. 81,1 % nemocných mělo následnou adjuvantní onkologickou léčbu. Výsledky: Do 30 dní po operaci zemřel 1 nemocný (2,7 %) na aktinomykotickou sepsi komplikovanou infekcí meticilin rezistentním stafylokokem. Morbidita souboru činila 11 %. K recidivě metastáz v játrech došlo u 10 nemocných, u 6 pacientů byla provedena RFA, 4 nemocní jsou dále léčeni onkologicky. Medián celkového a bezpříznakového přežívání nemocných po primární operaci metastáz byl 7,1, resp. 1,6 roku. Závěr: Chirurgická léčba je jedinou alternativou v rámci multimodální léčby nemocných s jaterními a plicními metastázami kolorektálního původu, která nabízí nemocným dobré dlouhodobé výsledky.
XVI/ 178. Adjuvantní léčba pacientů s nádory střev
Tomášek J.
Klinika komplexní onkologické péče, MOÚ, Brno
Chirurgické odstranění nádoru je jediná kurativní léčba pacientů s kolorektálním karcinomem v časném klinickém stadiu (stadium I–III). Jde o pacienty, u kterých nebyly podrobným vyšetřením (staging) prokázány vzdálené metastázy. U části těchto nemocných se ale nemoc vrací ve formě vzdálených metastáz nebo lokální recidivy nádoru. Důvodem je přítomnost mikrometastáz mimo resekovanou oblast, které jsou svou velikostí pod detekční schopností obvyklých stagingových metod. Adjuvantní (doplňková, zajišťující) léčba je zaměřena na zničení těchto drobných ložisek nádoru a cílem je snížit riziko recidivy onemocnění. Ve II. klinickém stadiu vede samotná resekce primárního nádoru k vyléčení přibližně 80 % pacientů, ve III. klinickém stadiu to je jen 60 %. Ve velkých klinických studiích III. fáze bylo dokázáno, že největší prospěch z adjuvantní léčby mají pacienti III. klinického stadia, kam patří pacienti s metastázami v regionálních uzlinách a pacienti II. klinického stadia, jejichž nádor má určité rizikové znaky. V adjuvantní indikaci byl řadu let běžně podáván bolusový režim s 5-fluorouracilem (5-FU) a leukovorinem v tzv. Mayo režimu, kdy je chemoterapie podávána pět dnů po sobě s opakováním každé čtyři týdny. V posledních letech je preferováno dvoudenní kontinuální podání 5-FU v režimu podle de Gramonta s opakováním každé dva týdny. Oxaliplatina přidaná do kombinace ke kontinuálně aplikovanému 5-FU (režim FOLFOX) prodlužuje ve III. klinickém stadiu jak přežití bez známek nemoci (DFS), tak celkové přežití (OS). Zvyšuje ale také toxicitu léčby. 5-FU lze nahradit perorálním kapecitabinem v monoterapii nebo v kombinaci s oxaliplatinou (režim XELOX). Podání chemoterapie je spojeno s možnými nežádoucími účinky léčby, které mohou ve vzácnějších případech výrazně alterovat celkový stav pacienta. U pacientů s více komorbiditami a vysokého věku může riziko provázející adjuvanci převážit nad možným prospěchem a potom není adjuvance vhodná. S každým pacientem je nutné probrat prospěch a rizika navrhované léčby. Cílená (biologická) léčba v současné době nemá v adjuvantní indikaci žádné místo, její přidání k obvyklé chemoterapii výsledky léčby nezlepšuje. Radioterapie zaměřená na oblast pánve se uplatňuje v adjuvanci adenokarcinomů konečníku v situaci, kdy nebyla tato modalita použita před operací (v neoadjuvanci). Radioterapie jak v neoadjuvantní, tak adjuvantní indikaci je obvykle kombinována s chemoterapií – konkomitantní podání. Běžně se používá i.v. 5-FU v kombinaci s leukovorinem nebo perorální kapecitabin.
XVI/ 179. Možnosti paliativní chemoterapie a cílené léčby nádorů tlustého střeva
Bencsiková B.
Klinika komplexní onkologické péče, MOÚ, Brno
Metastatický kolorektální karcinom (mCRC) představuje heterogenní skupinu onemocnění, lišících se molekulárními, klinickými charakteristikami i prognózou. Díky novým léčebným postupům se mCRC stává chronickým onemocněním. Důležitá je diskuze o léčebné strategii u konkrétního pacienta v rámci multioborového týmu. Je třeba dodržovat obecné principy terapie, důležité je stanovení léčebného záměru, zvažují se klinické faktory, potenciální nežádoucí účinky, stav pacienta a jeho preference. Předpokladem pro výběr správné cílené terapie pro konkrétního pacienta je stanovení prediktivních biomarkerů. V praxi se jedná o testování RAS statusu a stavu genu BRAF. Nové doporučené postupy České onkologické společnosti v souladu s ESMO guidelines pro léčbu mCRC z roku 2014 rozdělují pacienty do čtyř skupin. Skupina 0: Skupina nemocných, jejichž metastázy jsou jasně resekabilní. Léčbou první volby je resekce, doplněná o perioperační chemoterapii. Skupina 1: Radikální resekce metastáz je možná jen v případě zmenšení nádoru neadjuvantní terapií a pacient je dostatečně fit pro kombinační systémovou a chirurgickou léčbu. Snahou je podat nejúčinnější neadjuvantní chemoterapii, režimy FOLFOX/ FOLFIRI, v kombinaci s léčbou antiEGFR (cetuximab nebo panitumumab) u wtRAS nádorů, nebo v kombinaci s anti-VEGF u nádorů s prokázanou mutací onkogenů RAS. Skupina 2: Pacienti s rychle progredujícími mnohočetnými metastázami nebo symptomatickým onemocněním, kteří jsou dostatečně fit pro kombinační systémovou terapii. V běžné praxi je toto onemocnění nejčastější. Léčba je s paliativním záměrem, zohledňující především kvalitu života. Volí se dublety chemoterapie v kombinaci s léčbou cílenou dle stavu RAS a přítomnosti symptomů onemocnění (antiEGFR léčba u wtRAS mCRC). Skupina 3: Pacienti s generalizovaným onemocněním, bez možnosti resekce, iniciálně bez příznaků a/ nebo bez velkého rozsahu nádorového postižení nebo s potenciálně nízkou tolerabilitou léčby. Cílem léčby je oddálení progrese, doporučuje se méně intenzivní chemoterapie. Léčebná sekvence zahrnuje podání fluoropyrimidinu, irinotecanu, oxaliplatiny, nejčastěji ve formě chemodubletů nebo i v monoterapii. Možnosti cílené léčby zahrnují podání antiVEGF léčby (bevacizumab, aflibercept), antiEGFR léčby (cetuximab, panitumumab) a nově regorafenib. Závěr: Volba léčebné strategie u každého jednotlivého pacienta je vždy výsledkem komplexního zhodnocení v rámci multidisciplinárního týmu, respektuje aktuální doporučení léčebných postupů, tak i přání pacienta. Cílem paliativní léčby mCRC je prodloužit přežití a zachovat kvalitu života.
XVI/ 180. Standardy v systémové léčbě metastatického kolorektálního karcinomu
Kiss I.
Klinika komplexní onkologické péče, MOÚ, Brno
Chemoterapie v kombinaci s biologickou léčbou je nejdůležitější modalitou u pacientů s radikálně neresekabilním onemocněním, a to jak v indikaci neadjuvantní, tak paliativní. Opakovaně byla v rámci klinických hodnocení prokázána korelace narůstajícího počtu léčebných odpovědí s prodlužujícím se mediánem přežití pacientů s metastatickým kolorektálním karcinomem. Největší efekt ve smyslu prodlouženého přežití je jednoznačně u pacientů, u kterých došlo ke zmenšení nádoru do takové míry, že to umožňovalo radikální chirurgické řešení (R0 resekci). V dnešní době jsou již k dispozici i výsledky dlouhodobého přežití těchto sekundárně resekovaných pacientů, které dosahují pětiletého přežití až ve 40 % případů, což je plně srovnatelné s výsledky pacientů s primárně operabilním onemocněním. Z poslední aktualizované analýzy souboru sekundárně resekovaných pacientů bylo dosaženo přežití 10 let u 27 % pacientů. Původně bylo operability dosaženo v 74 % případů po první linii léčby a 26 % po druhé linii léčby. Tedy kurativní potenciál je i po selhání chemoterapie první řady, nicméně výrazně klesá pravděpodobnost, že tento tížený efekt chemoterapie bude dosažen. Strategie léčby metastatického kolorektálního karcinomu by měla být v současné době postavena na rozhodnutí multidisciplinární indikační komise, kde jsou zastoupeny odbornosti chirurga, radiologa, onkologa a radioterepeuta se zaměřením na léčbu kolorektálního karcinomu. Obecnou podmínkou resekce metastáz je vyloučení všech nádorových ložisek, která nejsou přístupna resekci či případnému ošetření některou z ablačních technik. Resekce samotná či v kombinaci s ablační technikou není indikována jako výkon paliativní, ale jen s kurativním záměrem. Největší efektivitu v současné době dosahuje kombinovaná chemoterapie na bázi oxaliplatiny či irinotekanu se srovnatelným efektem (FOLFOX, FOLFIRI), vykazující až 50 % léčebných odpovědí provázených prodlouženým mediánem přežití pacientů kolem 20 měsíců a s popisovanou sekundární operabilitou primárně inoperabilního onemocnění kolem 2–4 %. Při kombinaci chemoterapie s biologickou léčbou (bevacizumab, cetuximab, panitumumab) dochází k nárůstu sekundární operability.
XVI/ 124. Účinnost a toxicita bevacizumabu v kombinaci s chemoterapií v různých liniích léčby metastatického kolorektálního karcinomu
Kiss I.1, Bortlíček Z.2, Melichar B.3, Poprach A.1, Halámková J.1, Dušek L.2, Vyzula R.1, Büchler T.4
1 Klinika komplexní onkologické péče, MOÚ, Brno, 2 Institut biostatistiky a analýz, MU, Brno, 3 Onkologická klinika LF UP a FN Olomouc, 4 Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha
Východiska: Cílem této studie bylo popsat výsledky a toxicitu léčby pro pacienty léčené bevacizumabem v kombinaci s chemoterapií na základě údajů z Českého registru cílené léčby metastatického kolorektálního karcinomu (CORECT). Data byla hodnocena retrospektivně. Celkem 6 040 pacientů s metastazujícím kolorektálním karcinomem, kteří byli léčeni bevacizumabem v první linii (n = 5 303; 87,8 %), ve druhé linii (n = 579; 9,6 %) nebo ve třetí a vyšší linii (n = 158; 2,6 %) léčby. Výsledky: Medián přežití bez progrese (PFS) byl 11,3 měsíce (95% CI 11,0–11,7 měsíce), 9,5 měsíce (95% CI 8,2–10,9 měsíce) a 7,3 měsíce (95% CI 5,9–8,7 měsíce, p < 0,001) a medián celkového přežití od počátku léčby bevacizumabem byl 27 měsíce (95% CI 26,1–27,9 měsíce), 21,8 měsíce (95% CI 18,9–24,6 měsíce) a 14,5 měsíce (95% CI 11–18,1 měsíce; p < 0,001). Medián přežití pacientů od data stanovení metastatického onemocnění v první linii 28,3 měsíce (95% CI = 27,2–29,4 měsíce), ve druhé linii 31,8 měsíce (95% CI 28,7–34,9 měsíce) a ve třetí linii 36,3 měsíce (95% CI 29,5–43,0 měsíce) dokumentuje selekci pacientů, u kterých byl bevacizumab ve druhé a vyšších liniích aplikován. Přežití 5 let od stanovení metastatického onemocnění bylo 21,6 % : 25,1 % : 29,9 %. Jak vyplývá z hodnocení léčebné odpovědi, nejvyšší účinnost kombinované chemoterapie s bevacizumabem byla v první linii léčby, tj. kompletní remise 12,8 % : 6,9 % a 0,7 %; parciální remise 29,1 % : 22,1 % : 7,9 %; stabilizace onemocnění 39,4 % : 40,5 % : 48,2 %. Do registru jsou hlášeny pouze nežádoucí účinky spojené s aplikací bevacizumabu. Jejich výskyt byl celkově 11,6 %, 8,8 % a 8,1 % pro první, druhou a třetí/ vyšší linii léčby. Významné (tj. stupeň 3–5) nežádoucí účinky byly hlášeny vzácně (6,1 %, 2,6 % a 4,5 %). Jak se dalo očekávat, nejčastěji se jednalo bez ohledu na složení chemoterapie o hypertenzi. Tromboembolická nemoc byla hlášena u 2,9 %, 1,3 % a 1,8 % pacientů a proteinurie byla hlášena u 1,6 %, 1,8 % a 0,9 % pacientů pro různé léčebné linie. Závěr: Výsledky dokumentují účinnost bevacizumabu v kombinaci s chemoterapií ve všech liniích léčby metastatického kolorektálního karcinomu. Nejvyšší účinnost je v první a druhé linii léčby, což souvisí s účinností chemoterapie v časnějších fázích léčby. Důležité je i zjištění, že s narůstajícím počtem linií léčby zůstává stejný profil nežádoucích účinků i jejich stupeň závažnosti.
XVI/ 125. Bevacizumab v první linii terapie metastatického kolorektálního karcinomu s režimy FOLFOX nebo XELOX
Büchler T.1, Pavlík T.2, Melichar B.3, Bortlíček Z.2, Ušiaková Z.4, Dušek L.2, Kiss I.5, Kohoutek M.6, Benešová V.7, Vyzula R.5, Abrahámová J.1, Obermannová R.5
1 Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha, 2 Institut biostatistiky a analýz, MU, Brno, 3 Onkologická klinika LF UP a FN Olomouc, 4 Onkologická klinika 1. LF UK a VFN v Praze, 5 Klinika komplexní onkologické péče, MOÚ, Brno, 6 Komplexní onkologické centrum, Krajská nemocnice T. Bati, Zlín, 7 Onkologické oddělení, Nemocnice Jihlava
Východiska: Cílem naší retrospektivní studie založené na analýze dat z registru CORECT bylo zhodnotit možné rozdíly ve výsledcích léčby pacientů léčených bevacizumabem v kombinaci s chemoterapií XELOX nebo FOLFOX v první linii. Soubor pacientů a metody: Celkem 2 191 pacientů s metastazujícím kolorektálním karcinomem dostalo v první linii léčby bevacizumab v kombinaci režimem FOLFOX (n = 1 218, 55,6 %) nebo XELOX (n = 973, 44,4 %) a mělo hodnotitelné údaje. Průměrná doba sledování byla 15,9 měsíce (rozmezí 0,1–74,0 měsíce), k datu analýzy zůstávalo na léčbě první linie 300 pacientů z uvedeného souboru. Výsledky: Medián PFS byl 11,4 měsíce (95% CI 10,7–12,1 měsíce) u pacientů léčených kombinací bevacizumab/ FOLFOX a 11,5 měsíce (95% CI 10,8–12,3 měsíce) u pacientů léčených režimem bevacizumab/ XELOX (p = 0,337). Medián OS byl 27,0 měsíce (95% CI 24,6–29,5 měsíce) v rameni bevacizumab/ FOLFOX a 30,6 měsíce (95% CI 27,8–33,4 měsíce) u pacientů léčených bevacizumabem a chemoterapií XELOX (p = 0,281). Počet metastatických lokalit byl identifikován jako nejvýznamnější prediktor PFS a také OS. Nejčastějším nežádoucím účinkem bez ohledu na režim chemoterapie byla hypertenze. Byly hlášeny tři případy gastrointestinální perforace, všechny v kohortě FOLFOX/ bevacizumab. Závěr: Data z velké analýzy dat českého registru CORECT ukazují, že režimy XELOX a FOLFOX v kombinaci s bevacizumabem jsou ekvivalentní v první linii léčby mCRC. Počet metastatických lokalizací byl nejvýznamnějším prediktorem PFS a spolu s přítomností metastatického onemocnění v době stanovení diagnózy i OS.
XVI/ 126. Analýza klinických dat pacientů s mCRC léčených bevacizumabem (B) a chemoterapií (CT) v první linii ve vztahu ke KRAS
Bencsiková B.1, Bortlíček Z.2, Halámková J.1, Ostřížková L.3, Kiss I.1, Melichar B.4, Dušek L.2, Valík D.5, Vyzula R.1, Zdražilová Dubská L.5
1 Klinika komplexní onkologické péče, MOÚ, Brno, 2 Institut biostatistiky a analýz, MU, Brno, 3 Interní hematologická a onkologická klinika LF MU a FN Brno, 4 Onkologická klinika LF UP a FN Olomouc, 5 RECAMO, MOÚ, Brno
Východiska: Úloha genu KRAS v léčbě bevacizumabem a chemoterapií není dosud dobře známa. Aktivující mutace genu KRAS v buňkách karcinomu může indukovat angiogenezi prostřednictvím několika mechanizmů, zajímavá je interakce signalizace Ras a procesu angiogeneze nádorů. Lze říct, že potřeba biomarkerů roste s počtem nových léků v klinické praxi. Cíl: Cílem studie bylo posoudit klinický výsledek a rizikové faktory ovlivňující výsledky léčby v závislosti na stavu genu KRAS. Analýza byla provedena za použití dat 1 622 pacientů s mCRC léčených B + CT na bázi oxaliplatiny či irinotekanu. Zpracování dat z registru CORECT proběhlo se souhlasem všech spolupracujících center. Mutace KRAS byla přítomna u 40,6 % pacientů. Medián PFS u pacientů s wtKRAS byl 11,5 měsíce oproti 11,4 měsíce u pacientů s mut KRAS. Nebyl signifikantní rozdíl v mediánu OS v uvedených skupinách pacientů. Kombinace chemoterapie na bázi oxaliplatiny a bevacizumabu vedla k hraničnímu zvýšení OS, dále byl zajímavý poznatek, že pacienti s mutací KRAS měli plicní metastázy častěji než jedinci s wtKRAS (32,0 vs. 23,8 %, p = 0,001). Závěr: U pacientů s mCRC nebyl klinický přínos první linie léčby bevacizumabem a chemoterapií ovlivněn mutací genu KRAS. Diskuzi výsledků se zaměřením na specifické aspekty nádorové heterogenity mCRC uvádíme v prezentaci.
XVI/ 315. EGFRi po EGFRi, léčebná možnost? Klinická kazuistika
Matějka V.1, Fiala O.1, Kališová K.1, Tupý R.2, Holubec L.1, Fínek J.1
1 Onkologická a radioterapeutická klinika LF UK a FN Plzeň, 2 Klinika zobrazovacích metod LF UK a FN Plzeň
Východiska: Inhibitory receptoru pro epidermální růstový faktor (EGFRi) mají v léčbě metastatického kolorektálního karcinomu svou nezastupitelnou roli. I když jejich přidání do léčebných schémat vedlo k prodloužení času do progrese (PFS) i celkového přežití (OS), dříve nebo později dojde k selhání jejich efektu. Mechanizmus rezistence na léčbu EGFRi není dosud plně znám, i když bylo popsáno již několik možných způsobů. Např. de novo mutace EGFR S492R, de novo mutace genu RAS či matematickým modelem prokázaná přítomnost KRAS mutovaných buněk v nádoru od začátku léčby. Přes omezené znalosti přesných molekulárních mechanizmů může docházet k situacím, kdy je léčba EGFRi indikována u pacienta, který ji již dříve podstoupil. Takových případů je však zatím tak málo, že mohou být prezentovány pouze formou kazuistických sdělení. Popis případu: V našem sdělení prezentujeme případ 68letého pacienta, který v říjnu 2012 podstoupil subtotální kolektomii, splenektomii a resekci kaudy pankreatu pro středně diferencovaný adenokarcinom sestupného tračníku, prorůstající do mezokolon, KRAS nemutovaný, BRAF nemutovaný. Byly postiženy tři lymfatické uzliny z 19 odstraněných a v době operace nebyly známy známky vzdálené generalizace. Ta se však potvrdila zobrazovacím vyšetřením již v listopadu téhož roku. U pacienta byla pro mnohočetné postižení jater a lymfatických uzlin retroperitonea a mezenteria indikována paliativní chemoterapie FOLFOX 4 + biologická léčba panitumumabem. Pacient podstoupil celkem 13 cyklů této léčby a na kontrolním CT byla zjištěna parciální regrese v retroperitoneu a mezenteriu a kompletní remise postižení jater. Pacient byl dále pouze dispenzarizován. Na kontrolním vyšetření v dubnu 2014, tj. rok po ukončení léčby, však byla zachycena progrese sekundárního postižení na játrech. U pacienta byla indikována paliativní chemoterapie FOLFIRI a pro výbornou léčebnou odpověď i léčba EGFRi. Tato léková skupina byla tentokrát zastoupena preparátem cetuximab. Pacient podstoupil celkem 11 cyklů této léčby, v jejímž průběhu byla potvrzena parciální regrese ložisek na játrech. Po 11 cyklech došlo k selhání léčby a u pacienta došlo ke změně na třetí linii léčby. Závěr: Přestože máme o léčbě EGFRi mnohé informace, jak je vidno z naší kazuistiky, i pacient předléčený těmito preparáty může z jejich dalšího nasazení profitovat. Jedná se o jednotlivé případy, ale při omezených znalostí přesných mechanizmů rezistence nádorových buněk na EGFRim je velmi důležité přistupovat k jednotlivým případům individuálně.
XVI/ 273. Bevacizumab v léčbě nemocných s metastatickým kolorektálním karcinomem (mCRC), po 7 letech v kompletní klinické remisi – klinické kazuistiky
Holubec L.1,2, Fiala O.1, Fínek J.1, Ferda J.3, Matějka V.1, Mrázková P.3, Liška V.4
1 Onkologická a radioterapeutická klinika LF UK a FN Plzeň, 2 Biomedicínské centrum, LF UK v Plzni, 3 Klinika zobrazovacích metod LF UK a FN Plzeň, 4 Chirurgická klinika LF UK a FN Plzeň
Východiska: Využití bevacizumabu u nemocných s mCRC je dnes standardem léčby tohoto nádorového onemocnění. Příznivý bezpečnostní profil této monoklonální protilátky umožňuje dlouhodobou léčbu nemocných. Nejen výsledky klinických studií (CAIRO-3, AVEX), ale také naše vlastní observační data potvrzují benefit z dlouhodobého podání bevacizumabu v kombinaci s kapecitabinem, a to především u seniorů starších 70 let. Popis případu: První klinická kazuistika popisuje dlouhodobou léčbu u 85letého nemocného, kterému byl v roce 2008 diagnostikován dle PET/ CT vyšetření vysoce metabolicky aktivní tumor colon ascendens s vícečetným, metastatickým postižením jater, plic a uzlin mediastina. Nemocnému byla provedena paliativní pravostranná hemikolektomie, nález na játrech a plicích byl inoperabilní. Nemocný již v květnu 2008 zahájil kombinovanou léčbu bevacizumabu s kapecitabinem. Během roku byla dosažena výrazná parciální remise ve všech nádorových lokalitách a po dvou letech této léčby byla dosažena kompletní radiologická remise. Nemocný byl touto kombinací léčen do února 2014 a dosud je dispenzarizován. Nemocný je dle zobrazovacích metod v únoru 2015 nadále v kompletní radiologické remisi při velmi dobré kvalitě života. Druhá klinická kazuistika popisuje léčbu 76leté nemocné, které byl v roce 2008 diagnostikován dle PET/ CT s FDG relaps adenokarcinomu tlustého střeva v oblasti malé pánve a mnohočetné metastázy v mediastinu a na plicích. Nemocná byla nejprve léčena 12 cykly CHT FOLFOX 4 + bevacizumab, následně dosud pokračuje v kombinaci bevacizumab s kapecitabinem, kdy je poslední dva roky v kompletní radiologické remisi a pro minimální nežádoucí účinky nadále pokračuje v léčbě. Závěr: Obě klinické kazuistiky potvrzují v reálné klinické praxi vysokou účinnost kombinace bevacizumabu s kapecitabinem při zachování nízké toxicity této léčebné kombinace. Tato kombinace se tak jeví jako účinná a bezpečná léčba starších nemocných s mCRC.
Podporováno projektem CZ 1.05/ 2.1.00/ 03.0076.
XVI/ 128. Kontroverzní otázky v rozhodování multioborové komise u nemocného s jaterními metastázami kolorektálního karcinomu
Petruželka L.1, Georgiev P.2, Vočka M.1
1 Onkologická klinika 1. LF UK a VFN v Praze, 2 Onkologická klinika 1. LF UK a ÚVN Praha
Neoadjuvantní systémová farmakoterapie má potenciál konvertovat iniciálně neresekabilní metastázy do resekabilního stavu. Přesná kritéria pro výběr nemocných, optimální režim farmakoterapie, trvání neoadjuvantní terapie, včetně načasování chirurgické intervence závisí na řadě faktorů jak ze strany nemocného (PS, přidružená onemocnění), tak ze strany choroby (rozsah a lokalizace metastáz, synchronní vs. metachronní postižení). Skutečná frekvence konverzí je pravděpodobně nízká. V klinické praxi musí interdisciplinární týmy řešit tři základní modelové situace: a) pacient s primárně resekabilními jaterními metastázami, b) pacient s primárně neresekabilními metastázami, u kterých lze předpokládat možnost dosažení sekundární resekability, c) pacient s metastázami, u kterého nelze předpokládat, že bude dosaženo resekability. Indukční léčba má za cíl: 1) umožnění resekability primárně neresekabilních jaterních metastáz, 2) zvýšení počtu R0 resekcí (kompletní resekce jaterních metastáz je podmínkou dlouhodobého léčebného výsledku), 3) zabránění vzniku recidiv po chirurgickém výkonu (platí pro primárně resekabilní stav a kombinaci s postresekční léčbou). Výběr a načasování optimální systémové léčby (chemoterapie a cílená biologická léčba) nebyl doposud určen. Kontroverzní je též volba optimální postresekční systémové léčby. Vzhledem k rozmanitosti klinických situací a heterogenitě nádorů lze stanovit jen obecné principy. Je všeobecně přijatým konsenzem, že léčebný postup by měl stanovit multidisplinární tým.
XVI/ 283. Role multidisciplinárního týmu v léčbě JM KRK – kazuistika
Pudil J.1, Batko S.2, Ryska M.1
1 Chirurgická klinika 2. LF UK a ÚVN Praha, 2 Onkologická klinika 2. LF UK a FN v Motole, Praha
Východiska: U více než 60 % nemocných s kolorektálním karcinomem jsou diagnostikovány jaterní metastázy (JMKRK), ať už v době stanovení diagnózy, nebo v průběhu léčby. Chirurgická léčba je jedinou potenciálně kurabilní metodou s pětiletým přežíváním dosahujícím cca 50 %. Jaterní resekci však podstoupí méně než 20 % pacientů s JMKRK. Společnou snahou onkologů a chirurgů je navýšit počet resekovaných pacientů. Autoři prezentují na kazuistice praktickou ukázku spolupráce v multidisciplinárním týmu (MDT) u pacienta s primárně neresekabilními JMKRK. Popis případu: 58letý muž bez závažných komorbidit byl odeslán praktickým lékařem ke kolonoskopii pro pozitivní test na okultní krvácení. Při kolonoskopii byl nalezen pro endoskop prostupný tumor rekta v 11 cm, histologicky verifikovaný adenokarcinom, RAS wild type. CT prokázalo generalizaci do obou jaterních laloků – dohromady 10 metastáz. Plíce byly bez známek generalizace, staging byl stanoven T3N1M1Hep. Pacient byl bez poruchy pasáže, bez anemizace, proto jsme primárně zvolili na MDT systémovou léčbu s časným restagingem. Po šesti cyklech BCHT (Folfox + anti-EGFR léčba) nám kontrolní vyšetření ukázala parciální léčebnou odpověď. Pacient byl podruhé referován na MDT, kde jsme jej indikovali k resekci jater – pravostranná hepatektomie + metastasektomie tří drobných ložisek vlevo. Nicméně při operaci jsme nalezli játra s makroskopickými známkami sinusoidální přestavby („blue liver“) a od rozsáhlého resekčního výkonu jsme pro riziko jaterního selhání ustoupili. Rozhodli jsme se pro modifikaci našeho postupu – provedli jsme pouze dvě metastasektomie a jednou RFA ložisek v levém jaterním laloku a nízkou přední resekci rekta (pacient byl o této možnosti předoperačně informován). Po doplnění portální venózní embolizace a dostatečném nárůstu levého jaterního laloku jsme po šesti týdnech provedli pravostrannou hepatektomii. Obě hospitalizace proběhly bez závažných komplikací, následovalo osm cyklů adjuvantní chemoterapie (Folfox), po kterých byl pacient bez známek recidivy základního onemocnění a byl nadále dispenzarizován. Po jednom roce kontrolní vyšetření (CT a PET) prokázala recidivu metastázy v SIV. Pacienta jsme na MDT indikovali k reresekci. Nyní pacient podstupuje opět adjuvantní chemoterapii (FOLFOX), v plánu je opět osm cyklů. Pacient bude nadále pečlivě dispenzarizován. Závěr: Léčba pacientů s JMKRK nabízí širokou variabilitu postupu. Snažíme se preferovat léčbu šitou na míru (personalizovaná léčba) se zvážením individuality jednotlivých pacientů. Trend u asymptomatických primárních tumorů je primárně systémová léčba s navazujícím resekčním výkonem na játrech (liver first aproach). Úzká spolupráce mezi chirurgy erudovanými v chirurgii jater a klinickými onkology v multidisciplinárních týmech je podmínkou navýšení resekability u primárně neresekabilních pacientů.
Práce byla podpořena grantovým projektem IGA MZ ČR NT 13 660.
XVI/ 313. Metastatický primárně neresekabilní karcinom tlustého střeva manifestovaný v graviditě u 38leté pacientky pod klinickým obrazem karcinomu ovaria
Bednaříková M.1, Minář L.2, Číhalová M.3, Pavlovský Z.3, Řehák Z.4, Weinberger V.2, Bednařík O.1
1 Interní hematologická a onkologická klinika LF MU a FN Brno, 2 Gynekologicko-porodnická klinika LF MU a FN Brno, 3 Ústav patologie, LF MU a FN Brno, 4 Oddělení nukleární medicíny, MOÚ, Brno
Východiska: Manifestace zhoubného nádorového onemocnění během těhotenství, resp. v bezprostřední návaznosti na něj, je raritní situace objevující se s četností přibližně jeden případ na 1 000 gravidit. Mezi nejčastější malignity diagnostikované u těhotných žen patří nádory prsu a gynekologické tumory (nejčastěji nádory děložního hrdla, resp. vaječníků). Incidence nádorů tlustého střeva a konečníku u gravidních žen udávaná v literatuře se pohybuje kolem 0,002 %. Popis případu: 38letá pacientka přichází dne 11. 11. 2014 na plánovanou gynekologickou prohlídku ve 12. týdnu gravidity s anamnézou měsíc trvajících nevolností, bolestí a tlaků v břiše s maximem v pravém podbřišku, které spolu s rostoucím objemem dolní poloviny břicha pokládá za příznaky svého prvního těhotenství. Ultrazvukové vyšetření odhaluje missed abortus a současně podezření na ovariální cystu, pacientka je odeslána k hospitalizaci na GPK FN Brno. Zde provedený UZ popisuje objemný silnostěnný cystický tumor vycházející z pánve, na CT vyšetření popsán ascites, metastázy jaterní a na peritoneu. Provedena revize dutiny děložní a pacientka odeslána k další péči do Onkogynekologického centra FN Brno. Zde při vyšetření dne 19. 11. odebrán vzorek na histologické vyšetření z tuhé rezistence v zadní klenbě pochvy, na vaginálním UZ patrná jednoznačně maligní rezistence vs ovariálního origa, v laboratoři elevace Ca 125. Dne 24. 11. předvedena na Onkogynekologické indikační komisi s histologickým nálezem: adenokarcinom grade II, v. s. serózní, ovariální origo možné, imunoprofil formou dodatku. Indikována systémová terapie – plánován režim bevacizumab + CBDCA/ PAC, předána do péče IHOK FN Brno. Dne 2. 12. přichází na ambulanci klinického onkologa s výsledkem PET, ještě není k dispozici imunohistochemie, proto léčba nezahájena. Definitivní histologie k dispozici dne 4. 12.: imunoprofil není typický pro ovariální origo, ale nevylučuje jej, doporučeno prověřit možnost kolorektálního origa. Doplněna kolonoskopie s nálezem polyploidní infiltrace ve 28 cm od anu, histologie uzavřena jako středně diferencovaný tubulární adenokarcinom. Dne 16. 12. 2014 diagnosticky uzavřeno jako primární tumor tlustého střeva s diseminací do ovaria, jater, peritonea a zahájena kombinovaná CHT s biologickou léčbou cílená na kolorektální karcinom. Závěr: Kazuistika vedle popisu raritní medicínské situace dokumentuje nezbytnost multidisciplinární spolupráce v rámci komplexní onkologické péče, klíčovou a nezastupitelnou roli patologa v diagnostice a v neposlední řadě nutnou uvážlivost přes náročnost okolností, které si vyžadují brzké zahájení léčby.
XVI/ 129. Prognostický vliv změny exprese receptoru pro epidermální růstový faktor u pacientů léčených neoadjuvantní chemoradioterapií pro lokálně pokročilý karcinom rekta
Richter I.1, Bartoš J.2, Sirák I.3, Čermáková E.4, Ryška A.5, Sitorová V.5, Urbanec M.6, Bluml A.7, Dvořák J.8, Petera J.3
1 Onkologické oddělení, Krajská nemocnice Liberec, 2 Oddělení radiační a klinické onkologie, Krajská nemocnice Liberec, 3 Klinika onkologie a radioterapie LF UK a FN Hradec Králové, 4 Lékařská fakulta UK v Hradci Králové, 5 Fingerlandův ústav patologie, LF UK a FN Hradec Králové, 6 Oddělení patologie, Nemocnice s poliklinikou Česká Lípa, 7 Oddělení patologie, Krajská nemocnice Liberec, 8 Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha
Východiska: Cílem předkládané práce je zhodnocení vlivu neoadjuvantní chemoradioterapie na expresi epidermálního růstového faktoru (EGFR) u pacientů s lokálně pokročilým adenokarcinomem rekta. Soubor pacientů a metody: Celkem bylo hodnoceno 103 pacientů s adenokarcinomem rekta II. a III. klinického stadia. Byla aplikovaná dávka 44–50,4 Gy zevní radioterapie, potenciace byla kapecitabinem 825 mg/ m2 ve dvou denních dávkách po celou dobu radioterapie nebo 5-fluorouracilem v dávce 200 mg/ m2 v kontinuální infuzi. Chirurgický výkon byl indikován s odstupem 4–8 týdnů od ukončení chemoradioterapie. Exprese EGFR byla stanovena imunohistochemicky v endobiopsii a v chirurgickém resekátu. Výsledky: Všech 103 pacientů podstoupilo po neoadjuvantní chemoradioterapii operační výkon. Downstaging byl popsán u 64 pacientů, z toho u šesti byla popsána kompletní patologická remise. U 49 pacientů byla popsána recidiva onemocnění. U 22 pacientů se objevila lokální recidiva, u 27 generalizace. Celkem zemřelo 51 pacientů. Zvýšení exprese EGFR během neoadjuvantní chemoradioterapie bylo pozorováno u 26 pacientů. Bylo zjištěno statisticky významně kratší celkové přežití (p < 0,001) a statisticky významně kratší přežití bez známek recidivy (p < 0,001) u pacientů se zvýšenou expresí EGFR během neoadjuvantní chemoradioterapie ve srovnání s pacienty bez zvýšení exprese EGFR. Závěr: Zvýšená exprese EGFR během neoadjuvantní chemoradioterapie u pacientů s lokálně pokročilým adenokarcinomem rekta je spojena se statisticky významně kratším celkovým přežitím i s přežitím bez známek recidivy.
XVI/ 282. Prediktivní a prognostický význam sérových nádorových markerů u pacientů s metastatickým kolorektálním karcinomem léčených bevacizumabem
Fiala O.1,2, Fínek J.1, Büchler T.3, Matějka V.1, Holubec L.1,2, Kulhánková J.1, Bortlíček Z.4, Liška V.5, Topolčan O.6
1 Onkologická a radioterapeutická klinika LF UK a FN Plzeň, 2 Biomedicínské centrum, LF UK v Plzni, 3 Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha, 4 Institut biostatistiky a analýz, LF MU, Brno, 5 Chirurgická klinika LF UK a FN Plzeň, 6 Oddělení nukleární medicíny – Laboratoř imunoanalytické diagnostiky, LF UK a FN Plzeň
Východiska: Bevacizumab je monoklonální protilátka proti vaskulárnímu endotelovému růstovému faktoru (VEGF). V současné době je standardně užíván pro léčbu pacientů s metastatickým kolorektálním karcinomem (mCRC). Sérové nádorové markery jsou běžně využívány pro diagnostiku, monitorování léčby a dispenzarizaci pacientů s CRC. Cílem této práce bylo zhodnocení prediktivního a prognostického významu těchto sérových nádorových markerů: karcinoembryonální antigen (CEA), carbohydrate antigen 19-9 (CA 19-9), tymidin kináza (TK) a tkáňový polypeptidový specifický antigen (TPS), u pacientů s mCRC léčených bevacizumabem. Soubor pacientů a metody: Do retrospektivní studie bylo zařazeno celkem 152 pacientů s mCRC léčených bevacizumabem, u kterých byla před zahájením léčby stanovena sérová hladina onkomarkerů CEA, CA 19-9, TK a TPS. Cut-off hodnoty pro jednotlivé nádorové markery vycházely ze standardního referenčního rozmezí a byly následující: CEA 3 µg/ l; CA 19-9 28 µg/ l; TK 8 U/ l a TPS 90 µg/ l. Zdrojem klinických dat pacientů byl registr CORECT. Výsledky: Mediány přežití bez známek progrese (PFS) a celkového přežití (OS) u pacientů s vysokou hladinou CEA činily 9,7 a 35,1 vs. 21,0 a 56,0 měsíce u pacientů s nízkou hladinou (p < 0,001 a p = 0,107). Mediány PFS a OS u pacientů s vysokou hladinou CA 19-9 činily 9,7 a 29,0 vs. 13,5 a 56,0 měsíce u pacientů s nízkou hladinou (p = 0,034 a p = 0,003). Mediány PFS a OS u pacientů s vysokou hladinou TK činily 9,9 a 33,8 vs. 12,9 a 45,5 měsíce u pacientů s nízkou hladinou (p = 0,735 a p = 0,179). Mediány PFS a OS u pacientů s vysokou hladinou TPS činily 10,1 a 35,1 vs. 13,5 a 42,5 měsíce u pacientů s nízkou hladinou (p = 0,797 a p = 0,563). Výsledky vícerozměrného Coxova modelu prokázaly, že PFS bylo významně ovlivněno počtem metastatických ložisek (HR = 2,00, p = 0,001) a hladinou CEA (HR = 2,80, p < 0,001); OS bylo významně ovlivněno hladinou CA 19-9 (HR = 2,25, p = 0,008). Závěr: Výsledky této retrospektivní analýzy ukazují, že předléčebná hladina CEA představuje významný a nezávislý prediktivní biomarker pro PFS a hladina CA 19-9 představuje významný a nezávislý prediktivní biomarker pro OS u pacientů s mCRC léčených bevacizumabem.
Práce byla podpořena MZ ČR – RVO (FN Plzeň – FNPl, 00669806), IGA MZ ČR 14329 a projektem ED2.1.00/ 03.0076 Evropského fondu pro regionální rozvoj.
XVI/ 127. Význam typu mutace genu KRAS pro predikci efektu léčby bevacizumabem u pacientů s metastatickým kolorektálním karcinomem
Fiala O.1,2, Büchler T.3, Melichar B.4, Mohelníková-Duchoňová B.4, Matějka V.1, Holubec L.1,2, Kulhánková J.1, Bartoušková M.4, Bortlíček Z.5, Liška V.6, Topolčan O.7, Fínek J.1
1 Onkologická a radioterapeutická klinika LF UK a FN Plzeň, 2 Biomedicínské centrum, LF UK v Plzni, 3 Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha, 4 Onkologická klinika LF UP a FN Olomouc, 5 Institut biostatistiky a analýz, LF MU, Brno, 6 Chirurgická klinika LF UK a FN Plzeň, 7 Oddělení nukleární medicíny – Laboratoř imunoanalytické diagnostiky, LF UK a FN Plzeň
Východiska: Mutace genu KRAS se vyskytují u cca 35–45 % pacientů s kolorektálním karcinomem (CRC). Představují negativní prognostický faktor a rovněž významný prediktivní biomarker, který predikuje rezistenci k léčbě anti-EGFR monoklonálními protilátkami (cetuximab, panitumumab). Souvislost mutace genu KRAS se stimulací angiogeneze byla v minulosti prokázána, nicméně význam této mutace pro predikci efektu antiangiogenní cílené léčby dosud prokázán nebyl. Cílem této práce bylo zhodnocení prediktivního významu typu mutace genu KRAS u pacientů s mCRC léčených bevacizumabem. Pacienti a metody: Do retrospektivní studie bylo zařazeno celkem 358 pacientů s mCRC léčených bevacizumabem, kteří byli vyšetřeni na přítomnost mutace KRAS. Soubor zahrnoval 135 pacientů s mutací genu KRAS a 223 pacientů s wild-type KRAS genem. Zdrojem klinických dat pacientů byl registr CORECT. Výsledky: Mediány přežití bez progrese (PFS) a celkového přežití (OS) u pacientů s mutací KRAS byl 9,2 a 22,8 vs. 10,8 a 29,2 měsíce u pacientů s wild-type KRAS genem (p = 0,309 a p = 0,003). Nejkratšího přežití bylo dosaženo u pacientů s mutací KRAS G12V a G12A (souhrnně G12V/ A). Mediány PFS a OS u pacientů s mutací G12V/ A KRAS byly 6,6 a 16,8 vs. 11,6 a 26,3 měsíce u pacientů s jiným typem KRAS mutace (p < 0,001 a p < 0,001). Závěr: Hodnocení významu mutací genu KRAS bez ohledu na typ ukázalo významně kratší OS, potvrdil se tak negativní prognostický význam této mutace. Prokázali jsme významný rozdíl v efektu léčby bevacizumabem u pacientů s G12A/ V KRAS a jiným typem KRAS mutace. Mutace G12A/ V KRAS predikují významně kratší PFS i OS. Tato retrospektivní analýza ukazuje na možnost, že typ mutace KRAS má prediktivní význam u pacientů s mCRC léčených bevacizumabem.
Práce byla podpořena MZ ČR – RVO (FN Plzeň – FNPl, 00669806), IGA MZ ČR 14329 a projektem ED2.1.00/ 03.0076 Evropského fondu pro regionální rozvoj.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek Radioterapeutické metodyČlánek Nutriční podpora v onkologiiČlánek Psychosociální péčeČlánek EditorialČlánek Nádory prsuČlánek Nádory jícnu a žaludkuČlánek SOUTĚŽ O NEJLEPŠÍ PRÁCIČlánek SarkomyČlánek Nádory hlavy a krkuČlánek Gynekologická onkologieČlánek UroonkologieČlánek Nádory nervového systémuČlánek HematoonkologieČlánek Jmenný rejstříkČlánek Sborník abstrakt
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2015 Číslo Supplementum 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- SOUTĚŽ O NEJLEPŠÍ PRÁCI
- Nádory slinivky, jater a žlučových cest
- Neuroendokrinní a endokrinní tumory
- Sarkomy
- Nádory hlavy a krku
- Nádory hrudníku, plic, průdušek a pleury
- SOUTĚŽ NA PODPORU AUTORSKÝCH TÝMŮ PUBLIKUJÍCÍCH V ZAHRANIČNÍCH ODBORNÝCH TITULECH
- Gynekologická onkologie
- Uroonkologie
- Nádory nervového systému
- Hematoonkologie
- Nádory dětí, adolescentů a mladých dospělých
- Jiné malignity (ostatní, jinde nezařazené malignity)
- Varia (ostatní, jinde nezařazené příspěvky)
- Vývoj nových léčiv, farmakoekonomika, klinická farmacie v onkologii
- Základní a aplikovaný výzkum v onkologii
- Jmenný rejstřík
- Onkologická prevence a screening
- Organizace a financování zdravotní péče
- Epidemiologie nádorů, klinické registry, zdravotnická informatika
- Vzdělávání, kvalita a bezpečnost v onkologické praxi
- Diagnostické metody v onkologii
- Radioterapeutické metody
- Sborník abstrakt
- Nežádoucí účinky protinádorové léčby
- Paliativní péče a symptomatická léčba
- Nutriční podpora v onkologii
- Psychosociální péče
- Pacientské organizace a spolupráce s veřejností
- Hereditární nádorové syndromy
- Editorial
- Nádory prsu
- Nádory kůže a maligní melanom
- Nádory jícnu a žaludku
- Nádory tlustého střeva a konečníku
- Organizační a programový výbor BOD a KNZP v roce 2015
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Nádory tlustého střeva a konečníku
- Paliativní péče a symptomatická léčba
- Nádory prsu
- Nádory jícnu a žaludku
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



