-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Význam imunohistochemických metod v diagnostice mezenchymálních nádorů dělohy
The value of immunohistochemical methods in diagnosing mesenchymal tumours of the uterus
The goal of this manuscript is to provide a comprehensive overview of the use of immunohistochemical methods in diagnosing mesenchymal tumours of the uterus. The main points discussed include, especially, the issue of determining smooth muscle differentiation, the differential diagnosis between smooth muscle and endometrial stromal tumours, and the diagnosis of inflammatory myofibroblastic tumour. The role of immunohistochemical examination in the diagnosis of some of the only recently definedentities such as YWHAE-altered high grade endometrial stromal sarcoma (HG-ESS), BCOR-altered HG-ESS, tumours with NTRK fusion, and SMARCA4-deficient sarcomas is also discussed. The last aspect of this work is an analysis of the significance of immunohistochemical methods in the determination of the biological behaviour of leiomyocellular tumours. The issue of their molecular classification for those lesions associated with the presence of recurrent molecular aberrations is also discussed.
Keywords:
mesenchymal uterine tumors – smooth muscle tumors – endometrial stromal tumors – undifferentiated uterine sarcoma – immunohistochemistry – molecular classification
Autoři: Pavel Dundr; Mária Gregová; Kristýna Němejcová
; Michaela Bártů; Rosalie Jana Bennett; Ivana Stružinská
Působiště autorů: Ústav patologie 1. LF UK a VFN v Praze
Vyšlo v časopise: Čes.-slov. Patol., 57, 2021, No. 2, p. 86-95
Kategorie: Přehledový článek
Souhrn
Cílem následujícího sdělení je podat přehled využití imunohistochemických metod v diagnostice mezenchymálních nádorů dělohy. Diskutována je zejména problematika týkající se stanovení hladkosvalové diferenciace, diferenciální diagnostiky mezi hladkosvalovými a endometriálními stromálními nádory adiagnostika zánětlivého myofibroblastického nádoru. Kromě toho je zmíněn význam imunohistochemických vyšetření v diagnostice poměrně recentně definovaných jednotek, jako je YWHAE alterovaný high grade endometriální stromální sarkom (HG-ESS), BCOR alterovaný HG-ESS, nádory s NTRK fúzí a SMARCA4 deficientní sarkomy. Posledním aspektem je rozbor významu imunohistochemických metod při stanovení biologické povahy leiomyocelulárních nádorů. U jednotek s výskytem rekurentních molekulárních aberací je také zmíněna problematika jejich molekulární klasifikace.
Klíčová slova:
mezenchymální nádory dělohy – hladkosvalové nádory – endometriální stromální nádory – nediferencovaný sarkom dělohy – imunohistochemie – molekulární klasifikace
Mezenchymální nádory dělohy zahrnují široké spektrum lézí, naprostou většinu z nich však představují nádory s leiomyocelulární diferenciací, zejména benigní leiomyomy (LM) a jejich varianty. Čisté sarkomy dělohy (nikoliv tedy karcinosarkomy) představují < 3 % všech maligních nádorů dělohy (1). Většinu těchto nádorů představují leiomyosarkomy (LMS) a low grade endometriální stromální sarkomy (LG-ESS). Vyskytují se však i další typy sarkomů zahrnující high grade endometriální stromální sarkomy (HG-ESS), nediferencovaný sarkom dělohy (UUS) a celé spektrum sarkomů vyskytujících se v měkkých tkáních (včetně angiosarkomu, rabdomyosarkomu, osteosarkomu, alveolárního sarkomu měkkých tkání a Ewingova sarkomu / PNET)(2,3). Problematika nádorů měkkých tkání je však stejná, jako v místě jejich častějšího výskytu, a není proto předmětem stávajícího sdělení. Spektrum maligních nádorů se v souvislosti s rozvojem poznatků týkajících se zejména molekulárních aberací vyskytujících se u těchto lézí rozšiřuje a v současné době je zejména u endometriálních stromálních sarkomů (ESS) patrná subklasifikace s vyčleněním několika poměrně jasně definovaných typů nádorů zahrnujících YWHAE alterovaný HG-ESS, BCOR alterovaný HG-ESS, nádory s NTRK fúzí a SMARCA4 deficientní sarkomy. Znalosti týkající se morfologie, molekulárních aberací a výsledků imunohistochemických vyšetření jsou však u těchto nádorů v současné době limitované. Molekulární klasifikace je v tuto chvíli v některých aspektech nepřehledná a neustále se vyvíjí, navíc sama o sobě může být zavádějící a vždy je nutná korelace s morfologií, včetně IHC vyšetření. Význam některých aberací zůstává nejasný, např. fúze BRD8-PHF1 byla recentně popsána u LG-ESS, avšak brzy poté i u nádorů s high grade morfologií (4,5). Vzhledem k uvedeným nejasnostem je obecně vždy nutné komplexní hodnocení nádorů s ohledem na jejich morfologii i imunohistochemický profil. V tabulce 1 jsou uvedeny očekávané výsledky IHC vyšetření získané analýzou literárních dat. U některých jednotek a protilátek jsou však data výrazně limitovaná zejména s ohledem na literárně dostupné velikosti souborů (někdy v řádu jednotek pacientů) a jejich výsledky je nutné brát s rezervou (v tabulce jsou údaje o limitovaných výsledcích identifikovatelné). Nutné je však zdůraznit, že kromě imunohistochemických vyšetření se diagnostika některých sarkomů dělohy v současné době neobejde bez molekulárních vyšetření a bez těchto vyšetření tedy není diagnostika určitých typů nádorů s jistotou možná. Imunohistochemická vyšetření tedy v některých případech sama o sobě neumožní u nejasných případů stanovení diagnózy. Z uvedených důvodů se v následujícím sdělení kromě významu IHC tedy v určitých aspektech zaměřujeme i na problematiku molekulární diagnostiky.
Tab. 1. Výsledky diagnostických IHC vyšetření v jednotlivých typech mezenchymálních nádorů dělohy (uvedena jsou % pozitivních případů). 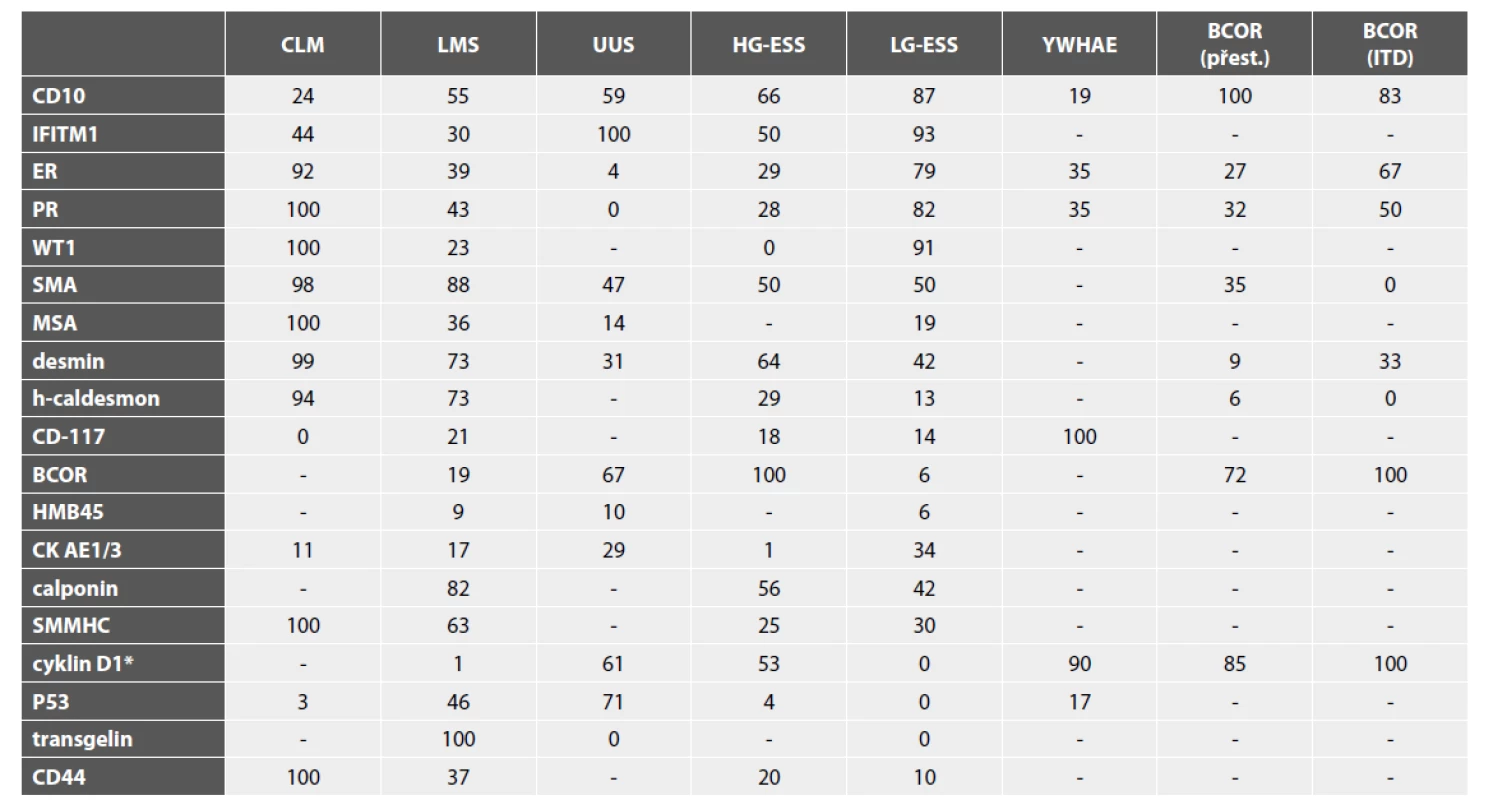
* silná exprese nad 70 %; CLM – celulární leiomyom; LMS – leiomyosarkom; UUS – nediferencovaný sarkom dělohy; HG-ESS – high grade endometriální stromální sarkom; LG-ESS – low grade endometriální stromální sarkom; YWHAE – HG-ESS s YWHAE aberací; BCOR (přest.) – HG-ESS s přestavbou BCOR; BCOR (ITD) – HG-ESS s interní tandemovou duplikací BCOR; SMA - smooth muscle actin; MSA - muscle specific actin; SMMHC - smooth muscle myosin heavy chain Hladkosvalové nádory
Imunohistochemický profil hladkosvalových nádorů reflektuje jejich diferenciaci a benigní nádory tedy exprimují v naprosté většině případů hladkosvalové markery v očekávaném rozsahu. U leiomyosarkomu však může být situace poněkud odlišná a jsou případy, kdy je exprese hladkosvalových markerů velmi limitovaná, a naopak u části případů se vyskytuje exprese dalších markerů, více specifických pro jiné jednotky, které připadají v diferenciální diagnóze v úvahu. Podle našeho přehledu se u LMS vyskytuje exprese hladkosvalového aktinu (SMA) v 88 % případů, svalově specifického aktinu (MSA) ve 36 % případů, h-caldesmonu a desminu v 73 % případů, a těžkého řetězce hladkosvalového myozinu v 63 % případů. Důležitá je také znalost možné exprese dalších markerů, jako je CD10 (55 %), IFITM1 (30 %), CD117 (21 %), BCOR (19 %), cytokeratiny AE1/3 (17 %) a HMB45 (9 %), jejichž exprese může být s ohledem na diferenciální diagnostiku zavádějící (6-23). Velmi specifickým markerem hladkosvalové diferenciace se zdá být transgelin, jehož exprese byla v jedné studii nalezena u 100 % leiomyosarkomů a u žádného LG-ESS či UUS, data jsou však velmi omezená a jsou zapotřebí další studie, které by tyto výsledky potvrdily (24,25).
Značná část hladkosvalových nádorů vykazuje specifické rekurentní molekulární aberace, zejména mutaci genu MED12, overexpresi HMGA2 a bialelickou inaktivaci genu pro fumarát hydratázu (FH). U leiomyomů je nejčastější mutace MED12, která se vyskytuje asi u 60-70 % běžných leiomyomů, častá je však i u morfologických variant leiomyomů (10-40 %) a LMS (asi 20 %) (26-28). Overexprese HMGA2 se vyskytuje asi u 25 % běžných leiomyomů, častější je u celulárních leiomyomů (asi 30 %), poměrně vzácná je u LMS (asi 6 %). Deficience FH je nejčastejší u leiomyomů s bizarními jádry, kde se vyskytuje asi u 30 % (29). U běžných leiomyomů a LMS se aberace FH vyskytují zcela raritně a jsou udávány v <1 % a leiomyomů asi ve 4 % LMS, v naší studii jsme je však neprokázali u žádného z uvedených typů nádorů (29). Znalost těchto aberací je důležitá a stejně tak jako rekurentní aberace u LG-ESS (diskutované níže) mohou být tyto změny významné v rámci diferenciální diagnostiky nejasných případů.
Význam IHC vyšetření při stanovení biologické povahy hladkosvalových nádorů
IHC může být přínosná v několika aspektech, zahrnujících stanovení mitotické aktivity a dále hodnocení rozdílné exprese vybraných markerů mezi benigními a maligními nádory. Určitý přínos v tomto kontextu může být i při hlubší charakterizaci hladkosvalových nádorů nejistého maligního potenciálu (“smooth muscle tumor of uncertain malignant potential” – STUMP).
Stanovení počtu mitóz je spolu s přítomností jaderných atypií a koagulačního typu nekrózy jeden ze základních parametrů hodnocených při hodnocení biologické povahy leiomyocelulárních nádorů. Rozlišení mitózy od jejích napodobovatelů (jako je např. karyorexe, apoptóza, pyknóza jader) však může být obtížné a existuje několik prací zabývající se možným využitím protilátky PHH3 (tato protilátka je cílená na fosforylovaný serin 10 histonu 3 vyskytující se v pozdní G2 a M fázi a měla by tedy být “specifická” pro mitózu). Nicméně je nutné vzít v potaz, že veškeré stávající algoritmy jsou založeny na počítání mitóz z barvení HE, které nekoreluje se stanovením počtu mitóz při použití PHH3, a v tomto kontextu tedy nelze IHC vyšetření použít. Existují nicméně práce, které si vzaly za cíl stanovení koeficientu, jež by toto využití umožnil (30-32). Podle jedné studie je koeficient pro leiomyom, mitoticky aktivní leiomyom, leiomyom s bizarními jádry a STUMP 1,5x a pro LMS 2,5x (30). Tyto koeficienty však nejsou validovány pro využití v diagnostické praxi. Význam PHH3 je tedy spíše v tom, že lze vybrat oblasti s nejvyšší mitotickou aktivitou, která je pak ale počítána z barvení HE, a dále vyšetření umožní odlišení mitóz a “pseudomitóz”. To může být významné zejména u sporných lézí, zahrnujících i některé případy leiomyomu s bizarními jádry. Podle některých údajů by se mohlo jednat i o marker umožňující stratifikaci sporných případů do prognosticky významných skupin a prognostický faktor u LMS, toto je však zatím pouze ve fázi výzkumu.
Imunohistochemická vyšetření mají potenciální význam při rozlišení mezi benigními nádory, STUMP a LMS a v prognostické „subklasifikaci“ STUMP, nicméně ve všech uvedených indikacích vykazují určité limitace, jichž bychom si pro praktické využití měli být vědomi (33). Nejčastěji používanými protilátkami v tomto kontextu jsou p16, p53, hodnocení proliferační aktivity (Ki-67) a také exprese ER a PR. Výsledky vybraných studií jsou shrnuty v tabulce 2 (13,23,32,34-58). Problémem jsou u určitých protilátek rozdílné hranice pozitivity, což v některých případech znemožňuje bližší analýzu dat. Např. exprese p53 byla jako „pozitivní“ brána v různých studiích nad hodnotu 33 %, 40 %, 50 %, 66 %, 75 %, a 80 % (či 0). Pro praktické využití se zdá být u běžných (tedy vřetenobuněčných) nádorů v tomto ohledu nejpřínosnější kombinace p53, p16 a proliferační aktivity. U hodnocení proliferační aktivity (Ki-67 index) je však správné „naprahování“ zásadní, literární data však jsou v tomto ohledu velmi nejednotná. Obecně platí, že Ki-67 index nad 25 % (30 %) se v naprosté většině případů vyskytuje pouze u části LMS a výjimečně u LBN, zatímco u dalších typů hladkosvalových nádorů je proliferace podstatně nižší. Nicméně nízká proliferace diagnózu LMS nevylučuje a marker je pouze pomocný, s nutným hodnocením společně s dalšími nálezy. Význam uvedených markerů v diagnostice LBN je však limitovaný a ve srovnání s ostatními hladkosvalovými nádory zde existuje výraznější IHC překryv mezi LBN a LMS. Některé práce se v tomto kontextu zabývaly i možností využití p21, p27, bcl2 a cyklinu D1, avšak praktické využití je s ohledem na nízkou specificitu i senzitivitu limitované (46,48). Recentní práce na poměrně malém souboru popsala také potenciální význam využití protilátky proti MCM2, která byla difúzně (>80 %) pozitivní u 12/13 (92 %) LMS a pouze u 1/10 LBN (10 %) a 1/12 STUMP (8 %) (46). Uvedený soubor je však poměrně malý a pro možné vyhodnocení praktického přínosu je zapotřebí více dat. Při hodnocení je také nutné zohlednit fakt, že exprese p16 se často vyskytuje v okolí nekróz, a to i ischemického typu, což může být u regresivně změněných leiomyomů zavádějící (59).
Tab. 2. Výsledky IHC vyšetření markerů s potenciálním významem při hodnocení biologické povahy (uvedena jsou % pozitivit). 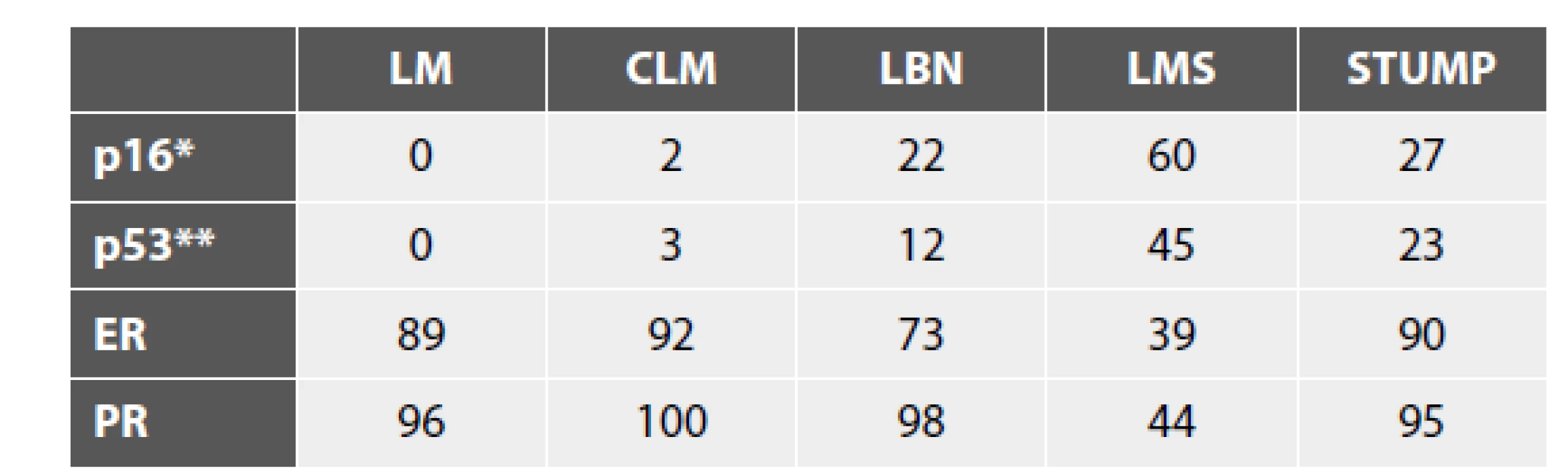
LM – leiomyom; CLM – celulární leiomyom; LBN – leiomyom s bizarními jádry; LMS – leiomyosarkom, STUMP – hladkosvalový nádor nejistého maligního potenciálu
* difúzní (bloková) exprese (celkový rozsah pozitivity se však v jednotlivých studiích může lišit)
** aberantní typ expreseS ohledem na prognostickou „subklasifikaci“ nádorů řazených do kategorie STUMP se zdají být nejlepšími markery rekurence p16 a p53, které vykazují mezi skupinou STUMP bez recidivy a recidivujícími nádory statisticky významné rozdíly (34,44). Určitý vztah je patrný i na úrovni proliferační aktivity (Ki-67 index). Doporučováno je tedy některými autory u všech pacientek s diagnózou STUMP provést kombinaci vyšetření p53, p16 a Ki-67, nutné je však zdůraznit, že data jsou stále poměrně limitovaná. V jedné studii byl také u STUMP a LMS časného stádia popsán prognostický význam ztráty exprese DAXX a ATRX (60). Praktický význam je však v tuto chvíli opět velmi limitovaný.
Celulární leiomyom vs. LG-ESS
Odlišení celulárního leiomyomu (CL) od LG-ESS je někdy poměrně komplikované, a to zejména u případů v literatuře označovaných jako tzv. vysoce CL (obr. 1, 2) (58,61,62). Pro pacientky je však správná diagnóza s ohledem na odlišnou biologickou povahu těchto jednotek zcela zásadní. Morfologická kritéria umožňující odlišení obou lézí jsou poměrně dobře definována, problémem však je, že existuje určitý překryv, a ne vždy je rozlišení s jistotou možné. Ve sporných případech se tedy nabízí využití IHC metod, které je však s ohledem na interpretaci výsledku často poměrně komplikované. Problémem je zejména překryv imunofenotypu pro většinu protilátek. Nejčastěji používanými protilátkami jsou v tomto kontextu CD10, h-caldesmon, desmin, hladkosvalový aktin a recentně i IFITM1 (6,18,58,63). Na expresi CD10 bylo v minulosti nahlíženo jako na poměrně specifický marker endometriální stromální diferenciace, vyskytuje se však poměrně často i u leiomyocelulárních nádorů. U LG-ESS je exprese CD10 přítomna asi v 87 % případů, u CL se však může vyskytovat také a udávána je asi u 24 % případů (8, 9). Důležitý ale kromě samotné přítomnosti exprese CD10 může být i její rozsah – u LG-ESS se výrazná pozitivita (která je však v jednotlivých studiích kvantifikována poněkud odlišně) vyskytuje asi v 55 % případů, naopak u CL je exprese většinou pouze fokální. S ohledem na další markery – desmin se vyskytuje asi u 40 % LG-ESS a 98 % CL, svalově specifický aktin (MSA) u 20 % LG-ESS a 100 % CL, hladkosvalový aktin (SMA) u 50 % LG-ESS a 98 % CL a h-caldesmon u 13 % LG-ESS a 94 % CL. Z uvedeného tedy vycházejí pro účely diferenciální diagnostiky jako nejpřínosnější CD10 a h-caldesmon. Poměrně nová protilátka IFITM1 má podle literárních údajů při zachování vysoké senzitivity pro LG-ESS podstatně vyšší specificitu než CD10.U CL však toto neplatí, podle literárních dat (která jsou však v případě CL výrazně kvantitativně limitovaná) je exprese IFITM1 u 93 % LG-ESS avšak i u 44 % CL. Při stanovení IHC profilu LG-ESS je však také nutno vzít v úvahu rozdíly v expresi některých markerů u jeho morfologických variant. Např. fibroblastická / myofibroblastická varianta LG-ESS je často CD10 negativní a LG-ESS s hladkosvalovou diferenciací má v oblastech této diferenciace stejný IHC profil jako hladkosvalové léze (obr. 3) (14,64-67).
Obr. 1. Celulární leiomyom. Vysoce buněčný leiomyom s fokálními hyalinizacemi a charakteristickými silnostěnnými cévami (1A, HE, 200x). Nádorové buňky jsou pozitivní při průkazu h-caldesmonu (1B, 100x), dezminu (1C, 200x), α-hladkosvalového aktinu (1D, 200x) a CD10 (1E, 200x). IFITM1 je v nádorových strukturách negativní s pozitivní vnitřní kontrolou v cévách (1F, 100x). 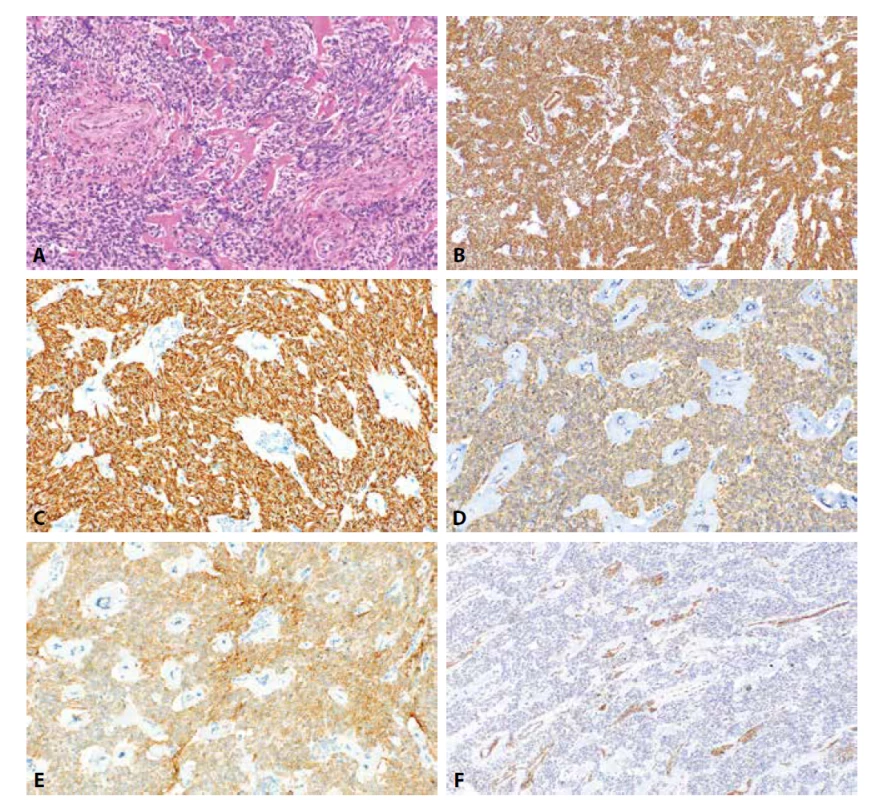
Obr. 2. Low grade endometriální stromální sarkom. Nádorové struktury s jazykovitou infiltrací myometria (1A, HE, 100x). Nádorové buňky jsou pozitivní při průkazu CD10 (1B, 40x), IFITM1 (2C, 200x) a negativní při průkazu h-caldesmonu (1D, 100x). 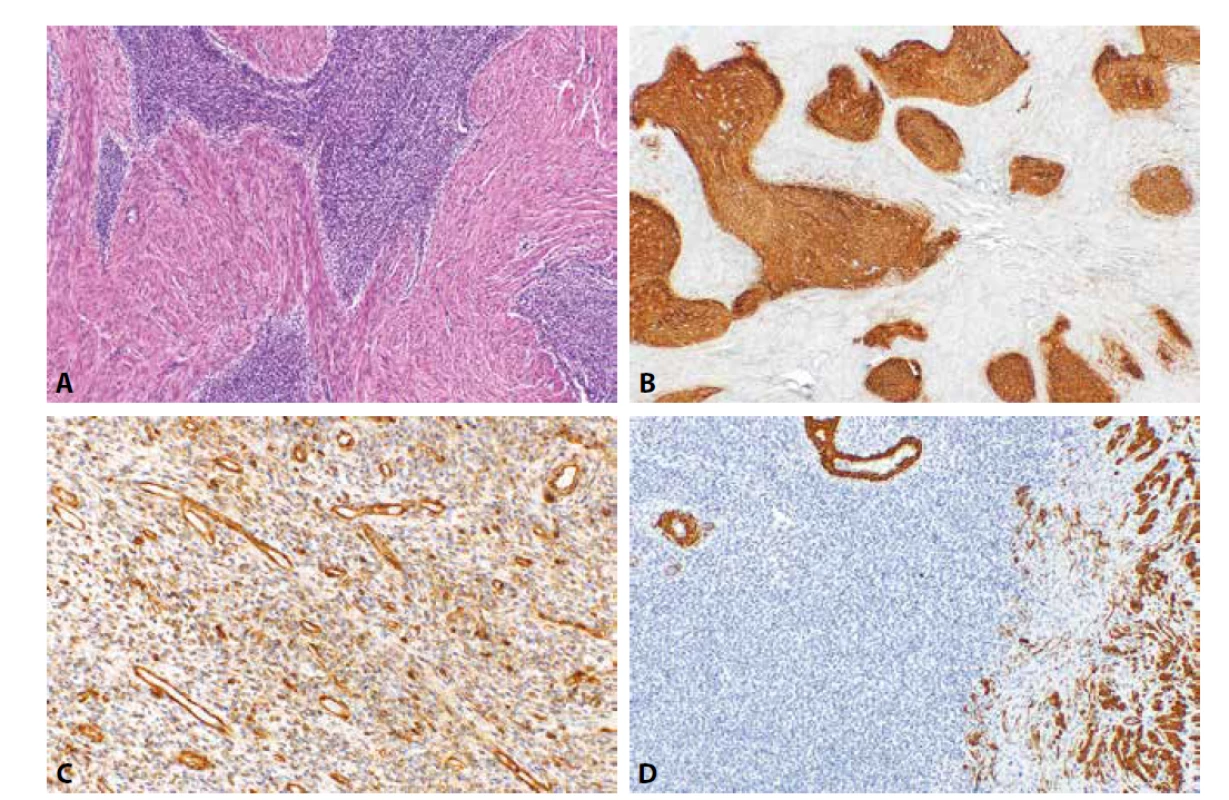
Obr. 3. Endometriální stromální uzel s hladkosvalovou diferenciací. Oblasti s endometriální stromální diferenciací prolnuté s oblastmi s hladkosvalovou diferenciací s mnohotnými hyalinními rozetami (1A, HE, 100x). Nádorové buňky v oblastech s hladkosvalovou diferenciací jsou pozitivní při průkazu h-caldesmonu (3B, 200x), desminu (3C, 200x) a α-hladkosvalového aktinu (3D, 200x). 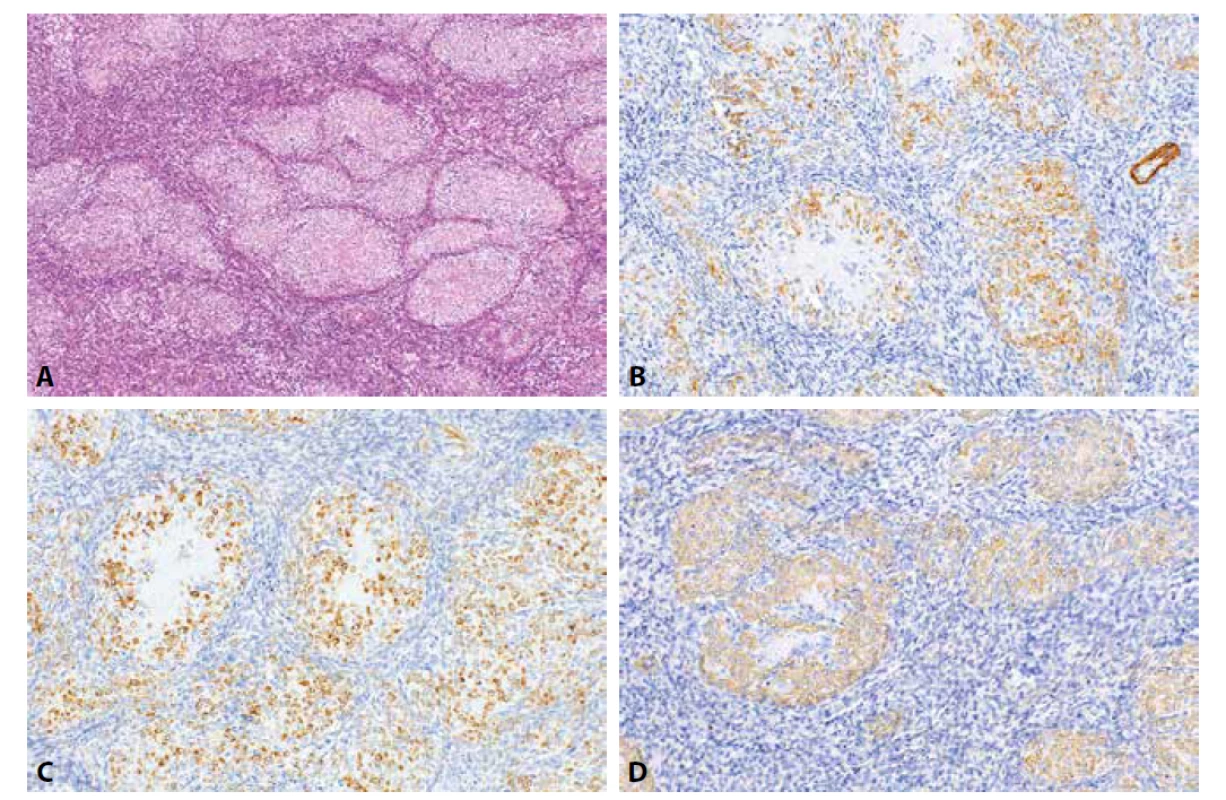
Z uvedeného tedy vyplývá, že morfologie a imunohistochemie hrají v diferenciální diagnostice uvedených lézí podstatnou roli, neumožní však přesnou diagnózu ve všech případech a u těchto sporných lézí hraje v současné době zcela zásadní roli molekulární testování rekurentních aberací, které se u LG-ESS vyskytují ve většině případů. Tyto aberace zahrnují různé translokace, nejčastěji s účastí genů zapojených do procesu regulace transkripce (JAZF1 a EPC1) a genů lokalizovaných na chromozómu Xp11 (CXorf67 a BCOR) (68). První popsaná translokace byla t(7;17)(p15;q11), postihující genyJAZF1 a JJAZ1 (SUZ12) (69,70). Následně byl popsán nový fúzní partner JAZF1 lokalizovaný na chromozómu 6p21 (PHF1) (71). Gen PHF1 může být rekombinován s dalšími geny, jmenovitě s EPC1 a MEAF6 (71). Přestavby postihující chromozóm Xp11 zahrnují 2 geny:CXorf67 a BCOR. Fúzní partneři těchto genů jsou lokalizovány na 17q21 (MBTD1) a 22q13 (ZC3H7B), s fúzíMBTD1-CXorf67 aZC3H7B-BCOR(72, 73). Molekulární klasifikace se však neustále vyvíjí a ukázalo se například, že nádory s translokací ZC3H7B-BCORpředstavují morfologicky i klinicky odlišnou jednotku od LG-ESS a v současné době jsou ESS s přestavbou BCOR klasifikovány jako samostatná léze spadající do kategorie HG-ESS (74,75). Nutné je také zdůraznit, že aberace vyskytující se u LG-ESS se mohou vyskytovat i u endometriálních stromálních uzlů a nelze je tedy využít jako markery pomocné při stanovení biologické povahy sporných lézí (76). Nadále také zůstává skupina LG-ESS, u kterých se nepodaří žádnou známou aberaci prokázat (77).
High grade endometriální stromální sarkomy
HG-ESS v současné době představují heterogenní skupinu nádorů s více agresivním chováním, nežli je chování LG-ESS.Jejich klasifikace se poměrně intenzivně rozvíjí zejména v souvislosti s rozvojem poznatků týkajících se molekulárních aberací vyskytujících se u těchto lézí. Současné znalosti jsou sice stále poměrně omezené, nicméně recentně bylo definováno několik jednotek se samostatným významem nejen s ohledem na molekulární aberace, ale i morfologii a imunohistochemický profil. Tyto jednotky zahrnují HG-ESS s alterací YWHAE, HG-ESS s alterací BCOR, SMARCA-4 deficientní sarkomy dělohy a sarkomy dělohy s fúzí NTRK (78-85).
Imunohistochemický profil HG-ESS se zdá být při analýze literárních dat poměrně heterogenní. Častý je v nich výskyt low grade komponenty, která má IHC profil totožný s LG-ESS. Podle WHO klasifikace je high grade komponenta těchto nádorů typicky CD10, ER a PR negativní a vykazuje difúzní silnou expresi (> 70 % jader) cyklinu D1. Tento imunofenotyp by měl být dle WHO nápomocný při odlišení od UUS, který má být variabilně CD10 pozitivní a může být slabě ER a PR pozitivní. Pokud se u UUS vyskytne silná pozitivita cyklinu D1, pak jsou tyto nádory zároveň CD10 pozitivní, což dle WHO vylučuje HG-ESS s translokací YWHAE. Nicméně literární data jsou v tomto ohledu poměrně rozporuplná. Z dostupných zdrojů, které specificky nevyčleňují HG-ESS s translokací YWHAE, je imunofenotyp HG-ESS udáván poněkud odlišně, s pozitivitou CD10 u 66 % případů (u 35 % silnou), ER u 39 % případů, PR u 27 % případů a cyklinu D1 u 53 % případů (4,15,86-88). Práce zaměřené na IHC analýzu molekulárně potvrzených HG-ESS s aberací YWHAE jsou poměrně limitované s malými počty pacientů, nicméně jejich výsledky prokázaly pozitivitu CD10 u 19 % případů, ER u 35 % případů, PR u 35 % případů a cyklinu D1 u 90 % případů (obr. 4). To je v rozporu s údaji uvedenými ve WHO a v praxi je s uvedeným imunofenotypem nutné počítat. Oproti uvedenému je také dle literárních dat UUS CD10 pozitivní v 59 % případů, ER pozitivní ve 4 % případů, PR v 0 % případů a cyklin D1 v 61 % případů. Z dalších protilátek limitovaná data svědčí pro to, že prakticky 100 % HG-ESS s aberací YWHAE je pozitivních při vyšetření s protilátkou proti BCOR, exprese BCOR se však může vyskytovat i u UUS (a dalších typů nádorů diskutovaných níže). V praxi je tedy při rozlišení mezi HG-ESS a UUS nutno zohlednit morfologii a výsledky IHC vyšetření, bez molekulárního vyšetření však v některých případech není diagnóza s jistotou možná.HG-ESS s YWHAE alterací je charakterizován translokací t(10;17) vedoucí k fúziYWHAE-NUTM2A/B, která byla poprvé popsána v roce 2012 (87, 89).
Obr. 4. High grade endometriální stromální sarkom s prokázanou fúzí YWHAE-NUTM1A. Nádorové struktury infiltrující myometrium (4A, HE, 100x). Nádorové buňky vykazují silně intenzivní jadernou pozitivitu cyklinu D1 (4B, 100x) a jadernou pozitivitu při průkazu BCOR (4C, 200x). Negativní je v nádorových strukturách α-hladkosvalový aktin (4D, 100x), CD10 (4E, 100x) a IFITM1 (4F, 200x). 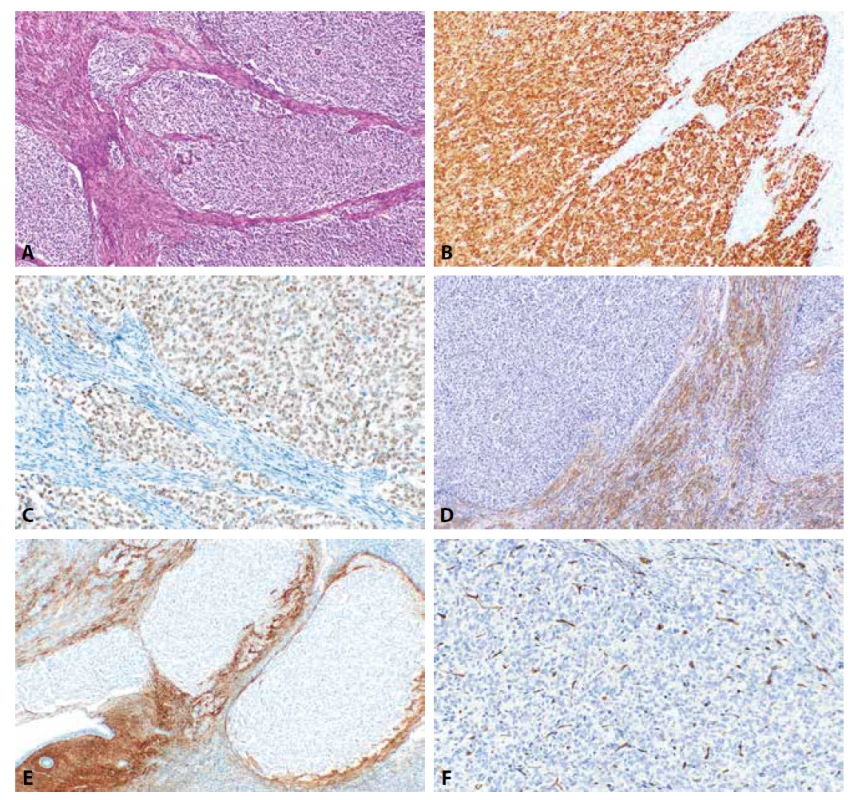
Další poměrně nově definovanou jednotkou jsou HG-ESS s alterací BCOR, u kterých se vyskytují 2 typické aberace. Jednou z nich je fúze genuBCOR (ZC3HB7-BCOR), druhou je interní tandemová duplikace (ITD) genu BCOR (73,84,90). Imunohistochemicky jsou tyto nádory silně CD10 pozitivní (100 % nádorů s translokací a 83 % s ITD), BCOR pozitivní (72 % nádorů s translokací a 100 % nádorů s ITD) a cyklin D1 pozitivní (85 % nádorů s translokací a 100 % nádorů s ITD). Může být přítomna i exprese ER, PR a méně často i některých hladkosvalových markerů.
Mezi další (zejména molekulárně definované sarkomy) patří sarkom dělohy charakterizovaný mutací genu SMARCA4 (78). Imunohistochemicky je pro tento nádor typická ztráta exprese SMARCA4 (BRG1), nejedná se však o specifický znak, ztráta exprese SMARCA4 se může vyskytovat i v dalších nádorech, jako je UUS.
Pro sarkomy dělohy s NTRK fúzí (které se aktuálně pokládají za variantu fibrosarkomu dělohy) je typická imunohistochemická pozitivita s panNTRK protilátkou, opět se však nejedná o rys specifický (85). Jednotky nejsou zcela přesně definovány a existuje překryv s nádory označovanými jako “endocervikální neurofibrosarkomy”, které jsou však charakterizovány ještě expresí CD34 a S100 proteinu (91).
Nediferencovaný sarkom dělohy
UUS představují dle stávajících poznatků heterogenní skupinu nádorů, zčásti zřejmě nerozpoznaných či dle současných kritérií neidentifikovatelných HG-ESS a spíše se tedy jedná o diagnózu stanovenou až po vyloučení všech jiných možností (4,92-95). Nádory z obecné definice nevykazují známky hladkosvalové ani endometriální stromální diferenciace a dle zastoupených znaků jsou klasifikovány na pleomorfní a monomorfní typ. Při imunohistochemickém vyšetření je obvykle udávána absence exprese hladkosvalových markerů, a zejména u monomorfního typu občasná pozitivita cyklinu D1, ER a PR. Pleomorfní typ častěji vykazuje aberantní typ exprese p53. CD10 je variabilní. Oproti uvedenému byla v námi hodnocených pracích zabývajících se touto problematikou souhrnně CD10 pozitivita u 59 % případů, ER pozitivita u 4 % případů, PR u 0 % případů a silná exprese cyklinu D1 u 61 % případů. Aberantní typ exprese p53 byl u 71 % případů.
Molekulární data týkající se těchto nádorů jsou velmi limitovaná. Podle některých studií UUS nemá specifické rekurentní aberace a je charakterizován komplexním karyotypem s častým výskytem mutací TP53. Molekulární testování by přesto mělo být standardní součástí diagnostiky těchto nádorů, právě s ohledem na jejich nejednoznačnost a potřebu vyloučit ostatní jednotky, které v diferenciální diagnostice připadají v úvahu.
Zánětlivý myofibroblastický nádor
Zánětlivý myofibroblastický nádor (IMT) dělohy je jednotka, která zřejmě často uniká rozpoznání a je diagnostikována jak leiomyocelulární léze (96). U sporných vřetenobuněčných a epiteloidních lézí s variabilním myxoidním pozadím je však na IMT v diferenciální diagnostice vždy nutné pomýšlet. Imunohistochemický profil je často nepříznačný a zahrnuje variabilní pozitivitu hladkosvalových markerů (aktin, desmin, méně často h-caldesmon) i CD10. Diagnostickým znakem je nicméně exprese (případně prokázaná přestavba) ALK, která se vyskytuje u většiny IMT (dle literárních údajů je to u > 90 % případů) (obr. 5) (97). U části nádorů, u kterých se aberace ALK nepodaří prokázat, se mohou vyskytovat jiné translokace zahrnující ROS1, NTRK, RET a PDGFRB (98). Důkladnější molekulární testování je u ALK negativních nádorů vykazujících rysy IMT tedy žádoucí.
Obr. 5. Zánětlivý myofibroblastický nádor (5A, HE, 200x). Nádorové buňky jsou pozitivní při průkazu ALK (5B, 200x). 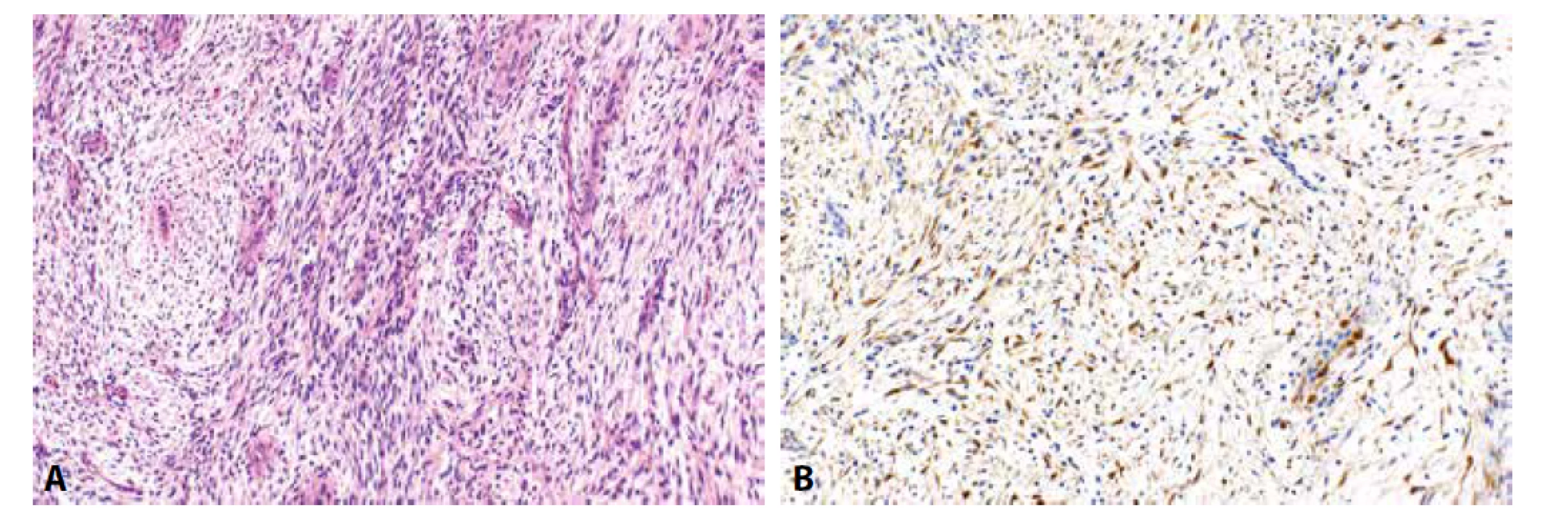
ZÁVĚR
Diagnostika mezenchymálních nádorů dělohy je ve většině případů jednoduchá, týká se benigních leiomyocelulárních nádorů, a vystačíme si se základním barvením HE. Existuje však široká skupina lézí, u kterých mají imunohistochemické a v poslední době i molekulární metody někdy pomocnou a jindy nezastupitelnou roli. Pro dosažení správné diagnózy je v prvé řadě potřebná znalost příslušných jednotek a jejich morfologických rysů, doprovázená znalostí pomocných diagnostických postupů. I přes rozšiřující se spektrum mezenchymálních nádorů dělohy zejména v souvislosti s jejich molekulární klasifikací je nadále znalost morfologie a imunofenotypu příslušných nádorů zásadní. Stejně jako v jiných oblastech je však zapotřebí uvědomit si nejen možnosti, ale i limity imunohistochemických (ale i molekulárních) vyšetření. V případě mezenchymálních nádorů dělohy je využití IHC metod a správná interpretace jejich výsledku někdy poměrně obtížné. Molekulární metody, umožňující klasifikaci nádorů na podkladě rekurentních aberací, lze v současné době pokládat za nedílnou součást bioptického vyšetření, bez níž by přesná klasifikace některých nádorů nebyla možná, nadále však zůstává mnoho nejasností a v této oblasti lze očekávat pokračující intenzivní rozvoj.
PODĚKOVÁNÍ
Práce byla podpořena MZČR (projekt RVO VFN64165) a Univerzitou Karlovou (projekt Progres Q28/LF1)
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
Prof. MUDr. Pavel Dundr, Ph.D.
Ústav patologie 1. LF UK a VFN v Praze
Studničkova 2, 128 00, Praha 2
Zdroje
1. Prat J, Mbatani. Uterine sarcomas. Int J Gynaecol Obstet 2015; 131 Suppl 2: S105-110.
2. Dundr P, Fischerová D, Povýšil C, et al. Uterine tumors with neuroectodermal differentiation. A report of 4 cases. Pathol Oncol Res 2010; 16(4): 601-608.
3. Dundr P, Fischerová D, Povýšil C, Tvrdik D, Cibula D. Primary synovial sarcoma of the uterus. Pathol Oncol Res 2012; 18(2): 529-533.
4. Cotzia P, Benayed R, Mullaney K, et al. Undifferentiated uterine sarcomas represent under-recognized high-grade endometrial stromal sarcomas. Am J Surg Pathol 2019; 43(5): 662-669.
5. Micci F, Brunetti M, Dal Cin P, et al. Fusion of the genes brd8 and phf1 in endometrial stromal sarcoma. Genes Chromosomes Cancer 2017; 56(12): 841-845.
6. Busca A, Gulavita P, Parra-Herran C, Islam S. Ifitm1 outperforms cd10 in differentiating low-grade endometrial stromal sarcomas from smooth muscle neoplasms of the uterus. Int J Gynecol Pathol 2017;
7. Parra-Herran CE, Yuan L, Nucci MR, Quade BJ. Targeted development of specific biomarkers of endometrial stromal cell differentiation using bioinformatics: The ifitm1 model. Mod Pathol 2014; 27(4): 569-579.
8. Chu PG, Arber DA, Weiss LM, Chang KL. Utility of cd10 in distinguishing between endometrial stromal sarcoma and uterine smooth muscle tumors: An immunohistochemical comparison of 34 cases. Mod Pathol 2001; 14(5): 465-471.
9. Mccluggage WG, Sumathi VP, Maxwell P. Cd10 is a sensitive and diagnostically useful immunohistochemical marker of normal endometrial stroma and of endometrial stromal neoplasms. Histopathology 2001; 39(3): 273-278.
10. Abeler VM, Nenodovic M. Diagnostic immunohistochemistry in uterine sarcomas: A study of 397 cases. Int J Gynecol Pathol 2011; 30(3): 236-243.
11. Carvalho JC, Thomas DG, Lucas DR. Cluster analysis of immunohistochemical markers in leiomyosarcoma delineates specific anatomic and gender subgroups. Cancer 2009; 115(18): 4186-4195.
12. Bodner K, Bodner-Adler B, Kimberger O, et al. Estrogen and progesterone receptor expression in patients with uterine leiomyosarcoma and correlation with different clinicopathological parameters. Anticancer Res 2003; 23(1B): 729-732.
13. Akhan SE, Yavuz E, Tecer A, et al. The expression of ki-67, p53, estrogen and progesterone receptors affecting survival in uterine leiomyosarcomas. A clinicopathologic study. Gynecol Oncol 2005; 99(1): 36-42.
14. Hwang H, Matsuo K, Duncan K, et al. Immunohistochemical panel to differentiate endometrial stromal sarcoma, uterine leiomyosarcoma and leiomyoma: Something old and something new. J Clin Pathol 2015; 68(9): 710-717.
15. Chiang S, Lee CH, Stewart CJR, et al. Bcor is a robust diagnostic immunohistochemical marker of genetically diverse high-grade endometrial stromal sarcoma, including tumors exhibiting variant morphology. Mod Pathol 2017; 30(9): 1251-1261.
16. Klein WM, Kurman RJ. Lack of expression of c-kit protein (cd117) in mesenchymal tumors of the uterus and ovary. Int J Gynecol Pathol 2003; 22(2): 181-184.
17. Simpson KW, Albores-Saavedra J. Hmb-45 reactivity in conventional uterine leiomyosarcomas. Am J Surg Pathol 2007; 31(1): 95-98.
18. Rush DS, Tan J, Baergen RN, Soslow RA. H-caldesmon, a novel smooth muscle-specific antibody, distinguishes between cellular leiomyoma and endometrial stromal sarcoma. Am J Surg Pathol 2001; 25(2): 253-258.
19. Toki T, Shimizu M, Takagi Y, Ashida T, Konishi I. Cd10 is a marker for normal and neoplastic endometrial stromal cells. Int J Gynecol Pathol 2002; 21(1): 41-47.
20. Wang L, Felix JC, Lee JL, et al. The proto-oncogene c-kit is expressed in leiomyosarcomas of the uterus. Gynecol Oncol 2003; 90(2): 402-406.
21. Koivisto-Korander R, Butzow R, Koivisto AM, Leminen A. Immunohistochemical studies on uterine carcinosarcoma, leiomyosarcoma, and endometrial stromal sarcoma: Expression and prognostic importance of ten different markers. Tumour Biol 2011; 32(3): 451-459.
22. Allen MM, Douds JJ, Liang SX, et al. An immunohistochemical analysis of stathmin 1 expression in uterine smooth muscle tumors: Differential expression in leiomyosarcomas and leiomyomas. Int J Clin Exp Pathol 2015; 8(3): 2795-2801.
23. Zhai YL, Kobayashi Y, Mori A, et al. Expression of steroid receptors, ki-67, and p53 in uterine leiomyosarcomas. Int J Gynecol Pathol 1999; 18(1): 20-28.
24. Robin YM, Penel N, Perot G, et al. Transgelin is a novel marker of smooth muscle differentiation that improves diagnostic accuracy of leiomyosarcomas: A comparative immunohistochemical reappraisal of myogenic markers in 900 soft tissue tumors. Mod Pathol 2013; 26(4): 502-510.
25. Tawfik O, Rao D, Nothnick WB, et al. Transgelin, a novel marker of smooth muscle differentiation, effectively distinguishes endometrial stromal tumors from uterine smooth muscle tumors. Int J Gynecol Obstet Reprod Med Res 2014; 1(1): 26-31.
26. Makinen N, Kampjarvi K, Frizzell N, Butzow R, Vahteristo P. Characterization of med12, hmga2, and fh alterations reveals molecular variability in uterine smooth muscle tumors. Mol Cancer 2017; 16(1): 101.
27. Makinen N, Vahteristo P, Kampjarvi K, et al. Med12 exon 2 mutations in histopathological uterine leiomyoma variants. Eur J Hum Genet 2013; 21(11): 1300-1303.
28. Croce S, Chibon F. Med12 and uterine smooth muscle oncogenesis: State of the art and perspectives. Eur J Cancer 2015; 51(12): 1603-1610.
29. Gregova M, Hojny J, Nemejcova K, et al. Leiomyoma with bizarre nuclei: A study of 108 cases focusing on clinicopathological features, morphology, and fumarate hydratase alterations. Pathol Oncol Res 2020; 26(3): 1527-1537.
30. Pang SJ, Li CC, Shen Y, et al. Value of counting positive phh3 cells in the diagnosis of uterine smooth muscle tumors. Int J Clin Exp Pathol 2015; 8(5): 4418-4426.
31. Chow KL, Tse KY, Cheung CL, et al. The mitosis-specific marker phosphohistone-h3 (phh3) is an independent prognosticator in uterine smooth muscle tumours: An outcome-based study. Histopathology 2017; 70(5): 746-755.
32. Liang Y, Zhang X, Chen X, Lu W. Diagnostic value of progesterone receptor, p16, p53 and phh3 expression in uterine atypical leiomyoma. Int J Clin Exp Pathol 2015; 8(6): 7196-7202.
33. Hewedi IH, Radwan NA, Shash LS. Diagnostic value of progesterone receptor and p53 expression in uterine smooth muscle tumors. Diagn Pathol 2012; 7 : 1.
34. Ip PP, Cheung AN, Clement PB. Uterine smooth muscle tumors of uncertain malignant potential (stump): A clinicopathologic analysis of 16 cases. Am J Surg Pathol 2009; 33(7): 992-1005.
35. Atkins KA, Arronte N, Darus CJ, Rice LW. The use of p16 in enhancing the histologic classification of uterine smooth muscle tumors. Am J Surg Pathol 2008; 32(1): 98-102.
36. Azimpouran M, Vazifekhah S, Moslemi F, Piri R, Naghavi-Behzad M. Immunohistochemical profile of uterine leiomyomas; a comparison between different subtypes. Niger Med J 2016; 57(1): 54-58.
37. Bennett JA, Weigelt B, Chiang S, et al. Leiomyoma with bizarre nuclei: A morphological, immunohistochemical and molecular analysis of 31 cases. Mod Pathol 2017; 30(10): 1476-1488.
38. Bodner-Adler B, Bodner K, Czerwenka K, et al. Expression of p16 protein in patients with uterine smooth muscle tumors: An immunohistochemical analysis. Gynecol Oncol 2005; 96(1): 62-66.
39. Cao HY, Yang S, Wang S, Deng LY, Lou JY. Is differential expression of p16ink4a based on the classification of uterine smooth muscle tumors associated with a different prognosis? A meta-analysis. Genet Mol Res 2017; 16(1):
40. Dastranj Tabrizi A, Ghojazadeh M, Thagizadeh Anvar H, et al. Immunohistochemical profile of uterine leiomyoma with bizarre nuclei; comparison with conventional leiomyoma, smooth muscle tumors of uncertain malignant potential and leiomyosarcoma. Adv Pharm Bull 2015; 5(Suppl 1): 683-687.
41. Gannon BR, Manduch M, Childs TJ. Differential immunoreactivity of p16 in leiomyosarcomas and leiomyoma variants. Int J Gynecol Pathol 2008; 27(1): 68-73.
42. Hakverdi S, Gungoren A, Yaldiz M, Hakverdi AU, Toprak S. Immunohistochemical analysis of p16 expression in uterine smooth muscle tumors. Eur J Gynaecol Oncol 2011; 32(5): 513-515.
43. Hall KL, Teneriello MG, Taylor RR, et al. Analysis of Ki-ras, p53, and MDM2 genes in uterine leiomyomas and leiomyosarcomas. Gynecol Oncol 1997; 65(2): 330-335.
44. Huo L, Wang D, Wang W, et al. Oncologic and reproductive outcomes of uterine smooth muscle tumor of uncertain malignant potential: A single center retrospective study of 67 cases. Front Oncol 2020; 10 : 647.
45. Chen L, Yang B. Immunohistochemical analysis of p16, p53, and ki-67 expression in uterine smooth muscle tumors. Int J Gynecol Pathol 2008; 27(3): 326-332.
46. Keyhanian K, Lage JM, Chernetsova E, et al. Combination of mcm2 with ki67 and p16 immunohistochemistry can distinguish uterine leiomyosarcomas. Int J Gynecol Pathol 2020; 39(4): 354-361.
47. Maltese G, Fontanella C, Lepori S, et al. Atypical uterine smooth muscle tumors: A retrospective evaluation of clinical and pathologic features. Oncology 2018; 94(1): 1-6.
48. Mills AM, Ly A, Balzer BL, et al. Cell cycle regulatory markers in uterine atypical leiomyoma and leiomyosarcoma: Immunohistochemical study of 68 cases with clinical follow-up. Am J Surg Pathol 2013; 37(5): 634-642.
49. Mittal K, Demopoulos RI. Mib-1 (ki-67), p53, estrogen receptor, and progesterone receptor expression in uterine smooth muscle tumors. Hum Pathol 2001; 32(9): 984-987.
50. O’neill CJ, Mcbride HA, Connolly LE, Mccluggage WG. Uterine leiomyosarcomas are characterized by high p16, p53 and mib1 expression in comparison with usual leiomyomas, leiomyoma variants and smooth muscle tumours of uncertain malignant potential. Histopathology 2007; 50(7): 851-858.
51. Stanescu AD, Nistor E, Sajin M, Stepan AE. Immunohistochemical analysis in the diagnosis of uterine myometrial smooth muscle tumors. Rom J Morphol Embryol 2014; 55(3 Suppl): 1129-1136.
52. Sun X, Mittal K. Mib-1 (ki-67), estrogen receptor, progesterone receptor, and p53 expression in atypical cells in uterine symplastic leiomyomas. Int J Gynecol Pathol 2010; 29(1): 51-54.
53. Sung CO, Ahn G, Song SY, Choi YL, Bae DS. Atypical leiomyomas of the uterus with long-term follow-up after myomectomy with immunohistochemical analysis for p16ink4a, p53, ki-67, estrogen receptors, and progesterone receptors. Int J Gynecol Pathol 2009; 28(6): 529-534.
54. Ubago JM, Zhang Q, Kim JJ, Kong B, Wei JJ. Two subtypes of atypical leiomyoma: Clinical, histologic, and molecular analysis. Am J Surg Pathol 2016; 40(7): 923-933.
55. Unver NU, Acikalin MF, Oner U, et al. Differential expression of p16 and p21 in benign and malignant uterine smooth muscle tumors. Arch Gynecol Obstet 2011; 284(2): 483-490.
56. Zhang Q, Kanis MJ, Ubago J, et al. The selected biomarker analysis in 5 types of uterine smooth muscle tumors. Hum Pathol 2018; 76 : 17-27.
57. Zheng YY, Liu XB, Mao YY, Lin MH. Smooth muscle tumor of uncertain malignant potential (stump): A clinicopathologic analysis of 26 cases. Int J Clin Exp Pathol 2020; 13(4): 818-826.
58. Zhu XQ, Shi YF, Cheng XD, Zhao CL, Wu YZ. Immunohistochemical markers in differential diagnosis of endometrial stromal sarcoma and cellular leiomyoma. Gynecol Oncol 2004; 92(1): 71-79.
59. Ip PP, Lim D, Cheung ANY, Oliva E. Immunoexpression of p16 in uterine leiomyomas with infarct-type necrosis: An analysis of 35 cases. Histopathology 2017; 71(5): 743-750.
60. Slatter TL, Hsia H, Samaranayaka A, et al. Loss of atrx and daxx expression identifies poor prognosis for smooth muscle tumours of uncertain malignant potential and early stage uterine leiomyosarcoma. J Pathol Clin Res 2015; 1(2): 95-105.
61. Oliva E, Young RH, Clement PB, Bhan AK, Scully RE. Cellular benign mesenchymal tumors of the uterus. A comparative morphologic and immunohistochemical analysis of 33 highly cellular leiomyomas and six endometrial stromal nodules, two frequently confused tumors. Am J Surg Pathol 1995; 19(7): 757-768.
62. Oliva E. Cellular mesenchymal tumors of the uterus: A review emphasizing recent observations. Int J Gynecol Pathol 2014; 33(4): 374-384.
63. Agoff SN, Grieco VS, Garcia R, Gown AM. Immunohistochemical distinction of endometrial stromal sarcoma and cellular leiomyoma. Appl Immunohistochem Mol Morphol 2001; 9(2): 164-169.
64. Oliva E, Young RH, Amin MB, Clement PB. An immunohistochemical analysis of endometrial stromal and smooth muscle tumors of the uterus: A study of 54 cases emphasizing the importance of using a panel because of overlap in immunoreactivity for individual antibodies. Am J Surg Pathol 2002; 26(4): 403-412.
65. Rahimi S, Akaev I, Marani C, Chopra M, Yeoh CC. Immunohistochemical expression of different subtypes of cytokeratins by endometrial stromal sarcoma. Appl Immunohistochem Mol Morphol 2019; 27(6): 466-470.
66. Yilmaz A, Rush DS, Soslow RA. Endometrial stromal sarcomas with unusual histologic features: A report of 24 primary and metastatic tumors emphasizing fibroblastic and smooth muscle differentiation. Am J Surg Pathol 2002; 26(9): 1142-1150.
67. Dundr P, Fischerová D, Povýšil C, Cibula D, Zikan M. Myxoid mixed low-grade endometrial stromal sarcoma and smooth muscle tumor of the uterus. Case report. Cesk Patol 2012; 48(2): 103-106.
68. Davidson B, Micci F. Molecular characteristics of uterine sarcomas. Expert Rev Mol Diagn 2017; 17(5): 515-522.
69. Sreekantaiah C, Li FP, Weidner N, Sandberg AA. An endometrial stromal sarcoma with clonal cytogenetic abnormalities. Cancer Genet Cytogenet 1991; 55(2): 163-166.
70. Koontz JI, Soreng AL, Nucci M, et al. Frequent fusion of the jazf1 and jjaz1 genes in endometrial stromal tumors. Proc Natl Acad Sci U S A 2001; 98(11): 6348-6353.
71. Micci F, Panagopoulos I, Bjerkehagen B, Heim S. Consistent rearrangement of chromosomal band 6p21 with generation of fusion genes jazf1/phf1 and epc1/phf1 in endometrial stromal sarcoma. Cancer Res 2006; 66(1): 107-112.
72. Dewaele B, Przybyl J, Quattrone A, et al. Identification of a novel, recurrent mbtd1-cxorf67 fusion in low-grade endometrial stromal sarcoma. Int J Cancer 2014; 134(5): 1112-1122.
73. Panagopoulos I, Thorsen J, Gorunova L, et al. Fusion of the zc3h7b and bcor genes in endometrial stromal sarcomas carrying an x;22-translocation. Genes Chromosomes Cancer 2013; 52(7): 610-618.
74. Hoang LN, Aneja A, Conlon N, et al. Novel high-grade endometrial stromal sarcoma: A morphologic mimicker of myxoid leiomyosarcoma. Am J Surg Pathol 2017; 41(1): 12-24.
75. Ondic O, Bednarova B, Ptakova N, et al. ZC3H7B-BCOR high-grade endometrial stromal sarcoma may present as myoma nascens with cytoplasmic signet ring cell change. Virchows Arch 2020; 476(4): 615-619.
76. Chiang S, Ali R, Melnyk N, et al. Frequency of known gene rearrangements in endometrial stromal tumors. Am J Surg Pathol 2011; 35(9): 1364-1372.
77. Micci F, Gorunova L, Agostini A, et al. Cytogenetic and molecular profile of endometrial stromal sarcoma. Genes Chromosomes Cancer 2016; 55(11): 834-846.
78. Kolin DL, Dong F, Baltay M, et al. Smarca4-deficient undifferentiated uterine sarcoma (malignant rhabdoid tumor of the uterus): A clinicopathologic entity distinct from undifferentiated carcinoma. Mod Pathol 2018; 31(9): 1442-1456.
79. Lin DI, Allen JM, Hecht JL, et al. SMARCA4 inactivation defines a subset of undifferentiated uterine sarcomas with rhabdoid and small cell features and germline mutation association. Mod Pathol 2019; 32(11):1675-1687.
80. Mccluggage WG, Lee CH. YWHAE-NUTM2A/B translocated high-grade endometrial stromal sarcoma commonly expresses cd56 and cd99. Int J Gynecol Pathol 2019; 38(6): 528-532.
81. Shah VI, Mccluggage WG. Cyclin D1 does not distinguish YWHAE-NUTM2 high-grade endometrial stromal sarcoma from undifferentiated endometrial carcinoma. Am J Surg Pathol 2015; 39(5): 722-724.
82. Kao YC, Sung YS, Zhang L, et al. Recurrent bcor internal tandem duplication and ywhae-nutm2b fusions in soft tissue undifferentiated round cell sarcoma of infancy: Overlapping genetic features with clear cell sarcoma of kidney. Am J Surg Pathol 2016; 40(8): 1009-1020.
83. Mansor S, Kuick CH, Lim SL, et al. ZC3H7B-BCOR-rearranged endometrial stromal sarcomas: A distinct subset merits its own classification? Int J Gynecol Pathol 2018;
84. Marino-Enriquez A, Lauria A, Przybyl J, et al. BCOR internal tandem duplication in high-grade uterine sarcomas. Am J Surg Pathol 2018; 42(3): 335-341.
85. Chiang S, Cotzia P, Hyman DM, et al. NTRK fusions define a novel uterine sarcoma subtype with features of fibrosarcoma. Am J Surg Pathol 2018; 42(6): 791-798.
86. Lee CH, Ali RH, Rouzbahman M, et al. Cyclin D1 as a diagnostic immunomarker for endometrial stromal sarcoma with YWHAE-FAM22 rearrangement. Am J Surg Pathol 2012; 36(10): 1562-1570.
87. Lee CH, Marino-Enriquez A, Ou W, et al. The clinicopathologic features of YWHAE-FAM22 endometrial stromal sarcomas: A histologically high-grade and clinically aggressive tumor. Am J Surg Pathol 2012; 36(5): 641-653.
88. Lee CH, Hoang LN, Yip S, et al. Frequent expression of kit in endometrial stromal sarcoma with ywhae genetic rearrangement. Mod Pathol 2014; 27(5): 751-757.
89. Isphording A, Ali RH, Irving J, et al. Ywhae-fam22 endometrial stromal sarcoma: Diagnosis by reverse transcription-polymerase chain reaction in formalin-fixed, paraffin-embedded tumor. Hum Pathol 2013; 44(5): 837-843.
90. Lewis N, Soslow RA, Delair DF, et al. ZC3H7B-BCOR high-grade endometrial stromal sarcomas: A report of 17 cases of a newly defined entity. Mod Pathol 2018; 31(4): 674-684.
91. Mills AM, Karamchandani JR, Vogel H, Longacre TA. Endocervical fibroblastic malignant peripheral nerve sheath tumor (neurofibrosarcoma): Report of a novel entity possibly related to endocervical CD34 fibrocytes. Am J Surg Pathol 2011; 35(3): 404-412.
92. Kurihara S, Oda Y, Ohishi Y, et al. Endometrial stromal sarcomas and related high-grade sarcomas: Immunohistochemical and molecular genetic study of 31 cases. Am J Surg Pathol 2008; 32(8): 1228-1238.
93. Bartosch C, Exposito MI, Lopes JM. Low-grade endometrial stromal sarcoma and undifferentiated endometrial sarcoma: A comparative analysis emphasizing the importance of distinguishing between these two groups. Int J Surg Pathol 2010; 18(4): 286-291.
94. Jakate K, Azimi F, Ali RH, et al. Endometrial sarcomas: An immunohistochemical and JAZF1 re-arrangement study in low-grade and undifferentiated tumors. Mod Pathol 2013; 26(1): 95-105.
95. Sciallis AP, Bedroske PP, Schoolmeester JK, et al. High-grade endometrial stromal sarcomas: A clinicopathologic study of a group of tumors with heterogenous morphologic and genetic features. Am J Surg Pathol 2014; 38(9): 1161-1172.
96. Stikova Z, Ptakova N, Horakova M, Kostun J, Ondic O. Inflammatory myofibroblastic tumor of the uterus - case report. Cesk Patol 2019; 55(4): 239-243.
97. Bennett JA, Nardi V, Rouzbahman M, et al. Inflammatory myofibroblastic tumor of the uterus: A clinicopathological, immunohistochemical, and molecular analysis of 13 cases highlighting their broad morphologic spectrum. Mod Pathol 2017; 30(10): 1489-1503.
98. Shukla PS, Mittal K. Inflammatory myofibroblastic tumor in female genital tract. Arch Pathol Lab Med 2019; 143(1): 122-129.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Novinky v gynekopatologiiČlánek ′ NEUROPATOLOGIEČlánek ′ NEFROPATOLOGIEČlánek ′ GYNEKOPATOLOGIEČlánek ′ UROPATOLOGIEČlánek ′ KARDIOPATOLOGIEČlánek ′ HEPATOPATOLOGIEČlánek ′ PATOLOGIE MĚKKÝCH TKÁNÍČlánek ′ PATOLOGIE GITČlánek ′ HEMATOPATOLOGIEČlánek ′ ENDOKRINOPATOLOGIEČlánek ′ CYTODIAGNOSTIKAČlánek ′ PATOLOGIE GITČlánek ′ HEMATOPATOLOGIEČlánek ′ PATOLOGIE MĚKKÝCH TKÁNÍČlánek ′ PATOLOGIE ORL OBLASTIČlánek ′ PULMOPATOLOGIE
Článek vyšel v časopiseČesko-slovenská patologie

2021 Číslo 2-
Všechny články tohoto čísla
- Kazuistika: Gaucherova choroba v biopsii kostní dřeně 16 leté dívky vyšetřované pro podezření na myelodysplastický syndrom
- Kazuistika: Postižení ledvin u pacientky s Crohnovou chorobou
- Vilém Dušan Lambl na Charkovské císařské Univerzitě (1861-1871): biografie.
- Prof. MUDr. Rostislav Koďousek, Dr.Sc. in memoriam
- Spomienka na emeritného primára MUDr. Jozefa Maťošku, CSc.
- Novinky v gynekopatologii
- Patologové by měli mít větší prostor pro popularizaci svého oboru
- ′ NEUROPATOLOGIE
- ′ NEFROPATOLOGIE
- ′ GYNEKOPATOLOGIE
- ′ UROPATOLOGIE
- ′ KARDIOPATOLOGIE
- ′ HEPATOPATOLOGIE
- ′ PATOLOGIE MĚKKÝCH TKÁNÍ
- ′ PATOLOGIE GIT
- ′ HEMATOPATOLOGIE
- ′ ENDOKRINOPATOLOGIE
- ′ CYTODIAGNOSTIKA
- ′ PATOLOGIE GIT
- ′ HEMATOPATOLOGIE
- ′ PATOLOGIE MĚKKÝCH TKÁNÍ
- ′ PATOLOGIE ORL OBLASTI
- ′ PULMOPATOLOGIE
- Význam imunohistochemických metod v diagnostice karcinomu endometria
- Význam imunohistochemických metod v diagnostice mezenchymálních nádorů dělohy
- Gynekologické léze u hereditárních nádorových syndromů
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Význam imunohistochemických metod v diagnostice karcinomu endometria
- Gynekologické léze u hereditárních nádorových syndromů
- Kazuistika: Postižení ledvin u pacientky s Crohnovou chorobou
- Význam imunohistochemických metod v diagnostice mezenchymálních nádorů dělohy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



