-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNovinky v histopatologické klasifikaci neuroendokrinních nádorů v 5. vydání WHO klasifikace nádorů trávicího traktu (2019)
Changes in histopathological classification of neuroendocrine tumors in 5th edition of WHO classification of gastrointestinal tract tumors (2019)
In a brief review is presented a summary of news in the classification of neuroendocrine neoplasms of the digestive system, as they were introduced in the 5th edition of the WHO Classification of Digestive System Tumors published in summer 2019.
Keywords:
neuroendocrine neoplasia – NEN – NET – NEC – MiNEN – WHO classification
Autoři: Tomáš Jirásek 1; Václav Mandys 2
Působiště autorů: Oddělení patologie, Centrum PATOS, Krajská nemocnice Liberec, a. s. 1; Ústav patologie 3. LF UK a Fakultní nemocnice Královské Vinohrady, Praha. 2
Vyšlo v časopise: Čes.-slov. Patol., 56, 2020, No. 4, p. 207-211
Kategorie: Přehledový článek
Souhrn
V krátkém přehledovém sdělení jsou uvedeny změny v klasifikaci neuroendokrinních nádorů trávicího traktu, které byly publikovány v 5. vydání WHO klasifikace nádorů trávicího ústrojí v létě 2019.
Klíčová slova:
neuroendokrinní neoplázie – NEN – NET – NEC – MiNEN – WHO klasifikace
Neuroendokrinní nádory trávicího ústrojí představují relativně vzácné afekce, jejichž frekvence záchytu ale postupně vzrůstá (1). Původně byly označovány jako „karcinoid“, podle práce publikované Oberndorferem v roce 1907 (2).
V druhé polovině 20. století byly „karcinoidy“ histopatologicky roztříděny podle klasifikace Sogy a Tazawy na několik typů karcinoidu typického a karcinoid atypický (3). V roce 2000 byla publikována zcela odlišná klasifikace těchto nádorů lokalizovaných v trávicím ústrojí (4), zatímco v plicní lokalizaci původní dělení na typické a atypické karcinoidy přetrvává dosud (5,6). Klasifikace WHO z roku 2000 a následná zpřesnění v letech 2002-2004 (7-9) zavedly zcela nové označení nádorů: dobře diferencovaný endokrinní tumor - „karcinoid“ (benigního nebo nejistého biologického chování), dobře diferencovaný endokrinní karcinom - „maligní karcinoid“ (maligního chování) a málo diferencovaný endokrinní karcinom (malobuněčný karcinom). Hlavní důraz v diagnóze byl kladen na histopatologickou morfologii, v kombinaci s imunohistochemickým průkazem chromograninu-A a synaptofyzinu a stanovením mitotické a proliferační aktivity nádorových buněk (tzv. Ki-67 index). Klasifikace obsahovala i bližší diagnostická kritéria pro smíšené nádory, které byly označeny jako smíšené exokrinní - endokrinní karcinomy. Navíc byly nádory v jednotlivých lokalizacích poměrně komplikovaně zařazovány do jednotlivých kategorií i podle tzv. klinicko-patologické korelace.
Závěry intenzivní diskuze zaměřené na klady a problémy klasifikace z roku 2000 byly formulovány ve WHO klasifikaci nádorů trávicího ústrojí z roku 2010 (10). Nově byly definovány dobře diferencované neuroendokrinní tumory (NET), v gastrointestinálním traktu (GIT) odpovídající původnímu „karcinoidu“. Na základě hodnocení proliferační a mitotické aktivity nádorových buněk byl určen grade NET na G1 a G2. Dále byly definovány nízce diferencované neuroendokrinní karcinomy (NEC), s podkategoriemi neuroendokrinního karcinomu malobuněčného a velkobuněčného; podle vysoké mitotické a proliferační aktivity nádorových buněk pouze G3. Na rozdíl od předchozích klasifikací byla převážná většina gastroenteropankreatických NET zařazena jako nádory maligní (/3) podle Mezinárodní klasifikace nemocí pro onkologii (MKN-O-3). Pro smíšené nádory bylo zavedeno nové pojmenování - smíšený adenoneuroendokrinní karcinom (mixed adenoneuroendocrine carcinoma – MANEC) a jako diagnostické kritérium bylo arbitrárně určeno minimální zastoupení jak adenokarcinomové, tak i neuroendokrinní komponenty na nejméně 30 % objemu nádoru.
Poslední 5. vydání WHO klasifikace nádorů trávicího ústrojí z roku 2019 (11) uvádí i upravenou klasifikaci neuroendokrinních nádorů, vycházející z klasifikace publikované v roce 2010. Změny nejsou zásadní a týkají se následujících oblastí (viz též Tabulka 1.):
- Nové skupinové označení neuroendokrinní nádory (neuroendocrine neoplasms - NEN).
- Rozšíření diferencovaných neuroendokrinních tumorů (NET) o kategorii NET G3 (obr. 1). NET je stále definován jako dobře diferencovaný neuroendokrinní nádor, sestávající z cytologicky většinou pravidelných polygonálních buněk uspořádaných do solidních hnízd, nebo trabekulárních (pentlicovitých) formací; méně obvyklá je tvorba většinou drobných tubulárních struktur. V některých nádorech mohou být tyto struktury kombinované. Nádorové buňky vykazují imunohistochemickou pozitivitu znaků neuroendokrinní diferenciace, pro základní histopatologickou diagnózu je doporučena detekce chromograninu-A a synaptofysinu. NET G1 jsou definovány velmi nízkou mitotickou aktivitou nádorových buněk, méně než 2 mitózy na 10 zorných polí mikroskopu při velkém zvětšení objektivu (HPF) a velmi nízkou proliferační aktivitou hodnocenou pomocí imunohistochemické detekce Ki-67 (Ki-67 index < 3 %). NET G2 jsou definovány zvýšenou mitotickou aktivitou nádorových buněk (2–20 mitóz/10 HPF) a jejich zvýšenou proliferační aktivitou (Ki-67 index 3–20 %). Nově zavedenou kategorii NETů představuje NET G3, vykazující vyšší mitotickou aktivitou nádorových buněk (>20 mitóz/10 HPF) a vyšší proliferační aktivitu (Ki-67 index >20 %). Proti původním návrhům není zaveden žádný horní limit ani pro mitotickou, ani pro proliferační aktivitu NET G3, původně navrhovaná hranice 55 % (13) se do finální klasifikace neprosadila. Z dostupných pramenů vyplývá, že NET G3 se nejčastěji vyskytuje v pankreatu (14). Z důvodu srozumitelnosti i s ohledem na možné riziko záměny s NEC doporučuje nová klasifikace vždy v textu nálezu použít i zkratkový výraz NET G3. Jako klíčové se jeví odlišení NET G3 od NEC. Samotné stanovení mitotické a proliferační aktivity nádoru k odlišení NET a NEC nestačí, základem je mikroskopický obraz – NET G3 je histologicky dobře diferencovaný, NEC je nízce diferencovaný (malobuněčný nebo velkobuněčný karcinom). K pomocným kritériím v rozlišení patří u pankreatických nádorů genetické vyšetření: pro NET G3 svědčí záchyt mutací genů MEN1, DAXX, ATRX a dalších tzv. chromatin remodelujících genů, zatímco pro NEC svědčí změny v genech TP53 a RB1. Typický imunoprofil NEC zahrnuje jadernou akumulaci p53, negativní průkaz exprese RB1 a ISL1 a zachovalou expresi DAXX a ATRX v nádorových buňkách. Genetické testování v současné době nepředstavuje rutinní nástroj k odlišení NET G3 a NEC v podmínkách běžného diagnostického provozu. V případě diagnostických rozpaků lze doporučit testování změn minimálně v genech TP53 a RB1, jejichž alterace favorizuje možnost NEC. Dalším pomocným kritériem může být podle WHO klasifikace anamnéza: pokud u pacienta s dříve diagnostikovaným NET (zpravidla NET G1, nebo NET G2) se vyskytne recidiva/metastatické postižení NEN, je doporučeno se při odpovídajících hodnotách mitotické a proliferační aktivity přiklonit k možnosti NET G3; výjimku představují nádory s nepochybnými histologickými znaky odpovídajícími velkobuněčnému neuroendokrinnímu karcinomu (large cell neuroendocrine carcinoma – LCNEC), či malobuněčnému neuroendokrinnímu karcinomu (small cell neuroendocrine carcinoma - SCNEC). Je totiž známo, že část pacientů s anamnézou NET a recidivou/metastatickým postižením, hodnoceným jako NEC, nereagovala na chemoterapii indikovanou na NEC a přežívala déle, než by odpovídalo diagnóze NEC (15). U této skupiny nemocných, kde se klinický průběh velmi podobá pacientům s NET G1/G2, se předpokládá, že v ložiscích progrese se jedná o NET G3 a ne o NEC. Neuroendokrinní karcinom (NEC) je definován jako nízce diferencovaný maligní nádor, sestávající z malých, fenotypicky primitivních nebo intermediárních buněk (malobuněčný karcinom - SCNEC), nebo z velkých buněk, často s vezikulárními jádry a obšírnější cytoplazmou (velkobuněčný karcinom – LCNEC) – viz obr. 2. Nádorové buňky vykazují vysokou aktivitu mitotickou (> 20 mitóz/ 10 HPF) i proliferační (Ki-67 index > 20 %). Znaky neuroendokrinní diferenciace jsou vyjádřeny variabilně, nejčastěji je difuzně pozitivní synaptofyzin (obr. 3). Podle WHO klasifikace jsou pro diagnózu NEC požadovány jak odpovídající histopatologický nález, tak imunohistochemický průkaz znaků neuroendokrinní diferenciace (zejména synaptofysinu, nebo chromograninu-A). V klasifikaci WHO je jednoznačně doporučeno (z důvodu možné záměny NET G3 a NEC) nepoužívat v textu nálezu u diagnózy neuroendokrinního karcinomu dříve často užívanou zkratku NEC (G3), ale pouze zkratku NEC (s možností označení malobuněčného typu - SCNEC, či velkobuněčného typu - LCNEC).
- Všechny NEN jsou klasifikovány jako maligní. Jedinou výjimkou je neuroendokrinní mikroadenom pankreatu, klasifikovaný jako benigní (M-8150/0).
- Změna označení smíšených nádorů: nově smíšený neuroendokrinní/non-neuroendokrinní nádor (MiNEN) – obr. 4, definovaný jako nádor tvořený dvěma komponentami, jednak karcinomem (adenokarcinom, dlaždicobuněčný karcinom - SCC, acinický karcinom), popřípadě i adenomem (byť ne ve všech lokalitách na tom panuje shoda), jednak neuroendokrinním nádorem. Arbitrárně bylo stanoveno, že každá z těchto komponent musí tvořit minimálně 30 % nádoru. Z toho vyplývá, že přítomnost ojedinělých rozptýlených neuroendokrinních buněk v karcinomu jiné morfologie neopravňuje k diagnóze MiNEN. Původní MANEC tedy v současné době představuje nejčastější „podmnožinu“ v kategorii MiNEN.
- Zrušení jednotky „karcinoid z pohárkových buněk“ (goblet cell carcinoid). Tento nádor, který se nejčastěji vyskytuje v apendixu, byl přeřazen do skupiny adenokarcinomu s novým označením „adenokarcinom z pohárkových buněk (goblet cell adenocarcinoma)“.
- Je uvedena i možnost primárních NEN jater, které nebyly ve WHO klasifikaci z roku 2010 zahrnuty/zmíněny. Neuroendokrinní nádory jater odpovídají základnímu schématu klasifikace, popsanému výše; dle literárních zdrojů jsou NEN jako primární v játrech popsány, nicméně velmi vzácné. Diagnóza je vždy per exclusionem; při záchytu NEN v játrech je nutné vždy vyloučit mnohem častější možnost metastatického postižení nádorem z jiné primární lokalizace. Jako zajímavost WHO klasifikace zmiňuje, že primární NET G3 jater nebyl doposud v literatuře popsán.
- U stanovení proliferační aktivity nádorových buněk (Ki-67 indexu) je evidentní postupný odklon od semikvantitativního hodnocení, jak uvádí WHO klasifikace nádorů endokrinních orgánů z roku 2017. Proliferační aktivita NEN se stanovuje podle procentuálního zastoupení nádorových buněk s Ki-67 jadernou pozitivitou, nově hodnoceného v nejméně 500 buňkách v oblastech nádoru s nejvyšší pozitivitou (tzv. hotspots). Pokud není pro hodnocení k dispozici morfometrická analýza, je doporučeno oblast „hotspots“ vizualizovat, vytisknout a manuálně stanovit počty pozitivních a negativních nádorových buněk. Mitotickou aktivitu je doporučeno stanovovat v padesáti zorných polích velkého zvětšení (HPF; plocha každého 0,2 mm2). V případě rozdílných hodnot mezi oběma metodami pro stanovení gradu nádoru (mitotická/proliferační aktivita) je pro určení grade nádoru rozhodující hodnota vyšší.
- Část NEN vzniká na podkladě známých hereditárních nádorových syndromů, jako jsou mnohotná endokrinní neoplázie typ 1 (MEN-1), von Hippel-Lindau syndrom (VHL), neurofibromatóza typ 1 (NF1), tuberózní skleróza, hyperplazie a neoplazie glukagon produkujících buněk a familiální insulinomatóza (16-19). Nově byl popsán familiálně vázaný výskyt mutací ATP4A genu, kódujícího část protonové pumpy, spojený s rozvojem NETů z ECL buněk v oblasti žaludku (20).
Tab. 1. Porovnání klasifikace NEN trávicího traktu dle WHO 2010 a 2019. 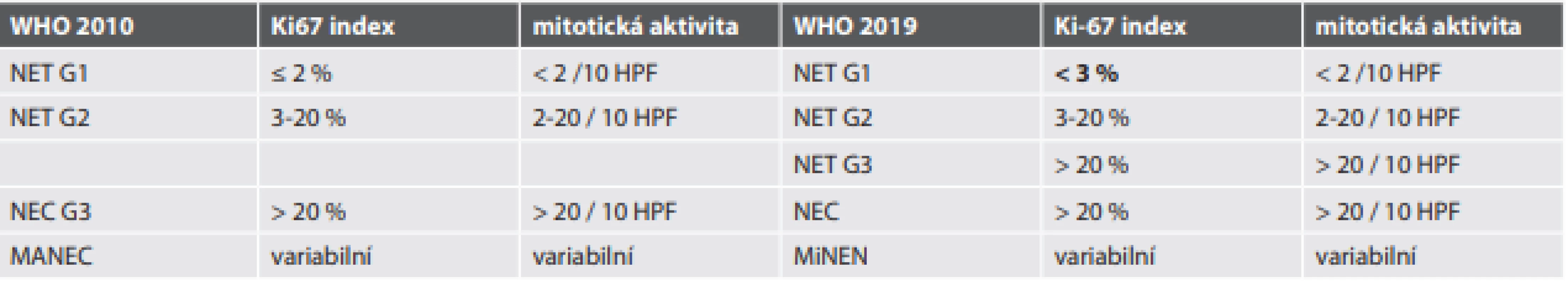
NEN = neuroendokrinní neoplázie; WHO = Světová zdravotnická organizace; NET = neuroendokrinní tumor, HPF = high power fi eld; NET = neuroendokrinní tumor; NEC = neuroendokrinní karcinom; MANEC = mixed adenoneuroendocrine carcinoma; MiNEN = mixed neuroendocrine - non-neuroendocrine neoplasm; G = grade Obr. 1. Morfologické spektrum neuroendokrinních tumorů (NET). 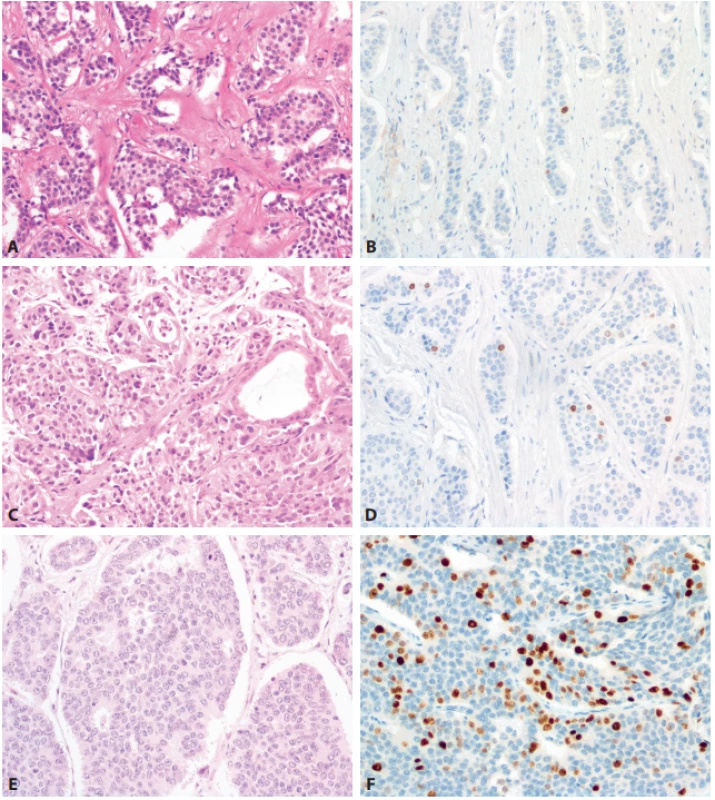
A – NET G1 (HE, 200x), B – NET G1, proliferační aktivita (Ki-67, 200x), C – NET G2 (HE, 200x), D – NET G2, proliferační aktivita (Ki-67, 200x), E – NET G3 (HE, 200x), F – NET G3, proliferační aktivita (Ki-67, 200x). Obr. 2. Morfologické spektrum neuroendokrinních karcinomů (NEC). 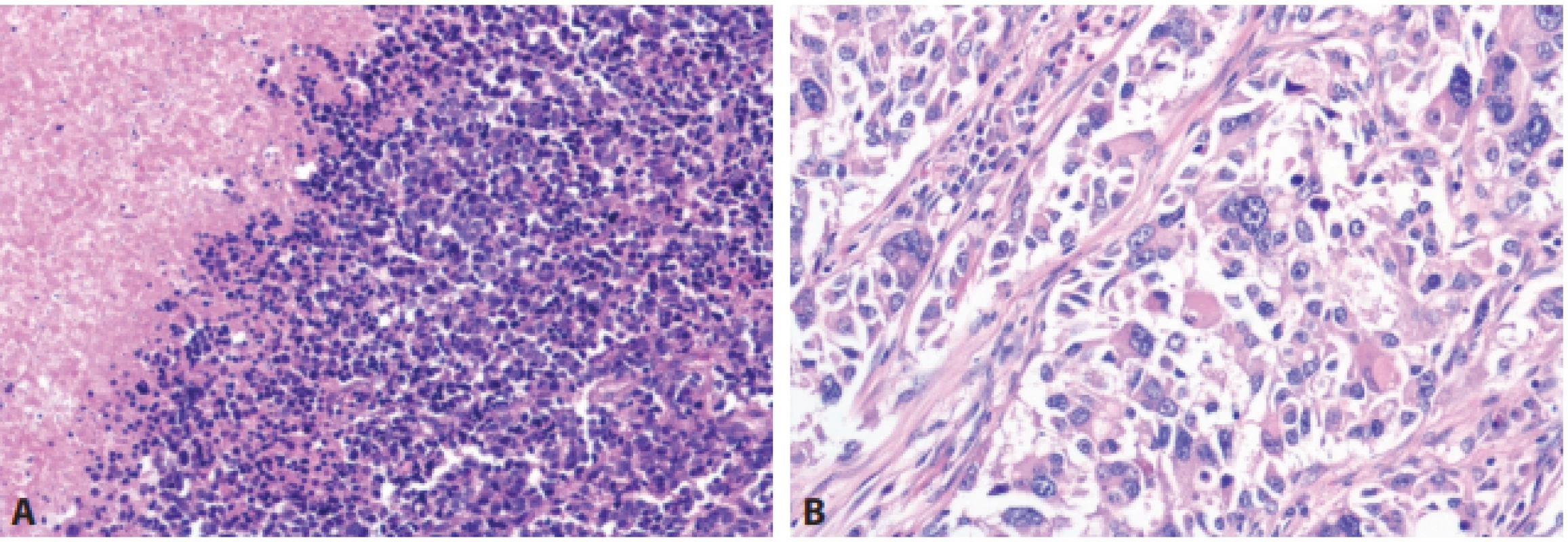
A – Malobuněčný NEC (HE, 200x), B – Velkobuněčný NEC (HE, 200x). Obr. 3. Základní imunohistochemické reakce u neuroendokrinních neoplázií (NEN). 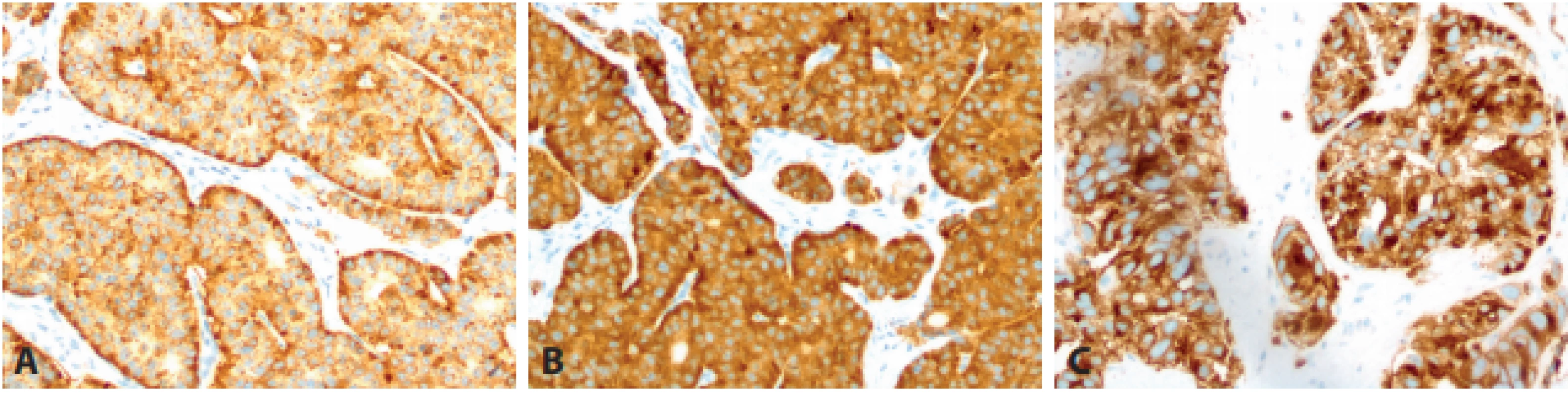
A – imunodetekce chromograninu-A u NET (HE, 200x), B – imunodetekce synaptofyzinu u NET (HE, 200x), C – imunodetekce synaptofyzinu u malobuněčného NEC (HE, 200x). Obr. 4. Smíšená neuroendokrinní-non-neuroendokrinní neoplázie (MiNEN). 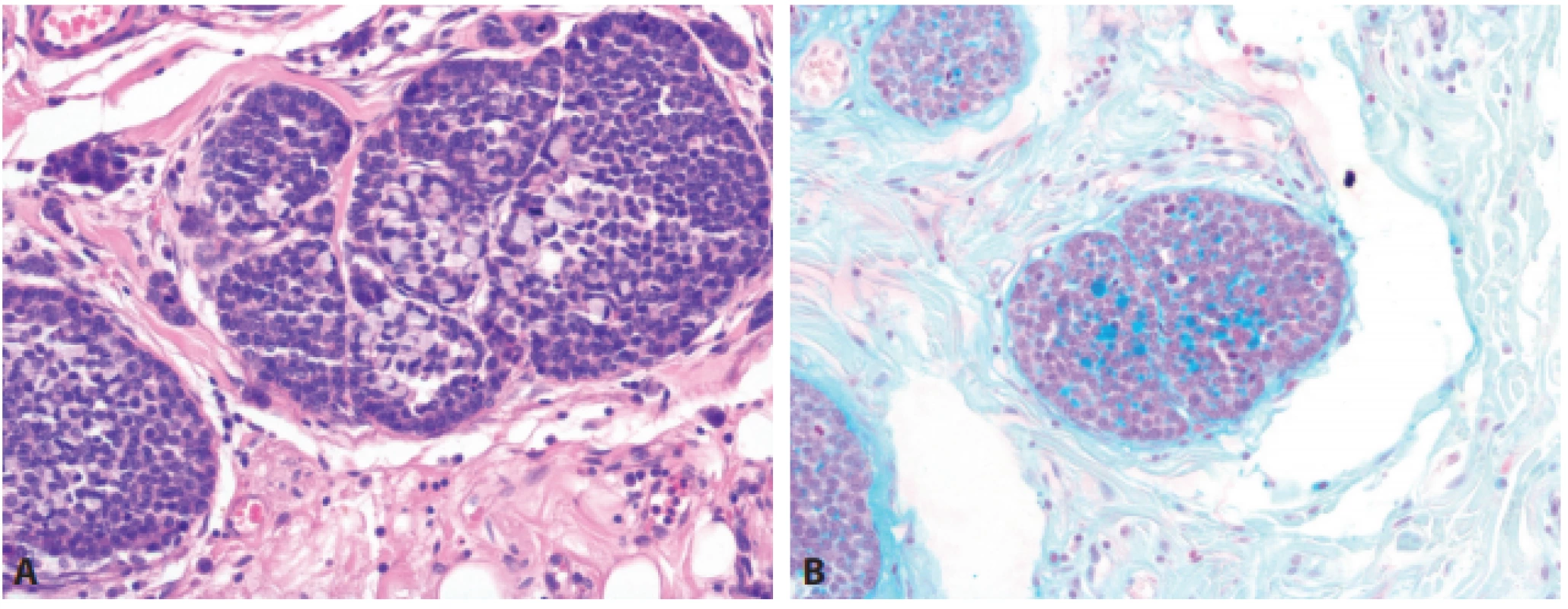
A – MiNEN (HE, 200x), B – průkaz hlenotvorby v nádoru (alciánová modř, 200x). ZÁVĚR
Nově upravená WHO klasifikace neuroendokrinních nádorů je nesporně přínosem pro sjednocení a zpřesnění diagnostických kritérií NEN. Podrobné informace pro praktickou bioptickou diagnostiku NEN uvádí „Doporučený postup pro histologické vyšetření neuroendokrinních nádorů trávicího ústrojí“, který bude vydán Společností českých patologů ČLS JEP.
PODĚKOVÁNÍ
Práce byla podpořena výzkumným projektem University Karlovy PROGRES Q28 - Onkologie.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
doc. MUDr. Tomáš Jirásek, Ph.D.
Oddělení patologie, Centrum PATOS
Husova 357/10, 460 63, Liberec
tel: 485 312 303
e-mail: tomas.jirasek@nemlib.cz
Zdroje
1. Zheng Z, Chen C, Jiang L, et al. Incidence and risk factors of gastrointestinal neuroendocrine neoplasm metastasis in liver, lung, bone, and brain: A population-based study. Cancer Med 2019; 8(17): 7288-7298.
2. Modlin IM, Shapiro MD, Kidd M. Siegfried Oberndorfer: origins and perspectives of carcinoid tumors. Hum Pathol 2004; 35(12): 1440-1451.
3. Soga J, Tazawa K. Pathologic analysis of carcinoids. Histologic reevaluation of 62 cases. Cancer 1971; 28(4): 990-998.
4. Solcia E, Klöppel G, Sobin LH. Histological typing of endocrine tumours (2nd edn). Berlin - New York: Springer; 2000 : 56-72.
5. Travis,WD, Brambilla E, Burke AP, Marx A, Nicholson AG. WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart (4th edn). Lyon (France): IARC; 2017 : 63-77.
6. Matěj R, Dundr P, Hornychová H, Ryška A, Tichá I. Nádory plic – doporučený postup pro bioptické vyšetření. Praha: Společnost českých patologů ČLS JEP; 2019 : 9-14.
7. Bordi C, D‘Adda T, Pizzi S, Crafa P, Rindi G. The assessment of malignancy in endocrine tumours of the gastrointestinal tract. Current Diagnostic Pathology 2002; 8(6): 421-429.
8. Rindi G, Klöppel G. Endocrine tumors of the gut and pancreas tumor biology and classification. Neuroendocrinology 2004; 80 (Suppl 1): 12-15.
9. Plöckinger U, Rindi G, Arnold R, et al. Guidelines for the diagnosis and treatment of neuroendocrine gastrointestinal tumours. A consensus statement on behalf of the European Neuroendocrine Tumour Society (ENETS). Neuroendocrinology 2004; 80(6): 394-424.
10. Bosman FT, Carneiro F, Hruban RH, Theise ND. WHO Classification of Tumours of the Digestive system (4th edn). Lyon (France): IARC; 2010 : 13-14.
11. WHO Classification of Tumours Editorial Board. Digestive system tumours (5th edn). Lyon (France): IARC; 2019 : 16-19.
12. Lloyd RV, Osamura RY, Klöppel G, et al. WHO Classification of Tumours of Endocrine Organs (4th edition). Lyon (France): IARC; 2017 : 210-239.
13. Basturk O, Yang Z, Tang LH, et al. The high-grade (WHO G3) pancreatic neuroendocrine tumor category is morphologically and biologically heterogenous and includes both well differentiated and poorly differentiated neoplasms. Am J Surg Pathol 2015; 39(5): 683-690.
14. Heetfeld M, Chougnet CN, Olsen IH, et al. Characteristics and treatment of patients with G3 gastroenteropancreatic neuroendocrine neoplasms. Endocr Relat Cancer 2015; 22(4): 657-664.
15. Tang LH, Untch BR, Reidy DL, et al. Well-Differentiated Neuroendocrine Tumors with a Morphologically Apparent High-Grade Component: A Pathway Distinct from Poorly Differentiated Neuroendocrine Carcinomas. Clin Cancer Res 2016; 22(4): 1011-1017.
16. Esposito I, Segler A, Steiger K, Klöppel G. Pathology, genetics and precursors of human and experimental pancreatic neoplasms: An update. Pancreatology 2015; 15(6): 598-610.
17. Sipos B, Sperveslage J, Anlauf M, et al. Glucagon cell hyperplasia and neoplasia with and without glucagon receptor mutations. J Clin Endocrinol Metab 2015; 100(5): 783-788.
18. Noë M, Pea A, Luchini C, et al. Whole-exome sequencing of duodenal neuroendocrine tumors in patients with neurofibromatosis type 1. Mod Pathol 2018; 31(10): 1532-1538.
19. Iacovazzo D, Flanagan SE, Walker E, et al. MAFA missense mutation causes familial insulinomatosis and diabetes mellitus. Proc Natl Acad Sci U S A 2018; 115(5): 1027-1032.
20. Fossmark R, Calvete O, Mjønes P, Benitez J, Waldum HL. ECL-cell carcinoids and carcinoma in patients homozygous for an inactivating mutation in the gastric H (+) K (+) ATPase alpha subunit. APMIS 2016; 124(7): 561-566.
Štítky
Patologie Soudní lékařství Toxikologie
Článek ′ UROPATOLOGIEČlánek ′ KARDIOPATOLOGIEČlánek ′ PATOLOGIE ORL OBLASTIČlánek ′ PULMOPATOLOGIEČlánek ′ PATOLOGIE GITČlánek ′ HEPATOPATOLOGIEČlánek ′ PATOLOGIE MĚKKÝCH TKÁNÍČlánek ′ PULMOPATOLOGIEČlánek ′ NEFROPATOLOGIEČlánek ′ GYNEKOPATOLOGIEČlánek ′ KARDIOPATOLOGIEČlánek ′ CYTODIAGNOSTIKAČlánek ′ NEUROPATOLOGIEČlánek ′ GYNEKOPATOLOGIE
Článek vyšel v časopiseČesko-slovenská patologie

2020 Číslo 4-
Všechny články tohoto čísla
- Gastrointestinální trakt – WHO klasifikace, imunohistochemie a molekulární genetika
- Chtěl jsem být bankovní lupič, ale nevěděl jsem, kde se na to studuje
- ′ UROPATOLOGIE
- ′ PATOLOGIE SERÓZNÍCH POVRCHŮ
- ′ KARDIOPATOLOGIE
- ′ PATOLOGIE ORL OBLASTI
- ′ PULMOPATOLOGIE
- ′ PATOLOGIE GIT
- ′ HEPATOPATOLOGIE
- ′ PATOLOGIE MĚKKÝCH TKÁNÍ
- ′ PULMOPATOLOGIE
- ′ NEFROPATOLOGIE
- ′ GYNEKOPATOLOGIE
- ′ KARDIOPATOLOGIE
- Novinky v páté verzi WHO klasifikace nádorů trávicího systému – 1. Gastrointestinální trakt
- ′ CYTODIAGNOSTIKA
- Novinky v histopatologické klasifikaci neuroendokrinních nádorů v 5. vydání WHO klasifikace nádorů trávicího traktu (2019)
- ′ NEUROPATOLOGIE
- Imunohistochemie a molekulární genetika v diferenciální diagnostice mezenchymálních lézí gastrointestinálního traktu
- Mukormykóza u imunokompetentního pacienta: Kazuistika a přehled literatury
- Myokarditida pravé komory srdeční indukovaná plicní trombembolií
- Prof. MUDr. Ľudovít Danihel, PhD. jubiluje.
- ′ GYNEKOPATOLOGIE
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chtěl jsem být bankovní lupič, ale nevěděl jsem, kde se na to studuje
- Novinky v páté verzi WHO klasifikace nádorů trávicího systému – 1. Gastrointestinální trakt
- Prof. MUDr. Ľudovít Danihel, PhD. jubiluje.
- Novinky v histopatologické klasifikaci neuroendokrinních nádorů v 5. vydání WHO klasifikace nádorů trávicího traktu (2019)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



