-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Imunohistochemie a molekulární genetika v diferenciální diagnostice mezenchymálních lézí gastrointestinálního traktu
Immunohistochemistry and molecular genetics in the differential diagnostics of mesenchymal lesions of gastrointestinal tract
Although, in routine practice, the differential diagnostics of mesenchymal tumors of the gastrointestinal tract is still focused mainly on the correct diagnosis of gastrointestinal stromal tumor and its further therapeutic management based on predictive diagnostics, recent progress in the development of endoscopic techniques has led to increased detection of other mesenchymal lesions, which were previously commonly neglected due to their small size or absence of symptoms requiring surgical exploration. Diagnosis of some of these lesions may be reached based on their histologic pattern alone, while others may be recognized with the use of tissue specific antibodies related to the probable lineage of differentiation of the neoplastic cells. Finally, a subset of tumors, commonly with uncertain lineage of differentiation, is defined by pathognomonic genetic alterations of neoplastic cells. Recognition of such alterations, based either on methods of molecular genetics or immunohistochemical detection of an altered protein product, enables a precise diagnosis in a growing number of these cases. However, regarding the fact that most of these alterations are not unique to a single tumor type, but are often shared by more neoplastic entities, the diagnosis must still be based on a complex diagnostic attitude, reflecting histological, immunohistochemical and molecular genetic features of the investigated tumor.
Keywords:
Gastrointestinal tract – digestive tract – mesenchymal tumors – differential diagnostics – immunohistochemistry – Molecular genetics
Autoři: Magdaléna Daumová 1,2; Bohuslava Vaňková 1,2; Marián Švajdler 1,2; Michal Michal 1
; Ondřej Daum 1,2
Působiště autorů: Šiklův ústav patologie LF UK a FN Plzeň 1; Bioptická laboratoř s. r. o., Plzeň 2
Vyšlo v časopise: Čes.-slov. Patol., 56, 2020, No. 4, p. 212-220
Kategorie: Přehledový článek
Souhrn
V rutinním diagnostickém provozu se problematika diagnostiky mezenchymálních nádorů gastrointestinálního traktu až na výjimky často zužuje na potvrzení diagnózy gastrointestinálního stromálního tumoru a jeho další diagnosticko-terapeutický management. S rozvojem endoskopických technik však narůstá i množství bioptovaných mezenchymálních lézí, které dříve často pro malé rozměry a asymptomatický průběh unikaly pozornosti. Část z nich je diagnostikovatelná již na základě charakteristického histologického obrazu, k diagnóze některých lze přispět užitím tkáňově specifických protilátek ve vztahu k předpokládané diferenciační linii nádorové buňky. Vzácné však nejsou ani případy s nejasnou linií diferenciace, jejichž precizní diagnóza je založena na detekci patognomické genetické alterace nádorových buněk prokazatelné metodami molekulární biologie a v některých případech i imunohistochemickou vizualizací alterovaného proteinového produktu. Vzhledem k tomu, že tyto genetické alterace většinou nejsou unikátní, ale mohou se vyskytovat v různých typech nádorů, je stále nutné dodržovat komplexní diagnostický přístup se zohledněním znaků histologických, imunohistochemických a molekulárně genetických.
Klíčová slova:
gastrointestinální trakt – trávicí trakt – mezenchymální nádory – diferenciální diagnostika – imunohistochemie – molekulární genetika
Problematika mezenchymálních nádorů trávicího traktu je, s výjimkou jícnu, převážně problematikou gastrointestinálního stromálního tumoru (GIST), který je zdaleka nejčastějším nádorem této kategorie. Vzhledem k závažným prognostickým a terapeutickým asociacím diagnózy GIST je vhodné jeho diagnózu ověřit imunohistochemicky (případně i molekulárně geneticky) i v histologicky typických případech. Podezření na jiné mezenchymové nádory a pseudotumory může vzniknout kvůli netypické lokalizaci, neobvyklému histologickému obrazu a/nebo atypickému imunoprofilu. Na těchto parametrech je založen kombinovaný diagnostický algoritmus představený v tomto přehledovém článku.
DIAGNOSTICKÝ ALGORITMUS
Centrálním bodem v diferenciální diagnostice mezenchymálních nádorů GIT je použití základního imunohistochemického panelu sestávajícího z protilátek proti antigenům KIT (CD117), desminu a proteinu S100 na nádory mezenchymálního vzhledu, tedy obecně lokalizované intramurálně a tvořené více či méně monotónní populací vřetenitých a/nebo epiteloidních buněk. Na základě výsledků těchto tří imunohistochemických reakcí, samozřejmě vždy s přihlédnutím k morfologii nádoru v konvenčním barvení, lze většinu mezenchymálních lézí GIT rozdělit do 6 kategorií (obr. 1). V další diferenciaci mezi individuálními jednotkami v rámci těchto kategorií se pak, kromě charakteristických histologických znaků, mohou uplatnit další imunohistochemické, případně i molekulárně genetické markery (tab. 1 a 2).
Obr. 1. Algoritmus diferenciální diagnostiky mezenchymálních lézí GIT. Na podkladě výsledků vyšetření základním imunohistochemickým panelem (CD117, desmin, S100) a bližší analýzy histomorfologie nádoru lze mezenchymální léze rozdělit do 6 základních diagnostických kategorií. Bližší charakteristika a diferenciální diagnostika samostatných jednotek z těchto kategorií je uvedena v textu. 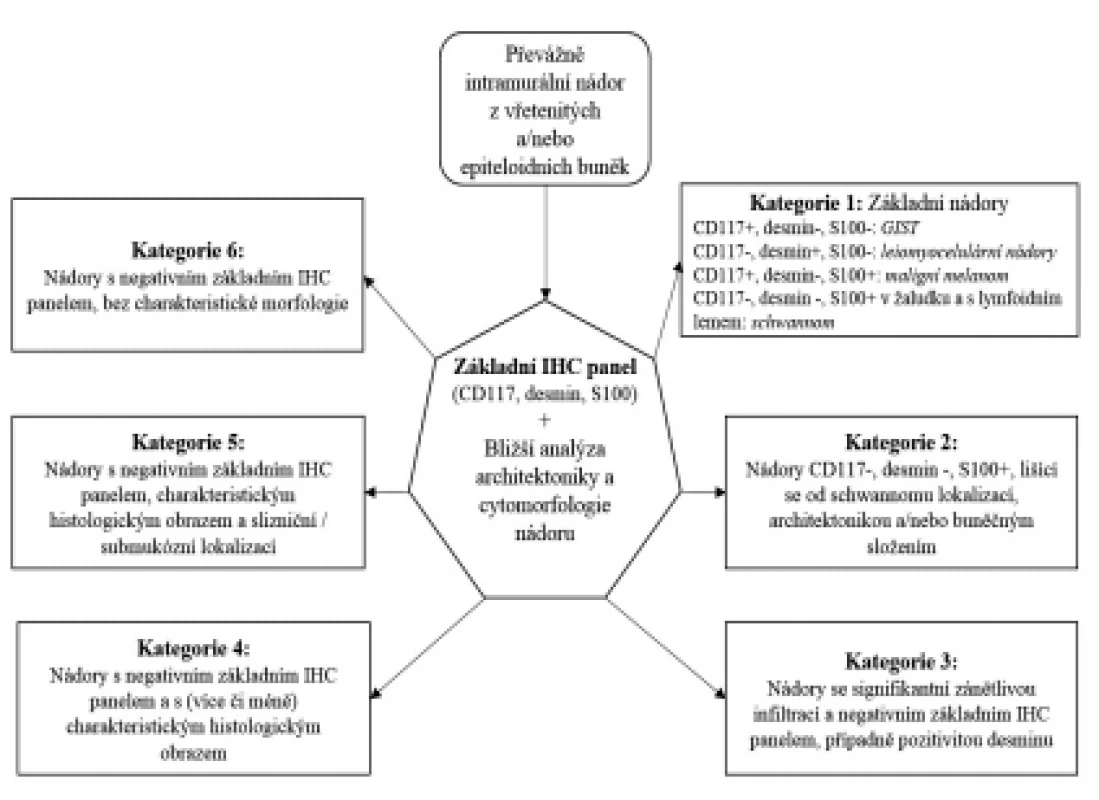
Tab. 1. Vybrané molekulárně genetické markery GIST. 
*: prokázána možnost familiárního výskytu při germinální mutaci
MAPK: mitogeny aktivovaná proteinkináza (mitogen-activated protein kinase), signální cesta označovaná také jako Ras-Raf-MEK-ERK
PI3K: fosfatidylinositol-3-kinázaTab. 2. Další histologická barvení, imunohistochemické a molekulárně genetické markery využitelné v diferenciální diagnostice. 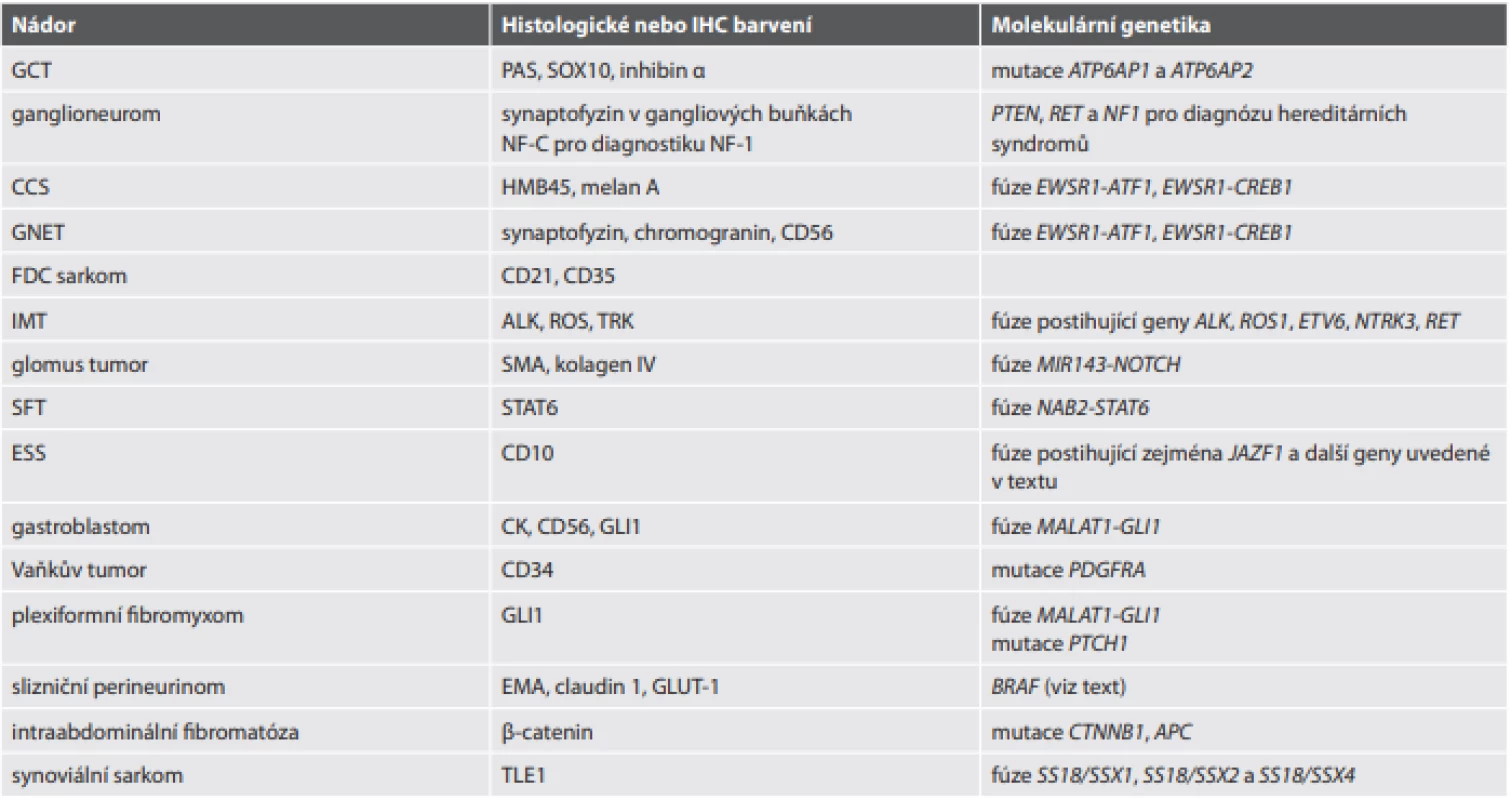
CCS: světlobuněčný sarkom (clear cell sarcoma), CK: cytokeratiny, ESS: endometriální stromální sarkom, FDC sarkom: sarkom z folikulárních dendritických buněk (follicular dendritic cell sarcoma), GCT: nádor z granulárních buněk (granular cell tumor), GNET: gastrointestinální neuroektodermální tumor, IMT: infl amatorní myofi broblastický tumor, NF-1: neurofi bromatóza 1. typu, SFT: solitární fi brózní tumor, SMA: hladkosvalový aktin (smooth muscle actin) DIAGNOSTICKÉ KATEGORIE
1. Základní nádory a základní tři protilátky: CD117, desmin a S100
Ve většině typických případů je dostačující imunohistochemický panel pokrývající nejdůležitější diferenciálně diagnostické spektrum: GIST, leiomyocelulární nádory a schwannom. „Typickým případem“ se v tomto kontextu rozumí intramurální nádor vycházející z tunica muscularis propria tvořený převážně monotónní populací vřetenitých buněk (případně i epiteloidních buněk s charakteristickou histomorfologií). Samozřejmě nejde o jediné markery těchto nádorů, tato kombinace je však v rutinní praxi ideální jak z ekonomického, tak diferenciálně diagnostického hlediska. Výsledky imunohistochemického barvení mohou vést k těmto kombinacím:
CD117 +, desmin -, S100 -
Tento imunofenotyp je (při odpovídající lokalizaci a morfologii) typický pro GIST. Kompletní diagnóza GIST samozřejmě vyžaduje ještě vyhodnocení rizika agresivního chování, respektive prognostické skupiny dle WHO, přičemž nádory s vysokým rizikem agresivního chování a nádory metastatické jsou kandidáty na prediktivní molekulárně genetické vyšetření (na základě písemné žádosti onkologa).
CD117 -, desmin +, S100 –
Při odpovídající morfologii jde o klasický imunofenotyp leiomyocelulárních nádorů. Přestože desmin nedisponuje vysokou senzitivitou, jeho vysoká specificita je důvod, proč je pro „primární rozstřel“ vhodnější než jiné, senzitivnější leiomyocelulární markery.
Kromě běžného leiomyomu a leiomyosarkomu je, zejména při mnohočetném výskytu u imunosuprimovaných pacientů, nutné myslet na možnost EBV-asociovaného hladkosvalového tumoru. Imunohistochemicky pro tuto jednotku svědčí imunoexprese EBV receptoru CD21 a EBNA (EBV nuclear antigen 2), případně lze in situ hybridizací prokázat EBER (EBV-encoded small RNA).
CD117-, desmin -, S100+
Jde o imunoprofil charakteristický pro gastrointestinální schwannom, který se vyskytuje nejčastěji v žaludku. Jde o druhou nejdůležitější diagnózu, kvůli níž je takřka nezbytné zařadit S100 do základního panelu. Na rozdíl od GIST s převážně nejistým maligním potenciálem je gastrointestinální schwannom benigní nádor, který je však odlišný od známějšího měkkotkáňového schwannomu. Zrádná je zejména pravidelná absence „šikování jader“. Naopak, je-li tento znak v nádoru žaludku přítomen, jde téměř vždy o GIST, nikoli o schwannom. Diagnóze může dále napomoci přítomnost lymfatických foliklů, případně i peritumorálního lymfoidního lemu, který je okolo schwannomu výrazně vytvořen, i se zárodečnými centry (obr. 2). Prakticky všechny případy „GIST s lymfoidním lemem“ ve skutečnosti představují chybně diagnostikované gastrointestinální schwannomy (1-3).
Obr. 2. Schwannom žaludku. Přítomnost lymfatických foliklů a zejména periferního lymfoidního lemu je velmi specifi ckým znakem žaludečního schwannomu (HE, 100x). 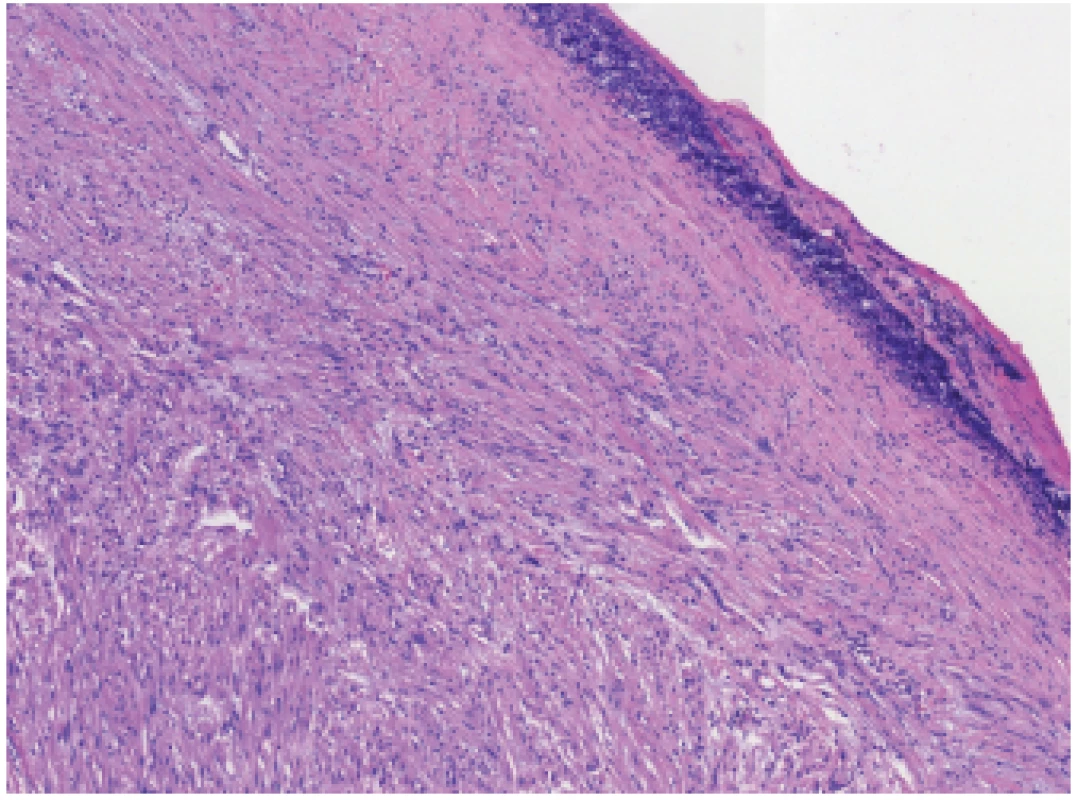
CD117+, desmin -, S100+
Nejdůležitější jednotkou, která vyžaduje zařazení S100 do základního diagnostického panelu mezenchymálních nádorů GIT, je maligní melanom, ať již primární (v jícnu nebo anu) nebo sekundární (ve zbytku trávicí trubice). Bez této protilátky by totiž jeho pozitivita v průkazu CD117 mohla snadno vést k záměně s GIST, který dovede maligní melanom morfologicky věrně napodobit. K potvrzení diagnózy lze poté použít dalších melanocytárních markerů (melan A, HMB45).
2. S100-pozitivní nádory s neurální diferenciací (jiné než schwannom)
K podezření na tuto skupinu nádorů může vést zejména pro schwannom netypický histologický obraz, jmenovitě epiteloidní vzhled buněk, vyšší mitotická aktivita nebo absence lymfoidního lemu. Také je vhodné o těchto jednotkách uvažovat v případě extragastrické lokalizace, protože mimo žaludek se v trávicí trubici schwannom vyskytuje vzácně. Stejně tak omezení S-100 pozitivní léze na sliznici (a případně superficiální submukózu) by mělo vést k hlubší analýze její morfologie.
Nádor z granulárních buněk (granular cell tumor, GCT) tvořený buňkami s objemnou cytoplazmou obsahující PAS-pozitivní granula, se vyskytuje v rámci gastrointestinálního traktu nejčastěji v jícnu, kde může kvůli pseudoepiteliomatózní hyperplazii dlaždicobuněčného epitelu nad nádorem vést i k mylné diagnóze dlaždicobuněčného karcinomu (zejména v malé povrchové endoskopické biopsii). I přes poněkud zavádějící pozitivitu v imunohistochemickém průkazu inhibinu α je uznáván jeho neurální původ, pro který svědčí exprese S100, SOX10 nebo PGP 9.5 (obr. 3) (4). Pro lyzosomální původ cytoplazmatických granul svědčí exprese CD68. Nedávno popsané inaktivační mutace genů ATP6AP1 a ATP6AP2, kódujících endosomální pH regulázy, mají nejen onkogenní účinek, ale také narušením acidifikace lyzosomů vedou k jejich akumulaci a tak i „granulárnosti“ nádorových buněk (5).
Obr. 3. Nádor z granulárních buněk. Pod metaplastickou barrettovskou sliznicí v distálním jícnu je infi ltrace dužnatými eosinofi lními buňkami s jemně zrnitou cytoplazmou (A – HE, 100x), které jsou pozitivní v imunohistochemickém průkazu S100 (B – 100x). 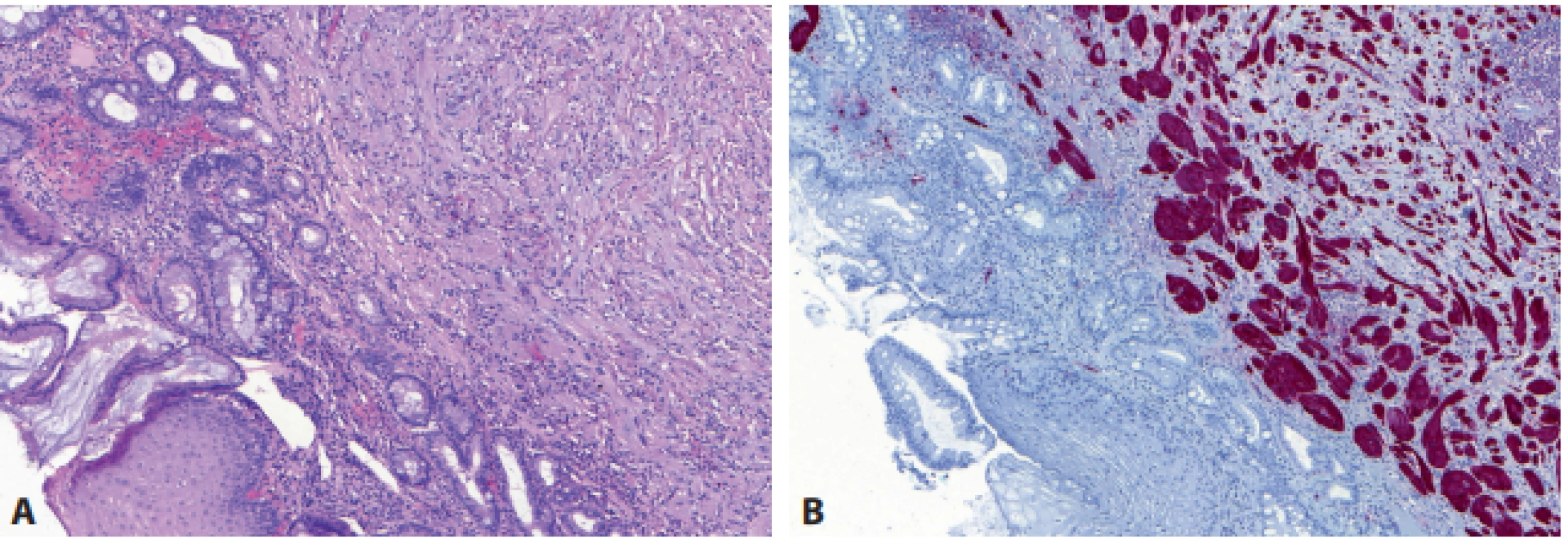
Slizniční hamartom ze Schwannových buněk je drobná (několik milimetrů v největším rozměru) polypoidní léze tvořená difúzní proliferací S100-pozitivních vřetenitých buněk, v níž jsou zachyceny střevní krypty. Od dobře ohraničeného gastrointestinálního schwannomu ji odlišuje právě difúzní charakter distribuce Schwannových buněk v rámci polypu. Od neurofibromu (který může být asociován s neurofibromatózou 1. typu) se liší absencí axonů pozitivních v průkazu neurofilament a nepřítomností submukózní komponenty, od ganglioneuromu zase absencí gangliových buněk. Na rozdíl od slizničního perineurinomu není tato léze asociována se „serrated“ kryptami a její buňky neexprimují perineurální markery (viz níže) (6,7).
Ganglioneurom se od předešlé léze liší jednak přítomností gangliových buněk, jednak klinickým významem. Vyskytuje se ve třech formách. Sporadický polypoidní ganglioneurom nepředstavuje pro pacienta významnější marker zdravotních komplikací, zbývající dvě formy však ano, protože mohou být součástí hereditárních nádorových syndromů, k jejichž detekci může přispět i vyšetření samotných ganglioneuromů (8). Ganglioneuromatózní polypóza (> 20 polypů) se může vyskytovat při syndromu Cowdenové (PTEN-hamartomový syndrom), tuberózní skleróze nebo syndromu juvenilní polypózy (obr. 4). Difúzní ganglioneuromatóza bývá popisována zejména v asociaci se syndromem MEN2B (mutace RET) a neurofibromatózou 1. typu (mutace NF1 může být predikována již na základě výsledku negativní imunohistochemické detekce neurofibrominu protilátkou NF-C) (9).
Obr. 4. Ganglioneurom.V tomto ganglioneuromatózním polypu od pacientky se syndromem Cowdenové jsou v převažující vřetenobuněčné proliferaci v proprii zastiženy nečetné drobné skupiny gangliových buněk (A – šipka, HE, 200x). Opticky lze gangliové buňky zvýraznit protilátkou proti synaptofyzinu (B – šipka, 400x). 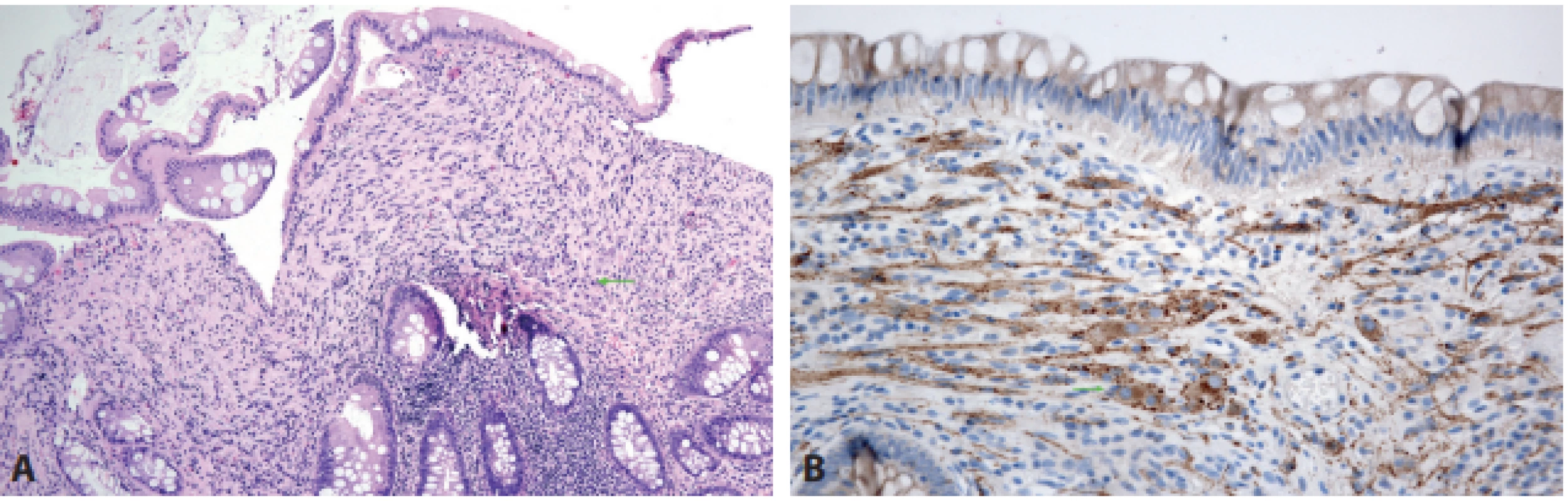
Světlobuněčný sarkom (clear cell sarcoma, CCS) a gastrointestinální neuroektodermální tumor (GNET) tvoří pravděpodobně spektrum nádorových obrazů vycházející z primitivních buněk autonomního nervového systému neurální lišty, o čemž svědčí jejich společná imunopozitivita S100 a SOX10. V CCS tvořeném epiteloidními buňkami s vodojasnou až světle eozinofilní cytoplazmou se dále uplatňuje parciální melanocytární diferenciace charakterizovaná pozitivitou melanocytárních markerů HMB45 a/nebo melan A. GNET, tvořený epiteloidními buňkami s eozinofilní cytoplazmou, naopak vykazuje primitivní neuroektodermální/neurální fenotyp charakterizovaný imunopozitivitou synaptofyzinu, chromograninu a/nebo CD56. V obou těchto nádorech může být příměs obrovských mnohojaderných buněk podobných osteoklastům. Potvrzením diagnózy je potvrzení translokace genu EWSR1, nejčastěji vedoucí k fúzi EWSR1-ATF1 nebo EWSR1-CREB1 (10).
3. Nádory s negativitou CD117 a S100 a se „zánětlivou morfologií“
Do této kategorie spadají dvě morfologicky podobné léze tvořené proliferací vřetenitých buněk s příměsí zánětlivých elementů:
Tumor/sarkom z folikulárních dendritických buněk je charakterizován intimním kontaktem proliferujících folikulárních dendritických buněk s malými lymfocyty. Nádorové buňky jsou negativní též v průkazu desminu, naopak vykazují pozitivitu markerů folikulárních dendritických buněk (např. CD21 a CD35) (11). Dosavadní výsledky genomické analýzy těchto nádorů sice prokázaly přítomnost řady genetických alterací v nádorových buňkách, zatím ale bez možnosti diagnostického využití (12,13).
Inflamatorní myofibroblastický tumor (IMT) může být, vzhledem ke své parciální leiomyocelulární diferenciaci, pozitivní v průkazu desminu (a dalších hladkosvalových markerů). Zánětlivý infiltrát je v něm polymorfnější než u výše uvedeného tumoru z folikulárních dendritických buněk, kromě malých lymfocytů jsou přítomné i plazmatické buňky a histiocyty (obr. 5) (14,15). V současné době je popsána řada genových fúzí uplatňujících se v onkogenezi IMT, které postihují zejména geny ALK, ROS1, ETV6, NTRK3 nebo RET. Podle typu translokace může být pozitivní imunohistochemický průkaz ALK, ROS nebo TRK (16-23). Opět je nutné vždy korelovat molekulárně genetické výsledky s morfologií, protože nejde o unikátní alterace, ale o změny sdílené i s jinými nádory.
Obr. 5. Infl amatorní myofi broblastický tumor.V infl amatorním myofi broblastickém tumoru je, podobně jako v sarkomu z folikulárních dendritických buněk, intimní vztah nádorových dužnatých vřetenitých buněk s buňkami chronického zánětlivého infi ltrátu (HE, 200x). 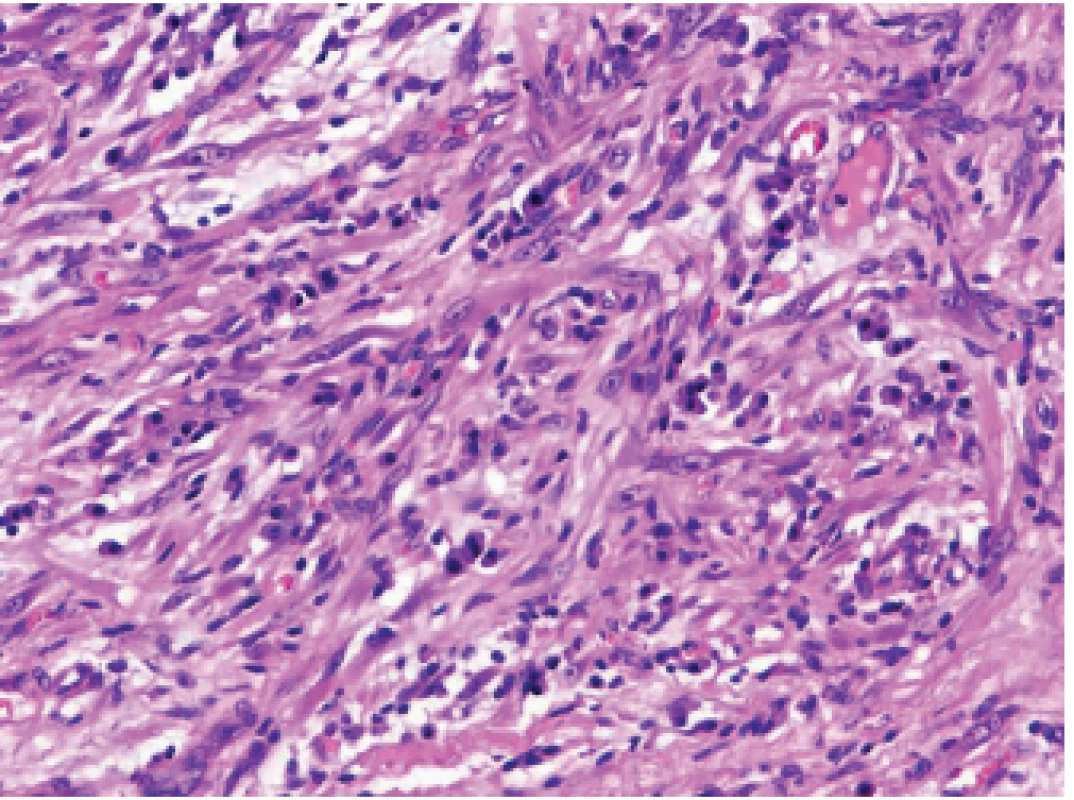
4. Nádory s negativním základním panelem a s charakteristickým histologickým obrazem
Glomus tumor (a jeho varianty jako glomangiom a glomangioleiomyom) činí zřídka diagnostické obtíže. Nejspíše ještě čistý glomus tumor, vyskytující se nejčastěji v žaludku, může vzhledem ke své epiteloidní morfologii a negativnímu základnímu imunohistochemickému panelu vyvolávat diagnostické rozpaky, které někdy mohou být ještě posíleny fokální pozitivitou synaptofyzinu (hlavně ve světlobuněčných partiích) svádějící k diagnóze neuroendokrinního tumoru. Nicméně i přes téměř vždy negativní imunohistochemický průkaz desminu je glomus tumor pozitivní v průkazu jiných hladkosvalových markerů, zejména hladkosvalového aktinu, a dále kolagenu IV. V části těchto nádoru lze detekovat onkogenní fúzi MIR143-NOTCH (24).
Solitární fibrózní tumor (SFT) je charakteristický svou heterogenitou s nepravidelným střídáním hypercelulárních a hypocelulárních úseků tvořených protáhlými vřetenitými buňkami, silnými provazci kolagenu a iregulárně distribuovanými cévami, často se silnější stěnou a někdy i s učebnicovým „parohovitým“ větvením. V imunohistochemické diagnostice je nejlépe zapomenout na tradovanou pozitivitu CD34, bcl-2 a CD99. Jednotlivé markery totiž trpí velmi nízkou specificitou a naopak koexprese všech tří markerů je ve skutečnosti poměrně vzácná. V současné době je zlatým standardem diagnostiky SFT průkaz imunoexprese STAT6, která je projevem genové fúze NAB2-STAT6 (25).
Endometriální stromální sarkom (ESS) se může v GIT vyskytovat sekundárně (při rozsevu primárního nádoru z ženského genitálu), nebo i primárně (z endometriózy ve stěně trávicí trubice). Typicky jde o „modře vypadající“ nádor tvořený denzní populací krátkých vřetenitých buněk s malým množstvím cytoplazmy, která je prostoupena četnými tenkostěnnými arteriolami spirálního typu (obr. 6). Imunohistochemicky může diagnózu potvrdit průkaz CD10 v nádorových buňkách (26). Na molekulárně genetické úrovni je ESS charakterizován fúzí JAZF1-SUZ12 (dříve označovanou JAZF1-JJAZ1), případně některou z méně častých alternativních fúzí (JAZF1-PHF1, EPC1-PHF1, MBTD1-CXorf67, MEAF6-PHF1, JAZF1-BCORL1, BRD8-PHF1 nebo MEAF6-SUZ12) (27). Problém může představovat zejména high-grade ESS s translokací YWHAE-NUTM2A/B, protože je charakteristicky CD117-pozitivní a CD10-negativní (28).
Obr. 6. Endometriální stromální sarkom. Ve sliznici a přilehlé submukóze je patrná denzní infi ltrace krátkými vřetenitými buňkami s malým množstvím cytoplazmy (A – HE, 100x), mezi nimiž jsou četné charakteristické spirální arterioly (B – HE, 200x). 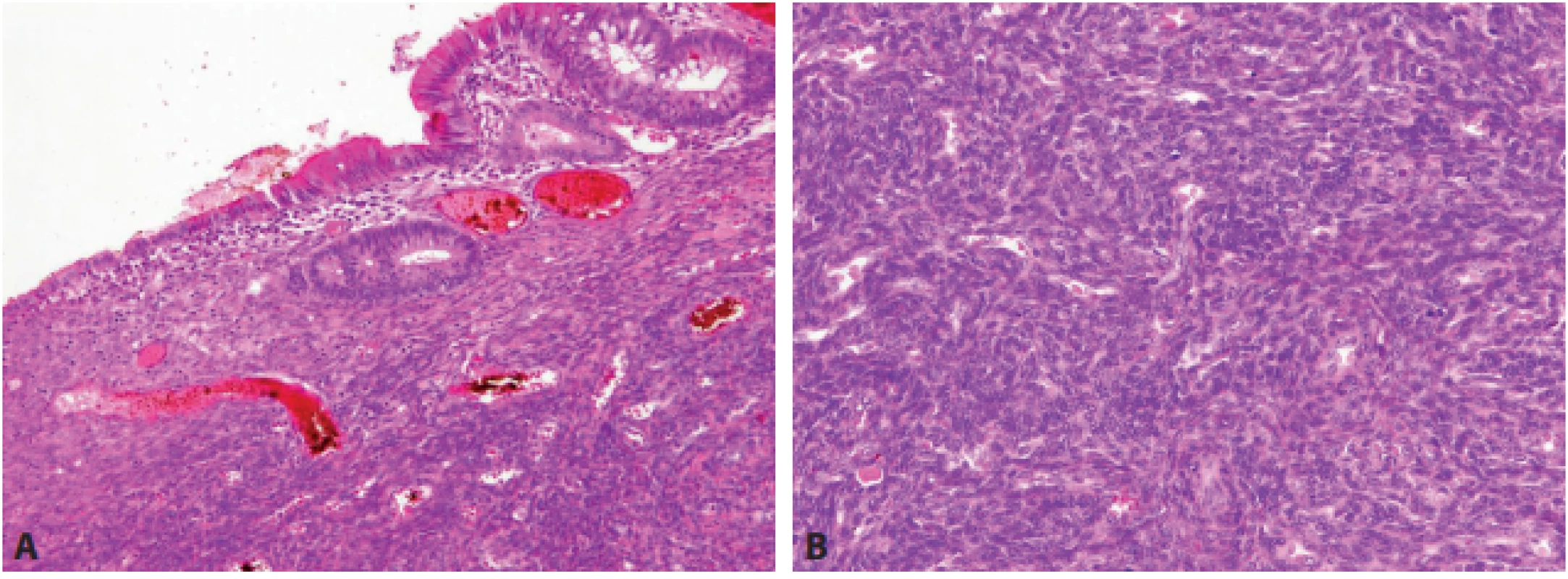
Kalcifikující fibrózní tumor (CFT), dříve nazývaný kalcifikující fibrózní pseudotumor, se vyskytuje hlavně ve vazbě na serózní vrstvu trávicí trubice, je tvořen hyalinizovaným vazivem, které se fokálně koncentricky organizuje okolo ložisek kalcifikací, obsahuje disperzní lymfocytární infiltraci s případnou tvorbou lymfoidních foliklů, a řídce zastoupenými vřetenitými a hvězdicovitými buňkami. Z genetických alterací v něm byly prokázány mutace genů ZNF717, FRG1, CDC27 a ztráta 6p22 (kde je lokalizován např. gen HFE) (29).
Gastroblastom je vzácný nádor žaludku bifázické epiteliální a mezenchymální morfologie (čímž může připomínat bifázický synoviální sarkom nebo sarkomatoidní karcinom). Obě komponenty mají histologicky „low grade“ vzhled, epiteliální je tvořena hnízdy uniformních buněk s okrouhlými normochromními jádry a malým množstvím slabě eozinofilní cytoplazmy, někdy s tvorbou rozetovitých formací, mezenchymální mívá retikulární vzhled pro obsah řídké myxoidní matrix mezi protáhlými vřetenitými buňkami. Běžné imunohistochemické vyšetření je nespecifické – epitelové buňky jsou pozitivní v průkazu cytokeratinů, CD56, vřetenité v průkazu vimentinu, hladkosvalového aktinu, případně CD10. Nedávno však byla v gastroblastomu popsána imunoexprese GLI1 podmíněná onkogenní fúzí MALAT1-GLI1, podobně jako v plexiformním fibromyxomu popsaném níže (30).
5. Nádory s negativním základním panelem, které mají charakteristický histologický obraz a slizniční nebo submukózní lokalizaci
Vaňkův tumor (inflamatorní fibroidní polyp) je nejdéle známou jednotkou této skupiny. Vzhledem ke svému benignímu chování, výrazné zánětlivé infiltraci a pravidelně přítomné povrchové ulceraci byl dlouhou dobu považován za reaktivní zánětlivou lézi, nicméně průkaz mutací PDGFRA svědčí pro jeho neoplastický charakter (31). V typických případech, hlavně v žaludeční lokalizaci, je diagnóza zřejmá již ze základního barvení, a to na základě tvorby cibulovitých koncentrických formací nádorových vřetenitých buněk okolo cév a žlázek a bohatým zánětlivým infiltrátem s výraznou účastí eozinofilních granulocytů (obr. 7). Pomocným diagnostickým znakem je také pozitivní imunohistochemický průkaz CD34 v nádorových buňkách. V méně typických případech, zejména v intestinální lokalizaci, však bohužel diagnostické koncentrické formace nejsou vytvořeny, což také bývá asociováno s negativitou CD34 (32). Nelze se zcela spolehnout ani na molekulárně genetický průkaz mutací PDGFRA, protože populace nádorových buněk je v porovnání s buňkami zánětlivého infiltrátu výrazně minoritní, takže výsledek sekvenační analýzy může být falešně negativní (33). Ačkoli je k dispozici diagnostická protilátka proti PDGFRA, z technických důvodů způsobujících nízkou specificitu barvení se nelze ani na tuto metodu plně spolehnout.
Obr. 7. Vaňkův tumor. Pod sliznicí žaludku je patrná proliferace vřetenitých buněk v edematózním stromatu s příměsí eosinofi lů, která tvoří koncentrické formace okolo cév (HE, 100x). 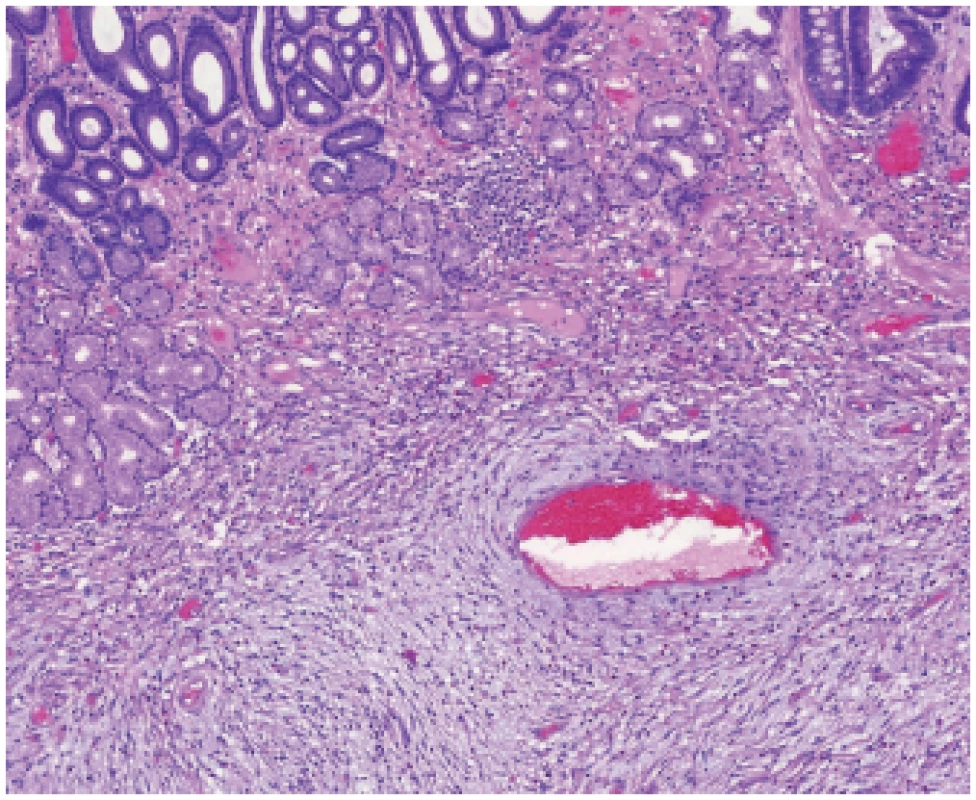
Plexiformní fibromyxom je relativně nová jednotka, která do značné míry připomíná Vaňkův tumor. Přestože i plexiformní fibromyxom se může, na rozdíl od původních předpokladů, vyskytovat i mimo žaludek, v malém zvětšení je patrné plexiformní/multinodulární uspořádání léze, nádorové buňky netvoří koncentrické formace a jsou CD34-negativní (34). Navíc byla v jedné třetině analyzovaných případů tohoto benigního nádoru prokázána fúze MALAT1-GLI1 s následnou overexpresí proteinu GLI1 (35). Alternativní příčinou overexprese GLI1 v plexiformním fibromyxomu může být inaktivace tumor supresorového genu PTCH1 (36).
Slizniční perineurinom, dříve též nazývaný benigní fibroblastický polyp colon, je na rozdíl od předchozích dvou nádorů lokalizován v tlustém střevě. Charakteristický je proliferací vřetenitých buněk exprimujících perineurální markery (např. EMA, claudin 1, GLUT-1) okolo krypt s pilovitým („serrated“) profilem lumina (obr. 8) (37,38). Vzhledem k tomu, že při na mikrodisekci založené separátní analýze epitelové a perineurální komponenty byla onkogenní mutace (BRAF V600E) prokázána pouze v epitelu pilovitých krypt, jde pravděpodobně primárně o epitelový nádor se sekundární reaktivní proliferací perikryptálních fibroblastů s perineurální diferenciací. Z toho důvodu je také navrhováno přejmenování tohoto nádoru na „serrated kolorektální polyp (hyperplastický polyp/sesilní serrated léze) s perineurálním stromatem“ (39).
Obr. 8. Slizniční perineurinom. Okolo krypt s pilovitým profi lem lumina je výrazná proliferace vřetenitých eosinofi lních buněk (HE, 100x). 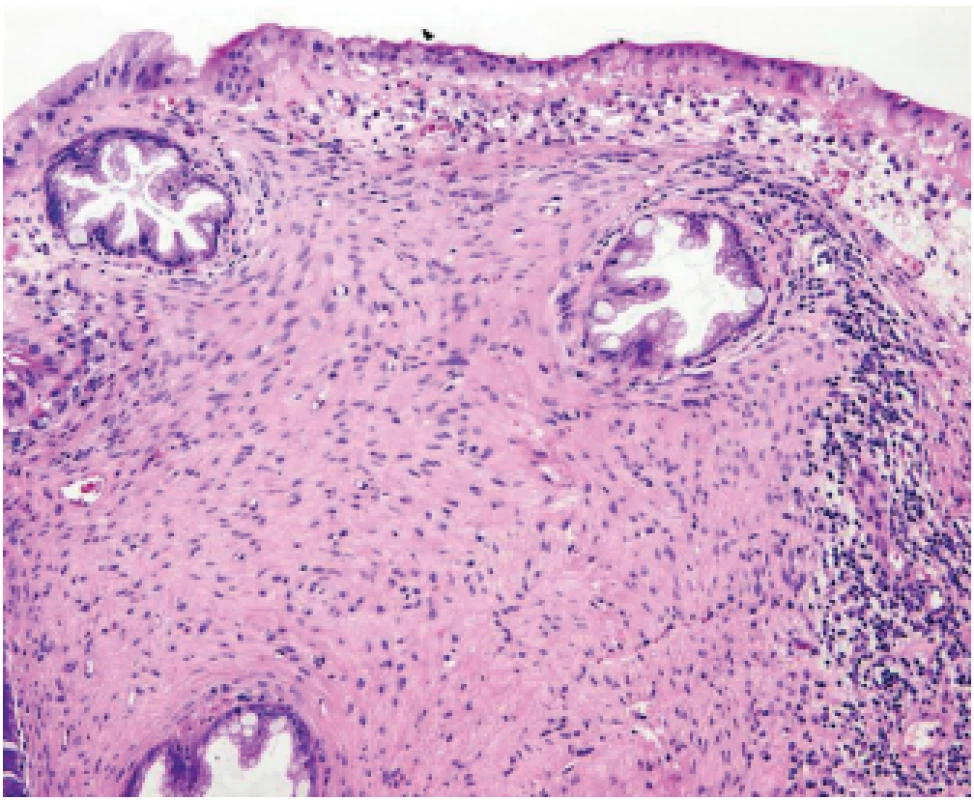
6. Negativní základní panel CD117, desmin a S100 v nádorech bez zvláštní morfologie
Jsou-li v mezenchymálním nádoru GIT bez „zvláštní morfologie“ negativní základní tři markery, je nutné jednak zvážit možnost nedostatečné senzitivity některé z těchto protilátek, jednak možnost jiné, méně obvyklé léze, než jsou výše uvedené nádory.
V prvé řadě je nutné vyloučit možnost CD117-negativního GIST. Na úrovni imunohistochemické lze použít DOG1 (anoctamin 1), vysoce senzitivní marker GIST (40,41). K definitivnímu potvrzení může posloužit molekulárně genetický průkaz alterací charakteristických pro GIST, zejména mutací genu KIT a PDGFRA, případně dalších (tab. 1), ovšem vždy s ohledem na morfologii nádoru, protože uvedené genové alterace mohou být sdíleny i jinými typy nádorů.
Dále je nutné počítat s možnou negativitou desminu v hladkosvalových nádorech, zejména leiomyosarkomu (který navíc může vykazovat matoucí pozitivitu v imunohistochemickém průkazu cytokeratinů) (42). V takovém případě lze doplnit vyšetření dalších markerů leiomyocelulární diferenciace, jako je hladkosvalový aktin, muscle-specific actin, calponin, caldesmon nebo myosin (řazeno podle klesající senzitivity těchto protilátek). K potvrzení hladkosvalové diferenciace by měla být prokázána imunoexprese alespoň dvou z těchto markerů, ovšem opět vždy s ohledem na odpovídající histomorfologii, protože pozitivita leiomyocelulárních markerů může být sdílena i jinými jednotkami (zejména myofibroblastickými lézemi).
Intraabdominální fibromatóza sice může být v typických případech rozpoznána na základě paralelně řazených svazků myofibroblastů s jadernou expresí β-cateninu (obr. 9), nicméně tento imunohistochemický znak není zcela specifický, protože dysregulace β-cateninu se může i jako sekundární událost vyskytovat v řadě tumorů (43,44). K odlišení od GIST by měl dále přispět negativní imunohistochemický průkaz CD117 a DOG1, i když i v tomto případě jsou popisovány falešně pozitivní reakce (45,46). Někdy, zejména v malých biopsiích tak může být nutné potvrdit diagnózu fibromatózy molekulárně genetickým průkazem mutací CTNNB1 nebo APC, případně vyloučit genetické změny charakteristické pro jiné nádory (47,48).
Obr. 9. Intraabdominální fi bromatóza. Histologicky poměrně nenápadná proliferace paralelně uspořádaných vřetenitých buněk (A – HE, 200x), které typicky vykazují aberantní jadernou expresi β-cateninu (B – 200x). 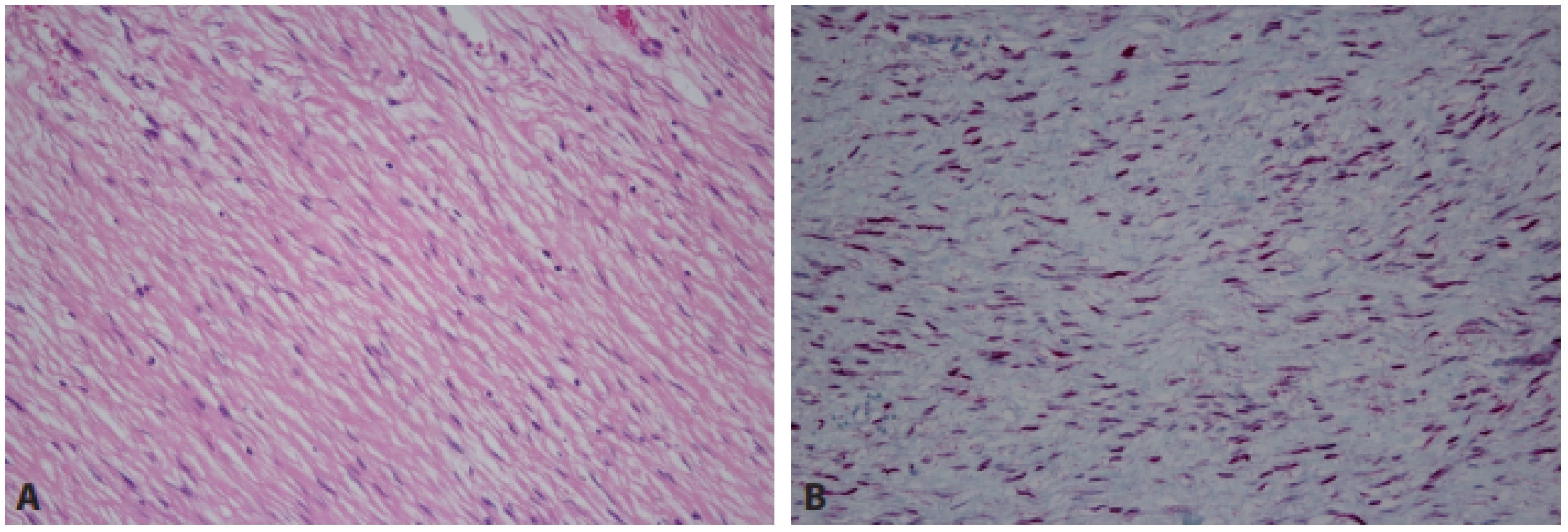
Synoviální sarkom ve své bifázické formě samozřejmě nelze považovat za nádor bez zvláštní morfologie, nicméně v GIT, hlavně v žaludku, má častěji formu monofázickou, tedy histologicky poměrně nespecifickou. Ačkoli podezření může vzbudit pozitivní imunohistochemický průkaz cytokeratinů a epiteliálního membránového antigenu (EMA), nejedná se samozřejmě o zcela specifické markery. Poměrně vysokou senzitivitu i specificitu má imunohistochemický průkaz TLE1 (49). Zrádná může být falešná pozitivita CD117 a DOG1 (50-52). Zejména v těchto případech může k diagnóze přispět vyloučení mutací KIT a PDGFRA charakteristických pro GIST a průkaz translokace t(X;18) charakteristické pro synoviální sarkom, respektive některé z ní rezultujících fúzí (SS18/SSX1, SS18/SSX2, SS18/SSX4) (53-55).
Sarkomatoidní karcinom představuje diferenciálně diagnosticky poměrně obtížnou jednotku, zejména postrádá-li imunoexpresi cytokeratinů, která navíc může být ložisková, a tedy být předmětem „sampling erroru“, hlavně v malých endoskopických biopsiích. Navíc byla popsána i aberantní exprese CD117 v karcinomu a cytokeratinů v GIST (obr. 10) (56-58). Protože karcinomy GIT nemají specifické genetické aberace umožňující jejich pozitivní diagnózu, přičemž ani negativní průkaz molekulárně genetických markerů mezenchymálních lézí přicházejících v úvahu v diferenciální diagnóze nesvědčí pouze pro karcinom, je často nezbytné zpracovat celý nádor a hledat reziduální epiteliálně diferencovanou komponentu.
Obr. 10. Sarkomatoidní karcinom. Sarkomatoidní karcinom tvořený vřetenitými i epiteloidními buňkami může v gastrointestinálním traktu napodobovat GIST (A – HE, 200x), zejména když jeho buňky exprimují antigen CD117 (B – 200x). 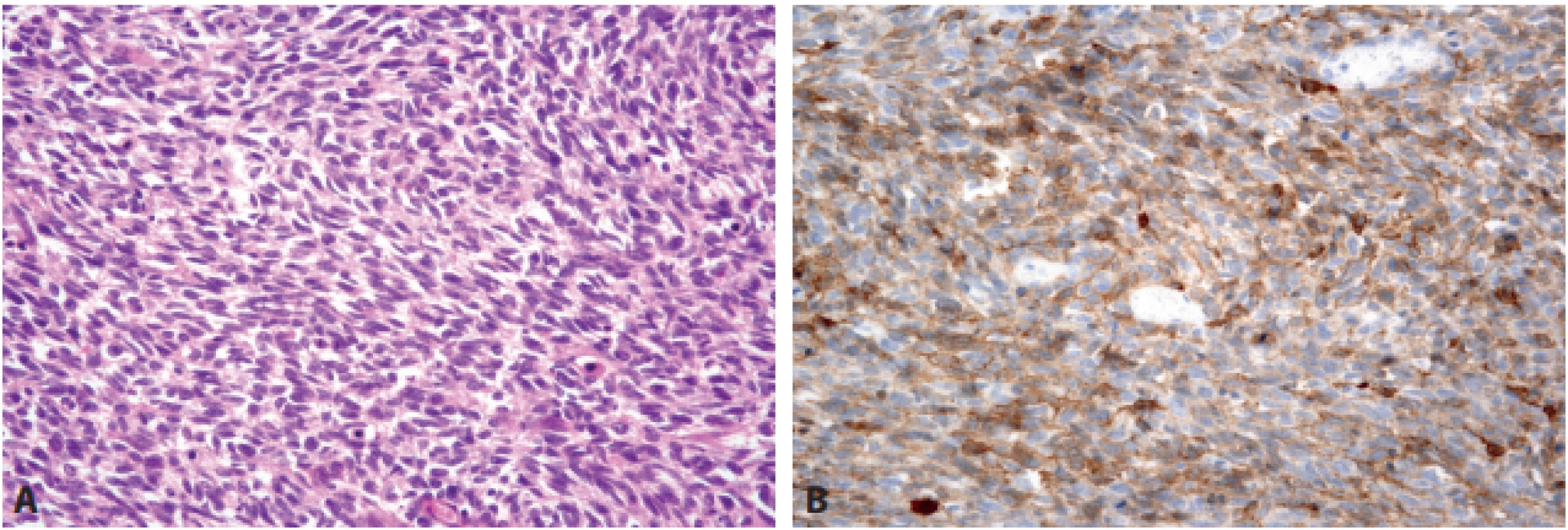
Nediferencovaný pleomorfní sarkom je svým způsobem „ultimum refugium“ po vyloučení všech ostatních možností. S ohledem na výše uvedené značné míry nejistoty v diagnostice sarkomatoidního karcinomu je zřejmé, že mezi těmito dvěma jednotkami se v diagnostice nachází šedá zóna, v níž nelze sarkomatoidní karcinom od sarkomu s jistotou rozlišit.
ZÁVĚR
Přestože nejčastější problematikou diferenciální diagnostiky mezenchymálních lézí gastrointestinálního traktu je stále diagnóza a prediktivní vyšetření gastrointestinálního stromálního tumoru, v posledních letech nabývají většího významu i méně časté nádory, ať již nově popsané nebo notoricky známé. Odkrývání molekulární podstaty jejich onkogeneze umožňuje nejen jejich přesnější definici a spolehlivější diagnostiku, ale poskytuje moderní medicíně i potenciální nové cíle pro jejich terapii, případně nástroje k odhalení hereditárních syndromů asociovaných s výskytem těchto lézí.
PODĚKOVÁNÍ
Práce byla podpořena grantem MŠMT SVV-2019 – 260 391.
ACKNOWLEDGEMENT
The work was supported by the Ministry of Education, Youth and Sports grant SVV-2019 – 260 391.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
∗ Adresa pro korespondenci:
MUDr. Magdaléna Daumová, Ph.D.
Šiklův ústav patologie LF UK a FN Plzeň
Edvarda Beneše 1128/13, 305 99 Plzeň
tel.: 377 402 251
email: DAUMOVAM@fnplzen.cz
Zdroje
1. Daimaru Y, Kido H, Hashimoto H, Enjoji M. Benign schwannoma of the gastrointestinal tract: a clinicopathologic and immunohistochemical study. Hum Pathol 1988; 19(3): 257-264.
2. Miettinen M, Shekitka KM, Sobin LH. Schwannomas in the colon and rectum: a clinicopathologic and immunohistochemical study of 20 cases. Am J Surg Pathol 2001; 25(7): 846-855.
3. Zámečník M, Mukenšnabl P, Sokol L, Michal M. Perineurial cells and nerve axons in gastrointestinal schwannomas: a similarity with neurofibromas. An immunohistochemical study of eight cases. Cesk Patol 2004; 40(4): 150-153.
4. Le BH, Boyer PJ, Lewis JE, Kapadia SB. Granular cell tumor: immunohistochemical assessment of inhibin-alpha, protein gene product 9.5, S100 protein, CD68, and Ki-67 proliferative index with clinical correlation. Arch Pathol Lab Med 2004; 128(7): 771-775.
5. Pareja F, Brandes AH, Basili T, et al. Loss-of-function mutations in ATP6AP1 and ATP6AP2 in granular cell tumors. Nature communications 2018; 9(1): 3533.
6. Gibson JA, Hornick JL. Mucosal Schwann cell “hamartoma”: clinicopathologic study of 26 neural colorectal polyps distinct from neurofibromas and mucosal neuromas. Am J Surg Pathol 2009; 33(5): 781-787.
7. Pasquini P, Baiocchini A, Falasca L, et al. Mucosal Schwann cell “hamartoma”: a new entity? World J Gastroenterol 2009; 15(18): 2287-2289.
8. Hechtman JF, Harpaz N. Neurogenic polyps of the gastrointestinal tract: a clinicopathologic review with emphasis on differential diagnosis and syndromic associations. Arch Pathol Lab Med 2015; 139(1): 133-139.
9. Rossi S, Gasparotto D, Cacciatore M, et al. Neurofibromin C terminus-specific antibody (clone NFC) is a valuable tool for the identification of NF1-inactivated GISTs. Mod Pathol 2018; 31(1): 160-168.
10. Green C, Spagnolo DV, Robbins PD, Fermoyle S, Wong DD. Clear cell sarcoma of the gastrointestinal tract and malignant gastrointestinal neuroectodermal tumour: distinct or related entities? A review. Pathology (Phila) 2018; 50(5): 490-498.
11. Hollowood K, Stamp G, Zouvani I, Fletcher CD. Extranodal follicular dendritic cell sarcoma of the gastrointestinal tract. Morphologic, immunohistochemical and ultrastructural analysis of two cases. Am J Clin Pathol 1995; 103(1): 90-97.
12. Griffin GK, Sholl LM, Lindeman NI, Fletcher CD, Hornick JL. Targeted genomic sequencing of follicular dendritic cell sarcoma reveals recurrent alterations in NF-kappaB regulatory genes. Mod Pathol 2016; 29(1): 67-74.
13. Andersen EF, Paxton CN, O’Malley DP, et al. Genomic analysis of follicular dendritic cell sarcoma by molecular inversion probe array reveals tumor suppressor-driven biology. Mod Pathol 2017; 30(9): 1321-1334.
14. Coffin CM, Watterson J, Priest JR, Dehner LP. Extrapulmonary inflammatory myofibroblastic tumor (inflammatory pseudotumor). A clinicopathologic and immunohistochemical study of 84 cases. Am J Surg Pathol 1995; 19(8): 859-872.
15. Coffin CM, Humphrey PA, Dehner LP. Extrapulmonary inflammatory myofibroblastic tumor: a clinical and pathological survey. Sem Diagn Pathol 1998; 15(2): 85-101.
16. Bridge JA, Kanamori M, Ma Z, et al. Fusion of the ALK gene to the clathrin heavy chain gene, CLTC, in inflammatory myofibroblastic tumor. Am J Pathol 2001; 159(2): 411-415.
17. Lawrence B, Perez-Atayde A, Hibbard MK, et al. TPM3-ALK and TPM4-ALK oncogenes in inflammatory myofibroblastic tumors. Am J Pathol 2000; 157(2): 377-384.
18. Milne AN, Sweeney KJ, O’Riordain DS, et al. Inflammatory myofibroblastic tumor with ALK/TPM3 fusion presenting as ileocolic intussusception: an unusual presentation of an unusual neoplasm. Hum Pathol 2006; 37(1): 112-116.
19. Cole B, Zhou H, McAllister N, Afify Z, Coffin CM. Inflammatory myofibroblastic tumor with thrombocytosis and a unique chromosomal translocation with ALK rearrangement. Arch Pathol Lab Med 2006; 130(7): 1042-1045.
20. Ma Z, Hill DA, Collins MH, et al. Fusion of ALK to the Ran-binding protein 2 (RANBP2) gene in inflammatory myofibroblastic tumor. Genes Chromosomes Cancer 2003; 37(1): 98-105.
21. Panagopoulos I, Nilsson T, Domanski HA, et al. Fusion of the SEC31L1 and ALK genes in an inflammatory myofibroblastic tumor. Int J Cancer 2006; 118(5): 1181-1186.
22. Cools J, Wlodarska I, Somers R, et al. Identification of novel fusion partners of ALK, the anaplastic lymphoma kinase, in anaplastic large-cell lymphoma and inflammatory myofibroblastic tumor. Genes Chromosomes Cancer 2002; 34(4): 354-362.
23. Yamamoto H, Yoshida A, Taguchi K, et al. ALK, ROS1 and NTRK3 gene rearrangements in inflammatory myofibroblastic tumours. Histopathology 2016; 69(1): 72-83.
24. Mosquera JM, Sboner A, Zhang L, et al. Novel MIR143-NOTCH fusions in benign and malignant glomus tumors. Genes Chromosomes Cancer 2013; 52(11): 1075-1087.
25. Yoshida A, Tsuta K, Ohno M, et al. STAT6 immunohistochemistry is helpful in the diagnosis of solitary fibrous tumors. Am J Surg Pathol 2014; 38(4): 552-559.
26. McCluggage WG, Sumathi VP, Maxwell P. CD10 is a sensitive and diagnostically useful immunohistochemical marker of normal endometrial stroma and of endometrial stromal neoplasms. Histopathology 2001; 39(3): 273-278.
27. Choi YJ, Jung SH, Kim MS, et al. Genomic landscape of endometrial stromal sarcoma of uterus. Oncotarget 2015; 6(32): 33319-33328.
28. McCluggage WG, Lee CH. YWHAE-NUTM2A/B translocated high-grade endometrial stromal sarcoma commonly expresses CD56 and CD99. Int J Gynecol Pathol 2019; 38(6): 528-532.
29. Mehrad M, LaFramboise WA, Lyons MA, Trejo Bittar HE, Yousem SA. Whole-exome sequencing identifies unique mutations and copy number losses in calcifying fibrous tumor of the pleura: report of 3 cases and review of the literature. Hum Pathol 2018; 78): 36-43.
30. Graham RP, Nair AA, Davila JI, et al. Gastroblastoma harbors a recurrent somatic MALAT1-GLI1 fusion gene. Mod Pathol 2017; 30(10): 1443-1452.
31. Schildhaus HU, Cavlar T, Binot E, et al. Inflammatory fibroid polyps harbour mutations in the platelet-derived growth factor receptor alpha (PDGFRA) gene. J Pathol 2008; 216(2): 176-182.
32. Daum O, Hes O, Vaněček T, et al. Vanek’s tumor (inflammatory fibroid polyp). Report of 18 cases and comparison with three cases of original Vanek’s series. Ann Diagn Pathol 2003; 7(6): 337-347.
33. Daum O, Hatlová J, Mandys V, et al. Comparison of morphological, immunohistochemical, and molecular genetic features of inflammatory fibroid polyps (Vanek’s tumors). Virchows Arch 2010; 456(5): 491-497.
34. Su HA, Yen HH, Chen CJ. An update on clinicopathological and molecular features of plexiform fibromyxoma. Canadian journal of gastroenterology & hepatology 2019; 2019 : 3960920.
35. Spans L, Fletcher CD, Antonescu CR, et al. Recurrent MALAT1-GLI1 oncogenic fusion and GLI1 up-regulation define a subset of plexiform fibromyxoma. J Pathol 2016; 239(3): 335-343.
36. Banerjee S, Corless CL, Miettinen MM, et al. Loss of the PTCH1 tumor suppressor defines a new subset of plexiform fibromyxoma. Journal of translational medicine 2019; 17(1): 246.
37. Eslami-Varzaneh F, Washington K, Robert ME, et al. Benign fibroblastic polyps of the colon: a histologic, immunohistochemical, and ultrastructural study. Am J Surg Pathol 2004; 28(3): 374-378.
38. Zámečník M, Chlumská A. Perineurioma versus fibroblastic polyp of the colon. Am J Surg Pathol 2006; 30(10): 1337-1339.
39. Agaimy A, Stoehr R, Vieth M, Hartmann A. Benign serrated colorectal fibroblastic polyps/intramucosal perineuriomas are true mixed epithelial-stromal polyps (hybrid hyperplastic polyp/mucosal perineurioma) with frequent BRAF mutations. Am J Surg Pathol 2010; 34(11): 1663-1671.
40. West RB, Corless CL, Chen X, et al. The novel marker, DOG1, is expressed ubiquitously in gastrointestinal stromal tumors irrespective of KIT or PDGFRA mutation status. Am J Pathol 2004; 165(1): 107-113.
41. Novelli M, Rossi S, Rodriguez-Justo M, et al. DOG1 and CD117 are the antibodies of choice in the diagnosis of gastrointestinal stromal tumours. Histopathology 2010; 57(2): 259-270.
42. Iwata J, Fletcher CD. Immunohistochemical detection of cytokeratin and epithelial membrane antigen in leiomyosarcoma: a systematic study of 100 cases. Pathol Int 2000; 50(1): 7-14.
43. Montgomery E, Torbenson MS, Kaushal M, Fisher C, Abraham SC. Beta-catenin immunohistochemistry separates mesenteric fibromatosis from gastrointestinal stromal tumor and sclerosing mesenteritis. Am J Surg Pathol 2002; 26(10): 1296-1301.
44. Ng TL, Gown AM, Barry TS, et al. Nuclear beta-catenin in mesenchymal tumors. Mod Pathol 2005; 18(1): 68-74.
45. Yantiss RK, Spiro IJ, Compton CC, Rosenberg AE. Gastrointestinal stromal tumor versus intra-abdominal fibromatosis of the bowel wall: a clinically important differential diagnosis. Am J Surg Pathol 2000; 24(7): 947-957.
46. Colombo P, Rahal D, Grizzi F, Quagliuolo V, Roncalli M. Localized intra-abdominal fibromatosis of the small bowel mimicking a gastrointestinal stromal tumor: a case report. World J Gastroenterol 2005; 11(33): 5226-5228.
47. Miyoshi Y, Iwao K, Nawa G, et al. Frequent mutations in the beta-catenin gene in desmoid tumors from patients without familial adenomatous polyposis. Oncol Res 1998; 10(11-12): 591-594.
48. Giarola M, Wells D, Mondini P, et al. Mutations of adenomatous polyposis coli (APC) gene are uncommon in sporadic desmoid tumours. Br J Cancer 1998; 78(5): 582-587.
49. Terry J, Saito T, Subramanian S, et al. TLE1 as a diagnostic immunohistochemical marker for synovial sarcoma emerging from gene expression profiling studies. Am J Surg Pathol 2007; 31(2): 240-246.
50. Yamaguchi U, Hasegawa T, Masuda T, et al. Differential diagnosis of gastrointestinal stromal tumor and other spindle cell tumors in the gastrointestinal tract based on immunohistochemical analysis. Virchows Arch 2004; 445(2): 142-150.
51. Wong NA, Shelley-Fraser G. Specificity of DOG1 (K9 clone) and protein kinase C theta (clone 27) as immunohistochemical markers of gastrointestinal stromal tumour. Histopathology 2010; 57(2): 250-258.
52. Dubová M, Daum O, Švajdler M, et al. Jaká je Vaše diagnóza? Téma: DOG1 imunoexprese v měkkotkáňových nádorech. Cesk Patol 2017; 53(4): 183-184 a 188-189.
53. Guillou L, Coindre J, Gallagher G, et al. Detection of the synovial sarcoma translocation t(X;18) (SYT;SSX) in paraffin-embedded tissues using reverse transcriptase-polymerase chain reaction: a reliable and powerful diagnostic tool for pathologists. A molecular analysis of 221 mesenchymal tumors fixed in different fixatives. Hum Pathol 2001; 32(1): 105-112.
54. Lasota J, Jasinski M, Debiec-Rychter M, et al. Detection of the SYT-SSX fusion transcripts in formaldehyde-fixed, paraffin-embedded tissue: a reverse transcription polymerase chain reaction amplification assay useful in the diagnosis of synovial sarcoma. Mod Pathol 1998; 11(7): 626-633.
55. Makhlouf HR, Ahrens W, Agarwal B, et al. Synovial sarcoma of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 10 cases. Am J Surg Pathol 2008; 32(2): 275-281.
56. Nga ME, Wong AS, Wee A, Salto-Tellez M. Cytokeratin expression in gastrointestinal stromal tumours: a word of caution. Histopathology 2002; 40(5): 480-481.
57. Rossi G, Sartori G, Valli R, et al. The value of c-kit mutational analysis in a cytokeratin positive gastrointestinal stromal tumour. J Clin Pathol 2005; 58(9): 991-993.
58. Martland GT, Goodman AJ, Shepherd NA. CD117 expression in oesophageal carcinosarcoma: a potential diagnostic pitfall. Histopathology 2004; 44(1): 77-80.
Štítky
Patologie Soudní lékařství Toxikologie
Článek ′ UROPATOLOGIEČlánek ′ KARDIOPATOLOGIEČlánek ′ PATOLOGIE ORL OBLASTIČlánek ′ PULMOPATOLOGIEČlánek ′ PATOLOGIE GITČlánek ′ HEPATOPATOLOGIEČlánek ′ PATOLOGIE MĚKKÝCH TKÁNÍČlánek ′ PULMOPATOLOGIEČlánek ′ NEFROPATOLOGIEČlánek ′ GYNEKOPATOLOGIEČlánek ′ KARDIOPATOLOGIEČlánek ′ CYTODIAGNOSTIKAČlánek ′ NEUROPATOLOGIEČlánek ′ GYNEKOPATOLOGIE
Článek vyšel v časopiseČesko-slovenská patologie

2020 Číslo 4-
Všechny články tohoto čísla
- Gastrointestinální trakt – WHO klasifikace, imunohistochemie a molekulární genetika
- Chtěl jsem být bankovní lupič, ale nevěděl jsem, kde se na to studuje
- ′ UROPATOLOGIE
- ′ PATOLOGIE SERÓZNÍCH POVRCHŮ
- ′ KARDIOPATOLOGIE
- ′ PATOLOGIE ORL OBLASTI
- ′ PULMOPATOLOGIE
- ′ PATOLOGIE GIT
- ′ HEPATOPATOLOGIE
- ′ PATOLOGIE MĚKKÝCH TKÁNÍ
- ′ PULMOPATOLOGIE
- ′ NEFROPATOLOGIE
- ′ GYNEKOPATOLOGIE
- ′ KARDIOPATOLOGIE
- Novinky v páté verzi WHO klasifikace nádorů trávicího systému – 1. Gastrointestinální trakt
- ′ CYTODIAGNOSTIKA
- Novinky v histopatologické klasifikaci neuroendokrinních nádorů v 5. vydání WHO klasifikace nádorů trávicího traktu (2019)
- ′ NEUROPATOLOGIE
- Imunohistochemie a molekulární genetika v diferenciální diagnostice mezenchymálních lézí gastrointestinálního traktu
- Mukormykóza u imunokompetentního pacienta: Kazuistika a přehled literatury
- Myokarditida pravé komory srdeční indukovaná plicní trombembolií
- Prof. MUDr. Ľudovít Danihel, PhD. jubiluje.
- ′ GYNEKOPATOLOGIE
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Chtěl jsem být bankovní lupič, ale nevěděl jsem, kde se na to studuje
- Novinky v páté verzi WHO klasifikace nádorů trávicího systému – 1. Gastrointestinální trakt
- Prof. MUDr. Ľudovít Danihel, PhD. jubiluje.
- Novinky v histopatologické klasifikaci neuroendokrinních nádorů v 5. vydání WHO klasifikace nádorů trávicího traktu (2019)
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



