-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Molekulární prediktory cílené anti-EGFR terapie u metastatického kolorektálního karcinomu
Mollecular predictive markers of EGFR-targeted therapy in metastatic colorectal cancer
The monoclonal antibodies panitumumab and cetuximab that target the epidermal growth factor receptor are effective in approximately 10% and 20% of EGFR expressing, chemotherapy resistant metastatic colorectal cancer patients in monotherapy and in combination with chemotherapy, respectively. The evidence that EGFR expression by immunohistochemistry does not predict clinical outcome in EGFR targeted treatment has led to an intensive search for additional predicitive biomarkers. Oncogenic activation of signalling pathways downstream of the EGFR, such as mutation of KRAS, BRAF, or PIK3CA oncogenes, or inactivation of the PTEN tumor supressor gene is central to the progression of colorectal cancer. Tumor KRAS mutation, which may be present in 35%–45% of patients with colorectal cancer, is now recognized as an important predictive marker of resistance to cetuximab or panitumumab treatment and is also widely used in clinical practice. Among tumors carrying wild-type KRAS, mutations of BRAF or PIK3CA or loss of PTEN expression may be associated with resistance to the anti-EGFR monoclonal antibody treatment. On the other hand, EGFR ligands overexpression detected in tumor tissue is a promising positive predictive marker. There are also some initial observations that gene expression profiling could also contribute to clinical decision-making about the cetuximab and panitumumab treatments. These observations require further validation in prospective clinical trials before incorporation into clinical practice.
Keywords:
EGFR – targeted therapy – prediction – colorectal carcinoma
Autoři: P. Fabian; J. Berkovcová
Působiště autorů: Oddělení onkologické a experimentální patologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Čes.-slov. Patol., 47, 2011, No. 4, p. 154-158
Kategorie: Přehledový článek
Souhrn
Terapie monoklonálními anti-EGFR protilátkami cetuximab a panitumumab je účinná u zhruba 10 % pacientů s metastatickým EGFR exprimujícím kolorektálním karcinomem v monoterapii a zhruba u 20 % pacientů při kombinované léčbě s chemoterapií. Prediktivní hodnota imunohistochemického vyšetření exprese EGFR nebyla prokázána, takže se intenzivně hledají nové prediktivní biomarkery. V progresi kolorektálního karcinomu hrají ústřední roli patologické aktivace signálních drah asociovaných s EGFR, ke kterým mohou vést aktivující mutace genů KRAS, BRAF, PIK3CA či inaktivace tumor supresorového genu PTEN. V současnosti jsou jako důležitý prediktor rezistence k terapii cetuximabem a panitumumabem uznávané mutace KRAS prokazatelné u 35–45 % kolorektálních karcinomů. Detekce mutací KRAS jsou také v klinické praxi používány. U nádorů, které nemají mutovaný gen KRAS, může být rezistence k anti-EGFR cílené terapii spojena s mutacemi v genech BRAF, PIK3CA či se ztrátou exprese proteinu PTEN. Na druhou stranu pozitivním prediktorem se jeví nadměrná exprese ligandů EGFR v nádorové tkáni. Rovněž profilování genové exprese by podle prvních výsledků mohlo přispět k rozhodování o indikaci léčby cetuximabem či panitumumabem. Tato pozorování si ovšem před zavedením do klinické praxe vyžadují další validaci v podmínkách prospektivních klinických studií.
Klíčová slova:
EGFR – cílená léčba – predikce – kolorektální karcinomKarcinom tlustého střeva a konečníku je závažným a velmi častým onemocněním. Incidence kalkulovaná na evropský věkový standard je v ČR 51,0/105 u mužů a 24,1/105 u žen (1). V celosvětovém měřítku jsme v incidenci i mortalitě na hrozivém druhém místě, index mortalita/incidence ale setrvale klesá (2). Nehledě na pokroky v terapii, přežití u metastatického kolorektálního karcinomu (mCRC) zůstává špatné, s mediánem celkového přežití (OS) 18–21 měsíců (3). Systémová terapie na bázi fluoropyrimidinů v kombinaci s irinotekanem či oxaliplatinou je v posledních letech kombinována s biologickou léčbou monoklonálními protilátkami proti VEGF (bevacizumab) a EGFR (cetuximab, panitumumab) (4–6).
EGFR
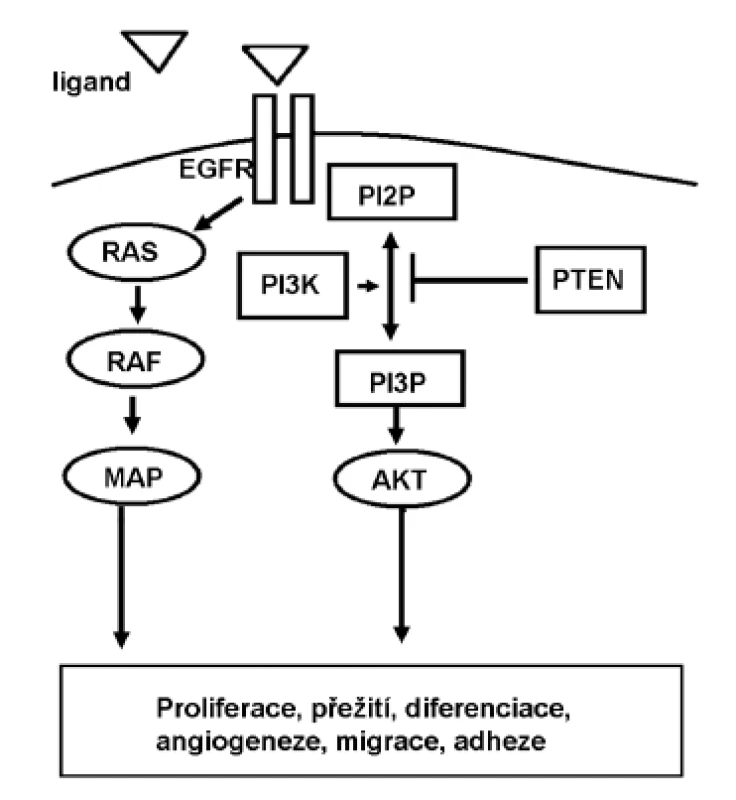
Receptor pro epidermální růstový faktor (EGFR, Egfr, Her1) je členem rodiny receptorů s tyrozinkinázovou aktivitou. Po vazbě ligandu (epidermálního růstového faktoru, epiregulinu, amphiregulinu, aj.) vytváří homo - či heterodimery a aktivuje dvě hlavní intracelulární cesty přenosu: signální dráha RAS-RAF-MAPK je zodpovědná zejména za signalizaci proliferační; zatímco dráha PI3K-PTEN-AKT zprostředkovává buněčné přežití a podílí se na motilitě a invazivitě nádorových buněk (7,8) (obr. 1). Vazba protilátek na extracelulární doménu receptoru blokuje přenos této signalizace. EGFR je overexprimován u cca 85 % případů kolorektálního karcinomu. V současnosti jsou dostupné a pro léčbu mCRC schválené dvě monoklonální protilátky (cetuximab – chimerická myší/humánní a panitumumab – plně humánní). V monoterapii u mCRC je dosaženo celkové odpovědi (overall response rate, ORR) ve smyslu kompletní remise onemocnění (complete response, CR) nebo výrazné redukce nádorových buněk (partial response, PR) u 10 % pacientů. V kombinaci s chemoterapií pak přibližně u 20 % pacientů (5,6,9). U dalších zhruba 50 % pacientů dojde ke stabilizaci onemocnění (11–14). Údaje o vlivu na přežití bez progrese onemocnění (progression free survival, PFS) a zejména celkovém přežití (overall survival, OS) jsou rovněž příznivé. Obě protilátky jsou schváleny pro použití u pacientů s mCRC již předléčených nejméně jednou linií chemoterapie s irinotekanem či oxaliplatinou, při níž došlo k progresi onemocnění. Jak vidno, významné terapeutické odezvy se dočká jen malá část nemocných, ostatní jsou vystaveni nežádoucím účinkům terapie bez očekávaného benefitu. Vzhledem k tomu a ke značné nákladnosti této biologické léčby jsou v současnosti usilovně hledány klinické i laboratorní prediktory, které by dovolily selektovat ty pacienty, u nichž je pravděpodobnost terapeutické odezvy vysoká. Prvním známým faktorem je výskyt kožních projevů (akneiformní vyrážky apod.). Nemocní se závažným stupněm těchto účinků mají významně lepší měřitelnou odpověď na terapii cílenou na EGFR, a to nejen u mCRC (4,7,10), ale i u ostatních malignit. Jde však o faktor, který nelze rozeznat před nasazením terapie, nejedná se tedy v pravém smyslu slova o prediktor. Molekulární podstata tohoto jevu není zatím objasněna.
KRAS
Retrospektivní i prospektivní studie s cetuximabem ukázaly, že velmi silným negativním prediktorem léčebné odpovědi je přítomnost aktivující mutace v genu kódujícím protein KRAS (11–17). KRAS je protein sloužící přenosu signálu, patří spolu s NRAS a HRAS do jedné rodiny. Téměř všechny (95 %) aktivující mutace se vyskytují v exonu 1, a to v kodonech 12 a 13 (18). V této oblasti se nalézá doména, která se u aktivního KRAS podílí na defosforylaci GTP a tím opětovné deaktivaci KRAS. Protein se tak sám udržuje v neaktivním stavu a je aktivován pouze dočasně a krátkodobě (19). Zmíněné mutace vedou ke ztrátě této vlastnosti a ke konstitutivní aktivaci nezávislé na vazbě ligandu na receptor. Je tedy nasnadě, že ovlivnění vazby ligandu cetuximabem či panitumumabem se bude míjet účinkem, což je nyní již považováno za bezpečně ověřené. U pacientů s tumorem s mutovaným genem KRAS nebyla zaznamenána léčebná odpověď a ani u nich nedochází k prodloužení PFS či OS (11–17,20). Výsledky studie OPUS dokonce ukazují, že podávání anti-EGFR terapie může mít u pacientů s KRAS mutací negativní efekt na OS (15,21).
Jak FDA (Food and Drug Administration) tak EMA (European Medicines Agency) limitují nasazení obou léků pro pacienty s tumorem, jehož gen KRAS není mutován (wild type – KRAS wt). Toto testování probíhá rutinně i v České republice v laboratořích prediktivní patologie, podobně jako např. testování HER2 statusu. Používají se zejména dvě metody – alelicky specifická PCR a přímé sekvenování (22).
Mutace KRAS je vysoce specifickým negativním prediktorem odpovědi (specificita 93 %), avšak senzitivita tohoto testu je nízká (43 %). Identifikuje pouze 35–45 % pacientů neodpovídajících na terapii (23). V současné době je známo několik velmi pravděpodobných mechanizmů, které, podobně jako mutace KRAS, způsobují rezistenci k léčbě cílené na EGFR. Jedná se o molekulární změny dalších prvků signálních drah aktivovaných EGFR, které rovněž vedou k jejich patologické aktivaci.
BRAF
Za nejprokázanější z těchto dalších mechanizmů je v současnosti považována přítomnost mutace genu BRAF, který kóduje stejnojmennou serin/threoninovou proteinkinázu účastnící se přenosu signálu v signální dráze MAPK (mitogen-activated protein kinase) podobně jako KRAS. Jedná se o jedinečnou mutaci v exonu 15 BRAF V6OOE, tj. záměna valinu za kyselinu glutamovou, která se vyskytuje u cca 7–10 % pacientů (24–28). Důležité je, že mutace KRAS a BRAF se nevyskytují v jednom nádoru společně, což ukazuje na to, že jejich efekt pro nádorovou transformaci buňky je podobný (20,29,30). Bylo opakovaně doloženo, že u pacientů s mutací BRAF léčba cetuximabem či panitumumabem prakticky nikdy nemá měřitelný efekt (25,28,31). Zároveň bylo prokázáno, že mutace BRAF je negativním prognostickým znakem, tedy že pacienti s detekovanou mutací BRAF mají horší prognózu bez ohledu na podávanou léčbu (26–28,32).
K inhibici BRAF lze použít řadu inhibitorů (např. sorafenib), jejichž účinek byl prokázán v buněčných modelech (31) a jsou v současnosti ve fázi klinického testování.
PI3K
Druhou signální dráhou aktivovanou EGFR je dráha AKT, jejímž prvním intracelulárním členem je PI3 kináza. Její aktivační podjednotka PIK3CA fosforyluje malou molekulu PI2P na PI3P a ta dále aktivuje skupinu AKT-kináz. PIK3CA může nést aktivující mutace v exonu 9 a 20, což se skutečně prokazuje u cca 10 % nemocných s mCRC (33–35). Tyto mutace pak vedou k trvale aktivnímu stavu PI3K a konstitutivní aktivaci uvedené dráhy, opět nezávislé na vazbě ligandu na EGFR. Studie u pacientů léčených EGFR monoklonálními protilátkami většinou potvrdily teoretický předpoklad, že tyto mutace jsou asociovány s absencí léčebné odpovědi (26,33,34). Některé práce však přinesly opačné výsledky (35), což význam mutací PIK3CA pro predikci odpovědi zpochybnilo. Recentní práce na velkém souboru nemocných (kde již bylo možné separátně hodnotit mutace v exonu 9 a exonu 20) ukazuje, že klinický význam má pravděpodobně pouze mutace v exonu 20 (36).
PTEN
Velmi podobně se jeví situace i v případě molekuly PTEN. PTEN vede k defosforylaci PI3P a udržuje tak signální dráhu neaktivní. Ztráta funkce PTEN (ať už způsobená delecí, mutací nebo hypermetylací promotoru) vede k trvalé aktivaci dráhy EGFR-PI3K-AKT. V buněčných liniích bylo prokázáno, že ztráta exprese PTEN je spojena s rezistencí k cílené anti-EGFR terapii (33,37). I zde jsou zatím publikované klinické výsledky nekoherentní, i když většina z nich silně podporuje zmiňované teoretické předpoklady (38–41). Problémem je metodika detekce ztráty funkce PTEN. Používá se nejčastěji kvantifikace imunohistochemicky prokazovaného proteinu v nádorových buňkách. Metodiky jsou však zcela nejednotné a výsledky proto obtížně porovnatelné. Studie různých autorů se liší použitou monoklonální protilátkou, metodikou semikvantitativního hodnocení i nastavením hraniční hodnoty pro ztrátu PTEN.
Overexprese EGFR
V počátcích cílené léčby monoklonálními protilátkami proti EGFR byl považován za pozitivní prediktor imunohistochemický průkaz overexprese EGFR. Ani zde kvantitativní imunohistochemie nepřinesla spolehlivé výsledky (ať již kvůli rozdílné senzitivitě používaných protilátek či kvůli nemožnosti standardizovat preanalytickou fázi, zejména délku a typ použité fixace tkáně) (42). V současné době se považuje za nezvratně prokázané, že IHC detekovaná overexprese EGFR není prediktorem odpovědi na cílenou inhibici EGFR (4–7,43).
Amplifikace EGFR
Dalším předpokládaným pozitivním prediktorem byla amplifikace genu EGFR (44,45). V publikovaných studiích je jako hraniční hodnota obvykle užíván průměrný počet kopií genu EGFR mezi 2,5–3 kopie na jádro, jde tedy o velmi nízké až hraniční zvýšení. Nicméně při takto nastavené hodnotě (jedná se o cca 30 % tumorů) je prokazatelná lepší odpověď nádorů s vyšším počtem kopií EGFR genu na anti-EGFR terapii. Je otázka, co vlastně počet necelé 3 kopie genu ukazuje. Může odrážet jen pouhou proliferační aktivitu nádoru a tedy počet buněk prošlých S fází buněčného cyklu, nebo odlišuje skupiny nádorů s různým stupněm chromozomální nestability. Při hraniční hodnotě 6 kopií genu na jádro je již zastoupení tumorů s amplifikací EGFR jen 10% (44–47). Případů s výrazně zvýšeným počtem kopií genu EGFR v buňce je mezi všemi kolorektálními karcinomy jen kolem jednoho procenta (48,49) a většina pacientů se zaznamenanou léčebnou odpovědí amplifikaci genu EGFR nemá. Jeví se proto jako neefektivní testování amplifikace provádět.
Mutace a polymorfizmy EGFR
Sporadicky se objevují práce ukazující význam germinálních polymorfizmů genu EGFR. Jejich význam je zatím nejistý (50,51).
Aktivující somatické mutace v genu EGFR, které jsou prediktorem účinnosti léčby nízkomolekulárními inhibitory tyrozinkinázové aktivity u nemalobuněčného karcinomu plic, se u kolorektálních karcinomů prakticky nevyskytují (44,52).
Genové expresní profily
Metoda genových expresních profilů ukázala na další potenciálně zajímavý faktor s prediktivní informací. Je jím exprese ligandů EGFR, zejména epiregulinu a amphiregulinu (53,54). Předpokládá se, že zvýšená exprese těchto ligandů ukazuje na aktivovanou proliferační signalizaci nádorově transformované buňky právě prostřednictvím zvýšené produkce ligandů EGFR, ať už autokrinní či parakrinní smyčkou, případně jiným způsobem. Podle zmíněného principu exkluzivity by potom nebylo pro malignizující buňku nutné vytvářet další změny pokrývající potřebu trvalé mitogenní signalizace, když už je to jedním mechanizmem zajištěno. Je tedy velmi pravděpodobné, že buňka závislá ve své proliferaci na overexpresi ligandů nebude nést mutace KRAS, BRAF, PI3K apod. Pacienti s overexpresí zmíněných molekul mají lepší klinickou odpověď na cílenou monoklonální EGFR terapii (38,53,54). Ojedinělé práce nalézají, podobně jako například u karcinomů mléčné žlázy, genové „podpisy“, jež mají predikovat senzitivitu k anti-EGFR léčbě (55,56). Je pravděpodobné, že analogicky jako u karcinomů prsu se budou takové studie opakovaně objevovat, ale že jejich výsledky budou velmi obtížně porovnatelné a klinicky málo použitelné.
SOUČASNÝ STAV PREDIKTIVNÍ DIAGNOSTIKY METASTAZUJÍCÍHO KOLOREKTÁLNÍHO KARCINOMU V ČR
V současné době se provádí vyšetřování mutačního stavu genu KRAS v těchto zařízeních: Všeobecná fakultní nemocnice a Fakultní Thomayerova nemocnice s poliklinikou v Praze, Fakultní nemocnice v Hradci Králové, Masarykův onkologický ústav v Brně, Fakultní nemocnice v Olomouci, Bioptická laboratoř s.r.o. v Plzni, P&R LAB a.s. v Novém Jičíně a CGB laboratoř a.s. v Ostravě. Tyto laboratoře musejí být akreditovány podle normy ČSN EN ISO 15 189.
Vyšetření indikuje ošetřující onkolog podle pravidel léčby mCRC daných tzv. modrou knihou České onkologické společnosti. Indikace tedy nepřísluší patologovi, což je podstatný rozdíl oproti povinnosti zajistit vyšetření stavu Her-2 u karcinomů prsu. Vyšetřeným materiálem je typicky tkáň v parafinovém bloku, může být použit i nebarvený řez na podložním skle, zmražená tkáň či jakýkoliv jiný vzorek obsahující nádorové buňky v dostatečném množství.
S ohledem na registrační studie je plátci péče stále požadováno imunohistochemické vyšetření exprese EGFR, přestože byla již mnohokrát jednoznačně potvrzena absence jeho prediktivní hodnoty (viz výše).
Úhrada vyšetření se podle dohody s plátci zdravotní péče děje prostřednictvím nově vytvořených výkonů prediktivní diagnostiky. Tyto výkony byly nasmlouvány jako nové kapacity a hrazeny výkonově, mimo paušál (situace na pracovišti autorů). Na posledním jednání Fóra onkologů v květnu 2011 však od zástupců pojišťoven zazněl jasný signál, že úhrada celé prediktivní diagnostiky bude zahrnuta v paušálech, což může znamenat jejich zastavení vyšetřování v těch zařízeních, která jsou placena paušálem. Logickým krokem by pak byl přesun všech vyšetření do laboratoří s výkonovou úhradou, takže pojišťovny vyšetření stejně zaplatí s tím, že umožní vznik faktických monopolů, a to na podkladě nerovně nastavených podmínek.
ZÁVĚR
Recentní práce (57–61) shrnují shora uvedené poznatky a navrhují komplexní testování metastatického kolorektálního karcinomu pro predikci efektu terapie monoklonálními protilátkami proti EGFR. Nádory s KRAS(wt) by se měly testovat na přítomnost mutací BRAF, PIK3CA, ztrátu exprese PTEN a případně i overexpresi epiregulinu a amphiregulinu. Tumory, které neponesou mutaci BRAF ani PIK3CA, budou mít zachovanou expresi PTEN (případy tzv.„quadruple negative“) a případně budou i overexprimovat jeden z ligandů EGFR, by měly být nejlepšími kandidáty pro cílenou anti-EGFR terapii.
Problémem je, že shora uvedené negativní prediktory, byť biologicky dobře odůvodněné, jsou dokladovány na malých souborech (30–130 pacientů). V rámci těchto souborů je bohužel značná heterogenita zařazených pacientů (stupeň předléčenosti chemoterapií, lokalizace primárního tumoru, stav mikrosatelitní nestability aj.), dále je hodnocení zatíženo ztrátami některých parametrů (analýza vzorků se nezdařila nebo již nebyl dostatek materiálu), a tak mnohé slibně vyhlížející výsledky nedosahují statistické významnosti. Zejména však všechny uvedené práce, až na jednu výjimku (61), neprovedly multivariantní analýzu, takže často se nedá s jistotou určit, zda publikovaný znak je nezávislý prediktivní faktor, anebo spíše negativní prognostický faktor asociovaný s vyšším rizikem progrese a úmrtí bez ohledu na použitou léčebnou modalitu.
Sumárně lze říci, že za prokázaný negativní prediktor odpovědi na cílenou anti-EGFR terapii u mCRC se považují jednoznačně mutace KRAS (testování je již v klinické praxi, včetně ČR, prováděno). Velmi pravděpodobně ke klinickému použití spěje i testování mutace BRAF.
PODĚKOVÁNÍ
Podpora: MZ ČR – výzkumný záměr FUNDIN MZ0MOU2005; MŠMT ČR – BBMRI_CZ (LM2010004).
Adresa pro korespondenci:
MUDr. Pavel Fabian, Ph.D.
Oddělení onkologické a experimentální patologie
Masarykův onkologický ústav, Žlutý kopec 7, 656 53 Brno
e-mail: fabian@mou.cz
tel: +420 543133400
Zdroje
1. Dušek L, Abrahámová J, Mužík, J et al. Populační odhady počtu nemocných s kolorektálním karcinomem – jeden z nástrojů včasné diagnostiky časných stadií a rekurence onemocnění. Farmakoterapie 2009; 5 : 11–20.
2. www.svod.cz
3. Poston GJ, Figueras J, Giuliante F et al. Urgent need for a new staging system in advanced colorectal cancer. J Clin Oncol 2008; 26(29): 4828–4833.
4. Cunningham D, Humblet Y, Siena S, et al. Cetuximab monotherapy and cetuximab plus irinotecan in irinotecan-refractory metastatic colorectal cancer. N Engl J Med 2004; 351(4): 337–345.
5. Saltz LB, Meropol NJ, Loehrer PJ, et al. Phase II trial of cetuximab in patients with refractory colorectal cancer that expresses the epidermal growth factor receptor. J Clin Oncol 2004; 22(7): 1201–1208.
6. Chung KY, Shia J, Kemeny NE, et al. Cetuximab shows activity in colorectal cancer patiens with tumors that do not express the epidermal growth factor receptor by immunohistochemistry. J Clin Oncol 2005; 23(9): 1803–1810.
7. Van Cutsem E, Peeters M, Siena S, et al. Open-label phase III trial of panitumumab plus best supportive care compared with best supportive care alone in patients with chemotherapy-refractory metastatic colorectal cancor. J Clin Oncol 2007; 25(13): 1658–1664.
8. Yarden Y, Sliwkowski MX. Untangling the ErbB signalling network. Nat Rev Mol Cell Biol 2001; 2(2): 127–137.
9. Sobrero AF, Maurel J, Fehrenbacher L, et al. EPIC: phase III trial of cetuximab plus irinotecan after fl uoropyrimidine and oxaliplatin failure in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26(14): 2311–2319.
10. Němeček R, Kocáková I, Kocák I, et al. Cetuximab a irinotecan v léčbě metastatického kolorektálního karcinomu – pilotní výsledky Masarykova onkologického ústavu. Klin Onkol 2009; 22(1): 27–33.
11. Amado RG, Wolf M, Peeters M, et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26(10): 1626–1634.
12. De Rookck W, Piessevaux H, De Schutter J, et al. KRAS wildtype state predicts survival and is associated to early radiological response in metastatic colorectal cancer treated with cetuximab. Ann Oncol 2008; 19(3): 508–515.
13. Lievre A, Bachet JB, Le CD, et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66(8): 3992–3995.
14. Lievre A, Bachet JB, Boige V, et al. KRAS mutations as an independent prognostic factor in patients with advanced colorectal cancer treated with cetuximab. J Clin Oncol 2008; 26(3): 374–379.
15. Bokemeyer C, Bondarenko I, Makhson A, et al. Fluorouracil, leucovorin, and oxaliplatin with and without cetuximab in the first-line treatment of metastatic colorectal cancer. J Clin Oncol 2009; 27(5): 663–671.
16. Karapetis CS, Khambata-Ford S, Jonker DJ, et al. K-ras mutations and benefit from cetuximab in advanced colorectal cancer. N Engl J Med 2008; 359(17): 1757–1765.
17. Richman SD, Seymour MT, Chambers P, et al. KRAS and BRAF mutations in advanced colorectal cancer are associated with poor prognosis but do not preclude benefit from oxaliplatin or irinotecan: results from the MRC FOCUS trial. J Clin Oncol 2009; 27(35): 5931–5937.
18. Wellcome Trust Sanger Institute. Catalogue of somatic mutations in cancer.
http://www.sanger.ac.uk/genetics/CG
/cosmic/. Accessed April 15, 2011.
19. Bos JL. ras oncogenes in human cancer: a review. Cancer Res 1989; 49(17): 4682–4689.
20. Benvenuti S, Sartore-Bianchi A, Di Nicolantonio F, et al. Oncogenic activation of the RAS/RAF signaling pathway impairs the response of metastatic colorectal cancers to anti-epidermal growth factor receptor antibody therapies. Cancer Res 2007; 67(6): 2643–2648.
21. Tol J, Koopman M, Cats A, et al. Chemotherapy, bevacizumab, and cetuximab in metastatic colorectal cancer. N Engl J Med 2009; 360(6): 563–572.
22. Dubská L, Vyskočilová M, Nenutil R et al. Vyšetření mutačního stavu genu KRAS jako součást algoritmu léčby metastatického kolorektálního karcinomu. Cas Lek Ces 2011; 150(6): 321–326.
23. Linardou H, Dahabreh IJ, Kanaloupiti D, et al. Assessment of somatic k-RAS mutations as a mechanism associated with resistance to EGFR-targeted agents: A systematic review and meta-analysis of studies in advanced non-small-cell lung cancer and metastatic colorectal cancer. Lancet Oncol 2008; 9(10): 962–972.
24. Saridaki Z, Georgoulias V, Souglakos J et al. Mechanisms of resistance to anti-EGFR monoclonal antibody treatment in metastatic colorectal cancer.World J Gastroenterol 2010; 16(10): 1177–1187.
25. Di NF, Martini M, Molinari F, et al. Wildtype BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer. J Clin Oncol 2008; 26(35): 5705–5712.
26. Laurent-Puig P, Cayre A, Manceau G, et al. Analysis of PTEN, BRAF, and EGFR status in determining benefit from cetuximab therapy in wild-type KRAS metastatic colon cancer. J Clin Oncol 2009; 27(35): 5924–5930.
27. Sartore-Bianchi A, Martini M, Molinari F, et al. PIK3CA mutations in colorectal cancer are associated with clinical resistance to EGFR-targeted monoclonal antibodies. Cancer Res 2009; 69(5): 1851–1857.
28. Souglakos J, Philips J, Wang R, et al. Prognostic and predictive value of common mutations for treatment response and survival in patients with metastatic colorectal cancer. Br J Cancer 2009; 101(3): 465–472.
29. Rajagopalan H, Bardelli A, Lengauer C, et al. Tumorigenesis: RAF/RAS oncogenes and mismatch-repair status. Nature 2002; 418 (6901): 934.
30. Fearon ER, Vogelstein B . A genetic model for colorectal tumorigenesis. Cell 1990; 61(5): 759–767.
31. Di Nicolantonio F, Martini M, Molinari F, et al. Wild-type BRAF is required for response to panitumumab or cetuximab in metastatic colorectal cancer. J Clin Oncol 2008; 26(35): 5705–5712.
32. Saridaki Z, Papadatos-Pastos D, Tzardi M, et al. BRAF mutations, microsatellite instability status and cyclin D1 expression predict metastatic colorectal patients’ outcome. Br J Cancer 2010; 102(12): 1762–1768.
33. Jhawer M, Goel S, Wilson AJ, et al. PIK3CA mutation/PTEN expression status predicts response of colon cancer cells to the epidermal growth factor receptor inhibitor cetuximab. Cancer Res 2008; 68(6): 1953–1961.
34. Ogino S, Nosho K, Kirkner GJ, et al. PIK3CA mutation is associated with poor prognosis among patients with curatively resected colon cancer. J Clin Oncol 2009; 27(9): 1477–1484.
35. Prenen H, De Schutter J, Jacobs B, et al. PIK3CA mutations are not a major determinant of resistance to the epidermal growth factor receptor inhibitor cetuximab in metastatic colorectal cancer. Clin Cancer Res 2009; 15(9): 3184–3188.
36. De Rook W, Claes B, Bernasconi D, et al. Effects of KRAS, BRAF, NRAS, and PIK3CA mutations on the efficacy of cetuximab plus chemotherapy in chemotherapy-refractory metastatic colorectal cancer: a retrospective consortium analysis. Lancet Oncol 2010; 11(8): 753–762.
37. Bianco R, Shin I, Ritter CA, et al. Loss of PTEN/MMAC1/TEP in EGF receptor-expressing tumor cells counteracts the antitumor action of EGFR tyrosine kinase inhibitors. Oncogene 2003; 22(18): 2812–2822.
38. Loupakis F, Pollina L, Stasi I, et al. PTEN expression and KRAS mutations on primary tumors and metastases in the prediction of benefit from cetuximab plus irinotecan for patients with metastatic colorectal cancer. J Clin Oncol 2009; 27(16): 2622–2629.
39. Frattini M, Saletti P, Romagnani E, et al. PTEN loss of expression predicts cetuximab efficacy in metastatic colorectal cancor patients. Br J Cancer 2007; 97(8): 1139–1145.
40. Perrone F, Lampis A, Orsenigo M, et al. PI3KCA/PTEN deregulation contributes to impaired responses to cetuximab in metastatic colorectal cancer patients. Ann Oncol 2009; 20(1): 84–90.
41. Razis E, Briasoulis E, Vrettou E, et al. Potential value of PTEN in predicting cetuximab response in colorectal cancer. An exploratory study. BMC Cancer 2008; 8 : 234.
42. Shia J, Klimstra DS, Li AR, et al. Epidermal growth factor receptor expression and gene amplifi cation in colorectal carcinoma: an immunohistochemical and chromogenic in situ hybridization study. Mod Pathol 2005; 18(10): 1350–1356.
43. Mitchell EP, Hecht JR, Baranda J, et al. Panitumumab activity in metastatic colorectal cancer patients with low or negative tumor epidermal growth factor receptor levels: an updated analysis J Clin Oncol 2007; 25(18): 4082.
44. Moroni M, Veronese S, Benvenuti S, et al. Gene copy number for epidermal rowth factor receptor (EGFR) and clinical response to antiEGFR treatment in colorectal cancer: a cohort study. Lancet Oncol 2005; 6(5): 279–286.
45. Sartore-Bianchi A, Moroni M, Veronese S, et al. Epidermal growth factor receptor gene copy number and clinical outcome of metastatic colorectal cancer treated with panitumumab. J Clin Oncol 2007; 25(22): 3238–3245.
46. Cappuzzo F, Finocchiaro G, Rossi E, et al. EGFR FISH assay predicts for response to cetuximab in chemotherapy refractory colorectal cancor patients. Ann Oncol 2008; 19(4): 717–723.
47. Personeni N, Fieuws S, Piessevaux H, et al. Clinical usefulness of EGFR gene copy number as a predictive marker in colorectal cancer patiens treated with cetuximab: a fl uorescent in situ hybridization study. Clin Cancer Res 2008; 14(18): 5869–5876.
48. Al-Kuraya K, Novotny H, Bavi P, et al. HER2, TOP2A, CCND1, EGFR and C - MYC oncogene amplification in colorectal cancer. J Clin Pathol 2007; 60(7): 768–72.
49. Petrova D, Jankova R, Yosifova A, et al. Tissue microarray analysis of EGFR gene amplification and gain in Bulgarian patients with colorectal cancer. Onkologie 2006; 29 (5): 198–200.
50. Goncalves A, Esteyries S, Taylor-Smedra B, et al. A polymorphism of EGFR extracellular domain is associated with progression free-survival in metastatic colorectal cancer patients receiving cetuximab-based treatment. BMC Cancer 2008; 8 : 169.
51. Wang WS, Chen PM, Chiou TJ, et al. Epidermal growth factor receptor R497K polymorphism is a favorable prognostic factor for patients with colorectal carcinoma. Clin Cancer Res 2007; 13(12): 3597–3604.
52. Barber TD, Vogelstein B, Kinzler KW, et al. Somatic mutations of EGFR in colorectal cancers and glioblastomas. N Engl J Med 2004; 351(27): 2883.
53. Khambata-Ford S, Garrett CR, Meropol NJ, et al. Expression of epiregulin and amphiregulin and K-ras mutation status predict disease control in metastatic colorectal cancer patients treated with cetuximab. J Clin Oncol 2007; 25(22): 3230–3237.
54. Jacobs B, De Roock W, Piessevaux H, et al. Amphiregulin and epiregulin mRNA expression in primary tumors predicts outcome in metastatic colorectal cancer treated with cetuximab. J Clin Oncol 2009; 27(30): 5068–5074.
55. Balko JM, Black EP. A gene expression predictor of response to EGFR-targeted therapy stratifies progression-free survival to cetuximab in KRAS wild-type metastatic colorectal cancer. BMC Cancer 2009; 13(9): 145.
56. Baker JB, Dutta D, Watson D et al. Tumour gene expression predicts response to cetuximab in patients with KRAS wild-type metastatic colorectal cancer. Br J Cancer 2011; 104(3): 488–495.
57. Bardelli A, Siena S Molecular mechanisms of resistance to cetuximab and panitumumab in colorectal cancer. J Clin Oncol 2010; 28(7): 1254-1261.
58. Siena S, Sartore-Bianchi A, Di Nicolantonio F. Biomarkers predicting clinical outcome of epidermal growth factor receptor-targeted therapy in metastatic colorectal cancer. J Natl Cancer Inst 2009; 101(19): 1308-24.
59. Spindler KL, Pallisgaard N, Lindebjerg J, Frifeldt SK, Jakobsen A. EGFR related mutational status and association to clinical outcome of third-line cetuximab-irinotecan in metastatic colorectal cancer. J BMC Cancer 2011; 11 : 107.
60. Park JH, Han SW, Oh DY. Analysis of KRAS, BRAF, PTEN, IGF1R, EGFR intron 1 CA status in both primary tumors and paired metastases in determining benefit from cetuximab therapy in colon cancer. Cancer Chemother Pharmacol. In press 2011.
61. Saridaki Z, Tzardi M, Papadaki C et al. Impact of KRAS, BRAF, PIK3CA mutations, PTEN, AREG, EREG expression and skin rash in ≥ 2 line cetuximab-based therapy of colorectal cancer patients. PLoS One 2011; 6(1): e15980.
Štítky
Patologie Soudní lékařství Toxikologie
Článek PATOLOGIE MAMMYČlánek CYTODIAGNOSTIKAČlánek PATOLOGIE GITČlánek HEPATOPATOLOGIEČlánek PATOLOGIE GITČlánek JAKÁ JE VAŠE DIAGNÓZA?Článek PATOLOGIE ORL OBLASTIČlánek DERMATOPATOLOGIEČlánek Carneyho komplex
Článek vyšel v časopiseČesko-slovenská patologie

2011 Číslo 4-
Všechny články tohoto čísla
- Terapeuticko-indikační patologie – “from bench to bedside”
- Karcinom pankreatu je zatím smutnou kapitolou medicíny
- HEMATOPATOLOGIE, ENDOKRINOPATOLOGIE, GYNEKOPATOLOGIE...
- Zjednodušené schéma receptorových mechanismů a intracelulárních signálních drah v nádorové buňce s možnými cíli biologické léčby
- Prediktivní diagnostika u karcinomu prsu
- Molekulární diagnostika gastrointestinálních stromálních tumorů ve vztahu k predikci terapeutické odpovědi na cílenou biologickou léčbu
- PATOLOGIE MAMMY
- Molekulární prediktory cílené anti-EGFR terapie u metastatického kolorektálního karcinomu
- CYTODIAGNOSTIKA
- Prediktivní diagnostika HER2 v adenokarcinomu žaludku
- PATOLOGIE GIT
- Cielená liečba melanómu: fakt alebo fikcia?
- HEPATOPATOLOGIE
- Novinky v klasifikaci adenokarcinomů plic a potenciální prognostické a prediktivní faktory u nemalobuněčných plicních karcinomů
- PATOLOGIE GIT
- Klinické registry jako nezbytná podpora personalizované medicíny
- JAKÁ JE VAŠE DIAGNÓZA?
- „Gigantický“ bazocelulárny karcinóm kože hlavy s intrakraniálnou propagáciou – kazuistika
- JAKÁ JE VAŠE DIAGNÓZA? - ODPOVĚĎ
- Akantolytický variant skvamózneho karcinómu prsnej žľazy. Kazuistika a prehľad literatúry
- PATOLOGIE ORL OBLASTI
- Intraperikardiální teratom jako příčina intrauterinního odumření – kazuistika
- DERMATOPATOLOGIE
- Carneyho komplex
- Primárna sklerozujúca cholangitída
- UROPATOLOGIE, GYNEKOPATOLOGIE, HEMATOPATOLOGIE, NEUROPATOLOGIE, ORTOPEDICKÁ PATOLOGIE
- Profesor Habanec osmdesátiletý
- K životnému jubileu prof. MUDr. Štefana Galbavého, DrSc.
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Carneyho komplex
- Prediktivní diagnostika HER2 v adenokarcinomu žaludku
- Prediktivní diagnostika u karcinomu prsu
- „Gigantický“ bazocelulárny karcinóm kože hlavy s intrakraniálnou propagáciou – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání