-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Cielená liečba melanómu: fakt alebo fikcia?
Targeted therapy of melanoma: Fact or fiction ?
Advanced malignant melanoma is incurable by the current means of therapy. Traditional morphological classification (nodular melanoma, lentigo maligna melanoma, nevoid melanoma etc.) does not have any significant prognostic or predictive impact. Recent advances in molecular pathogenesis and the availability of targeted therapies have produced several positive results. In the near future, the main challenge for pathologists, geneticists and oncologists will be the identification of accurate therapeutic targets, as well as mechanisms of resistance, in melanoma in the particular patient in care.
Keywords:
melanoma – pathogenesis – genetics – targeted therapy – BRAF – vemurafenib
Autoři: Švajdler M. Ihash2ihash4 ml. 1 2 1
Působiště autorů: Oddelenie patológie UNLP Košice, pracovisko Trieda SNP 1, Cytopathos s. r. o., Bratislava 1
Vyšlo v časopise: Čes.-slov. Patol., 47, 2011, No. 4, p. 165-167
Kategorie: Přehledový článek
Souhrn
Pokročilý malígny melanóm je v súčasnosti neliečiteľné ochorenie. Tradičná morfologická klasifikácia (nodular melanoma, lentigo maligna melanoma, nevoid melanoma atď.) nemá väčší prognostický alebo prediktívny význam. Nové poznatky z molekulárnej patogenézy a dostupnosť cielených farmakologických prípravkov začínajú prinášať prvé pozitívne výsledky. Výzvou blízkej budúcnosti pre patológov, genetikov a onkológov bude identifikácia správnych terapeutických cieľov a mechanizmov rezistencie u konkrétneho pacienta.
Kľúčové slová:
melanóm – patogenéza – genetika – cielená liečba – BRAF – vemurafenibMalígny melanóm diagnostikovaný a liečený chirurgicky vo včasnom štádiu má excelentnú prognózu. Melanóm, ktorý je inoperabilný alebo má distantné metastázy je v súčasnosti neliečiteľné ochorenie s hrozivou prognózou – len 14 % pacientov prežíva päť rokov (1,2). Výsledok súčasnej adjuvantnej terapie je minimálny. Efekt rôznych chemoterapeutík ako aj biologickej liečby (interferón, interleukín-2), vrátane rôznych kombinácií (biochemoterapia) je v rozmedzí 15–25 %, s žiadnym alebo len minimálnym zlepšením celkového prežívania (1).
Aj keď identifikácia signálnych ciest vedúcich ku vzniku a progresii melanómu nie je ani zďaleka kompletná, doposiaľ získané vedomosti otvárajú nové možnosti hľadania účinnejších spôsobov liečby.
V nasledujúcich riadkoch prinášame stručný a značne zjednodušený pohľad na molekulárnu patogenézu a možnosti cielenej liečby malígneho melanómu. Ako príklad uvedieme velmi sľubnú inhibíciu mutovaného BRAF proteínu.
Genetické alterácie v malígnom melanóme
Vo väčšine melanómov sú aktivované dve hlavné signálne cesty (obr. 1): cesta MAPK (mitogen-activated protein kinase) zahŕňajúca signálnu kaskádu RAS-RAF-MEK-ERK, ktorá má významnú úlohu v bunkovom raste, a cesta PI3K-AKT-mTOR, regulujúca najmä apoptózu. Samotná alterácia hlavných proteínov týchto ciest však nevedie k vzniku melanómu – napr. mutácie BRAF alebo RAS sa vyskytujú rovnako často v melanóme ako aj benígnych névoch. Na progresiu sú nutné ďalšie genetické alterácie, predovšetkým v génoch pre tumor supresory.
Obr. 1. Vybrané cesty v patogenéze melanómu. Popis v texte. 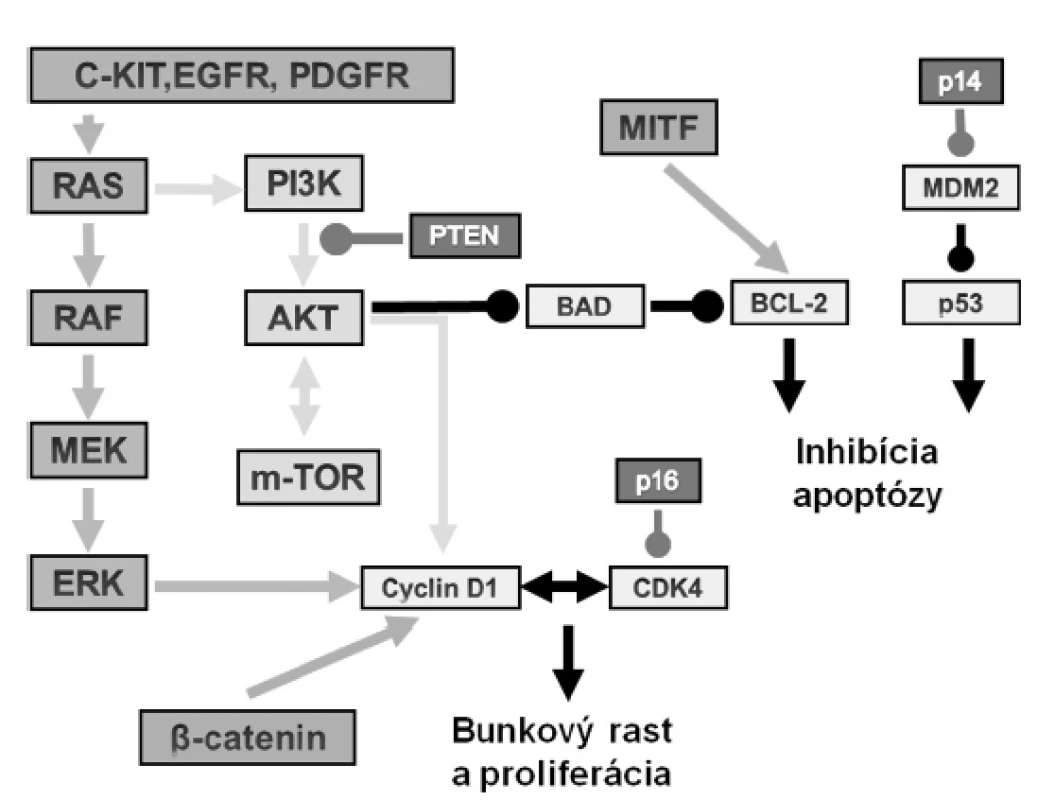
Častou mutáciou je inaktivácia tumor supresora CDKN2A, génu, ktorý kóduje dva proteíny – inhibítor bunkového cyklu p16INK4A (inhibuje aktivitu komplexu cyclinD1/CDK4) a proteín p14ARF (je antagonistom proteínu MDM2, regulátora ubiquinácie p53). Úlohu CDKN2A podčiarkuje fakt, že jeho mutácia sa vyskytuje približne u 25–40 % rodín s familiárnym malígnym melanómom.
Ďalšie rodiny s rodinným výskytom melanómu majú vzácne mutácie v kináze CDK4, amplifikácia ktorej sa vyskytuje aj v sporadických melanómoch, najčastejšie v akrálnych a mukozálnych. Amplifikácia CDK4 sa vyskytuje nezávisle od mutácie BRAF, N-RAS a CCND1 (kóduje cyclin D1, regulátor kinázy CDK4). Častá amplifikácia CCND1, ktorá je tiež nezávislá od mutácie BRAF, podčiarkuje úlohu cyclin D1 ako ďalšieho samostatného faktora progresie melanómu.
Významnú úlohu hraje aj mutácia tumor supresora PTEN (vyskytuje sa spolu s mutáciou BRAF ale nie N-RAS), ktorý oslabuje aktiváciu AKT udržiavaním nízkej hladiny fosfatidylinositol-3-fosfátu. Aktivita AKT (inaktivuje okrem iného napr. BAD - supresor kľúčového antiapoptotického proteínu BCL-2) však môže byť zvyšená aj amplifikáciou génu a overexpresiou.
Prevažne v melanómoch so zlou prognózou sa vyskytuje amplifikácia transkripčného proteínu MITF (zvyšuje expresiu BCL-2).
Pri invázii a ďalšom šírení melanómu zohráva úlohu strata bunkovej kohezivity, za ktorú sú zodpovedné alterácie v expresii cadherínov a integrínov. Intracelulárna doména cadherínov je funkčne asociovaná s komplexom proteínov, ktorý zahŕňa β-catenin, ktorý má kľúčovú úlohu v bunkovej adhézii a signalizácii. Alterácia signalizácie β-catenínu (regulovaná WNT cestou) vedie k zvýšeniu jeho koncentrácie v cytoplazme a jadre, kde spôsobuje expresiu viacero proteínov regulujúcich bunkový cyklus (napr. MITF a cyclin D1).
Melanóm variabilne exprimuje viacero, pre cielenú terapiu zaujímavých, receptorov rastových faktorov, vrátane EGFR, PDGFR, ErbB4 ako aj c-KIT (2–7).
Melanómy z rôznych častí tela, s odlišnou expozíciou na UV žiarenie – akrálne, mukozálne, na miestach s chronickým sololárnym poškodením a bez solárneho poškodenia – sa líšia zastúpením jednotlivých genetických alterácií. Akrálne a mukozálne melanómy majú signifikantne vyšší počet rôznych amplifikácií (napr. CCND1), zatiaľ čo amplifikácie sú vzácne v ďalších dvoch skupinách. V skupine bez chronického solárneho poškodenia je signifikantne častejšia mutácia BRAF a strata PTEN. Mutácie N-RAS sa vyskytujú bez signifikantnejšej asociácie s typom melanómu, pričom mutácie BRAF a N-RAS sú vzájomne exkluzívne (4). Mutácia c-KIT sa vyskytuje iba v akrálnych a mukozálnych melanómoch a v melanómoch s chronickým solárnym poškodením (8).
BRAF ako potencionálny terapeutický cieľ
Aktivujúce mutácie BRAF (člen rodiny kináz RAF), boli identifikované v rôznom percente vo viacerých malignitách. Vysoko nad ostatnými (napr. karcinómy hrubého čreva, ovária) vyčnieva výskyt v malígnom melanóme (50–59 %) ako aj papilárnom a anaplastickom karcinóme štítnej žľazy (cca 40–70 %) (4,9,10). Vo väčšine prípadov (približne 90 %) sa jedná o bodovú mutáciu TřA nukleotidu 1796, ktorá vedie v sekvencii aminokyselín k zámene valínu za kyselinu glutámovú na pozícii 599, v aktivačnej doméne BRAF (označovaná bežne ako BRAFV600E) (9). Vysoký výskyt mutácií BRAF v malígnych nádoroch podnietil výrazný záujem o cielenú inhibíciu tejto signálnej cesty (11).
Flaherty a spol. publikovali v roku 2010 štúdiu, v ktorej použili inhibítor mutovaného BRAFV600E PLX4032 (vemurafenib) na liečbu malígneho melanómu. V prvej fáze štúdie bolo primárnym cieľom určenie bezpečnosti a farmakokinetiky. Následne stanovili objektívnu terapeutickú odpoveď a jej trvanie. Do štúdie bolo zaradených 81 pacientov s metastázujúcim melanómom, pričom 48 z nich malo mutovaný BRAF (všetkých 32 pacientov v druhej fáze štúdie). Na posúdenie farmakodynamiky bola u siedmich pacientov pri vstupe do štúdie a na 15. deň liečby vykonaná biopsia a imunohistochemické porovnanie expresie fosforylovaného ERK, cyklínu D1 a Ki-67. Vo všetkých prípadoch došlo k signifikantnej redukcii expresie všetkých sledovaných proteínov, indikujúc úspešnú inhibíciu MAPK cesty. Z 32 pacientov zaradených do druhej fázy štúdie malo 26 (81 %) terapeutickú odpoveď, z toho 24 pacienti parciálnu a dvaja kompletnú. V čase publikácie bolo 16 z 32 pacientov stále v štúdii, s mediánom času do progresie sedem mesiacov; celkové prežívanie nebolo stanovené. U žiadneho pacienta s wild-typ BRAF terapeutická odpoveď pozorovaná nebola (12). Štúdia fázy 2 účinnosti PLX4032 u pacientov s BRAF mutovaným metastatickým melanómom, ktorí podstúpili najmenej jednu prvolíniovú liečbu (BRIM-2; 132 pacientov), dokázala 52,3% odpoveď s mediánom trvania odpovede 6,7 mesiaca (13). Následná randomizovaná štúdia fázy 3 (BRIM-3) porovnávajúca účinnosť PLX4032 oproti dakarbazínu (675 pacientov, bez predchádzajúcej liečby), dokázala zlepšenie celkového prežívania ako aj času do progresie. V šiestom mesiaci bolo celkové prežívanie v ramene liečenom vemurafenibom 84 %, oproti 64 % liečeným dakarbazínom (výsledok je však limitovaný krátkym sledovaním). Liečebná odpoveď bola zaznamenaná v 48 % pri vemurafenibe a len 5 % pri dakarbazíne (BRAF mutované melanómy sú však pravdepodobne rezistentnejšie na chemoterapiu). Liečba vemurafenibom v porovnaní s dakarbazínom redukovala riziko úmrtia o 63 % a riziko progresie o 74 % (14).
Podobne ako pri iných molekulárnych cieľoch, aj pri inhibícii BRAF je dôležitým faktorom primárna a sekundárna rezistencia na liečbu (11). Časť mechanizmov zodpovedných za rezistenciu na inhibíciu BRAFV600E bolo už objasnených, predovšetkým v in vitro modeloch (obr.2)(15). PLX4032 inhibuje MAPK cestu iba v bunkách s mutovaným BRAF. Za normálnych okolností RAS spôsobuje dimerizáciu BRAF, a naviazanie lieku na jeden BRAF spôsobuje paradoxnú aktiváciu druhého. Ak je však BRAF mutovaný, normálna aktivita RAS nestačí na formovanie dimérov BRAF a ten môže byť inhibovaný. Aktivačná mutácia RAS spôsobuje zvýšenú dimerizáciu mutovaného BRAF a tým aj rezistenciu na liečbu.
Obr. 2. Schéma inhibície mutovaného BRAF (vľavo) a mechanizmy rezistencie (<em>vpravo</em>). 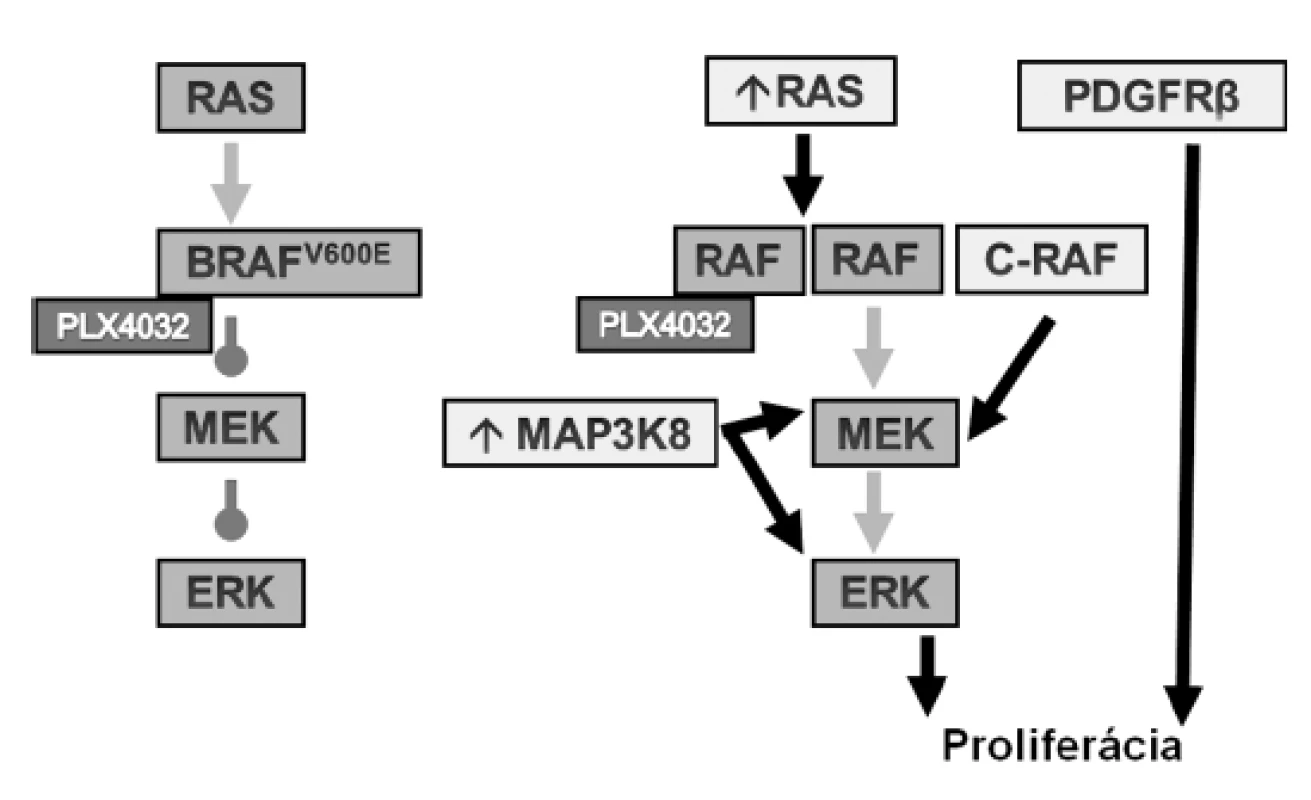
Ďalšími mechanizmami rezistencie je overexpresia ďalšieho člena rodiny kináz RAF - RAF1 (C-RAF), a overexpresia kinázy MAP3K8 (COT), ktorá fosforyluje MEK nezávisle od RAF. Navyše, MAP3K8 môže priamo aktivovať aj ERK. Za rezistenciu môže byť zodpovedná aktivácia alternatívnych ciest, napr. prostredníctvom PDGFRβ alebo iných receptorov tyrozínkináz (15).
Záver
Malígny melanóm nepredstavuje homogénne ochorenie. Ide o skupinu viacerých malignít vznikajúcich rôznymi cestami, ktoré viac-menej korelujú s expozíciou na UV žiarenie. Genetická klasifikácia a identifikácia potenciálnych terapeutických cieľov bude v budúcnosti prínosnejšia ako v súčasnosti používaná histologická klasifikácia, ktorá nemá väčší prognostický alebo prediktívny význam. Identifikácia terapeutických cieľov je výrazným prísľubom pre pacientov a bude výzvou pre rutínnu diagnostickú prax patológov a genetikov. Na to, či cielená liečba zlepší celkové prežívanie pacientov, výber najvhodnejších liekov (a ich kombinácií) ako aj konkrétnych stratégií na odhalenie primárnej alebo sekundárnej rezistencie si musíme ešte počkať. Na otázku ,,Cielená liečba melanómu: fakt alebo fikcia ?” sa však núka mierne optimimistická odpoveď.
Adresa pro korespondenci:
MUDr. Marián Švajdler ml.
Oddelenie patológie UNLP Košice
Pracovisko Trieda SNP 1
041 66 Košice
tel: +421 556402914; fax: +421 556402945
e-mail: svajdler@yahoo.com
Zdroje
1. Jilaveanu LB, Aziz SA, Kluger HM. Chemotherapy and biologic therapies for melanoma: do they work? Clin Dermatol 2009; 27(6): 614–625.
2. Miller AJ, Mihm MC Jr. Melanoma. N Engl J Med 2006; 355(1): 51–65.
3. Ko JM, Fisher DE. A new era: melanoma genetics and therapeutics. J Pathol 2011; 223(2): 241–250.
4. Curtin JA, Fridlyand J, Kageshita T, et al. Distinct sets of genetic alterations in melanoma. N Engl J Med 2005; 353(20): 2135–2147.
5. Ko JM, Velez NF, Tsao H. Pathways to melanoma. Semin Cutan Med Surg 2010; 29(4): 210–217.
6. Settleman J. A therapeutic opportunity in melanoma: ErbB4 makes a mark on skin. Cancer Cell 2009; 16(4): 278–279.
7. Dahl C, Guldberg P. The genome and epigenome of malignant melanoma. APMIS 2007; 115(10): 1161–1176.
8. Curtin JA, Busam K, Pinkel D, Bastian BC. Somatic activation of KIT in distinct subtypes of melanoma. J Clin Oncol 2006; 24(26): 4340–4346.
9. Davies H, Bignell GR, Cox C, et al. Mutations of the BRAF gene in human cancer. Nature 2002; 417(6892): 949–954.
10. Puxeddu J, Moretti S, Elisei R, et al. BRAF(V599E) mutation is the leading genetic event in adult sporadic papillary thyroid carcinomas. J Clin Endocrinol Metab 2004; 89(5): 2414–2420.
11. Puzanov I, Burnett P, Flaherty KT. Biological challenges of BRAF inhibitor therapy. Mol Oncol 2011; 5(2): 116–123.
12. Flaherty KT, Puzanov I, Kim KB, et al. Inhibition of mutated, activated BRAF in metastatic melanoma. N Engl J Med 2010; 363(9): 809–819.
13. Ribas A, Kim KB, Schuchter LM, et al. BRIM-2: an open-label, multicenter phase II study of vemurafenib in previously treated patients with BRAFV600E mutation-positive metastatic melanoma. J Clin Oncol 2011; 29(Suppl): 8509.
14. Chapman PB, Hauschild A, Robert C et al. Improved survival with vemurafenib in melanoma with BRAF V600E mutation. N Engl J Med 2011; 364(26): 2507–2516.
15. Solit DB, Rosen N. Resistance to BRAF inhibition in melanomas. N Engl J Med 2011; 364(8): 772–774.
Štítky
Patologie Soudní lékařství Toxikologie
Článek PATOLOGIE MAMMYČlánek CYTODIAGNOSTIKAČlánek PATOLOGIE GITČlánek HEPATOPATOLOGIEČlánek PATOLOGIE GITČlánek JAKÁ JE VAŠE DIAGNÓZA?Článek PATOLOGIE ORL OBLASTIČlánek DERMATOPATOLOGIEČlánek Carneyho komplex
Článek vyšel v časopiseČesko-slovenská patologie

2011 Číslo 4-
Všechny články tohoto čísla
- Terapeuticko-indikační patologie – “from bench to bedside”
- Karcinom pankreatu je zatím smutnou kapitolou medicíny
- HEMATOPATOLOGIE, ENDOKRINOPATOLOGIE, GYNEKOPATOLOGIE...
- Zjednodušené schéma receptorových mechanismů a intracelulárních signálních drah v nádorové buňce s možnými cíli biologické léčby
- Prediktivní diagnostika u karcinomu prsu
- Molekulární diagnostika gastrointestinálních stromálních tumorů ve vztahu k predikci terapeutické odpovědi na cílenou biologickou léčbu
- PATOLOGIE MAMMY
- Molekulární prediktory cílené anti-EGFR terapie u metastatického kolorektálního karcinomu
- CYTODIAGNOSTIKA
- Prediktivní diagnostika HER2 v adenokarcinomu žaludku
- PATOLOGIE GIT
- Cielená liečba melanómu: fakt alebo fikcia?
- HEPATOPATOLOGIE
- Novinky v klasifikaci adenokarcinomů plic a potenciální prognostické a prediktivní faktory u nemalobuněčných plicních karcinomů
- PATOLOGIE GIT
- Klinické registry jako nezbytná podpora personalizované medicíny
- JAKÁ JE VAŠE DIAGNÓZA?
- „Gigantický“ bazocelulárny karcinóm kože hlavy s intrakraniálnou propagáciou – kazuistika
- JAKÁ JE VAŠE DIAGNÓZA? - ODPOVĚĎ
- Akantolytický variant skvamózneho karcinómu prsnej žľazy. Kazuistika a prehľad literatúry
- PATOLOGIE ORL OBLASTI
- Intraperikardiální teratom jako příčina intrauterinního odumření – kazuistika
- DERMATOPATOLOGIE
- Carneyho komplex
- Primárna sklerozujúca cholangitída
- UROPATOLOGIE, GYNEKOPATOLOGIE, HEMATOPATOLOGIE, NEUROPATOLOGIE, ORTOPEDICKÁ PATOLOGIE
- Profesor Habanec osmdesátiletý
- K životnému jubileu prof. MUDr. Štefana Galbavého, DrSc.
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Carneyho komplex
- Prediktivní diagnostika HER2 v adenokarcinomu žaludku
- Prediktivní diagnostika u karcinomu prsu
- „Gigantický“ bazocelulárny karcinóm kože hlavy s intrakraniálnou propagáciou – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



