-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Molekulární diagnostika gastrointestinálních stromálních tumorů ve vztahu k predikci terapeutické odpovědi na cílenou biologickou léčbu
Gastrointestinal stromal tumor molecular diagnostics in relation to the prediction of a therapeutic response to targeted biological therapy
Targeted therapy based on the inhibition of the receptor tyrosine kinases has improved the outcome of patients with metastatic, recurrent and/or unresectable gastrointestinal stromal tumors (GIST). Activating mutations of KIT and PDGFRA genes, which code for receptor tyrosine kinases, play an important role in the malignant transformation of stromal cells in the gastrointestinal tract. The response to targeted therapy is associated with the presence and type of mutations. Molecular identification of the primary mutational status became an important tool in predicting the response to therapy (sensibility/resistance). The identification of secondary mutations occurring in patients treated with targeted therapy may explain the cause of acquired, secondary resistance of GIST. In these cases, mutational analysis represents a tool to explain failure of the therapy and provides a rationale for alternative therapeutic strategies.
Keywords:
GIST – receptor tyrosine kinases – KIT – PDGFRA – targeted therapy – molecular analysis
Autoři: A. Augustiňáková; R. Kodet
Působiště autorů: Ústav patologie a molekulární medicíny, 2. LF UK a FN Motol, Praha
Vyšlo v časopise: Čes.-slov. Patol., 47, 2011, No. 4, p. 148-152
Kategorie: Přehledový článek
Souhrn
Cílená biologická léčba založená na inhibici receptorových tyrosinkináz přinesla průlom v terapii pacientů s metastatickým, recidivujícím nebo inoperabilním gastrointestinálním stromálním tumorem (GIST). Aktivační mutace genů KIT a PDGFRA, které kódují příslušné receptorové tyrozinkinázy, jsou jedním z hlavních faktorů maligní transformace stromálních buněk trávicího ústrojí. Přesná lokalizace mutací rovněž určuje odezvu nádoru na cílené terapeutikum. Molekulární diagnostika primárních mutací se v tomto ohledu stává důležitým nástrojem pro určení citlivosti respektive rezistence nádoru na terapii. Význam molekulární analýzy navíc spočívá v detekci sekundárních mutací zodpovědných za získanou rezistenci nádoru k biologické terapii. Mutační analýza v tomto případě umožňuje vysvětlit selhávání terapie a poskytuje příležitost pro volbu alternativní léčby.
Klíčová slova:
GIST – receptorové tyrozinkinázy – KIT – PDGFRA – cílená biologická terapie – molekulární analýzaGastrointestinální stromální tumory (GIST) patří mezi nejčastější mezenchymální nádory gastrointestinálního traktu (GIT) (1).
Morfologicky tvoří heterogenní skupinu nádorů, u které se setkáváme s odlišnostmi a rozdíly v rámci jednoho nádoru, stejně jako s odlišnostmi mezi jednotlivými nádory v rámci této skupiny onemocnění. Nádor je nejčastěji složen z vřetenitých buněk (přibližně 70 %). Méně častá je epiteloidní varianta (20 %) s polygonálními buňkami a s relativně uniformními jádry kulatého až oválného tvaru (2). Existují i varianty smíšené (10 %) (3).
GIST mohou vzniknout kdekoliv v trávicí trubici od jícnu až po rektum. Jejich nejčastější lokalizací je však žaludek (40–60 %) a tenké střevo (30–40 %). S přítomností nádoru v dalších intraabdominálních orgánech, tj. v jícnu, tlustém střevu, rektu nebo apendixu se setkáváme ojediněle (u méně než 10 % případů) (2,4). Možný, i když vzácný, je výskyt tohoto typu nádoru ve tkáních a orgánech mimo trávicí trakt. Jedná se o tzv. extragastrointestinální stromální tumory (EGIST) lokalizované v mesenteriu, retroperitoneu, v močovém měchýři, žlučníku, játrech, prostatě, vagině, děloze, ale i na pleuře.
HISTOPATOLOGICKÁ DIAGNOSTIKA GIST
Histopatologická diagnostika GIST je založena na stanovení charakteristických morfologických a imunofenotypových znaků nádorových buněk. Kromě již zmíněného základního morfologického obrazu je typickým a diagnosticky významným znakem GIST exprese transmembránového proteinu KIT (povrchová molekula CD117), který je u GIST detekován přibližně v 95 % (5).
Dalšími diferenciálně diagnosticky hodnotnými vyšetřeními je imunohistochemický průkaz exprese molekuly CD34 (60–70 %) a markerů svalové, případně neuroektodermální, diferenciace, zpravidla hladkosvalového aktinu (30–40 %), proteinu S100 (5 %) a desminu (1–2 %). Pozitivita CD117 je obvykle silná a difúzní, s cytoplazmatickou, membranózní nebo perinukleární (bodovou) distribucí. Některé případy CD117 negativních nádorů jsou charakteristicky spojeny s epiteloidní morfologií, lokalizací v žaludku, omentu či v retroperitoneu a s přítomností mutací v genu PDGFRA (3).
Častá koexprese proteinu KIT a povrchové molekuly CD34, která je společná pro GIST i intersticiální Cajalovy buňky (ICC, interstitial cells of Cajal) vedla k úvahám o pravděpodobném vzniku GIST z transformovaných ICC nebo z jejich prekurzorů, tedy z tkáňových progenitorových buněk diferencujících se v ICC. V rámci GIT mají ICC funkci tzv. pacemarkerů (2,6). Ve stěně trávicí trubice zprostředkovávají přenos impulzů mezi nervovými buňkami a buňkami hladké svaloviny a podílejí se na řízení peristaltiky střev (6,7).
Podrobnější histopatologickou diagnostiku GIST uvádíme v přehledném článku věnovanému této problematice (8). Bližší orientaci lze získat i z dalších článků publikovaných v českém i zahraničním písemnictví (9–14).
RECEPTOROVÉ TYROZINKINÁZY
Jedním z dosud známých patogenetických mechanizmů vzniku GIST jsou aktivační mutace genů KIT a PDGFRA (plateled-derived growth factor receptor alpha), které kódují příslušné receptorové tyrozinkinázy (RTK) KIT a PDGFRA. Proteiny KIT i PDGFRA patří do rodiny receptorů podobných receptoru pro destičkový růstový faktor (PDGFR), která je také označována pořadovým číslem III. Mimo zmiňovaných proteinů KIT a PDGFRA patří do této skupiny rovněž proteiny PDGFRB, CSF1 (colony stimulating factor-1) a FLT3 (FMS-like tyrosin kinase-3)(15). Pro uvedenou skupinu receptorů je charakteristická přítomnost pěti domén podobných molekule imunoglobulinu v extracelulární části, jednoduchá transmembránová část a intracelulární část proteinu se dvěma tyrozinkinázovými doménami (TK1 a TK2). Schématické znázornění struktury RTK KIT a PDGFRA včetně oblastí, které kódují vyšetřované exony genů KIT nebo PDGFRA (viz níže), poskytuje obr. 1.
Obr. 1. Schématický přehled struktury receptorových tyrosinkináz KIT a PDGFRA a oblasti, které kódují vyšetřované exony genů KIT a PDGFRA. 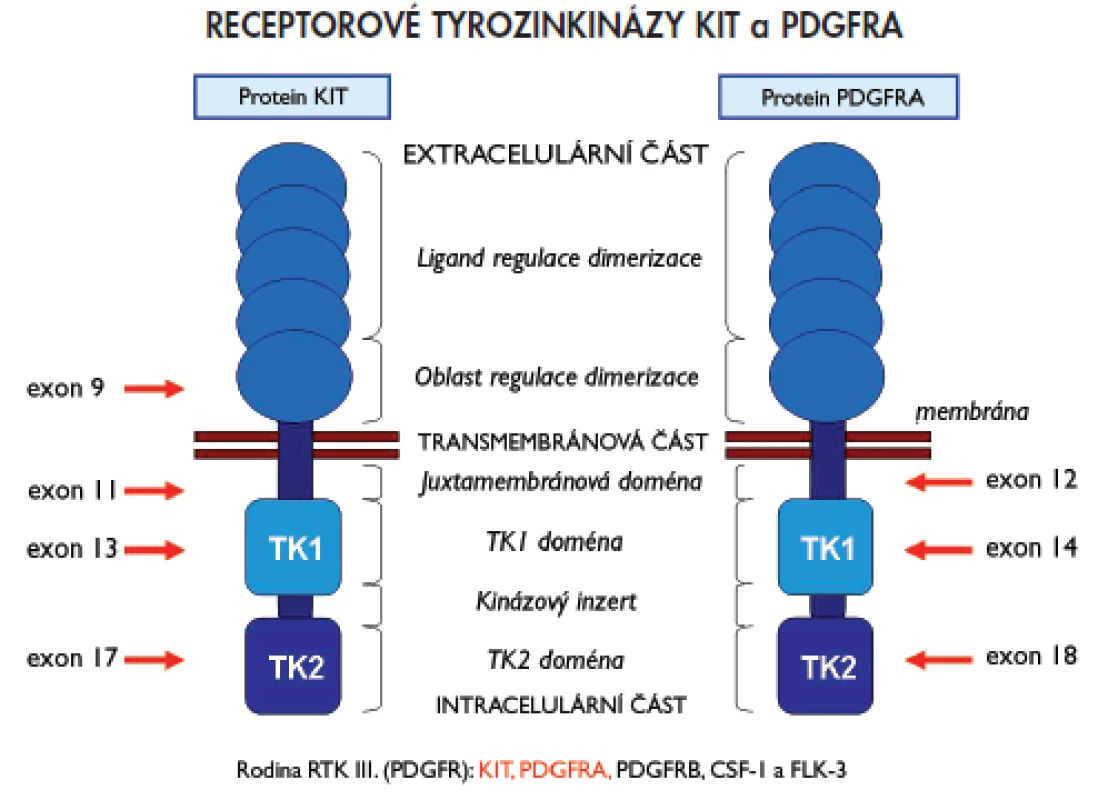
RTK KIT a PDGFRA plní důležitou funkci při přenosu extracelulárních signálů do nitra buněk. Přenos signálu se děje prostřednictvím vazby odpovídajících ligandů na extracelulární doménu RTK. V případě receptoru KIT je příslušným ligandem růstový faktor kmenových buněk (SCF, stem cell factor), u receptoru PDGFRA je to destičkový růstový factor PDGF (13). Vazbou ligandu na extracelulární doménu receptoru dochází ke konformačním změnám proteinu a k aktivaci TK domén v jeho intracelulární části. Aktivované domény TK následně aktivují další signální molekuly v cytoplazmě buňky a spouštějí signalizační dráhy vedoucí v konečném důsledku k ovlivnění exprese molekul odpovědných za proliferaci, diferenciaci nebo za programovanou smrt buňky (16).
MUTACE GENŮ KIT a PDGFRA
Mutace v genech KIT nebo PDGFRA způsobují aktivaci uvedené signalizační kaskády bez přítomnosti specifického ligandu. Výsledkem je neregulovaná exprese molekul, která ve spojení s nekontrolovanou zvýšenou proliferací buněk nebo se sníženou schopností přejít do apoptózy vede k maligní transformaci buněk.
Mutace mohou být přítomny v kterémkoliv z exonů, vzácně i intronů, genů KIT nebo PDGFRA, zvýšeně se však kumulují v určitých a pro daný gen typických místech (tzv. hot spots). U genu KIT jsou jimi exony 9, 11, 13 a 17, u genu PDGFRA exony 12, 14 a 18. Nejčastěji se mutace vyskytují v exonu 11 genu KIT (60–70 %), který kóduje juxtamembránovou oblast proteinu. Méně často se přítomnost mutací zjišťuje v exonu 9 téhož genu (10 %), který kóduje extracelulární doménu. Ojediněle se vyskytují mutace v exonech 13 a 17, které kódují intracelulární TK domény (TK1, respektive TK2) (1–2 %, respektive 1 %). Exony 12, 14 a 18 genu PDGFRA kódují analogické oblasti u proteinu PDGFRA jako je tomu u proteinu KIT. Nejčastěji se mutace genu PDGFRA vyskytují v exonu 18 (5 %), který kóduje doménu TK2. Výjimečně pak v exonech 12 a 14, které kódují juxtamembránovou doménu, respektive doménu TK1 (1 %, respektive <1 %) (15). Podle dosud známých informací se současný výskyt primárních mutací v obou genech vzájemně vylučuje. Pokud jsou tedy mutace přítomny v genu KIT, nevyskytují se v genu PDGFRA a naopak. U části pacientů se přítomnost mutací nezjistí ani v jednom z vyšetřovaných genů. U skupiny GIST s nemutovanými geny KIT nebo PDGFRA je mechanizmus vzniku vysvětlován pravděpodobným výskytem aktivačních mutací v genech pro jiné RTK, funkčně příbuzné transmebránovým proteinům KIT a PDGFRA, nebo v genech pro signální molekuly, které jsou regulovány signalizační kaskádou zprostředkovanou RTK KIT nebo PDGFRA (3). Přehled lokalizace mutací v jednotlivých exonech genů KIT a PDGFRA, frekvence výskytu a typů diagnostikovaných mutací poskytuje tab. 1.
TERAPIE IMATINIB MESYLÁTEM – MECHANIZMUS ÚČINKU
Význam molekulární diagnostiky GIST a analýzy mutačního stavu genů KIT a PDGFRA vzrostl se zavedením cílené protinádorové terapie pomocí imatinib mesylátu (IM) (Gleevec®, Novartis Pharma, Basel, Switzerland). IM je účinným inhibitorem RTK KIT, PDGFRA, PDGFRB, ABL a BCR-ABL. Výrazně ovlivňuje přežití pacientů s inoperabilním, metastazujícím nebo recidivujícím GIST (17). IM byl nejprve úspěšně použit v léčbě chronické myeloidní leukémie. Mechanizmus účinku IM v tomto případě spočívá v inhibici aktivace signálních drah vedoucích ke vzniku leukemického fenotypu buňky, který byl navozen vznikem fúzního proteinu BCR-ABL (18). IM je nízkomolekulovým analogem ATP. Vazbou na vazebné místo pro ATP v cytoplazmatické doméně TK uvedených receptorů znemožní změnu konformace proteinu. Tímto procesem blokuje přenos fosfátových skupin (P) z ATP na tyrozinová rezidua molekul, která patří k substrátům těchto proteinů (19). Zmíněnou blokací se zastaví aktivační signální kaskáda podílející se na vzniku nádorů (obr. 2).
Obr. 2. Mechanizmus působení inhibitoru receptorových tyrozinkináz imatinib mesylatu (IM). 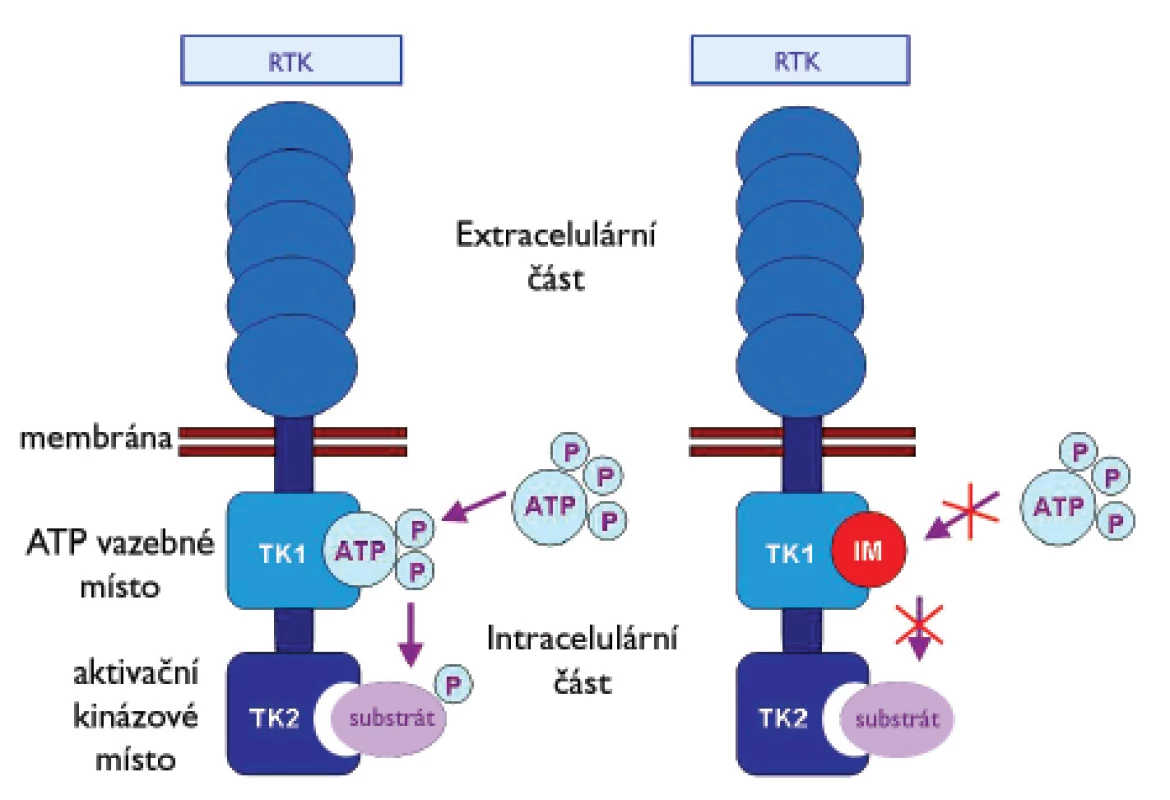
VÝZNAM MOLEKULÁRNÍ ANALÝZY GIST
Analýza uvedených mutací má pro pacienty s GIST podstupující biologickou léčbu IM zásadní klinicko-terapeutický dopad. Charakter odpovědi nádoru na cílenou terapii totiž výrazně souvisí s přítomností a přesnou lokalizací mutací ve vyšetřovaných genech KIT a PDGFRA. Na základě výsledků mutační analýzy můžeme předpokládat odpověď nádoru na terapii a následně tedy odhadnout i účinnost terapie IM.
Obecně se nádory s mutacemi genů KIT a PDGFRA v oblastech kódujících regulační oblasti proteinů (exon 11 u genu KIT a exon 12 u PDGFRA) považují za mutace s dobrou odpovědi na léčbu IM. Naproti tomu nádory s mutacemi v exonech kódujících enzymatické domény receptorů (exony 13 a 17 genu KIT a exony 14 a 18 genu PDGFRA) nebo nemutovanými geny KIT a PDGFRA odpovídají na léčbu IM méně, případně jsou primárně rezistentní (3), vždy však záleží na přesné lokalizaci mutace a jejím konkrétním typu. Stručný přehled vztahu lokalizace mutací k biologickému chování nádoru a odpovědi nádoru na terapii IM poskytuje tab. 1.
Tab. 1. Přehled lokalizace, výskytu, typu mutací a odpovědi nádoru na cílenou terapii IM 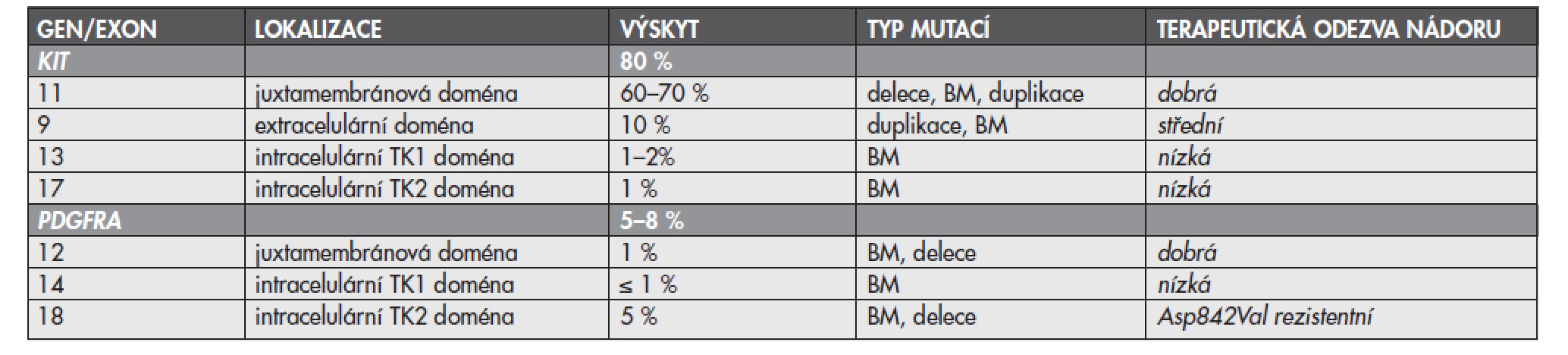
IM – imatinib mesylát, BM – bodové mutace, TK – tyrozinkinázová U pacientů s mutacemi v exonech 11 a 9 genu KIT se obecně setkáváme s nejlepší odezvou na terapii IM. Exon 11, jak již bylo uvedeno, kóduje intracelulární juxtamembránovou doménu proteinu KIT. Juxtamembránová doména plní funkci negativního regulátoru kinázové aktivity receptoru. Následkem mutací v této doméně dojde ke konformačním změnám proteinu a tím k porušení regulační funkce domény (20). Exon 9 kóduje extracelulární část proteinu KIT, jehož dimerizací po vazbě specifického ligandu dochází k aktivaci receptorové kinázy. Mutace postihující exon 9 narušují antidimerizační motiv a vedou ke spontánní homodimerizaci proteinu a tím i ke konstituční aktivaci receptoru. V obou případech (tj. mutacích v exonu 11 i 9) cílená inhibice RTK prostřednictvím kompetice vazby IM a ATP vazebné místo účinně ovlivňuje jejich mutacemi navozenou deregulaci činnosti. Při hodnocení odezvy nádoru se však i u mutací v exonech 11 a 9, které jsou senzitivní na IM, setkáváme s rozdíly v terapeutické odpovědi. Parciální odpověď nádoru s mutacemi v juxtamembránové doméně genu KIT (exon 11) je přibližně 84 % ve srovnání se 48 % při přítomnosti mutací v extracelulární doméně (exon 9) (21). Podle studií z poslední doby zabývajících se strategií terapie IM mají pacienti s mutacemi v exonu 9 genu KIT významně prodlouženou dobu přežití bez příznaků onemocnění při podání akcelerované dávky IM již v počátku terapie (22).
U pacientů s mutacemi v exonech 13 a 17 genu KIT, které kódují tzv. enzymatické oblasti proteinu KIT (vazebné místo pro ATP, respektive kinázové aktivační místo), je odpověď nádoru na terapii nižší. Důvodem je v prvním případě neschopnost vazby IM na mutací změněné vazebné místo pro ATP. V druhém případě spočívá selhání inhibičního účinku IM v tvorbě stabilně aktivní konformace proteinu KIT. Je nutné podotknout, že mutace v enzymatických doménách přitom nemusí vždy postihovat přesně oblasti vazby IM. Změna struktury proteinu i ve vzdálenějším místě může totiž indukovat konformační změny zamezující vazbě molekuly IM.
U pacientů s GIST se setkáváme jednak s primární rezistencí na terapii IM, jednak s rezistencí sekundární. U pacientů s nádory primárně rezistentními se klinická odpověď na léčbu neprojeví, naopak nádor progreduje v průběhu prvních 6 měsíců terapie IM. Primární rezistence je mimo jiné spojena s bodovou mutací v exonu 18 genu PDGFRA, která vede k záměně aminokyseliny kyseliny asparagové za aminokyselinu valin (p. Asp842Val), nebo s nemutovaným stavem genů KIT a PDGFRA. Důvodem rezistence je v případě bodové mutace v exonu 18 genu PDGFRA vznik stabilně aktivní konformace proteinu. Nemutovaný stav genů KIT nebo PDGFRA a následně i neaktivované RTK KIT a PDGFRA znemožňují naproti tomu specifickou inhibici IM (1).
U některých primárně senzitivních nádorů dochází ke vzniku sekundární neboli získané rezistence. Sekundární rezistenci definuje progrese nemoci v průběhu terapie IM vznikající 6 měsíců po zahájení zprvu účinné terapie. Mechanizmy vzniku sekundární rezistence jsou různé. Zahrnují mimo jiné vznik sekundárních mutací v genech KIT a PDGFRA, amplifikaci genu KIT s následnou zvýšenou expresí proteinu KIT, nebo aktivaci jiných RTK (23).
Navzdory značnému prospěchu biologické léčby pacientů s GIST představuje primární a sekundární rezistence na IM v terapii těchto nádorů značný klinický problém. Přibližně 4 % pacientů s GIST na léčbu IM nereagují. Kromě toho se u asi 50 % pacientů nakonec vyvine rezistence na IM v průběhu léčby s mediánem doby vzniku resistence 24 měsíců. V 70 % je rezistence důsledkem vzniku sekundárních mutací (22). Podle současných návrhů terapeutických postupů se pacientům, u kterých došlo k metastatickému rozsevu nádoru, pacientům progredujicím na terapii nebo pacientům rezistentním na terapii, doporučuje podávání vyšší dávky IM, a to 800mg/den místo obvyklých 400mg/den (22).
DALŠÍ MOŽNOSTI TERAPIE
Stále se rozvíjející, doplňovaná a přepracovávaná terapeutická doporučení dále navrhují, aby se u pacientů s neresekovatelným nebo metastatickým nádorem, u kterých byla zjištěna mutace v exonu 9 genu KIT, podávala zvýšená dávka IM (800mg/den) už při zahájení terapie (22). Při progresi nemoci i na vysokodávkovaném IM nebo při intoleranci IM je lékem druhé volby sunitinib malát (SM).
Sunitinib malát (SUTENT®, Pfizer Inc., CA, USA) je tyrozinkinázovým inhibitorem druhé generace (24). Inhibuje širší spektrum RTK, které zahrnují receptory pro cévní endoteliální růstové faktory (VEGFR1, VEGFR2 a VEGFR3; vascular endothelial growth factor receptors), receptory KIT, PDGFRA, PDGFRB, FLT3, CSF1 a RET (22,25). Efektivita SM může záviset na mutačním stavu nádoru. Jak se ukazuje, nemutované geny KIT nebo PDGFRA nebo nádory s mutacemi v exonu 9 genu KIT, vykazují lepší odpověď než pacienti s mutacemi v exonu 11 genu KIT (4).
Současně se v rámci klinických studií pro léčbu pacientů s GIST testuje několik dalších nových inhibitorů receptorových tyrozinkináz s předpokládaným inhibičním efektem podobným jako je tomu u IM nebo SM. Jedná se o terapeutika nilotinib, sorafenib nebo masatinib. Nilotinib účinkuje na aktivované RTK KIT, PDGFRA a/nebo PDGFRB a BCR/ABL. Podávání samotného nilotinibu nebo v kombinaci s IM se testuje u pacientů, kteří na léčbě IM progredují nebo špatně snášejí terapii IM při dávce 800mg/den. Sorafenib prokázal efektivitu u pacientů s rezistencí na IM nebo SM. Masatinib (AB 1010), nové cílené terapeutikum RTK KIT, PDGFRA a/nebo PDGFRB a receptoru růstového faktoru fibroblastů - FGF (fibroblast growth factor receptor), je v současné době testován jako potenciální lék první linie terapie GIST (22).
S ohledem na častý vznik získané rezistence GIST způsobené sekundárními mutacemi není samotné podávání inhibitorů aktivovaných tyrozinkináz dostačující. Podle posledních studií je možným alternativním přístupem blokace proteinu KIT prostřednictvím inhibice „heat shock proteinu 90“ (HSP 90). HSP 90 je proteinem z třídy tzv. chaperonů, které chrání proteiny před degradací v proteasomu. Inhibice HSP 90 zamezuje stabilizaci proteinu a tím snižuje jeho ochranu před degradací (24). Stejně tak se zkouší kombinace inhibitoru proteinkinázy C (PKC412) společně s IM u pacientů, kteří progredují na terapii samotným IM nebo u pokročilých GIST kombinace PKC412 s makrolidovým inhibitorem mTOR (mammalian target of rapamycin) sirolimus (jinak též rapamycin). U pacientů, kteří progredují na monoterapii IM, mají metastatické postižení, nebo u pacientů s předchozí terapeutickou zátěží se klinické testování zaměřuje na zjišťování účinnosti terapie v kombinacích: IM a SM, IM a everolimus (inhibitor mTOR), IM a bevacizumab (inhibitor VEGF) nebo IM a chemoterapie (konkrétně IM a nízké dávky doxorubicinu). Přehled standardních postupů a pokroků v terapii GIST v českém písemnictví poskytuje článek autorů Linke a spol. (26). Souhrnný přehled nových terapeutik a v současné době zkoušených kombinací terapie u pacientů s výskytem metastatického GIST poskytuje tab. 2.
Tab. 2. Přehled nových terapeutik a v současné době zkoušených kombinací terapie u pacientů s výskytem metastatického gastrointestinálního stromalního tumoru 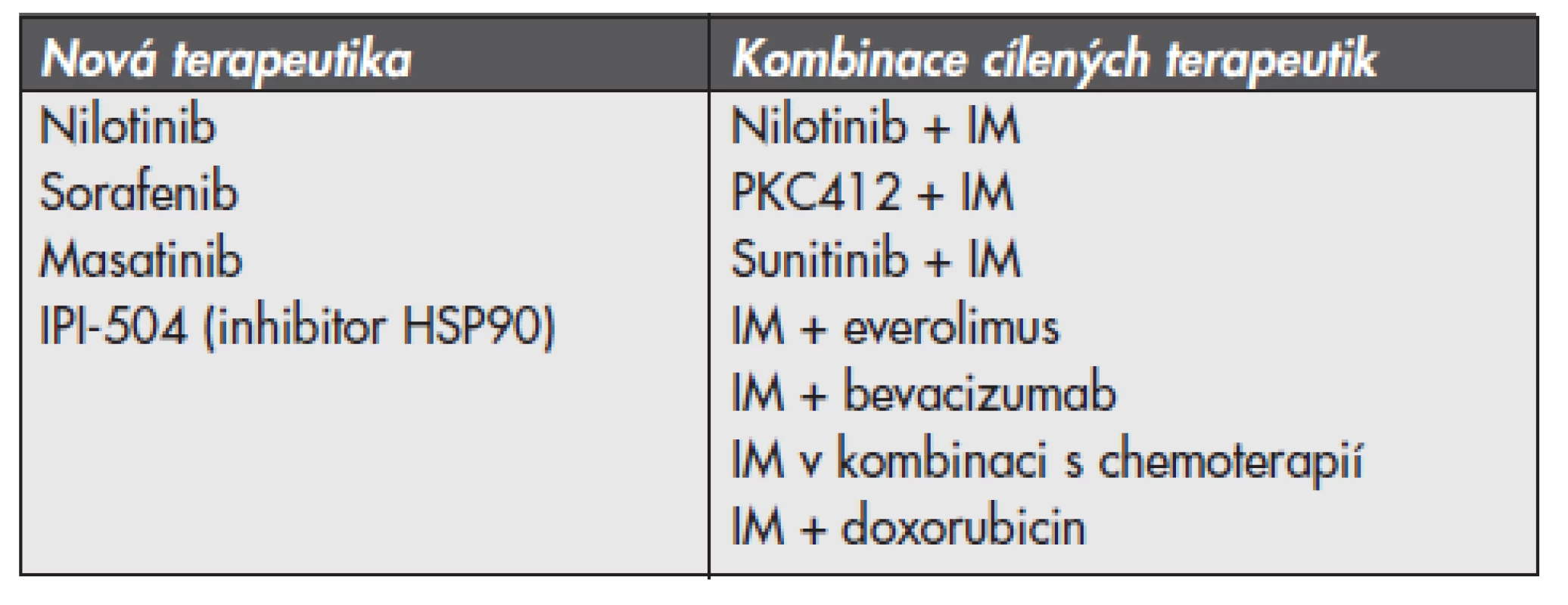
Upraveno dle (22). VÝZNAM A DOPAD MOLEKULÁRNÍ ANALÝZY MUTACÍ U GIST
Z předchozího textu vyplývá i nutnost přesné molekulární analýzy GIST, která bude mít do budoucna stále větší význam. V současné době jsou výsledky molekulární diagnostiky mutací GIST využívány v následujících bodech:
- A. Potvrzení patogenetického mechanizmu vzniku GIST.
- B. Diagnostický význam: potvrzení diagnózy GIST, zejména u tumorů bez exprese povrchové molekuly CD117.
- C. Prediktivní význam: zjištění přítomnosti mutací GIST primárně rezistentních na IM (mutace Asp842Val v exonu 18 genu PDGFRA), mutací v exonech 9, 13 a 17 genu KIT, v exonech 14 a 18 genu PDGFRA nebo nemutovaného stavu genů s možností volby dvojnásobné dávky IM nebo terapie pomocí inhibitorů tyrozinkináz další generace.
- D. Průkaz přítomnosti sekundárních mutací u pacientů s progresí nemoci s možností volby dvojnásobné dávky IM nebo aplikace inhibitorů druhé či třetí generace.
PODĚKOVÁNÍ
Práce byla podpořena Výzkumným záměrem Fakultní nemocnice Motol a Ministerstva zdravotnictví č. MZ0 FNM 2005/6704.
Adresa pro korespondenci:
Mgr. Alena Augustiňáková
Ústav patologie a molekulární medicíny
2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
tel: 224 435 622, fax: 224 435 620
e-mail: alena.augustinakova@fnmotol.cz
Zdroje
1. Heinrich MC. Molecular basis for treatment of gastrointestinal stromal tumours. EJC Supplements 2006; 4(1): 10–18.
2. Joensuu H. Current perspectives on the epidemiology of gastrointestinal stromal tumours. EJC Supplements 2006; 4(1): 4–9.
3. Rubin BP. Gastrointestinal stromal tumours: an update. Histopathology 2006; 48(1): 83–96.
4. Dirnhofer S, Leyvraz S. Current standards and progress in understanding and treatment of GIST. Swiss Med Wkly 2009; 139(7–8): 90–102.
5. Miettinen M, Lasota J. Gastrointestinal stromal tumors: review on morphology, molecular pathology, prognosis, and differential diagnosis. Arch Pathol Lab Med 2006; 130(10): 1466–1478.
6. Miettinen M, Sarlomo-Rikala M, Lasota J. Gastrointestinal stromal tumors: Recent advances in understanding of their biology. Hum Pathol 1999; 30(10): 1213–1220.
7. Chen LL, Holden JA, Choi H, et al. Evolution from heterozygous to homozygous KIT mutation in gastrointestinal stromal tumor correlates with the mechanism of mitotic nondisjunction and significant tumor progression. Mod Pathol 2008; 21(7): 826–836.
8. Augustiňáková A, Kodet R. Histopatologická a molekulární charakteristika a diagnostika gastrointestinálních stromálních tumorů. Farmakoterapie (speciální příloha: Aktuální pohled na léčbu GIST) 2010; 6–13.
9. Daum O, Vaněček T, Šíma R, et al. Gastrointestinální stromální tumor: Současný pohled. Klinická onkologie 2006; 19(4): 201–211.
10. Daum O, Vaněček T, Michal M. Patologická diagnostika gastrointestinálního stromálního tumoru. Onkologie 2010; 4(1): 13–17.
11. Plank L. Bioptická diagnostika gastrointestinálnych stromálnych nádorov. Onkologie 2007; 1(2): 73–78.
12. Miettinen M, Sobin LH, Lasota J. Gastrointestinal stromal tumors of the stomach: a clinicopathologic, immunohistochemical, and molecular genetic study of 1765 cases with long-term follow-up. Am J Surg Pathol 2005; 29(1): 52–68.
13. Miettinen M, Lasota J. Gastrointestinal stromal tumors-definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnosis. Virchows Arch 2001; 438(1): 1–12.
14. Fletcher CD, Berman JJ, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: A consensus approach. Hum Pathol 2002; 33(5): 459–465.
15. Wardelmann E, Hrychyk A, Merkelbach-Bruse S, et al. Association of plateled-derived growth factor receptor alpha mutation with gastric primary site and epitheloid or mixed cell morphology in gastrointestinal stromal tumors. J Mol Diagn 2004; 6(3): 197–204.
16. Burger H, den Bakker MA, Kross JM, et al. Activating mutation in c-KIT and PDGFRalpha are exclusively found in gastrointestinal stromal tumors and not in other tumors overexpressing these imatinib mesylate target genes. Cancer Biol Ther 2005; 4(11): 1270–1274.
17. Penzel R, Aulmann S, Moock M, et al. The location of KIT and PDGFRA gene mutations in gastrointestinal stromal tumors is site and phenotype asociated. J Clin Pathol 2005; 58(6): 634–639.
18. Breccia M, Alimena G. The metabolic consequences of imatinib mesylate: Changes on glucose, lypidic and bone metabolism. Leuk Res 2009; 33(7): 871–875.
19. Heinrich MC, Corless CL, Demeteri GD, et al. Kinase mutations and imatinib response in patients with metastatic gastrointestinal stromal tumor. J Clin Oncology 2003; 21(23): 4342–4349.
20. Antonescu CR. Targeted therapy of cancer: new roles for pathologists in identifying GISTs and other sarcomas. Mod Pathol 2008; 21(Suppl 2): S31–36.
21. Hirota S, Isozaki K. Pathology of gastrointestinal stromal tumors. Pathol Int 2006; 56(1): 1–9.
22. Blay JY, Reichardt P. Advanced gastrointestinal stromal tumor in Europe: a review of updated treatment recommendations. Expert Rev Anticancer Ther 2009; 9(6): 831–838.
23. Samelis GF, Ekmektzoglou KA, Zografos GC. Gastrointestinal stromal tumor: clinical overview, surgery and recent advances in imatinib mesylate therapy. Eur J Surg Oncol 2007; 33(8): 942–950.
24. Hornick JL, Fletcher CD. The role of Kit in the management of pacients with gastrointestinal stromal tumor. Hum Pathol 2007; 38(5): 679–687.
25. Gupta P, Tewari M, Shukla HS. Gastrointestinal stromal tumor. Surg Oncol 2008; 17(2): 129–138.
26. Linke Z, Prausová J, Kubáčková K. Pokroky v léčbě gastrointestinálního stromálního tumoru. Farmakoterapie 2007; 3(4): 373–381
Štítky
Patologie Soudní lékařství Toxikologie
Článek PATOLOGIE MAMMYČlánek CYTODIAGNOSTIKAČlánek PATOLOGIE GITČlánek HEPATOPATOLOGIEČlánek PATOLOGIE GITČlánek JAKÁ JE VAŠE DIAGNÓZA?Článek PATOLOGIE ORL OBLASTIČlánek DERMATOPATOLOGIEČlánek Carneyho komplex
Článek vyšel v časopiseČesko-slovenská patologie

2011 Číslo 4-
Všechny články tohoto čísla
- Terapeuticko-indikační patologie – “from bench to bedside”
- Karcinom pankreatu je zatím smutnou kapitolou medicíny
- HEMATOPATOLOGIE, ENDOKRINOPATOLOGIE, GYNEKOPATOLOGIE...
- Zjednodušené schéma receptorových mechanismů a intracelulárních signálních drah v nádorové buňce s možnými cíli biologické léčby
- Prediktivní diagnostika u karcinomu prsu
- Molekulární diagnostika gastrointestinálních stromálních tumorů ve vztahu k predikci terapeutické odpovědi na cílenou biologickou léčbu
- PATOLOGIE MAMMY
- Molekulární prediktory cílené anti-EGFR terapie u metastatického kolorektálního karcinomu
- CYTODIAGNOSTIKA
- Prediktivní diagnostika HER2 v adenokarcinomu žaludku
- PATOLOGIE GIT
- Cielená liečba melanómu: fakt alebo fikcia?
- HEPATOPATOLOGIE
- Novinky v klasifikaci adenokarcinomů plic a potenciální prognostické a prediktivní faktory u nemalobuněčných plicních karcinomů
- PATOLOGIE GIT
- Klinické registry jako nezbytná podpora personalizované medicíny
- JAKÁ JE VAŠE DIAGNÓZA?
- „Gigantický“ bazocelulárny karcinóm kože hlavy s intrakraniálnou propagáciou – kazuistika
- JAKÁ JE VAŠE DIAGNÓZA? - ODPOVĚĎ
- Akantolytický variant skvamózneho karcinómu prsnej žľazy. Kazuistika a prehľad literatúry
- PATOLOGIE ORL OBLASTI
- Intraperikardiální teratom jako příčina intrauterinního odumření – kazuistika
- DERMATOPATOLOGIE
- Carneyho komplex
- Primárna sklerozujúca cholangitída
- UROPATOLOGIE, GYNEKOPATOLOGIE, HEMATOPATOLOGIE, NEUROPATOLOGIE, ORTOPEDICKÁ PATOLOGIE
- Profesor Habanec osmdesátiletý
- K životnému jubileu prof. MUDr. Štefana Galbavého, DrSc.
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Carneyho komplex
- Prediktivní diagnostika HER2 v adenokarcinomu žaludku
- Prediktivní diagnostika u karcinomu prsu
- „Gigantický“ bazocelulárny karcinóm kože hlavy s intrakraniálnou propagáciou – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



