-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Svízelná diagnostika primární sklerozující cholangitidy u pacienta s rekurentními epizodami akutní bakteriální cholangitidy
Complicated diagnostics of primary sclerosing cholangitis in a patient with recurrent episodes of acute bacterial cholangitis
Acute bacterial cholangitis is one of the possible complications of primary sclerosing cholangitis and in some cases it can occur as a fulminant cholangiogenic sepsis with septic shock and multiple organ dysfunction syndrome. The authors describe a case of a 39-year ‑ old man where the primary sclerosing cholangitis manifested as recurrent episodes of acute bacterial cholangitis, including one with a life ‑ threatening consequences. The diagnostic and therapeutic method of choice an urgent endoscopic retrograde cholangiopancreatography with a decompression of the biliary tree and subsequent targeted antibiotic therapy. The diagnosis of primary sclerosing cholangitis can sometimes be difficult, as it was in our case, due to insufficient histologic verification and intercurrent clinical complications.
Key words:
primary sclerosing cholangitis – acute bacterial cholangitis – cholangiogenic sepsis – endoscopic retrograde cholangiography
The author declares he has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
12. 8. 2014Accepted:
11. 1. 2015
Autoři: L. Douda 1; R. Keil 1; J. Lochmannová 1; J. Drábek 1; O. Fabián 2; L. Hornofová 2; E. Honsová 3; M. Jirsa⁴
Působiště autorů: Interní klinika 2. LF UK a FN v Motole, Praha 1; Ústav patologie a molekulární medicíny, 2. LF UK a FN v Motole, Praha 2; Pracoviště klinické a transplantační patologie, Transplacentrum, IKEM, Praha 3; Centrum experimentální medicíny, IKEM, Praha 4
Vyšlo v časopise: Gastroent Hepatol 2015; 69(4): 368-375
Kategorie: Klinická a experimentální gastroenterologie: kazuistika
doi: https://doi.org/10.14735/amgh2015368Souhrn
Akutní bakteriální cholangitida je závažnou komplikací primární sklerozující cholangitidy. V některých případech může mít tato bakteriální komplikace fulminantní průběh ve smyslu cholangiogenní sepse a septického šoku s multiorgánovým selháním. Autoři popisují případ 39letého muže s opakovanými atakami akutní bakteriální cholangitidy, u něhož byla zejména na základě radiografického nálezu při endoskopické retrográdní cholangiopankreatografii diagnostikována primární sklerozující cholangitida. Stanovení diagnózy primární sklerozující cholangitidy bylo ztíženo jednak nejednoznačnými výsledky provedených vyšetření a dále klinickými komplikacemi, jež nastaly v průběhu diagnostického procesu.
Klíčová slova:
primární sklerozující cholangitida – akutní bakteriální cholangitida – cholangiogenní sepse – endoskopická retrográdní cholangiopankreatografieÚvod
Primární sklerozující cholangitida (PSC) je chronické cholestatické a postupně progredující onemocnění charakterizované difuzním zánětem a fibrózou žlučového stromu s následnou obliterací intra ‑ a/ nebo extrahepatálních žlučovodů. Onemocnění postupně vede ke vzniku jaterní cirhózy.
Etiologie není zcela jasná a v patogenezi hraje roli několik mechanizmů – autoimunitní, zánětlivý (hypotéza popisující translokaci bakterií zánětem poškozenou sliznicí tlustého střeva a jejich transport portálním řečištěm a usídlení ve žlučovém stromu s následnou cholangitidou) a případně ischemický (experimentálně při ischemickém inzultu žlučovodů intraarteriální aplikací floxuridinu dochází ke vzniku podobného cholangiografického obrazu jako při PSC) [1]. Genetický podklad onemocnění byl prokázán v genech třídy HLA i non‑HLA [2 – 8], přičemž příbuzní pacientů s PSC mají až 39násobně vyšší riziko vzniku PSC ve srovnání s ostatní populací [2]. Incidence PSC se dle různých studií uvádí kolem 1/ 100 000 obyvatel/ rok [1,9]. Častěji bývají postiženi muži (ve srovnání se ženami v 70 %) středního věku (průměrný věk kolem 40 let).
Klinická symptomatologie je často nespecifická a bývá zpočátku těžko rozpoznatelná od ostatních jaterních onemocnění. Dominující postavení v diagnostice PSC má radiografické zobrazení žlučových cest (ERCP, MRCP či PTC), dále pak histologický nález z jaterní biopsie a laboratorní výsledky s alterací obstrukčních jaterních enzymů.
Jednou z nejzávažnějších komplikací PSC je akutní bakteriální cholangitida, přičemž její průběh může být mírný s dobrou odezvou na příslušnou terapii, avšak nezřídka probíhá pod obrazem život ohrožující cholangiogenní sepse [10 – 12].
Cílem léčby PSC je zpomalení progrese základního onemocnění a co nejefektivnější řešení jeho komplikací. Progresivní charakter PSC vede postupně k nezvratnému poškození jater a jedinou kurativní možností léčby zůstává jaterní transplantace.
Popis případu
39letý dosud zdravý muž byl přijat na interní oddělení okresní nemocnice pro asi dva týdny trvající žluté zbarvení kůže, pruritus, tmavou moč a světlou stolici a zhruba měsíc trvající břišní dyskomfort s horší snášenlivostí mastných a pečených pokrmů. Vstupní fyzikální nález byl kromě zjištěného ikteru kůže a sklér a mírné palpační citlivosti v oblasti epigastria v normě. Pacient byl afebrilní a kardiopulmonálně kompenzován. Laboratorně jsme zjistili elevaci jaterních obstrukčních enzymů a bilirubinu (ALP 3,51 µmol/ l, GGT 3,96 µkat/ l, AST 0,83 µkat/ l, ALT 1,64 µkat/ l, bilirubin 195,4 µkat/ l), přičemž laboratorní známky zánětu nebyly vstupně vyjádřeny a ostatní biochemické ukazatele vykazovaly též fyziologické hodnoty. V rámci diferenciální diagnostiky jsme vyloučili infekční virovou hepatitidu. Sonograficky a následně i dle CT břicha byla prokázána dilatace nitrojaterních žlučovodů (obr. 1).
Obr. 1. Sonografický obraz dilatace nitrojaterních žlučovod (šipka). Fig. 2. Ultrasound image of intrahepatic bile duct dilatation (arrow). 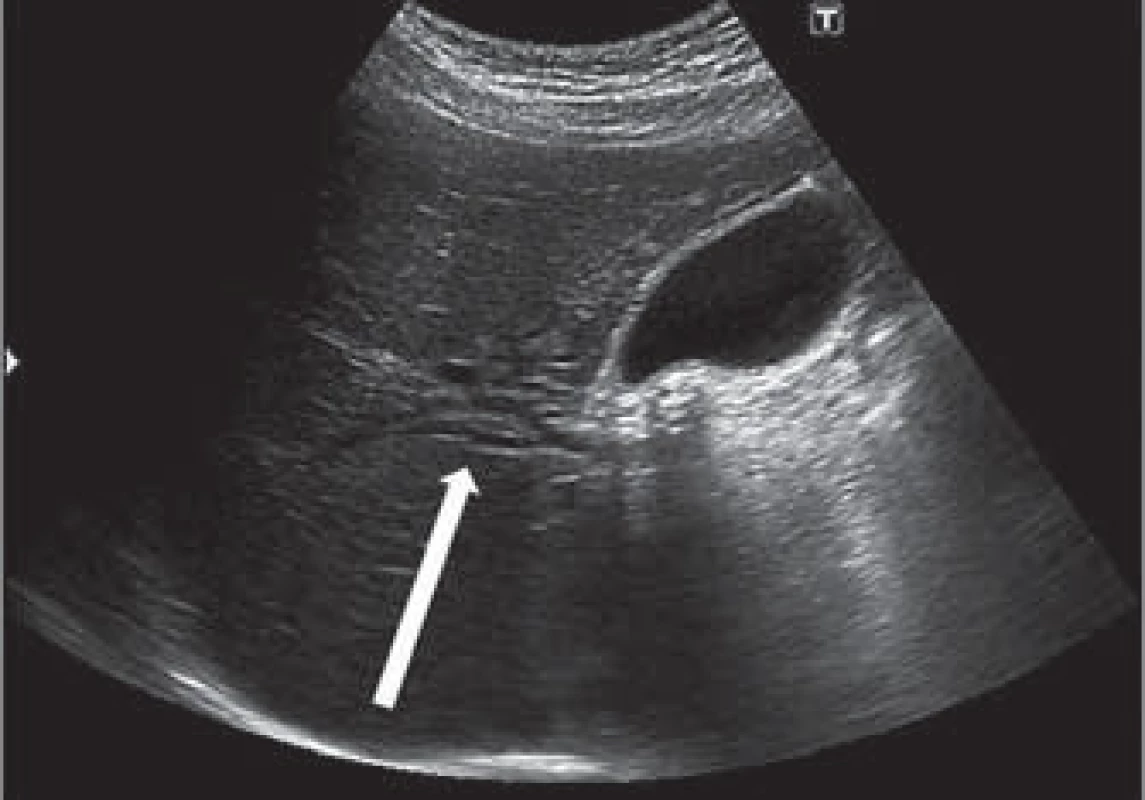
Při další laboratorní kontrole měly zánětlivé parametry tendenci k vzestupu a u pacienta jsme indikovali provedení ERCP, která prokázala mnohočetnou litiázu v oblasti junkce pravého a levého ductus hepaticus, intrahepatální litiázu a současně nápadně štíhlý ductus choledochus a ductus cysticus (obr. 2). Po provedení papilotomie bylo extrahováno větší množství drobných konkrementů a pacienta jsme zajistili biliární drenáží (obr. 3).
Obr. 2. ERCP – mnohočetná litiáza v oblasti junkce pravého a levého ductus hepaticus, intrahepatální litiáza, štíhlý ductus choledochus a ductus cysticus (šipky). Fig. 2. ERCP – multiple lithiasis in the junction between the right and left hepatic duct, intrahepatic lithiasis, thin bile duct and cystic duct (arrows). 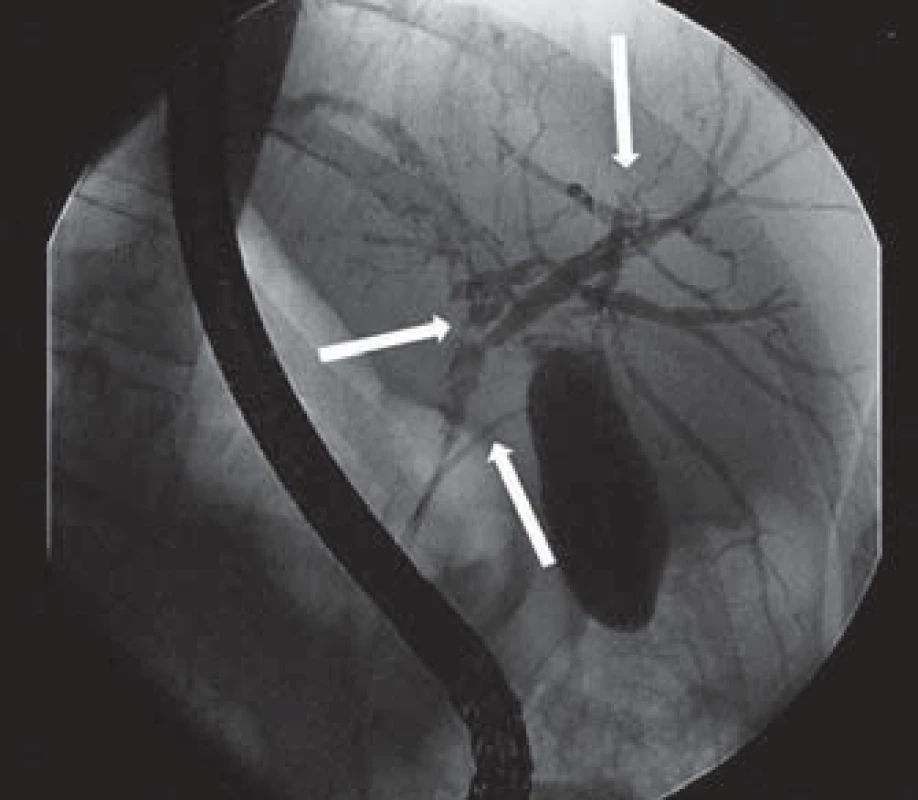
Obr. 3. ERCP – zavedená biliární drenáž (7 Fr) do oblasti levého ductus hepaticus (šipka). Fig. 3. ERCP – biliary drainage (7 Fr) inserted in the left hepatic duct (arrow). 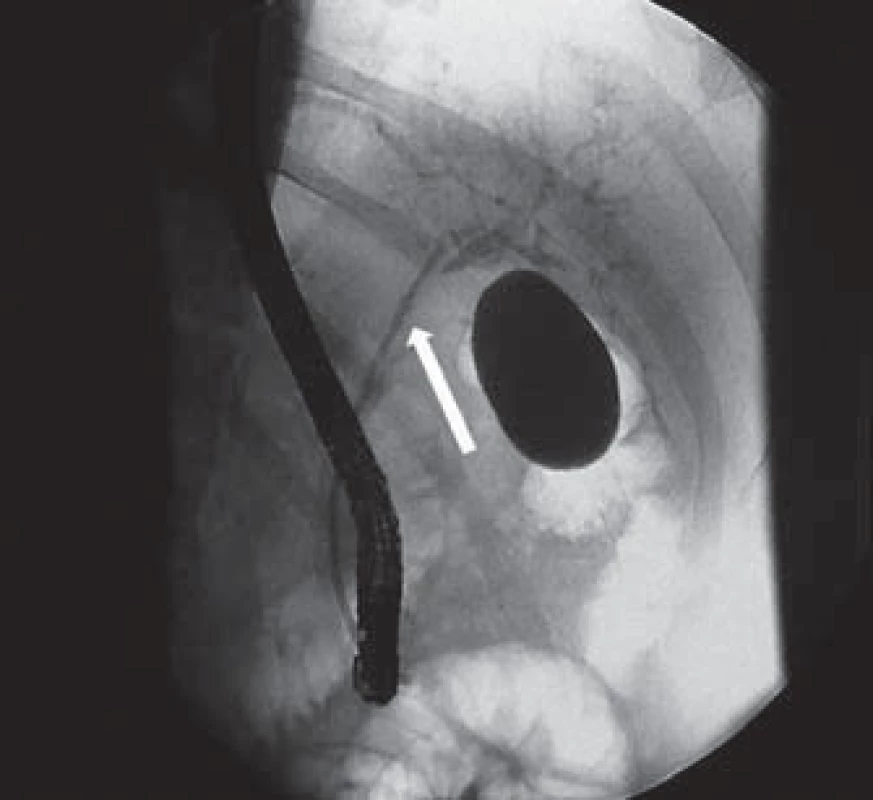
První ataka akutní bakteriální cholangitidy byla zvládnuta bez větších problémů, při negativním výsledku hemokultivačního vyšetření byl pacient léčen empiricky parenterálně podávanými antibiotiky (Ciprofloxacin). Jaterní obstrukční enzymy měly stejně jako zánětlivé parametry tendenci k poklesu, hodnota bilirubinu však oscilovala kolem hodnoty 340 µmol/ l a její pokles byl velmi pomalý (graf 1 – 4).
Graf 1. Dynamika zánětlivých parametrů (C- reaktivní protein) při probíhajících atakách akutní bakteriální cholangitidy (šipkou označena epizoda proběhlé cholangiogenní sepse provázená septickým šokem). Graph 1. Dynamics of inflammatory parameters (C-reactive protein) during attacks of acute bacterial cholangitis (an episode of past cholangiogenic sepsis accompanied by septic shock is indicated by an arrow). 
Graf 2. Dynamika zánětlivých parametrů (leukocyty) při probíhajících atakách akutní bakteriální cholangitidy (šipkou označena epizoda proběhlé cholangiogenní sepse provázená septickým šokem). Graph 2. Dynamics of inflammatory parameters (leukocytes) during attacks of acute bacterial cholangitis (an episode of past cholangiogenic sepsis accompanied by septic shock is indicated by an arrow). 
Graf 3. Dynamika sérové koncentrace GGT, ALP a bilirubinu (šipkou označena epizoda proběhlé cholangiogenní sepse doprovázená septickým šokem). Je patrna prvotní téměř stacionární elevace sérové hodnoty bilirubinu s následným klesajícím trendem po výměně biliární drenáže. Graph 3. The dynamics of serum concentrations of GGT, ALP and bilirubin (an episode of past cholangiogenic sepsis accompanied by septic shock is indicated by an arrow). The graph shows an initial almost stationary elevation of serum bilirubin, followed by a declining trend after the change of biliary drainage. 
Graf 4. Dynamika sérové koncentrace aminotransferáz (AST, ALT) při probíhajících atakách akutní bakteriální cholangitidy (je patrný výrazný vzestup hodnot aminotransferáz při druhé atace bakteriální cholangitidy). Graph 4. Dynamics of serum levels of aminotransferases (AST, ALT) during attacks of acute bacterial cholangitis (the graph shows a marked increase in aminotransferase levels during the second attack of bacterial cholangitis). 
Osmý den od zavedení biliární drenáže došlo k náhlému zhoršení celkového stavu pacienta ve smyslu rozvoje septického šoku. Pacienta jsme v kritickém stavu (hypotenzní, febrilní a s poruchou vědomí) přeložili na jednotku intenzivní péče. Byla okamžitě zahájena léčba s volumovou resuscitací a s nutností vazopresorické podpory oběhu. Při urgentně provedené ERCP jsme prokázali parciální obturaci biliární drenáže, která byla vyměněna. Hemokultivačním vyšetřením jsme zjistili multirezistentní E. coli, přičemž stejné infekční agens (spolu s Enterobacter cloacae) bylo vykultivováno i ze žluče. Vzhledem k celkově závažnému stavu byl pacient léčen dvojkombinací parenterálně podávaných antibiotik dle citlivosti (Metronidazol, Imipenem). Díky včasně zahájené intenzivní komplexní terapii, urgentně provedené výměně biliární drenáže a cílené antibiotické terapii se pacientův klinický stav promptně zlepšil. Došlo k poklesu známek cholestázy (tentokrát již i s poklesem sérové hodnoty bilirubinu) i známek zánětu. Pacienta jsme propustili v klinicky dobrém stavu, afebrilního a s prakticky normálním laboratorním nálezem (graf 1 – 4).
Během hospitalizace bylo u našeho pacienta vyjádřeno podezření na primární sklerozující cholangitidu. Základem pro toto podezření byl opakovaně suspektní cholangiogram s intrahepatálními stenózami a litiázou a nápadně štíhlými extrahepatálními žlučovody (obr. 2). V rámci verifikace naší diagnostické rozvahy jsme dvakrát provedli jaterní biopsii, která ukázala pouze obraz akutní a subakutní cholestázy, avšak bez morfologických rysů typických pro PSC (obr. 4). Vzhledem k nejednoznačnému nálezu bylo provedeno druhé čtení histologického preparátu erudovaným patologem se stejným závěrem.
Obr. 4. Histologický obraz akutní a subakutní cholestázy (HE 100×, bez morfologických známek typických pro PSC). Fig. 4. Histological image of acute and subacute cholestasis (HE 100×, no morphological signs typical of PSC). 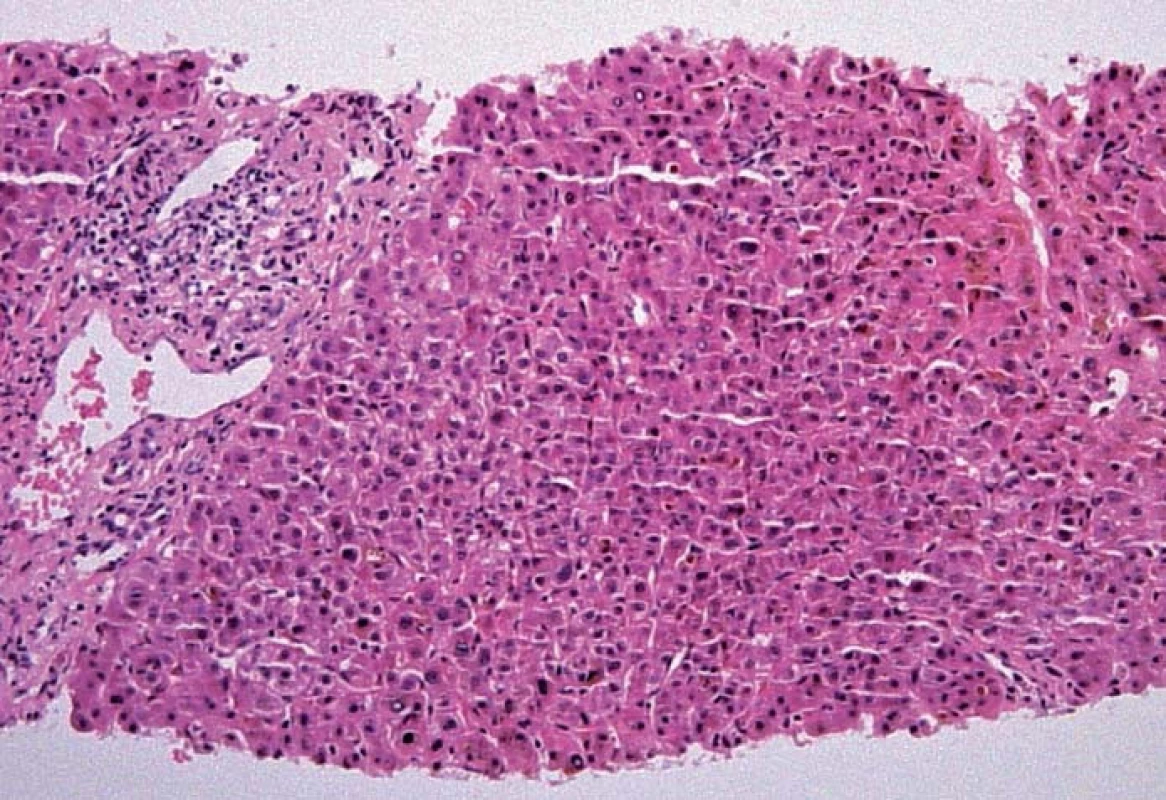
Laboratorně jsme dále zjistili pozitivitu protilátek p ‑ ANCA. Vzhledem k možnosti současného výskytu PSC a idiopatického střevního zánětu jsme provedli koloskopii, při které jsme kromě dvou drobných low ‑ grade adenomů rektosigmatu nezjistili makroskopické známky ulcerózní kolitidy. Z etážové biopsie tračníku byla patologem popsána chronická nespecifická kolitida, přičemž i tento mikroskopický nález může podporovat současný výskyt PSC [13 – 15]. Gastroskopický nález do D2 byl v normě, stejně tak sérová hodnota ceruloplazminu a obsah mědi v sušině z jaterní biopsie byly normální. Přítomnost výrazné hyperbilirubinemie při současné hepatikolitiáze nás vedla (též dle doporučení erudovaného patologa) i ke zvážení možnosti vrozeného cholestatického syndromu při deficitu MDR3. Následným genetickým vyšetřením jsme však tuto diagnózu nepotvrdili. Hodnota alfa‑fetoproteinu (AFP) vykazovala normální hodnoty. Sérová hladina onkomarkeru Ca 19 ‑ 9 byla v předchorobí (tj. před první atakou bakteriální cholangitidy) v normálním rozmezí (21,3 kU/ l), avšak v souvislosti s opakovanými akutními záněty žlučového stromu vystoupala až na vysoce pozitivní hodnotu (> 700 kU/ l). Po stabilizaci stavu měla hodnota Ca 19 ‑ 9 po několika měsících tendenci k poklesu (380 kU/ l) a v odstupu jednoho roku byla již opět v mezích normy. Přechodnou elevaci Ca 19 ‑ 9 tedy hodnotíme jako sekundární při nově se manifestující primární sklerozující cholangitidě. Doplněné PET ‑ CT vyšetření neprokázalo malignitu v hepatobiliární oblasti. Dále, v rámci diferenciální diagnostiky, jsme vyloučili IgG ‑ 4 asociovanou cholangitidu.
V odstupu následujících 24 týdnů došlo k opětovnému rozvoji dvou atak akutní bakteriální cholangitidy, přičemž obě byly nekomplikované a byly zvládnuty výměnou biliární drenáže a efektivní antibiotickou léčbou.
Diskuze
Diagnostika primární sklerozující cholangitidy je často svízelná a naráží na řadu problematických okolností – zejména na absenci jasných diagnostických kritérií, jejichž splněním by byla diagnóza pevně stanovena. Diagnostika PSC se opírá o výsledky následujících vyšetření – 1. cholangiogram (ERCP, MRCP či PTC), 2. jaterní biopsie, 3. laboratorní nález s dominující cholestatickou jaterní lézí (a různými imunologickými odchylkami), 4. současný výskyt idiopatického střevního zánětu (nejčastěji ulcerózní kolitida).
Charakteristickým cholangiografickým nálezem jsou multifokální striktury se segmentálními dilatacemi intrahepatálních a/ nebo extrahepatálních žlučovodů.
Při „klasické formě PSC“ jsou postiženy asi v 87 % případů intrahepatální i extrahepatální žlučovody, v 11 % pouze intrahepatální a ve 2 % pouze extrahepatální žlučovody [16]. Velmi časné stadium onemocnění nebo onemocnění postihující nejmenší žlučovody (tzv. small‑duct PSC) [17] může mít velmi chudý až negativní radiografický obraz. Nespornou výhodou MRCP (magnetická rezonanční cholangiopankreatografie) je její neinvazivita [18,19]. Naproti tomu ERCP je jednoznačnou metodou volby u pacientů v akutním stavu, u nichž se PSC manifestovala nebo komplikovala probíhající bakteriální cholangitidou. Výtěžnost MRCP a ERCP je srovnatelná (senzitivita > 80 %, specificita > 87 %) [20,21], avšak výhodou ERCP je nejen její diagnostický přínos (zejména vysoká senzitivita vyšetření při změnách na žlučovodech v časném stadiu onemocnění [18] a při postižení velkých žlučovodů), ale i možnost okamžitého terapeutického zásahu ve smyslu dekomprese žlučového stromu při jeho obstrukci (papilotomie, extrakce konkrementů, biliární drenáž). Provedení jaterní biopsie s histologickou verifikací je na místě v případech, kdy cholangiogram není dostatečně diagnostický. Vzhledem k tomu, že histologické změny u PSC mají často fokální charakter a mohou být lokalizovány kolem velkých žlučovodů včetně oblasti jaterního hilu, nemusí být jaterní biopsie jednoznačnou diagnostickou metodou [22]. Jaterní biopsie tak při typickém radiografickém nálezu typickém pro PSC není doporučována jako rutinní diagnostická metoda [18] a slouží zejména pro průkaz „small‑duct PSC“.
Při PSC laboratorně dominuje jaterní léze cholestatického typu (zejména vzestup ALP a bilirubinu) [23 – 25]. Odchylky v imunologickém spektru jsou též obvyklé (ukazují na imunitní dysregulaci při PSC), avšak nespecifické, a jejich výpovědní hodnota pro stanovení diagnózy je nízká. Pozitivita perinukleárních antineutrofilních cytoplazmatických protilátek (p ‑ ANCA) je pouze v 50 – 80 % případů a tento nález v některých případech koreluje se současným postižení tlustého střeva nespecifickým zánětem [26,27].
Vztah PSC a ulcerózní kolitidy není reciproký. Dle některých studií je až 90 % pacientů s PSC současně postiženo ulcerózní kolitidou [16,28 – 31], přičemž ulcerózní kolitida asociovaná s PSC bývá mírné aktivity [13,14]. U některých pacientů s PSC může být přítomna pouze mikroskopická nespecifická kolitida bez makroskopických známek typických pro ulcerózní kolitidu [32]. Pouze méně než 10 % pacientů s ulcerózní kolitidou má PSC [33] a postižení morbus Crohn se vyskytuje u méně než 4 % případů [34,35].
Jednou z nejzávažnějších komplikací PSC je akutní bakteriální cholangitida. Její průběh může mít až fulminantní charakter s rozvojem cholangiogenní sepse, septického šoku a multiorgánového selhání. Okamžitá dekomprese žlučového stromu s cílenou parenterální antibiotickou léčbou jsou základními kroky v diagnosticko‑terapeutickém postupu. Další závažnou komplikací PSC je zhruba v 15 % případů vznik cholangiokarcinomu [16,36] a též zvýšené riziko vzniku kolorektálního karcinomu vzhledem k časté asociaci PSC s ulcerózní kolitidou [37].
Strategie léčby u pacientů s PSC sleduje dva základní cíle – 1. zpomalení progrese základního onemocnění, 2. řešení komplikací PSC.
Možnosti farmakologické léčby jsou omezené a dosud nebyl potvrzen pozitivní vliv medikamentózní terapie na průběh a zejména progresi základního onemocnění [38]. Jedním z nejvíce diskutovaných preparátů je kyselina ursodeoxycholová (UDCA). Dávky do 15 mg/ kg/ den mohou být spojeny se zlepšením laboratorních parametrů cholestázy a stabilizací zánětlivých procesů v játrech (vliv na zlepšení histologického obrazu je však minimální), avšak dlouhodobý benefit ve smyslu ovlivnění progrese onemocnění nebyl prokázán [39 – 47]. Užívání vysokých dávek UDCA (20 – 30 mg/ kg/ den) vedlo k časnějším úmrtím pacientů, k výskytu jícnových či žaludečních varixů a ve výsledku k nutnosti časnější jaterní transplantace [48]. Z toho důvodu je podávání vysokodávkované UDCA u pacientů s PSC kontraindikováno. I další skupiny léčiv (glukokortikoidy, cyklosporin, takrolimus, metotrexát, azathioprin a 6‑merkaptopurin, penicilamin, anti‑TNF preparáty) nemají v léčbě PSC své pevné místo. Podávání antibiotik v rámci dlouhodobé léčby PSC je rozporuplné i přesto, že podávání kombinace metronidazolu a UDCA vedlo ke zlepšení laboratorního výsledku nemocných (snížení sérových hodnot ALP) podobně jako podávání kombinace metronidazolu s vankomycinem [48].
Endoskopické možnosti terapie PSC jsou zaměřeny na udržení průchodnosti žlučového stromu a spočívají v balonové dilataci, založení biliární drenáže nebo v kombinaci obou předchozích. Dosud neexistuje jednoznačné doporučení ohledně metody volby a vždy záleží na rozhodnutí a zvyklostech jednotlivého endoskopického pracoviště. Efekt balonové dilatace (se současným zavedením biliárního stentu nebo bez něj) ve smyslu zlepšení radiografického, laboratorního i klinického stavu pacienta ukazuje několik pozorování [49 – 54]. Z některých dalších studií však vyplývá, že kombinace dilatace a založení stentu je spojena s vyšším rizikem postprocedurálních komplikací (obturace biliární drenáže, bakteriální cholangitida) [55]. Biliární drenáž spočívá v založení plastových stentů a jejich výměnách v různě dlouhých časových intervalech. Při dlouhodobé biliární drenáži je doporučováno zavedení maximálního možného počtu stentů s pravidelnými výměnami (zhruba každé tři měsíce) až do dosažení úplné rezoluce dominantní striktury [56,57]. Z hlediska výskytu komplikací lze tento typ endoskopické léčby rozdělit do třech stadií: 1. založení drenáže (komplikace okolo 10 %), 2. drén in situ a jeho výměna v tříměsíčních intervalech (komplikace v 10 – 15 %), 3. sledování pacienta po extrakci drénu (rekurence stenóz je asi v 20 %, přičemž asi polovina z nich vzniká do dvou let). Za účelem snížení četnosti komplikací se někdy přistupuje ke krátkodobé biliární drenáži s frekventnějšími výměnami stentů každých 9 – 11 dnů. Úspěšnost po jednom roce od extrakce stentu je v těchto případech kolem 80 % [58,59].
Chirurgická léčba PSC představuje jednak provedení biliární rekonstrukční operace (s intraoperačním založením stentu do biliodigestivní spojky nebo bez něj). Vzhledem k tomu, že tyto operace jsou zatíženy vysokou morbiditou i mortalitou (zejména z důvodu již rozvinuté jaterní cirhózy), vysokým rizikem pooperační infekce a jizvením v oblasti porta hepatis (představujícím potenciální komplikace pro budoucí jaterní transplantaci), nejsou tyto operace u pacientů s PCS všeobecně doporučovány [60]. Dalším typem operace, se kterou se setkáváme u pacientů s PSC, je provedení proktokolektomie, avšak pouze u pacientů, u kterých je tento zákrok indikován z důvodu probíhajícího nespecifického střevního zánětu. Proktokolektomie sama o sobě nevede ke zlepšení laboratorního ani cholangiografického nálezu či histologického jaterního nálezu.
Poslední možností chirurgické léčby PSC, a zároveň jedinou kurativní, je provedení jaterní transplantace. Výsledky a přežívání pacientů po jaterní transplantaci pro PSC jsou nadprůměrné – pětileté přežití přesahuje 85 % [61 – 65].
Závěr
Primární sklerozující cholangitida (PSC) je chronické progredující cholestatické onemocnění charakterizované postupnou fibrózou a obliterací žlučových cest. Diagnostika PSC je založena na radiografickém zobrazení žlučových cest a současně zjištěné cholestatické jaterní lézi. Histologická verifikace onemocnění nemusí být vždy výtěžná vzhledem k častému fokálnímu charakteru onemocnění. Jednou z nejzávažnějších komplikací PSC je akutní bakteriální cholangitida. Námi popsaný případ pacienta ukazuje, že diagnostika PSC nemusí být vždy jednoznačná a je založena na kombinaci různých diagnostických metod, přičemž dominantní postavení v diagnostice má radiografické zobrazení žlučového stromu. U našeho pacienta, jenž se manifestoval rekurentními epizodami akutní bakteriální cholangitidy, jsme diagnózu PSC stanovili podle přesvědčivého radiografického, laboratorního a klinického nálezu.
Podpořeno projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL).
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 12. 8. 2014
Přijato: 11. 1. 2015
MU Dr. Ladislav Douda
Interní klinika 2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
ladislav.douda@fnmotol.cz
Zdroje
1. Woolf GM, Vierling JM. Disappearing intrahepatic bile ducts: the syndromes and their mechanisms. Semin Liver Dis 1993; 13(3): 261 – 275.
2. Bergquist A, Montgomery SM, Bahmanyar S et al. Increased risk of primary sclerosing cholangitis and ulcerative colitis in first ‑ degree relatives of patients with primary sclerosing cholangitis. Clin Gastroenterol Hepatol 2008; 6(8): 939 – 943. doi: 10.1016/ j.cgh.2008.03.016.
3. Prochazka EJ, Terasaki PI, Park MS et al. Association of primary sclerosing cholangitis with HLA‑DRw52a. N Engl J Med 1990; 322(26): 1842 – 1844.
4. Zetterquist H, Broomé U, Einarsson K et al. HLA class II genes in primary sclerosing cholangitis and chronic inflammatory bowel disease: no HLA‑DRw52a association in Swedish patients with sclerosing cholangitis. Gut 1992; 33(7): 942 – 946.
5. Norris S, Kondeatis E, Collins R et al. Mapping MHC ‑ encoded susceptibility and resistance in primary sclerosing cholangitis: the role of MICA polymorphism. Gastroenterology 2001; 120(6): 1475 – 1482.
6. Janse M, Lamberts LE, Franke L et al. Three ulcerative colitis susceptibility loci are associated with primary sclerosing cholangitis and indicate a role for IL2, REL, and CARD9. Hepatology 2011; 53(6): 1977 – 1985. doi: 10.1002/ hep.24307.
7. Melum E, Franke A, Schramm C et al. Genome ‑ wide association analysis in primary sclerosing cholangitis identifies two non‑HLA susceptibility loci. Nat Genet 2011; 43(1): 17 – 19. doi: 10.1038/ ng.728.
8. Hov JR, Keitel V, Laerdahl JK et al. Mutational characterization of the bile acid receptor TGR5 in primary sclerosing cholangitis. PLoS One 2010; 5(8): e12403. doi: 10.1371/ journal.pone.0012403.
9. Molodecky NA, Kareemi H, Parab R et al. Incidence of primary sclerosing cholangitis: a systematic review and meta‑analysis. Hepatology 2011; 53(5): 1590 – 1599. doi: 10.1002/ hep.24247.
10. Wienser RH, Porayko MK, LaRusso NF et al. Diseases of the Liver. 7th ed. Philadelphia: JB Lippincott 1993 : 411.
11. Vierling JM. Hepatobiliary complications of ulcerative colitis and Crohn‘s disease. In: Zakim D, Boyer TD, WB Saunders (eds). Hepatology: a textbook of liver disease. Vol 2. Philadelphia 1996 : 1366.
12. Porayko MK, LaRusso NF, Wiesner RH. Primary sclerosing cholangitis: a progressive disease? Semin Liver Dis 1991; 11(1): 18 – 25.
13. Sokol H, Cosnes J, Chazouilleres O et al. Disease activity and cancer risk in inflammatory bowel disease associated with primary sclerosing cholangitis. World J Gastroenterol 2008; 14(22): 3497 – 3503.
14. Drastich P, Kamenář DE, Wohl P et al. Ulcerative colitis in patiens with primary sclerosing cholangitis (PSC ‑ UC) – a specific subgroup. Čes a Slov Gastroent a Hepatol 2007; 61 (Suppl 1).
15. Loftus EV Jr., Harewood GC, Loftus C et al. PSC ‑ IBD: a unique form of inflammatory bowel disease associated with primary sclerosing cholangitis. Gut 2005; 54(1): 91 – 96.
16. Lee YM, Kaplan MM. Primary sclerosing cholangitis. N Engl J Med 1995; 332(14): 924 – 933.
17. Wee A, Ludwig J. Pericholangitis in chronic ulcerative colitis: primary sclerosing cholangitis of the small bile ducts? Ann Intern Med 1985; 102(5): 581 – 587.
18. Chapman R, Fevery J, Kalloo A et al. Diagnosis and management of primary sclerosing cholangitis. Hepatology 2010; 51(2): 660 – 678. doi: 10.1002/ hep.23294.
19. Dave M, Elmunzer BJ, Dwamena BA et al. Primary sclerosing cholangitis: meta‑analysis of diagnostic performance of MR cholangiopancreatography. Radiology 2010; 256(2): 387 – 396. doi: 10.1148/ radiol. 10091953.
20. Berstad AE, Aabakken L, Smith HJ et al. Diagnostic accuracy of magnetic resonance and endoscopic retrograde cholangiography in primary sclerosing cholangitis. Clin Gastroenterol Hepatol 2006; 4(4): 514 – 520.
21. Angulo P, Pearce DH, Johnson CD et al. Magnetic resonance cholangiography in patients with biliary disease: its role in primary sclerosing cholangitis. J Hepatol 2000; 33(4): 520 – 527.
22. Burak KW, Angulo P, Lindor KD. Is there a role for liver biopsy in primary sclerosing cholangitis? Am J Gastroenterol 2003; 98(5): 1155 – 1158.
23. Tischendorf JJ, Hecker H, Kruger M et al. Characterization, outcome, and prognosis in 273 patients with primary sclerosing cholangitis: a single center study. Am J Gastroenterol 2007; 102(1): 107 – 114.
24. Broome U, Olsson R, Loof L et al. Natural history and prognostic factors in 305 Swedish patients with primary sclerosing cholangitis. Gut 1996; 38(4): 610 – 615.
25. Chapman RW, Arborgh BA, Rhodes JM et al. Primary sclerosing cholangitis: a review of its clinical features, cholangiography, and hepatic histology. Gut 1980; 21(10): 870 – 877.
26. van Milligen de Wit AW, van Deventer SJ, Tytgat GN. Immunogenetic aspects of primary sclerosing cholangitis: implications for therapeutic strategies. Am J Gastroenterol 1995; 90(6): 893 – 900.
27. Hov JR, Boberg KM, Karlsen TH. Autoantibodies in primary sclerosing cholangitis. World J Gastroenterol 2008; 14(24): 3781 – 3791.
28. Fausa O, Schrumpf E, Elgjo K. Relationship of inflammatory bowel disease and primary sclerosing cholangitis. Semin Liver Dis 1991; 11(1): 31 – 39.
29. Tung BY, Brentnall T, Kowdley KV et al. Diagnosis and prevalence of ulcerative colitis in patients with sclerosing cholangitis (abstract). Hepatology 1996; 24 : 169A.
30. Bambha K, Kim WR, Talwalkar J et al. Incidence, clinical spectrum, and outcomes of primary sclerosing cholangitis in a United States community. Gastroenterology 2003; 125(5): 1364 – 1369.
31. Escorsell A, Parés A, Rodés J et al. Epidemiology of primary sclerosing cholangitis in Spain. Spanish Association for the Study of the Liver. J Hepatol 1994; 21(5): 787 – 791.
32. Jørgensen KK, Grzyb K, Lundin KE et al. Inflammatory bowel disease in patients with primary sclerosing cholangitis: clinical characterization in liver transplanted and nontransplanted patients. Inflamm Bowel Dis 2012; 18(3): 536 – 545. doi: 10.1002/ ibd.21699.
33. Olsson R, Danielsson A, Jarnerot G et al. Prevalence of primary sclerosing cholangitis in patients with ulcerative colitis. Gastroenterology 1991; 100 (5 Pt 1): 1319 – 1323.
34. Kaplan GG, Laupland KB, Butzner D et al. The burden of large and small duct primary sclerosing cholangitis in adults and children: a population‑based analysis. Am J Gastroenterol 2007; 102(5): 1042 – 1049.
35. Rasmussen HH, Fallingborg JF, Mortensen PB et al. Hepatobiliary dysfunction and primary sclerosing cholangitis in patients with Crohn‘s disease. Scand J Gastroenterol 1997; 32(6): 604 – 610.
36. Rosen CB, Nagorney DM, Wiesner RH et al. Cholangiocarcinoma complicating primary sclerosing cholangitis. Ann Surg 1991; 213(1): 21 – 25.
37. Jørgensen KK, Grzyb K, Lundin KE et al. Inflammatory bowel disease in patients with primary sclerosing cholangitis: clinical characterization in liver transplanted and nontransplanted patients. Inflamm Bowel Dis 2011; 18(3): 536 – 545. doi: 10.1002/ ibd.21699.
38. Lindström L, Hultcrantz R, Boberg KM et al. Association between reduced levels of alkaline phosphatase and survival times of patients with primary sclerosing cholangitis. Clin Gastroenterol Hepatol 2013; 11(7): 841 – 846. doi: 10.1016/ j.cgh.2012.12.032.
39. Préaux AM, Mallat A, Rosenbaum J et al. Pentoxifylline inhibits growth and collagen synthesis of cultured human hepatic myofibroblast‑like cells. Hepatology 1997; 26(2): 315 – 322.
40. Bharucha AE, Jorgensen R, Lichtman SN et al. A pilot study of pentoxifylline for the treatment of primary sclerosing cholangitis. Am J Gastroenterol 2000; 95(9): 2338 – 2342.
41. Schramm C, Schirmacher P, Helmreich ‑ Becker I et al. Combined therapy with azathioprine, prednisolone, and ursodiol in patients with primary sclerosing cholangitis. A case series. Ann Intern Med 1999; 131(12): 943 – 946.
42. van Hoogstraten HJ, Vleggaar FP, Boland GJ et al. Budesonide or prednisone in combination with ursodeoxycholic acid in primary sclerosing cholangitis: a randomized double‑blind pilot study. BelgianDutch PSC Study Group. Am J Gastroenterol 2000; 95(8): 2015 – 2122.
43. Farkkila MA, Karkkainen P, Karvonen AL et al. Combination of ursodeoxycholic acid (UDCA) and metronidazole (MTZ) in PSC: reduction of inflammation in liver correlates with the decrease of the New Mayo Risk Score (abstract). Gastroenterology 2003; 124: A707.
44. Lichtman SN, Sartor RB, Keku J et al. Hepatic inflammation in rats with experimental small intestinal bacterial overgrowth. Gastroenterology 1990; 98(2): 414 – 423.
45. Färkkilä M, Karvonen AL, Nurmi H et al. Metronidazole and ursodeoxycholic acid for primary sclerosing cholangitis: a randomized placebo ‑ controlled trial. Hepatology 2004; 40(6): 1379 – 1386.
46. Davies YK, Cox KM, Abdullah BA et al. Long‑term treatment of primary sclerosing cholangitis in children with oral vancomycin: an immunomodulating antibiotic. J Pediatr Gastroenterol Nutr 2008; 47(1): 61 – 67. doi: 10.1097/ MPG.0b013e31816fee95.
47. Silveira MG, Torok NJ, Gossard AA et al. Minocycline in the treatment of patients with primary sclerosing cholangitis: results of a pilot study. Am J Gastroenterol 2009; 104(1): 83 – 88. doi: 10.1038/ ajg.2008.14.
48. Tabibian JH, Weeding E, Jorgensen RA et al. Randomised clinical trial: vancomycin or metronidazole in patients with primary sclerosing cholangitis – a pilot study. Aliment Pharmacol Ther 2013; 37(6): 604 – 612. doi: 10.1111/ apt.12232.
49. MacCarty RL, LaRusso NF, Wiesner RH et al. Primary sclerosing cholangitis: findings on cholangiography and pancreatography. Radiology 1983; 149(1): 39 – 44.
50. May GR, Bender CE, LaRusso NF et al. Nonoperative dilatation of dominant strictures in primary sclerosing cholangitis. AJR Am J Roentgenol 1985; 145(5): 1061 – 1064.
51. Johnson GK, Geenen JE, Venu RP et al. Endoscopic treatment of biliary tract strictures in sclerosing cholangitis: a larger series and recommendations for treatment. Gastrointest Endosc 1991; 37(1): 38 – 43.
52. Lee JG, Schutz SM, England RE et al. Endoscopic therapy of sclerosing cholangitis. Hepatology 1995; 21(3): 661 – 667.
53. Gaing AA, Geders JM, Cohen SA et al. Endoscopic management of primary sclerosing cholangitis: review, and report of an open series. Am J Gastroenterol 1993; 88(12): 2000 – 2008.
54. van Milligen de Wit AW, van Bracht J, Rauws EA et al. Endoscopic stent therapy for dominant extrahepatic bile duct strictures in primary sclerosing cholangitis. Gastrointest Endosc 1996; 44(3): 293 – 299.
55. Papatheodoridis GV, Hamilton M, Mistry PK et al. Ulcerative colitis has an aggressive course after orthotopic liver transplantation for primary sclerosing cholangitis. Gut 1998; 43(5): 639 – 644.
56. Bergman JJ. Management of postsurgical bile leaks and bile duct strictures. In: Cotton PB (ed.). ERCP. GastroHep eBook 2008.
57. Larghi A, Tringali A, Lecca PG et al. Management of biliary strictures. Am J Gastroenterol 2008; 103(2): 458 – 473.
58. vanMilligen deWitt AW, Rauws EA, vanBracht J et al. Lack of complications for extrahepatic bile duct strictures in primary sclerosing cholangitis. Gastrointest Endosc 1997; 46(4): 344 – 347.
59. Ponsioen CY, Lam K, vanMiligen deWitt AW et al. Four years experience with short term stenting in primary sclerosing cholangitis. Am J Gastroenterol 1999; 94(9): 2403 – 2407.
60. Pawlik TM, Olbrecht VA, Pitt HA et al. Primary sclerosing cholangitis: role of extrahepatic biliary resection. J Am Coll Surg 2008; 206(5): 822 – 830. doi: 10.1016/ j.jamcollsurg.2007.12.015.
61. Drastich P, Bajer L, Wohl P et al. Transplantace jater pro primární sklerozující cholangitidu. Gastroent Hepatol 2013; 67(5): 413 – 420.
62. Langnas AN, Grazi GL, Stratta RJ et al. Primary sclerosing cholangitis: the emerging role for liver transplantation. Am J Gastroenterol 1990; 85(9): 1136 – 1141.
63. McEntee G, Wiesner RH, Rosen C et al. A comparative study of patients undergoing liver transplantation for primary sclerosing cholangitis and primary biliary cirrhosis. Transplant Proc 1991; 23(1 Pt 2): 1563 – 1564.
64. Graziadei IW, Wiesner RH, Marotta PJet al. Long‑term results of patients undergoing liver transplantation for primary sclerosing cholangitis. Hepatology 1999; 30(5): 1121 – 1127.
65. Adam R, Hoti E. Liver transplantation: the current situation. Semin Liver Dis 2009; 29(1): 3 – 18. doi: 10.1055/ s ‑ 0029 ‑ 1192052.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2015 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Vývoj České gastroenterologické společnosti a gastroenterologie z pohledu tří generací lékařů
- Starší generace gastroenterologů a hepatologů
- Vývoj a proměny české gastroenterologie a gastroenterologické společnosti v 70leté historii
- Niektoré postrehy z histórie slovenskej gastroenterológie 1945– 2002
- Vývoj a proměny české gastroenterologie – 90. léta minulého století
- Vzťahy
- Střední generace gastroenterologů a hepatologů
- Česká gastroenterologie po roce 1989 – osobní pohled
- Spolupráce Společnosti pro gastrointestinální onkologii s Českou gastroenterologickou společností
- Význam hradecké školy pro českou gastroenterologii
- Vývoj a premeny česko‑ slovenskej gastroenterológie po roku 2000
- Střední generace gastroenterologů a hepatologů
- Historie hepatologie na území České republiky
- Nekonečná endoskopická cesta aneb endoskopická chirurgie – nový obor?
- Vývoj léčby idiopatických střevních zánětů v posledních 20 letech
- Mladší generace gastroenterologů a hepatologů
- Další vývoj české gastroenterologie z pohledu mladých gastroenterologů
- Medailonky předsedů České gastroenterologické společnosti
- Diagnostika a léčba anémie u nemocných s chorobami gastrointestinálního traktu
-
Komentář k článku v časopise Gut
Screening jaterního poškození u pacientů s diabetes mellitus 2. typu - Svízelná diagnostika primární sklerozující cholangitidy u pacienta s rekurentními epizodami akutní bakteriální cholangitidy
-
Komentář ke kazuistice
Svízelná diagnostika primární sklerozující cholangitidy s rekurentními epizodami akutní bakteriální cholangitidy - Neobvyklá příčina průjmu – cholecystokolická píštěl: kazuistika a literární přehled
- Bouveretův syndrom – endoskopické řešení vysokého ileu
- ICDS 2015, Praha
- Komentáře k vybraným zahraničním článkům
- Budenofalk Uno 9 mg enterosolventní granule
- Autodidaktický test: historie gastroenterologické společnosti a časopisu
- SOUTĚŽ O NEJLEPŠÍ KAZUISTIKU 2015
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Neobvyklá příčina průjmu – cholecystokolická píštěl: kazuistika a literární přehled
- Budenofalk Uno 9 mg enterosolventní granule
- Diagnostika a léčba anémie u nemocných s chorobami gastrointestinálního traktu
- Střední generace gastroenterologů a hepatologů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



