-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaNáš článek po 10 letech: The practice of therapeutic mild hypothermia in cardiac arrest survivors in the Czech Republic
Our article after ten years: The practice of therapeutic mild hypothermia in cardiac arrest survivors in the Czech Republic
In 2010, the results of a national survey on the use of therapeutic mild hypothermia in patients successfully resuscitated from Cardiac arrest or sudden circulatory arrest hospitalized in intensive care units in the Czech Republic were published. This article reflects the results of the survey in the context of knowledge at the time of publication and from the perspective of current knowledge.
Keywords:
therapeutic mild hypothermia – intensive care unit – survey
Autoři: R.- Škulec 1 4; A. Truhlář 3,5; J. Knor 2; J. Šeblová 2,6,7; V.- Černý 1,4,8 10
Působiště autorů: Klinika anesteziologie, perioperační a intenzivní medicíny, Univerzita J. E. Purkyně v Ústí nad Labem, Masarykova nemocnice v Ústí nad Labem 1; Zdravotnická záchranná služba Středočeského kraje 2; Klinika anesteziologie, resuscitace a intenzivní medicíny, Univerzita Karlova, Lékařská fakulta v Hradci Králové, Fakultní nemocnice Hradec Králové 3; Fakulta zdravotnických studií, Univerzita J. E. Purkyně v Ústí nad Labem 4; Zdravotnická záchranná služba Královehradeckého kraje 5; Urgentní příjem, Oblastní nemocnice Kladno 6; Oddělení urgentního příjmu a LSPP dětí, Fakultní nemocnice Motol, Praha 7; Centrum pro výzkum a vývoj, Fakultní nemocnice Hradec Králové 8; Department of Anesthesia, Pain Management and Perioperative Medicine, Dalhousie University, Halifax, Canada 9; Technická univerzita v Liberci 10
Vyšlo v časopise: Anest. intenziv. Med., 31, 2020, č. 4, s. 165-171
Kategorie: Přehledové články
Souhrn
V roce 2010 byly v časopise Minerva Anestesiologica publikovány výsledky národního dotazníkového průzkumu o po užívání terapeutické mírné hypotermie u pacientů úspěšně resuscitovaných pro náhlou zástavu oběhu na jednotkách intenzivní péče v České republice. Tento článek reflektuje výsledky práce v kontextu znalostí v době publikace a z pohledu současného poznání.
Klíčová slova:
terapeutická mírná hypotermie – jednotka intenzivní péče – průzkum
Úvod
Tento článek je vyžádaná práce s cílem reflektovat publikaci „Skulec R, Truhlar A, Knor J, Seblova J, Cerny V. The practice of therapeutic mild hypothermia in cardiac arrest survivors in the Czech Republic. Minerva Anestesiol 2010; 76(8): 617–623“ v kontextu znalostí o problematice v době publikace a z pohledu současného poznání [1].
Návrat spontánní cirkulace (ROSC) po úspěšné kardiopulmonální resuscitaci (KPR) pro mimonemocniční náhlou zástavu oběhu (OHCA) nebo náhlou zástavu oběhu v nemocnici (IHCA) je následován rozvojem syndromu po srdeční zástavě. Tento syndrom zahrnuje posthypoxickou encefalopatii, která je hlavní příčinou smrti v poresuscitačním období a klíčovým faktorem ovlivňujícím dlouhodobou kvalitu života [2]. Jeden z postupů, který může zvýšit šanci na příznivý neurologický výsledek a pravděpodobně snižuje celkovou mortalitu nemocných po náhlé zástavě oběhu je cílená regulace tělesné teploty (targeted temperature management, TTM) v časné intenzivní péči. Jedna z forem TTM je indukce terapeutické mírné hypotermie (TH). Používání této metody je tématem zmíněné publikace.
Souhrn publikované práce
Publikovaná práce shrnuje výsledky národního dotazníkového průzkumu o používání TH u pacientů úspěšně resuscitovaných pro náhlou zástavu oběhu na jednotkách intenzivní péče v České republice [1]. Realizace a publikace byla financována grantem IGA MH CZ NS10383 - 2/2009 Ministerstva zdravotnictví České republiky a grantem MZO 00179906 Fakultní nemocnice Hradec Králové, a podpořena Českou společností anesteziologie, resuscitace a intenzivní medicíny ČLS JEP, Českou společností intenzivní medicíny a Společností urgentní medicíny a medicíny katastrof ČLS JEP. Výsledky práce byly prezentovány na XVII. národním kongresu ČSARIM 2010 ve Zlíně a na Third International Hypothermia Symposium 2009 v Lundu, Švédsko.
Cílem průzkumu bylo zjistit způsob používání TH u pacientů úspěšně resuscitovaných pro náhlou zástavu oběhu na jednotkách intenzivní péče v České republice a diskutovat o možnostech další optimalizace. Průzkum byl uskutečněn jako druhý projekt pracovní skupiny PRE‑COOL (Pre‑hospital Cooling in Cardiac Arrest Patients) a nazván „PRE‑COOL 2: Hospital Survey 2008“.
Na základě registru nemocnic České republiky a internetových veřejných zdrojů byl sestaven seznam jednotek intenzivní péče v České republice. Po vyřazení chirurgických, porodnicko‑gynekologických a ortopedických byli v říjnu 2008 poštou obesláni vedoucí lékaři celkem 487 oddělení s prosbou o vyplnění dotazníku. Dotazník byl sestaven ze 44 strukturovaných polouzavřených nebo uzavřených dichotomických nebo polytomických otázek zkoumajících obecné charakteristiky jednotek intenzivní péče, četnost používání TH a metodologii používání TH.
Návratnost dotazníků byla 41,5 %, z toho 141 respondentů uvedlo, že poskytují časnou poresuscitační péči. Z těchto oddělení uvedlo 90 respondentů (63,8 %), že na oddělení používají TH. Tyto odpovědi byly dále analyzovány. Hlavní charakteristiky jednotek intenzivní péče, indikace TH, trvání jednotlivých fází, cílovou tělesnou teplotu a způsob měření tělesné teploty shrnuje tabulka 1. Nejčastěji používané ochlazovací metody byly prosté ledové obklady (88,9 %), nitrožilní rychlá aplikace chladného krystaloidního roztoku (84,4 %) a chladný výplach žaludku (68,9 %) a močového měchýře (43,4 %). Sofistikovaný ochlazovací systém s možností automatické regulace (katétrové endovaskulární ochlazování, chladící matrace) používalo 37,8 % respondentů. Ochlazovací metody byly různě kombinovány a nejčastější kombinace byly prosté ledové obklady a nitrožilní aplikace chladného roztoku (70,6 %).
Tab. 1. Charakteristika respondentů, indikace TH a některé procedurální charakteristiky 
Strategii plánované komplexní poresuscitační péče zahrnující TH, hemodynamickou optimalizaci, kontrolu glykemie a indikaci urgentní katetrizace u pacientů s akutním koronárním syndromem používalo 52,2 % jednotek intenzivní péče. Urgentní koronarografii indikovalo 83,3 % respondentů u pacientů s akutním infarktem myokardu s elevacemi ST úseku a 45,6 % respondentů u pacientů s akutním koronárním syndromem bez elevací ST úseku. Glykemie < 12 mmol/l byla cílovou hodnotou pro 67,8 % respondentů, 4,4–6,1 mmol /l pro 32,2 %. Snaha o hemodynamickou optimalizaci rychlým dosažením cílových hodnot byla rutinním postupem u 62,2 % respondentů a nejčastějším cílovým hemodynamickým parametrem byla kombinace středního arteriálního tlaku a centrálního žilního tlaku (62,2 %). Nejčastějším způsobem sedace pacientů byla kombinace midazolamu a sufentanylu (82,8 %). Rutinní podávání myorelaxace během procedury TH referovalo 65,6 % respondentů. Nejčastěji používaným myorelaxanciem bylo pipecuronium (59,3 %). Paušální podávání inhibitorů produkce žaludeční kyseliny během TH uvádělo 73,3 %, heparinu 55,5 %, magnézia 30,0 %, antibiotik 16,7 % a antipyretik 16,7 % respondentů. Nutrice byla indikovaná nejčastěji po návratu normotermie (58,9 %), 15,5 % respondentů indikovalo nutrici již během TH.
Výsledky průzkumu ukázaly, že TH v časné poresuscitační péči o pacienty úspěšně resuscitované pro náhlou zástavu oběhu používaly v roce 2008 téměř dvě třetiny jednotek intenzivní péče v České republice ze všech, které tuto péči poskytovaly. Tato míra implementace byla špičková i ve světovém měřítku [4]. Polovina respondentů se snažila praktikovat strategii aktivní komplexní poresuscitační péče včetně TH a téměř dvě třetiny respondentů používaly TH na základě psaného protokolu. Metodologické aspekty byly různé, ale převážně reflektovaly tehdejší úroveň znalostí. Až vizionářsky působí informace, že 2,2 % respondentů považovalo za cílovou teplotu i 36 °C. Jako hlavní výstup byla uvedena nutnost úsilí vedoucí ke standardizaci jednotného protokolu pro používání TH.
Tehdejší stav znalostí o TH u pacientů po náhlé zástavě oběhu
Fyziologickým cílem používání TH u pacientů úspěšně resuscitovaných pro náhlou zástavu oběhu je suprese dějů vedoucích k nevratnému poškození centrálního nervového systému, klinickým cílem pak obnovení integrity neurologických funkcí v maximální možné míře a snížení mortality pacientů s předpokladem dobrého klinického výsledku. Širokou implementaci metody TH do praxe umožnila plejáda vědeckých argumentů různého charakteru: známý patofyziologický mechanismus syndromu po srdeční zástavě, známý tlumící vliv TH na tyto děje, výsledky experimentálních studií potvrzujících účinnost TH, výsledky randomizovaných klinických studií, relativní bezpečnost metody TH a absence jiného postupu, který by prokazatelně zlepšoval prognózu pacientů.
Mechanismus účinku TH vyplývá z faktu, že obnovení životních funkcí u pacientů s náhlou zástavou oběhu pomocí kardiopulmonální resuscitace je z evolučního hlediska zcela nepřirozený patofyziologický stav (zdůrazňujeme, že v tomto případě nebereme v úvahu medicínský, etický a filozofický aspekt snahy o záchranu života). Důsledkem toho je, že lidský organismus nemá k dispozici žádné specifické reparační mechanismy pro řešení následků náhlé zástavy oběhu. Využívá proto mechanismy náhradní, určené k boji s infekcí, k hojení ran apod. Jedná se však o dvojsečný meč a řada těchto náhradních mechanismů naopak organismus dále poškozuje. Celý komplex dějů vede k rozvoji klinického syndromu po srdeční zástavě, součástí kterého jsou poškození mozku, myokardiální dysfunkce po srdeční zástavě, systémová ischemicko‑reperfuzní reakce a perzistující základní onemocnění [4]. Některé z patofyziologických pochodů syndromu po srdeční zástavě se rozvíjejí velmi časně, ještě během srdeční zástavy, jiné jsou spuštěny až po ROSC a rozvíjí se v dalších hodinách. Tím se otvírá časové okno pro potenciální léčebnou intervenci. Nejzávažnější součástí syndromu po srdeční zástavě, která výrazně ovlivňuje časnou mortalitu i dlouhodobou kvalitu života, je poškození mozku, které je hlavním terapeutickým cílem TH [4]. Snížení tělesné teploty je nespecifické opatření, které ovlivňuje průběh ischemicko‑reperfuzního poškození řadou mechanismů a má neuroprotektivní, antiapoptotický, antiedematózní a protizánětlivý efekt [5]. Navození hypotermie redukuje intracerebrální metabolickou aktivitu o 7 % na každý 1 °C poklesu teploty mozku a redukuje celotělovou energetickou potřebu organismu [6].
Experimentální práce vedly k objevu jednotlivých mechanismů hypotermické protekce mozku a také prokázaly pozitivní efekt hypotermie na intenzitu neurologického poškození po experimentální srdeční zástavě ve srovnání s normotermií [7, 8]. Základní patofyziologické děje vedoucí k poresuscitační encefalopatii shrnuje obrázek 1.
Obr. 1. Patofyziologické mechanismy poškození mozku po srdeční zástavě 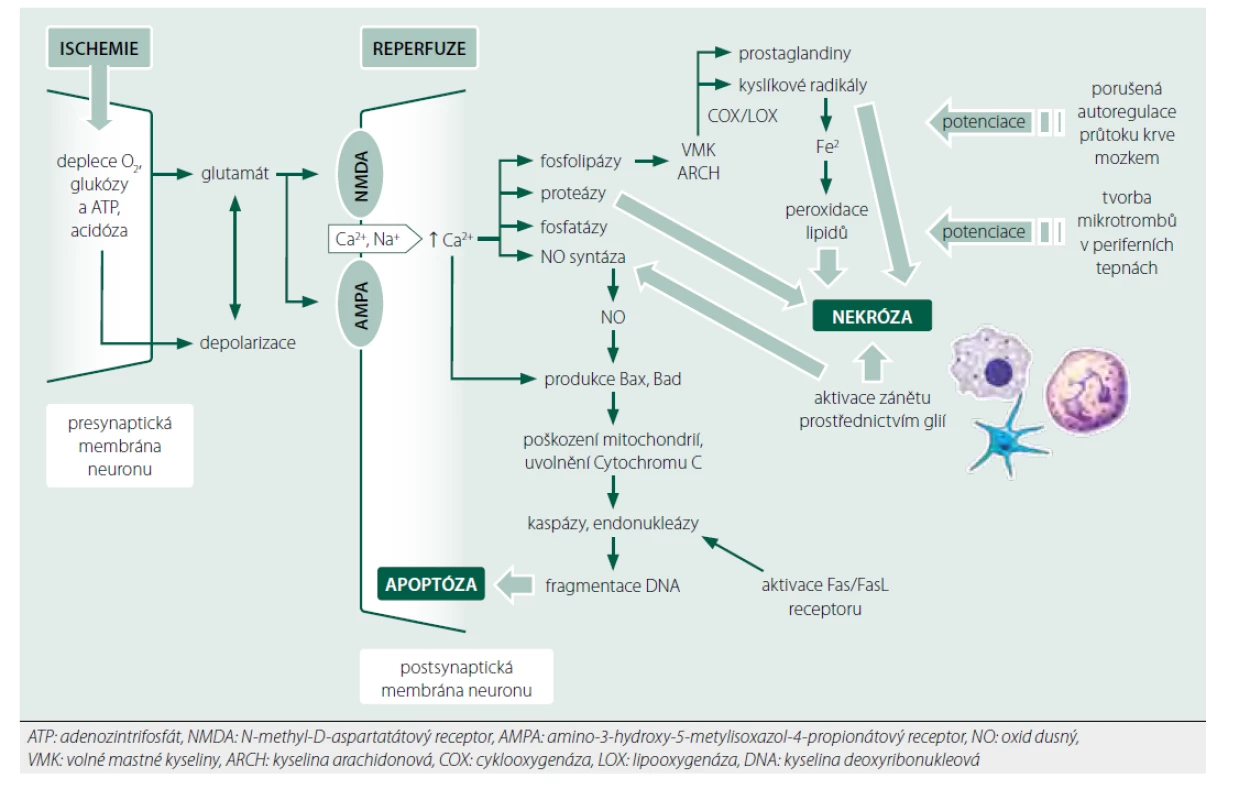
Klinické důkazy o účinnosti TH u pacientů po náhlé zástavě oběhu ukázaly především dvě randomizované klinické studie společně publikované v jednom čísle New England Journal of Medicine v únoru 2002. Protokol obou klinických studií byl velmi podobný, a přestože probíhaly zcela nezávisle, autoři dosáhli podobných výsledků výrazně podporujících ochlazování po náhlé zástavě oběhu [9, 10]. Do klinické studie The European Hypothermia After Cardiac Arrest (HACA) bylo zařazeno 275 nemocných úspěšně resuscitovaných pro OHCA s defibrilovatelným iniciálním rytmem. Pacienti byli randomizováni ke konvenční léčbě bez ochlazování nebo k indukci TH o teplotě 32–34 °C v trvání 24 hodin. Kromě příznivého neuroprotektivního efektu v podobě signifikantně nižšího rizika závažné posthypoxické encefalopatie byla ve skupině s TH pozorovaná po 6 měsících nižší mortalita než ve skupině s konvenční léčbou (41 vs. 55 %, p < 0,05, RR 0,74, CI 95 % 0,58–0,95, p < 0,05) [9]. Do australské studie Bernarda et al. bylo zařazeno 77 nemocných úspěšně resuscitovaných pro OHCA s fibrilací komor. Pacienti byli následně randomizováni k ochlazení na 32–34 °C v trvání 12 hodin. Použití TH bylo spojeno s vyšší pravděpodobností dosažení příznivého neurologického výsledku při propuštění z nemocnice (49 vs. 26 %; p < 0,05) [10]. Do roku 2010 bylo následně publikováno mnoho dalších prací s různou kvalitou evidence hodnotících různé aspekty TH a převážně deklarujících pozitivní efekt metody na prognózu pacientů či na jednotlivé aspekty klinického průběhu [11–18]. Žádná z nich nepřekonala uvedené dvě klinické studie. Domníváme se, že nejcennější z těchto prací s největším dopadem na rutinní péči měla práce Sundeho et al. [19]. Porovnali soubor úspěšně resuscitovaných pacientů po mimonemocniční náhlé zástavě oběhu léčených před érou TH tradičním pasivním a vyčkávacím přístupem a soubor pacientů léčených aktivním a komplexním způsobem podle předem stanoveného protokolu obsahujícího terapeutické cíle a zjistili, že aktivním přístupem lze docílit lepší terapeutický výsledek [19]. Další studie toto pozorování potvrdily [14, 20, 21].
Na základě všech poznatků byl velký důraz kladen na princip „čím dříve je ochlazování zahájeno a čím dříve je dosaženo cílové tělesné teploty, tím lépe“. Proto byl rozvíjen i koncept zahájení TH bezprostředně po ROSC, v přednemocniční neodkladné péči anebo dokonce již během kardiopulmonální resuscitace [15, 22, 23].
Z metodologického hlediska bylo zásadních několik otázek:
Jaká je cílová skupina pacientů indikovaných k TH?
Jaká je optimální cílová tělesná teplota?
Jaké je optimální načasování zahájení ochlazování?
Jaká je nejvhodnější ochlazovací rychlost?
Jak dlouho je třeba udržovat cílovou tělesnou teplotu?
Jaká je nejvhodnější ochlazovací metoda a závisí klinický výsledek na typu ochlazovací metody?
K prvním pěti otázkám se vyjádřily Doporučení pro kardiopulmonální resuscitaci Evropské resuscitační rady z roku 2005 a 2010. Bylo doporučeno, že dospělí pacienti úspěšně resuscitovaní pro OHCA pro fibrilaci komor s přetrvávajícím bezvědomím po ROSC by měli být ochlazováni na cílovou tělesnou teplotu 32–34 °C, ochlazování by mělo být zahájeno co nejdříve a hypotermie v cílovém rozmezí by měla být udržována po dobu 12–24 hodin. Bylo navíc konstatováno, že TH může být prospěšná i pro pacienty s nedefibrilovatelným iniciálním rytmem a pro pacienty s náhlou zástavou oběhu v nemocnici [24, 25]. Je ale třeba zdůraznit, že tato doporučení byla zkonstruována na základě protokolů dvou již uvedených randomizovaných klinických studií a konsenzu světových autorit v resuscitační medicíně. Kdyby byly protokoly odlišné, odlišná by byla pravděpodobně i doporučení. Proto bylo i na konci první dekády 21. století nutné konstatovat, že není přesně známé, kteří pacienti z TH profitují a kteří ne, a nevěděli jsme, jaká je optimální cílová tělesná teplota, rychlost ochlazování, načasování zahájení ochlazování a jak dlouho by TH měla trvat. Přestože byly k dispozici různé ochlazovací metody, chyběl důkaz, že by některá z nich měla být preferována ve smyslu pravděpodobnosti lepšího neurologického výsledku [26]. U sofistikovaných technik bylo pouze zjištěno, že umožňují přesněji udržet tělesnou teplotu v cílovém rozmezí a nedochází tak k fenoménu nadměrného nebo naopak nedostačeného ochlazení [16, 27].
V době publikace diskutované práce se začala více zdůrazňovat nutnost počítat s odlišnou farmakokinetikou léků (zejména opioidy, benzodiazepiny a myorelaxancia) během TH [28].
Další vývoj poznání v problematice
V následujících deseti letech byla publikována řada prací, které ovlivnily další používání TH a pozměnily celý pohled na tuto problematiku. Pokrok v problematice lze shrnout do následujících základních bodů.
Rozšíření spektra cílené regulace tělesné teploty
Největším dilematem první dekády používání TH bylo, zda je pro docílení optimálního neuroprotektivního efektu nutné snížit tělesnou teplotu do pásma mírné hypotermie, anebo stačí udržovat normotermii. Doprovodný jev syndromu po srdeční zástavě je totiž rozvoj hypertermie, a bylo prokázáno, že horečka v poresuscitačním období zhoršuje neurologické poškození a prognózu pacientů [29, 30]. V obou uvedených klinických studiích z roku 2002 nebyla hypertermie v kontrolních skupinách kontrolovaná a ve skutečnosti šlo o porovnání efektu mírné hypotermie a hypertermie [9, 10]. V roce 2014 publikovali Nielsen et al. výsledky doposud největší randomizované klinické studie, která hodnotila klinický efekt TH ve srovnání s normotermií (The Target Temperature Management 33 °C versus 36 °C after Out‑of‑Hospital Cardiac Arrest). Randomizovali 950 nemocných úspěšně resuscitovaných pro OHCA s pravděpodobnou kardiální etiologií bez ohledu na iniciální rytmus k cílené regulaci tělesné teploty na 33 nebo 36 °C po dobu 28 hodin (včetně indukční fáze) s následným řízeným ohříváním na 37 °C rychlostí 0,5 °C/hod. Poté bylo cílem udržet tělesnou teplotu < 37,5 °C až do uplynutí 72 hodin od srdeční zástavy. Nebyl zjištěn rozdíl v mortalitě v obou skupinách (skupina 33 °C: 50 %; skupina 36 °C: 48 %; p = 0,510), ani ve výskytu špatného neurologického výsledku (hodnota cerebral performance category 3–5 u 54 % nemocných ve skupině s 33 °C a 52 % ve skupině s 36 °C, p > 0,500). Nebyl tedy zjištěn prospěch indukce TH ve srovnání s normotermií [31]. Výsledky této studie vnesly do poresuscitační péče určitou nejistotu. Přestože byla Nielsenova studie kritizována z řady důvodů (heterogenita pacientů, velký rozptyl cílové tělesné teploty v obou skupinách, velmi krátký čas od kolapsu do zahájení kardiopulmonální resuscitace, pomalá indukční fáze TH apod.), jde o kvalitní a největší publikovanou studii na toto téma a její výsledky nelze opomíjet. Hlavním praktickým výsledkem je rozšíření spektra cílové tělesné teploty (a s tím související popularizace termínu cílená regulace tělesné teploty, TTM) na 32–36 °C [32]. Toto široké rozmezí nejde podle současného poznání nijak více upřesnit a ani nelze identifikovat, jestli je u některé subpopulace pacientů po náhlé zástavě oběhu výhodnější udržování normotermie nebo indukce TH. Situaci nevyjasnily ani výsledky klinické studie HYPERION s podobným designem jako Nielsenova studie. Ukázala zvýšení šance na příznivý neurologický výsledek u pacientů s nedefibrilovatelným rytmem léčených cílovou teplotou 33 °C ve srovnání s 37 °C [33]. Komunita intenzivistů je tak rozdělena na zastánce cílové tělesné teploty 33 °C a 36 °C. V každém případě je obojí lepší než přístup bez regulace tělesné teploty.
Osobní názor autorů je, že v případě pacientů se spatřenou OHCA kardiální etiologie a s prakticky ihned zahájenou kardiopulmonální resuscitací (základní nebo rozšířenou) lze použít protokol udržování normotermie 36 °C. U ostatních pacientů je třeba vždy primárně zvážit indukci TH s cílovou tělesnou teplotou 32–34 °C, a podle individuální rozvahy, která zahrnuje všechny relevantní dostupné klinické informace (trvání kolapsu, trvání kardiopulmonální resuscitace a její kvalita, riziko potenciálních komplikací TH apod.) případně indikovat udržování normotermie.
Odklon od zahájení TH v přednemocniční neodkladné péči
Přestože je teze o zahájení TTM co nejdříve po ROSC stále považována za racionální, klinické studie se zahájením TH téměř hned po ROSC, v přednemocniční neodkladné péči, nebo dokonce během kardiopulmonální resuscitace neprokázaly vyšší šanci na příznivý neurologický výsledek a přežívání a studie Kima et al dokonce referovala vyšší výskyt opakování srdeční zástavy během transportu a vyšší výskyt nálezu plicního edému na příjmovém rentgenovém snímku než v kontrolní skupině [23, 34–38]. Ve většině ze studií byla testována ochlazovací metoda nitrožilní aplikace 4°C chladného krystaloidního roztoku v dávce 25–30 ml/kg. Na základě těchto výsledků bylo doporučeno, že přednemocniční ochlazování pomocí rychlé nitrožilní infuze velkého objemu chladného roztoku ihned po ROSC není indikováno a obecně, vzhledem k absenci průkazu superiority použití přednemocniční terapeutické hypotermie ve srovnání s konvenčním postupem, není aktuálně u pacientů úspěšně resuscitovaných pro OHCA doporučeno ani přednemocniční ochlazování [32]. To vedlo k útlumu této metody v České republice i v zahraničí. Podle názoru týmu autorů však při kritické analýze vědeckých údajů situace není tak jednoznačná a nelze směšovat negativní vliv rychlého podání velkého objemu chladného roztoku a efekt ochlazení jako takového. Aby byla přednemocniční TH účinná, je nutné na ni navázat kvalitně prováděnou TTM v nemocnici a hodnocení pouze přednemocniční TH nedává velký smysl (jak bylo realizováno v publikovaných velkých studiích). V malé klinické studii PRE‑COOL (Pre‑Hospital Cooling in Cardiac Arrest Patients) Škulec et al. ukázali, že kombinace přednemocniční TH s následnou TH v nemocnici je spojená s vyšší šancí na příznivý neurologický výsledek ve srovnání s jakýmkoliv jiným postupem (OR 4,1; 95% CI 1,1–18,2; p = 0,046) [15]. Proto je postoj k přednemocniční terapeutické hypotermii v Konsenzuálním stanovisku pro cílenou regulaci tělesné teploty v přednemocniční neodkladné péči u nemocných po mimonemocniční náhlé zástavě oběhu české Společnosti urgentní medicíny a medicíny katastrof České lékařské společnosti J. E. Purkyně méně kategorický. Uvádí se v něm, že metoda cílené regulace tělesné teploty může být použita v přednemocniční neodkladné péči v individuálních případech, po pečlivé analýze poměru předpokládaného přínosu metody a jejích případných rizik s ohledem na okolnosti zástavy oběhu a ostatní individuální klinický kontext. K ochlazování není doporučena nitrožilní aplikace velkých dávek chladného krystaloidního roztoku [39].
Prognózování a paliativní rozhodování u pacientů léčených cílenou regulací tělesné teploty
Prognózování pacientů po kardiopulmonální resuscitaci pro náhlou zástavu oběhu se stalo standardní součástí intenzivní péče. Metoda TTM může potenciálně interferovat s prognózováním ovlivnění stavu vědomí přímo anebo prostřednictvím prodloužení odbourávání sedativ. Proto se doporučuje provádět prognózování s časovým odstupem ≥ 72 hodin od kardiopulmonální resuscitace [32].
Používání sofistikovaných ochlazovacích metod se zpětnou vazbou a autoregulací
Technické provedení, technická a klinická účinnost různých ochlazovacích metod byly primárním nebo sekundárním předmětem hodnocení řady studií. V současnosti máme k dispozici poměrně rozsáhlé armamentárium termoregulačních metod umožňujících regionální ochlazování nebo celotělovou regulaci tělesné teploty s různou mírou autoregulace [5]. K celotělovému ochlazování jsou používány externí termoregulační systémy se zpětnou vazbou na principu matrace nebo nalepovacích obkladů s cirkulací vody nebo vzduchu, intravaskulární termoregulace katétrem s cirkulací vody, jednoduché pasivní povrchové ochlazování pomocí ledových obkladů a chladících gelů bez možnosti autoregulace, s povrchovou regulací chladící matrací nebo gelovými obklady. Řada dalších metod, jako jsou rychlá intravenózní aplikace chladného krystaloidního roztoku, intrakavitální aplikace chladného roztoku, regulace pomocí mimotělního oběhu, selektivní ochlazování hlavy intranazální aplikací chladícího média, chladící čepicí, nebo lokální ochlazování krčních cév chladícím límcem jsou pravděpodobně používány velmi zřídka. V roce 2019 publikovali Calabro et al. metaanalýzu studií hodnotících použití různých ochlazovacích metod ve vztahu k pravděpodobnosti dosažení příznivého neurologického výsledku a nižší mortality. Přestože je výsledek založený zejména na nerandomizovaných klinických studiích, sofistikované TTM metody s autoregulační zpětnou vazbou byly spojeny s nižším rizikem nepříznivého neurologického výsledku než konvenční studie bez možnosti autoregulace [40]. Proto by tyto sofistikované metody měly být preferovány.
Přes všechny uvedené nové poznatky a pokrok v léčbě pacientů po srdeční zástavě je však z vědeckého hlediska nutné konstatovat, že v řadě aspektů TTM trvá značná nejistota, a stejně jako v roce 2010 spolehlivě nevíme, kteří pacienti z TH mohou mít prospěch a kteří nikoliv. Nejasnosti a nejednotný klinický názor trvají v otázkách: jaká je optimální cílová tělesná teplota, rychlost ochlazování, načasování zahájení ochlazování a jak dlouho by TH měla trvat. To by nám samozřejmě nemělo bránit ve správném využití toho, co víme a poskytovat co nejlepší poresuscitační péči včetně metody TTM podle aktuálních doporučení Evropské resuscitační rady a podle dokumentu „Cílená regulace tělesné teploty: konsenzuální stanovisko mezioborové pracovní skupiny k použití metody „targeted temperature management“ u dospělých pacientů v intenzivní péči [41]. Nejdůležitější informace z obou dokumentů shrnuje tabulka 2.
Tab. 2. Hlavní doporučení pro používání TTM Evropské resuscitační rady 2015 a mezioborové pracovní skupiny zástupců odborných společností oborů intenzivní péče, urgentní medicíny a kardiopulmonální resuscitace v České republice 2020 [32, 41] ![Hlavní doporučení pro používání TTM Evropské resuscitační rady 2015 a mezioborové pracovní skupiny zástupců odborných společností oborů
intenzivní péče, urgentní medicíny a kardiopulmonální resuscitace v České republice 2020 [32, 41]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/01fd06a75e30c0327080123a66db6bd9.png)
Současné hodnocení a co bychom udělali jinak
Dotazník a jeho struktura odrážely stav odborného poznání předmětné problematiky v době přípravy práce. Původní prací zjištěné výsledky poskytly originální data z ČR, umožnily porovnat naší praxi s praxí v jiných zemích a do určité míry definovaly rámec problematiky pro navazující projekty jiných výzkumných skupin.
Je zřejmé, že projekt podobných cílů a identického formátu bychom dnes mírně modifikovali směrem k získání odpovědí na otázky, které v kontextu desetileté diskuze k TTM získaly na naléhavosti a klinické relevanci – bezpečnost metody, metody prevence a léčbu třesu, v neposlední řadě, jak TTM modifikuje odhad individuálního klinického výsledku aj.
Je otázkou, zda po deseti letech je správný čas průzkum opakovat a ověřit, jaký je současný postoj české odborné komunity k metodě TTM u pacientů úspěšně resuscitovaných pro náhlou zástavu oběhu. Nárůst objemu informací za 10 let od vydání naší práce a zmapování posunu názorů v klinické praxi v ČR jsou podle našeho názoru dostatečným důvodem.
Závěr
Práci, kterou hodnotíme 10 let od její publikace, považujeme zpětně za významný zdroj informací o provádění TTM v kontextu klinické praxe KPR v ČR v tehdejší době. Nárůst poznatků za posledních 10 let v problematice TTM vedl ke změně praxe na řadě pracovišť ve světě a chceme‑li mít s nimi srovnání, šetření bude nutno zopakovat.
PROHLÁŠENÍ AUTORŮ: Prohlášení o původnosti: Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média. Doposud nebyla prezentovaná v žádné formě. Střet zájmů: Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce. Podíl autorů: Autoři rukopis napsali, četli a souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína. Všichni autoři se podíleli na sepsání finální podoby článku. Financování: Žádné. Poděkování: Děkujeme všem respondentům původní publikace za spolupráci.
KORESPONDENČNÍ ADRESA AUTORA:
Článek přijat redakcí: 8. 6. 2020; Článek přijat k tisku: 18. 8. 2020
doc. MUDr. Roman Škulec, Ph.D.
Cit. zkr: Anest intenziv Med. 2020; 31(4): 165–171
Zdroje
1. Skulec R, Truhlar A, Knor J, Seblova J, Cerny V. The practice of therapeutic mild hypothermia in cardiac arrest survivors in the Czech republic. Minerva Anestesiol. 2010; 76(8): 617–623.
2. Edgren E, Hedstrand U, Kelsey S, Sutton‑Tyrrell K, Safar P. Assessment of neurological prognosis in comatose survivors of cardiac arrest. BRCT I Study Group. Lancet. 1994; 343(8905): 1055–1059.
3. Škulec R, Truhlář A, Šeblová J, Knor J, Dostál P, Černý V. In‑hospital therapeutic hypothermia in cardiac arrest survivors: Growing implementation in the Czech Republic (PRE‑COOL 2: Hospital survey 2008). Anesteziol a Intenziv Med. 2010; 21(6): 317–323.
4. Nolan JP, Neumar RW, Adrie C, Aibiki M, Berg RA, Böttiger BW, et al. Post ‑ cardiac arrest syndrome: epidemiology, pathophysiology, treatment, and prognostication. A Scientific Statement from the International Liaison Committee on Resuscitation; the American Heart Association Emergency Cardiovascular Care Committee; the Coun. Resuscitation. 2008; 79(3): 350–379.
5. Skulec R, Truhlar A, Ostadal P, Telekes P, Knor J, Tichacek M, et al. Current cooling methods for induction of mild hypothermia in cardiac arrest survivors. Vnitřní lékařství. 2009; 55(11): 1060–1069.
6. Erecinska M, Thoresen M, Silver IA. Effects of hypothermia on energy metabolism in Mammalian central nervous system. J Cereb Blood Flow Metab. 2003; 23(5): 513–530.
7. Busto R, Globus MY, Dietrich WD, Martinez E, Valdes I, Ginsberg MD. Effect of mild hypothermia on ischemia ‑ induced release of neurotransmitters and free fatty acids in rat brain. Stroke. 1989; 20(7): 904–910.
8. Globus MY, Busto R, Lin B, Schnippering H, Ginsberg MD. Detection of free radical activity during transient global ischemia and recirculation: effects of intraischemic brain temperature modulation. J Neurochem. 1995; 65(3): 1250–1256.
9. Hypothermia after Cardiac Arrest Study Group. Mild therapeutic hypothermia to improve the neurologic outcome after cardiac arrest. N Engl J Med. 2002; 346(8): 549–556.
10. Bernard SA, Gray TW, Buist MD, Jones BM, Silvester W, Gutteridge G, et al. Treatment of comatose survivors of out ‑ of‑hospital cardiac arrest with induced hypothermia. N Engl J Med. 2002; 346(8): 557–563.
11. Testori C, Sterz F, Behringer W, Haugk M, Uray T, Zeiner A, et al. Mild therapeutic hypothermia is associated with favourable outcome in patients after cardiac arrest with non‑shockable rhythms. Resuscitation. 2011; 82(9): 1162–1167.
12. Behringer W, Arrich J, Holzer M, Sterz F. Out‑of‑hospital therapeutic hypothermia in cardiac arrest victims. Scand J Trauma Resusc Emerg Med. 2009; 17 : 52.
13. Arrich J; European Resuscitation Council Hypothermia After Cardiac Arrest Registry Study Group. Clinical application of mild therapeutic hypothermia after cardiac arrest. Crit Care Med. 2007; 35(4): 1041–1047.
14. Skulec R, Kovarnik T, Dostalova G, Kolar J, Linhart A. Induction of mild hypothermia in cardiac arrest survivors presenting with cardiogenic shock syndrome. Acta Anaesthesiol Scand. 2008; 52(2): 188–194.
15. Skulec R, Truhlar A, Seblova J, Dostal P, Cerny V. Pre‑hospital cooling of patients following cardiac arrest is effective using even low volumes of cold saline. Crit Care. 2010; 14(6): R231.
16. Skulec R, Kovarnik T, Belohlavek J, Dostalova G, Kolar J, Linhart A, et al. Overcooling during mild hypothermia in cardiac arrest survivors--phenomenon we should keep in mind. Vnitřní lékařství. 2008; 54(6): 609–614.
17. Nielsen N, Hovdenes F, Nilsson F, Rubertsson S, Stammet P, Sunde K, et al. Outcome, timing and adverse events in therapeutic hypothermia after out‑of‑hospital cardiac arrest. Acta Anaesthesiol Scand. 2009; 53(7): 926–934.
18. Hovdenes J, Laake JH, Aaberge L, Haugaa H, Bugge JF. Therapeutic hypothermia after out‑of‑hospital cardiac arrest: experiences with patients treated with percutaneous coronary intervention and cardiogenic shock. Acta Anaesthesiol Scand. 2007; 51(2): 137–142.
19. Sunde K, Pytte M, Jacobsen D, Mangschau A, Jensen LP, Smedsrud C, et al. Implementation of a standardised treatment protocol for post resuscitation care after out‑of‑hospital cardiac arrest. Resuscitation. 2007; 73(1): 29–39.
20. Tømte O, Andersen GØ, Jacobsen D, Drægni T, Auestad B, Sunde K. Strong and weak aspects of an established post‑resuscitation treatment protocol‑A five‑year observational study. Resuscitation. 2011; 82(9): 1186–1193.
21. Werling M, Thorén A‑B, Axelsson C, Herlitz J. Treatment and outcome in post‑resuscitation care after out‑of‑hospital cardiac arrest when a modern therapeutic approach was introduced. Resuscitation. 2007; 73(1): 40–45.
22. Kim F, Olsufka M, Longstreth WT Jr, Maynard C, Carlbom D, Deem S, et al. Pilot randomized clinical trial of prehospital induction of mild hypothermia in out‑of‑hospital cardiac arrest patients with a rapid infusion of 4 degrees C normal saline. Circulation. 2007; 115(24): 3064–3070.
23. Castrén M, Nordberg P, Svensson L, Taccone F, Vincent JL, Desruelles D, et al. Intra‑arrest transnasal evaporative cooling: a randomized, prehospital, multicenter study (PRINCE: Pre‑ROSC IntraNasal Cooling Effectiveness). Circulation. 2010; 122(7): 729–736.
24. Nolan JP, Deakin CD, Soar J, Böttiger BW, Smith G. European Resuscitation Council guidelines for resuscitation 2005. Section 4. Adult advanced life support. Resuscitation. 2005; 67 Suppl 1: S39–86.
25. Deakin CD, Nolan JP, Soar J, Sunde K, Koster RW, Smih GB, et al. European Resuscitation Council Guidelines for Resuscitation 2010 Section 4. Adult advanced life support. Resuscitation. 2010; 81(10): 1305–1352.
26. Hoedemaekers CW, Ezzahti M, Gerritsen A, van der Hoeven JG. Comparison of cooling methods to induce and maintain normo - and hypothermia in intensive care unit patients: a prospective intervention study. Crit Care. 2007; 11(4): R91.
27. Finley Caulfield A, Rachabattula S, Eyngorn I, Hamilton SA, Kalimuthu R, Hsia AW, et al. A comparison of cooling techniques to treat cardiac arrest patients with hypothermia. Stroke Res Treat. 2011; 2011 : 1–6.
28. Zhou J, Poloyac SM. The effect of therapeutic hypothermia on drug metabolism and response: cellular mechanisms to organ function. Expert Opin Drug Metab Toxicol. 2011; 7(7): 803–816.
29. Takino M, Okada Y. Hyperthermia following cardiopulmonary resuscitation. Intensive Care Med. 1991; 17(7): 419–420.
30. Takasu A, Saitoh D, Kaneko N, Sakamoto T, Okada Y. Hyperthermia: is it an ominous sign after cardiac arrest? Resuscitation. 2001; 49(3): 273–277.
31. Nielsen N, Wetterslev J, Cronberg T, Erlinge D, Gasche Y, Hassager C, et al. Targeted Temperature Management at 33 °C versus 36 °C after Cardiac Arrest. N Engl J Med. 2013; 369(23): 2197–2206.
32. Nolan JP, Soar J, Cariou A, Cronberg T, Moulaert VLM, Deakin CD, et al. European Resuscitation Council and European Society of Intensive Care Medicine Guidelines for Post‑resuscitation Care 2015: Section 5 of the European Resuscitation Council Guidelines for Resuscitation 2015. Resuscitation. 2015; 95 : 202–222.
33. Lascarrou JB, Merdji H, Le Gouge A, Colin G, Grillet G, Girardie P, et al. Targeted Temperature Management for Cardiac Arrest with Nonshockable Rhythm. N Engl J Med. 2019; 381(24): 2327–2337.
34. Kämäräinen A, Hoppu S, Silfvast T, Virkkunen I. Prehospital therapeutic hypothermia after cardiac arrest--from current concepts to a future standard. Scand J Trauma Resusc Emerg Med. 2009; 17(August): 53.
35. Kämäräinen A, Virkkunen I, Tenhunen J, Yli‑Hankala A, Silfvast T. Prehospital induction of therapeutic hypothermia during CPR: a pilot study. Resuscitation. 2008; 76(3): 360–363.
36. Bernard SA, Smith K, Cameron P, Masci K, Taylor DM, Cooper DJ, et al. Induction of therapeutic hypothermia by paramedics after resuscitation from out‑of‑hospital ventricular fibrillation cardiac arrest: a randomized controlled trial. Circulation. 2010; 122(7): 737–742.
37. Bernard SA, Smith K, Cameron P, Masci K, Taylor DM, Cooper DJ, et al. Induction of prehospital therapeutic hypothermia after resuscitation from nonventricular fibrillation cardiac arrest*. Crit Care Med. 2012; 40(3): 747–753.
38. Kim F, Nichol G, Maynard C, Hallstrom A, Kudenchuk PJ, Rea T, et al. Effect of prehospital induction of mild hypothermia on survival and neurological status among adults with cardiac arrest: a randomized clinical trial. JAMA. 2014; 311(1): 45–52.
39. Škulec R, Šeblová J, Truhlář A. Konsenzuální stanovisko pro cílenou regulaci tělesné teploty v přednemocniční neodkladné péči u nemocných po mimonemocniční náhlé zástavě oběhu. Urgentní medicína. 2017; 20(2): 28–29.
40. Calabró L, Bougouin W, Cariou A, De Fazio C, Skrifvars M, Soreide E, et al. Effect of different methods of cooling for targeted temperature management on outcome after cardiac arrest: a systematic review and meta‑analysis. Crit Care. 2019; 23(1): 285.
41. Balík M, Bělohlávek J, Beneš J, Černý V, Cvachovec K, Drábek T, et al. Cílená regulace tělesné teploty: konsenzuální stanovisko mezioborové pracovní skupiny. Anest intenziv Med. 2020; 31(1–2): 59–63.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2020 Číslo 4- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Metamizol a jeho pozice v léčbě bolesti
-
Všechny články tohoto čísla
- Doporučené postupy anestezie u pacientů trpících vzácným onemocněním v češtině – „OrphanAnesthesia.cz“
- Efekt midazolamu a dexmedetomidinu na funkci srdečních komor s využitím MRI – pilotní randomizovaná studie
- Perioperační péče o transgender pacienty/pacientky
- Audit antibiotické profylaxe v chirurgii
- Sto šedesát let od izolace kokainu a 115 let od syntézy prokainu – historie lokálních anestetik a jejich objevitelů
- Renesance ketaminu v léčbě dospělých pacientů v akutním a v kritickém stavu
- Náš článek po 10 letech: The practice of therapeutic mild hypothermia in cardiac arrest survivors in the Czech Republic
- Hemadsorpční metody u kriticky nemocných – dvojitá sázka naslepo?
- Inzulinová rezistence, hyperglykemie a proteinový katabolismus u kriticky nemocných: hledání klíčů k uzamčeným dveřím
- Suspektní imunitní trombocytopenie při Morbus Crohn
- Diagnostika COVID-19 pneumonie pomocí výpočetní tomografie, naše zkušenosti
- Perioperační použití gabapentinoidů v léčbě akutní pooperační bolesti – systematický přehled a metaanalýza
- Infekce krevního řečiště u kriticky nemocných: expertní stanovisko
- Tranexamová kyselina
- Hypoxie a hyperkapnie – jak fungují chemoreceptory?
- Disrupce rytmicity melatoninu v kritickém stavu
- Zajímavosti, tipy a triky, informace z jiných oborů
- CO2 oproti vzduchu významně sníží riziko vzduchové embolie při intervenčních ERCP a GIT endoskopiích
-
MEZIOBOROVÉ STANOVISKO
(evidenční číslo ČSARIM: 11/2020)
ZÁSADY ÚČELNÉ INDIKACE REMDESIVIRU U PACIENTŮ S COVID-19
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Tranexamová kyselina
- Hypoxie a hyperkapnie – jak fungují chemoreceptory?
- Audit antibiotické profylaxe v chirurgii
- Sto šedesát let od izolace kokainu a 115 let od syntézy prokainu – historie lokálních anestetik a jejich objevitelů
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



