-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Základní imunohistochemický panel pro diagnostiku nádorů měkkých tkání
A basic immunohistochemical panel for the diagnosis of soft tissue tumors
There is no universal immunohistochemical panel which would be useful for the diagnosis of soft tissue tumors in all circumstances. Nevertheless, especially when faced with an uncharacteristic spindle cell neoplasm, a basic immunohistochemical panel can be recommended consisting of CD34, desmin, epithelial membrane antigen, broad-spectrum cytokeratins, S100 protein and smooth muscle actin. This review will address the utility and pitfalls of this panel. The use of MDM2 immunohistochemistry and fluorescence in situ hybridization in the diagnosis of lipomatous tumors will be discussed as well.
Keywords:
soft tissue tumors – immunohistochemistry – MDM2
Autoři: Michael Michal 1,2
Působiště autorů: Bioptická laboratoř, s. r. o., Plzeň 1; Šiklův ústav patologie LF UK v Plzni a FN Plzeň 2
Vyšlo v časopise: Čes.-slov. Patol., 57, 2021, No. 1, p. 12-18
Kategorie: Přehledový článek
Souhrn
Neexistuje žádný univerzální imunohistochemický panel, který by byl v diagnostice nádorů měkkých tkání užitečný za každé situace. Přesto je možné doporučit základní sadu markerů, které jsou vhodné pro použití zejména u nepříliš charakteristických vřetenobuněčných lézí, kdy na základě morfologie nelze jednoznačně určit nejen konkrétní diagnózu, ale často ani směr diferenciace. V tomto přehledovém článku budou shrnuty poznatky o hlavních a letitou praxí osvědčených imunohistochemických markerech pro diagnostiku jednotlivých nádorových skupin v této části patologie se vyskytující: CD34, desmin, epiteliální membránový antigen, širokospektré cytokeratiny, S100 protein a hladkosvalový aktin. Dále bude diskutována problematika spojená jak s využitím imunohistochemického barvení s protilátkou MDM2, tak s metodou fluorescenční in situ hybridizace pro detekci amplifikace genu MDM2 v lipomatózních tumorech
Klíčová slova:
nádory měkkých tkání – imunohistochemie – MDM2
Imunohistochemie (IHC) je nedílnou součástí histopatologické praxe, v málokteré subspecializaci však hraje tak významnou roli jako v diagnostice mezenchymálních nádorů. Velké množství jednotek, jejich vzájemně se překrývající morfologický obraz spolu s relativní raritou těchto lézí představují důvody, proč se dnes již většina diagnóz v patologii měkkých tkání bez této pomocné metody neobejde. V tomto přehledovém článku budou představeny hlavní a letitou praxí osvědčené imunohistochemické markery pro diagnostiku jednotlivých nádorových skupin v této části patologie se vyskytující.
Žádný univerzální imunohistochemický panel, který by byl v diagnostice nádorů měkkých tkání užitečný za každé situace, samozřejmě neexistuje. Přesto je možné doporučit základní sadu markerů, které jsou vhodné pro použití zejména u nepříliš charakteristických vřetenobuněčných lézí, kdy na základě morfologie nelze jednoznačně určit nejen konkrétní diagnózu, ale často ani směr diferenciace. Miettinen, jeden z předních expertů v této oblasti, doporučuje těchto 6 protilátek: CD34, desmin, epiteliální membránový antigen (EMA), keratinový koktejl (např. AE1/AE3), S100 protein a hladkosvalový aktin (SMA)(1). Dobrým doplňkem tohoto panelu, zejména u vřetenobuněčných sarkomů retroperitonea či jiných hlubokých měkkých tkání, je rovněž protilátka MDM2 (viz dále). S jejím použitím úzce souvisí problematika analýzy pomocí fluorescenční in situ hybridizace (FISH) k detekci amplifikace genu MDM2, a proto zde též bude diskutována.
CD34
CD34 je obstojným vaskulárním markerem, ačkoliv jeho exprese v lymfatických cévách bývá slabší a rovněž maligní vaskulární tumory jako např. epiteloidní hemangioedoteliom či angiosarkom mohou být negativní až v polovině případů (1,2). Proto při podezření na vaskulární lézi je dobré přidat ještě některý z citlivějších endoteliálních markerů (např. ERG, CD31). Protilátka CD34 je také exprimována celou řadou fibroblastických tumorů jako např. dermatofibrosarcoma protuberans (DFSP) či solitárním fibrózním tumorem (SFT). Jeho senzitivita však výrazně klesá v případě přechodu těchto dvou lézí do fibrosarkomové (DFSP) respektive maligní/dediferencované (SFT) formy, kde exprese nezřídka zcela chybí (3). To platí především v případě DFSP, kde lze typicky pozorovat difúzní expresi CD34 v low-grade oblastech a její ztrátu ve fascikulárně rostoucích high-grade oblastech (obr. 1A). Ke ztrátě exprese v těchto partiích dochází ve zhruba polovině případů (4) a může být nápomocná k jejich identifikaci. Co se SFT týče, k potvrzení diagnózy lze dnes místo CD34 použít ve všech ohledech lepší protilátku STAT6. Protilátka CD34 je též užitečná k odlišení DFSP od benigního fibrózního histiocytomu. U fibrózních histiocytomů, zejména pak u jeho celulárních forem, je exprese CD34 někdy také přítomna, ale téměř vždy pouze na periferii tumoru, zatímco v jeho centru, na rozdíl od DFSP, chybí (obr. 1B). Výjimku tvoří vzácné atypické fibrózní histiocytomy (1,5), kde může být exprese difúznější. Protilátka se rovněž hodí k odlišení neurofibromu od schwannomu. Neurofibrom je téměř vždy difúzně pozitivní, zatímco ve schwannomu exprese obvykle chybí, případně je omezena pouze na periferii tumoru. Zde je nutné podotknout, že rovněž zhruba polovina perineuriomů může být difúzně CD34 pozitivní (6). CD34 pozitivní buňky v neurofibromech odpovídají fibroblastům a tvoří zde jakousi síťovitou strukturu, která je dobře patrná právě v tomto barvení (obr. 2A, B). Při nádorové progresi do atypického neurofibromu a low-grade maligního tumoru z pochev periferních nervů (MPNST) dochází ke změně architektoniky původního neurofibromu.To vede i ke ztrátě této CD34 pozitivní síťovité struktury, což je spolu s dalšími rysy považováno za jeden z diagnostických znaků této progrese (obr. 2C, D)(7).Dalším, v praxi často se vyskytujícím tumorem exprimujícím CD34, je vřetenobuněčný/pleomorfní lipom. Nejen zde je však nutné mít na paměti, že CD34 je značně nespecifická protilátka, jejíž pozitivita je přítomna např. i v dediferencovaném liposarkomu, myxoidním liposarkomu, gastrointestinálním stromálním tumoru či v myxofibrosarkomu (1). Již dle názvu nepřekvapí, že s touto protilátkou reaguje i nedávno popsaný superficiální CD34 pozitivní fibroblastický tumor, o němž je detailněji pojednáno v dalším přehledovém článku v tomto čísle.
Obr. 1. U dermatofibrosarcoma protuberans (DFSP) je možné pozorovat difúzní expresi CD34 v low-grade oblastech (A - vlevo) a její ztrátu v převážně fascikulárně rostoucích high-grade oblastech (A – vpravo). Ke ztrátě exprese v těchto partiích dochází ve zhruba polovině případů a může být nápomocná ke stanovení diagnózy fibrosarkomu ex DFSP. Protilátka CD34 je též užitečná k odlišení DFSP od benigního fibrózního histiocytomu. U fibrózních histiocytomů, zejména pak u jeho celulárních forem, je exprese CD34 někdy také přítomna, ale téměř vždy pouze na periferii tumoru, zatímco v jeho centru, na rozdíl od DFSP, chybí (B). 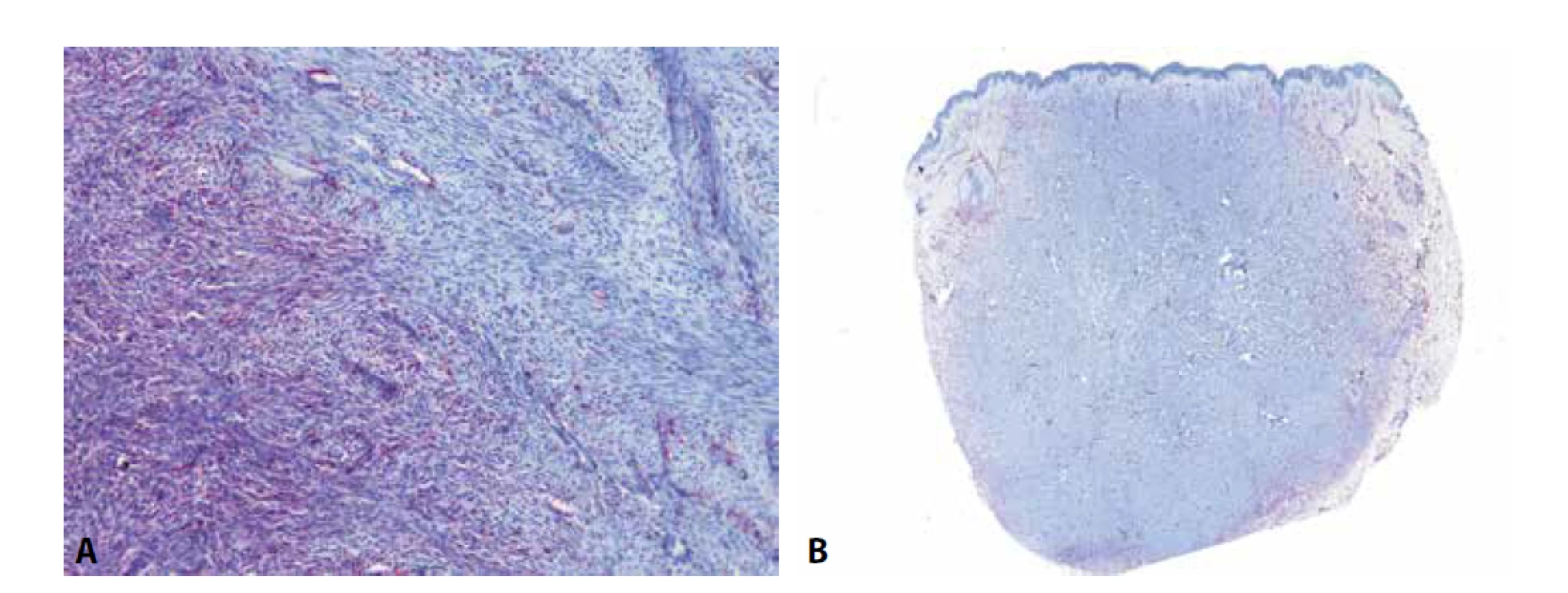
Obr. 2. CD34 pozitivní buňky v neurofibromech (A) odpovídají fibroblastům a tvoří zde jakousi síťovitou strukturu, která je dobře patrná právě v tomto barvení (B). Při nádorové progresi do atypického neurofibromu (C) a low-grade maligního tumoru z pochev periferních nervů dochází ke změně architektoniky původního neurofibromu. To vede i ke ztrátě této CD34 pozitivní síťovité struktury (D), což je spolu s dalšími rysy považováno za jeden z diagnostických znaků této progrese. 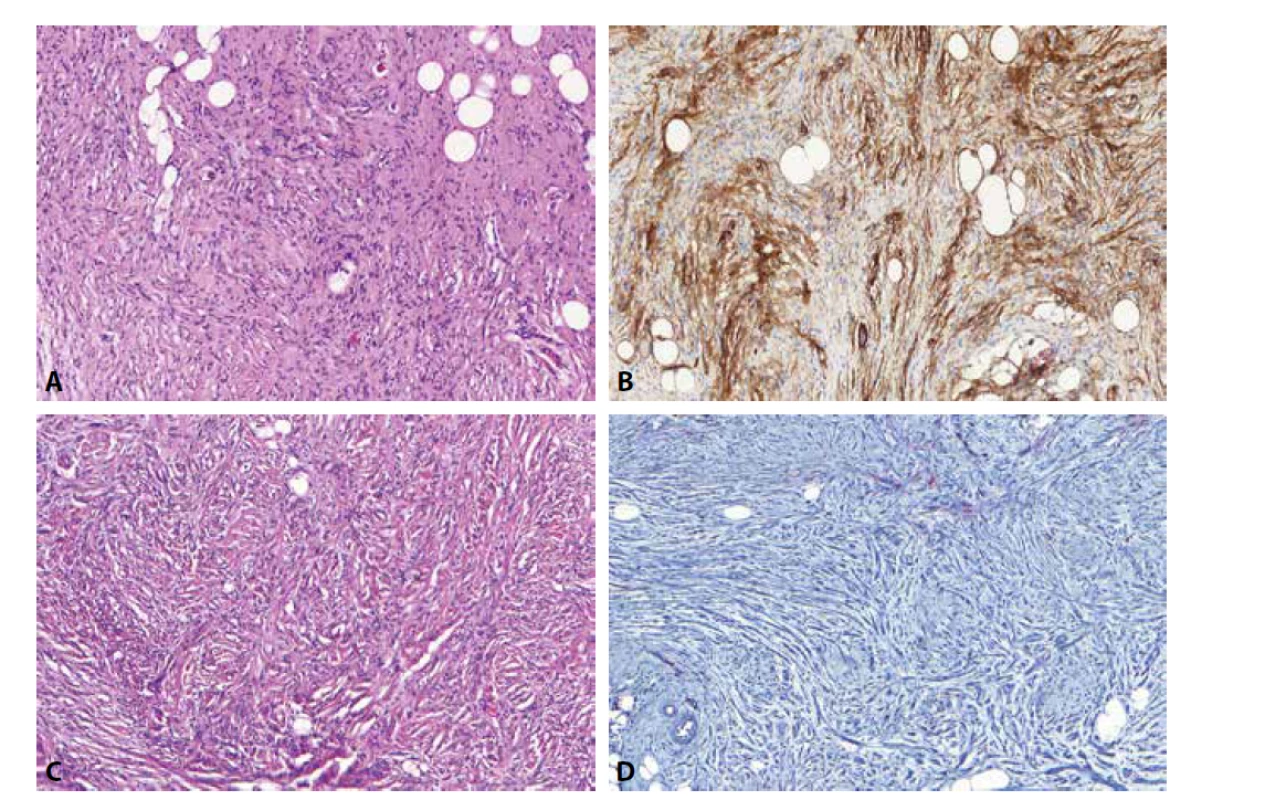
SMA
V rámci měkkotkáňové patologie je SMA využíván především jako marker hladké svaloviny, myofibroblastů, pericytů a z nich vznikajících tumorů. Prakticky všechny benigní i maligní hladkosvalové tumory by měly být pozitivní. Myofibroblastické léze jako nodulární fasciitida, myofibrom, fibromatóza či inflammatorní myofibroblastický tumor (IMT) jsou obvykle SMA pozitivní, ačkoliv někdy pouze místy a v některých případech může exprese i zcela chybět. Především v diferenciální diagnostice fibromatózy či IMT je třeba pamatovat, že i zhruba třetina gastrointestinálních stromálních tumorů (GISTů) je SMA pozitivní, někdy i difúzně. Protože proliferace myofibroblastů je spolu s neoangiogenezí hlavní reakcí měkkých tkání na poranění, často se lze setkat s expresí SMA i v okolí infiltrativně rostoucích tumorů, což může vést k nesprávné diagnóze desmoidní fibromatózy či low-grade myofibroblastického sarkomu. Pericytární tumory jako myopericytom či glomus tumor exprimují SMA a nejinak je tomu u pericytů v okolí vaskulárních neoplazií. Zde může pravidelná, neporušená, SMA pozitivní pericytární vrstva napomoci odlišit benigní vaskulární tumory od maligních, neboť ty většinou tuto vrstvu postrádají či ji mají výrazně narušenou (8,9).
Desmin
Desmin je užitečný především v diagnostice tumorů s diferenciací do kosterní či hladké svaloviny. Je velmi senzitivním markerem pro diagnózu rhabdomyosarkomů (10), které často mohou být morfologicky obtížně rozpoznatelné. Chytákem je exprese desminu v zanikajících rhabdomyocytech v místech, kde infiltrativně rostoucí tumor prorůstá do příčně pruhované svaloviny. Vzhledem k degenerativním změnám tyto rhabdomyocyty navíc budí dojem malignity a mohou vést až k mylné diagnóze rhabdomyosarkomu. Dále může být desmin převážně fokálně pozitivní v celulárním fibrózním histiocytomu (5) či v myofibroblastických tumorech jako např. v desmoidní fibromatóze, low-grade myofibroblastickém sarkomu či inflamatorním myofibroblastickém tumoru (11). Výjimku představuje epiteloidní varianta inflamatorního myofibroblastického tumoru/sarkomu, která s desminem reaguje silně a difúzně. Tento tumor se nejčastěji vyskytuje v zažívacím traktu a je vždy současně ALK-1 pozitivní (12). Exprese desminu v leiomyosarkomech může být nevýrazná a téměř ve čtvrtině případů dokonce zcela chybí, zpravidla pak v těch nejhůře diferencovaných případech (13). Další skupinou nádorů, které jsou desmin imunoreaktivní jsou benigní stromální tumory gynekologického traktu jako např. agresivní angiomyxom či celulární angiofibrom (14). Užitečným vodítkem může být fokální exprese desminu ve zhruba v polovině angiomatoidních fibrózních histiocytomů(15), osifikujících fibromyxoidních tumorů (16) a obrovskobuněčných tumorů šlachové pochvy, kde se nachází pouze v ojedinělých objemných buňkách s dendritickými výběžky (obr. 3A)(17). Známá je charakteristická tečkovitá pozitivita desminu v desmoplastickém malobuněčném tumoru, někdy spojená i pozitivitou cytoplazmatickou (18).
Obr. 3. Zhruba polovina obrovskobuněčných tumorů šlachové pochvy exprimuje desmin v ojedinělých objemných buňkách s dendritickými výběžky (A). Při hodnocení barvení EMA v perineurálních lézích je důležité pamatovat na často velmi slabou expresi této protilátky. Její reaktivitu je proto nutné hodnotit obzvlášť důkladně při větším zvětšení (B). Maligní tumor z pochev periferních nervů (MPNST) bývá S100 pozitivní spíše místy (C) a zhruba polovina případů je dokonce zcela negativní, zatímco difúzní exprese je přítomna spíše zřídka. U Rosai-Dorfmanovi choroby je užitečná nejen samotná S100 pozitivita nádorových buněk, ale i negativita lymfoidních buněk, které byly nádorovými buňkami pozřeny a nacházejí se v jejich cytoplazmě; dochází zde k tzv. emperipoléze (D). 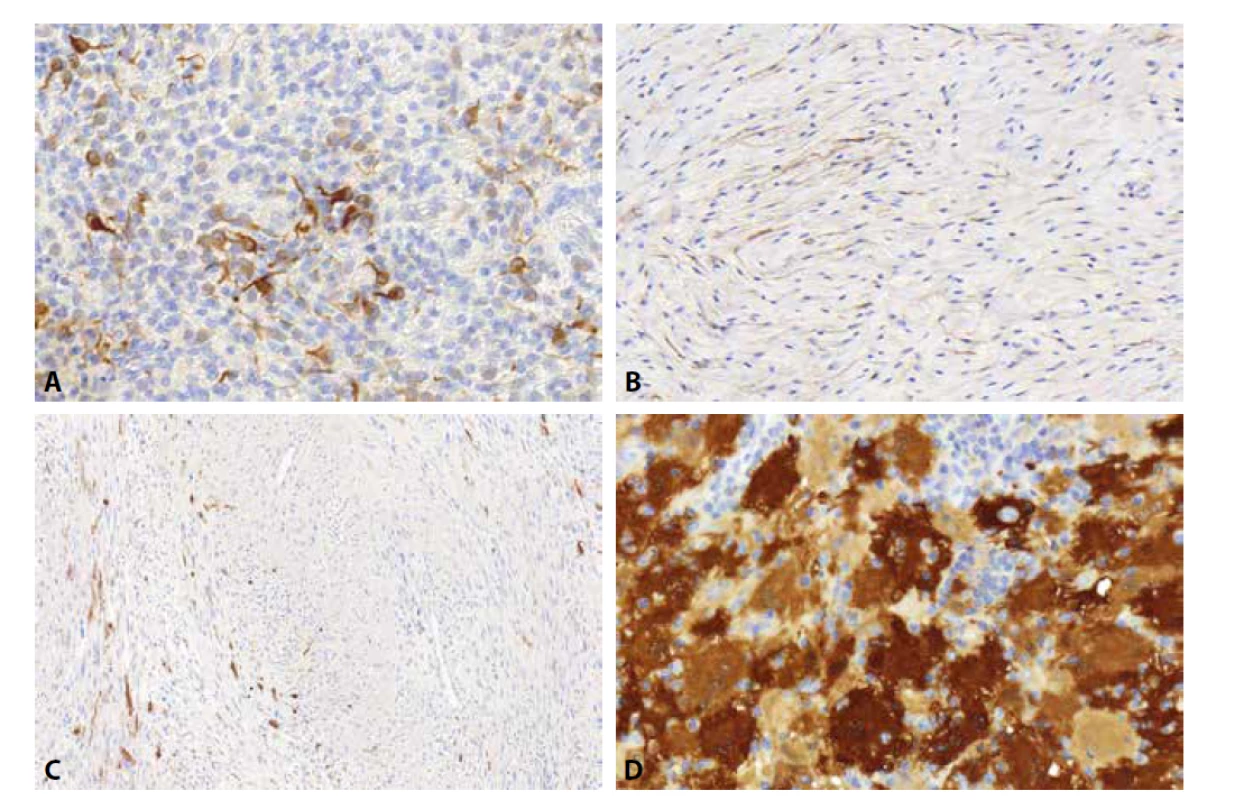
EMA
Tato protilátka v panelu slouží především jako marker epiteliální a perineurální diferenciace. Reaguje pozitivně v nemalé části karcinomů, a především pak v synoviálním a epiteloidním sarkomu či v myoepiteliomu. Podobně jako cytokeratiny však může někdy reagovat i v některých leiomyosarkomech či angiosarkomech (1). Protože perineurální buňky jsou periferní obdobou arachnoideálních buněk CNS, EMA je rovněž pozitivní ve většině meningiomů, včetně těch extrakraniálních (19).Také zhruba dvě třetiny angiomatoidních fibrózních histiocytomů exprimují EMA (20). Vzhledem k morfologické podobnosti a současné expresi EMA až v 90% low-grade fibromyxoidních sarkomů(21), bývala v době před objevením protilátky MUC4 (viz dále) záměna tohoto tumoru za perineuriom častou a závažnou diagnostickou chybou. Při hodnocení barvení EMA v perineurálních lézích je důležité pamatovat na často velmi slabou expresi této protilátky. Její reaktivitu je proto nutné hodnotit obzvlášť důkladně při větším zvětšení (obr. 3B). V případě vyššího podezření na perineurální lézi je vhodné doplnit další perineurální markery jako claudin-1 a Glut1 (22).
S100
S100 protein nemůže v základním panelu chybět především z důvodu jeho vysoké senzitivity pro neoplazie vznikající ze Schwannových buněk a melanocytů. Metastatický melanom je obvykle silně S100 pozitivní a představuje možná vůbec nejčastější S100 pozitivní maligní tumor měkkých tkání. Je to i proto, že MPNST bývá S100 pozitivní spíše místy (obr. 3C) a zhruba polovina případů je dokonce zcela negativní, zatímco difúzní exprese je přítomna spíše zřídka (23). Ke zvýšení pravděpodobnosti záchytu S100 pozitivních oblastí je, při vysokém podezření na MPNST, vhodné nabarvit více bloků najednou. Výjimkou je vzácnější epiteloidní MPNST, který vždy reaguje s touto protilátkou velmi silně (24). V diferenciální diagnostice metastatického melanomu a MPNST je třeba pamatovat i na S100 pozitivní světlobuněčný sarkom šlach a aponeuróz, dodnes někdy nesprávně nazývaný jako melanom měkkých tkání. Zde lze v morfologicky nejasných případech využít molekulárně-genetické analýzy EWSR1 genu, který je u světlobuněčného sarkomu rearanžovaný. Důležité je pamatovat na možnost převážně slabé exprese S100 proteinu ve zhruba třetině synoviálních sarkomů (25), což by při nevyšetření širšího panelu protilátek zahrnujícího např. cytokeratiny mohlo vést k záměně za MPNST. S100 protein je dále velmi užitečný v diagnostice tumorů odvozených od Langerhansových buněk, jako např. histiocytóza z Langerhansových buněk (26) či Rosai-Dorfmanova choroba (27) a je pochopitelně pozitivní i v nenádorových Langerhansových buňkách běžně přítomných v dermis. U Rosai-Dorfmanovy choroby je užitečná nejen samotná S100 pozitivita nádorových buněk, ale i negativita lymfoidních buněk, které byly nádorovými buňkami pozřeny a nacházejí se v jejich cytoplazmě; dochází zde k tzv. emperipoléze (obr. 3D). Diagnosticky významná je také exprese S100 proteinu ve zhruba 50-70 % osifikujících fibromyxoidních tumorů. Jde o nádor s velmi širokým morfologickým spektrem a mimo obvykle silné peritumorální fibrózní kapsuly a přítomnosti osifikovaných oblastí (obojí však může chybět) je exprese S100 proteinu jedním z mála znaků, který může na tuto diagnózu navést. Exprese S100 je méně častá u atypických a zejména maligních forem (28). V některých tumorech může být tato protilátka užitečná také k potvrzení přítomnosti chondrogenní či adipocytární komponenty.
Cytokeratiny
V problematice patologie měkkých tkání jsou z obou skupin cytokeratinů (bazických a acidických) významné především ty s nízkou molekulární hmotností, tedy 7, 8 a 18, 19. Z praktického hlediska je nejvhodnější použití širokospektrých keratinových koktejlů, jako např. AE1/AE3. Synoviální a epiteloidní sarkom představují dva hlavní měkkotkáňové tumory s epiteliální diferenciací. Oba exprimují keratiny 8, 18 a 19, synoviální sarkom navíc ještě keratin 7 (1). Další zpravidla keratin pozitivní tumory běžně se vyskytující v měkkých tkáních jsou myoepiteliom, chordom a desmoplastický malobuněčný tumor. Kromě významu pro diagnostiku výše zmíněných jednotek pak cytokeratiny v základním panelu slouží také pro vyloučení alternativních diagnóz jako např. mezoteliomu, sarkomatoidního karcinomu či karcinomu z Merkelových buněk.
Situaci poněkud komplikuje fakt, že i některé fyziologické mezenchymální struktury jako např. hladká svalovina myometria, cév a některých parenchymatózních orgánů exprimuje cytokeratiny 7, 8 a 18. Některé endotelie mohou reagovat s cytokeratiny 7 a 18. To má význam zejména proto, že až třetina nádorů s touto diferenciací jako jsou hemangiomy, hemangioendoteliomy, angiosarkomy či leiomyosarkomy mohou být cytokeratiny pozitivních (29). Dále je třeba počítat s relativně častou, ale většinou pouze fokální cytokeratinovou pozitivitou v mnoha sarkomech, mj. v Ewingově sarkomu, rhabdomyosarkomech (zejména alveolárních, ale i vřetenobuněčných)(30,31), inflamatorním myofibroblastickém tumoru, myxoinflammatorním fibroblastickém sarkomu (32), superficiálním CD34-pozitivním fibroblastickém tumoru (33), myxofibrosarkomu a v nediferencovaném pleomorfním sarkomu (1). Difúzní pozitivita u dvou posledně jmenovaných výrazně zpochybňuje tuto diagnózu a spíše svědčí pro diagnózu špatně diferencovaného epitelového tumoru.
MDM2
Většina atypických lipomatózních tumorů/dobře diferencovaných liposarkomů (ALT/WDL) i dediferencovaných liposarkomů obsahuje nadpočetný kruhový a/nebo giant marker chromozom sestávající z amplifikovaných sekvencí q13-q15 pocházejících z 12. chromozomu. Tento region obsahuje řadu různých genů, mj. i gen MDM2. Protože jsou v nádorových buňkách přítomny mnohočetné kopie tohoto genu, je i stejnojmenný protein tímto genem kódovaný ve zvýšené míře exprimován a lze ho imunohistochemicky detekovat. Relativně vysoká incidence těchto lipomatózních tumorů spolu s častými obtížemi v jejich diagnostice vedla k velikému rozšíření této protilátky. Ačkoliv v určitých situacích je utilita MDM2 nesporná, existují i indikace, kde se od jejího použití spíše ustupuje. Ukazuje se, že výtěžnost tohoto barvení je problematická zejména v diferenciální diagnostice mezi různými variantami lipomu a ALT/WDL. Protein MDM2 je totiž v nejvyšší míře exprimován v nejatypičtějších lipocytárních jádrech, jejichž velmi nízký počet v některých případech ALT/WDL však právě bývá hlavní příčinou diagnostických rozpaků, které následně vedou k indikaci MDM2 IHC. U těchto hraničních lézí proto klesá senzitivita MDM2 IHC až pod 50 % (34). V diagnostice výrazně atypických lipomatózních lézí sice protilátka funguje velmi dobře, zde však IHC nebývá potřeba, nález lze uzavřít na základě znalosti klinických údajů a morfologie. Vzhledem k běžné expresi MDM2 proteinu v nenádorových endoteliích a makrofázích (obr. 4) je navíc u lézí s malým množstvím velkých atypických jader obtížnější interpretace barvení. Z tohoto důvodu někteří autoři doporučují v takovýchto situacích nepoužívat metod IHC a spoléhat se pouze na důkladné histologické vyšetření a klinické údaje (anatomická lokalizace včetně hloubky postižení, recidivy atd.). V přesně definovaných situacích pak doporučují raději rovnou použít metodu FISH (34,35). Protože se jedná o metodu ne všude dostupnou, která je navíc dražší než IHC, byly navrženy indikace, kdy je v rámci diagnostiky dobře diferencovaných lipomatózních neoplazií použití FISH nejvíce žádoucí (tab. 1)(35). Na tomto místě stojí za připomínku dvě již letité poučky, které se promítají i do těchto kritérií: dobře diferencované lipomatózní tumory uložené v povrchových měkkých tkáních (tzn. neprorůstající do příčně pruhované svaloviny) jsou ve velké většině lipomy či jejich varianty, ALT se takto povrchově vyskytuje zřídka. To platí i v případě výskytu atypií, kdy se spíše bude jednat o vřetenobuněčný/pleomorfní lipom či o nově charakterizovaný dysplastický lipom. Druhý jmenovaný je navíc ve 40 % případů imunohistochemicky MDM2 pozitivní, většinou však jen zcela fokálně (36). Naopak, ačkoliv lipomy retroperitonea bezpochyby existují, jsou vzácné, a i blandně vyhlížející lipomatózní tumory v této lokalizaci většinou představují liposarkomy.
Obr. 4. Traumatizovaná tuková tkáň (A) je jednou z lézí, která poměrně věrně napodobuje atypický lipomatózní tumor/dobře diferencovaný liposarkom. Situaci dále komplikuje exprese MDM2 proteinu v nenádorových endoteliích a obzvláště v makrofázích, kterých je zde značné množství (B). 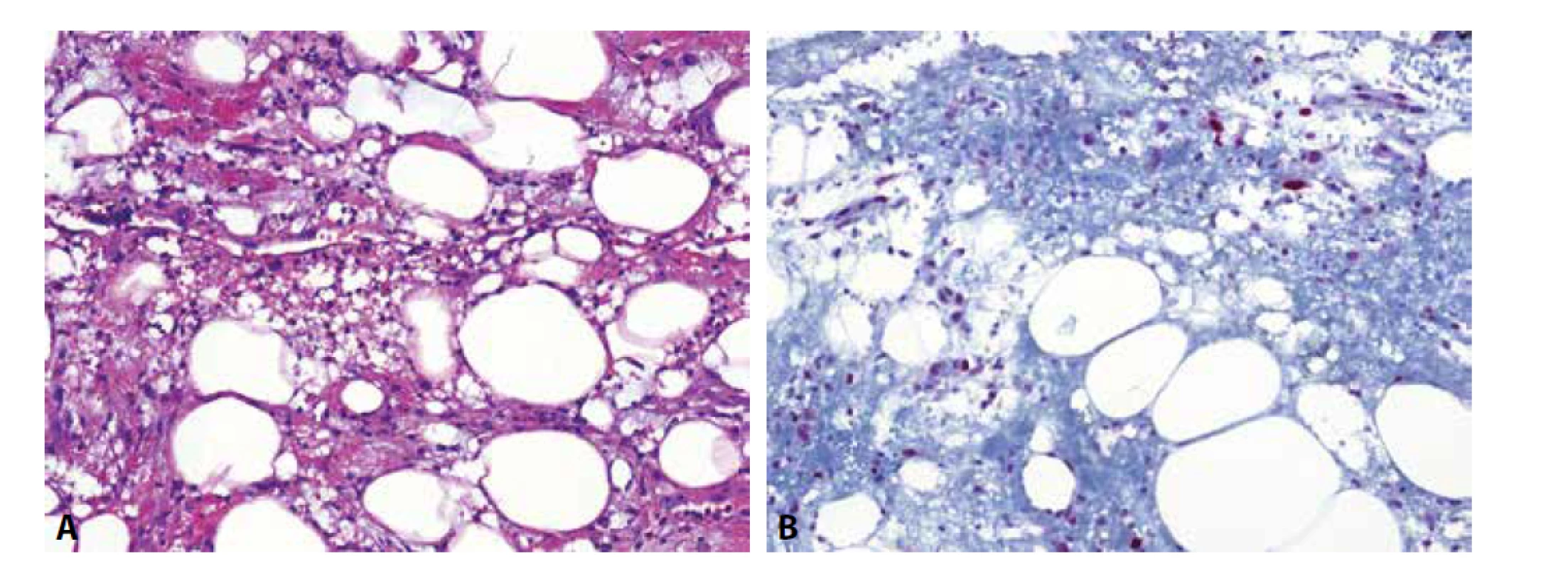
Tab. 1. Indikace k použití FISH analýzy pro detekci amplifikace MDM2 genu v rámci diagnostiky dobře diferencovaných lipomatózních neoplazií*. 
*Adaptováno z publikace Clay et at. (35) Imunohistochemická detekce MDM2 proteinu je naopak velmi užitečná v diagnostice dediferencovaného liposarkomu, pro který má pozitivita ve více než 10 % nádorových jader senzitivitu vysoko přes 90 % (37). Vzhledem k relativně nízké specificitě v kontextu vřetenobuněčných sarkomů je ovšem užitečná spíše jako screeningový marker tohoto tumoru, protože spolehnout se lze jen na zcela negativní výsledek barvení. V případě pozitivity IHC je proto optimální nález ještě potvrdit vyšetřením FISH. Bohužel ani přítomnost MDM2 amplifikace není 100% specifická a senzitivní pro dediferencovaný liposarkom. Morfologicky podobné tumory jako leiomyosarkom, MPNST či intimální sarkom jsou jen některé z neoplazií, které mohou rovněž vykazovat MDM2 amplifikaci (37,38). K rozlišení je vždy opět nutná korelace s dalšími klinickopatologickými vlastnostmi tumoru. Okolo 1 % dediferenovaných liposarkomů pak nevzniká na podkladě MDM2 amplifikace, ale je způsobeno jinými genetickými abnormalitami, např. mutacemi v genu TP53 (39).
Často používané protilátky bez diagnostické hodnoty
Mezi jednu z vůbec nejčastěji používaných protilátek v diagnostice nádorů měkkých tkání bohužel stále patří vimentin a to i přesto, že jeho diagnostická hodnota v této oblasti je prakticky nulová (40). Je zcela nespecifický nejen ve vztahu k jakémukoliv nádoru měkkých tkání, ale je exprimován i většinou melanomů, mnoha karcinomy i lymfomy (41,42). Rovněž je exprimován téměř všemi vřetenobuněčnými tumory, ať už jde ve skutečnosti o sarkomy či sarkomatoidní karcinomy (42). Podobně nespecifické a často používané jsou i protilátky Bcl-2 či neuron specifická enoláza. Myoglobin, jeden z prvních používaných markerů pro diagnózu rhabdomyosarkomů, byl dnes nahrazen senzitivnějšími i specifičtějšími protilátkami. Kromě nízké sensitivity pro rhabdomyosarkomy je problematické zejména silné přibarvování non-neoplastického pozadí, které často činí interpretaci barvení velmi obtížnou až nemožnou (40).
ZÁVĚR
Pro přesnou interpretaci jakéhokoliv imunohistochemického barvení je samozřejmě vždy nutné dodržovat všeobecně platné zásady správného používání imunohistochemie: protilátky správně kalibrovat, aplikovat a sledovat vnější a ideálně i vnitřní kontroly, imunohistochemické výsledky vždy korelovat s morfologií, vyloučit např. expresi ve fyziologických strukturách apod.
Je zřejmé, že prezentované protilátky jsou převážně multispecifickými markery pokrývajícími velkou část diagnostického spektra. Tento panel často sám o sobě nevede k definitivní diagnóze, avšak napomáhá navést lékaře správným směrem. K definitivní diagnóze bývá potřeba doplnit další, již více specifická imunohistochemická barvení, případně metody molekulární genetiky. Některé z těchto pomocných metod budou představeny v následujícím textu.
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Tato studie byla podpořena Národním programem udržitelnosti I (NPU I) č. LO1503 a grantem SVV–2020 No. 260 391 poskytnutého Ministerstvem sportu, mládeže a tělovýchovy České republiky.
∗ Adresa pro korespondenci:
MUDr. Michael Michal, Ph.D.
Šiklův ústav patologie LF UK v Plzni a FN Plzeň,
Alej Svobody 80, 304 60 Plzeň,
tel.: +420 603 792 671
e-mail: michael.michal@medima.cz
Zdroje
1. Miettinen M. Immunohistochemistry of soft tissue tumours - review with emphasis on 10 markers. Histopathology 2014; 64(1): 101-118.
2. Ordonez NG. Immunohistochemical endothelial markers: a review. Adv Anat Pathol 2012; 19(5): 281-295.
3. Dagrada GP, Spagnuolo RD, Mauro V, et al. Solitary fibrous tumors: loss of chimeric protein expression and genomic instability mark dedifferentiation. Mod Pathol 2015; 28(8): 1074-1083.
4. Mentzel T, Beham A, Katenkamp D, Dei Tos AP, Fletcher CD. Fibrosarcomatous (“high-grade”) dermatofibrosarcoma protuberans: clinicopathologic and immunohistochemical study of a series of 41 cases with emphasis on prognostic significance. Am J Surg Pathol 1998; 22(5): 576-587.
5. Volpicelli ER, Fletcher CD. Desmin and CD34 positivity in cellular fibrous histiocytoma: an immunohistochemical analysis of 100 cases. J Cutan Pathol 2012; 39(8): 747-752.
6. Hornick JL, Fletcher CD. Soft tissue perineurioma: clinicopathologic analysis of 81 cases including those with atypical histologic features. Am J Surg Pathol 2005; 29(7): 845-858.
7. Miettinen MM, Antonescu CR, Fletcher CDM, et al. Histopathologic evaluation of atypical neurofibromatous tumors and their transformation into malignant peripheral nerve sheath tumor in patients with neurofibromatosis 1-a consensus overview. Hum Pathol 2017; 67 : 1-10.
8. Fletcher CDM. Diagnostic Histopathology of Tumors (5th ed). Philadelphia: Elsevier; 2021 : 47.
9. Svajdler M, Bohus P, Baumohlova H, Sokol L, Bielek J. Epiteloidný hemangióm nohy.Cesk Patol 2006; 42(2): 86-90.
10. Parham DM, Webber B, Holt H, Williams WK, Maurer H. Immunohistochemical study of childhood rhabdomyosarcomas and related neoplasms. Results of an Intergroup Rhabdomyosarcoma study project. Cancer 1991; 67(12): 3072-3080.
11. Qiu X, Montgomery E, Sun B. Inflammatory myofibroblastic tumor and low-grade myofibroblastic sarcoma: a comparative study of clinicopathologic features and further observations on the immunohistochemical profile of myofibroblasts. Hum Pathol 2008; 39(6): 846-856.
12. Marino-Enriquez A, Wang WL, Roy A, et al. Epithelioid inflammatory myofibroblastic sarcoma: An aggressive intra-abdominal variant of inflammatory myofibroblastic tumor with nuclear membrane or perinuclear ALK. Am J Surg Pathol 2011; 35(1): 135-144.
13. Hisaoka M, Wei-Qi S, Jian W, Morio T, Hashimoto H. Specific but variable expression of h-caldesmon in leiomyosarcomas: an immunohistochemical reassessment of a novel myogenic marker. Appl Immunohistochem Mol Morphol 2001; 9(4): 302-308.
14. Schoolmeester JK, Fritchie KJ. Genital soft tissue tumors. J Cutan Pathol 2015; 42(7): 441-451.
15. Fanburg-Smith JC, Miettinen M. Angiomatoid “malignant” fibrous histiocytoma: a clinicopathologic study of 158 cases and further exploration of the myoid phenotype. Hum Pathol 1999; 30(11): 1336-1343.
16. Schneider N, Fisher C, Thway K. Ossifying fibromyxoid tumor: morphology, genetics, and differential diagnosis. Ann Diagn Pathol 2016; 20 : 52-58.
17. Folpe AL, Weiss SW, Fletcher CD, Gown AM. Tenosynovial giant cell tumors: evidence for a desmin-positive dendritic cell subpopulation. Mod Pathol 1998; 11(10): 939-944.
18. Thway K, Noujaim J, Zaidi S, et al. Desmoplastic small round cell tumor: pathology, genetics, and potential therapeutic strategies. Int J Surg Pathol 2016; 24(8): 672-684.
19. Agaimy A, Buslei R, Coras R, Rubin BP, Mentzel T. Comparative study of soft tissue perineurioma and meningioma using a five-marker immunohistochemical panel. Histopathology 2014; 65(1): 60-70.
20. Bohman SL, Goldblum JR, Rubin BP, Tanas MR, Billings SD. Angiomatoid fibrous histiocytoma: an expansion of the clinical and histological spectrum. Pathology 2014; 46(3): 199-204.
21. Guillou L, Benhattar J, Gengler C, et al. Translocation-positive low-grade fibromyxoid sarcoma: clinicopathologic and molecular analysis of a series expanding the morphologic spectrum and suggesting potential relationship to sclerosing epithelioid fibrosarcoma: a study from the French Sarcoma Group. Am J Surg Pathol 2007; 31(9): 1387-1402.
22. Folpe AL, Billings SD, McKenney JK, Walsh SV, Nusrat A, Weiss SW. Expression of claudin-1, a recently described tight junction-associated protein, distinguishes soft tissue perineurioma from potential mimics. Am J Surg Pathol 2002; 26(12): 1620-1626.
23. Pekmezci M, Reuss DE, Hirbe AC, et al. Morphologic and immunohistochemical features of malignant peripheral nerve sheath tumors and cellular schwannomas. Mod Pathol 2015; 28(2): 187-200.
24. Jo VY, Fletcher CD. Epithelioid malignant peripheral nerve sheath tumor: clinicopathologic analysis of 63 cases. Am J Surg Pathol 2015; 39(5): 673-682.
25. Pelmus M, Guillou L, Hostein I, Sierankowski G, Lussan C, Coindre JM. Monophasic fibrous and poorly differentiated synovial sarcoma: immunohistochemical reassessment of 60 t(X;18)(SYT-SSX)-positive cases. Am J Surg Pathol 2002; 26(11): 1434-1440.
26. Nakajima T, Watanabe S, Sato Y, Kameya T, Hirota T, Shimosato Y. An immunoperoxidase study of S-100 protein distribution in normal and neoplastic tissues. Am J Surg Pathol 1982; 6(8): 715-727.
27. Eisen RN, Buckley PJ, Rosai J. Immunophenotypic characterization of sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease). Semin Diagn Pathol 1990; 7(1): 74-82.
28. Graham RP, Dry S, Li X, et al. Ossifying fibromyxoid tumor of soft parts: a clinicopathologic, proteomic, and genomic study. Am J Surg Pathol 2011; 35(11): 1615-1625.
29. Miettinen M, Fetsch JF. Distribution of keratins in normal endothelial cells and a spectrum of vascular tumors: implications in tumor diagnosis. Hum Pathol 2000; 31(9): 1062-1067.
30. Bahrami A, Gown AM, Baird GS, Hicks MJ, Folpe AL. Aberrant expression of epithelial and neuroendocrine markers in alveolar rhabdomyosarcoma: a potentially serious diagnostic pitfall. Mod Pathol 2008; 21(7): 795-806.
31. Švajdler M ŠP, Michal M. Jaká je Vaše diagnóza? Vretenobunkový rabdomyosarkóm. Cesk Patol 2017; 53(2): 100;102-103.
32. Laskin WB, Fetsch JF, Miettinen M. Myxoinflammatory fibroblastic sarcoma: a clinicopathologic analysis of 104 cases, with emphasis on predictors of outcome. Am J Surg Pathol 2014; 38(1): 1-12.
33. Carter JM, Weiss SW, Linos K, DiCaudo DJ, Folpe AL. Superficial CD34-positive fibroblastic tumor: report of 18 cases of a distinctive low-grade mesenchymal neoplasm of intermediate (borderline) malignancy. Mod Pathol 2014; 27(2): 294-302.
34. Clay MR, Martinez AP, Weiss SW, Edgar MA. MDM2 and CDK4 immunohistochemistry: should it be used in problematic differentiated lipomatous tumors?: A new perspective. Am J Surg Pathol 2016; 40(12): 1647-1652.
35. Clay MR, Martinez AP, Weiss SW, Edgar MA. MDM2 amplification in problematic lipomatous tumors: analysis of FISH testing criteria. Am J Surg Pathol 2015; 39(10): 1433-1439.
36. Michal M, Agaimy A, Contreras AL, et al. Dysplastic lipoma: adistinctive atypical lipomatous neoplasm with anisocytosis, focal nuclear atypia, p53 overexpression, and a lack of MDM2 gene amplification by FISH; A report of 66 cases demonstrating occasional multifocality and a rare association with retinoblastoma. Am J Surg Pathol 2018; 42(11): 1530-1540.
37. Binh MB, Sastre-Garau X, Guillou L, et al. MDM2 and CDK4 immunostainings are useful adjuncts in diagnosing well-differentiated and dedifferentiated liposarcoma subtypes: a comparative analysis of 559 soft tissue neoplasms with genetic data. Am J Surg Pathol 2005; 29(10): 1340-1347.
38. Neuville A, Collin F, Bruneval P, et al. Intimal sarcoma is the most frequent primary cardiac sarcoma: clinicopathologic and molecular retrospective analysis of 100 primary cardiac sarcomas. Am J Surg Pathol 2014; 38(4): 461-469.
39. Demicco EG. Molecular updates in adipocytic neoplasms. Semin Diagn Pathol 2019; 36(2): 85-94.
40. Goldblum JR, Folpe AL, Weiss SW. Enzinger & Weiss’s Soft Tissue Tumors (7th ed). Philadelphia: Elsevier; 2020 : 129, 143.
41. Azumi N, Battifora H. The distribution of vimentin and keratin in epithelial and nonepithelial neoplasms. A comprehensive immunohistochemical study on formalin - and alcohol-fixed tumors. Am J Clin Pathol 1987; 88(3): 286-296.
42. Dabbs DJ. Diagnostic Immunohistochemistry: Theranostic and Genomic Applications (4th ed). Philadelphia: Elsevier; 2014 : 202, 219.
Štítky
Patologie Soudní lékařství Toxikologie
Článek ′ CYTODIAGNOSTIKAČlánek ′ UROPATOLOGIEČlánek ′ KARDIOPATOLOGIEČlánek ′ PULMOPATOLOGIEČlánek ′ PATOLOGICKÁ DIAGNOSTIKAČlánek ′ PATOLOGIE MAMMYČlánek ′ PATOLOGIE GITČlánek ′ ORTOPEDICKÁ PATOLOGIEČlánek ′ HEPATOPATOLOGIEČlánek ′ GYNEKOPATOLOGIEČlánek ′ NEFROPATOLOGIEČlánek ′ PATOLOGIE ORL OBLASTIČlánek ′ HEMATOPATOLOGIEČlánek Iatrogenní embolizace hydrofilních polymerů jako komplikace endovaskulárních výkonů – nová jednotkaČlánek ′ NEUROPATOLOGIEČlánek ′ GYNEKOPATOLOGIEČlánek ′ PATOLOGIE MĚKKÝCH TKÁNÍ
Článek vyšel v časopiseČesko-slovenská patologie

2021 Číslo 1-
Všechny články tohoto čísla
- ′ CYTODIAGNOSTIKA
- ′ UROPATOLOGIE
- ′ KARDIOPATOLOGIE
- Doc. MUDr. Jaroslav Horáček, CSc.
- Základní imunohistochemický panel pro diagnostiku nádorů měkkých tkání
- Vybrané novinky v imunohistochemii a molekulární genetice nádorů měkkých tkání
- Novinky v patologii měkkých tkání a kostí
- Ložiskové léze kostí – diagnostické využití imunohistochemie a molekulární patologie
- Význam časopisu vidím hlavně v jeho doškolovací části
- Iatrogenní embolizace hydrofilních polymerů jako komplikace endovaskulárních výkonů – nová jednotka
- ′ NEUROPATOLOGIE
- Sekundárna hypoplázia pľúc asociovaná s kalcifikovaným Meckelovým divertikulom s oseálnou metapláziou
- ′ GYNEKOPATOLOGIE
- Fabryho choroba s kardiovaskulární manifestací u pacienta s terminálním selháním ledvin
- ′ PULMOPATOLOGIE
- ′ PATOLOGICKÁ DIAGNOSTIKA
-
Konsensuální doporučení České kooperativní skupiny pro nádory hlavy a krku (2019):
definice resekčních okrajů, reportování krčních disekcí a vyšetřování HPV/p16 - Spomienka na prof. MUDr. Ivana Slugeňa, DrSc.
- ′ PATOLOGIE MĚKKÝCH TKÁNÍ
- ′ PATOLOGIE MAMMY
- ′ PATOLOGIE GIT
- ′ ORTOPEDICKÁ PATOLOGIE
- ′ HEPATOPATOLOGIE
- ′ GYNEKOPATOLOGIE
- ′ NEFROPATOLOGIE
- ′ PATOLOGIE ORL OBLASTI
- ′ HEMATOPATOLOGIE
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Základní imunohistochemický panel pro diagnostiku nádorů měkkých tkání
- Ložiskové léze kostí – diagnostické využití imunohistochemie a molekulární patologie
- Sekundárna hypoplázia pľúc asociovaná s kalcifikovaným Meckelovým divertikulom s oseálnou metapláziou
-
Konsensuální doporučení České kooperativní skupiny pro nádory hlavy a krku (2019):
definice resekčních okrajů, reportování krčních disekcí a vyšetřování HPV/p16
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



