-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaDoporučený postup pro diagnostiku a léčbu anémie u IBD
Standard diagnostic and therapeutic process of IBD-associated anaemia
The below-mentioned guidelines for the diagnosis and therapy of anaemia in IBD patients were generated by the Czech IBD Working Group (Czech Society for Gastroenterology of the Czech Medical Association of Jan Evangelista Purkyně) during a consensus meeting at Šiškův Mlýn near Telč in June 7–8, 2012. The guidelines are based on data coming from recent publications presented in the US and EU, which were broadly discussed in view of the local availability of the mentioned diagnostic and therapeutic recommendations. The final recommended procedure follows the consensus of all members of the IBD Working Group. It presents the current preferred approach to resolving anaemia in IBD patients as well as a recommendation for following up these patients. We hope that this document is a basic platform for the current diagnostic and therapeutic regimen for anaemia in IBD patients.
Key words:
ulcerative colitis – Crohn’s disease – anaemia – iron therapy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
24. 6. 2012Accepted:
26. 7. 2012
Autoři: Luděk Hrdlička 1; P. Kohout 2; M. Liberda 3; M. Konečný 4; M. Lukáš 1
; Pracovní Skupina Pro Idiopatické Střevní Záněty Čgs Čls Jep
Působiště autorů: Klinické a výzkumné centrum pro střevní záněty, ISCARE, Praha 1; II. interní klinika, Thomayerova nemocnice, Praha 2; Gastroenterologické oddělení, Nemocnice Valašské Meziříčí 3; II. interní klinika gastroenterologická a hepatologická, FN Olomouc 4
Vyšlo v časopise: Gastroent Hepatol 2012; 66(4): 280-285
Kategorie: IBD: doporučené postupy
Souhrn
Uvedená doporučení pro diagnostiku a léčbu anémie u IBD pacientů byla vytvořena Pracovní skupinou pro idiopatické střevní záněty ČGS ČLS JEP na výjezdním zasedání v Šiškově mlýně u Telče ve dnech 7.–8. 6. 2012. Jsou založena zejména na recentních publikacích evropských i amerických autorů, které byly široce diskutovány s ohledem na lokální dostupnost citovaných diagnostických a terapeutických doporučení. Definitivní doporučený postup je pak konsenzem celé pracovní skupiny. Představuje preferovaný přístup k řešení níže probíraných klinických situací u anemických pacientů s IBD, jehož nedílnou součástí je i doporučení, jak tyto pacienty sledovat. Předkládaný materiál je základem pro efektivní péči o anemické nemocné s IBD.
Klíčová slova:
ulcerózní kolitida – Crohnova nemoc – anemie – terapie železemPokroky v diagnostice a terapii anémií, kterých bylo dosaženo v posledních deseti letech, se odrazily také v léčbě pacientů s idiopatickými střevními záněty, Crohnovou nemocí a ulcerózní kolitidou. Ukázalo se, že sideropenie a sideropenní anemie je velmi častou příčinou vleklých symptomů a horší kvality života u těchto pacientů. Dlouhodobá terapie perorálními preparáty železa je relativně málo účinná a navíc u některých pacientů je špatně tolerovaná a/nebo spojená s indukcí relapsu střevního zánětu, především ulcerózní kolitidy. Nové možnosti parenterální substituce železa skýtající podstatně vyšší efektivitu a bezpečnost, nesrovnatelnou s dříve užívanými preparáty železa, zásadně změnily pohled na intravenózní aplikaci železa u těchto pacientů. Disproporce mezi současnými možnostmi a zažitou klinickou praxí byla hlavním stimulem, který vedl k potřebě vytvoření nového přístupu k terapii anémie u nemocných se střevními záněty. Na základě studia literatury a klinických zkušeností vypracovali členové Pracovní skupiny pro IBD doporučení pro diagnostiku a léčbu anémií u nemocných se střevními záněty v průběhu dvoudenního zasedání v červnu letošního roku.
Klinické projevy a prevalence anémie u IBD
Anémie je nejčastější extraintestinální manifestací idiopatických střevních zánětů a má závažné důsledky na kvalitu života pacientů [1–3]. Nejběžnějšími klinickými projevy jsou únava, slabost, spavost, závratě, dušnost, palpitace, stenokardie, omezená svalová síla nebo porucha kognitivních funkcí. Tíže symptomů je závislá zejména na pokročilosti anémie a rychlosti jejího nástupu. U naprosté většiny pacientů s IBD dochází k postupné a pozvolné anemizaci, a proto jsou na chudokrevnost poměrně dobře adaptováni a tolerují i velmi nízké hladiny hemoglobinu. Jiná situace nastává při rychlém poklesu hladiny hemoglobinu nebo hemodynamicky významné krevní ztrátě, zejména u starších pacientů s vaskulárními komorbiditami. Zde může být rozvoj symptomů velmi rychlý a anémie může pro tyto pacienty znamenat i život ohrožující komplikaci.
Literární data týkající se prevalence anémie jsou velmi různorodá, pohybují se mezi 6 a 74 %, u sideropenie pak mezi 36 a 90 % [1–4], nejzávažnější faktory ovlivňující hodnocení prevalence jsou samotná choroba (Crohnova nemoc/ulcerózní kolitida), aktivita onemocnění, ambulantní/hospitalizovaný pacient a věk studované populace. Recentní metaanalýza publikovaných prací [4] prokazuje prevalenci anémie 16 % u ambulantních a 68 % u hospitalizovaných pacientů.
Klasifikace a patofyziologie anémií u IBD
Hlavní typy anémie u IBD jsou anémie hypochromní a anémie chronických chorob (anémie chronického zánětu) a jejich kombinace [5–7]. Ostatní typy chudokrevnosti jsou podstatně vzácnější, zahrnují zejména makrocytární a polékovou anémii. Příčinou makrocytární anémie je deficit vitaminu B12 (stavy po resekcích ilea, extenzivní postižení ilea, syndrom bakteriálního přerůstání) nebo kyseliny listové (medikace sulfasalazinem nebo metotrexátem, extenzivní postižení orálního tenkého střeva, stav po resekci jejuna). U polékových anémií je nejčastější příčinou medikace thiopuriny (azathioprin, merkaptopurin), méně často sulfasalazinem nebo metotrexátem [6,7]. Jiné příčiny anémie jsou velmi vzácné a jejich prevalence se neliší od běžné populace.
Základními patofyziologickými rysy hypochromní anémie jsou porucha resorpce železa (restrikce resorpční plochy zánětem nebo postresekčně, blokáda transmembránového přenašeče ferroportinu vysokou hladinou prozánětlivého cytokinu hepcidinu), porucha uvolňování železa retinovaného v makrofázích a chronické krevní ztráty zapříčiněné rekurentním makroskopickým nebo mikroskopickým krvácením ze zánětlivě změněné sliznice [5]. U anémie chronického zánětu hrají hlavní patofyziologickou roli prozánětlivé mediátory, které spoluindukují poruchy metabolizmu železa (zadržování Fe v retikuloendotelové soustavě), indukují poruchy erytropoézy včetně snížení hladiny erytropoetinu a způsobují zkrácené přežívání erytrocytů [6,7]. Zjednodušené schéma patofyziologických mechanizmů vedoucích k anémii u IBD pacientů je zobrazeno na obr. 1.
Obr. 1. Zjednodušené schéma patofyziologických mechanizmů vedoucích k anémii u IBD pacientů (Weiss a Gasche, 2010). Fig. 1. Simplified chart of pathophysiological mechanisms leading to anaemia in IBD patients (Weiss and Gasche, 2010). 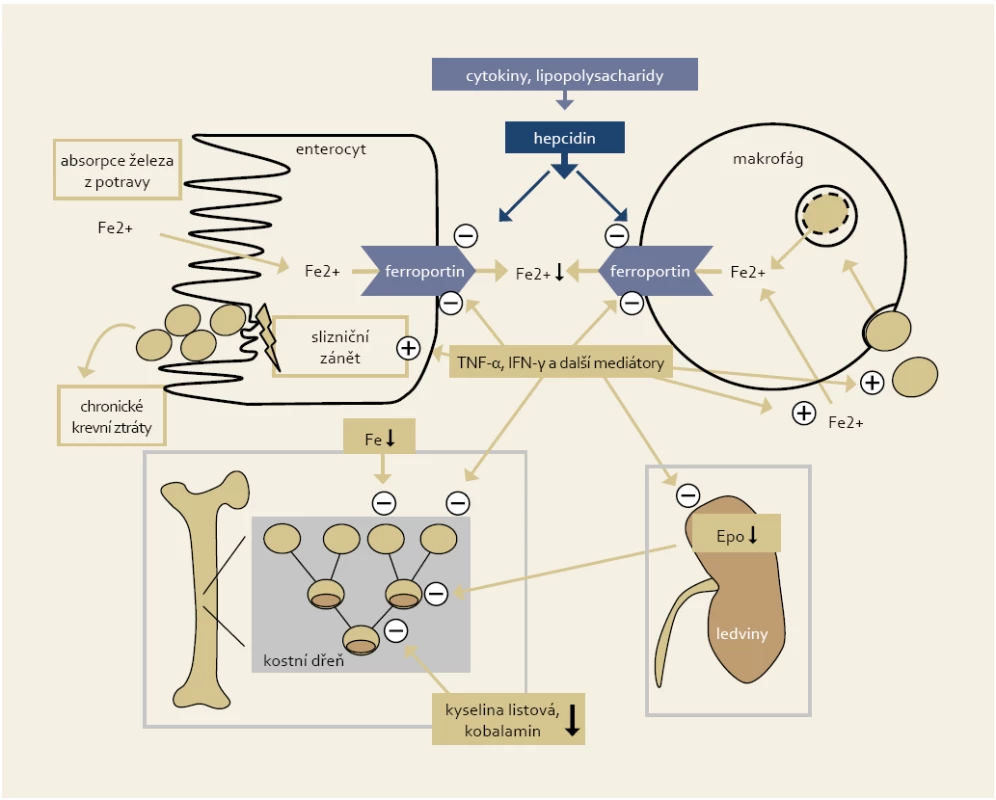
Diagnostika anémie u IBD pacientů
Za kritéria pro diagnostiku anémie stále ještě užíváme klasifikaci WHO platnou od roku 1998 [4]. Za anemického se považuje pacient s hladinou hemoglobinu (Hgb) nižší než 130 g/l (muž), resp. 120 g/l (žena, při těhotenství se tato hranice snižuje na 110 g/l). Za těžký stupeň anémie je třeba považovat již všechny hodnoty Hgb pod 100 g/l. Z parametrů metabolizmu železa je značně nespolehlivá, nicméně stále paušálně používaná hladina sérového železa (norma 8–28 µmol/l). Její hodnota kolísá v závislosti na příjmu v potravě, cirkadiálním rytmu, přítomnosti jakéhokoli horečnatého onemocnění a je zatížena poměrně velkou laboratorní chybou [8,9]. Naopak spolehlivým markerem zásob železa v organizmu je hladina feritinu (norma 30–100 µg/l) [9–13]. Ten je nejen zásobním proteinem železa v organizmu, ale i proteinem akutní fáze, jeho hladina se tak zvyšuje u anémie chronického zánětu. Dalším cenným pomocníkem v diagnostice sideropenie a typu anémie u IBD je saturace transferinu (norma 25–50 %) [11–14]. Samozřejmé je současné stanovení aktivity střevní choroby za použití laboratorních (CRP) a fekálních (kalprotektin) markerů a endoskopických a zobrazovacích metod [9,10,12–14].
Pro diagnostiku sideropenie svědčí snížení hladiny sérového feritinu (< 30 µg/l) a saturace transferinu (< 16 %), pro anémii při chronickém zánětu pak zvýšená hladina sérového feritinu (> 100 µg/l) a snížená saturace transferinu (< 16 %) [9,11,13]. Pro objasnění jednotlivých klinických situací s ohledem na stav zásob železa a pro snazší diferenciální diagnostiku jednotlivých typů anémií u IBD pacientů připojujeme tab. 1 a 2.
Tab. 1. Diferenciální diagnostika hlavních typů anémií u IBD. Tab. 1. Differential diagnosis of major types of anaemia associated with IBD. 
Tab. 2. Stav zásob železa a aktivita IBD. Tab. 2. Iron stores and IBD activity. 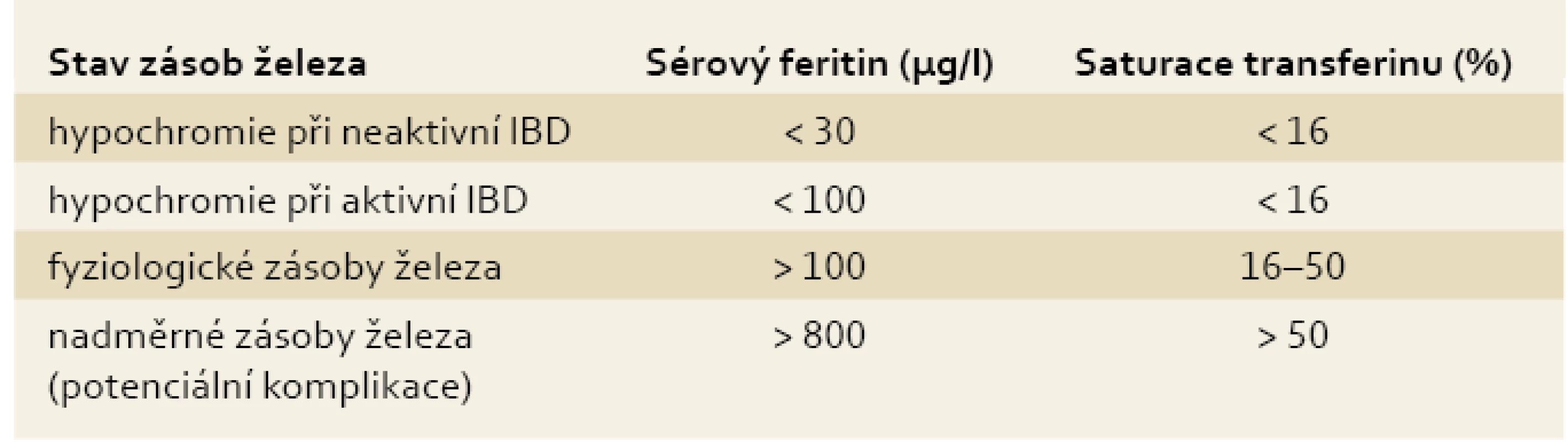
Z ostatních diagnostických laboratorních parametrů užíváme hladinu vitaminu B12 (norma 223–1 132 pg/ml) a kyseliny listové (norma 4,5–15 ng/ml) při podezření na možnost jejich deficitu (makrocytóza, postižení tenkého střeva, stavy po resekci tenkého střeva, event. žaludku), v diagnostice sideropenie je velmi přínosné stanovení hladiny solubilních transferinových receptorů (5 ± 1 mg/l). Perspektivní a velmi přínosné jsou i další markery anémie, jako je hladina hepcidinu, stanovení hemoglobinu v retikulocytech nebo percentuální kvantifikace hypochromních erytrocytů [15–17].
Zahájení léčby a cíle léčby anémie u pacientů s IBD
Léčbu zahajujeme již při průkazu anémie – Hgb < 120 (ženy) / 130 g/l (muži), nečekáme na další pokles hladiny hemoglobinu. Cílem léčby je úplná normalizace hladiny Hgb (> 130 (muži) / 120 g/l (ženy)) a normalizace zásob železa (feritin > 100 µg/l, saturace transferinu > 30 %), takový postup vede k úpravě kvality života a prevenci rekurence anémie [8,18–20]. Je prokázané, že největší akcelerace ve zlepšení kvality života je při vzestupu ze 110 na 130 g Hgb/l [4].
Terapie sideropenie bez anémie
Ve shodě s většinou citovaných prací [1,4,5,8] doporučujeme zahájit substituci hypochromie již u pacientů, kteří doposud mají normální hladinu hemoglobinu. Již tito mohou být symptomatičtí, nejčastějšími klinickými projevy jsou plíživá progredující porucha kognitivních funkcí, únava a poruchy spánku a nálady. Vhodná je perorální substituce, při nesnášenlivosti nebo neefektivitě je vhodné zahájit intravenózní podávání. Indikací k primární intravenózní léčbě sideropenie bez anémie u IBD je Crohnova choroba s proximálním postižením, stavy po resekci žaludku nebo orálního tenkého střeva a aktivní ulcerózní kolitida s hrozícím zhoršením po perorálním železe.
Způsob léčby, deficit železa
Způsob léčby volíme s ohledem na intenzitu anémie, anemické symptomy, dynamiku poklesu, aktivitu choroby, komorbidity, toleranci léčby, nežádoucí účinky a efektivitu předcházející terapie. Pro výpočet deficitu železa, a tedy substituční dávky, postupujeme empiricky, dříve používaná Ganzoniho formule výpočtu deficitu železa se ukázala být nepraktickou a v klinickém životě nepoužitelnou, významným způsobem navíc podhodnocovala skutečný nedostatek železa [1,4,8,9]. Deficit železa u IBD pacientů je minimálně 0,5–1 g, většinou je však vyšší a u nemocných s aktivní chorobou a hlubší anémií dosahuje až 2 g [13,19]. Tab. 2 ukazuje empirické stanovení deficitu železa s ohledem na intenzitu anémie a tělesnou hmotnost pacienta.
Intravenózní aplikace železa
Intravenózní aplikace železa je základem substituční léčby, příznivě na ni reaguje 70–80 % anemických IBD pacientů do čtyř týdnů [21]. Indikacemi k jejímu podání jsou: závažnější anémie (< 100 (žena) < 110 (muž) g Hgb/l), potřeba urychlené korekce lehké anémie, aktivní střevní choroba a intolerance nebo nedostatečná odpověď (do 2–4 týdnů) na p.o. železo. Další indikací je sideropenie bez anémie nereagující na p.o. terapii a stavy po resekci tenkého střeva a žaludku. Podle recentní metaanalýzy [22] byla na souboru 333 pacientů (203 intravenozní / 130 perorální substituce) prokázána vyšší efektivita a tolerance intravenózní léčby oproti perorální substituci železa. V intravenózní větvi byl zaznamenán signifikantně větší vzestup hladiny hemoglobinu o 6,8 g/l (p = 0,02) a feritinu o 110 µg/l (p = 0,04) po třech měsících léčby, více N.Ú. bylo zaznamenáno v p.o. větvi (OR 6,2). Diagram shrnující doporučení pro terapii sideropenní anémie je uveden na obr. 2.
Obr. 2. Doporučení pro substituční léčbu sideropenní anémie u IBD pacentů. Fig. 2. Recommendation for iron supplementation in IBD patients with iron deficiency anaemia. 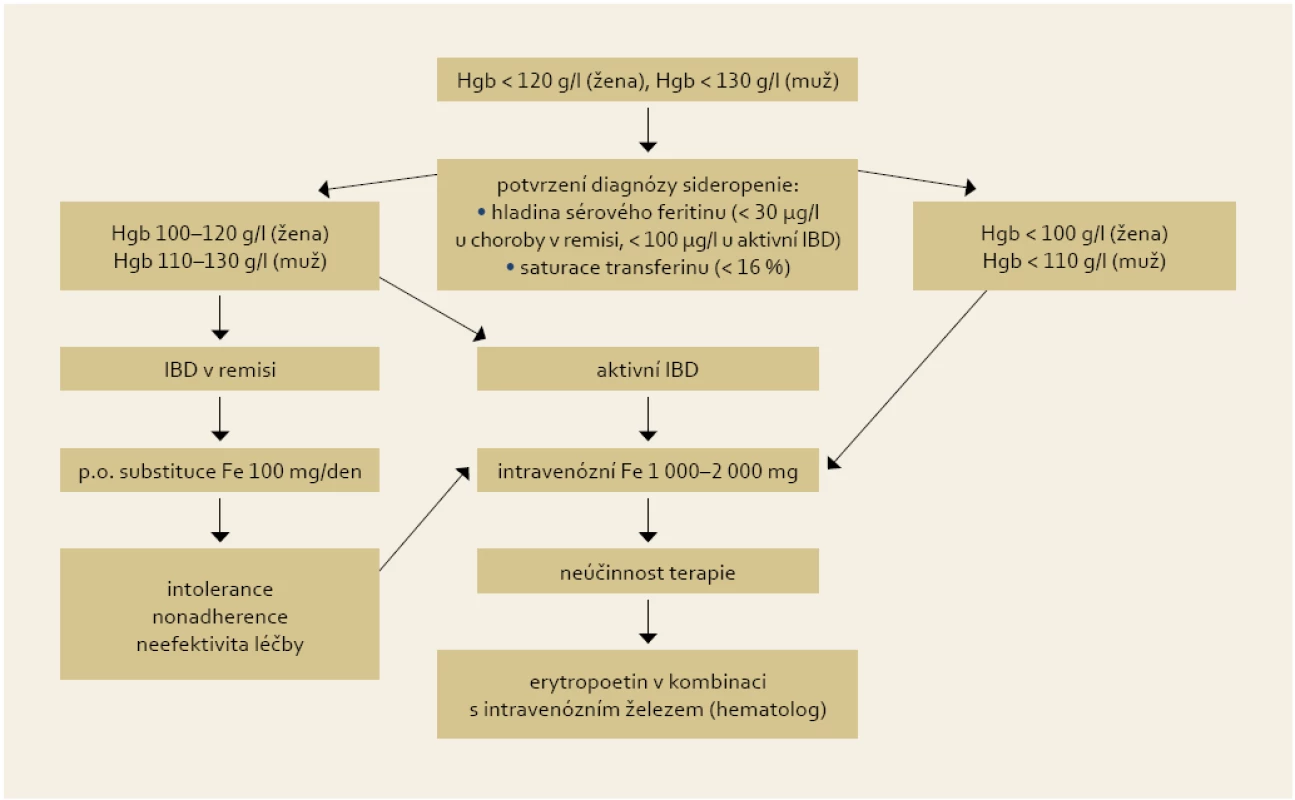
Vzhledem k lepší efektivitě, zásadnímu snížení počtu aplikací a dobré bezpečnosti a toleranci léčby by měly být upřednostněny nové makromolekulární preparáty – např. carboxymaltosum ferricum. Tato skutečnost je dostatečně dokumentována studií FERGIcor [23], v níž bylo randomizováno 485 pacientů s hypochromní anémií při IBD do dvou větví léčených stejnou substituční dávkou železa – s carboxymaltosum ferricum a s oxidem železitým se sacharózou. Pacienti dostávající karboxymaltózu železa (1–3 infuze) zaznamenali signifikantně častější normalizaci hladiny hemoglobinu (72,8 vs 61,8 %; p = 0,015) oproti pacientům léčeným oxidem železitým se sacharózou (až 11 infuzí), signifikantní byl i rozdíl v nárůstu hladiny feritinu a saturace transferinu. Oba léčebné režimy byly dobře tolerovány, výskyt N.Ú. byl řídký (13,9 vs 11,3 %; p = 0,413). Minimální výskyt komplikací léčby karboxymaltózou železa vyplývá z vysoké molekulové hmotnosti látky (akutní toxicita stoupá se snižující se molekulovou hmotností), absenci vazby na deriváty dextranu (není riziko anafylaxe) a ze selektivního ukládání železa do kostní dřeně (nehrozí toxické poškození jater). Dávku karboxymaltózy železa určujeme empiricky (tab. 3), maximální jednorázová dávka je 1 000 mg v minimálně 15minutové infuzi. Dávka 500 mg i.v. může být podána bolusově. Aplikace může být opakována po jednom týdnu. Maximální jednorázová dávka mikromolekulárních preparátů (Fe-glukonát) je 125 mg denně v minimálně 60minutové infuzi, aplikace může být opakována maximálně dvakrát týdně. Léčba intravenózním železem není vhodná u pacientů v septickém stavu.
Tab. 3. Empirické stanovení deficitu železa. Tab. 3. Empirical determination of individual iron deficiency. 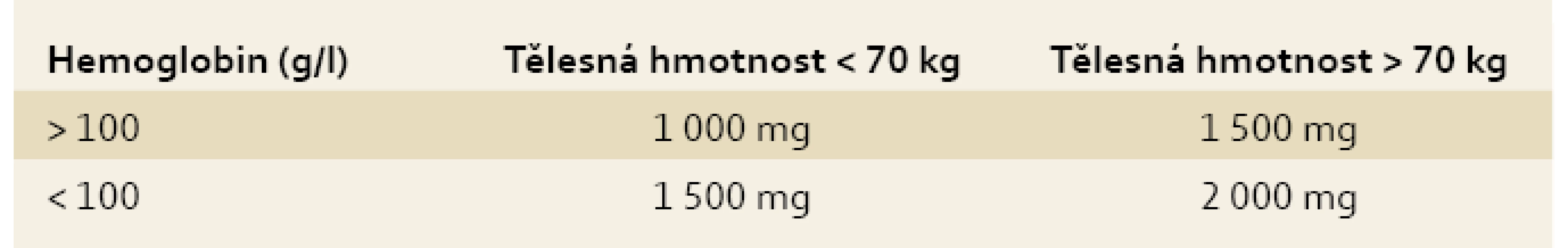
Perorální substituce železa
Perorální substituce železa je určena ke korekci jen mírné anémie (> 100–110 g Hgb/l), je spojena s poměrně častou intolerancí (více než 20 % – bolesti břicha, průjem, nauzea) [1,4]. Více než 90 % železa není absorbováno, retinované Fe soli mohou aktivovat slizniční zánět (vstřebá se maximálně 10–20 mg/den), aktivní IBD navíc dále zhoršuje resorpci [5,8,13]. Podáváme dávky do 100 mg p.o./den, navyšování perorální léčby je kontraproduktivní a vede k zvýšení četnosti N.Ú.
Další léčba
Erytropoetin je indikován v léčbě anemických IBD pacientů s těžkou anémií (< 100 g Hgb/l), u nichž nedošlo k odpovědi na i.v. substituci železa do čtyř týdnů, zejména u pacientů s refrakterní aktivní chorobou. Nutná je vždy kombinace s i.v. substitucí železem [4,13]. Takový pacient by měl být konzultován s hematologem. Vitamin B12 a kyselinu listovou aplikujeme jen při prokázaných snížených sérových hladinách. Úvodní dávky jsou 1 000 µg i.m. jednou měsíčně (vitamin B12) a 10 mg denně p.o. (folát), dále se dávkování řídí podle laboratorních kontrol [5,8]. Kyselinu listovou podáváme vždy při medikaci sulfasalazinem a metotrexátem. Samozřejmostí je léčba střevního zánětu a malnutrice. Vzhledem k postupné dobré adaptaci pacientů s IBD a sideropenní anémií nebo anémií chronického zánětu není užití krevních převodů časté. Na místě je jejich podání u těžké život ohrožující anémie, u významné anemické symptomatologie a u závažných, zejména vaskulárních komorbidit. Po převodu erymas (pro jejich krátkodobý efekt) je nutné bezprostředně zahájit i.v. suplementaci železa [4,8,9,21].
Monitoring pacienta s IBD anémií
Laboratorní sledování (Hgb, feritin, saturace transferinu) je nutné v pravidelných intervalech. U pacientů s léčenou těžkou anémií (< 100 g Hgb/l) jsou tyto kontroly opakovány v intervalu max. jednoho měsíce, u anémie lehčí (> 100 g Hgb/l) lze tento interval prodloužit na 2–3 měsíce. Při progresi aktivity IBD nebo akcentaci anemických symptomů je nutná kontrola časná.
Obr. 3. Pracovní skupina pro idiopatické střevní záněty ČGS, 8. 6. 2012. Fig. 3. The Czech National IBD Working Group, 8 June 2012. 
Závěr
Anémie je nejčastější extraintestinální manifestací IBD, významným způsobem alteruje kvalitu života pacientů. Hlavními typy anémie u IBD jsou anémie hypochromní a anémie chronických chorob (anémie chronického zánětu) a jejich kombinace. Ostatní typy chudokrevnosti jsou podstatně vzácnější, zahrnují zejména makrocytární a polékovou anémii. Základními patofyziologickými rysy hypochromní anémie jsou porucha resorpce železa, porucha uvolňování železa retinovaného v makrofázích a chronické krevní ztráty zapříčiněné rekurentním makroskopickým nebo mikroskopickým krvácením ze zánětlivě změněné sliznice. V patogenezi anémie chronického zánětu hrají hlavní roli prozánětlivé mediátory ovlivňující všechny stupně erytropoézy. V diagnostice sideropenie a diferenciální diagnostice hlavních typů anémie u IBD jsou nejpřínosnější stanovení hladiny feritinu a saturace transferinu. Naopak stanovení sérové hladiny železa je nedostatečným a nespolehlivým laboratorním markerem sideropenie. Nezbytná je současná evaluace aktivity střevní choroby.
Základem léčby hypochromní anémie a anémie chronických chorob se sideropenií u IBD pacientů je i.v. aplikace železa. Vzhledem k lepší efektivitě, zásadnímu snížení počtu aplikací a dobré bezpečnosti a toleranci léčby by měly být upřednostněny nové makromolekulární preparáty – např. karboxymaltóza železa. Léčbu zahajujeme ihned při poklesu hladiny hemoglobinu pod fyziologickou hodnotu. I u sideropenních pacientů bez anémie doporučujeme zahájit substituci. Cílem terapie je úplná normalizace hladiny hemoglobinu a zásob železa v organizmu. Samozřejmá je účinná terapie střevní choroby a malnutrice. Perorální substituce železa je vyhrazena pouze pro pacienty s lehkou anémií a chorobou v remisi. Erytropoetin je v kombinaci s i.v. aplikací železa efektivní v léčbě refrakterní anémie zejména u aktivní střevní choroby. Substituci vitaminu B12 a listové kyseliny indikujeme při zjištění jejich nízkých sérových koncentrací. Krevní převody nemají nahrazovat léčbu železem, mají místo jen u život ohrožující anémie, výrazných anemických symptomů anebo u pacientů s vážnými komorbiditami. Pravidelný monitoring anemických pacientů s IBD je nezbytný.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 24. 6. 2012
Přijato: 26. 7. 2012
MUDr. Luděk Hrdlička
Klinické a výzkumné centrum pro střevní záněty, ISCARE a 1. LF UK v Praze
Jankovcova 1569/2C
170 04 Praha 7
ludek.hrdlicka@post.cz
Zdroje
1. Gasche C, Berstad A, Befrits R et al. Guidelines on the diagnosis and management of iron deficiency and anemia in inflammatory bowel diseases. Inflamm Bowel Dis 2007; 13(12): 1545–1553.
2. Oustamanolakis P, Koutroubakis IE, Kouromalis EA. Diagnosing anemia in inflammatory bowel disease: Beyond the established markers. J Crohns Colitis 2011; 5(5): 381–391.
3. Gasche C. Anemia in IBD: the overlooked villain. Inflamm Bowel Dis 2000; 6(2): 142–150.
4. Gomollon F, Gisbert JP. Anemia and inflammatory bowel diseases. J World Gastroenterol 2009; 15(37): 4659–4665.
5. Weiss G, Gasche C. Pathogenesis and treatment of anemia in inflammatory bowel disease. Haematologica 2010; 95(2): 175–178.
6. Bergamaschi G, Di Sabatino A, Albertini R et al. Prevalence and pathogenesis of anemia in inflammatory bowel disease. Influence of anti-tumor necrosis factor--alpha treatment. Haematologica 2010; 95(2): 199–205.
7. Giannini S, Martes C. Anemia in inflammatory bowel disease. Minerva Gastroenterol Dietol 2006; 52(3): 275–291.
8. Kulnigg S, Gasche C. Systematic review: managing anemia in Crohn's disease. Aliment Pharmacol Ther 2006; 24(11–12): 1507–1523.
9. Zhu A, Kaneshiro M, Kaunitz JD. Evaluation and treatment of iron deficiency anemia: a gastroenterological perspective. Dig Dis Sci 2010; 55(3): 548–559.
10. Guagnozzi D, Severi C, Ialongo P et al. Ferritin as a simple indicator of iron deficiency in anemic IBD patients. Inflamm Bowel Dis 2006; 12(2): 150–151.
11. Stein J, Hartmann F, Dignass AU. Diagnosis and management of iron deficiency anemia in patients with IBD. Nat Rev Gastroenterol Hepatol 2010; 7(11): 599–610.
12. Wish JB. Assessing iron status: beyond serum ferritin and transferrin saturation. Clin J Am Soc Nephrol 2006; 1: S4–S8.
13. Clark SF. Iron deficiency anemia: diagnosis and management. Curr Opin Gastroenterol 2009; 25(2): 122–128.
14. Fernandez-Rodriguez AM, Guindeo--Casasús MC, Molero-Labarta T et al. Diagnosis of iron deficiency in chronic renal failure. Am J Kidney Dis 1999; 34(3): 508–513.
15. Nemeth E, Tuttle MS, Powelson J et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science 2004; 306(5704): 2090–2093.
16. Oustamanolakis P, Koutroubakis IE, Messaritakis I et al. Serum hepcidin and prohepcidin concentrations in inflammatory bowel disease. Eur J Gastroenterol Hepatol 2011; 23(3): 262–268.
17. Oustamanolakis P, Koutroubakis IE, Messaritakis I et al. Measurement of reticulocyte and red blood cell indices in the evaluation of anemia in inflammatory bowel disease. J Crohns Colitis 2011; 5(4): 295–300.
18. Hart AL, Ng SC. Inflammatory Bowel Disease: An Evidence-based Practical Guide. UK tmf Publishing Ltd. 2012: 259–278.
19. Kulnigg S, Gasche C. Systematic review: managing anaemia in Crohn´s disease. Aliment Pharmacol Ther 2006; 24(11–12): 1507–1523.
20. Dali-Youcef N, Andres E. An update on cobalamin deficiency in adults. QJM 2009; 102 : 17–28.
21. Bátovský M. Súčasný prístup k anemii u pacientov s nešpecifickými črevnými zápalmi. Gastroent Hepatol 2012; 66(2): 131–135.
22. Lee TW, Kolber MR, Fedorak RN et al. Iron replacement therapy in IBD patients with IDA: A systematic review and meta-analysis. J Crohns Colitis 2012; 6(3): 267–275.
23. Evstatiev R, Marteau P, Iqbal T et al. FERGIcor study. Gastroenterology 2011; 141(3): 846–853.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2012 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Zácpa na okraji?
- Zácpa a přežívající mýty. Laxativa
- Neobvyklá příčina anémie a střevní obstrukce u mladého pacienta
- Zácpa a hypofunkce štítné žlázy. Mýtus nebo skutečnost?
- Syndrom solitárního rektálního vředu
- Defekografie
- Radioizotopové vyšetření segmentální pasáže tlustým střevem pomocí 67Ga-citrátu
- Úspěšná léčba pacientky s obstrukčním defekačním syndromem
- Mezenteriálna fibromatóza ako príčina náhlej príhody brušnej
- Doporučený postup pro diagnostiku a léčbu anémie u IBD
-
Dlouhodobé výsledky terapie infliximabem u pacientů s ulcerózní kolitidou
Pokračování studií ACT-1 a ACT-2 - Flexibilní ezofagogastroskopie – jakých nálezů si má všímat gastroenterolog v hypofaryngu a hrtanu?
- Endoskopická polypektomie – jak dosáhnout standardu kvality v roce 2012?
- Liečba spontánnej baktériovej peritonitídy
-
Kvalita života je důležitým faktorem indikační rozvahy u nemocných s karcinomem pankreatu
Multicentrická prospektivní studie - Nová sekce Diskuzní fórum
- Vleklé dyspepsie: co a jak v běžné praxi
- Správná odpověď na kvíz
- 44th congress of the European Pancreatic Club (EPC) and PROMED symposium in 2012
- Dulcolax® čípky
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Defekografie
- Zácpa a hypofunkce štítné žlázy. Mýtus nebo skutečnost?
- Syndrom solitárního rektálního vředu
- Liečba spontánnej baktériovej peritonitídy
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



