-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Léčba akutního srdečního selhání – přehled
Treatment of acute heart failure syndrome – review
Acute heart failure syndromes comprises a heterogenous set of conditions associated with a high mortality and hospitalizations rates and a consequent heavy healthcare burden. Initial therapy in patients with acute heart failure should be directed at improving symptoms and patient haemodynamics. The evidence base for many traditional therapies is weak, and, in some cases, short-term benefits are gained at the expense of long-term outcomes. This paper summarizes current basic pharmacological and non-pharmacological management of patients with acute heart failure syndromes.
Key words:
acute heart failure – management of heart failure – vasodilators – inotropes – ventricular assist devices
Autoři: Kettner Jiří
Působiště autorů: Klinika kardiologie, IKEM, Praha
Vyšlo v časopise: Anest. intenziv. Med., 19, 2008, č. 4, s. 218-225
Kategorie: Intenzivní medicína - Přehledný článek
Souhrn
Syndromy akutního srdečního selhání představují heterogenní skupinu chorobných stavů, které jsou charakterizovány narůstající incidencí, vysokou mortalitou, častou rehospitalizací a s tím spojenou značnou ekonomickou náročností léčby. Klíčovým bezprostředním cílem léčby syndromů akutního srdečního selhání je zmírnění a odstranění obtíží a zlepšení hemodynamického stavu nemocného. Pro tuto tradiční léčbu akutních fází prakticky neexistuje podpora v randomizovaných studiích, a léčba je tak převážně empirická. Článek shrnuje současné základy farmakologické a nefarmakologické léčby u nemocných s akutním srdečním selháním.
Klíčová slova:
akutní srdeční selhání – léčba srdečního selhání – vazodilatační léčba – inotropní léky – mechanické srdeční podporyÚvod
Akutní srdeční selhání je definováno jako rychlý vznik projevů a příznaků selhání srdce v důsledku abnormální srdeční funkce [1]. Nemocné s akutním srdečním selháním můžeme rozdělit do 3 skupin:
- Nemocní se zhoršeným chronickým systolickým či diastolickým selháním;
- nemocní s prvním projevem srdečního selhání (de novo) v důsledku nejčastěji akutního infarktu myokardu (AIM) nebo náhlého zvýšení krevního tlaku u LK se sníženou poddajností;
- nemocní se zhoršením terminální fáze srdečního selhání se špatnou odpovědí na léčbu.
Toto široké spektrum příčin a projevů představuje syndromy akutního srdečního selhání (SASS). Symptomy mohou vzniknout jak u nemocného se známým předchozím onemocněním srdce, tak i bez něj, a mohou tak být prvním projevem srdečního onemocnění. Porušená srdeční funkce může být systolická, diastolická i smíšená, projevem mohou být poruchy srdečního rytmu nebo poruchy plnění či vyprazdňování srdečních komor. Kritickým vyvrcholením akutního srdečního selhání je kardiogenní šok.
Akutní srdeční selhání a zejména opakované dekompenzace představují významný a narůstající problém společnosti. Mezi hlavní charakteristiky tohoto syndromu patří:
- Neustále narůstající incidence – ročně je hospitalizováno v USA s touto diagnózou 1 milion nemocných [2]; důvodem je i úspěšná léčba chronického srdečního selhání (včetně implantací kardioverterů-defibrilátorů) a akutních koronárních syndromů.
- Závažná prognóza s roční mortalitou 30–40 % (tj. 3–5krát vyšší než u infarktu myokardu [3, 4].
- Značná ekonomická náročnost léčby – 30–60 % nemocných se SASS je během 3–6 měsíců znovu hospitalizováno [5].
- Převážně empirická léčba akutních fází – v posledních 15 letech bez významnější změny či zavedení nových léků do rutinní praxe. Výjimkou je pouze levosimendan a v Evropě dosud neregistrovaný nesiritid.
Všechny tyto skutečnosti akcentují potřebu zvýšené pozornosti k SASS, která byla v posledních desetiletích věnována spíše chronickému srdečnímu selhání. Z těchto důvodů byla sepsána první doporučení pro léčbu akutního srdečního selhání a v roce 2005 publikována Evropskou kardiologickou společností (ESC) [1]. V následujícím roce byla publikována i národní doporučení [6]. Následující stručný přehled léčby SASS se zaměřením na levostranné srdeční selhání se snaží upozornit na zásadní postupy a problémy této léčby. Vychází z doporučení ESC a v podrobnostech na ně odkazuje.
Základní obecné cíle léčby
Mezi obecné základní přístupy a cíle léčby SASS patří:
- Zvládnutí akutního kritického stavu (podle hemodynamického profilu).
- Odhalení a řešení reverzibilních příčin SASS.
- Léčba komorbidit a vyvolávajících příčin.
- Zavedení dlouhodobé léčby ovlivňující prognózu; zhodnocení funkční kapacity a plán kontrol.
Klíčovým bezprostředním cílem léčby SASS je zmírnění a odstranění obtíží (nejčastěji dušnost), snížení objemu extracelulární (především intravaskulární) tekutiny = městnání, snížení plnících tlaků srdečních komor (především levé komory, LK), úprava krevního tlaku, srdeční frekvence a rytmu, zabezpečení prokrvení vitálních orgánů a protekce ledvinných funkcí a myokardu. Současnou snahou je odhalení příčiny vzniku akutního srdečního selhání. Zde je nejužitečnější echokardiografie – slouží k posouzení regionální i globální funkce srdečních komor, funkce i struktury srdečních chlopní, k detekci mechanických komplikací infarktu myokardu i k posouzení stavu perikardu. To umožní v krátké době určit příčinu srdečního selhání a podle toho zahájit správnou léčbu. Z těchto důvodů by mělo být echokardiografické vyšetření dostupné na kardiologických pracovištích nepřetržitě. Na základě dopplerovského vyšetření je možno odhadovat hodnotu srdečního výdeje, plnící tlak LK, diastolickou funkci LK či tlaky v plícnici. Opakovaná vyšetření tak přispívají k hodnocení úspěšnosti léčby.
V případě akutního koronárního syndromu je indikována selektivní koronarografie. Hlavní příčiny SASS ukazuje tabulka 1.
Tab. 1. Nejčastější příčiny syndromu akutního srdečního selhání (SASS) 
Farmakologická léčba
Diuretika
Pilířem léčby akutního srdečního selhání v prvních hodinách po přijetí nemocného je intravenózní podání diuretik, vazodilatátorů a popř. inotropních látek.
Více než 75 % nemocných přijatých s příznaky SASS má městnání různého stupně. Nejčastějšími léky těchto stadií jsou proto intravenózní diuretika. Přes široké a téměř univerzální používání diuretik neexistuje randomizovaná placebem kontrolovaná studie, která by podporovala jejich prospěch, zejména z prognostických důvodů. Víme však, že navození diurézy nemocným uleví, sníží objem extracelulární tekutiny i plnící tlak LK; tím plníme výše uvedené bezprostřední léčebné cíle. Je však nutné vědět, že současným efektem – již méně chtěným – je deplece intravaskulárního objemu, neurohormonální aktivace, zhoršení ledvinných funkcí, možnost hypokalémie a hyponatrémie. Důležité proto je dávky pečlivě zvážit. Jinak bude reagovat nemocný bez předchozí diuretické léčby (stačí menší dávky), a jinak nemocný na chronické diuretické léčbě s denní dávkou furosemidu 100 mg a více (nutnost vyšších dávek). Důvodem je aktivace renálních kompenzačních mechanismů u nemocných s chronickou srdeční nedostatečností a diuretickou léčbou.
Dalším důležitým momentem je patofyziologická podstata městnání v plicích. U staršího nemocného s akutním plicním edémem se zachovalou systolickou funkcí LK je městnání v plicích způsobeno především centrální redistribucí tekutin – přesun tekutiny do nejvíce poddajného vaskulárního kompartmentu, tj. do plicního řečiště (obr. 1). Zvýšená tuhost cévního řečiště, spolu s relativně zachovalou kontraktilitou LK, má za následek zvýšenou citlivost výkonu levé komory na plnění, což se projevuje u těchto nemocných zvýšenou labilitou systémových tlaků [7]. Akutní vzestup systémového krevního tlaku pak vede k tomuto charakteru levostranného srdečního selhání. Mluvíme dnes spíše o cévním selhání než srdečním selhání, i kdy i subklinická systolická dysfunkce a diastolická dysfunkce LK může být součástí komplexního obrazu. Pro léčbu to má dopad právě v akcentaci vazodilatační léčby a menších dávek diuretik, neboť tito nemocní (typicky starší ženy s cukrovkou) mohou mít i relativní hypovolémii. Vhodné je proto vyvarovat se paušálního podávání vysokých iniciálních dávek, neboť charakter plicního městnání je spíše redistribuční (redistribuce části intravaskulárního objemu do plic) a kontrakce intravaskulárního objemu po nadměrné diuréze může vést k hypotenzi se zhoršením renální a orgánové perfuze. Přednosti vazodilatační léčby ukázala i randomizovaná studie, která porovnávala léčbu plicního edému postavenou na vysokých dávkách furosemidu s léčbou postavenou na vysokých dávkách nitrátů [8]. Léčba vysokými dávkami isosorbid-dinitrátu (v kombinaci s nízkou dávkou diuretik) byla účinnější než podávání vysokých dávek furosemidu (v kombinaci s nízkou dávkou nitrátů) a snížila významně nutnost intubace či výskyt infarktu myokardu.
Obr. 1. Charakteristické známky „cévního“ selhání 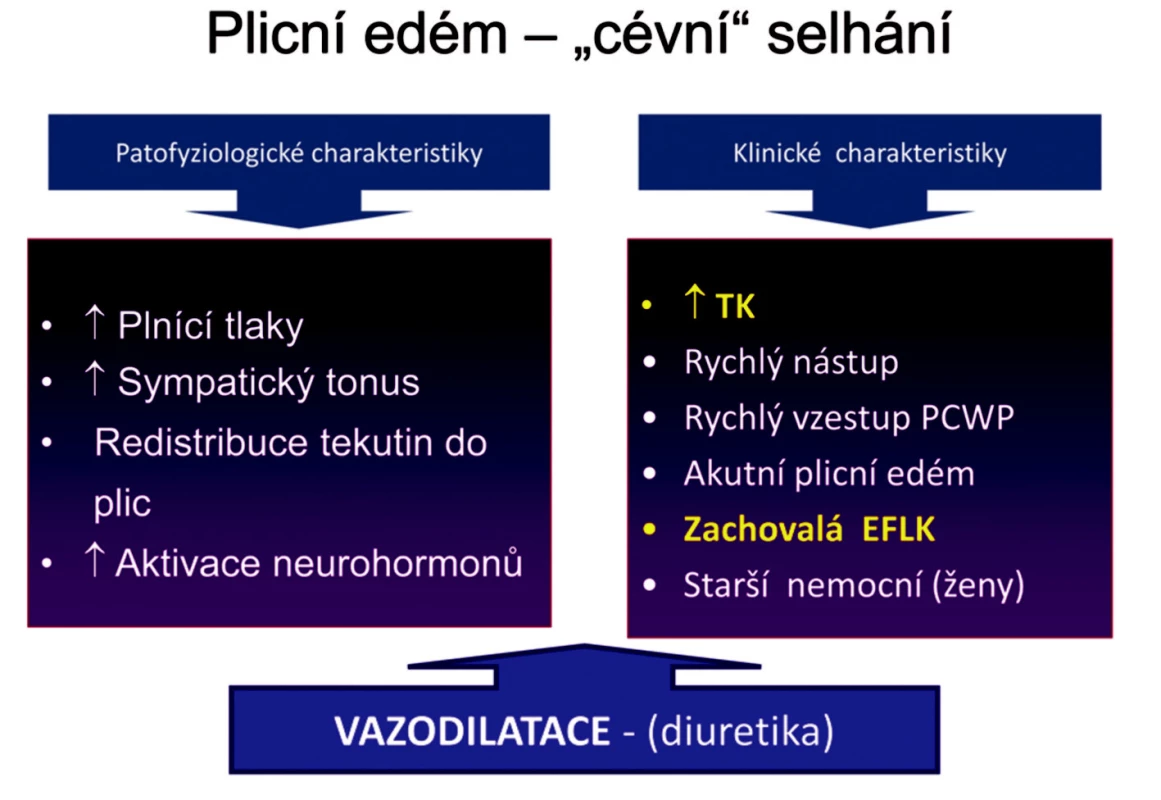
V akutní fázi srdečního selhání podáváme diuretikum zásadně intravenózně – prakticky vždy jde o furosemid, který působí v celém vzestupném raménku Henleho kličky blokádou aktivního transportu sodíku a chloridů. Dalším jeho efektem je vazodilatace v žilním řečišti a tím snížení předtížení (preloadu). Obvyklé jsou opakované bolusy (furosemid 20–80 mg i. v. ) podle diuretické odpovědi, u akutní dekompenzace chronického srdečního selhání je vhodnější aplikací kontinuální infuze furosemidu v dávce 5–40 mg . h-1 vždy za pečlivé kontroly renálních funkcí. Často je výhodná a bezpečnější kombinace s thiazidovými diuretiky, která umožňuje nižší dávky diuretik. U této skupiny nemocných je vhodné též použití malých dávek dopaminu (tzv. renální dávka 2–3 μg . kg-1 . min-1), a to zejména u nemocných s renální insuficiencí, kde se obáváme zhoršení renálních funkcí při vysokých dávkách furosemidu. I přes neexistenci randomizované studie řešící tento postup jsou podporou rozsáhlé pozitivní klinické zkušenosti s tímto přístupem na pracovišti autora, zejména u akutní dekompenzace srdečního selhání.
Vazodilatační léčba
Vazodilatační léčba je u všech nemocných s akutním srdečním selháním bez hypotenze (systolický TK > 100 mm Hg) postupem volby. Nejčastěji používaným lékem jsou nitráty – nitroglycerin nebo isosorbid-dinitrát. Indikace, dávky a hlavní vedlejší účinky ukazuje tabulka 2.
Tab. 2. Nitrovazodilatátory – indikace, dávky a vedlejší účinky 
Nitráty podáváme intravenózně za pečlivé kontroly krevního tlaku, v akutní situaci do doby získání venózního přístupu je možné použít opakované sublingvální aplikace. Pokud má nemocný hypertenzi, je vhodné podat bolus intravenózně před následující infuzí.
Dalším lékem je nitroprusid sodný, jehož použití je omezeno na stavy refrakterní hypertenze a současného akutního srdečního selhání. Nevhodný je u nemocných s akutním koronárním syndromem pro riziko tzv. steal fenoménu, zde je lékem volby nitrát. Podávání nitroprusidu je nutné omezit na nezbytně nutnou dobu pro nebezpečí tvorby toxických metabolitů, zejména u nemocných s jaterním a renálním postižením. Dávka nitroprusidu se titruje od 0,3 µg . kg-1 . min-1 do 5 µg . kg-1 . min-1 za přísné kontroly krevního tlaku; často je nutné přímé měření tepenného tlaku. Natriuretické peptidy (nesiritid, ularitid) nejsou v ČR registrovány.
Pozitivně inotropní léky
Jako pozitivně inotropní léky označujeme látky, které zvyšují srdeční výdej zvětšením tepového objemu v důsledku posílení kontrakce myokardu. Mechanismem účinku nejčastěji současných používaných léků – dopamin, dobutamin a milrinon – je zvýšení koncentrace nitrobuněčných kalciových iontů v důsledku zvýšení hladin cyklického adenosin monofosfátu (cAMP) buď zvýšením jeho produkce (agonisté betareceptorů – dopamin, dobutamin) nebo inhibicí jeho degradace (inhibitory fosfodiesterázy III – milrinon). Výsledkem zvýšené nabídky kalciových iontů troponinu C je posílená kontrakce srdečního svalu. Další adrenergní agonisté – adrenalin a noradrenalin – jsou doporučovány zejména v rámci kardiopulmonální resuscitace. Noradrenalin je používán u nemocných se SASS a významně sníženou systémovou rezistencí, což v praxi představuje téměř vždy SIRS a septický šok. Noradrenalin a/nebo adrenalin pak někdy používáme v případech nedostatečného účinku dopaminu či dobutaminu s trvající hypotenzí.
Je nutné si vždy uvědomit, že použití pozitivně inotropních látek může vést ke vzniku arytmií, ischémie myokardu, apoptóze kardiomyocytů, neurohormonální aktivaci a k prohloubení energetické krize s důsledky na progresi myokardiální dysfunkce a to jsou velké prospektivní limitace cAMP dependentních, pozitivně inotropních léků [9, 10]. Jejich aplikace by měla být proto vždy pečlivě zvážena a použita pouze k překlenutí kritického období. Indikací jsou tedy stavy s nízkým srdečním výdejem s hypoperfuzí orgánů a kardiogenní šok. U nemocných léčených před epizodou akutní dekompenzace betablokátory dáváme přednost milrinonu [11], a to zejména u pacientů s neischemickým původem kardiomyopatie [12].
Představitelé nové třídy pozitivně inotropních léků jsou tzv. kalciové senzitizéry, jakými jsou pimobendan, vesnarinon a levosimendan. V praxi používáme pouze levosimendan s duálním mechanismem účinku: zvýšení citlivosti myocytárních kontraktilních proteinů – zejména troponinu C – k intracelulárním kalciovým iontům je odpovědné za pozitivně inotropní účinek a stimulace otevření adenosintrifosfát-senzitivních draslíkových kanálů je odpovědné za periferní vazodilataci včetně koronárních tepen. Pozitivně inotropní efekt je nezávislý na cAMP a lék nezvyšuje absolutní koncentraci intracelulárního kalcia. Tím je významně eliminován proarytmický efekt a apoptóza kardiomyocytů. Popsaný mechanismus účinku zvyšuje kontraktilitu bez ovlivnění diastolické relaxace a bez zvýšení myokardiální spotřeby kyslíku. To ho zásadně odlišuje od výše uvedených cAMP dependentních, pozitivně inotropních látek. Acetylovaný metabolit levosimendanu si uchovává vlastnosti původní látky a jeho poločas kolem 80 hodin vede k protrahovanému účinku po 24hodinové infuzi levosimendanu [13, 14]. Farmakologický efekt konečného metabolitu OR-1896 může přetrvávat až 7 dnů od ukončení infuze [15].
Studie LIDO, RUSSLAN a CASINO [16, 17, 18] shodně prokázaly, že krátkodobá (6–24hodinová) infuze levosimendanu příznivě ovlivňuje hemodynamické parametry, zlepšuje příznaky akutního srdečního selhání a snižuje krátkodobou úmrtnost oproti placebu a dobutaminu. Studie SURVIVE nepotvrdila vliv levosimendanu na dlouhodobé ovlivnění mortality při srovnání s dobutaminem [19]. Shrneme-li všechny současné poznatky o efektu levosimendanu v léčbě SASS ve světle publikovaných a přednesených studií, lze říci, že levosimendan patří mezi významné léky v této indikaci, a to zejména u určitých podskupin tohoto značně heterogenního syndromu. Platí to zejména pro dekompenzované chronické srdeční selhání u nemocných léčených betablokátory bez vstupní systémové hypotenze a s hypervolémií a u nemocných se srdečním selháním v důsledku akutní ischémie, např. po neúspěšné koronární intervenci s přetrvávajícími projevy srdečního selhání. Dnes levosimendan u těchto nemocných podáváme téměř vždy bez úvodního bolusu, který byl dříve doporučován. V konkrétních klinických situacích lze kombinovat levosimendan s dobutaminem, ale vždy je nutné se vyvarovat systémové hypotenze a vyloučit hypovolémii.
Srdeční glykosidy mají u SASS slabý pozitivně inotropní účinek. Digoxin může být prospěšný v akutní fázi srdečního selhání u nemocných s tachykardií v důsledku rychlé komorové odpovědi při fibrilaci síní, kdy se obáváme aplikace betablokátorů. Vyhýbáme se jeho aplikaci u nemocných se SASS u AIM, kdy dáváme přednost u výše zmíněné indikace amiodaronu. U závažného srdečního selhání po akutní epizodě dekompenzace může být nasazení srdečních glykosidů prospěšné k zabránění opětné dekompenzace, a to zejména u nemocných s výrazně dilatovanou LK, třetí srdeční ozvou a fibrilací síní.
Obvyklé dávkování pozitivně inotropních léků ukazuje tabulka 3.
Tab. 3. Obvyklé dávkování pozitivně inotropních léků 
*U nemocných s hypotenzí bez bolusu. **Dávka může být opakována během 3–5 minut, endotracheální podání pouze při nemožnosti i. v. aplikace. ***Někdy i vyšší dávky podle konkrétní klinické situace. V současné době nemáme ideální inotropní lék a použití jednotlivých léků v konkrétních situacích je individuálně empirické. Na základě zkušeností však lze preferovat jednotlivé léky u různých stavů, jak to ukazuje tabulka 4.
Tab. 4. Příklady použití pozitivně inotropních látek 
IABK – intraaortální balonková kontrapulzace; MSP – mechanická srdeční podpora; PVR – plicní vaskulární rezistence; SVR – systémová vaskulární rezistence; VAD – ventricular assist device. Analgezie a sedace
Při dušnosti s neklidem je vhodný morfin, nejlépe v malých bolusech (např. 3 mg i. v. opakovaně) nebo fentanyl i. v. Morfin způsobuje vhodnou venodilataci a snižuje tepovou frekvenci. Zklidnění a relaxace nemocného se SASS je nedílnou součástí komplexní léčby, zejména u nemocných s umělou ventilací.
Antiagregační a antikoagulační léčba
Antiagregační léčba u nemocných se SASS v důsledku akutního koronárního syndromu se řídí doporučenými postupy pro léčbu těchto stavů [21]. Podávání nízkomolekulárního heparinu vede u nemocných s akutním interním onemocněním ke snížení výskytu tromboembolických příhod [22] a v preventivních dávkách ho používáme u nemocných s akutním srdečním selháním. Antikoagulační léčba je indikována u nemocných s fibrilací síní, plicní embolií, aneurysmatem LK s přítomným trombem a pokračujeme v ní při chronickém užívání z indikovaných důvodů (např. chlopenní náhrady). Akutní srdeční selhání je často spojeno s poruchou jaterních funkcí a hypokoagulačním stavem, a proto je nutná pečlivá kontrola koagulačních parametrů.
Pokud se týká ostatní farmakologické léčby, z antiarytmik je u SASS nejčastěji používán amiodaron, a to především u nemocných s fibrilací síní či komorovými tachykardiemi k zabránění jejich recidiv. Inhibitory ACE a betablokátory nejsou v akutních fázích srdečního selhání doporučovány, při akutní dekompenzaci chronického srdečního selhání užívané betablokátory úplně nevysazujeme, ale snažíme se pokračovat v nízkých dávkách – tento postup je nutné přísně individualizovat.
Farmakologická léčba nemocných se SASS je stále empirická a komplikovaná, protože v řadě případů jasně prospěšný akutní hemodynamický efekt automaticky neznamená příznivé ovlivnění další prognózy, což platí zejména pro současně používané pozitivně inotropní léky. Narůstající počty nemocných se srdečním selháním a akutní dekompenzací vedly v poslední době ke zvýšenému zájmu o tento syndrom a studiu řady nových léků. Mezi ně patří např. inhibitory Na/k-ATPázy (např. istaroxim), selektivní antagonisté adenosinových receptorů s ovlivněním renálního krevního průtoku, antagonisté arginin-vasopressinu (např. tolvaptan, conivaptan, lixivaptan), atriální natriuretický peptid (např. syntetická forma urodilatinu ularitid) a metabolické modulátory (např. perhexilin) k ovlivnění energetiky myocytů [23].
Cílem výzkumu nových inotropních léků je separovat vlastní inotropní účinek od arytmogenního, např. přímou stimulací tvorby myokardiální myozinové ATPázy. V případě nových diuretik je cílem separovat ztrátu objemu tekutin od ztráty solutů, a vzniká tak nová třída léků tzv. aquaretik. Tak by bylo možné farmakologicky úspěšně řešit dosud svízelný stav hypervolemické hyponatrémie.
Nefarmakologická léčba
Inhalace kyslíku, umělá plicní ventilace
Většina nemocných se SASS je léčena kyslíkem pomocí obličejové masky. Saturace kyslíku (SaO2 ) by měla být v mezích normy, tedy 95–98%, což zabezpečuje dostatečnou dodávku kyslíku do tkání a zabraňuje multiorgánovému poškození. V případě přetrvávání závažné hypoxémie i přes léčbu kyslíkem je indikována umělá plicní ventilace (UPV).
Hlavní cíle UPV v intenzivní péči jsou: podpora výměny plynů v plicích, zvýšení plicního objemu a snížení dechové práce. V případě odstranitelné příčiny srdečního selhání (typicky: plicní edém při akcelerované hypertenzi) a pokud není kontraindikace, je metodou volby neinvazivní plicní ventilace, která může zabránit intubaci. V současné době jsou doporučovány u kardiogenního plicního edému dvě techniky neinvazivní ventilace – spontánní ventilace s trvalým přetlakem v dýchacích cestách (continuous positive airway pressure – CPAP) a neinvazivní ventilace s tlakovou podporou (noninvasive positive-pressure ventilation – NIPPV). V případě CPAP je nejčastěji používána těsná obličejová maska s exspiračním ventilem k udržení pozitivního tlaku na konci výdechu. Tato technika vede ke zvýšení funkční reziduální kapacity plic a zlepšení plicní poddajnosti s následným zlepšením oxygenace, snížení dechové práce, žilního návratu a snížení afterloadu LK [24]. NIPPV je sofistikovanější metodou neinvazivní ventilace, která vyžaduje ventilátor k zajištění inspirační tlakové podpory a pozitivního endexspiračního přetlaku (PEEP). Inspirační asistence dále snižuje dechovou práci a celkové metabolické nároky organismu. Podmínkou je dobře spolupracující nemocný, nepřítomnost hypovolémie a maligních arytmií. Kontraindikace neinvazivní ventilace ukazuje tabulka 5. Metaanalýza studií, srovnávající neinvazivní ventilaci s konvenční léčbou u pacientů s akutním kardiogenním plicním edémem, ukázala, že neinvazivní ventilace snižuje nutnost intubace a snižuje též mortalitu [25].
Použití invazivní mechanické ventilace (s tracheální intubací) by mělo být rezervováno pro nemocné se SASS, nedostatečnou ventilací s posunem pH krve, hypoxémií a nadměrným respiračním úsilím, u kterých je neinvazivní ventilace kontraindikována nebo selhává (viz tab. 5). Jde tedy o stavy, které nelze zvládnout vazodilatační léčbou, oxygenoterapií či neinvazivní ventilací. Další indikací je kardiogenní šok s významnou a refrakterní hypoxémií a závažný plicní edém u nemocných s AIM s elevacemi ST úseků, kde je indikována neodkladná intervenční léčba.
Tab. 5. Kontraindikace neinvazivní ventilace 
Renální selhání, kardiorenální syndrom
Významným problémem léčebným i prognostickým u nemocných se SASS je výskyt renálního selhání a dnes mluvíme o tzv. kardiorenálním syndromu. Současná data z rozsáhlého amerického národního registru nemocných s akutním dekompenzovaným srdečním selháním (ADHERE) ukázala, že hlavními ukazateli nepříznivé prognózy u těchto nemocných jsou sérové hladiny urey, kreatininu a hodnota systolického krevního tlaku. Srdeční selhání způsobuje hypoperfuzi ledvin jednak přímo z důvodu nízkého minutového výdeje snížením renálního perfuzního tlaku při vysokém žilním tlaku, a nepřímo vlivem aktivace vazokonstrikčních mechanismů. Ke zhoršení renálního selhání může přispět i podávání ACE inhibitorů, nesteroidních antiflogistik či diuretik. Selhání ledvin při akutním srdečním selhání může být zdánlivě asymptomatické, avšak jakýkoliv vzestup hladiny kreatininu v séru nebo pokles glomerulární filtrace je spojen se špatnou prognózou [26]. Nezbytná je pečlivá kontrola a korekce elektrolytů a acidobazické rovnováhy k vyloučení závažných arytmií. Vždy musíme myslet i na možnou stenózu renální tepny, ale i na postrenální selhání. Hodnoty kreatininu 180–250 μmol . l-1 jsou spojeny i s horší odpovědí na diuretika a jsou ukazatelem nepříznivé prognózy nemocného. U těchto nemocných musíme často zvyšovat dávku diuretik, podávat kličková diuretika kontinuálně či kombinovat diuretika s různým mechanismem účinku, což může vést k další iontové dysbalanci a dalšímu snížení glomerulární filtrace. U nemocných se závažnou renální insuficiencí a refrekterní retencí tekutin je indikace k některé z renálních eliminačních metod (RRT – renal replacement therapy). Nejvhodnějším přístupem jsou kontinuální metody (CRRT), nejčastěji veno-venózní hemofiltrace (CVVH). Její použití se u těchto nemocných stalo z fyziologického hlediska standardem [27]. Touto metodou lze odstranit velké množství tekutiny bez rizika iontové dysbalance a řeší i problém rezistence na diuretika u pokročilých fází městnavé dekompenzace [28].
Mechanické srdeční podpory
Mechanické srdeční podpory (MSP) hrají významnou roli v léčbě akutního srdečního selhání či akutní dekompenzace terminální fáze kardiomyopatií v případě selhání farmakologické léčby. Standardně jsou dnes používány u farmakologicky refrakterní myokardiální dysfunkce po operaci srdce, dekompenzovaného chronického srdečního selhání u kandidátů transplantace srdce a u nemocných s kardiogenním šokem v důsledku AIM či jeho mechanických komplikací. Z celé řady různých druhů MSP jsou nejčastěji používány intraaortální balonková kontrapulzace (IABK, obr. 2), centrifugální pumpy s oxygenátorem nebo bez něj (obr. 3), parakorporální mechanické pumpy (obr. 4) a implantovatelné pumpy (obr. 5). Podrobnější přehled a indikace jsme publikovali dříve [29, 30]. Výběr druhu MSP závisí na klinické situaci a cíli použití: v případě život ohrožujících stavů jsou preferovány jednodušší a s možností perkutánního zavedení, u kandidátů transplantace srdce pak mechanické pumpy s pulzatilním či kontinuálním průtokem jako univentrikulární (nejčastěji jako left ventricular assist device – LVAD) nebo biventrikulární podpora.
Obr. 2. Intraaortální balonková kontrapulzace Vlevo – zavedení do descendentní aorty; vpravo – hemodynamický efekt na tlakové křivce z aorty – diastolická augmentace. 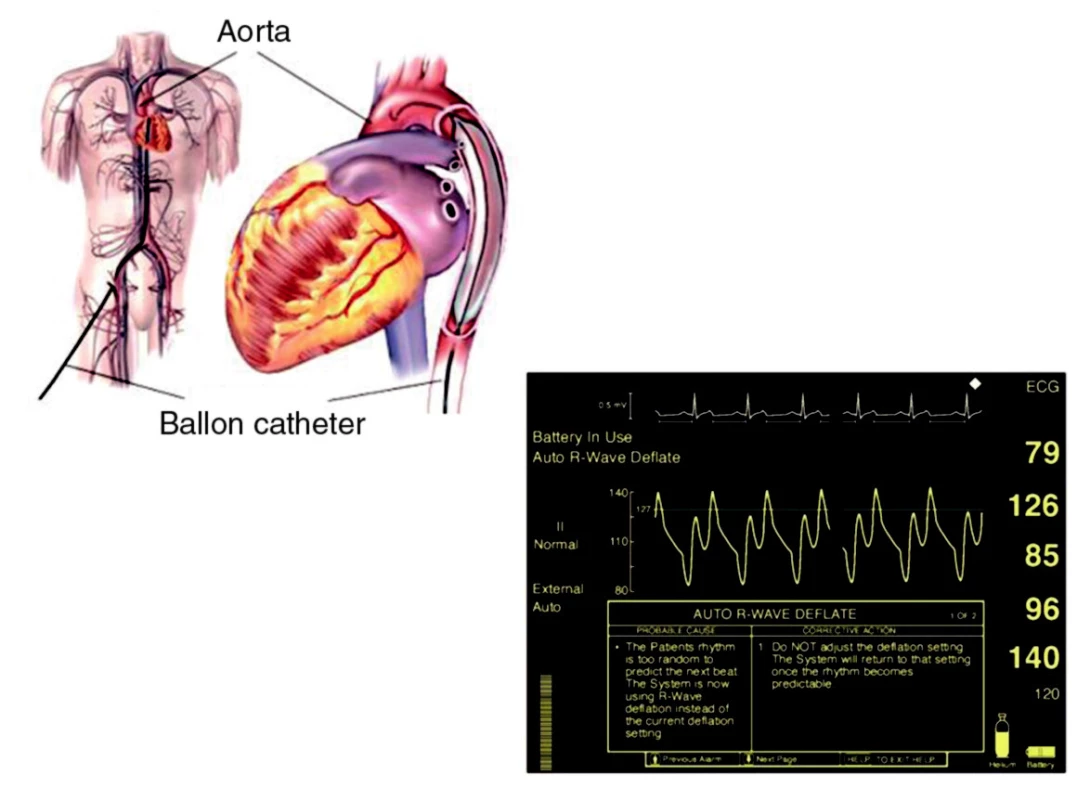
Obr. 3. Extrakorporální centrifugální pumpy Vlevo – systém TandemHeart pVAD; vpravo – systém Jostra RotaFlow. 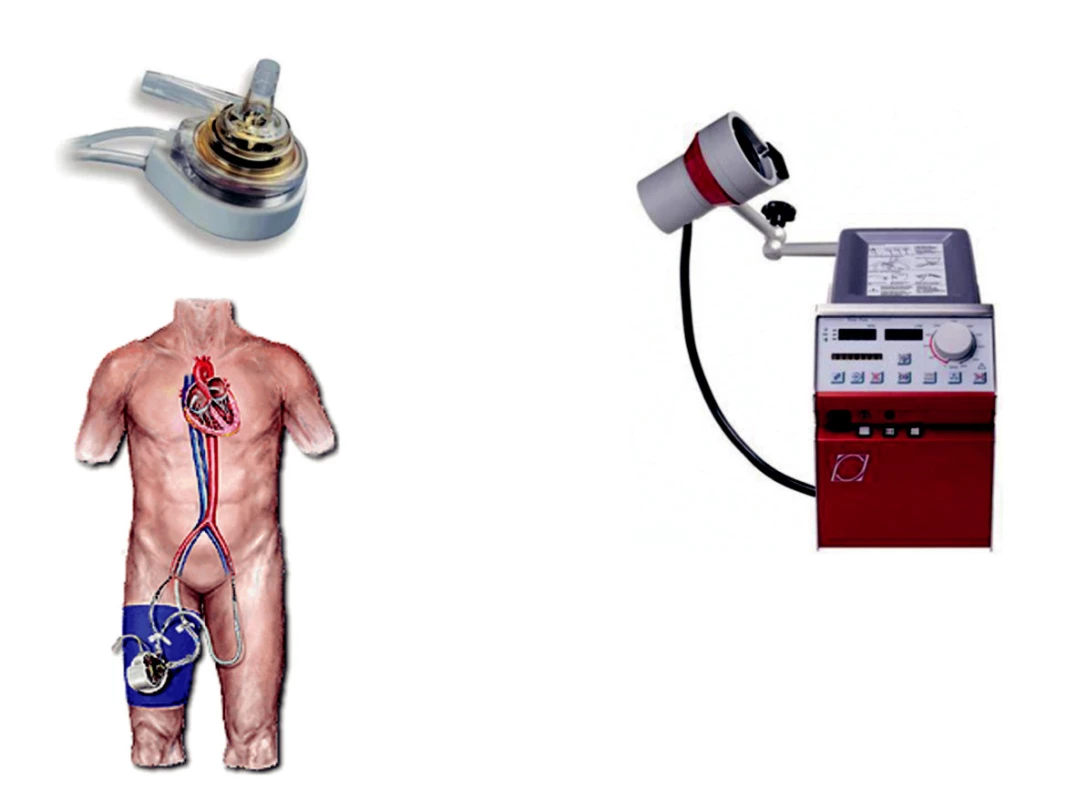
Obr. 4. Mechanické pumpy Vlevo – parakorporální systém Thoratec PVAD s pulzatilním průtokem pro střednědobé použití; vpravo – systém LevitronixCentriMag VAD pro krátkodobé použití. Obě pumpy lze použít jak pro uni-, tak i biventrikulární podporu. 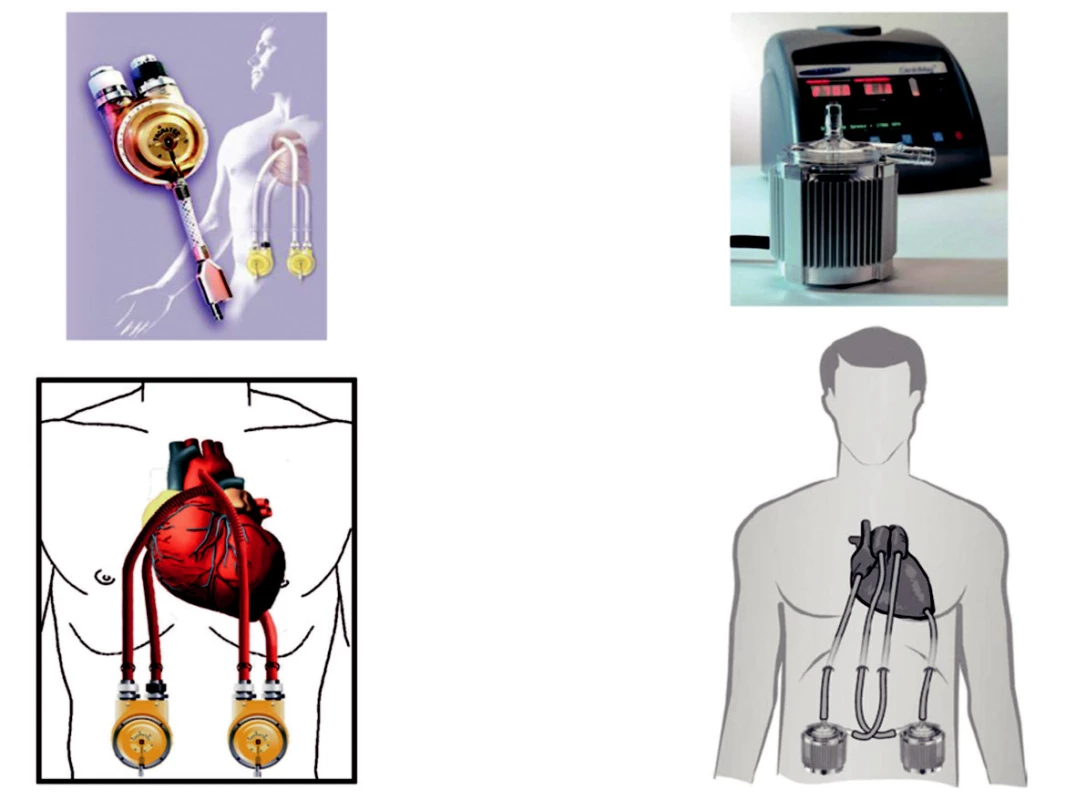
Obr. 5. Implantovatelné mechanické podpory s kontinuálním průtokem Vlevo – MicroMed DeBakey VAD; vpravo – systém Thoratec-HeartMate II 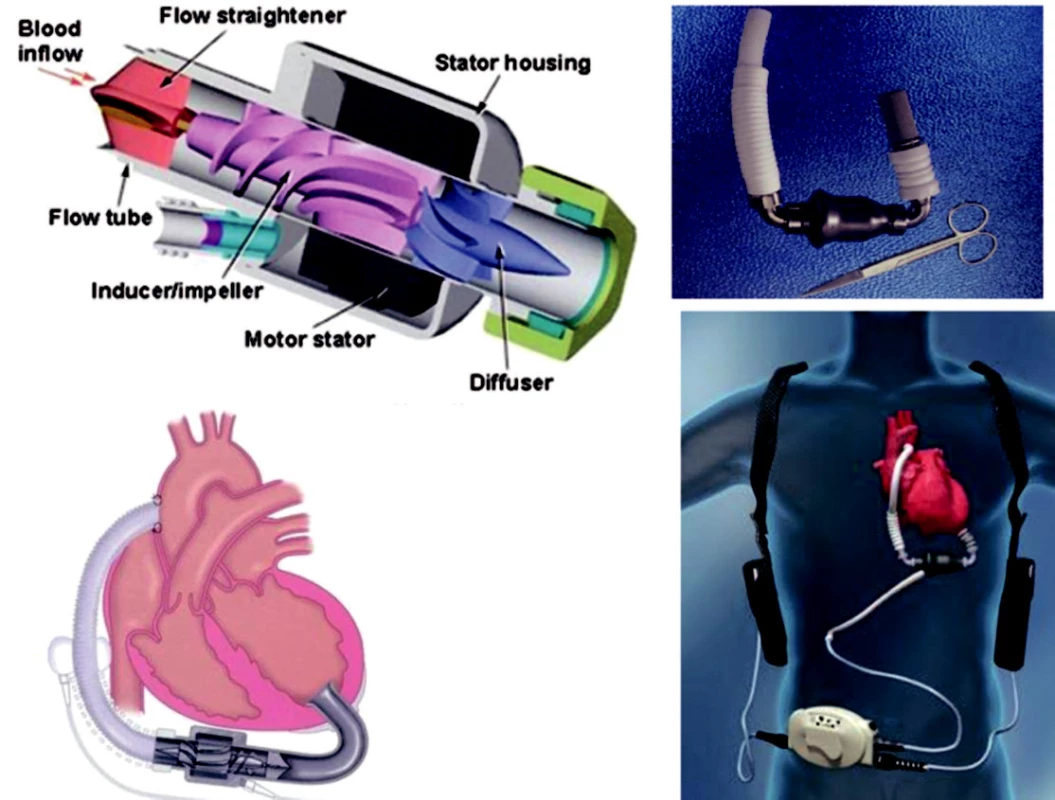
Chirurgická léčba a transplantace srdce
Příklady diagnóz s ASS vyžadující chirurgickou léčbu ukazuje tabulka 6. I přes vysoké riziko těchto operací je urgentní nebo časný chirurgický výkon zásadním přístupem k záchraně života či příznivému ovlivněním prognózy. Transplantace srdce je v současné době jediným prokázaným a uznávaným řešením terminální fáze srdečního selhání s dlouhodobým přijatelným efektem. Transplantace srdce může být zvážena u ASS s vysoce pravděpodobným předpokladem selhání konvenční léčby a nepříznivou prognózou. Jde např. o závažnou akutní myokarditidu, rychle progredující selhání u kardiomyopatie nebo rozsáhlý IM po neúspěšné revaskularizaci s pokračujícím selháním. V těchto případech musí být vždy posouzeny kontraindikace transplantace srdce a tato může být provedena až po stabilizaci stavu nemocného často i s použitím MSP. Vhodná je vždy včasná konzultace s kardiocentrem provádějícím tyto operace.
Tab. 6. Příklady ASS indikované k chirurgické léčbě 
Došlo 6. 5. 2008.
Přijato 12. 6. 2008.
Adresa pro korespondenci:
MUDr. Jiří Kettner, CSc., FESC
Klinika kardiologie IKEM
Videňská 1958/9
140 21 Praha 4
e-mail: jiri.kettner@ikem.cz
Zdroje
1. Nieminen, M. S., Boehm, M., Cowie, M. R. et al. Executive summary of the guidelines on the diagnosis and treatment of acute heart failure. Eur. Heart J., 2005, 26, p. 383–416.
2. American Heart Association Heart Disease and Stroke Statistics – 2004 Update. Dallas, TX : American Heart Association, 2003.
3. Stevenson, R.,Ranjadayalan, K., Wilkinson, P. et al. Short and long term prognosis of acute myocardial infarction since introduction of thrombolysis. Br. Med. J., 1993, 307, p. 349–353.
4. Roguin, A., Behar, D., Ben Ami, H. et al. Long-term prognosis of acute pulmonary oedema – an ominous outcome. Eur. J. Heart Fail., 2000, 2, p. 137–144.
5. Krumholz, H. M., Parent, E. M., Tu, N. et al. Readmission after hospitalization for congestive heart failure among Medicare beneficiaries. Arch. Intern. Med., 1997, 157, p. 99–104.
6. Špinar, J., Janský, P., Kettner, J. et al. Doporučení pro diagnostiku a léčbu akutního srdečního selhání. CorVasa, 2006, 48, p. K3–31.
7. Chen, C. H., Nakayama, M., Nevo, E. et al. Coupled systolic-ventricular and vascular stiffening with age: implications for pressure regulation and cardiac reserve in the elderly. J. Am. Coll. Cardiol., 1998, 32, p. 1221–1227.
8. Cotter, G., Metzkor, E., Kaluski, E. et al. Randomised trial of high-dose isosorbide dinitrate plus low-dose furosemide versus high-dose furosemide plus low-dose isosorbide dinitrate in severe pulmonary oedema. Lancet, 1998, 351, 9100, p. 389–393.
9. Narula, J., Haider, N., Virmani, R. et al. Apoptosis in myocytes in end-stage heart failure. N. Engl. J. Med., 1996, 335, p. 1182–1189.
10. Thackray, S., Easthaugh, J., Freemantle, N. et al. The effectiveness and relative effectiveness of intravenous inotropic drugs acting through the adrenergic pathway in patients with heart failure – a meta-regression analysis. Eur. J. Heart Fail., 2002, 4, p. 515–529.
11. Lowes, B. D., Tsvetkova, T., Eichhorn, E. J. et al. Milrinone versus dobutamine in heart failure subjects treated chronically with carvedilol. Int. J. Cardiol., 2001, 81, p. 141–149.
12. Felker, G. M., Benza, R. L., Chandler, A. B. et al. Heart failure etiology and response to milrinone in decompensated heart failure. Results from the OPTIME-CHF Study. JACC, 2003, 41, p. 997–1003.
13. Kivikko, M., Lehtonen, L., Colucci, W. S. Sustained hemodynamic effects of intravenous levosimendan. Circulation, 2003, 107, p. 81–86.
14. Innes, C. A., Wagstaff, A. J. Levosimendan: A review of its use in the management of acute decompensated heart failure. Drugs, 2003, 63, p. 2651–2671.
15. Kivikko, M., Antila, S., Eha, J. et al. Pharmacokinetics of levosimendan and its metabolites during and after a 24 h continuous infusion in patients with severe heart failure. Int. J. Clin. Pharmacol. Ther., 2002, 40, p. 465–471.
16. Follath, F., Cleland, J. G. F., Just, H. et al. Efficacy and safety of intravenous levosimendan compared with dobutamine in severe low-output heart failure (the LIDO study): a randomised double blind study. Lancet, 2002, 360, p. 196–202.
17. Moiseyev, V. S., Poder, P., Andrejevs, N. et al. Safety and efficacy of a novel calcium sensitiser, levosimendan, in patients with left ventricular failure due to an acute myocardial infarction. A randomised, placebo-controlled, double blind study (RUSSLAN). Eur. Heart J., 2002, 23, p. 132–142.
18. Zairis, M. N., Apostolatos, C., Anastassiadis, F. et al. Comparison of the effect of levosimendan, or dobutamin or placebo in chronic low output decompensated heart failure. Calcium Sensitizer or Inotrope or None in low output heart failure (CASINO) study. Eur. J. Heart Fail., 2004, 3, Suppl. 1, 66, abstract 273.
19. Mebazaa, A., Nieminen, M. S., Packer, M., Cohen-Solal, A., Kleber, F. X., Pocock, S. J., Thakkar, R., Padley, R. J., Põder, P., Kivikko, M., SURVIVE Investigators Levosimendan vs dobutamine for patients with acute decompensated heart failure: the SURVIVE Randomized Trial. JAMA, 2007, 297, p. 1883–1891.
20. Yamani, M. H., Haji, S. A., Starling, R. C. et al. Comparison of dobutamine-based and milrinone-based therapy for advanced decompensated congestive heart failure: Hemodynamic efficacy, clinical outcome, and economic impact. Am. Heart J., 2001, 142, p. 998–1002.
21. Guidelines for the diagnosis and treatment of non-ST segment elevation acute coronary syndromes. The Task Force for the Diagnosis and Treatment of Non-ST Segment Elevation Acute Coronary Syndrome of the European Society of Cardiology. Eur. Heart J., 2007, 28, p. 1598–1660.
22. Samama, M. M., Cohen, A. T., Darmon, J. Y. et al. A comparison of enoxaparin with placebo for the prevention of venous thromboembolism in acutely ill medical patients. N. Engl. J. Med., 1999, 341, p. 793–800.
23. deGoma, E. M., Vagelos, R. H., Fowler, M. B. et al. Emerging therapies for the management of decompensated heart failure. J. Am. Coll. Cardiol., 2006, 48, p. 2397–2409.
24. Liesching, T., Kwok, H., Hill, N. S. Acute applications of noninvasive positive pressure ventilation. Chest, 2003, 124, p. 699–713.
25. Peter, J. V., Moran, J. L., Phillips-Hughes, J. et al. Effect of non-invasive positive pressure ventilation (NIPPV) on mortality in patients with acute cardiogenic pulmonary oedema: a meta-analysis. Lancet, 2006, 367, p. 1155–1163.
26. Neuberg, G. W., Miller, A. B., O´Connor, C. M. et al. Diuretic resistance predicts mortality in patients with advanced heart failure. Am. Heart J., 2002, 144, p. 31–38.
27. Bellomo, R., Ronco, C. Continuous haemofiltration in the intensive care unit. Crit. Care, 2000, 4, p. 339–345.
28. Costanzo, M. R., Guglin, M. E., Saltzberg, M. T. et al. For the UNLOAD Trial Investigators. Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure. J. Am. Coll. Cardiol., 2007, 49, p. 675–683.
29. Kettner, J. Mechanické podpory krevního oběhu. Cor. Vasa., 2003, 45, 9, p. 437–443.
30. Kettner, J. Mechanické srdeční podpory u závažného srdečního selhání. Postgrad Med. (mimořádná příloha), 2007, 9, p. 44–50.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Stala se chyba a jak dál?Článek Reaktivita na volumexpanzi a její predikce u nemocných po srdeční zástavě léčených mírnou hypotermiíČlánek Vzdělávací akce IPVZČlánek Vzdělávací akce IPVZČlánek Konference a kongresyČlánek Zdroje na www.csarim.czČlánek Výborová schůze ČSARIMČlánek In memoriam Peter BaskettČlánek UEMS
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2008 Číslo 4- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Šance na postup do elitního klubu – nastal čas na změnu a co pro to musíme udělat?
- Déjà vu, mais pas en anglais aneb jak podpořit náš časopis a zachovat publikační etiku
- Stala se chyba a jak dál?
- Poslední halotanová hepatitida v České republice?
- Reaktivita na volumexpanzi a její predikce u nemocných po srdeční zástavě léčených mírnou hypotermií
- Vzdělávací akce IPVZ
- Akútna intoxikácia teofylínom
- Vzdělávací akce IPVZ
- Akutní diseminovaná encefalomyelitida
- Možnosti antimikrobiální ochrany centrálních žilních katétrů
- Léčba akutního srdečního selhání – přehled
- Počátky anesteziologie na ORL klinice LF UK v Plzni
- Minářovy dny – MUDr. Jiří Minář, CSc.*
- Předběžná statistická data oboru Anesteziologie a resuscitace, Česká republika za rok 2007
- Konference a kongresy
- Nový výukový internetový portál www.akutne.cz
- Novinky v intenzivní medicíně 2007
- Identifikační a slevové karty pro všechny členy ČLS JEP
- Zdroje na www.csarim.cz
- Doporučené postupy a stanoviska ČSARIM na www.csarim.cz
- Výborová schůze ČSARIM
- Informace pro členy společnosti
- Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny
- In memoriam Peter Baskett
- Zápis z jednání výboru 2/2008
- Zápis z jednání výboru 3/2008
- European Board of Intensive Care Medicine Meeting Minutes
- UEMS
- Za prim. MUDr. Oldřichem Markem, Ph.D.
- MUDr. Oldřich Marek, Ph.D., in memoriam
- Poslední vzpomínka na prim. MUDr. Oldřicha Marka, Ph.D.
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní diseminovaná encefalomyelitida
- Možnosti antimikrobiální ochrany centrálních žilních katétrů
- Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny
- Akútna intoxikácia teofylínom
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



