-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Akútna intoxikácia teofylínom
Acute theophylline intoxication – Case report
A case report of acute theophylline overdose in a mentally retarded patient is presented. Due to alterations of consciousness, no relevant data enabling a potential diagnosis of theophylline intoxication could be obtained either from the patient or from his family. Considering methanol and ethylenglycol intoxication, toxicologic analysis was realized, that finally revealed a severe theophylline intoxication, consistent with both clinical and biochemical status. Clinical symptoms and biochemical findings of the patient are then analysed from the pathophysiological point of view. Acute renal failure and septic pulmonary infection occurred as a complication, requiring artificial ventilation and urgent hemodialysis. Patient was transferred to internal department on day 32 in a good clinical condition.
Key words:
theophylline – intoxication – clinical intoxication symptoms – theophylline intoxication therapy
Autoři: Májek Milan 1; Volnárová Alena 2; Hollá Zuzana 3; Lichvárová Ildikó 2; Valaška Pavol 2
Působiště autorů: Klinika anestéziológie a intenzívnej medicíny, NsP akad. L. Dérera, Bratislava 1; Oddelenie anestéziológie a intenzívnej medicíny, Nemocničná, a. s., Malacky 2; Hemodialyzačné oddelenie, Nemocničná a. s., Malacky 3
Vyšlo v časopise: Anest. intenziv. Med., 19, 2008, č. 4, s. 197-202
Kategorie: Intenzivní medicína - Kazuistika
Souhrn
Autori prezentujú prípad akútneho predávkovania teofylínom u psychicky retardovaného pacienta. Vzhľadom k poruche vedomia nebolo možné od pacienta, no ani od jeho rodiny, získať relevantné údaje, na základe ktorých by sa mohla predpokladať potenciálna možnosť otravy teofylínom. Až toxikologická analýza, urobená s cieľom vylúčiť, alebo potvrdiť možnú otravu metanolom alebo etylénglykolom, potvrdila ťažkú otravu teofylínom, ktorej zodpovedal klinický a biochemický obraz. Priebeh otravy sa komplikoval vznikom akútneho obličkového zlyhania a septickým priebehom pľúcnej infekcie vyžadujúcej umelú ventiláciu pľúc a akútnu hemodialyzačnú liečbu. Pacienta po 32 dňoch hospitalizácie preložili na interné oddelenie v dobrom klinickom stave. Autori analyzujú jednotlivé klinické znaky a biochemické nálezy prítomné u prijatého pacienta a uvádzajú ich patofyziologickú podstatu.
Kľúčové slová:
teofylín – intoxikácia – klinický priebeh otravy – liečba intoxikácie teofylínomÚvod
Incidencia intoxikácií teofylínom sa v ostatných rokoch prudko znížila, jednak pretože v liečbe bronchiálnej astmy alebo chronickej obštrukčnej pľúcnej choroby (CHOPCH) došlo k radikálnej zmene farmakologickej liečby z dôvodov častejšej aplikácie inhalačných betamimetík s kortikosteroidami, a jednak pretože pre veľmi úzke terapeutické rozpätie teofylínov sa rapídne znížila ich preskribcia [1]. Práve nízka incidencia ťažkých otráv teofylínmi, ich klinický priebeh, najmä však laboratórne nálezy, ktoré imponujú ako možná dekompenzácia metabolických chorôb (diabetická ketoacidóza), alebo častejšie sa vyskytujúce otravy metanolom alebo etylénglykolom, robia diagnostiku predávkovania teofylínom, najmä pri nedostatku anamnestických údajov, niekedy problematickú. Pri diferenciálnej diagnostike biochemického nálezu zisteného u pacienta pri prijatí do nemocnice to bol práve predpoklad potenciálnej otravy metanolom alebo etylénglykolom, ktorý pomohol pri skríningovom toxikologickom vyšetrení moču a krvi potvrdiť ťažkú otravu teofylínom a začať úspešnú a efektívnu eliminačnú liečbu. Napriek tomu došlo u pacienta k rozvoju komplikácií (bronchopneumónia, akútne oligoanurické obličkové zlyhanie, sepsa, syndróm dysfunkcie orgánových systémov), ktoré determinovali potrebu umelej ventilácie pľúc a akútnej hemodialyzačnej liečby (intermitentná veno-venózna hemodialýza pre intoxikáciu aj pre akútne renálne zlyhanie).
Nízka incidencia otráv teofylínom, výskyt vedľajších účinkov aj pri hladinách teofylínu, ktoré sú v terapeutickom rozsahu, a výskyt vážnych dôsledkov pri predávkovaní sú dôvodmi, prečo by sa na otravu teofylínom malo myslieť, napriek jeho klesajúcej preskribcii, oveľa častejšie.
Kazuistika
Na oddelenie anestéziológie a intenzívnej medicíny okresnej nemocnice vo večerných hodinách prijali ľahko až stredne mentálne retardovaného 57-ročného pacienta, u ktorého sa vzhľadom k jedinému relevantnému a získateľnému anamnestickému údaju o zvracaní 500–700 ml krvavého žalúdkového obsahu, určila pracovná diagnóza hypovolemického šoku. Po získaní prvých laboratórnych výsledkov sme však s touto diagnózou ďalej nepracovali.
Pri objektívnom vyšetrení bol pacient bledý, schvátený, dezorientovaný a somnolentný. Vedomie sa hodnotilo podľa Glasgow Coma Scale stupňom 10. Hodnoty krvného tlaku (TK) boli: 90/60 torr, pulz: 190/min. (supraventrikulárna tachykardia), frekvencia dýchania 28/min. (Kussmaulovo dýchanie). Orientačným vyšetrením centrálneho nervového systému sa zistila reakcia na verbálne podnety, no komunikácia nebola možná a reakcie boli neadekvátne. Zrenice mal pacient izokorické, ľahko mydriatické so spomalenou odpoveďou na svetlo. Na jazyku a slizniciach v dutine ústnej boli prítomné pozostatky po zvratkoch, ktoré mali charakter „natrávenej krvi – kávových usadenín“.
Bezprostredne po prijatí sa pacientovi zabezpečil vnútrožilový prístup, zaviedli sa artériový katéter do a. radialis, nazogastrická sonda a močový katéter. Odobral sa biologický materiál na laboratórne a toxikologické vyšetrenia; pri orientačnom vyšetrení moču labstixovou metódou (Penta Phan, Lachema Diagnostika) bol nález: glukóza: ++, bielkoviny: +, hemoglobín: +++, ketóny: +.
Analýza krvných plynov a acidobázickej rovnováhy metódou podľa Astrupa potvrdila prítomnosť ťažkej metabolickej acidózy: pH = 7,175; paCO2: 1,43 kPa; paO2: 23,02 kPa; HCO3: 3,8 mmol . l-1; BE: -21,7 mmol . l-1. Saturácia hemoglobínu kyslíkom sledovaná pulzovou oxymetriou bola 98%, pri spontánnom dýchaní a kyslíkovej liečbe maskou s FiO2: 0,35. Pri vyšetrení krvného obrazu sme nezaznamenali výsledky, ktoré by mohli potvrdiť krvácanie do zažívacieho traktu; vzhľad žalúdkového obsahu, hoci pripomínal prímes krvi, nebol spôsobený krvácaním, pretože hodnota erytrocytov bola 4,5 . 1012. l-1, hemoglobín: 146 g . l-1, hematokrit bol 0,46 a trombocyty: 247 000. Ani realizovaná gastrofibroskopia neodhalila aktívne krvácanie z horných častí zažívacieho traktu (vybrané biochemické výsledky uvádza tabuľka 1).
Tab. 1. Hodnoty vybraných laboratórnych parametrov pri prijatí 
Vzhľadom k podmienkam a špecifikám práce v malej nemocnici sme materiál na toxikologické vyšetrenie mohli odoslať až nasledujúci deň ráno a jeho výsledky sme získali približne 12 hodín po prijatí do nemocnice. U pacienta však v raňajších hodinách vznikli tonicko-klonické kŕče, ktoré sme riešili analgosedáciou, so zabezpečením dýchacích ciest orotracheálnou intubáciou a umelou ventiláciou pľúc. Vyšetrenia na metanol, etylénglykol a tricyklické antidepresíva boli negatívne. Toxikologické vyšetrenie však potvrdilo prítomnosť masívneho množstva teofylínu v moči a vysoké hladiny v krvi, 6-násobne presahujúce maximálnu terapeutickú hladinu. Koncentrácia teofylínu v krvi bola 119 µg . ml-1.
Bezprostredne po získaní tejto informácie sa indikovala 3 hodiny trvajúca hemodialýza, po ktorej sa znížila hodnota teofylínu na 13,3 µg . ml-1. V hemodialýze sme však museli pokračovať aj po normalizácii hladín teofylínu, a to pre rozvoj akútneho oligo-anurického obličkového zlyhania. Hemodialyzačná liečba sa aplikovala až do 23. dňa hospitalizácie. V umelej ventilácii pľúc sme museli pokračovať, pretože u pacienta došlo k vzniku zápalových pľúcnych komplikácií, ktoré v teréne chronickej pľúcnej choroby vyústili do septického priebehu a syndrómu dysfunkcie viacerých orgánových systémov. Vznik infekčných komplikácií potvrdzoval aj priebeh markerov bakteriálneho zápalu (CRP), ktorého vysokú hodnotu sme zaznamenali už druhý deň po prijatí pacienta na OAIM (tab. 2). Cielenou antibiotickou liečbou sa pľúcne infekčné komplikácie zvládli a po skončení hemodialyzačnej liečby, na 23. deň hospitalizácie, sme začali pacienta odpájať z umelej ventilácie pľúc.
Tab. 2. Klinické a laboratórne znaky a príznaky pri akútnej otrave teofylínom 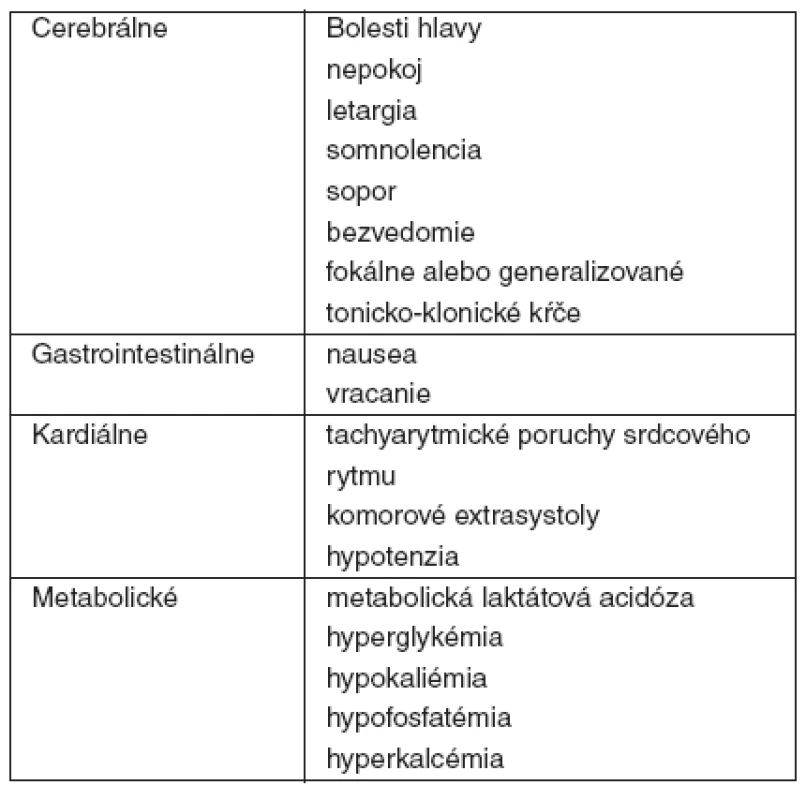
Pacienta sme po 32 dňoch hospitalizácie na OAIM preložili na interné oddelenie.
Diskusia
Pri intoxikácii teofylínom frekvencia výskytu a závažnosť cerebrálnych, kardiálnych, metabolických a gastrointestinálnych nálezov koreluje s jeho sérovými koncentráciami [2]. Väčšia časť klinickej symptomatológie a biochemických nálezov je dôsledkom inhibície fosfodiestérazových enzýmov (PDE), beta-adrenergnej stimulácie a priamej stimulácie centrálneho nervového systému [3] – tabuľka 3.
Tab. 3. Priebeh hodnôt vybraných laboratórnych parametrov 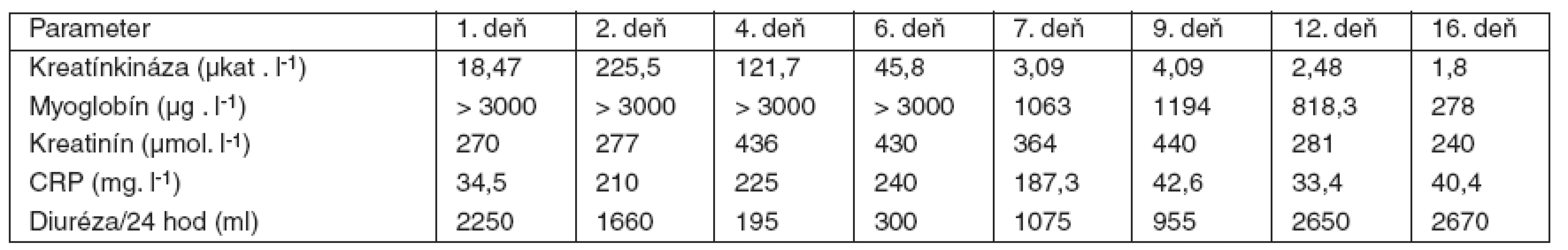
Medzi gastrointestinálnymi príznakmi sa pravidelne vyskytuje nausea, vracanie a niekedy sa stav pre vzhľad žalúdkového obsahu považuje za hematemézu [4]. Práve údaj o vracaní 500–700 ml krvavého žalúdkového obsahu bol dôvodom privolania rýchlej lekárskej pomoci k pacientovi s jeho následným transportom do nemocnice a prijatím na OAIM.
Klinický obraz a laboratórne nálezy nie sú pri otrave teofylínmi špecifické a bez anamnézy a bez toxikologického vyšetrenia robia diferenciálnu diagnostiku, najmä v podmienkach malej nemocnice, značne problematickú. Vzhľadom k mentálnej retardácii pacienta a stavu jeho vedomia pri prijatí, ako aj k sociálnym podmienkam, sme nemohli nájsť žiadny relevantný údaj, ktorý by poukazoval na predávkovanie teofylínu. Aj informáciu o chronickej liečbe teofylínom z dôvodov chronického pľúcneho ochorenia sa nám podarilo získať až oveľa neskôr.
U pacienta sme zaznamenali ťažkú metabolickú acidózu, ktorá sa pri otrave teofylínom vyskytuje aj pri klinicky zdanlivo adekvátnej perfúzii tkanív, no aj pri chýbaní alebo len pri minimálnej generalizovanej kŕčovej aktivite. Predpoklad potenciálnej otravy metanolom alebo etylénglykolom, ktoré sme zvažovali na základe biochemických nálezov, pomohol pri skríningovom toxikologickom vyšetrení moču a krvi potvrdiť ťažkú otravu teofylínom. V prípade požitia alebo vypitia látok, pri ktorých z dôvodov ich chemického zloženia a metabolizmu v organizme (napr. metanol alebo etylénglykol) vzniká metabolická acidóza pravidelne, sa hľadanie jej príčin musí urobiť razantne, nielen z hľadiska eliminačnej liečby noxy a odstránenia jej vyvolávajúcej príčiny, ale aj z hľadiska riešenia metabolickej acidózy samotnej. U pacienta sme približne o 8 hodín po prijatí, pri nepoznanom výsledku toxikologického vyšetrenia zaznamenali výskyt tonicko-klonických generalizovaných kŕčov, ktoré sme riešili kontinuálnou analgosedáciou. Umelú ventiláciu pľúc sme indikovali aj pre výraznú hypokapniu pri hyperventilácii, potenciálne ohrozujúcu cerebrálnu perfúziu (paCO2: 1,43 kPa = 10,8 torr).
Nebezpečenstvo potencovala aj prítomnosť kombinovanej poruchy acidobázickej rovnováhy, lebo PaCO2 nezodpovedal kompenzácii metabolickej acidózy. Pri výpočte vzťahu PaCO2 k HCO3 (podľa Dzúrika) bol meraný PaCO2 podstatne nižší, ako mal byť pri kompenzácii len metabolickej acidózy [5]. Dzúrik pre výpočet vzťahu PaCO2 a HCO3 používa vzorec:
Δ PaCO2 = 0,16 . ΔHCO3- ± 0,2.
Podľa tohto prístupu by u nášho pacienta zodpovedal kompenzovanému stavu metabolickej acidózy a zmeranej hodnote HCO3 výsledok PaCO2: 3,23 kPa, no v skutočnosti bola prítomná veľká nezhoda medzi vypočítaným a zmeraným PaCO2, ktorý bol 1,43 kPa. Porucha acidobázickej rovnováhy prítomná u nášho pacienta bola kombináciou metabolickej acidózy a respiračnej alkalózy. Respiračná alkalóza vznikla ako dôsledok stimulácie centrálneho nervového systému teofylínom a ventilačnej stimulácie zvýšenými hladinami katecholamínov, ktoré sa pri otrave teofylínom zvyšujú [6].
Sme toho názoru, že kŕčová aktivita v prednemocničnom období mohla byť prítomná, no v literárnych zdrojoch opisovanú komplikáciu pri predávkovaní teofylínu – rabdomyolýzu – vylúčiť nemôžeme [7]. Nález postupne sa zvyšujúcich hodnôt kreatínkinázy podporuje tieto predpoklady a rabdomyolýza mohla tiež prispievať k vzniku metabolickej laktátovej acidózy. Akútne oligo-anurické obličkové zlyhanie bolo s veľmi vysokou pravdepodobnosťou kombinovanej genézy a vyvinulo sa následkom hemodynamickej depresie srdcovo-cievneho systému a mechanickej obštrukcie renálnych tubulov strómou myoglobínu. Vysoká hodnota myoglobínu viac ako 3000 µg . l-1, ktorú sme zaznamenali až do 7. dňa po prijatí, mohla pri ťažkej rabdomyolýze pretrvávať a takto sa podieľať na vzniku akútneho obličkového zlyhania.
V diskusii o príčinách metabolickej acidózy pri otrave teofylínom sú v odbornej literatúre publikované rôzne názory [8, 9]. Často prevláda názor, že pokiaľ nie je predávkovanie sprevádzané hypoxémiou, šokom alebo prolongovanými kŕčmi, acidóza nebude klinicky významná alebo nesúvisí s pôsobením teofylínu. Hoci u pacienta bola prítomná hemodynamická kompromitácia, sme toho názoru, že vzhľadom k jej stupňu nebola samotná príčinou metabolickej laktátovej acidózy typu A. Na analýzu príčin metabolickej acidózy sa môže použiť známa Cohenova klasifikácia [9] zo 70. rokov 20. storočia, no teofylín, respektive jeho predávkovanie, sa medzi príčinami v skupine metabolických acidóz B1 podľa Cohenovej klasifikácie neuvádza (tab. 4).
Tab. 4. Cohenova a Woodova klasifikácia metabolickej acidózy [14] ![Cohenova a Woodova klasifikácia metabolickej acidózy [14]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b1da51d848bbc670a8d194577cb57ec3.png)
Sme toho názoru, že pri predávkovaní teofylínom má metabolická acidóza kombinovanú genézu typu A a typu B2. Extrémna tachykardia zaznamenaná u pacienta pri prijatí (190 pulzov/min) však musela kompromitovať minútový objem srdca, pokles ktorého síce mohol byť kompenzovaný zvýšenými hodnotami adrenalínu a noradrenalínu, no za cenu prevažujúceho alfa-adrenergného stimulačného účinku s následnou periférnou vazokonstrikciou, čím sa vytvorili podmienky pre vznik anaerobeného metabolizmu. U pacienta sme nemali možnosť sledovať hemodynamické ukazovatele invazívnym prístupom, čo by prípadne mohlo odhaliť klinicky nepostrehnuteľný pokles perfúzie tkanív. Laktátová acidóza typu A však nemusí mať genézu len v hemodynamickej kompromitácii srdcovo-cievneho systému [9].
Pri analýze biochemických nálezov po prijatí a pri nedostatočných a nezískateľných anamnestických údajoch sme nemohli jednoznačne vylúčiť ani metabolickú príčinu acidózy vyskytujúcej sa pri dekompezácii diabetes mellitus s rozvojom ketoacidózy [8], hoci minimálny nález ketolátok v moči zvádza k úvahe, že acidóza nemohla mať pri takomto náleze pôvod v ketoacidóze. Práve nízka hodnota ketolátok pri vyšetrení moča labstixovou metódou býva nálezom pri diabetickej ketoacidóze v štádiu, ktoré charakterizuje ťažký deficit intracelulárnej a extracelulárnej tekutiny a závažná hemodynamická kompromitácia a hypoperfúza periférnych tkanív s prevahou anaeróbneho metabolizmu. Dostatok vodíkových iónov zo vznikajúcej kyseliny mliečnej je príčinou transformácie kyseliny acetooctovej (AcAc) na kyselinu beta-hydroxymaslovú (BOHB) a zvrátenia pomeru týchto dvoch zlúčenín v prospech kyseliny beta-hydroxymaslovej. Vyšetrenie moču labstixovou metódou na prítomnosť ketolátok je založené na reakcii kyseliny acetooctovej s nitroprussidom sodným obsiahnutým v prúžku na zistenie prítomnosti ketolátok. Kyselina beta-hydroxymaslová s nitroprusidom sodným nereaguje, preto pri nízkom pomere AcAc/BOHB je nález ketolátok v moči relatívne nízky, čo môže zmeniť diagnostické úvahy pri nie celkom známych príčinách metabolickej acidózy, lebo aj hodnota kyseliny mliečnej bude v tomto štádiu závažnej dekompenzácie diabetes mellitus zvýšená.
Predpokladané zvýšené hodnoty katecholamínov samotných sa mohli tiež určitým stupňom podieľať na metabolickej acidóze rovnakým mechanizmom ako pri feochromocytóme [10] (B1 – laktátová acidóza alebo po infúzii adrenalínu B2 – typ laktátovej acidózy). Zvýšené hodnoty katecholamínov sa môžu na laktátovej metabolickej acidóze podieľať 4 faktormi:
- Spôsobia vazokonstrikciu v periférnych tkanivách s následným znížením dodávky kyslíka, čo klinicky vôbec nemusí byť detekovateľné.
- Môže dochádzať k určitému stupňu myokardiálnej dysfunkcie pre katecholamínami indukovanú ischémiu.
- Zmeny metabolizmu glukózy následkom zvýšenia glukoneogenézy, ktorá je hlavným zdrojom pozorovanej hyperglykémie, môžu časť glukózy presmerovať do glykolytických metabolických ciest obchádzajúcich Krebsov cyklus.
- Zmeny v perfúzii pečene pri hemodynamickej kompromitácii môžu byť príčinou zníženej klírens kyseliny mliečnej.
Beta-adrenergne sprostredkované účinky katecholamínov sa môžu potencovať teofylínom indukovanou inhibíciu fosfodiesteráz, čo môže byť pre vznik klinických prejavoch pri intoxikácii rozhodujúce [12]. Sme toho názoru, že akútna teofilínová intoxikácia vyvoláva stav nekontrolovanej beta-adrenergnej stimulácie, ktorá prispieva aspoň z časti ku klinickým a toxickým prejavom vrátane porúch srdcového rytmu, hypotenzii, tremoru, kŕčom, agitovanosti a k metabolickým poruchám. Okrem toho zvýšené hladiny katecholamínov pri teofylínovej intoxikácii stimulujú glykogenolýzu v pečeni a vo svaloch na zabezpečenie dostatočného množstva energetického substrátu pre bunky a sú príčinou pozorovanej hyperglykémie [11].
Pri ťažkej akútnej intoxikácii teofylínom je hypokaliemia, napriek prítomnosti potentných stimulov (metabolická acidóza, pokles minútového objemu srdca a pokles diurézy) zvyšujúcich hladinu draslíka v extracelulárnej tekutine, takmer patognomickým nálezom. Rovnováhu draslíka vo fyziologickom rozsahu medzi intra - a extracelulárnou tekutinou reguluje v čase ohraničenom minútami, okrem iných (inzulín, koncentrácia bikarbonátu) aj koncentrácia a aktivita beta-adrenergných agonistov. Beta-adrenergná stimulácia v stresovej situácii síce indukuje hyperkaliemiu spôsobenú masívnym presunom kália z intracelulárneho priestoru hepatálnych buniek do extracelulárneho prostredia, pri masívnej glykogenolýze prostredníctvom stimulácie beta-2-receptorov. Táto hyperkaliemia je však prechodná, často pri prijatí pacienta intoxikovaného teofylínom už nedetekovateľná a vystriedaná prolongovanou hypokaliemiou. Stimulácia beta--2-receptorov aktivuje adenylcyklázu a sodík-draslík ATP-ázu, čo spolu s vysokou koncentráciou cAMP ako sekundárneho prenášača adrenergného signálu pri inhibícii PDE teofylínom spôsobuje výrazný presun kália do intracelulárneho priestoru. Tieto mechanizmy znižujú koncentráciu kália v ECT, čo pri intoxikáciach teofylínom prispieva k tachyarytmickým poruchám srdcového rytmu.
Pokles krvného tlaku spôsobený tachykardickými poruchami srdcového rytmu sa po spomalení srdcovej frekvencie obvykle upravuje. Ak sa však pri rozvoji hypotenzie uplatňujú aj iné faktory, spomalenie srdcovej frekvencie nemusí hypotenziu odstrániť. Hoci pri otrave teofylínom sa opakovane dokázala prítomnosť zvýšených hodnôt katecholamínov [6], pretrvávanie hypotenzie aj po spomalení srdcovej frekvencie u nášho pacienta ukazuje, že príčinou hypotenzie bolo viac etiologických faktorov, s rozhodujúcou poruchou regulácie periférneho vazomotorického tonusu. Teofylín samotný má vazodilatačné vlastnosti a v patogenéze teofylínovej hypotenzie sa budú uplatňovať zvýšené koncentrácie cAMP. Zdá sa preto, že hypotenzný efekt teofylínu vznikajúci v dôsledku beta-adrenergnej hyperreaktivity je potencovaný zvýšenou koncentráciou cAMP s následnou relaxáciou hladkého svalstva arteriolárneho riečiska.
Uvedomujúc si tieto možné mechanizmy pri vzniku hypotenzie, nebude prekvapujúce, že liečba teofylínovej hypotenzie konvenčnými sympatikomimetickými katecholamínami nebude efektívna. Podanie preparátov s beta-mimetickými vlastnosťami môže dokonca exacerbovať alebo prehĺbiť prítomnú hypotenziu. Okrem toho tieto sympatikomimetické látky agravujú toxické účinky teofylínu vrátane tachykardických porúch srdcového rytmu. Nie je preto prekvapujúce, že podanie blokátorov beta-sympatikových receptorov môže mnohé príznaky teofylínom indukované odstrániť. Je však diskutabilné a problematické ich podanie u pacientov, ktorý majú astmu, no v prípadoch ťažkých intoxikácii s vysokými hladinami teofylínu a pri extrémne vyznačenej klinickej symptomatológie teofylínovej otravy s ťažkým narušením orgánových život ohrozujúcich funkcií, ich podanie možno považovať za indikované.
Teofylín sa v organizme eliminuje biotraformáciou v pečeni na zlúčeniny, ktoré sa vylúčia obličkami. Je súčasne dobre hemodialyzovateľný a rovnako účinná je aj hemoperfúzia [4]. V minulosti boli indikácie na extrakorporálnu eliminačnú liečbu nasledujúce:
- koncentrácia teofylínu vyššia ako 80–100 µg . ml-1 pri akútnej intoxikácii,
- koncentrácia teofylínu viac ako 40–50 µg . ml-1 pri chronickom predávkovaní,
- opakované kŕče alebo arytmie bez ohľadu na koncentráciu teofylínu [13].
V období posledných 20 rokov sa na základe záverov klinických a výskumných štúdií pôvodný protokol zmenil s odporúčaním v taktike liečby použiť 4 signifikantné zmeny:
- Kritéria na hemodialýzu alebo hemoperfúziu sa vo vzťahu k veku pacienta zmenili tak, že sú indikované u pacientov starších ako 60–65 rokov bez ohľadu na koncentrácie teofylínu.
- Hemodialýza sa považuje za rovnocennú eliminačnú metódu s hemoperfúziou.
- Liekom voľby na zvládnutie kŕčových aktivít sú benzodiazepíny, ktoré sú vhodnejšie ako fenytoin.
- Na liečbu supraventikulárnych tachyarytmických porúch je indikované použiť adenozín [13].
Záver
Intoxikácia teofylínom môže v podmienkach malých nemocníc predstavovať zložitý diferenciálne diagnostický problém, najmä pri chýbaní akýchkoľvek anamnestických údajov. Klinický a biochemický obraz nie je špecifický, no hyperglykémia, hypokaliemia a najmä metabolická acidóza sú nálezy, ktoré majú iniciovať úvahy o možnej intoxikácii jedmi, ktoré pre svoje chemické zloženie a metabolizmus vyvolávajú v organizme metabolickú acidózu. Toxikologické vyšetrenie, ktoré je v týchto prípadoch jednoznačne indikované, obvykle odhalí príčinu, biochemických nálezov a klinického obrazu. Kľúčovými v liečbe teofylínovej intoxikácie sú zvládnutie a odstránenie generalizovaných kŕčov, v prípade potreby hlbokou analgosedáciou a umelou ventiláciou pľúc, postupy zamerané na odstránenie a prevenciu porúch srdcového rytmu a elimináciu jedu s takým skorým začiatkom, ako je to možné, hemodialýzou a/alebo hemoperfúziou.
Došlo 20. 3. 2008.
Přijato 12. 6. 2008.
Adresa pre korešpondenciu:
Doc. MUDr. Milan Májek, CSc.
Klinika anestéziológie a intenzívnej medicíny
NsP akad. L. Dérera
Limbová 5
83305 Bratislava
Slovenská republika
e-mail: majek@stonline.sk,
majek@rohozniksk.net
Zdroje
1. Reilly, T. H., Holstege, C. P. Toxicity, Theophylline. August 2006. Dostupné na: www.emedicine.com/ped/topic2725.
2. Dawson, A. H., Whyte, I. M. The assessment and treatment of theophylline poisoning. Med. J., 1989, 151, p. 689–693.
3. Shannon, M. Predictors of major toxicity after theophylline overdose. Ann. Intern. Med., 1993, 119, p. 1161–1167.
4. Anderson, W., Youl, B., Mackay, I. R. Acute theophylline intoxication. Ann. Emerg. Med., 1991, 20, p. 1143–1145.
5. Dzúrik, R., Dzúriková, V., Fedelešová,V. Poruchy vnútorného prostredia. Osveta : Martin 1984, 253 s.
6. Shannon, M. Hypokaliemia, hyperglykemia and plasma catecholamine activity after severe theophylline intoxication. Clin. Toxikol., 1994, 32, p. 41–47.
7. Teweleit, S., Hippius, M., Pfeifer, R., Hoffmann, A. Rhabdomyolysis as a rare complication of theophylline poisoning. Medizinische Klinik (Munich, Germany), 2001, 96, p. 40–44.
8. Charyton, D., Jansen., K. Severe metabolic complications from theophylline intoxication. Nephrology (Carlton), 2003, 8, p. 239–242.
9. Bernard, S. Severe lactic acidosis following theophylline overdose. Ann. Emerg. Med., 1991, 20, p. 1135–1137.
10. Madias, N. E., Goorno, W. E., Herson, S. Severe lactic acidosis as a presenting feature of pheochromocytoma. Am. J. Kidney Dis., 1987, 102, p. 250–253.
11. Kearney, T. E., Ziegler, M. G. Theophylline toxicity and the beta-adrenergic system. Ann. Intern. Med., 1985, 102, p. 766–769.
12. Moss, J., Glick, D. The autonomic nervous system. In: Miller, R. D. Miller’s anesthesia. Philadephia: Elsevier Churchil Livingstone, 2005, p. 617–677. ISBN 9997629035.
13. Shannon, M. Life-threating events after theofylline overdose. A 10-year prospective analysis. Arch. Intern. Med., 1999, 159, p. 989–994.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Stala se chyba a jak dál?Článek Reaktivita na volumexpanzi a její predikce u nemocných po srdeční zástavě léčených mírnou hypotermiíČlánek Vzdělávací akce IPVZČlánek Konference a kongresyČlánek Zdroje na www.csarim.czČlánek Výborová schůze ČSARIMČlánek In memoriam Peter BaskettČlánek UEMSČlánek Vzdělávací akce IPVZ
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2008 Číslo 4- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Jak souvisí postcovidový syndrom s poškozením mozku?
- Léčba akutní pooperační bolesti z pohledu ortopeda
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
-
Všechny články tohoto čísla
- Šance na postup do elitního klubu – nastal čas na změnu a co pro to musíme udělat?
- Déjà vu, mais pas en anglais aneb jak podpořit náš časopis a zachovat publikační etiku
- Stala se chyba a jak dál?
- Poslední halotanová hepatitida v České republice?
- Reaktivita na volumexpanzi a její predikce u nemocných po srdeční zástavě léčených mírnou hypotermií
- Vzdělávací akce IPVZ
- Akútna intoxikácia teofylínom
- Vzdělávací akce IPVZ
- Akutní diseminovaná encefalomyelitida
- Možnosti antimikrobiální ochrany centrálních žilních katétrů
- Léčba akutního srdečního selhání – přehled
- Počátky anesteziologie na ORL klinice LF UK v Plzni
- Minářovy dny – MUDr. Jiří Minář, CSc.*
- Předběžná statistická data oboru Anesteziologie a resuscitace, Česká republika za rok 2007
- Konference a kongresy
- Nový výukový internetový portál www.akutne.cz
- Novinky v intenzivní medicíně 2007
- Identifikační a slevové karty pro všechny členy ČLS JEP
- Zdroje na www.csarim.cz
- Doporučené postupy a stanoviska ČSARIM na www.csarim.cz
- Výborová schůze ČSARIM
- Informace pro členy společnosti
- Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny
- In memoriam Peter Baskett
- Zápis z jednání výboru 2/2008
- Zápis z jednání výboru 3/2008
- European Board of Intensive Care Medicine Meeting Minutes
- UEMS
- Za prim. MUDr. Oldřichem Markem, Ph.D.
- MUDr. Oldřich Marek, Ph.D., in memoriam
- Poslední vzpomínka na prim. MUDr. Oldřicha Marka, Ph.D.
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní diseminovaná encefalomyelitida
- Možnosti antimikrobiální ochrany centrálních žilních katétrů
- Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny
- Akútna intoxikácia teofylínom
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



