-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Reaktivita na volumexpanzi a její predikce u nemocných po srdeční zástavě léčených mírnou hypotermií
Volume responsivness and its predictability in cardiac arrest survivors treated by mild hypothermia (MH)
Objective:
To assess whether cardiac arrest survivors treated by MH with low cardiac index (CI) respond to volumexpansion. To assess whether respiratory variability of maximal aortic valve blood flow (ΔVmaxao) and velocity time integral of aortic valve blood flow (ΔVTIao) predict fluid responsiveness (increase of CI of >15%).Design:
Prospective observational study.Setting:
Emergency Medical Service, Cardiovascular Medicine Department, University Hospital.Material and Method:
We investigated 10 consecutive cardiac arrest survivors treated by MH, with CI of < 2.5 l/min/m2. CI, ΔVmaxao and ΔVTIao were measured by transthoracic echocardiography after stabilization of body temperature in the range of 32–34 °C. This was followed by rapid administration of normal saline (8 ml/kg) and the second measurement.Results:
Volumexpansion was followed by CI increase in 8 patients (from 1.86 ± 0.36 to 2.69 ± 0.53 l/min/m2, p = 0,003, responders) while in 2 subjects was not (non-responders). The values of ΔVmaxao (25.6 ± 4.8 vs. 4.2 ± 3.4 %, p < 0.001) and ΔVTIao (35.6 ± 4.3 vs. 4.1 ± 0.8%, p < 0,001) before volumexpansion were higher in responders than in non-responders. In responders, it decreased after volumexpansion (ΔVmaxao: to 6.9 ± 3.6%, ΔVTIao: to 7.0 ± 3.5%, p < 0,001) while in non-responders not. The baseline values of ΔVmaxao (r = 0.588, p = 0.003) and ΔVTIao (r = 0.552, p = 0.003) correlated with further increase of CI.Conclusion:
Majority of MH treated cardiac arrest survivors with low CI in our set responded to volumexpansion. High values of ΔVmaxao and ΔΔVTIao predicted fluid responsiveness, low values fluid unresponsiveness.Key words:
cardiac arrests, mild hypothermia, fluid responsiveness
Autoři: Škulec Roman 1; Linhart Aleš 2
Působiště autorů: Záchranná služba Středočeského kraje, stanoviště Beroun 1; II. interní klinika kardiologie a angiologie, Všeobecná fakultní nemocnice, Praha 2
Vyšlo v časopise: Anest. intenziv. Med., 19, 2008, č. 4, s. 190-196
Kategorie: Intenzivní medicína - Původní práce
Souhrn
Cíl studie:
Zhodnotit, zda nemocní po srdeční zástavě léčení MH s nízkým srdečním indexem (CI) příznivě reagují na volumexpanzi. Posoudit, zda respirační variabilita maximální rychlosti průtoku krve aortální chlopní (ΔVmaxao) a respirační variabilita integrálu rychlosti proudění krve aortální chlopní (ΔVTIao) predikují reaktivitu na volumexpanzi (klinicky relevantní nárůst CI o > 15 %).Typ studie:
Prospektivní observační studie.Název a místo pracoviště:
Územní středisko Záchranné služby, Interní klinika VFN Praha.Materiál a metoda:
Vyšetřili jsme celkem deset konsekutivních pacientů po srdeční zástavě léčených MH s CI < 2,5 l . min⁻¹. m⁻². Po ekvilibrizaci tělesné teploty v rozmezí 32–34 °C byly transtorakální echokardiografií stanoveny CI, ΔVmaxao a ΔΔVTIao. Po rychlé volumexpanzi fyziologickým roztokem v dávce 8 ml . kg⁻¹ byla měření opakována.Výsledky:
U 8 pacientů došlo k nárůstu CI (z 1,86 ± 0,36 na 2,69 ± 0,53 l . min⁻¹ . m⁻², p = 0,003, respondéři), u dvou ne (non-respondéři). U respondérů byly hodnoty ΔVmaxao (25,6 ± 4,8 vs 4,2 ± 3,4 %, p < 0,001) a ΔVTIao (35,6 ± 4,3 vs 4,1 ± 0,8 %, p < 0,001) před volumexpanzí výrazně vyšší než u non-respondérů. Po volumexpanzi došlo u respondérů k jejich poklesu (ΔVmaxao: na 6,9 ± 3,6 %, ΔVTIao: na 7,0 ± 3,5 %, p < 0,001), u non-respondérů se nezměnily. Absolutní hodnoty ΔVmaxao (r = 0,588, p = 0,003) a ΔVTIao (r = 0,552, p = 0,003) před volumexpanzí korelovaly s nárůstem CI po volumexpanzi.Závěr:
Většina nemocných po srdeční zástavě léčených MH a s nízkým CI v našem souboru příznivě reagovala na volumexpanzi. Vysoké hodnoty ΔVmaxao a ΔΔVTIao predikovaly reaktivitu na volumexpanzi, nízké hodnoty areaktivitu na volumexpanzi.Klíčová slova:
srdeční zástava – mírná hypotermie – reaktivita na volumexpanziÚvod
Srdeční zástava s úspěšnou neodkladnou resuscitací je závažná náhlá situace bezprostředně ovlivňující nejenom kardiovaskulární systém, ale i další orgány. Mezi základní cíle v časné poresuscitační péči patří udržení dostatečného krevního tlaku a srdečního výdeje k zajištění optimální perfuze mozku. Hemodynamika je však většinou alterovaná zejména poresuscitační myokardiální dysfunkcí a celotělovým ischemicko-reperfuzním syndromem [1, 2, 3]. Na oběhových změnách se může podílet i terapeutická mírná hypotermie (MH) [4]. V této složité situaci často není lehké správně posoudit, zda má být pacient léčen podáním tekutin, inotropní a/nebo vazopresorickou podporou či dokonce pomocí mechanické srdeční podpory. Volumexpanze je první volbou v terapii akutního oběhového selhání u kriticky nemocných. Z těchto pacientů však pouze někteří zareagují klinicky relevantním zvýšením srdečního výdeje [5]. V poslední době byly identifikovány dynamické parametry, které s vysokou senzitivitou a specificitou predikují reaktivitu na volumexpanzi (RNV) u uměle ventilovaných septických pacientů, kriticky nemocných i u spontánně ventilujících zdravých dobrovolníků [6–9]. Není známo, zda je možné tyto parametry využít i u nemocných s akutním selháním cirkulace po srdeční zástavě léčených mírnou hypotermií. Proto jsme se rozhodli zhodnotit, zda pacienti po srdeční zástavě s nízkým srdečním výdejem léčení MH příznivě reagují na volumexpanzi a zda tuto příznivou reakci predikuje respirační variabilita průtoku krve aortální chlopní.
Soubor pacientů a metoda
Definice souboru, protokol mírné hypotermie
Do studie jsme konsekutivně zařadili 10 nemocných po srdeční zástavě léčených mírnou hypotermií na Koronární jednotce (KJ) II. interní kliniky kardiologie a angiologie VFN Praha, kteří splňovali zařazovací kritéria. Všichni pacienti byli iniciálně oběhově stabilizováni, udržováni v hluboké analgosedaci kontinuální infuzí midazolamu a fentanylu a relaxováni pipekuroniem nebo pankuroniem. Během MH byla každému pacientovi aplikována kontinuální infuze hořčíku (4 g/24 hodin). Glykémie byla udržována v rozmezí 4–7 mmol-1. V terapii jsme respektovali doporučené hemodynamické cíle po srdeční zástavě [10]. Každý nemocný měl zavedený centrální žilní katétr a arteriální katétr. Swan-Ganzův katétr byl zaváděn podle potřeby. Rutinní kontinuální monitorování u všech pacientů sestávalo ze sledování EKG, tepové frekvence (TF), saturace O2 (satO2), koncentrace CO2 ve vydechovaném vzduchu (EtCO2), přímo měřeného arteriálního krevního tlaku, centrálního žilního tlaku (CVP) a tělesné teploty (TT). Tělesná teplota byla u všech nemocných kontinuálně monitorována pomocí rektálního čidla. U některých pacientů byla navíc měřena i tympanicky a/nebo Swan-Ganzovým katétrem.
Terapeutická mírná hypotermie byla indikována a realizována v souladu s platnými doporučeními [11, 12]. Oběhově nestabilní pacienti (splňující kritéria kardiogenního šoku podle Evropských doporučení pro diagnostiku a léčbu akutního srdečního selhání) nebyli automaticky vyloučeni z ošetření MH [13]. Pacienti byli ochlazeni co nejrychleji na cílovou TT 33 °C pomocí povrchového chlazení ledovými obklady a rychlou nitrožilní infuzí fyziologického roztoku o teplotě 4 °C v dávce 16 ± 5 ml . kg-1. Následně byla TT 32 až 34 °C udržována po dobu 12–24 hodin. Poté byli nemocní ponecháni pasivnímu ohřátí na 36 °C a udržováni v normotermii po dobu dalších 48 hodin [12].
Echokardiografie
Transtorakální echokardiografické vyšetření bylo prováděno ve standardní apikální čtyřdutinové projekci (A4C), apikální pětidutinové projekci (A5C) a parasternální projekci v dlouhé ose (PLAX). Měření jsme prováděli přístrojem Toshiba Corevision (Tokio, Japonsko). Měřené parametry byly nejvyšší (Vmaxaomax) a nejnižší (Vmaxaomin) hodnota maximálního průtoku krve aortální chlopní během respiračního cyklu, nejvyšší (VTIaomax) a nejnižší (VTIaomin) hodnota integrálu rychlosti průtoku krve aortální chlopní v čase během respiračního cyklu (měřené kontinuální dopplerovskou metodou v A5C), nejvyšší (VTIlvotmax) a nejnižší (VTIlvotmin) hodnota integrálu rychlosti průtoku krve výtokovým traktem levé komory během respiračního cyklu (měřené pulzní dopplerovskou metodou v A5C), průměr výtokového traktu levé komory (Dlvot) měřený M-módem v PLAX a diastolický (LKd) a systolický (LKs) rozměr levé komory M-módem v PLAX. Hodnota každého parametru byla stanovena třikrát ve třech po sobě jdoucích respiračních cyklech a zprůměrována pro další analýzu. Záznam byl nahráván na videokazetu a sledované parametry byly kalkulovány až po ukončení protokolu. Respirační variabilita maximální rychlosti proudění krve aortální chlopní (ΔVmaxao) byla vypočtena podle vzorce:
((Vmaxaomax – Vmaxaomin) /
(Vmaxaomax + Vmaxaomin) /2)) . 100
Analogicky, respirační variabilita integrálu rychlosti průtoku krve aortální chlopní (ΔVTIao) byla stanovena [14, 15] podle vzorce:
((VTIaomax – VTIaomin) / (VTIaomax + VTIaomin)/2)) . 100
Tepový objem (SV) byl kalkulován podle vzorce:
((VTIlvotmax + VTIlvotmin)/2 . ((π . Dlvot2)/4)
CI byl vypočten podle vzorce:
(S . TF)/plocha tělesného povrchu
Systolickou funkci levé komory jsme stanovili v PLAX metodou frakčního zkrácení bazálních segmentů levé komory (FZ LK) v procentech, kalkulovanou podle vzorce: ((LKd – LKs)/LKd) . 100) [16].
Protokol studie
Naše studie byla realizována v souladu s Helsinskou deklarací. Všechna vyšetření byla provedena za standardní vlhkosti a atmosférického tlaku, v podmínkách mírné hypotermie. Nikomu ve studii nebyl podán experimentální lék a nebyl použit žádný experimentální invazivní diagnostický postup. Všichni pacienti byli indikováni k volumexpanzi na základě klinického stavu a pouze jsme nekonvenčně zpracovali běžné echokardiografické parametry.
Reaktivitu na volumexpanzi jsme stanovovali pomocí parametrů ΔVmaxao a ΔVTIao 2–3 hodiny po zahájení udržovací fáze MH, tedy v době stabilní TT v rozpětí 32–34 °C; všichni nemocní byli vyšetřeni echokardiograficky včetně stanovení CI. Při splnění zařazovacích kritérií – CI < 2,5 l . min-1 . m-2, dobrá možnost transtorakálního echokardiografického vyšetření, sinusový rytmus, v případě terapie inotropiky a/nebo vazopresory neměnná dávka v posledních 60 minutách a ventilační stabilita při běžném neagresivním ventilačním režimu – byl nastaven ventilační režim řízené mechanické objemové ventilace s dechovými objemy 10 ml . kg-1 t. hm., s dechovou frekvencí 10/min při poměru inspiria a exspiria 1 : 2, s nulovým endexspiračním přetlakem. Po 10 minutové ekvilibrizaci bylo provedeno první specializované echokardiografické vyšetření se stanovením CI, ΔVmaxao, ΔVTIao, LKd a LKs. Následně byl všem během 20 minut aplikován do centrální žíly bolus fyziologického roztoku o pokojové teplotě v dávce 8 ml . kg-1 t. hm. Ihned po aplikaci jsme v nezměněných podmínkách provedli druhé echokardiografické vyšetření se stanovením stejných parametrů. Před studií, v jejím průběhu i po ní byli pacienti standardně monitorováni. Naměřené údaje byly statisticky zpracovány. Za klinicky významný vzestup CI byl považován nárůst o > 15 %. Za klinicky významnou redukci dávky vazopresorů a/nebo inotropik byla považována redukce o > 10 %. Nemocní, u kterých došlo ke klinicky významnému vzestupu CI, byli označeni jako respondéři, ti u kterých nenastal, jako non-respondéři.
Do studie nebyli zařazeni pacienti se systolickou dysfunkcí pravé komory, s plicní hypertenzí, s jakýmkoliv postižením aortální chlopně a s jakoukoliv stenotickou vadou na ostatních chlopních či s regurgitační vadou na ostatních chlopních se závažností větší než 1 stupeň podle barevného mapování.
Statistika
Pro všechny proměnné byly kalkulovány průměrné hodnoty ± směrodatná odchylka (SD), nebo byly vyjádřeny v procentech. Rozdíly mezi skupinami byly porovnány chí-kvadrát testem a statistická významnost byla kalkulovaná Fischerovým exaktním testem pro všechny alternativní proměnné. Statistická významnost pro kontinuální proměnné byla stanovena Studentovým t-testem. Vzájemná korelace kontinuálních proměnných byla vyjádřena Spearmanovým korelačním indexem. Statistické zpracování dat bylo provedeno pomocí programu JMP 3.2 (SAS Institute, Cary, NC, USA). Za statisticky významné byly považovány rozdíly s p < 0,05.
Výsledky
Demografie a konvenční hemodynamické parametry
V tabulce 1 jsou uvedena demografická data všech 10 nemocných. Všem byly od přijetí do zahájení studie, v rámci iniciální stabilizace a ochlazování, nitrožilně podány krystaloidy a koloidy v dávce 1620 ± 489 ml. Všichni byli léčeni kontinuální infuzí dobutaminu (4,1 ± 2,7 μg . kg-1 . min-1) a noradrenalinu (0,08 ± 0,6 μg . μkg-1 . min-1). Obrázek 1 ukazuje základní konvenční hemodynamické parametry před volumexpanzí a po ní u všech 10 pacientů. Mezi skupinou respondérů a non-respondérů nebyly statisticky významné rozdíly. Během procedury byl patrný trend nárůstu MAP. TT se mezi měřeními neměnila. Oxygenační a ventilační parametry byly také nezměněny (SatO2 99 ± 1 a 100 ± 1 %, EtCO23,3 ± 0,5 a 3,2 ± 0,6 kPa, p > 0,05).
Tab. 1. Demografické údaje 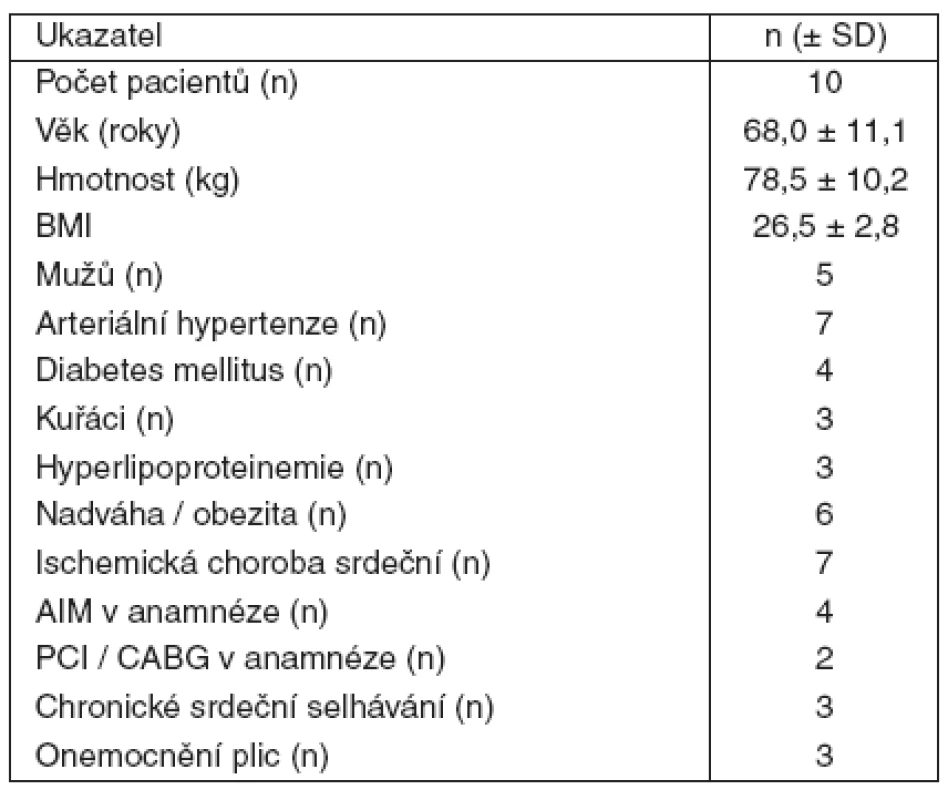
PCI – perkutánní koronární intervence, CABG – aortokoronární bypass, AIM – akutní infarkt myoka Obr. 1. Konvenční hemodynamické parametry všech deseti nemocných před volumexpanzí a po ní MAP – střední arteriální tlak, TF – tepová frekvence, CVP – centrální žilní tlak, TT – tělesná teplota 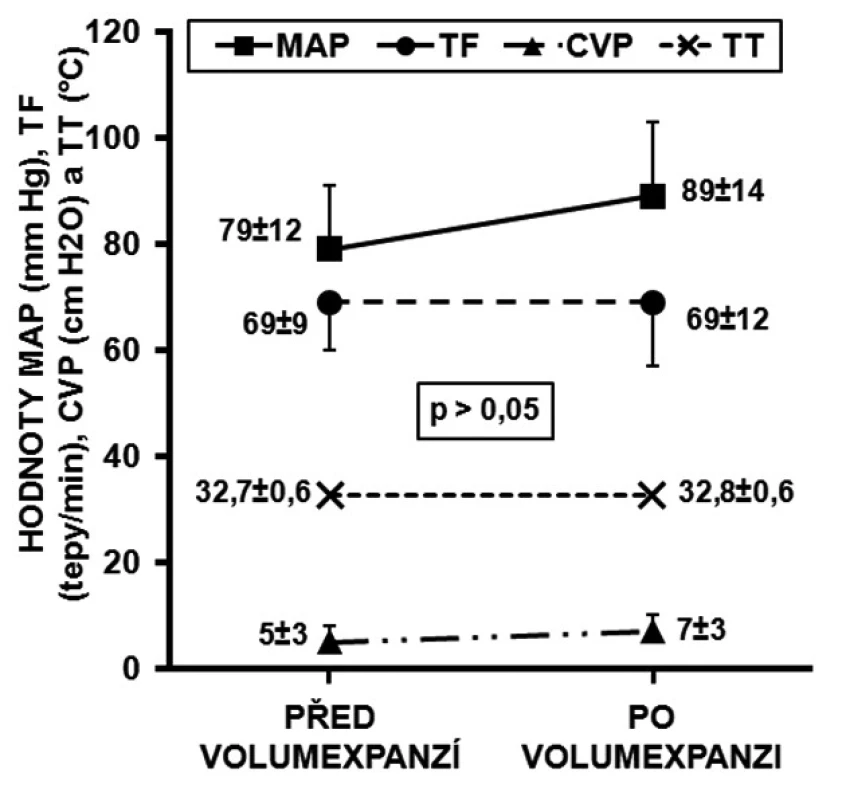
Vliv volumexpanze na CI a systolickou funkci LK
U 8 nemocných vedla volumexpanze ke klinicky relevantnímu nárůstu CI (z 1,86 ± 0,36 na 2,69 ± 0,53 l . m-2, p = 0,003, respondéři), u dvou pacientů se CI nezměnil (z 2,39 ± 0,10 na 2,47 ± 0,11 l . min-1 . m-2, p = 0,526, non-respondéři). U respondérů byla vstupní hodnota CI nižší než u non-respondérů (p = 0,083). Průměrná bazální poresuscitační systolická funkce LK byla mírně snížená (FZ LK 31,2 ± 9,3 %). Po volumexpanzi byl patrný trend k nárůstu u všech nemocných (tab. 2), nicméně nárůst byl vyšší u respondérů (p = 0,043).
Tab. 2. Systolická funkce a rozměry levé komory srdeční před volumexpanzí a po volumexpanzi u respondérů a non-respondérů 
FZ LK – frakční zkrácení levé komory, LKd – diastolický rozměr levé komory, LKs – systolický rozměr levé komory U šesti respondérů vedla volumexpanze ke klinicky relevantní redukci farmakologické podpory oběhu, zatímco u non-respondérů ne.
Vliv volumexpanze na ΔVmaxao a ΔVTIao, jejich prediktivita reakce na volumexpanzi
U respondérů byly hodnoty ΔVmaxao (p < 0,001) a ΔVTIao (p < 0,001) před volumexpanzí výrazně vyšší než u non-respondérů. Po volumexpanzi došlo u respondérů k jejich uniformnímu a statisticky významnému poklesu (obr. 2 a 3). Změna CI po volumexpanzi u všech nemocných pozitivně korelovala se změnou ΔVmaxao a ΔVTIao (obr. 4 a 5). Navíc, absolutní hodnoty ΔVmaxao (r = 0,588, p = 0,003) a ΔVTIao (r = 0,552, p = 0,003) před volumexpanzí korelovaly s nárůstem CI po volumexpanzi. Mezi maximální zjištěnou hodnotou ΔVmaxao a ΔVTIao před volumexpanzí u non-respondérů a minimální zjištěnou hodnotou ΔVmaxao a ΔVTIao před volumexpanzí u respondérů byl zjištěn výrazný rozdíl (zóna prahu na obrázcích 2 a 3). Vysoké hodnoty ΔVmaxao a ΔVTIao tak predikovaly RNV se 100% senzitivitou a specificitou. Naopak, nízké hodnoty ΔVmaxao a ΔVTIao predikovaly areaktivitu na volumexpanzi.
Obr. 2. Reakce ΔVmaxao na volumexpanzi 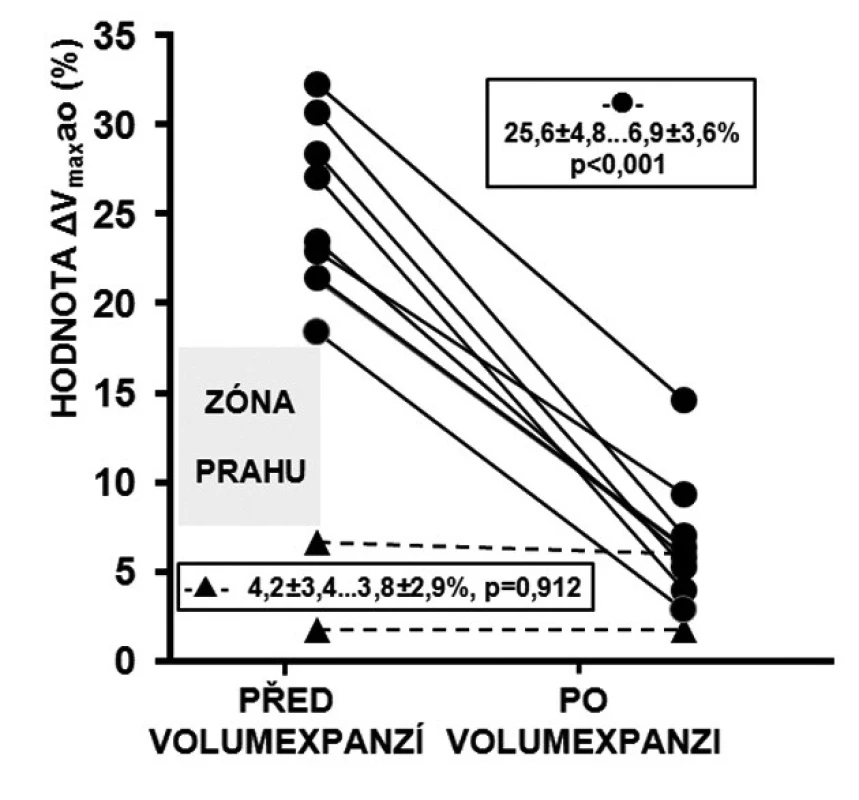
Obr. 3. Reakce ΔVTIao na volumexpanzi 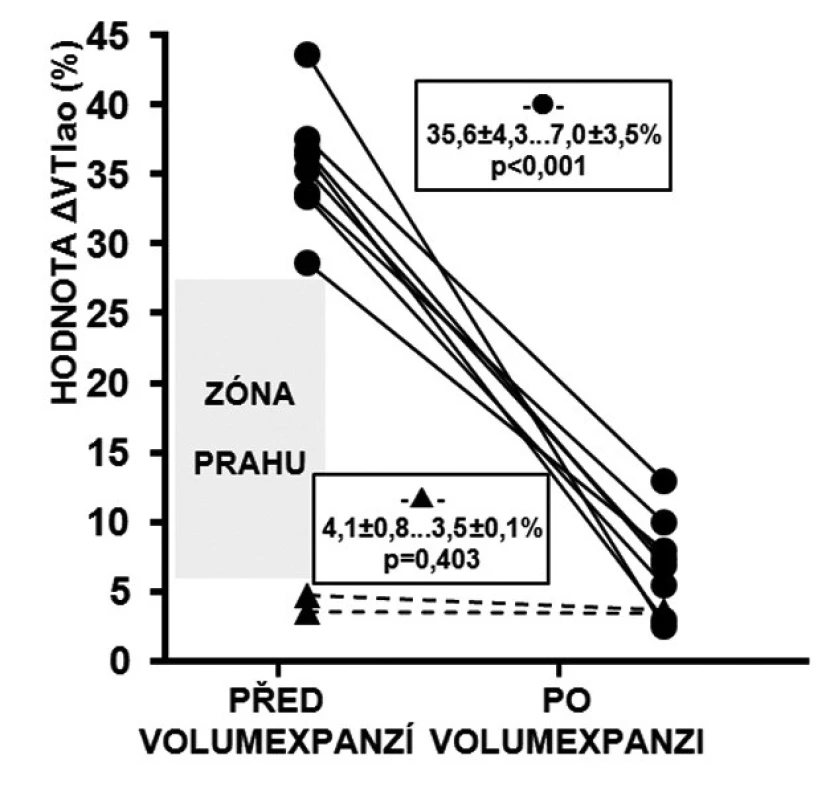
Obr. 4. Korelace změny ΔVmaxao a změny CI po volumexpan 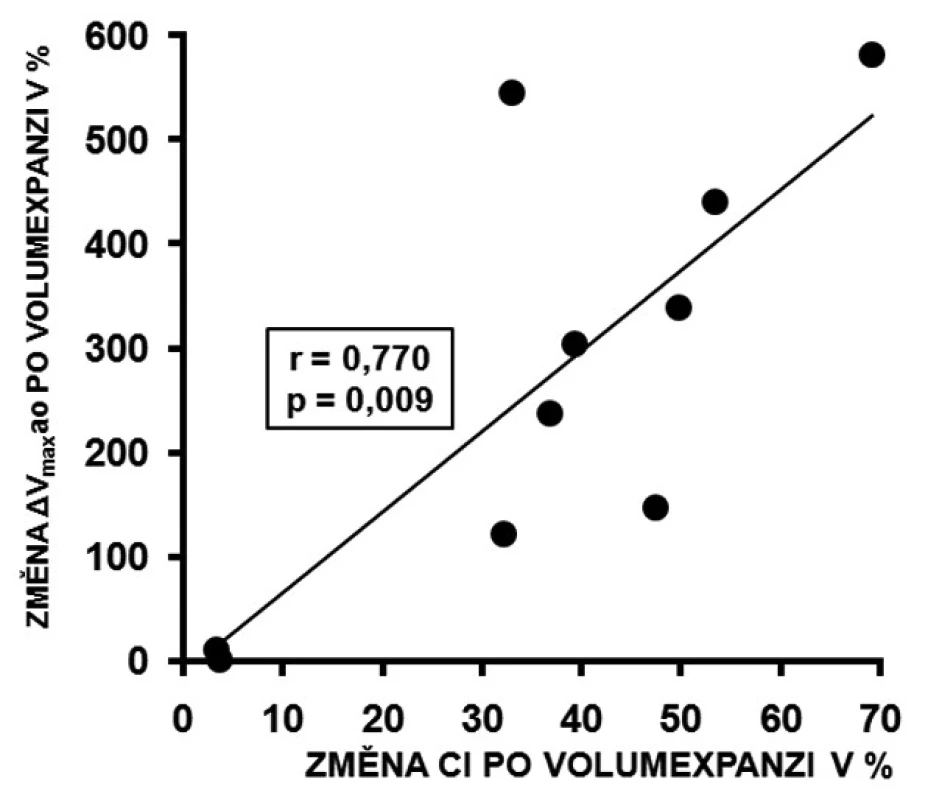
Obr. 5. Korelace změny ΔVTIao a změna CI po volumexpanzi 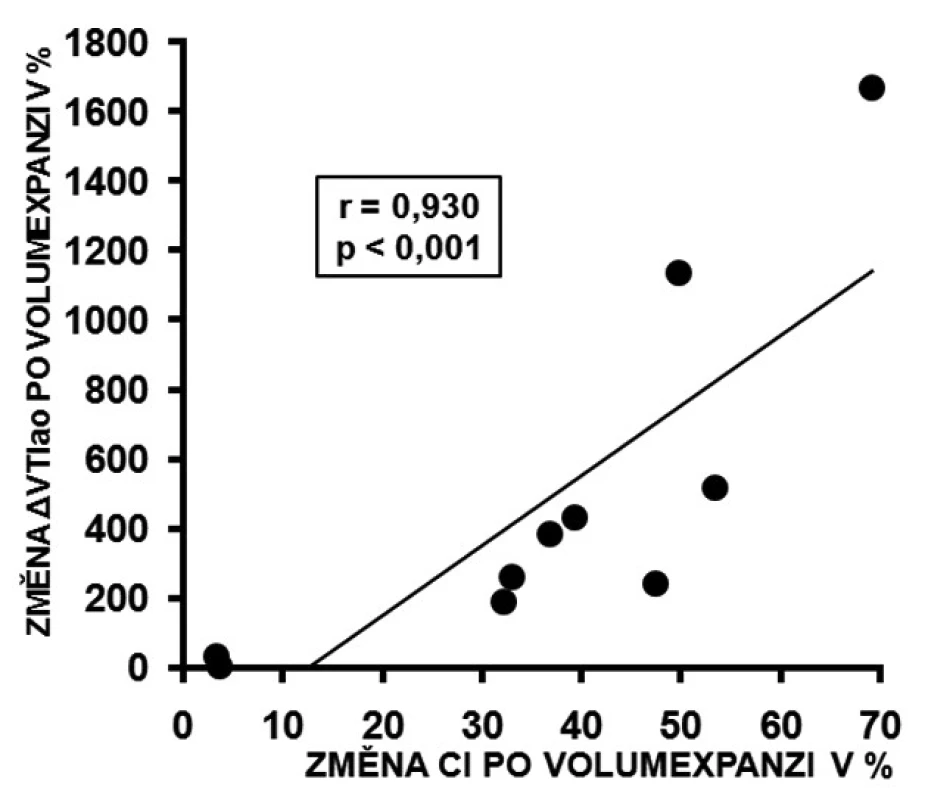
Diskuse
Hlavním zjištěním je, že většina nemocných v našem souboru pacientů po srdeční zástavě léčených MH příznivě reagovala na volumexpanzi a vysoké hodnoty ΔVmaxao a ΔVTIao predikovaly RNV.
V akutní poresuscitační péči u nemocných úspěšně resuscitovaných pro srdeční zástavu je třeba co nejdříve zahájit komplexní neuroprotektivní přístup, který redukuje riziko vzniku závažné posthypoxické encefalopatie [10, 17]. Součástí tohoto přístupu je navození MH a co nejrychlejší dosažení hemodynamických cílů, které zajistí dostatečnou perfuzi mozku a dalších orgánů. Tyto cíle byly na konferenci v Rocky Mountains (USA) v roce 2003 definovány jako MAP 80–100 mm Hg a CI > 2,5 l . min-1 . m-2[10]. Hemodynamika po srdeční zástavě je však obvykle komplexně alterovaná. Za prvé, příčina zástavy (akutní infarkt myokardu, plicní embolie apod.) může vést k redukci srdečního výdeje. Za druhé, srdeční zástava sama o sobě vede k omráčení myokardu a k reverzibilní systolické a diastolické dysfunkci [1, 18]. Za třetí, dysfunkce myokardu může být prohloubená podáváním vysokých dávek adrenalinu během neodkladné resuscitace [19]. Za čtvrté, v rámci ischemicko-reperfuzní reakce se rozvíjí syndrom systémové zánětlivé odpovědi a vazodilatační reakce podobné septickému šoku [2, 20]. Za páté, hemodynamiku ovlivňuje i MH. Obecnou fyziologickou reakcí na hypotermii je proporcionální pokles CI, TF, vzestup periferní vaskulární rezistence a rozvoj absolutní i relativní intravaskulární hypovolemie [4]. Výsledkem těchto mnoha okolností může být až syndrom šoku, v úvodu převážně s kardiogenními rysy, později charakteru spíše septického [2, 21].
Prvním léčebným krokem bývá nejčastěji terapeutický pokus s volumexpanzí. Na tuto terapii však přibližně 50 % kriticky nemocných neodpovídá. U některých z nich může dokonce dojít ke zhoršení oběhového selhání [5, 6]. Bylo by tedy prospěšné mít k dispozici parametr, který by byl schopen jednoduše, rychle a spolehlivě predikovat příznivou RNV. Zatímco tradiční statické ukazatele preloadu (CVP, tlak v zaklínění plicních kapilár) v predikci RNV selhávají, v poslední době bylo identifikováno několik dynamických parametrů (respirační variabilita SV, průtoku krve aortální chlopní, průměru dolní duté žíly, arteriálního krevního tlaku apod.), které s 80–90% senzitivitou i specificitou předpovídají, zda volumexpanze povede ke klinicky relevantnímu nárůstu srdečního výdeje [7, 22]. Fyziologickým podkladem dynamických parametrů u uměle ventilovaných pacientů je sepětí změn intrapleurálního a nitrohrudního tlaku navozeného umělou plicní ventilací a změn žilního návratu do pravého srdce s následnou reakcí levého srdce [23]. Respirační variabilita uvedených parametrů tak odráží, ve které části Frank-Starlingovy křivky aktuálně srdeční komory pracují. Pokud operují na vzestupné části křivky, srdeční komory jsou relativně méně naplněny, mají „vyšší poddajnost“ k respiračním změnám a změny intrakardiálních tlaků a průtoků jsou vyšší. Respirační variabilita uvedených parametrů tak bude vysoká a pacienti budou respondéři na volumexpanzi. Naopak, nízká variabilita dynamických parametrů znamená, že komory pracují na ploché části křivky, jsou optimálně či nadměrně plněné a reakce na volumexpanzi bude pravděpodobně nedostatečná.
Z nabídky dynamických parametrů jsme zvolili respirační variabilitu průtoku krve aortální chlopní zejména proto, že echokardiografické vyšetření je rutinní diagnostickou metodou na koronární jednotce a nevyžaduje nadstandardní technické vybavení. Slama et al. analyzovali prediktivní hodnotu ΔVTIao pro RNV u 12 mechanicky ventilovaných králíků během vykrvácení a reinfuze odebrané krve. Během krvácení ΔVTIao narůstala a po vrácení krve klesla na původní hodnotu. Změny ΔΔVTIao korelovaly se změnou CI a hodnoty ΔVTIao po odběru krve predikovaly RNV [14]. Feissel et al. měřili ΔVmaxao u 19 mechanicky ventilovaných nemocných se septickým šokem před volumexanzí a po ní. Hodnota ΔVmaxao 12 % s vysokou senzitivitou a specificitou rozdělila soubor pacientů na respondéry a non-respondéry [15].
V našem souboru odpovědělo na volumexpanzi 80 % nemocných. To je v souladu s komplexní patofyziologií cirkulačního selhání po neodkladné resuscitaci u nemocných v MH, na kterém se podílí i hypovolémie. Mírná hypotermie má klinicky významný diuretický efekt [4]. Mezi respondéry nebyli pouze nemocní s normální systolickou funkcí LK, ale u většiny jsme naopak zjistili mírnou či středně těžkou systolickou dysfunkci LK. Volumexpanze se tedy jeví být účinná i v přítomnosti určitého stupně poresuscitační systolické dysfunkce LK [24, 25]. Navíc je zajímavé, že volumexpanze nevede ke zvýšení CI pouze mechanicky nárůstem enddiastolického objemu, ale také pozitivním vlivem na kontraktilitu myokardu a/nebo poklesem afterloadu. Toto bylo pozorováno u zdravých dobrovolníků, u kriticky nemocných i ve zvířecím experimentu s omráčeným myokardem [24–28]. Vzhledem k malému množství probandů však v našem souboru tento fenomén nelze spolehlivě ověřit. Volumexpanze byla v dávce 8 ml . kg-1 u všech nemocných v našem souboru bezpečná a u některých vedla k redukci vazopresorické a/nebo inotropní podpory. U nemocných po srdeční zástavě léčených MH je tedy obzvláště důležitá kontrola bilance tekutin, její pravidelná konfrontace s hemodynamickými parametry včetně srdečního výdeje a udržování řádného preloadu, což je v souladu s klinickou zkušeností.
ΔVmaxao a ΔΔVTIao se v našem souboru ukázaly být velmi citlivé prediktory reaktivity na volumexpanzi a naopak také prediktory areaktivity na volumexpanzi. Mnohonásobně vyšší hodnoty sledovaných parametrů před volumexpanzí než u non-respondérů jsme pozorovali u všech respondérů a predikovaly tak RNV. Po podání definovaného množství fyziologického roztoku klesly na hodnoty srovnatelné s non-respondéry. U nich se hodnoty ΔVmaxao a ΔVTIao nezměnily a jejich nízká hodnota predikovala následnou areaktivitu na volumexpanzi. Výrazný rozdíl mezi hodnotami respirační variability průtoku krve aortální chlopní u respondérů a non-respondérů naznačuje, že u této specifické skupiny pacientů je asociace RNV, respektive asociace objemově dependentní změny srdečního výdeje a variability průtoku krve aortální chlopní, silným biologickým fenoménem (viz obr. 2 a 3). Teoreticky predikovaly RNV oba testované parametry se 100% senztivitou i specificitou, nicméně se domníváme, že na tak malém souboru nelze reálnou a klinicky relevantní kalkulaci senzitivity a specificity aplikovat. CVP jako představitel statické konvenční míry preloadu tuto prediktivní hodnotu neměl. Toto bylo u kriticky nemocných opakovaně pozorováno a znamená to, že hodnota CVP sama o sobě není automaticky indikací ani kontraindikací podání tekutin [6, 7]. Vzhledem k tomu, že na volumexpanzi reagovala většina nemocných, praktický význam těchto parametrů u nemocných po srdeční zástavě v MH by mohl být především v predikci areaktivity na volumexpanzi. U této menšiny nemocných by jsme místo dalších pokusů o ovlivnění srdečního výdeje podáním bolusu tekutin mohli rovnou zvýšit dávku inotropní/vazopresorické podpory a uvažovat o zahájení mechanické srdeční podpory.
Validita a obecná akceptovatelnost nálezů naší studie je omezená zejména malým počtem probandů. Výsledky je třeba ověřit na větším souboru, kde bude možné stanovit i prahovou hodnotu a reálnou senzitivitu a specifitu ΔVmaxao a ΔVTIao pro predikci RNV, resp. areaktivity na volumexpanzi. Otázkou zůstává, jaký vliv na validitu těchto parametrů má přítomnost systolické a /nebo diastolické dysfunkce levé komory její etiologie a reverzibilita. Zároveň důrazňujeme, že výsledky našeho souboru nelze extrapolovat na nemocné s těžkou systolickou dysfunkcí levé komory.
Došlo 20. 3. 2008.
Přijato 12. 6. 2008.
Adresa pro korespondenci:
MUDr. Roman Škulec
Tyršova 52
266 01 Beroun
email: skulec@email.cz
Zdroje
1. Laurent, I., Monchi, M., Chiche, J. D. et al. Reversible myocardial dysfunction in survivors of out-of-hospital cardiac arrest. J. Am. Coll. Cardiol., 2002, 40, p. 2110–2116.
2. Adrie, Ch., Adib-Conquy, M., Laurent, I. et al. Successful Cardiopulmonary Resuscitation After Cardiac Arrest as a “Sepsis-Like” Syndrome. Circulation, 2002, 106, p. 562–568.
3. Jonesa, A. E., Shapirob, N. I., Kilgannonc, J. H. et al. on behalf of the Emergency Medicine Shock Research Network (EMSHOCKNET) investigators. Goal-directed hemodynamic optimization in the post-cardiac arrest syndrome: A systematic review. Resuscitation, 2008, 77, p. 26–29.
4. Polderman, K. H. Application of therapeutic hypothermia in the intensive care unit. Opportunities and pitfalls of a promising treatment modality – Part 2: Practical aspects and side effects. Intensive Care Med., 2004, 30, p. 757–769.
5. Tavernier, B., Makhotine, O., Lebuffe, G. et al. Systolic Pressure Variation as a Guide to Fluid Therapy in Patients with Sepsis-induced Hypotension. Anestesiology, 1998, 89, p. 1313–1321.
6. Michard, F., Teboul, J. L. Using heart-lung interactions to assess fluid responsiveness during mechanical ventilation. Crit. Care, 2000, 4, p. 282–289.
7. Pinsky, M. R. Assessment of indices of preload and volume responsiveness. Curr. Opin. Crit. Care, 2005, 11, p. 235–239.
8. Gunn, S. R., Pinsky, M. R. Implications of arterial pressure variation in patients in the intensive care unit. Curr. Opin. Crit. Care, 2001, 7, p. 212–217.
9. Skulec, R., Belohlavek, J., Linhart, A. et al. Respiratory variability of aortic blood velocity: predictor of preload responsiveness in healthy spontaneously breathing volunteers. Crit. Care, 2005, 9, Suppl. 1, p. P54.
10. Bell, D. D., Brindley, P. G., Forrest, D. et al. Management following resuscitation from cardiac arrest: recommendations from the 2003 Rocky Mountain Critical Care Conference. Can. J. Anesth., 2005, 52, p. 309–322.
11. American Heart Association Guidelines for Cardiopulmonary Resuscitation and Emergency Cardiovascular Care. Part 7.5: postresuscitation Support. Circulation, 2005, 112, Suppl. I, p. IV–84–88.
12. Škulec, R., Bělohlávek, J., Dytrych, V. et al. Protokol pro použití terapeutické mírné hypotermie u nemocných po srdeční zástavě. Cor. Vasa, 2007, 49, s. 61–65.
13. Nieminen, M. S., Bohm, M., Cowie, M. R. et al. ESC Committee for Practice Guideline (CPG). Executive summary of the guidelines on the diagnosis and treatment of acute heart failure: the Task Force on Acute Heart Failure of the European Society of Cardiology. Eur. Heart J., 2005, 26, p. 384–416.
14. Slama, M., Masson, H., Teboul, J. L. Respiratory variations of aortic VTI: a new index of hypovolemia and fluid responsiveness. Am. J. Physiol. Heart Circ. Physiol., 2002, 283, p. H1729–H1733.
15. Feissel, M., Michard, F., Mangin, I. Respiratory changes in aortic blood velocity as an indicator of fluid responsiveness in ventilated patients with septic shock. Chest, 2001, 119, p. 867–873.
16. Linhart, A., Paleček, T., Aschermann, M. Echokardiografie pro praxi, 1. vyd. The Hague Audioscan : Praha, 2002, 238 s.
17. Wright, W. L., Geocadin, R. G. Postresuscitative intensive care: neuroprotective strategies after cardiac arrest. Semin. Neurol., 2006, 26, p. 396–402.
18. Checchia, P. A., Sehra, R., Moynihan, J. et al. Myocardial injury in children following resuscitation after cardiac arrest. Resuscitation, 2003, 57, p. 131–137.
19. Tang, W., Weil, M. H., Sun, S. et al. Epinephrine increases the severity of postresuscitation myocardial dysfunction. Circulation, 1995, 92, p. 3089–3093.
20. Adrie, C., Laurent, I., Monchi, M. et al. Postresuscitation disease after cardiac arrest: a sepsis-like syndrome? Curr. Opin. Crit. Care, 2004, 10, p. 208–212.
21. Skulec, R., Kovarnik, T., Dostalova, G. et al. Induction of mild hypothermia in cardiac arrest survivors presenting with cardiogenic shock syndrome. Acta Anaesthesiol. Scand., 2008, 52, p. 188–194.
22. Feissel, M., Michard, F., Faller, J. P. et al. The respiratory variation in inferior vena cava diameter as a guide to fluid therapy. Intensive Care Med., 2004, 30, p. 1834–1837.
23. Sheldon, M. Clinical Usefulness of Respiratory Variations in Arterial Pressure. Am. J. Respir. Crit. Care Med., 2004, 169, p. 151–155.
24. Du, F., Chen, X. L., Drzewiecki, G. Hypervolaemia improves global and local function and efficiency in postischaemic myocardium. Clin. Exp. Pharmacol. Physiol., 2001, 28, p. 630–636.
25. Sidi, A., Muehlschlegel, J. D., Kirby, D. S. et al. Treating ischemic left ventricular dysfunction with hypertonic saline administered after coronary occlusion in pigs. J. Cardiothorac. Vasc. Anesth., 2007, 21, p. 400–405.
26. Kumar, A., Anel, R., Bunnell, E. et al. Preload-independent mechanisms contribute to increased stroke volume following large volume saline infusion in normal volunteers: a prospective interventional study. Crit. Care, 2004, 8, p. R128–R136.
27. Calvin, J. E., Driedger, A. A., Sibbald, W. J. The hemodynamic effect of rapid fluid infusion in critically ill patients. Surgery, 1981, 90, p. 61–76.
28. van Daele, M. E., Trouwborst, A., van Woerkens, L. C. et al. Transesophageal echocardiographic monitoring of preoperative acute hypervolemic hemodilution. Anesthesiology, 1994, 81, p. 602–609.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek Stala se chyba a jak dál?Článek Konference a kongresyČlánek Zdroje na www.csarim.czČlánek Výborová schůze ČSARIMČlánek In memoriam Peter BaskettČlánek UEMSČlánek Vzdělávací akce IPVZČlánek Vzdělávací akce IPVZ
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2008 Číslo 4- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Šance na postup do elitního klubu – nastal čas na změnu a co pro to musíme udělat?
- Déjà vu, mais pas en anglais aneb jak podpořit náš časopis a zachovat publikační etiku
- Stala se chyba a jak dál?
- Poslední halotanová hepatitida v České republice?
- Reaktivita na volumexpanzi a její predikce u nemocných po srdeční zástavě léčených mírnou hypotermií
- Vzdělávací akce IPVZ
- Akútna intoxikácia teofylínom
- Vzdělávací akce IPVZ
- Akutní diseminovaná encefalomyelitida
- Možnosti antimikrobiální ochrany centrálních žilních katétrů
- Léčba akutního srdečního selhání – přehled
- Počátky anesteziologie na ORL klinice LF UK v Plzni
- Minářovy dny – MUDr. Jiří Minář, CSc.*
- Předběžná statistická data oboru Anesteziologie a resuscitace, Česká republika za rok 2007
- Konference a kongresy
- Nový výukový internetový portál www.akutne.cz
- Novinky v intenzivní medicíně 2007
- Identifikační a slevové karty pro všechny členy ČLS JEP
- Zdroje na www.csarim.cz
- Doporučené postupy a stanoviska ČSARIM na www.csarim.cz
- Výborová schůze ČSARIM
- Informace pro členy společnosti
- Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny
- In memoriam Peter Baskett
- Zápis z jednání výboru 2/2008
- Zápis z jednání výboru 3/2008
- European Board of Intensive Care Medicine Meeting Minutes
- UEMS
- Za prim. MUDr. Oldřichem Markem, Ph.D.
- MUDr. Oldřich Marek, Ph.D., in memoriam
- Poslední vzpomínka na prim. MUDr. Oldřicha Marka, Ph.D.
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Akutní diseminovaná encefalomyelitida
- Možnosti antimikrobiální ochrany centrálních žilních katétrů
- Referátový výběr z anesteziologie, resuscitace a intenzivní medicíny
- Akútna intoxikácia teofylínom
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



