-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Transrektální biopsie prostaty naváděná ultrazvukovým vyšetřením
Key words:
biopsy, TRUS, prostate cancer, template
Autoři: P. F. Fulgham
Působiště autorů: Director of Surgical Oncology Services, Texas Health Presbyterian Hospital of Dallas
Vyšlo v časopise: Urol List 2011; 9(2): 18-23
Souhrn
Klíčová slova:
biopsie, TRUS, karcinom prostaty, šablonaINDIKACE
Transrektální biopsie prostaty naváděná ultrazvukovým vyšetřením (TRUS/BX) je téměř vždy indikována při specifických klinických indikacích, jako je zvýšení nebo změna hladiny PSA nebo abnormální nález při digitálním rektálním vyšetření. Nález HGPIN (prostatické intraepiteliální neoplazie prostaty vysokého grade) nebo ASAP (atypické malé acinární proliferace) při první biopsii považují někteří autoři za indikaci pro opakování biopsie (ať již okamžitě, nebo později).
TRUS/BX může být indikována rovněž v případě, že po primární terapii dojde ke zvýšení PSA. Plánovaná opakovaná biopsie se v současné době užívá čím dál častěji v rámci strategie pozorného vyčkávání (WW = watchful waiting). U pacienta, u něhož po radikální retropubické prostatektomii dojde ke zvýšení hladiny PSA, lze pomocí biopsie a ultrazvukového vyšetření prostatického lůžka a vezikouretrální anastomózy diagnostikovat lokální recidivu onemocnění. TRUS/BX se užívá pro diagnostikování selhání lokální léčby po radioterapii nebo kryoterapii (tab. 1).
Tab. 1. Indikace pro transrektální biopsii naváděnou pomocí ultrazvuku. 
NÁLEZ ULTRAZVUKOVÉHO VYŠETŘENÍ
Bez ohledu na indikaci hraje ultrazvukové vyšetření v rámci biopsie prostaty významnou roli. Ačkoli primární funkce ultrazvukového vyšetření spočívá v navigaci jehly, každou biopsii prostaty je vhodné zahájit důkladným diagnostickým ultrazvukovým vyšetřením. Dobře popsány byly sonografické charakteristiky karcinomu prostaty při ultrazvukovém vyšetření a výskyt karcinomu v jednotlivých zónách. Je zřejmé, že všechny karcinomy prostaty nevykazují stejnou echogenicitu, která by umožňovala diagnostikovat onemocnění na základě pouhého ultrazvukového vyšetření tkáně.
Přibližně v 70 % případů se karcinom prostaty na ultrazvuku jeví jako hypoechogenní oblast. Mikroskopické tumory však mohou být k nerozeznání od okolní normální prostatické tkáně, a mohou tedy zůstat při ultrazvukovém vyšetřené skryty (obr. 1). 75 % karcinomů se nachází v peri-ferní zóně, minimálně 20 % může být lokalizováno v přechodné zóně a zbývajících 5 % v centrální zóně prostaty (obr. 2).
Obr. 1. Ultrazvukové zobrazení karcinomu prostaty. 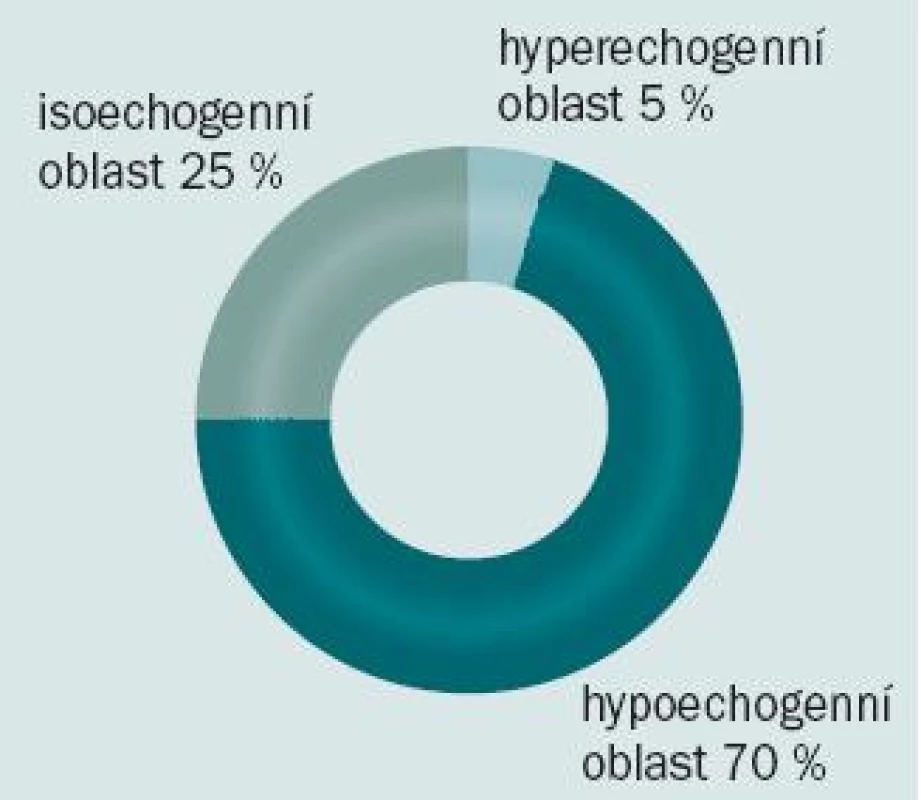
Obr. 2. Výskyt karcinomu prostaty v jednotlivých zónách. 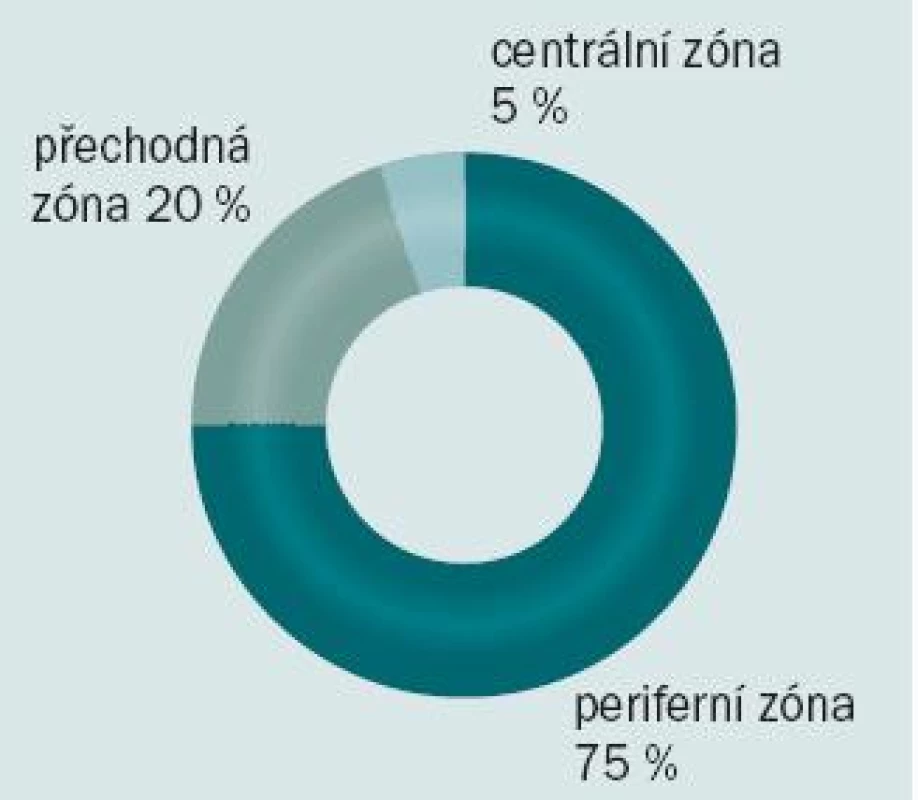
Zvýšená mikrovaskulatura v některých karcinomech prostaty je příliš malé velikosti, aby mohla být zobrazena pomocí běžné 7,5 mHz sondy. Dopplerovské průtokové vyšetření však umožňuje u některých karcinomů prostaty zobrazit zvýšený regionální průtok krve. Intravaskulární aplikace kontrastní látky může dále usnadnit identifikaci zvýšeného průtoku krve. FDA však v současné době užitítěchto látek v rámci ultrazvukového vyšetření prostaty neschvaluje [1].
Ačkoli echogenicita poskytuje vodítko pro lokalizaci karcinomu prostaty, existují i další ultrazvukové nálezy, které mohou být potenciálním indikátorem karcinomu prostaty. Podezřelým nálezem může být ohnutí vrstvy corpora amylacea mezi přechodnou a periferní zónou prostaty (obr. 3).
Obr. 3. Příčné zobrazení prostaty demonstrující ohnutí vrstvy corpora amylacea směrem nahoru (šipky) na spojnici mezi přechodnou (TZ) a periferní zónou (PZ). 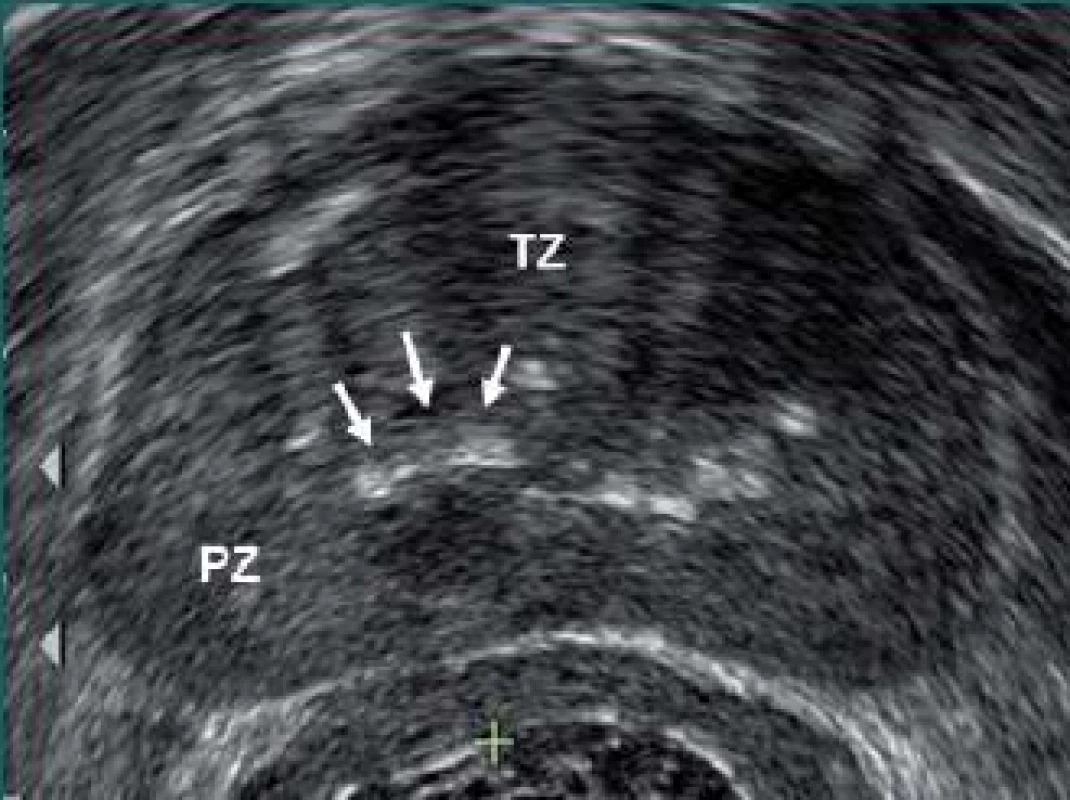
Asymetrie prostaty, vyklenutí prostatické kapsuly a zvýšený regionální průtok krve při zobrazení barevným Dopplerovským ultrazvukovým vyšetřením jsou další znaky nasvědčující potenciální přítomnosti karcinomu prostaty (obr. 4).
Obr. 4. Nálezy ultrazvukového vyšetření prostaty nasvědčující potenciální přítomnosti karcinomu prostaty. 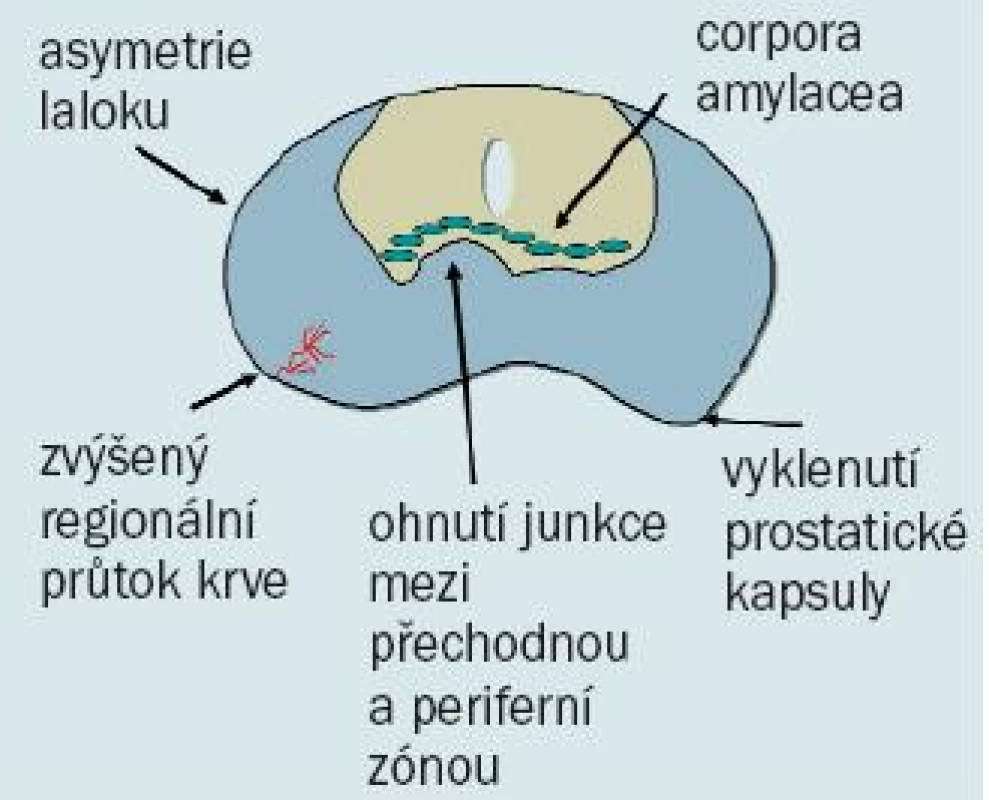
PŘÍPRAVA PACIENTA
Nejprve je nutné pacienta řádně instruovat a získat informovaný souhlas. Pacienta je třeba informovat o potenciálním výskytu nepříznivých komplikací a o skutečnosti, že biopsie je spojena s 10–27% mírou falešně negativních výsledků [2,3]. Dále je třeba pacienta upozornit na fakt, že diagnostika malých nebo klinicky nesignifikantních karcinomů může vést k indikaci léčby spojené s významnou morbiditou.
Pacienta je třeba informovat o nutnosti přerušení užívání aspirinu a agens na bázi aspirinu (NSAIDS), antikoagulancií (vitamin E, dipyridamol, warfarin sodný nebo klopidogrel bisulfát) a všech rostlinných doplňků alespoň sedm dnů před plánovanou biopsií. V užívání těchto preparátů by pacient neměl pokračovat dříve než 24 hod po výkonu a do doby, než dojde k zastavení krvácení. Některé studie uvádějí, že nízká dávka aspirinu (75–150 mg denně) nemusí nutně zvyšovat riziko krvácení [4–6]. Klinické riziko spojené s vysazením antikoagulancií je nutné uvážit v kontextu potenciálního rizika krvácení po biopsii.
Dvě až tři hodiny před biopsií by měl pacient provést klystýr. Ačkoli nebylo dosaženo jednomyslné shody v otázce, jaký má pročišťovací klystýr význam pro prevenci infekce, odstranění stolice a plynu z rektální dutiny pravděpodobně zvyšuje kvalitu zobrazení. Jeon et al [7] prokázali nižší riziko komplikací spojených s infekcí u pacientů, kteří před TRUS/BX podstoupili klystýr (1,3 %), oproti pacientům, kteří klystýr neabsolvovali (9,5 %).
Před biopsií se doporučuje orální aplikace fluorochinolonu s dlouhodobým účinkem. Navzdory tomu, že zde existuje riziko vzniku bakteriurie (44 %) a bakteriemie (16 %) (jak prokázali Lindert et al [8]) po biopsii, riziko vzniku významné klinické infekce je v případě profylaxe antibiotiky nízké [9]. Optimální načasování profylaxe antibiotiky je nutné teprve stanovit, zatím se jako vhodné jeví aplikace jedné dávky hodinu před biopsií a druhé dávky 24 hod po výkonu. Důkazy o vzniku multirezistentní E. coli v důsledku masového užívání širokospektrálních antibiotik jasně hovoří pro co nejkratší aplikaci antibiotik jako prevence před vážnými klinickými důsledky. Pacienti s protézami, kloubními náhradami nebo onemocněním srdeční chlopně mohou vyžadovat další profylaxi [10].
Přestože je před biopsií obvykle indikován rozbor moči, nebylo prokázáno, že abnormální výsledek tohoto testu jakkoli zvyšuje riziko vzniku signifikantní klinické infekce. U pacientů s anamnézou bakteriurie, zejména u jedinců, u nichž předpokládáme přítomnost multirezistentních mikroorganizmů / mikroorganizmů získaných během předchozí hospitalizace, a jedinců, u nichž může mít bakteriemie významnější následky (tj. pacienti užívající imunosupresiva), může vyšetření močového sedimentu pomoci při rozhodování, zda u pacienta biopsii provádět, nebo nikoli.
POLOHOVÁNÍ PACIENTA A LOKÁLNÍ ANESTEZIE
Při ambulantní TRUS/BX může být pacient umístěn do laterální dekubitální polohy nebo litotomické polohy. Laterální dekubitální poloha umožňuje upravovat stupeň ohybu v kyčelním kloubu pacienta pro lepší angulaci sondy a lepší vizualizaci prostaty. Možnost sledovat ultrazvukové vyšetření na monitoru pacienta uklidní a usnadní urologovi vysvětlení nálezu. Umístění podložek (které zachytí jakoukoli krev či tělesné tekutiny během biopsie) pod pacienta a na podlahu usnadní úklid a minimalizuje riziko pro osoby manipulující s instrumenty a provádějící úklid.
Přímo před TRUS/BX je třeba provést důkladné digitální rektální vyšetření, čímž dilatujeme rektální svěrač pro zavedení sondy. Pomocí DRE se rovněž znovu ujistíme o velikosti a lokalizaci hmatných abnormalit. Pozornost je třeba věnovat rozsahu onemocnění, symetrii prostaty, zasažení semenných váčků nebo přilehlých pánevních struktur. Dále je nutné zaznamenat potenciální přítomnost vnitř-ních/vnějších hemeroidů. Prst, který zavádíme do rekta, je třeba rovněž nasměrovat posteriorně pro vyšetření rektálních lézí.
Výšku stolu je třeba nastavit tak, aby poskytovala maximální ergonomické pohodlí pro vyšetřujícího. Ultrazvukový přístroj je třeba umístit tak, aby bylo možné v průběhu vyšetření upravovat nastavení pro zajištění maximální kvality zobrazení.
Při užití sondy o malém průměru a lokální anestezii je možné odebrat velký počet vzorků, aniž by pacient pocítil významnější dyskomfort. Vzhledem k tomu, že přesný způsob přenosu bolesti během biopsie prostaty nebyl dosud přesně po-psán, zůstává přesná lokalizace a přístup pro aplikaci anestetika stále předmětem debaty. Bolest může vyvolávat již distenze rekta během zavádění sondy. Nervová zakončení a vlákna vedoucí bolest jsou přítomna v prostatické kapsule nebo parenchymu prostaty a v eferentních vláknech vedoucích z oblasti hrdla močového měchýře či močové trubice. Jak popisují Kravchick et al [11], adekvátní anestezie lze dosáhnout intrarektální aplikací lidokainu nebo kombinací lidokainového gelu a DMSO. Pro zajištění regionální anestezie během biopsie prostaty se často používá periprostatická infiltrace lidokainem v oblasti spojení prostaty a semenných váčků (obr. 5).
Obr. 5. Sagitální zobrazení prostaty demonstrující místo periprostatické infiltrace do oblasti neurovaskulárního svazku na spojnici mezi semennými váčky (SV) a bází prostaty (P). 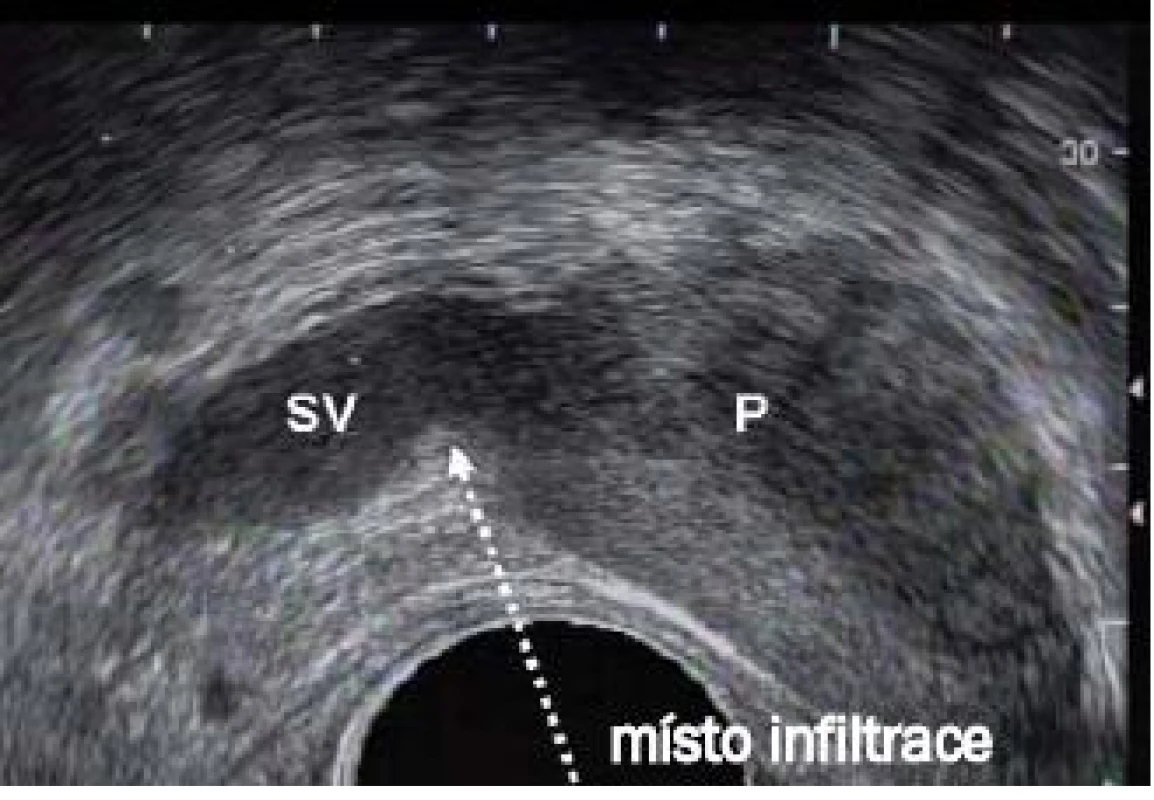
Pro aplikaci 15 ml 1% nebo 2% lidokainu do přímé blízkosti obou neurovaskulárních svazků lze užít jehlu o šířce 22 G. Různí autoři navrhují modifikaci tohoto postupu, např. aplikaci jedné dávky 10 ml 1% lidokainu do střední čáry mezi Denonvilliersovou fascií a periprostatickou fasciií směrem od báze po apex [12], kombinovanou periprostatickou a periapikální infiltraci [13] a kombinovanou periprostatickou a intraprostatickou infiltraci [14]. Cevik et al [13] prokázali, že doba, jež uplyne mezi infiltrací a biopsií, úzce souvisí s intenzitou vnímané bolesti (jak uvádí sami pacienti). Tito autoři doporučují anestetikum aplikovat 15 min před biopsií.
TECHNIKA BIOPSIE
Cílem jakékoli biopsie by měl být odběr adekvátního množství tkáně z oblastí s nejvyšší pravděpodobností výskytu karcinomu při co nejmenší morbiditě. Optimální technika pro TRUS/BX zůstává nadále kontroverzním tématem. Při primární biopsii prostaty většina klinických lékařů volí transrektální přístup s užitím šablony (tzv. templated biopsie) s odběrem 12 vzorků plus cílený odběr dle indikace. Nebylo prokázáno, že by některá ze šablon pro biopsii byla významně lepší než ostatní. U vzorků odebraných z laterální periferní zóny a apexu existuje nejvyšší statistická pravděpodobnost, že budou obsahovat karcinom [15]. Je tedy vhodné zvolit takovou strategii, která umožní maximální odběr tkáně z těchto oblastí. Typické schéma je založeno na sextantové strategii v kombinaci s odběrem vzorků z late-rální části (obr. 6).
Obr. 6. Typická „templated“ biopsie s odběrem 12 vzorků. 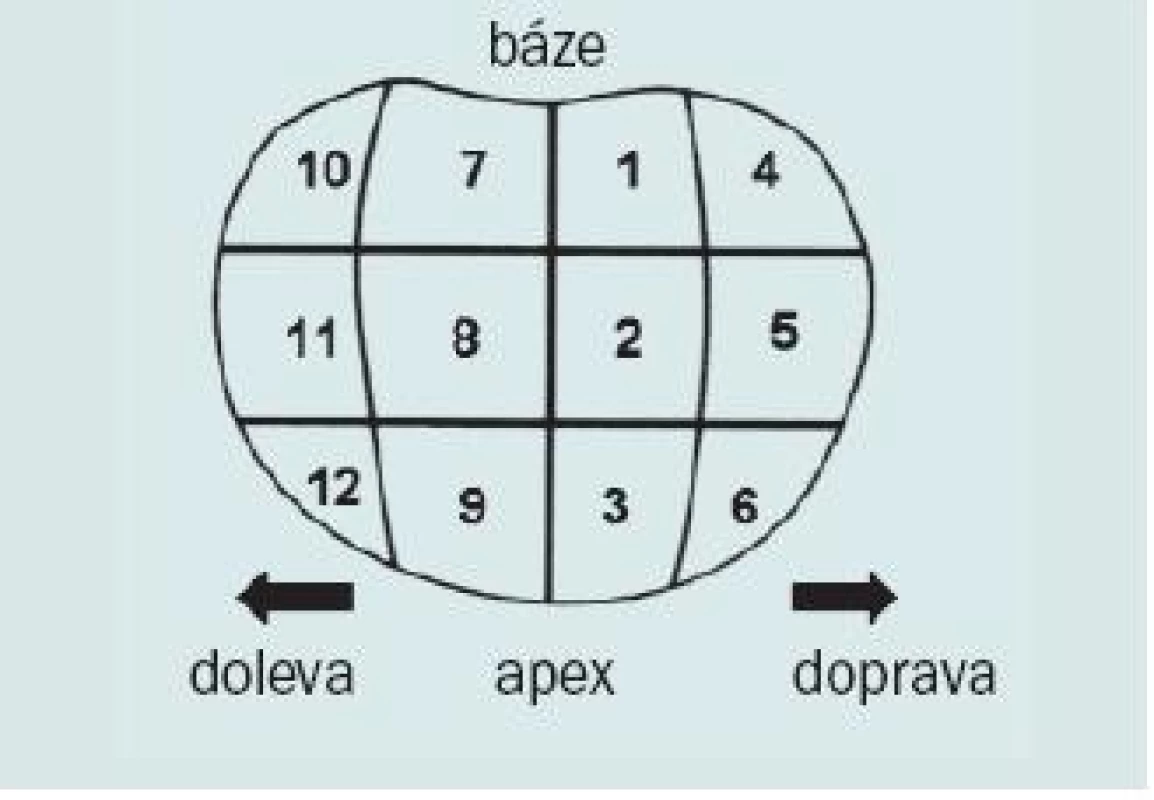
Řada urologů rovněž provádí cílenou biopsii na základě nálezu ultrazvukového vyšetření. Vzorky jsou odebírány tak, aby maximálně reflektovaly naše znalosti o obvyklém rozprostření karcinomu v jednotlivých částech prostaty a jeho nejčastější ultrazvukovou charakteristiku. Existují přesvědčivé důkazy o tom, že systematická biopsie umožní identifikovat i karcinomy, jež jsou vizuálně v ultrazvukovém obraze nedetekovatelné. Rovněž bylo prokázáno, že biopsie zacílená na hypoechogenní nebo hypervaskulární oblasti prostaty může pomoci diagnostikovat karcinom, který by při pouhé systematické „templated“ biopsii nebyl identifikován [16] (obr. 7).
Obr. 7. Zvýšený regionální průtok krve (bílá šipka) v důsledku karcinomu prostaty na barevném Dopplerovském ultrazvukovém vyšetření. 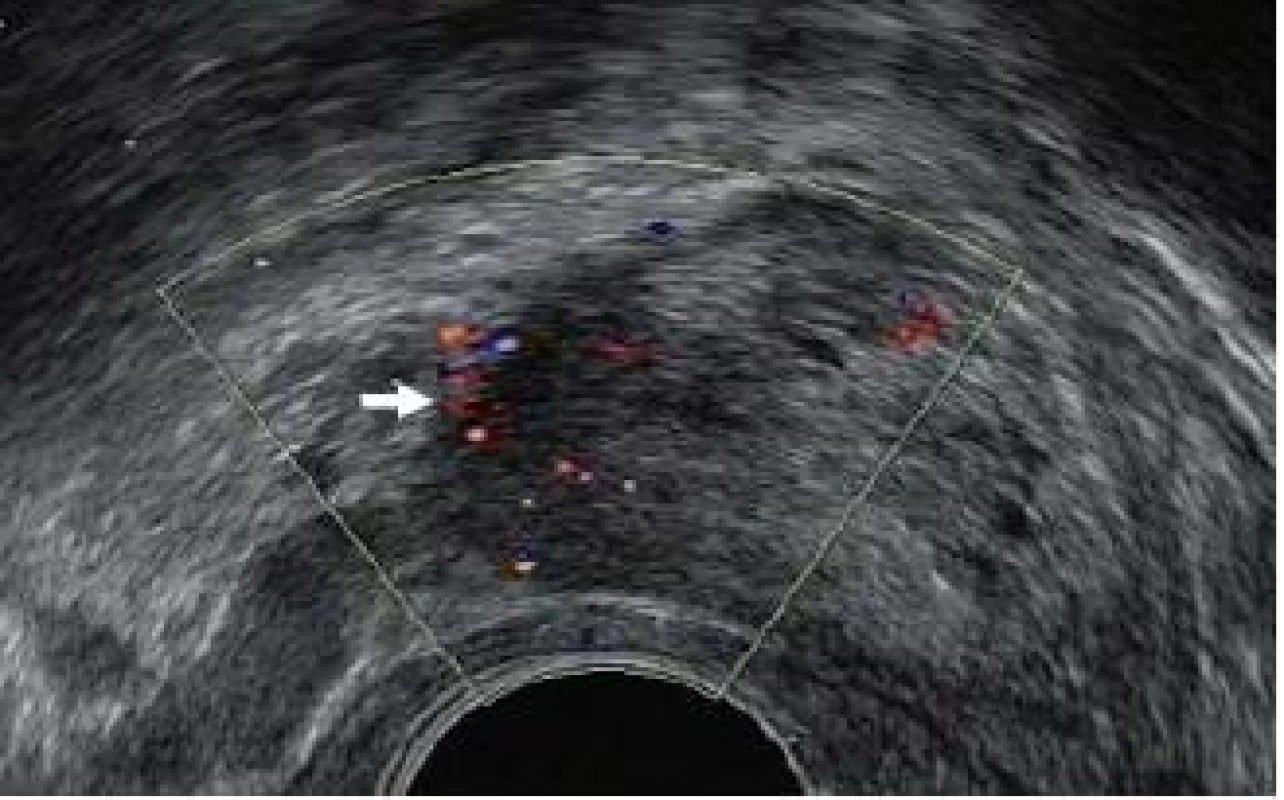
Odběr většího počtu vzorků na základě velikosti prostaty může zvýšit procento pozitivních biopsií a zároveň snížit míru výskytu falešně negativních biopsií u pacientů s větší prostatickou žlázou [17]. V některých případech může být přítomna hmatná abnormalita, která se však při ultrazvukovém vyšetření nezobrazuje jako echogenní abnormalita ani jako narušení běžné architektury tkáně. Renfer et al [18] ve starší studii srovnávající ultrazvukové vs digitální navádění biopsie uvádějí, že 12 % karcinomů bylo detekováno pouze díky digitální navigaci. V případě, že ultrazvukové vyšetření neumožňuje zobrazit hmatnou abnormalitu, doporučuje se provedení digitálně naváděné biopsie prostaty s naváděním bioptické jehly podél urologova prstu. Při tomto typu biopsie lze užít ochrannou pochvu nebo tzv. „trumpetu“.
Mapování lokalizace pro odběr vzorků má svůj význam, neboť rozsah a lokalizace onemocnění mohou ovlivnit volbu léčby, a to zejména v případě, že je při první biopsii diagnostikována intraepiteliální neoplazie nebo atypie. Mapování může poskytnout užitečné informace o tom, v kterých zónách prostaty bude při rozšířené nebo opakované biopsii s největší pravděpodobností detekován pozitivní nález.
Při odběru tkáně z prostatické žlázy je důležité co nejlépe využít potenciál automatické bioptické jehly. Špičku jehly je třeba přiblížit k prostatické kapsule. Distální exkurze jehly a její následné překrytí její dutou pochvou umožní odebrat vzorek tkáně o délce přibližně 17 mm. Pakliže je špička jehly správně umístěna na začátku výkonu, bude vzorek zasahovat prostatickou kapsulu. Obr. 8–10 zobrazují okamžik přiblížení prostatické jehly do prostaty, zachycení vzorku a pochvu překrývající a zachycující vzorek do bioptické jehly.
Obr. 8. Umístění bioptické jehly na začátku výkonu. Špička jehly (bílá šipka) směřuje do kapsuly. 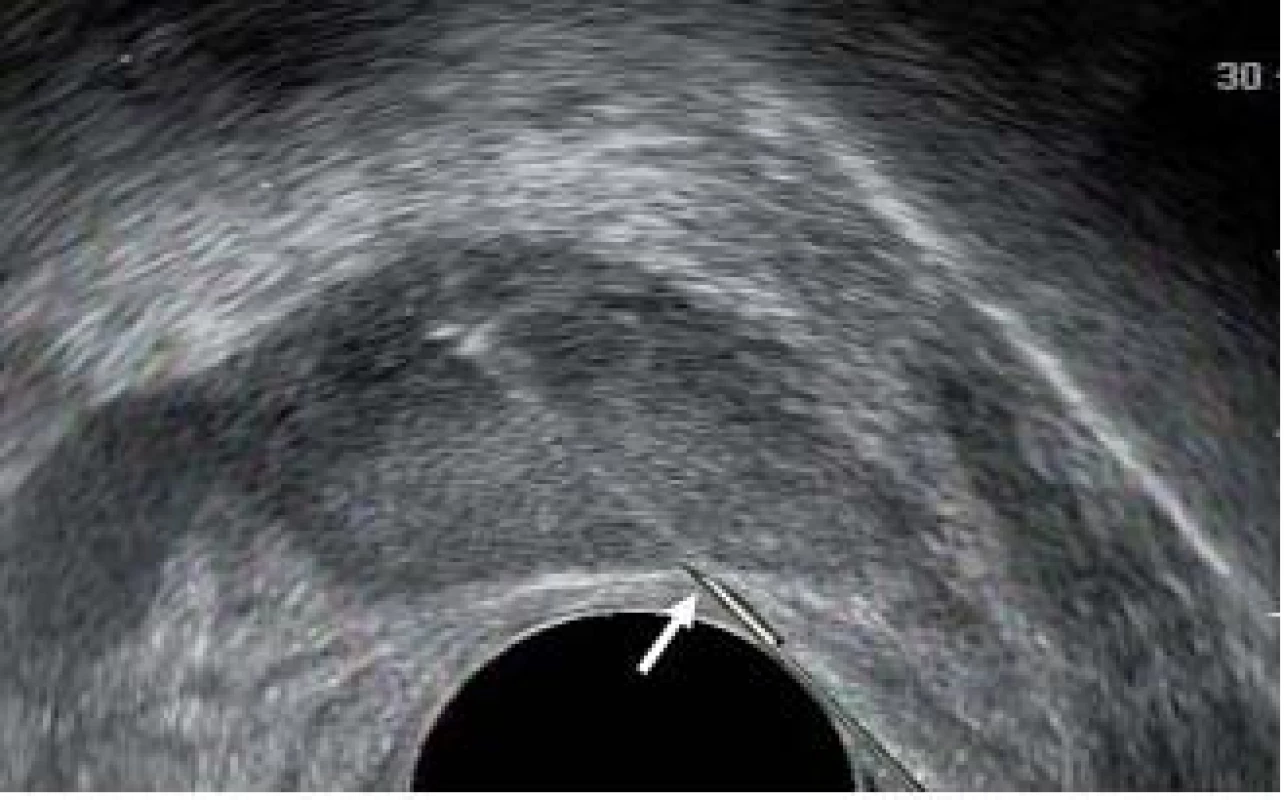
Obr. 9. Trajektorie (mezi bílými šipkami) vnitřní jehly během biopsie. 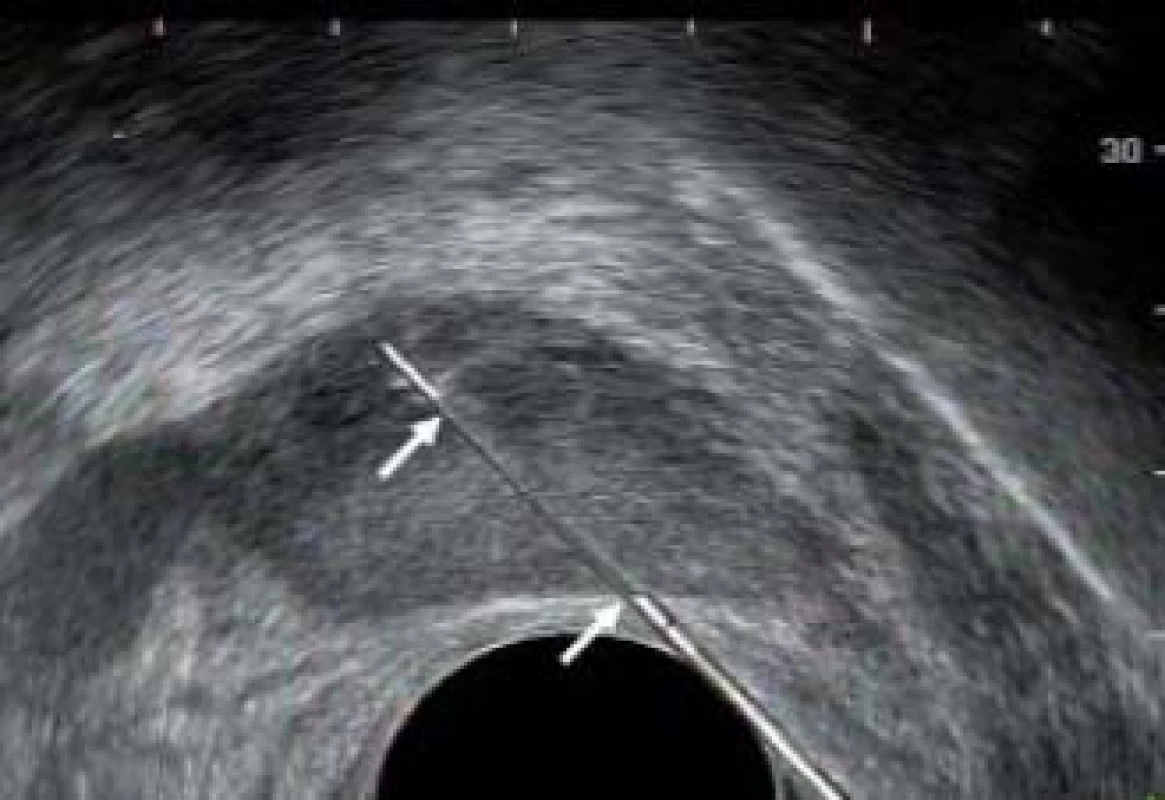
Obr. 10. Jehla překrytá distální špičkou pochvy (šipka). 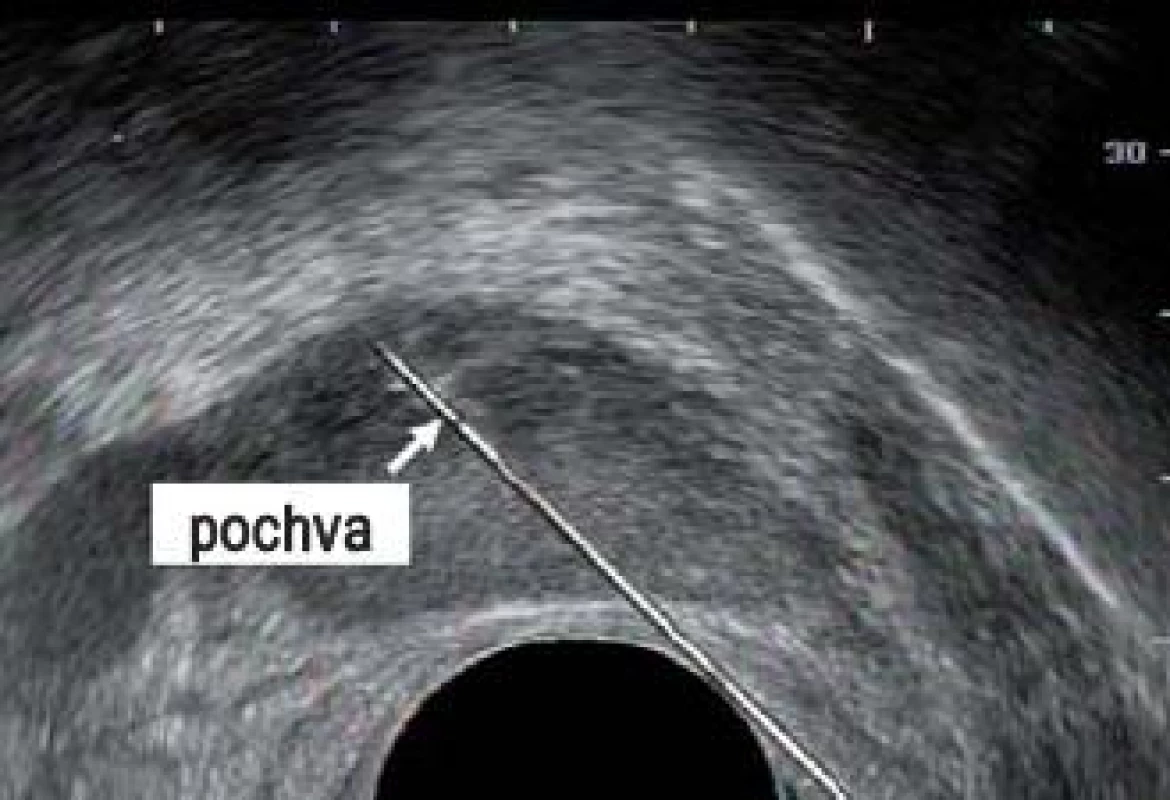
ROZŠÍŘENÁ BIOPSIE
Rozšířená biopsie je indikována v případě, že pacient podstoupil jednu nebo více biopsií podle šablony s negativním výsledkem, navzdory přetrvávajícím podezřelým klinickým nálezům, jako jsou progresivní zvýšení hladiny PSA nebo progredující abnormální nález při DRE. Indikaci rozšířené biopsie lze zvážit rovněž u pacientů s HGPIN nebo atypií.
Míra pozitivního výsledku biopsie u pacientů s HGPIN, kteří podstoupí opakovanou biopsii, se pohybuje v rozmezí 10–27 % [2,3], což svědčí o tom, že tito pacienti nemají vyšší riziko, že u nich bude detekován karcinom, než pacienti s počáteční indikací pro biopsii. Zároveň však nasvědčují tomu, že míra falešně-negativních výsledků u většiny standardních technik biopsie může dosahovat až 30 %. Riziko falešně-negativního výsledku biopsie je třeba prodiskutovat s pacientem v rámci informovaného souhlasu. Při rozšířené technice biopsie se obvykle odebírá 20–40 vzorků. Rozšířená biopsie se obvykle provádí v sedaci nebo celkové anestezii, pacient je umístěn do laterální dekubitální polohy na levém boku nebo litotomické polohy. Biopsie se provádí systematicky, z oblastí, kde byla při minulé biopsii prokázána přítomnost abnormality, jsou odebrány další vzorky. Rovněž se obvykle odebírají vzorky z obou přechodných zón. Doporučuje se získat vzorky z anatomicky obtížněji přístupných oblastí, jako jsou anteriorní rohy a apex.
Někteří autoři se domnívají, že z oblasti anteriorních laterálních rohů a anteriorní části prostaty lze vzorek lépe odebrat pomocí perineálního přístupu spíše než transrektální cestou. Při trans-perineálním „templated“ přístupu je pacient umístěn do dorzální litotomické polohy a transrektální ultrazvuková sonda je nastavena stejným způsobem jako při brachyterapii. Pomocí šablony jako navigace jsou vzorky odebrány z koronárních řezů, jak popisují Igel et al [19]. U pacientů s velkou prostatou lze vzorky odebrat z oblasti apexu a následně z báze ve stejné koronární rovině. Tato technika, jejímž autorem je Moran [20], umožňuje odebrat větší množství tkáně z anteriorní části prostaty, laterálních rohů a přechodné zóny než prostřednictvím transrektálního přístupu (obr. 11).
Obr. 11. Diagram zobrazující transperineální biopsii s použitím template (šablony). Tkáň z anteriorní distální části prostaty (A) lze snadno získat pomocí perineálního přístupu. 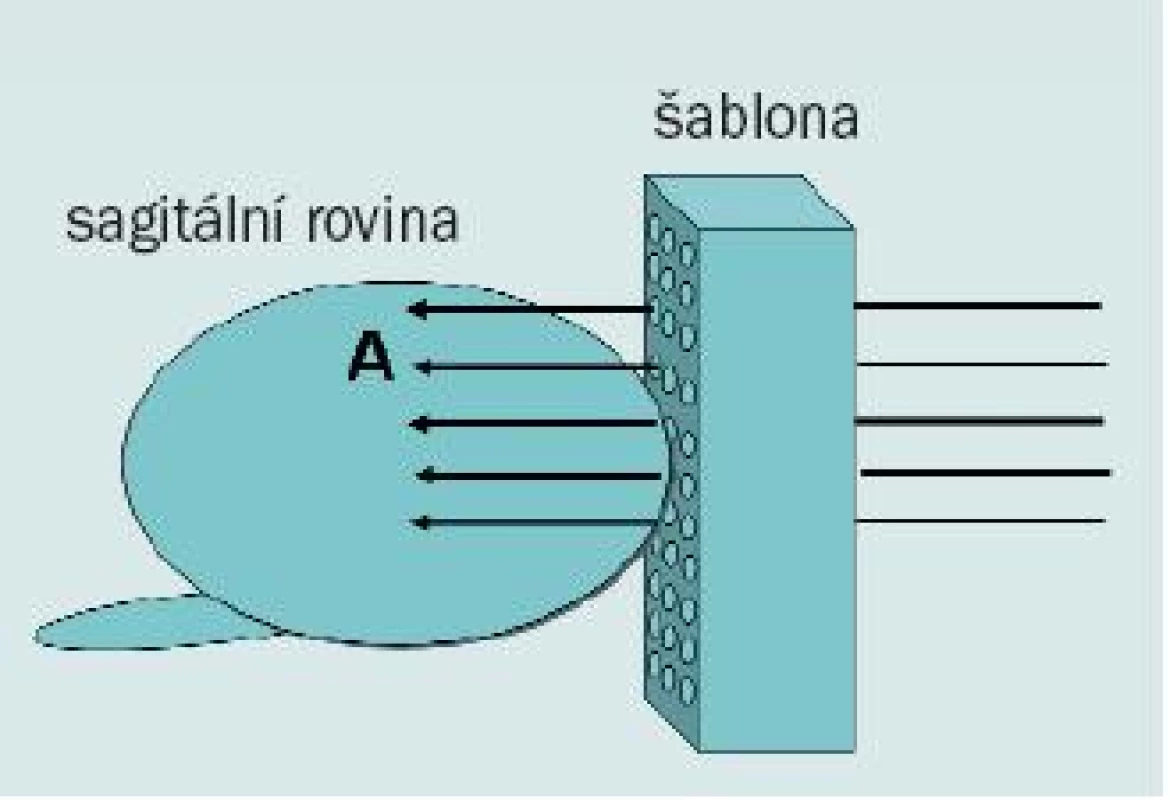
KOMPLIKACE
Obecně lze říci, že transrektálním ultrazvukem naváděná biopsie prostaty je bezpečný a pacienty dobře snášený výkon. Navzdory rozšířenému užívání lokální anestezie pociťuje velký podíl mužů během výkonu silnou bolest [21]. Mírné krvácení ve formě hematurie (39–58 %), hematospermie (28–45 %) a hematochezie (21–37 %) se vyskytuje tak často, že je lze považovat spíše za následek procedury než za komplikaci. Během 72 hod po výkonu může pacient obvykle pozorovat krev v moči nebo stolici, v ejakulátu krev přetrvává i několik týdnů.
Závažné komplikace TRUS/BX zahrnují febrilní UTI/sepsi (< 1 %) [9], krvácení z rekta vyžadující transfuzi nebo endo-skopický zákrok (0,7–4 %) [9,22], vazovagální reakci, močovou retenci a epididymitidu (< 1 %) (tab. 2) [23].
Tab. 2. Komplikace spojené s TRUS/BX. 
Pacienta je vhodné po biopsii krátkou dobu sledovat, abychom se ujistili o tom, že nedošlo k aktivnímu krvácení z rekta. Řada pacientů pociťuje chvíli po biopsii přechodnou nevolnost nebo dyskomfort v oblasti rekta, ovšem bez nepříznivých důsledků. Nevolnost v kombinaci s tachykardií však bývá známkou akutního krvácení a distenze rekta. V tomto případě je vhodné pacienta poslat před propuštěním na toaletu, abychom se přesvědčili o tom, zda z rekta neuniká velké množství krve. V případě, že pacient krvácí, pokusíme se o kompresi rektální stěny pomocí digitálního rektálního vyšetření nebo znovu-zavedením sondy, pomocí níž vyvineme tlak proti posteriornímu aspektu prostaty. V případě závažnějšího krvácení zavedeme do rekta velký Foleyho katétr (24–26 F) s balonkem naplněným 50 ml sterilní vody, jenž obvykle poskytne dostatečnou kompresi pro zastavení lokálního krvácení.
Infekce, ač často plíživá, může představovat pro pacienta závažnou hrozbu. Pacienti, u nichž dojde po TRUS/BX ke vzniku infekce, mohou během dalších 24–72 hod pociťovat zimnici a horečku. V tomto případě obvykle rychle zabere orální aplikace antibiotik. V případě, že je detekována E. coli rezistentní na aplikaci chinolonů, může být nutná změna antibiotika. V některých případech může dojít ke vzniku mikroabscesů v prostatě [24], což je doprovázeno dlouhotrvající zvýšenou teplotou, obtížným močením a tlakem v oblasti perinea. V tomto případě může být nezbytné provedení dalších zobrazovacích vyšetření, hospitalizace pacienta a i.v. aplikace antibiotik [23]. Někteří pacienti mohou pociťovat přechodné obtíže při močení související s podrážděním prostaty nebo močové trubice nebo vznikem otoku. Až u 1 % pacientů může dojít ke vzniku akutní močové retence vyžadující přechodné zavedení katétru. U pacientů s méně závažnou mikční dysfunkcí může pomoci aplikace alfablokátorů.
U 1–8 % pacientů dochází k vazovagální reakci, pro niž je charakteristická bradykardie, hypotenze a bledost ve tváři. Zívání může být varovným znakem nadcházející ztráty vědomí. Bradykardie představuje nejspolehlivější parametr pro rozlišení vazovagální reakce a akutní ztráty krve. U většiny pacientů vazovagální reakce odezní během 15–20 min. Doporučuje se sledovat pacienta, monitorovat životní funkce a zabránit případnému pádu. Před tím, než pacient vstane, je vhodné jej chvíli sledovat v sedě, čímž můžeme předejít komplikacím v podobě vazovagální reakce nebo ztráty vědomí.
ZÁVĚR
Biopsie prostaty naváděná pomocí ultrazvuku představuje jednu z nejefektivnějších diagnostických metod v současné medicíně. Tato modalita vykazuje 40–50% míru pozitivní biopsie.
Klíčem pro přesný výsledek a zajištění pacientovy bezpečnosti je vhodná příprava, zobrazovací technika a systematický přístup při odebírání vzorku.
Pat Fox Fulgham, MD
Director of Surgical Oncology Services
Texas Health Presbyterian Hospital of Dallas
8230 Walnut Hill Lane Suite 700
Dallas, TX 75231
pfulgham@airmail.net
Zdroje
1. Frauscher F, Klauser, A, Volgger H et al. Comparison of contrast enhanced color doppler targeted biopsy with conventional systematic biopsy: impact on prostate cancer detection. J Urol 2002; 167(4): 1648–1652.
2. Djavan B, Zlotta A, Remzi M et al. Optimal predictors of prostate cancer on repeat prostate biopsy: a prospective study of 1,051 men. Urol 2000; 163(4): 1144–1149.
3. Fowler J, Bigler S, Miles D et al. Predictors of first repeat biopsy cancer detection with suspected local stage prostate cancer. J Urol 2000; 163(3): 813–818.
4. Ghani K, Rockall A, Nargund V et al. Prostate biopsy: to stop anticoagulation or not? BJU Int 2006; 97(2): 224–225.
5. Rodriguez LV, Terris MK. Risks and complications of transrectal ultrasound guided prostate needle biopsy: a prospective study and review of the literature. J Urol 1998; 160 (6 Pt 1): 2115–2120.
6. Maan Z, Cutting CW, Patel U et al. Morbidity of transrectal ultrasonography-guided prostate biopsies in patients after the continued use of low-dose aspirin. BJU Int 2003; 91(9): 798–800.
7. Jeon S, Woo S, Hyun J et al. Bisacodyl rectal preparation can decrease infectious complications of trans-rectal ultrasound-guided prostate biopsy. Urology 2003; 62(3): 461–466.
8. Lindert K, Kabalin J, Terris M. Bacteremia and bacteriuria after transrectal ultrasound-guided prostate biopsy. J Urol 2000; 164(1): 76–80.
9. Sieber P, Rommel F, Theodoran C et al. Contemporary prostate biopsy complication rates in community-based urology practice. Urology 2007; 70(3): 498–500.
10. Advisory Statement: Antibiotic prophylaxis for urological patients with total joint replacement issued by the American Urological Association and the American Academy of Orthopedic Surgeons. Accessed via the world wide web 1/3/08: http://www.auanet.org/ guidelines/main_reports/antibiotic_prophylaxis.pdf
11. Kravchick S, Peled R, Ben-Dor D et al. Comparison of different local anesthesia techniques during TRUS-guided biopsies: a prospective pilot study. Urology 2005; 65(1): 109–113.
12. Taverna G, Maffezzini M, Benetti A et al. A single injection of lidocaine as local anesthesia for ultrasound guided needle biopsy of the prostate. J Urol 2002; 167(1): 222–223.
13. Cevik I, Dillioglugil O, Zisman A et al. Combined “periprostatic and periapical” local anesthesia is not superior to “periprostatic” anesthesia alone in reducing pain during tru-cut prostate bipsy. Urology 2006; 68(6): 1215–1219.
14. Lee H, Byun S, Lee S et al. Effect of intraprostatic local anesthesia during transrectal ultrasound guided prostate biopsy: comparison of 3 methods in a randomized, double-blind, placebo controlled trial. J Urol 2007; 178(2): 469–472.
15. Kravchick S, Cytron S, Peled R et al. Optimal combinations for detection of prostate cancer: systematic sextant and laterally directed biopsies versus systematic sextant and color Doppler-targeted biopsies. Urology 2004; 63(2): 301–305.
16. Hodge K, McNeal J, Terris M et al. Random systematic versus directed ultrasound guided transrectal core biopsies of the prostate. J Urol 1989; 142(1): 71–75.
17. Remzi M, Fong Y, Dobrovits M et al. The Vienna nomogram: validation of a novel biopsy strategy defining the optimal number of cores based on patient age and total prostate volume. J Urol 2005; 174 (4 Pt 1): 1256–1261.
18. Renfer L, Schow D, Thompson I et al. Is ultrasound guidance necessary for transrectal prostate biopsy? J Urol 1995; 154(4): 1390–1391.
19. Igel T, Knight M, Young P et al. Systematic transperineal ultrasound guided template biopsy of the prostate in patients at high risk. J Urol 2001; 165(5): 1575–1579.
20. Moran B, Braccioforte M, Conterato D. Re-biopsy of the prostate using a stereotactic transperineal technique. J Urol 2006; 176 (4 Pt 1): 1376–1381.
21. Altman A, Resnick M. Ultrasonographically guided biopsy of the prostate gland. J Ultrasound Med 2001; 20(2): 159–167.
22. Ghani K, Dundas D, Patel U. Bleeding after transrectal ultrasonography-guided prostate biopsy: a study of 7-day morbidity after a six-, eight - and 12-core biopsy protocol. BJU Int 2004; 94(7): 1014–1020.
23. Donzella J, Merrick G, Lindert D et al. Epididymitis after transrectal ultrasound-guided needle biopsy of prostate gland. Urology 2004; 63(2): 306–308.
24. Fisher M, Nisenbaum H, Axel L et al. Prostatic abscess due to aspergillus fumigatus: TRUS and MR imaging findings. J Ultrasound Med 1998; 17(3): 181–184.
Štítky
Dětská urologie Urologie
Článek Screening karcinomu prostatyČlánek Ze zahraničních periodik
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2011 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Nostiriazyn – spolehlivá 1. volba u nekomplikovaných infekcí močových cest
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Vysoká hladina PSA a její rychlý nárůst jsou nepříznivými prognostickými faktory u karcinomu prostaty
-
Všechny články tohoto čísla
- Screening karcinomu prostaty
- Transrektální biopsie prostaty naváděná ultrazvukovým vyšetřením
- Rehabilitace erektilní funkce po radikální prostatektomii: současný stav
- Přehled nejnovějších technologií pro léčbu karcinomu prostaty (robotické systémy, laparoskopie, brachyterapie, kryoterapie, technologie Cyberknife)
- Budou dosaženy očekávané počty nádorů ledvin a močového měchýře?
- Zanedbání profesionální péče při výkonu lékařského povolání v urologické praxi v USA: trendy a analýza
- Antimuskarinika při léčbě OAB
- Korekce pánevního prolapsu pomocí augmentace s užitím síťky ze syntetického materiálu
- Zpráva z konference AUA Annual Meeting 2011, Washington, D.C., USA
- Možnosti primární prevence karcinomu prostaty – běžná klinická praxe, nereálná fikce nebo blízká budoucnost?
- Ze zahraničních periodik
- EAU Guidelines pro léčbu karcinomu prostaty - Část první: Screening, diagnostika a léčba klinicky lokalizovaného karcinomu
- EAU Guidelines pro léčbu karcinomu prostaty - Část druhá: Léčba pokročilého, recidivujícího karcinomu prostaty rezistentního vůči kastraci
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Přehled nejnovějších technologií pro léčbu karcinomu prostaty (robotické systémy, laparoskopie, brachyterapie, kryoterapie, technologie Cyberknife)
- Transrektální biopsie prostaty naváděná ultrazvukovým vyšetřením
- Korekce pánevního prolapsu pomocí augmentace s užitím síťky ze syntetického materiálu
- Rehabilitace erektilní funkce po radikální prostatektomii: současný stav
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



