-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaAntimuskarinika při léčbě OAB
Key words:
antimuscarinics, OAB, DO
Autoři: A. L. Smith; A. J. Wein
Působiště autorů: Division of Urology at PENN Medicine ; University of Pennsylvania School of Medicine, Philadelphia, PA, USA ; Pelvic Medicine & Reconstructive Surgery
Vyšlo v časopise: Urol List 2011; 9(2): 49-56
Souhrn
Klíčová slova:
antimuskarinika, OAB, hyperaktivní detruzorPříčinou poruchy plnicí a shromažďovací funkce dolních cest močových (LUT) může být přítomnost patologie v močovém měchýři, ve výtoku z močového měchýře, případně v obou strukturách [1]. Nejčastější etiologií této poruchy je hyperaktivita detruzoru (DO), jež se symptomaticky projevuje hyperaktivitou močového měchýře (OAB). Pro OAB je charakteristická urgence, s nutkavou inkontinencí, nebo bez ní (UUI), jež může souviset s nykturií a změnami ve frekvenci močení [1]. Pro DO jsou typické mimovolní kontrakce (diskrétní a fazické). Mimovolní kontrakce obvykle souvisí s neurologickým onemocněním, zánětlivými procesy v močovém měchýři, obstrukcí výtoku z močového měchýře a vyšším věkem. Kontrakce mohou být dvojího typu: vyvolané stresem nebo idiopatické.
Druhou nejčastější příčinou poruchy plnicí/shromažďovací funkce je narušená kompliance močového měchýře. Komplianci lze definovat jako podíl změny objemu močového měchýře a tomu odpovídající změny tlaku. Při cystometrii je narušená kompliance často zaměňována s DO. Poruchu kompliance však lze rozeznat na základě postupného zvyšování tlaku detruzoru s následným poklesem.
Narušená kompliance močového měchýře je obvykle důsledkem neurologického onemocnění, může však být vyvolána jakýmkoli procesem, který poškozuje elastické či viskoelastické vlastnosti stěny močového měchýře. Léčba těchto onemocnění spočívá v omezení aktivity nebo zvýšení kapacity močového měchýře.
Za medikamentózní léčbu OAB první volby je v současnosti považována aplikace antimuskarinik [2]. K dispozici máme celou řadu preparátů, které se liší kvalitou i kvantitou studií testujících jejich účinnost. ICI (International Consultation on Incontinence) uveřejnila doporučení pro všechny dostupné preparáty (tab. 1). Klinická doporučení jsou založena na hodnocení pomocí Oxford Centre for Evidence-based Medicine (www.cebm.net/index, aspx?o=1025). V současné době bohužel nejsou k dispozici žádné head-to-head studie, které by srovnávaly všechny preparáty. Podobné studie by poskytly cenné údaje pro tvorbu doporučení pro léčbu OAB.
Tab. 1. Preparáty užívané při léčbě OAB/DO. Hodnocení na základě Oxford Centre for Evidence-based Medicine (modifikováno). 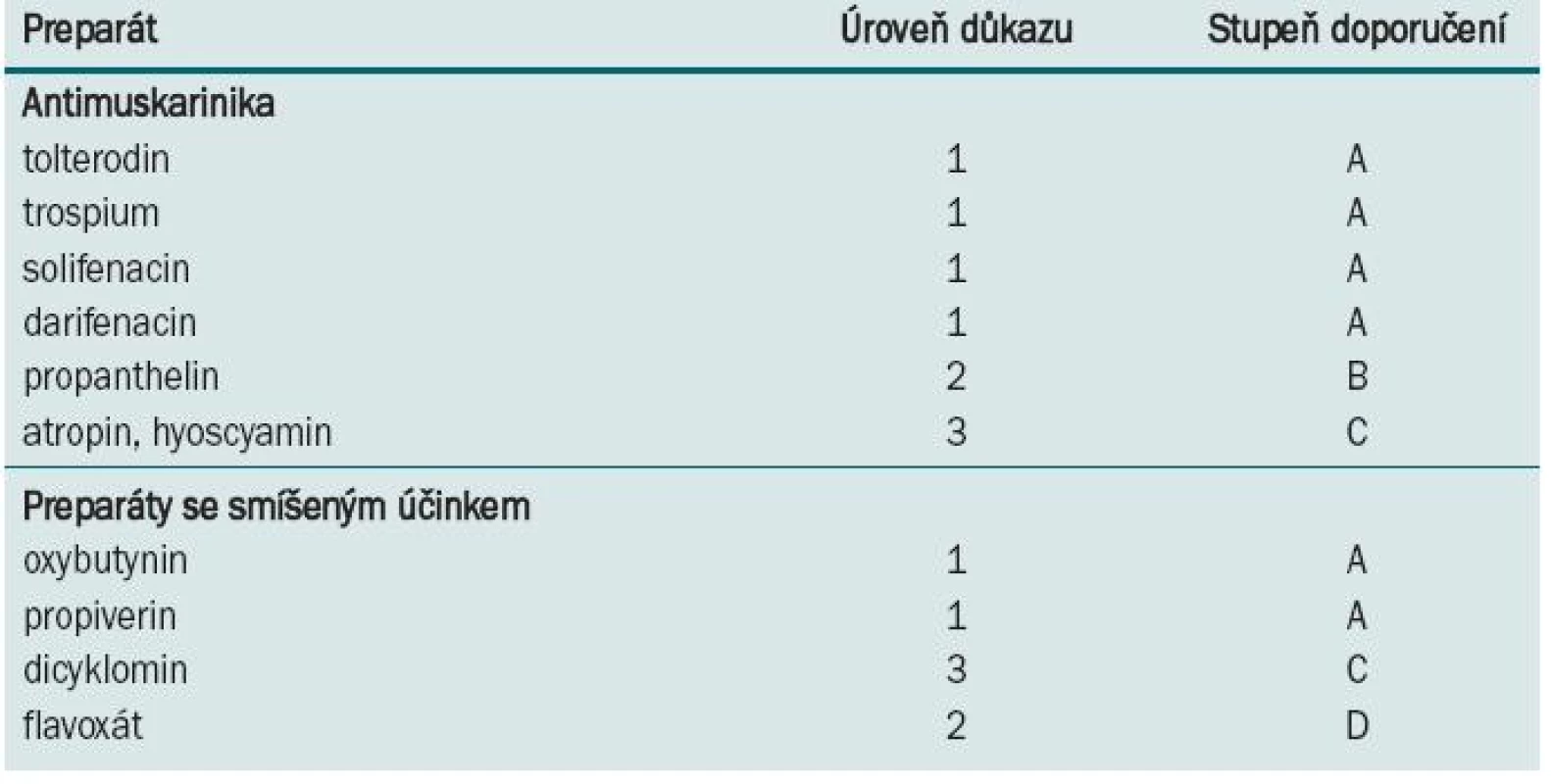
ANTIMUSKARINIKA
Předpokládá se, že fyziologické kontrakce močového měchýře jsou primárně vyvolány ACh (acetylcholin) stimulací postganglionických, parasympatických, muskarinních cholinergních receptorů v hladké svalovině močového měchýře [1,3].
Atropin a další antagonisté, kteří se váží na tyto ACh receptory, potlačují normální kontrakce močového měchýře a mimovolní kontrakce jakéhokoli původu [3,4]. Aplikace těchto preparátů rovněž zvětšuje objem do první mimovolní kontrakce, celkovou kapacitu močového měchýře a snižuje amplitudu kontrakcí [5].
Obvykle se předpokládá, že antimuskarinika se váží na receptory stimulované ACh ve svalovině detruzoru. Během plnicí fáze však není přítomen žádný sakrální parasympatický signál [6], což vyvolává otázku, proč antimuskarinika ovlivňují plnicí fázi mikčního cyklu, zvyšují kapacitu močového měchýře u pacientů s OAB/bez DO a zmírňují urgenci. Muskarinní receptory se nachází rovněž v urotelu a suburotelu močového měchýře [7]. K určitému bazálnímu uvolňování ACh dochází i ve svalovině detruzoru. Tento ACh může být produkován (alespoň částečně) v urotelu a suburotelu [8]. Tato zjištění nasvědčují tomu, že tonus detruzoru může být ovlivňován neustálou stimulací ACh. Přímé experimentální důkazy prokazují, že antimuskarinika potlačují aktivitu v aferentních nervových vláknech C i A-delta z močového měchýře během plnicí fáze [9,10]. Ve skutečnosti existuje pouze minimum důkazů o tom, že by antimuskarinika (v současně užívaném dávkování pro léčbu OAB) způsobovala významné zmírnění kontrakcí při močení (obr. 1).
Obr. 1. Vysvětlení pro užívání antimuskarinik při léčbě OAB/DO. Blokáda muskarinních receptorů v detruzoru i mimo něj může zabránit vzniku symptomů OAB a DO bez současného potlačení kontrakcí během močení. 
V nedávné době provedená meta-analýza srovnávající účinnost antimuskarinik prokázala, že tato agens dosahují lepší účinnosti než placebo jak s ohledem na počet dní bez výskytu inkontinence, tak na průměrný objem moči i počet příhod urgence i frekvence močení [11]. Většina testovaných preparátů zlepšovala kvalitu života pacienta (související se zdravotním stavem). Na základě velkého vzorku pacientů lze říci, že všechna v současné době dostupná antimuskarinika mají srovnatelný účinek, ale vykazují měřitelné rozdíly ve snášenlivosti [12]. Profil i dávkování jednotlivých preparátů se liší. Při volbě vhodné léčby u jednotlivých pacientů je třeba tuto skutečnost zohlednit spolu s komorbitami a další současnou medikací.
V současné době dostupná antimuskarinika nepůsobí selektivně na močový měchýř, v důsledku čehož působí vedlejší účinky na ostatní orgánové systémy. Nejčastější vedlejší účinky zahrnují suchost v ústech, rozmazané vidění, pruritus, tachykardii, ospalost, poruchu kognitivních funkcí a bolest hlavy. Jako nejobtížnější vedlejší účinek pacienti uvádí zácpu [11]. Užívání antimuskarinik je kontraindikováno u pacientů trpících močovou retencí, gastrickou retencí a dalšími závažnými poruchami motility gastrointestinálního systému a nekontrolovaným glaukomem s uzavřeným úhlem.
Uvádíme charakteristiku a údaje o účinku některých antimuskarinik a srovnání jejich účinnosti s dalšími preparáty v této třídě.
Atropin
Atropin je (spolu s hyoscyaminem a skopolaminem) aktivní alkaloid jedovaté rostliny Atropa bella-dona (rulík zlomocný), jež vykazuje anticholinergní vlastnosti [10]. Užívání atropinu je spojeno s významnými systémovými vedlejšími účinky jako např. ventrikulární fibrilace, tachykardie, malátnost, nevolnost, rozmazané vidění, porucha stability, rozšířené zornice, fotofobie, extrémní zmatenost a asociativní halucinace, které jsou překážkou orální aplikaci tohoto preparátu při léčbě OAB. V tomto výčtu je atropin zmíněn spíše z důvodu jeho dřívějšího užívání.
Darifenacin
Darifenacin je terciární mírně lipofilní amin. Jedná se o poměrně selektivního antagonistu muskarinního receptoru M3. Přinejmenším teoretický benefit darifenacinu oproti ostatním antimuskarinikům spočívá v jeho schopnosti selektivně blokovat receptor M3, který (ačkoli je méně prevalentní než receptor M2) pravděpodobně hraje významnou roli při kon-trakci močového měchýře. Předpokládá se, že tato receptorová selektivita zvyšuje účinnost léčby u pacientů s OAB při současném snížení výskytu nepříznivých účinků souvisejících s blokádou ostatních muskarinních receptorů [13]. Darifenacin se dodává ve formě s postupným uvolňováním, což umožňuje každodenní aplikaci. K dispozici je v dávkách 7,5 a 15 mg.
Chapple et al v roce 2005 publikovali přehled údajů ze tří multicentrických, dvojitě zaslepených, randomizovaných studií III. fáze testujících účinnost darifenacinu [14]. Celkem 1 059 pacientů (85 % ženského pohlaví) trpících symptomy OAB (urgence, UUI a zvýšená frekvence mikce) užívalo denně 7,5 mg nebo 15 mg darifenacinu nebo placeba po dobu 12 týdnů. U pacientů užívajících preparát byl zaznamenán signifikantní pokles počtu příhod inkontinence za týden v závislosti na aplikované dávce: průměrně o 8,8 příhod za týden méně u pacientů užívajících 7,5mg dávku a o 10,6 příhod za týden méně u pacientů užívajících 15mg dávku. Rovněž bylo zaznamenáno zlepšení v oblasti frekvence močení, kapacity močového měchýře a závažnosti urgence. Nejčastější vedlejší účinky zahrnovaly suchost v ústech a zácpu, ačkoli pouze minimum pacientů v důsledku těchto komplikací léčbu ukončilo.
Randomizovaná, dvojitě zaslepená, třikrát zkřížená studie zahrnující 129 pacientů ve věku ≥ 65 let hodnotí efekt aplikace darifenacinu na kognitivní funkci [15]. Po dvoutýdenní léčbě nebyl zaznamenán žádný dopad preparátu na kognitivní funkce (oproti počátečnímu stavu). Autoři předpokládají, že tento výsledek je pravděpodobně zapříčiněn relativně selektivním účinkem darifenacinu na receptor M3.
Fesoterodin
Fesoterodin je novější preparát z třídy antimuskarinik, který je rychle metabolizován na 5-HMT (5-hydroxymethyl tolterodin). Tento aktivní metabolit je stejný jako jiné antimuskarinikum – tolterodin [16]. 5-HMT je metabolizován v játrech. K významné exkreci dochází rovněž v ledvinách (ovšem bez další metabolizace), což vzbuzuje možnost, že 5-HMT může účinkovat rovněž z vnitřní strany močového měchýře [17]. Fesoterodin je indikován pro léčbu DO v denní dávce 4 nebo 8 mg.
Multicentrická, dvojitě zaslepená, randomizovaná kontrolovaná studie zahrnující 1 132 pacientů testuje účinnost fesoterodinu s postupným uvolňováním [16]. Tato studie prokázala, že fesoterodin v dávkování 4 i 8 mg denně vede ke zlepšení symptomů OAB. Dávka 8 mg vykazovala vyšší účinnost za cenu vyšší míry výskytu suchosti v ústech. Pouze jeden subjekt z každé skupiny léčbu v důsledku suchosti v ústech ukončil. Závislost účinku na velikosti dávky potvrdila i další studie na základě údajů dvou randomizovaných, kontrolovaných studií III. fáze [18]. Na základě údajů, jež pacienti zaznamenávali do mikčního diáře, bylo zjištěno, že fesoterodin v dávkování 8 mg byl účinnější jak s ohledem na zmírnění urgence, tak i UUI než v dávkování 4 mg, což nabízí možnost titrace dávky.
Propanthelin bromid
Jedná se o klasické antimuskaranikum užívané pro svůj účinek na LUT. Propanthelin bromid je neselektivní kvarterní amoniová sloučenina, která se při perorální aplikaci špatně vstřebává [10]. Tento preparát má krátký poločas rozpadu < 2 hod a různou biologickou dostupnost vyžadující individuální titraci dávky. Léčba je zahájena v dávkování 15–30 mg denně/čtyřikrát denně, ačkoli často je nezbytné dávku zvýšit [19]. Navzdory tomu, že tento preparát má vazebný potenciál podobný atropinu, o jeho účinnosti při léčbě OAB/DO neexistuje dostatek přesvědčivých důkazů. Publikované studie uvádí protichůdné výsledky. Zatímcojedna ze studií prokázala kompletní odpověď na propanthelin bromid u 25 ze 26 pacientů [20], jiná studie neprokázala žádný rozdíl mezi aplikací propanthelin bromidu a placebem u 154 pacientů s DO [21]. Další studie zahrnující 23 žen s DO neprokázala mezi oxybutyninem a propanthelinem žádný významný rozdíl v úlevě symptomů [22]. Účinek propanthelinu při léčbě DO však nebyl dostatečně zaznamenán v randomizovaných kontrolovaných studiích podle současných standardů. Na základě dlouhodobých zkušeností s aplikací propanethelinu však lze tento preparát považovat za účinný a při individuální titraci dávky může být klinicky užitečný.
Solifenacin
Solifenacin je terciární amin s částečnou selektivitou na M3 receptor – oproti receptoru M2 a pouze okrajovou selektivitou na M3 receptor – oproti receptoru M1 [1,23]. Tento preparát je k dispozici v dávkování 5 a 10 mg a užívá se jednou denně. Abrams et al uskutečnili mezinárodní, randomizovanou, kontrolovanou studii, jež srovnává účinnost každodenní aplikace solifenacinu v dávkování 5 a 10 mg s placebem u 857 pacientů [1]. Na základě údajů mikčního diáře, které pacienti zaznamenávali po dobu tří dnů, bylo zjištěno, že solifenacin v obou dávkách vede (ve srovnání s placebem) k signifikantnímu zmírnění frekvence i urgence močení, zvětšení vymočeného objemu a poklesu počtu příhod inkontinence. Ze všech pacientů, kteří před zahájením léčby uváděli výskyt inkontinence, bylo kontinentních 50 % užívajících solifenacin a 27,9 % užívajících placebo. Pocit suchosti v ústech uvádí 7,7 % pacientů užívajících 5 mg solifenacinu, 23,1 % pacientů užívajících 10 mg solifenacinu a 2,3 % pacientů užívajících placebo. Pouze malé procento pacientů nedokončilo léčbu z důvodu výskytu vedlejších účinků (2–4 %). Toto procento bylo srovnatelné ve všech skupinách.
Prospektivní, dvojitě zaslepená studie STAR (Solifenacin and Tolterodine as an Active Comparator in a Randomized Trial) srovnává účinnost 5 a 10 mg solifenacinu s 4 mg tolterodinu s postupným uvolňováním (aplikace jednou denně po dobu 12 týdnů) [24]. Po 4 týdnech léčby měli pacienti možnost navýšit užívanou dávku. Dávka však byla ve skutečnosti zvýšena pouze pacientům užívajícím solifenacin. Výsledky ukazují, že flexibilní proto-kol dávkování solifenacinu nedosahuje (s ohledem na frekvenci močení) horších výsledků než tolterodin s postupným uvolňováním. Aplikace solifenacinu vedla (ve srovnání s tolterodinem s postupným uvolňováním) k poklesu počtu příhod urgence, inkontinence a počtu užitých vložek. Na základě údajů mikčního diáře, které pacienti zaznamenávali po dobu tří dnů, bylo zjištěno, že na konci studie byl kontinentní větší počet pacientů užívajících solifenacin než pacientů užívajících tolterodin (59 vs 49 %).
Zmírnění symptomů však bylo doprovázeno vyšší incidencí nepříznivých příhod – suchost v ústech u 30 % a zácpa u 6,4 % subjektů ve skupině pacientů užívajících solifenacin a 23 % a 2,5 % ve skupině pacientů užívajících tolterodin. Počet pacientů, kteří ukončili léčbu, byl v obou skupinách poměrně nízký.
Tolterodin
Tolterodin je terciární amin s hlavním aktivním metabolitem 5-HMT, jenž se významně podílí na účinku tohoto preparátu [25]. Tolterodin i jeho metabolit mají poločas rozpadu 2–3 hod, jejich účinek na močový měchýř se však zdá dlouhodobější. Zda je to zapříčiněno vylučováním preparátu do moči a jeho následným působením přímo na sliznici močového měchýře, nebylo dosud prokázáno. Tolterodin je k dispozici ve dvou formách: s okamžitým účinkem – dávkování 2 mg dvakrát denně, anebo s postupným uvolňováním – 2 nebo 4 mg jednou denně. Forma s postupným uvolňováním je pravděpodobně účinnější a pacienty lépe snášena [1]. Užívání tolterodinu je spojeno s nízkou incidencí vedlejších účinků ovlivňujících kognitivní funkce, lék i jeho metabolit mají nízkou lipofilicitu, což minimalizuje pronikání preparátu do CNS [26].
Účinnost tolterodinu u pacientů s DO byla prokázána v několika dvojitě zaslepených, randomizovaných, kontrolovaných studiích. Studie IMPACT (Improvement in Patiens: Assessing Symptomatic Control with Tolterodine Extended-Release) hodnotí účinnost tolterodinu na nejvíce obtěžující symptomy [27]. Výsledky ukazují, že léčba vede k významnému zmírnění všech obtěžujících symptomů – snížení počtu příhod inkontinence, urgence i frekvence mikce. Vedlejší účinky v podobě suchosti v ústech se vyskytovaly u 10 % pacientů a v podobě zácpy u 4 % pacientů.
Studie OPERA (Overactive Bladder: Performance of Extended-Release Agents) srovnává každodenní užívání tolterodinu (4 mg) a jiného antimuskarinika – oxybutyninu (10 mg) s postupným uvolňováním u 790 žen se symptomy OAB [28]. Jedná se o dvojitě zaslepenou, randomizovanou kontrolovanou studii, která trvala celkem 12 týdnů. U obou skupin byl zaznamenán srovnatelný pokles počtu příhod UUI, aplikace oxybutyninu však častěji vedla k vyléčení onemocnění (23,0 vs 16,8 % u pacientů užívajících tolterodin s postupným uvolňováním). Aplikace oxybutyninu s postupným uvolňováním byla rovněž účinnější při zmírnění frekvence močení, ovšem za cenu častějšího výskytu suchosti v ústech. Míra výskytu vedlejších účinků byla poměrně nízká, počet pacientů, kteří léčbu ukončili, byl v obou skupinách srovnatelný.
Trospium
Trospium je hydrofilní kvarterní amin s omezenou schopností průchodu přes hematoencefalickou bariéru. Aplikace tohoto preparátu by tedy, alespoň teoreticky, měla minimálně ovlivňovat kognitivní funkce [29]. Trospium je vylučováno do moči prakticky nezměněno renální tubulární sekrecí, díky čemuž může působit na signální dráhy uroteliální sliznice (jak bylo prokázáno na krysím modelu) [30]. Zda tento mechanizmus přispívá ke klinickému účinku rovněž u lidí, není zatím známo.
Jünemann et al srovnávají účinek aplikace 20 mg trospia dvakrát denně a 2 mg tolterodinu dvakrát denně u 232 pacientů s DO nebo smíšenou močovou inkontinencí v placebem kontrolované studii. Autoři dospěli k závěru, že aplikace trospia podstatně účinněji snižuje frekvenci močení než aplikace tolterodinu i placeba [31]. Tento preparát způsobuje rovněž větší pokles počtu příhod inkontinence, míra výskytu suchosti v ústech byla v obou skupinách srovnatelná.
Halaska et al srovnávají dlouhodobou snášenlivost a účinnost 20 mg trospia dvakrát denně a 5 mg oxybutyninu dvakrát denně u 358 pacientů s DO po dobu 52 týdnů [32]. Autoři hodnotili výsledky urodynamické studie a záznamy v mikčním diáři pacienta před zahájením léčby, po 26 týdnech a po 52 týdnech léčby. U pacientů užívajících trospium došlo k průměrnému zvýšení maximální cystometrické kapacity o 92 ml po 26 týdnech a o 115 ml po 52 týdnech. Mezi oběma skupinami nebyly zaznamenány žádné další významné urodynamické rozdíly. Údaje z mikčního diáře prokazují, že léčba vedla k poklesu frekvence močení, frekvence příhod inkontinence i počtu příhod urgence (v obou skupinách). Minimálně jedna nepříznivá příhoda se vyskytla u 64,8 % pacientů užívajících trospium a u 76,6 % pacientů užívajících oxybutynin. Nejčastějším vedlejším účinkem byla v obou větvích studie suchost v ústech. Celkově lze říci, že oba preparáty jsou srovnatelné s ohledem na zmírnění močových symptomů, trospium však má díky lepší snášenlivosti preparátu příznivější poměr benefit – riziko.
Několik randomizovaných kontrolovaných studií prokázalo, že aplikace trospia ve formě s postupným uvolňováním (60 mg jednou denně) má srovnatelný účinek i incidenci vedlejších účinků jako aplikace dvou dávek denně [33]. Jednoduše zaslepená, randomizovaná, kontrolovaná studie z jednoho centra hodnotí účinnost intravezikální aplikace trospia u 84 pacientů [34]. Vzhledem k tomu, že se při intravezikální aplikaci trospium nevstřebává systematicky, nabízí se zde možnost terapie s minimálním výskytem systémových účinků [35]. Ve srovnání s placebem vede intravezikální aplikace trospia k významnému zvýšení maximální kapacity močového měchýře a poklesu tlaku detruzoru. Nebylo zaznamenáno žádné zlepšení netlumených kontrakcí detruzoru a žádný výskyt nepříznivých účinků s výjimkou zvětšení objemu reziduální moči.
DUÁLNÍ MUSKULOTROPNÍ RELAXANCIA: ANTIMUSKARINIKA
U některých preparátů byl prokázán dvojí účinek – antimuskarinní mechanizmus v kombinaci s přímým muskulotropním účinkem na hladkou svalovinu močového měchýře v oblasti, jež se nalézá meta-bolicky distálně od antimuskarinního receptoru.
Klinický účinek těchto agens je primárně připisován jejich antimuskarinnímu efektu.
Flavoxát
Flavoxát má přímý inhibiční účinek na hladkou svalovinu a kromě toho vykazuje velmi slabé anticholinergní vlastnosti [36]. Tento preparát vykazuje rovněž slabý účinek antagonisty kalcia, lokální anestetický efekt a je schopen inhibovat fosfodiesterázu [37]. Studie na zvířecích modelech (kočkách a krysách) rovněž poskytují důkazy o tom, že flavoxát může vykazovat centrální účinek na inhibici mikčního reflexu [38,39].
Výsledky klinických studií testujících účinnost flavoxátu při léčbě OAB a DO jsou rozporuplné. Dvojitě zaslepená, zkřížená studie srovnává účinek 1 200 mg flavoxátu denně a 15 mg oxybutyninu denně u 41 žen s idiopatickou DO. Výsledky ukazují, že oba preparáty mají srovnatelný účinek, aplikace flavoxátu je spojena s menším počtem méně závažných vedlejších účinků [40]. Velmi malá studie testující účinek flavoxátu na starší populaci pacientů s nonneurogenní DO prokázala, že tento preparát nemá žádný vliv na cystometrickou kapacitu ani inkontinenci [41]. Rovněž Chapple et al uvádí, že flavoxát nepřináší při léčbě idiopatické DO žádný benefit [42]. Obecně lze říci, že léčba pomocí flavoxátu je spojena s minimálním výskytem vedlejších účinků. Tento preparát však nebyl hodnocen v žádné současné randomizované kontrolované studii.
Oxybutynin
Oxybutynin je středně silné antimuskarinikum, vykazující významný nezávislý muskulotropní relaxační a lokální anestetický účinek (který nabývá na významu pouze při intravezikální aplikaci preparátu). Doporučená dávka pro perorální aplikaci preparátu (pro dospělé pacienty) s okamžitým uvolňováním je 5 mg tři - nebo čtyřikrát denně. K dispozici jsou rovněž další formy: perorální aplikace s postupným uvolňováním jednou denně, transdermální systém s aplikací dvakrát týdně a transdermální gel s dávkováním jednou denně. Vedlejší účinky jsou vyvolány vázáním preparátu na nespecifický muskarinní receptor.
První studie uvádí, že oxybutynin účinně zmírňuje neurogenní DO [43], další studie popisují jeho účinek v rámci inhibice idiopatické DO [44]. Metaanalýza hodnotící výsledky 15 randomizovaných kontrolovaných studií (n = 476) uvádí, že oxybutynin způsobuje pokles počtu příhod inkontinence o průměrně 52 %, zmírnění frekvence močení o průměrně 33 %. Průměrná míra celkového zlepšení činí 74 % [45]. Těchto výsledků bylo dosaženo za cenu výskytu vedlejších účinků u 70 % pacientů.
Terapeutický účinek oxybutyninu ve formě s okamžitým uvolňováním je spojen s vysokou incidencí vedlejších účinků, které obvykle závisí na velikosti dávky [46]. Preparát ve formě s postupným uvolňováním využívá osmotický systém k uvolňování aktivní složky o kontrolované rychlosti po dobu 24 hod, díky čemuž dochází k menší absorpci preparátu v proximální části gastrointestinálního traktu, menšímu metabolizmu při prvním průchodu a menšímu výskytu vedlejších účinků (zejména suchosti v ústech), díky čemuž dodržuje léčebný režim větší procento pacientů [47].
Randomizovaná, kontrolovaná studie srovnávající účinek oxybutyninu ve třech různých dávkách (5, 10 a 15 mg) prokázala signifikantní souvislost mezi velikostí dávky a počtem příhod UUI a výskytem suchosti v ústech. Nejvyšší spokojenost uvádí pacienti při užívání 15mg dávky [48].
Při transdermální aplikaci oxybutyninu dochází ke změně metabolizmu preparátu a menší tvorbě metabolitu (oproti preparátu s postupným uvolňováním). Aplikace náplasti s dávkou 3,9 mg denně vede ke zmírnění frekvence, snížení počtu příhod inkontinence při současném zvětšení průměrného objemu vymočené moči [49]. Incidence suchosti v ústech byla srovnatelná jako u pacientů užívajících placebo. Studie srovnávající transdermální aplikaci oxybutyninu s formou s okamžitým uvolňováním uvádí, že obě formy podávání preparátu dosahují srovnatelného poklesu počtu příhod inkontinence. Transdermální systém je však spojen s významně menším výskytem suchosti v ústech (38 vs 94 %, p < 0,001) [50]. Třetí studie srovnává transdermální aplikaci oxybutyninu s placebem a tolterodinem ve formě s postupným uvolňováním [51]. Oba preparáty dosahují srovnatelného účinku s ohledem na snížení počtu příhod denní inkontinence a zvýšení objemu vymočené moči. Užívání tolterodinu s postupným uvolňováním bylo spojeno s vyšší incidencí nepříznivých příhod. Nejvýznamnější vedlejší účinky spojené s transdermální aplikací zahrnovaly pruritus v místě aplikace (14 %) a erytém (8,3 %). Cartwright a Cardozo ve svém přehledovém článku uvádí, že rovnováha mezi účinkem a snášenlivostí transdermální aplikace oxybutyninu byla vyvážena výskytem lokálního podráždění kůže [52].
Intravezikální aplikace oxybutyninu je lákavou formou podávání zvláště u pacientů, kteří provádí čistou intermitentní katetrizaci. Speciální forma preparátu pro intravezikální aplikaci není k dispozici a forma určená pro perorální podání (tekutina nebo rozdrcená tableta v roztoku) se v současné době aplikuje pomocí katétru. Několik nerandomizovaných, nezaslepených studií bez placeba prokázalo účinek této terapie u řady pacientů s neurogenním močovým měchýřem. Aplikace oxybutyninu způsobuje významné zvýšení cystometrické kapacity, objemu při první mimovolní kontrakci, kompliance močového měchýře a celkové zlepšení kontinence [53,54]. Studie testující farmakokinetiku intravezikální vs perorální aplikace oxybutyninu prokázala, že po perorální aplikaci oxybutyninu dojde během dvou hodin ke zvýšení hladiny preparátu v plazmě na 7,3 mg/ml a následně po čtyřech hodinách k prudkému poklesu na < 2 mg /ml [55]. Při intravezikální aplikaci se hladina preparátu v plazmě postupně zvyšuje, až dosáhne maxima 6,2 mg/ml po 3,5 hodinách a po 9 hodinách se ustálí na hodnotě 3–4 mg/ml. Na základě těchto výsledků nelze stanovit, zda intravezikálně aplikovaná látka působí lokálně nebo systémově.
Dvojitě zaslepená, randomizovaná, kontrolovaná studie zahrnující 52 žen s DO srovnává účinek intravezikální aplikace oxybutyninu jednou denně (20 mg nebo 40 ml ve fyziologickém roztoku) a placeba po dobu 12 dnů [56]. Výsledky prokázaly signifikantní rozdíly ve výskytu symptomů před léčbou a po ní. Objem moči při prvním nutkání močit se zvýšil z 95 ml na 150 ml, cystometrická kapacita z 205 ml na 310 ml, maximální tlak během plnicí fáze se snížil z 16 cm na 9 cm vodního sloupce. Došlo ke snížení frekvence močení během dne ze 7,5 příhod na 4 příhody za den a počtu příhod nykturie z 5,1 na 1,8. Incidence vedlejších účinků byla v obou skupinách srovnatelná. Z nevysvětlitelných důvodů přetrvala u 19 ze 23 (léčených) pacientů úleva symptomů i po ukončení léčby.
Oxybutynin je k dostání v nové formě jako topický gel, který se nanáší jednou denně na břicho, stehna, ramena nebo oblast horních paží [57]. Dávka 1 g vyloučí do oběhu přibližně 4 mg preparátu a dosahuje stabilní koncentrace v plazmě. V multicentrické, randomizované, kontrolované studii bylo celkem 789 pacientů (89 % žen) trpících močovou inkontinencí s převážnou komponentou urgence randomizováno k aplikaci oxybutyninu ve formě gelu nebo placeba jednou denně po dobu 12 týdnů. Na základě údajů mikčního diáře, které pacienti zaznamenávali po dobu tří dnů, došlo k poklesu průměrného počtu příhod UUI o 3,0 za den ve srovnání s 2,5 ve větvi pacientů užívajících placebo (p < 0,0001). U pacientů podstupujících léčbu došlo k poklesu frekvence močení průměrně o 2,7 příhod denně ve srovnání s 2,0 ve větvi pacientů užívajících placebo (p = 0,0017). U pacientů podstupujících léčbu došlo ke zvětšení objemu vymočené moči o 21 ml, u pacientů užívajících placebo o 3,8 ml (p = 0,0018). 6,9 % pacientů podstupujících léčbu a 2,8 % v placebo skupině uvádělo pocit suchosti v ústech. Kožní reakci v místě aplikace preparátu uvádělo 5,4 % pacientů podstupujících léčbu a 1,0 % pacientů v placebo skupině. Předpokládá se, že lepší snášenlivost oxybutyninu ve formě gelu oproti transdermální aplikaci je způsobena nedostatečnou adhezí a okluzí kožních pórů.
Gel po aplikaci rychle zasychá a nezanechává žádnou stopu na kůži. Přenosu preparátu na kůži jiné osoby lze z velké části zabránit zakrytím místa aplikace tkaninou.
Propiverin
Propiverin je muskulotropní relaxans hladké svaloviny s neselektivním antimuskarinním účinem. U tohoto preparátu byly prokázány rovněž vlastnosti antagonistů kalcia, jejich význam v rámci klinické účinnosti papaverinu však nebyl prokázán [58]. Analýza devíti randomizovaných kontrolovaných studií zahrnujících celkem 230 pacientů užívajících propiverin prokázala 17% pokles frekvence mikce. Dále bylo zaznamenáno zvětšení kapacity močového měchýře průměrně o 64 ml a 77% zlepšení subjektivních symptomů. Vedlejší účinky zaznamenalo 14 % pacientů [45]. Několik komparativních studií potvrdilo účinek propiverinu při léčbě OAB. Předpokládá se, že aplikace propiverinu může mít stejný účinek na zvýšení kapacity močového měchýře a snížení krevního tlaku jako aplikace oxybutyninu, ovšem při nižším výskytu vedlejších účinků [59,60]. Abrams et al v roce 2006 uveřejnili důkazy, jež vyvrací výsledky výše uváděných studií [1]. Dvojitě zaslepená, placebem kontrolovaná, zkřížená studie srovnávající účinnost 20 mg propiverinu jednou denně, 15 mg propiverinu třikrát denně, 5 mg oxybutyninu třikrát denně a placeba prokázala, že s ohledem na zmírnění mimovolních kontrakcí močového měchýře dosahuje propiverin v dávce 20 mg horšího účinku než oxybutynin. Propiverin rovněž významněji ovlivňuje gastrointestinální a kardiovaskulární funkci i vidění.
Ve velké japonské studii bylo 1 584 pacientů randomizováno k aplikaci solifenacinu (5 nebo 10 mg), 20 mg propiverinu nebo placeba [61]. Všechny terapeutické protokoly prokázaly větší účinnost než placebo v následujících doménách: zmírnění frekvence močení, zvětšení mikčního objemu a zlepšení QoL. Aplikace 10 mg solifenacinu (oproti 20 mg propiverinu) vedla k významnějšímu poklesu počtu příhod nykturie, urgence a zvětšení objemu vymočené moči. Aplikace 10 mg solifenacinu byla rovněž spojena s větším výskytem vedlejších účinků – suchosti v ústech a zácpy.
BEZPEČNOST LÉČBY
Je třeba zmínit tři specifické oblasti související s užíváním antimuskarinik: močová retence, narušení kognitivních funkcí a vznik glaukomu.
V minulosti byla preskripce antimuskarinik obvykle spojena s obavami ze vzniku močové retence. Andersson a Wein a Andersson et al však uvádí, že tyto preparáty jsou obvykle kompetitivními antagonisty [9,10]. To v praxi znamená, že v případě, že je při močení uvolňováno větší množství ACh, by se měl účinek preparátu zmenšovat. V opačném případě by v důsledku absence kontrakce močového měchýře mohlo docházet k močové retenci. Při aplikaci vyšší dávky antimuskarinik skutečně může docházet ke vzniku močové retence, při užívání dávky obvykle předepisované při léčbě DO však tento vedlejší efekt není příliš častý [9]. U pacientů se zvětšenou prostatou nebo neúplným vyprazdňováním močového měchýře se doporučuje monitorování postmikčního rezidua. Tyto diagnózy však není třeba automaticky považovat za absolutní kontraindikaci pro léčbu antimuskariniky.
V nedávné době se začalo hovořit o riziku souvislosti mezi užíváním anti-cholinergik a narušením kognitivních funkcí, což bylo impulzem pro vznik několika studií testujících reakční dobu, paměť, stupeň zmatení a další poruchy kognitivních funkcí. Longitudinální studie zahrnující 372 pacientů starších > 60 let (kteří ne-trpěli před zahájením léčby demencí) hodnotí účinek dlouhodobého užívání anticholinergik na kognitivní funkce [62]. U celkem 80 % pacientů bylo zaznamenáno mírné narušení kognitivních funkcí (ve srovnání s pouze 35 % pacientů, kteří neužívali žádnou léčbu). Po osmi letech sledování bylo riziko vzniku demence u obou skupin srovnatelné. Další studie zahrnující kontinentní starší dobrovolníky neprokázaly žádný významný dopad léčby pomocí antimuskarinik na kognitivní funkce [15]. Existuje pouze minimum údajů o dopadu anticholinergik na kognitivní funkci u pacientů trpících demencí. Bylo však prokázáno, že inhibitory cholinesterázy, jež jsou často indikovány pro zlepšení kognitivních funkcí u pacientů trpících Alzheimerovou chorobou, vyvolávají vznik močové inkontinence.
Další dilema představují pacienti s OAB a glaukomem. Prevalence obou onemocnění se zvyšuje spolu s věkem a odhaduje se, že v Japonsku trpí oběma chorobami současně přibližně 11,6 % žen [64]. Při indikaci léčby je nezbytné rozlišovat mezi glaukomem s otevřeným komorovým úhlem a uzavřeným úhlem. V případě, že není typ glaukomu znám, je nutné pacienta odeslat k oftalmologovi. Japonská studie uvádí, že přibližně u 75 % pacientů, u nichž se současně vyskytují glaukom a OAB, je přítomen glaukom s otevřeným úhlem [65], což nezvyšuje riziko k aplikaci anticholinergik. U zbývajících 25 % pacientů s glaukomy s uzavřeným úhlem je riziko intervence vyšší pouze v případě, že pacient nepodstoupil iridotomii anebo onemocnění není pod dostatečnou kontrolou, což snižuje skutečnou míru kontraindikací na přibližně 8,3 % pacientů s OAB. Je zajímavým zjištěním, že stejná studie uvádí, že 33 % pacientů neuvedlo glaukom na přijímacím formuláři [65]. Podceňování rizika glaukomu může ve vzácných případech způsobovat i oslepnutí a naopak při přeceňování rizika (což je častým případem v důsledku obav pacienta) může být pacient připraven o možnost nejúčinnější perorální terapie pro léčbu OAB. Stížnosti pacienta na bolest v oku, bolesti hlavy nebo poruchy vidění po zahájení terapie není vhodné podceňovat a je třeba vyhledat okamžitou lékařskou pomoc [66].
ZÁVĚR
Antimuskarinika představují účinnou a bezpečnou modalitu pro léčbu OAB [11]. Vyvíjení novějších preparátů je motivováno skutečností, že ideální preparát – se selektivním účinkem na LUT, snadnou aplikací a poměrně nízkou cenou – nebyl doposud nalezen. V současné době jsou testovány nejrůznější terapie s různým mechanizmem účinku se slibnými výsledky.
Nejdůležitější informace získané ze systémových přehledů dostupných publikací lze shrnout do následujících bodů:
- léčbu pomocí starších preparátů, jako např. oxybutynin, velké procento pacientů nedokončí v důsledku vedlejších účinků, naopak tolterodin ve formě s postupným uvolňováním je pacienty dobře snášen
- novější preparáty, jako darifenacin, solifenacin a fesoterodin, jsou k dispozici v různém dávkování, což umožňuje individuální titraci pro dosažení optimální rovnováhy mezi účinkem a snášenlivostí
- dávkování jednou denně je pacienty lépe snášeno a může být potenciálně účinnější při zmírňování symptomů a QoL
Bohužel zatím nejsou k dispozici žádné srovnávací head-to-head studie, které by přinesly nové informace o této problematice.
prof. Ariana J. Smith, MD
University of Pennsylvania School of Medicine, Philadelphia, PA, USA
Pelvic Medicine & Reconstructive Surgery
Division of Urology at PENN Medicine
299 South 8th Street, Philadelphia, PA19106, USA
ariana.smith@uphs.upenn.edu
Zdroje
1. Abrams P, Cardozo L, Fall M. The standardisation of terminology of lower urinary tract function: report from the standardisation sub-committee of the International Continence Society. Am J Obstet Gynecol 2002; 187(1): 116–126.
2. Andersson KE. Antimuscarinics for treatment of overactive bladder. Lancet Neurol 2004; 3(1): 46–53.
3. Anderson KE. Pharmacology of lower urinary tract smooth muscles and penile erectile tissues. Pharmacol Rev 1993; 45(3): 253–308.
4. Andersson KE, Wein AJ. Pharmacology of the lower urinary tract: basis for current and future treatments of urinary incontinence. Pharmacol Rev 2004; 56(4): 581–631.
5. Jensen D. Pharmacological studies of the uninhibited neurogenic bladder. III. The influence of adrenergic excitatory and inhibitory drugs on the cystometrogram of neurological patients with normal and uninhibited neurogenic bladder. Acta Neurol Scand 1981; 64(6): 401–426.
6. Anderson KE, Yoshida M. Antimuscarinics and the overactive detrusor – which is the main mechanism of action? Eur Urol 2003; 43(1): 1–5.
7. Chess-Williams R. Muscarinic receptors of the urinary bladder: detrusor, urothelial, and prejunctional. Auton Autacoid Pharmacol 2002; 22(3): 133–145.
8. Yoshida M, Miyamae K, Iwashita H et al. Management of detrusor dysfunction in the elderly: changes in acetylcholine and adenosine triphosphate release during aging. Urology 2004; 63 (Suppl 1): 17–23.
9. Andersson KE, Wein AJ. Pharmacologic management of storage and emptying failure. In: Wein AJ, Kavoussi LR, Novick AC et al (Eds.). Campbell-Walsh Urology. 9th ed. Philadelphia, PA: Saunders, 2007 : 2091–2123.
10. Andersson KE, Chapple CR, Cardozo L et al. Pharmacological treatment of urinary incontinence. In: Abrams P, Cardozo L, Khoury S et al (Eds.). Incontinence. 4th ed. France: Health Publication Ltd., Editions 21; 2009 : 631–699.
11. Chapple CR, Khullar V, Gabriel Z et al. The effects of antimuscarinic treatments in overactive bladder: an update of a systematic review and meta-analysis. Eur Urol 2008; 54(3): 543–562.
12. Witte LP, Mulder WM, de la Rosette JJ et al. Muscarinic receptor antagonists for overactive bladder treatment: does one fit all? Curr Opin Urol 2009; 19(1): 13–19.
13. Andersson KE. Potential benefits of muscarinic M3 receptor selectivity. Eur Urol 2002; 1 (Suppl): 23–28.
14. Chapple CR, Steers W, Norton P et al. Apooled analysis of three phase IIIstudies to investigate the efficacy, tolerability, and safety of darifenacin, a muscarinic M3 selective receptor antagonist, in the treatment of overactive bladder. BJU Int 2005; 95(7): 993–1001.
15. Lipton RB, Kolodner K, Wesnes K. Assessment of cognitive function of the elderly population: effects of darifenacin. J Urol 2005; 173(2): 493–498.
16. Chapple C, Van Kerrebroeck P, Tubaro A et al. Clinical efficacy, safety, and tolerability of once-daily fesoterodine in subjects with overactive bladder. Eur Urol 2007; 52(4): 1204–1212.
17. Michel MC. Fesoterodine: a novel muscarinic receptor antagonist for the treatment of overactive bladder syndrome. Expert Opin Pharmacother 2008; 9(10): 1787–1796.
18. Khullar V, Rovner ES, Dmochowski R et al. Fesoterodine dose response in subjects with overactive bladder syndrome. Urology 2008; 71(5): 839–843.
19. Beermann B, Hellström K, Rosèn A. On the metabolism of propantheline in man. Clin Pharmacol Ther 1972; 13(2): 212–220.
20. Blaivas JG, Labib KB, Michalik J et al. Cystometric response to propantheline in detrusor hyperreflexia: therapeutic implications. J Urol 1980; 124(2): 259–262.
21. Thüroff JW, Bunke B, Ebner A et al. Randomized, double-blind, multicenter trial on treatment of frequency, urgency, and incontinence related to detrusor hyperactivity: oxybutynin versus propantheline versus placebo. J Urol 1991; 145(4): 813–817.
22. Holmes DM, Montz FJ, Stanton SL. Oxybutynin versus propantheline in the management of detrusor instability. Apatient-regulated variable dose trial. Br J Obstet Gynaecol 1989; 96(5): 607–612.
23. Ikeda K, Kobayashi S, Suzuki M et al. M(3) receptor antagonism by the novel antimuscarinic agent solifenacin in the urinary bladder and salivary gland. Naunyn Schmiedebergs Arch Pharmacol 2002; 366(2): 97–103.
24. Chapple CR, Martinez-Garcia R, Selvaggi L et al for the STAR study group. A comparison of the efficacy and tolerability of solifenacin succinate and extended release tolterodine at treating overactive bladder syndrome: results of the STARTrial. Eur Urol 2005; 48(3): 464–470.
25. Brynne N, Stahl MM, Hallén B et al. Pharmacokinetics and pharmacodynamics of tolterodine in man: a new drug for the treatment of urinary bladder overactivity. Int J Clin Pharmacol Ther 1997; 35(7): 287–295.
26. Hills CJ, Winter SA, Balfour JA. Tolterodine. Drugs 1998; 55(6): 813.
27. Elinoff V, Bavendam T, Glasser DB et al. Symptom-specific efficacy of tolterodine extended release in patients with overactive bladder: the IMPACTtrial. Int J Clin Pract 2006; 60(6): 745–751.
28. Diokno AC, Appell RA, Sand PK et al. OPERAStudy Group. Prospective, randomized, double-blind study of the efficacy and tolerability of the extended-release formulations of oxybutynin and tolterodine for overactive bladder: results of the OPERAtrial. Mayo Clin Proc 2003; 78(6): 687–695.
29. Todorova A, Vonderheid-Guth B, Dimpfel W. Effects of tolterodine, trospium chloride, and oxybutynin on the central nervous system. J Clin Pharmacol 2001; 41(6): 636–644.
30. Kim Y, Yoshimura N, Masuda H et al. Intravesical instillation of human urine after oral administration of trospium, tolterodine and oxybutynin in a rat model of detrusor overactivity. BJU Int 2006; 97(2): 400–403.
31. Jünemann KP, Al-Shukri S. Efficacy and tolerability of trospium chloride and tolterodine in 234 patients with urge-syndrome: a double-blind, placebo-controlled, multicenter clinical trial. Neurourol Urodyn 2000; 19 : 488–490.
32. Halaska M, Ralph G, Wiedemann A et al. Controlled, double-blind, multicentre clinical trial to investigate long-term tolerability and efficacy of trospium chloride in patients with detrusor instability. World J Urol 2003; 20(6): 392–329.
33. Dmochowski RR, Sand PK, Zinner NR et al. Trospium 60 mg once daily (QD) for overactive bladder syndrome: results from a placebo-controlled interventional study. Urology 2008; 71(3): 449–454.
34. Fröhlich G, Burmeister S, Wiedemann A et al. [Intravesical instillation of trospium chloride, oxybutynin, and verapamil for relaxation of the bladder detrusor muscle. Aplacebo controlled, randomized clinical test]. Arzneimittelforschung 1998; 48(5): 486–491. In German.
35. Walter P, Grosse J, Bihr AM et al. Bioavailability of trospium chloride after intravesical instillation in patients with neurogenic lower urinary tract dysfunction: Apilot study. Neurourol Urodyn 1999; 18(5): 447–453.
36. Ruffmann R. Areview of flavoxate hydrochloride in the treatment of urge incontinence. J Int Med Res 1988; 16(5): 317–330.
37. Guarneri L, Robinston E, Testa R. A review of flavoxate: pharmacology and mechanism of action. Drugs Today 1994; 30 : 91.
38. Oka M, Kimura Y, Itoh Y et al. Brain pertussis toxin-sensitive G proteins are involved in the flavoxate hydrochloride-induced suppression of the micturition reflex in rats. Brain Res 1996; 727(1–2): 91–98.
39. Kimura Y, Sasaki Y, Hamada K et al. Mechanisms of suppression of the bladder activity by flavoxate. Int J Urol 1996; 3(3): 218–227.
40. Milani R, Scalambrino S, Milia R et al. Double-blind crossover comparison of flavoxate and oxybutynin in women affected by urinary urge syndrome. Int Urogynecol 1993; 4 : 3–8.
41. Briggs RS, Castleden CM, Asher MJ. The effect of flavoxate on uninhibited detrusor contractions and urinary incontinence in the elderly. J Urol 1980; 123(5): 665–666.
42. Chapple CR, Parkhouse H, Gardener C et al. Double-blind, placebo-controlled, cross-over study of flavoxate in the treatment of idiopathic detrusor instability. Br J Urol 1990; 66(5): 491–494.
43. Thompson IM, Lauvetz R. Oxybutynin in bladder spasm, neurogenic bladder, and enuresis. Urology 1976; 8(5): 452–454.
44. Andersson KE. Current concepts in the treatment of disorders of micturition. Drugs 1988; 35(4): 477–494.
45. Thüroff JW, Chartier-Kastler E, Corcus J et al. Medical treatment and medical side effects in urinary incontinence in the elderly. World J Urol 1998; 16 (Suppl 1): S48–61.
46. Baigrie RJ, Kelleher JP, Fawcett KP et al. Oxybutynin: is it safe? Br J Urol 1988; 62(4): 319–322.
47. Gupta SK, Sathyan G. Pharmacokinetics of an oral once-a-day, controlled-release oxybutynin formulation compared with immediate-release oxybutynin. J Clin Pharmacol 1999; 39(3): 289–296.
48. Corcos J, Casey R, Patrick A et al. Uromax Study Group. Adouble-blind randomized dose-response study comparing daily doses of 5, 10, and 15 mg controlled-release oxybutynin: balancing efficacy with severity of dry mouth. BJU Int 2006; 97(3): 520–527.
49. Dmochowski RR, Davila GW, Zinner NR et al. Efficacy and safety of transdermal oxybutynin in patients with urge and mixed urinary incontinence. J Urol 2002; 168(2): 580–586.
50. Davila GW, Daugherty CA, Sanders SW. Ashort-term, multi-center, randomized, double-blind, dose-titration study of the efficacy and anticholinergic side effects of transdermal compared to immediate release oral oxybutynin treatment of patients with urge urinary incontinence. J Urol 2001; 166(1): 150–151.
51. Dmochowski RR, Sand PK, Zinner NR et al. Comparative efficacy and safety of transdermal oxybutynin and oral tolterodine versus placebo in previously treated patients with urge and mixed urinary incontinence. Urology 2003; 62(2): 237–242.
52. Cartwright R, Cardozo L. Transdermal oxybu-tynin: sticking to the facts. Eur Urol 2007; 51(4): 907–914.
53. Connor JP, Betrus G, Fleming P et al. Early cystometrograms can predict the response to intravesical instillation of oxybutynin chloride in myelomeningocele patients. J Urol 1994; 151(4): 1045–1047.
54. Szollar SM, Lee SM. Intravesical oxybutynin for spinal cord injury patients. Spinal Cord 1996; 34(5): 284–287.
55. Madersbacher H, Jilg G. Control of detrusor hyperreflexia by the intravesical instillation of oxybutynin hydrochloride. Paraplegia 1991; 29(2): 84–90.
56. Enzelsberger H, Helmer H, Kurz C. Intravesical instillation of oxybutynin in women with idiopathic detrusor instability: a randomized trial. Br J Obstet Gynaecol 1995; 102(11): 929–930.
57. Staskin DR, Dmochowski RR, Sand PK et al. Efficacy and safety of oxybutynin chloride topical gel for overactive bladder: a randomized, double-blind, placebo controlled, multicenter study. J Urol 2009; 181(4): 1764–1772.
58. Haruno A. Inhibitory effects of propiverine hydrochloride on the agonist-induced or spontaneous contractions of various isolated muscle preparations. Arzneimittelforschung 1992; 42(6): 815–817.
59. Stöhrer M, Murtz G, Kramer G et al. Propiverine compared to oxybutynin in neurogenic detrusor overactivity – results of a randomized, double-blind, multicenter clinical study. Eur Urol 2007; 51(1): 235–242.
60. Madersbacher H, Halaska M, Voigt R et al. Aplacebo-controlled, multicentre study comparing the tolerability and efficacy of propiverine and oxybutynin in patients with urgency and urge incontinence. BJU Int 1999; 84(6): 646–651.
61. Yamaguchi O, Marui E, Kakizaki H. Randomized, double-blind, placebo - and propiverine-controlled trial of the once-daily antimuscarinic agent solifenacin in Japanese patients with overactive bladder. BJU Int 2007; 100(3): 579–587.
62. Ancelin ML, Artero S, Portet F et al. Non-degenerative mild cognitive impairment in elderly people and use of anticholinergic drugs: longitudinal cohort study. BMJ 2006; 332(7539): 455–459.
63. Hashimoto M, Imamura T, Tanimukai S et al. Urinary incontinence: an unrecognised adverse effect with donepezil. Lancet 2000; 356(9229): 568.
64. Kato K, Furuhashi K, Suzuki K et al. Overactive bladder and glaucoma: a survey at outpatient clinics in Japan. Int J Urol 2007; 14(7): 595–597.
65. Ikato K, Furuhashi K, Suzuki Ket al. Overactive bladder and glaucoma: a survey at outpatient clinics in Japan. Int J Urol 2007; 14(7): 595–597.
66. Fink AM, Aylward GW. Buscopan and glaucoma: a survey of current practice. Clin Radiol 1995; 50(3): 160–164.
Štítky
Dětská urologie Urologie
Článek Screening karcinomu prostatyČlánek Ze zahraničních periodik
Článek vyšel v časopiseUrologické listy
Nejčtenější tento týden
2011 Číslo 2- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Infekce močových cest u dospělých – mezery v současných guidelines a doporučení pro klinickou praxi
- Prevence opakovaných infekcí močových cest s využitím přípravku Uro-Vaxom
- Nitrofurantoin s řízeným uvolňováním: osvědčená účinnost, lepší snášenlivost a méně tablet při akutní cystitidě
- Aktuální doporučení EAU pro léčbu nekomplikovaných cystitid
-
Všechny články tohoto čísla
- Screening karcinomu prostaty
- Transrektální biopsie prostaty naváděná ultrazvukovým vyšetřením
- Rehabilitace erektilní funkce po radikální prostatektomii: současný stav
- Přehled nejnovějších technologií pro léčbu karcinomu prostaty (robotické systémy, laparoskopie, brachyterapie, kryoterapie, technologie Cyberknife)
- Budou dosaženy očekávané počty nádorů ledvin a močového měchýře?
- Zanedbání profesionální péče při výkonu lékařského povolání v urologické praxi v USA: trendy a analýza
- Antimuskarinika při léčbě OAB
- Korekce pánevního prolapsu pomocí augmentace s užitím síťky ze syntetického materiálu
- Zpráva z konference AUA Annual Meeting 2011, Washington, D.C., USA
- Možnosti primární prevence karcinomu prostaty – běžná klinická praxe, nereálná fikce nebo blízká budoucnost?
- Ze zahraničních periodik
- EAU Guidelines pro léčbu karcinomu prostaty - Část první: Screening, diagnostika a léčba klinicky lokalizovaného karcinomu
- EAU Guidelines pro léčbu karcinomu prostaty - Část druhá: Léčba pokročilého, recidivujícího karcinomu prostaty rezistentního vůči kastraci
- Urologické listy
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Přehled nejnovějších technologií pro léčbu karcinomu prostaty (robotické systémy, laparoskopie, brachyterapie, kryoterapie, technologie Cyberknife)
- Transrektální biopsie prostaty naváděná ultrazvukovým vyšetřením
- Korekce pánevního prolapsu pomocí augmentace s užitím síťky ze syntetického materiálu
- Rehabilitace erektilní funkce po radikální prostatektomii: současný stav
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



