-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Hilový cholangiokarcinom (Klatskinův tumor) – současné možnosti léčby
Hilar cholangiocarcinoma (Klatskin tumor) – current treatment options
Hilar cholangiocarcinoma is a rare tumor with a rather poor prognosis, and thus remains a challenge for diagnosis and treatment. The sole potentionally curative treatment is the complete resection of the tumor. A negative surgical margin is one of the most important factors in achieving prolonged survival. A preoperative evaluation of the tumor is important for the evaluation of resectability and the extent of surgery. Unfortunately, only a small number of patients with hilar cholangiocarcinoma is indicated for the radical procedure. Liver transplantation is not a standard method in the treatment of the Klatskin tumor and it is reserved only for carefully selected patients in a few transplant centres. The main aim of the palliative treatment is biliary drainage, reduction of the pain and pruritus and overall improvement of the quality of life. Adjuvant chemotherapy and radiotherapy are the important parts of the complex therapy, however, no definite regimen has been established to date. Further evidence is needed to define the role of liver transplantation and (neo)adjuvant new therapeutic modalities.
Key words:
hilar cholangiocarcinoma – radical surgery – palliative treatment – liver transplantation – (neo) adjuvant chemotherapy – radiotherapy
Autoři: F. Bělina
Působiště autorů: Chirurgická klinika 2. LF UK a ÚVN Praha, přednosta: prof. MUDr. M. Ryska, CSc.
Vyšlo v časopise: Rozhl. Chir., 2013, roč. 92, č. 1, s. 4-15.
Kategorie: Souhrnné sdělení
Souhrn
Cholangiokarcinom proximálních extrahepatálních žlučových cest (Klatskinův tumor) není časté nádorové onemocnění, nicméně jeho diagnostika je obtížná a výsledky léčby nejsou stále uspokojivé. Jedinou potenciálně kurabilní metodou je chirurgická resekce, avšak pouze malá část nemocných je indikována k radikálnímu výkonu. Mikroskopicky negativní okraje po R0 resekci jsou jedním z nejdůležitějších prognostických faktorů dlouhodobého přežívání. Transplantace jater není dosud standardní metodou léčby nemocných s Klatskinovým tumorem. Většina nemocných je odkázána na léčbu paliativní.
Hlavním cílem paliativní léčby je zajištění adekvátní a dlouhodobé biliární drenáže, ovlivnění bolestí a pruritu a zlepšení celkové kvality života nemocných s inoperabilním tumorem. Adjuvantní chemoterapie a radioterapie jsou důležitou součástí komplexní léčby, nicméně standardní protokol a postup není definován. Zlepšení výsledků léčby a prognózy nemocných s hilovým cholangiokarcinomem lze v budoucnu očekávat od diagnostiky časných stadií a zvýšení resekability onemocnění, upřesnění role transplantace jater v léčbě hilového cholangiokarcinomu a zavedení nových (neo)adjuvantních léčebných metod.Klíčová slova:
hilový cholangiokarcinom – radikální resekce – transplantace jater – paliativní léčba – (neo)adjuvantní chemoterapie – radioterapieÚvod
Zhoubné nádory žlučových cest nepatří mezi častá onemocnění, ale z hlediska léčebných možností a dlouhodobých výsledků léčby jde o onemocnění s velmi závažnou prognózou. Z širšího pohledu nádory žlučových cest zahrnují intrahepatální a extrahepatální tumory, nádory žlučníku a nádory v oblasti Vaterské papily. Histologicky převážnou většinu těchto nádorů tvoří karcinomy. Zhoubný nádor žlučových cest neboli cholangiokarcinom je po hepatocelulárním karcinomu druhý nejčastější primární zhoubný nádor jater. Cholangiokarcinom je z diagnostického a klinického hlediska rozdělován podle lokalizace na nitrojaterní (intrahepatální), oblast spojení levého a pravého žlučovodu (hilový) a nádor lokalizovaný v periferní části žlučovodu (distální extrahepatální). Hilový cholangiokarcinom je historicky rovněž označován jako Altemeierův nebo častěji Klatskinův tumor [1, 2]. Asi 60–70 % cholangiokarcinomů je lokalizováno v hilu jater v oblasti spojení pravostranných a levostranných žlučovodů, menší část nitrojaterně (10 %) a asi třetina nádorů se nachází v oblasti distálního žlučovodu. Z hlediska četnosti výskytu, obtížné diagnostiky a možnosti léčby je nejzávažnější hilový cholangiokarcinom.
Incidence a rizikové faktory
Incidence hilového cholangiokarcinomu, tedy počet nově diagnostikovaných případů za rok, je například v USA udávána 0,8–0,95/100 000 obyvatel.
V České republice nejsou k dispozici relevantní údaje o současné incidenci a prevalenci nádorů extrahepatálních žlučovodů. Dostupné souhrnné údaje z NOR a ÚZIS zahrnují nádory žlučových cest společně s nádory žlučníku, a hilový cholangiokarcinom tedy není blíže specifikován. Nádory žlučových cest a žlučníku nepatří mezi časté malignity a tvoří zhruba 1,5 % všech nově diagnostikovaných zhoubných nádorů. Z údajů vyplývá, že počet diagnostikovaných případů v ČR za rok se pohybuje kolem 1000 (v roce 2005 bylo zaznamenáno 1016 případů) [3].
Tyto zhoubné nádory se vyskytují dvakrát častěji u žen a incidence u obou pohlaví se v průběhu posledních let nemění. Věk nemocných v době diagnózy se nejčastěji pohybuje kolem 73 let s patrným téměř identickým průběhem křivky incidence a mortality onemocnění v jednotlivých věkových skupinách (Graf 1).
Graf 1. Věková struktura nemocných Graph 1: Age structure 
Neuspokojivý stav přetrvává v časné diagnostice onemocnění. Méně pokročilá stadia onemocnění dle TNM klasifikace (I. a II. stadium) tvoří pouze 7 % všech diagnostikovaných nádorů žlučníku a žlučových cest, zatímco nádory v pokročilých stadiích (III. a IV. stadium) tvoří většinu (Graf 2). I když je při srovnání údajů za posledních deset let v této oblasti patrný mírný trend ke zlepšení, nelze v diagnostice očekávat v nejbližším období výrazné zlepšení (Graf 3).
Graf 2. Klinická stadia nádoru Graph 2: Clinical stages 
Graf 3. Trend incidence a mortality Graph 3: Incidence and mortality trend 
Z etiologického hlediska není u většiny nemocných s hilovým cholangiokarcinomem známa příčina vzniku onemocnění. Nicméně zaznamenané rizikové faktory a onemocnění spojená s vyšší incidencí cholangiokarcinomu jsou uvedeny v Tab. 1 [4].
Tab. 1. Rizikové faktory vzniku cholangiokarcinomu Tab. 1: Risk factors of the cholangiocarcinoma 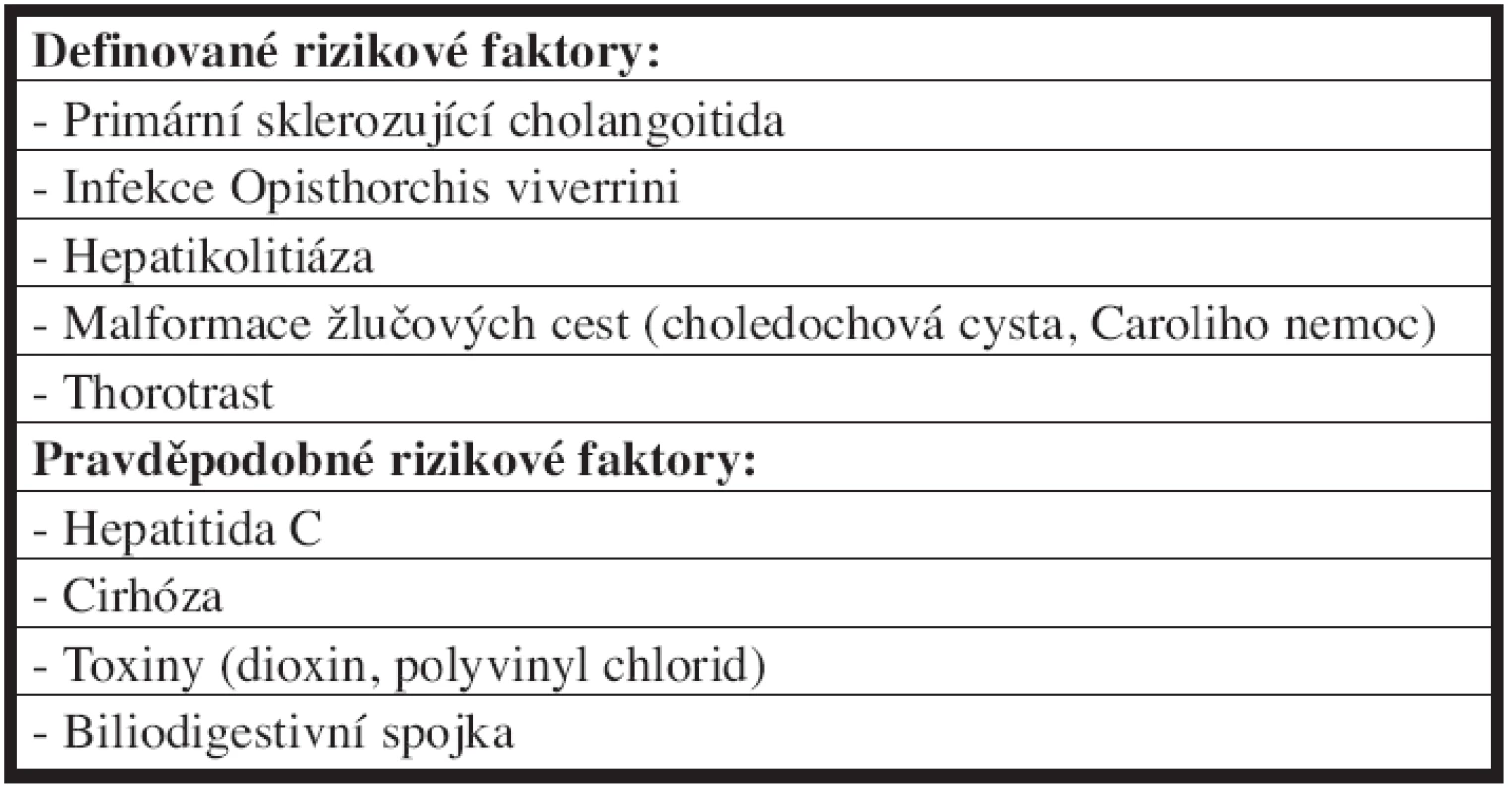
Diagnostika
Nejčastějším klinickým projevem onemocnění je bezbolestně vzniklý ikterus (90 %) způsobený obstrukcí žlučových cest nádorem. Asi u 10 % nemocných je provázen akutní cholangoitidou. Část nemocných udává bolesti, svědění kůže a váhový úbytek.
Diagnostika onemocnění může být obtížná. Od hilového cholangiokarcinomu je třeba odlišit jiná onemocnění, která mohou mít podobné příznaky: zánětlivé zúžení žlučových cest, primární sklerotizující cholangoitida (PSC), hepatikolitiáza, Mirizziho syndrom a další onemocnění. Součástí laboratorního vyšetření je stanovení sérových hladin onkomarkerů (Ca 19–9, CEA, Ca 50, Ca 125, Ca 195 a dalších). Nejvyužívanější je antigen Ca 19–9, jehož hodnota > 100 U/ml má pro tumory žlučových cest nejvyšší senzitivitu a specificitu (80–89 %). Jeho citlivost lze zvýšit při kombinaci s jinými onkomarkery, především s karcinoembryonálním antigenem CEA. Ca 19–9 je rovněž využíván při časné detekci cholangiokarcinomu v terénu PSC.
Hlavní význam pro stanovení diagnózy, lokalizace a pokročilosti onemocnění mají zobrazovací metody. Z neinvazivních vyšetření má vedle transabdominální ultrasonografie s dopplerovským vyšetřením pro stanovení diagnózy a pokročilosti onemocnění zásadní význam především kontrastní magnetická rezonance (MR) s možností zobrazení žlučových cest (MRCP) a cévních struktur (MRA) (Obr. 1). Rovněž CT a CT angiografie umožní diagnostiku a stanovení stagingu nádorového onemocnění (Obr. 2).
Obr. 1. MRCP u nemocné s Klatskinovým tumorem Bismuth IIIA Fig. 1: MRCP of patient with Klatskin tumor type Bismuth IIIA 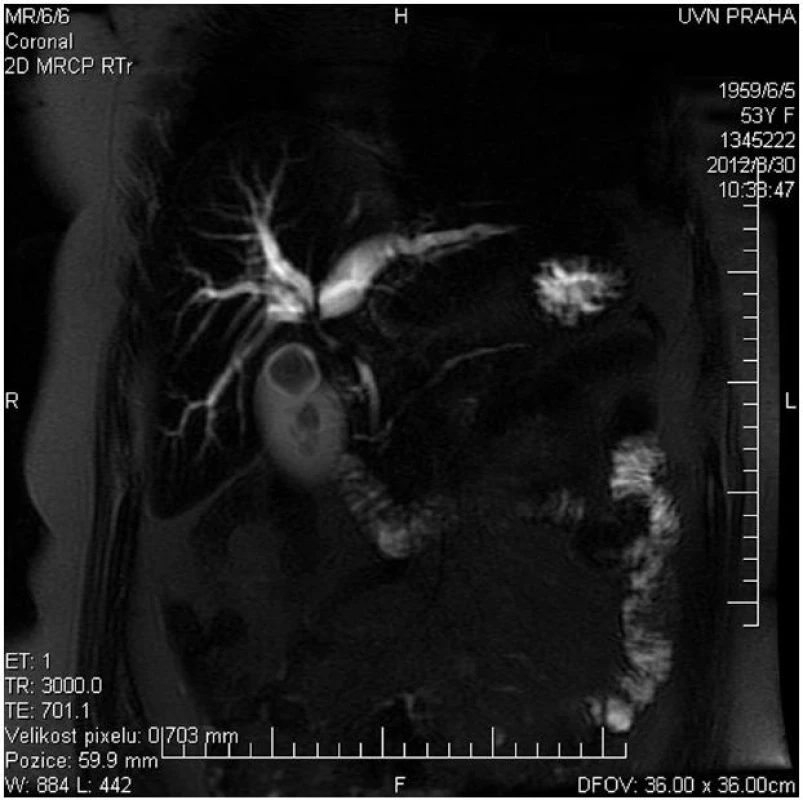
Obr. 2. CT vyšetření znázorňující dilataci levostranných žlučovodů při obstrukcí v hilu jater a průchodné portální větve pro II., III. a IV. segment jater Fig. 2: CT scan shows dilatated left side biliary ducts due to hilar obstruction and patent flow of the portal branches of hepatic segments No II., III. and IV. 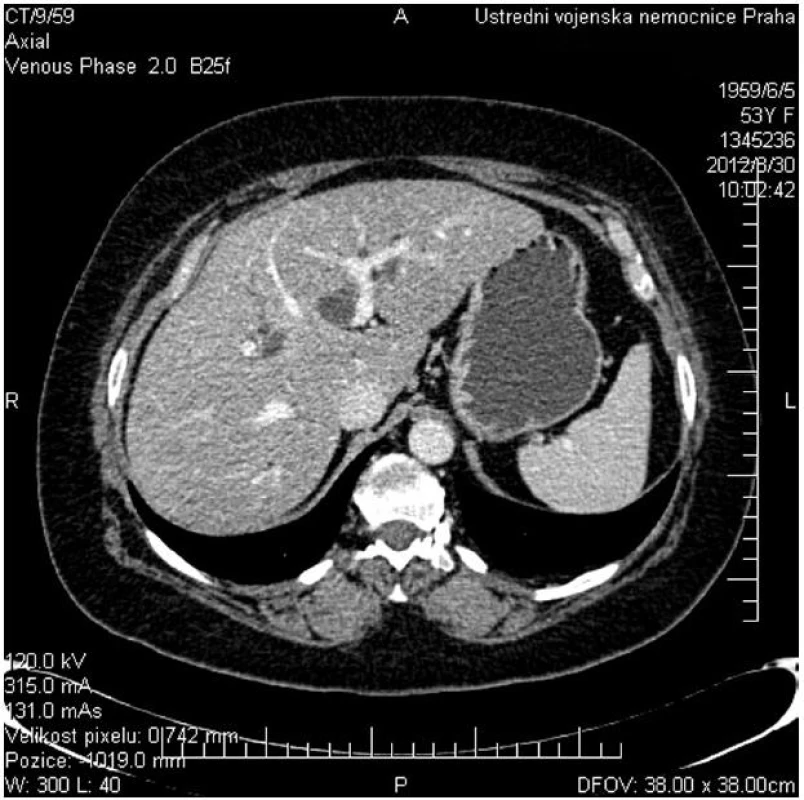
Recentně některá pracoviště standardně zařazují do algoritmu vyšetření pozitronovou emisní tomografii (PET). Z invazivních vyšetření, která přímo zobrazí žlučové cesty náplní kontrastní látkou, to jsou endoskopická retrográdní cholangiografie (ERC) a perkutánní transhepatální cholangiografie (PTC) s možností odběru „brush“ cytologie z výstelky žlučovodů. Další výhodou těchto invazivních vyšetření je možnost současného provedení biliární drenáže zavedením stentu perkutánní či endoskopickou cestou. Význam endoskopické ultrasonografie (EUS) je především ve zpřesnění stagingu při hodnocení angioinvaze a spádových lymfatických uzlin s možností cíleného odběru vzorků tkáně na cytologické vyšetření tenkou bioptickou jehlou (FANB). Mezi méně dostupné metody patří cholangioskopie a intraduktální ultrasonografie. Použití cholangioskopie umožňuje přesnější odběr bioptického vzorku pod kontrolou zraku. Cholangioskop může být zaveden endoskopicky nebo perkutánně.
Významný přínos pro chirurgii jater a žlučových cest mělo zavedení peroperační ultrasonografie (IOUS), která je považována za standardní součást výkonu (Obr. 3). Pro svou vysokou senzitivitu a specificitu umožňuje diagnostikovat předoperačně nezjištěné ložiskové léze, zpřesní staging nádorového onemocnění a podá detailní informaci o nitrojaterních anatomických strukturách, především průběhu žlučovodů a cév [5, 40]. Některá pracoviště před laparotomií zahajují výkon laparoskopií eventuálně doplněnou o laparoskopickou ultrasonografii. Morfologicky jsou u Klatskinova tumoru popisovány 3 základní typy: sklerozující, který je nejčastější, nodulární a nejméně častá intraduktální papilární forma nádoru. Jednotlivé typy se liší klinickým obrazem, chováním a rovněž i prognózou [6].
Obr. 3. Peroperační ultrasonografie jater s dopplerovským vyšetřením znázorňující dilataci nitrojaterních cest u hilového nádoru typu Bismuth III s průchodnou levou větví a hlavním kmenem portální žíly Fig. 3: Intraoperative ultrasonography of the liver with doppler investigation shows dilatated biliary intrahepatic ducts due to hilar cholangiocarcinoma type Bismuth III with patent left portal branch and main portal trunk 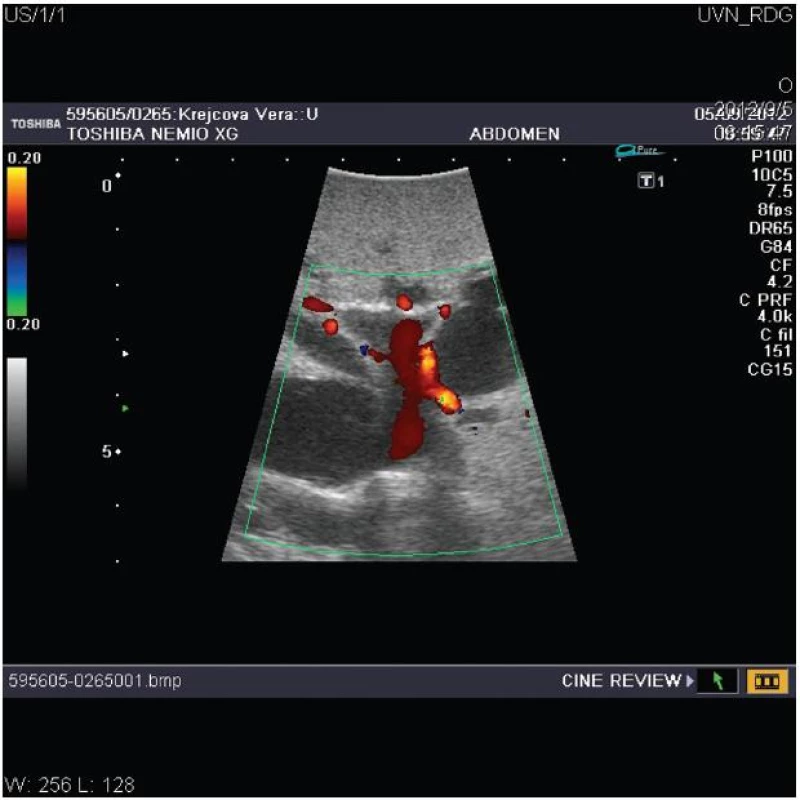
Staging
Cílem vyšetřovacího procesu je stanovit diagnózu a co nejpřesněji určit lokalizaci a pokročilost nádorového onemocnění. Stanovení rozsahu onemocnění (stagingu nádoru) je určující pro následný léčebný postup. Nemocní s potenciálně resekabilním nádorem, u kterého je předpoklad dosažení R0 resekce, jsou indikováni k radikálnímu chirurgickému výkonu. Paliativní postup je volen u nemocných s neoperabilním nádorem. Příčinou neresekability může být kromě lokální pokročilosti nádoru i vysoké riziko výkonu pro přítomnost závažných přidružených onemocnění či pokročilý věk nemocného.
V klinice je používáno několik klasifikací hilového cholangikarcinomu. Nejčastěji zmiňovanou klasifikaci zavedl v roce 1975 H. Bismuth a M. B. Corlette [8]. Klasifikace popisuje podle závažnosti 4 úrovně nádorového postižení žlučového stromu v longitudinálním směru (Obr. 4). V původní aplikaci zjednodušeně umožňovala podle stupně postižení volbu chirurgického výkonu (I. – II. stadium – lokální excize, III. stadium – excize s resekcí jater, IV. stadium – inoperabilní nález). Hlavní nevýhodou této klasifikace je, že neposkytuje dostatečné informace o nádorové progresi v radiálním směru často spojenou s angioinvazí do portálního a arteriálního řečiště s atrofií přilehlého jaterního parenchymu. Tato klasifikace nemusí odpovídat reálné pokročilosti a resekabilitě nádorového onemocnění.
Obr. 4. Klasifikace Bismuth – Corlette Fig. 4: Bismuth Corlette classification 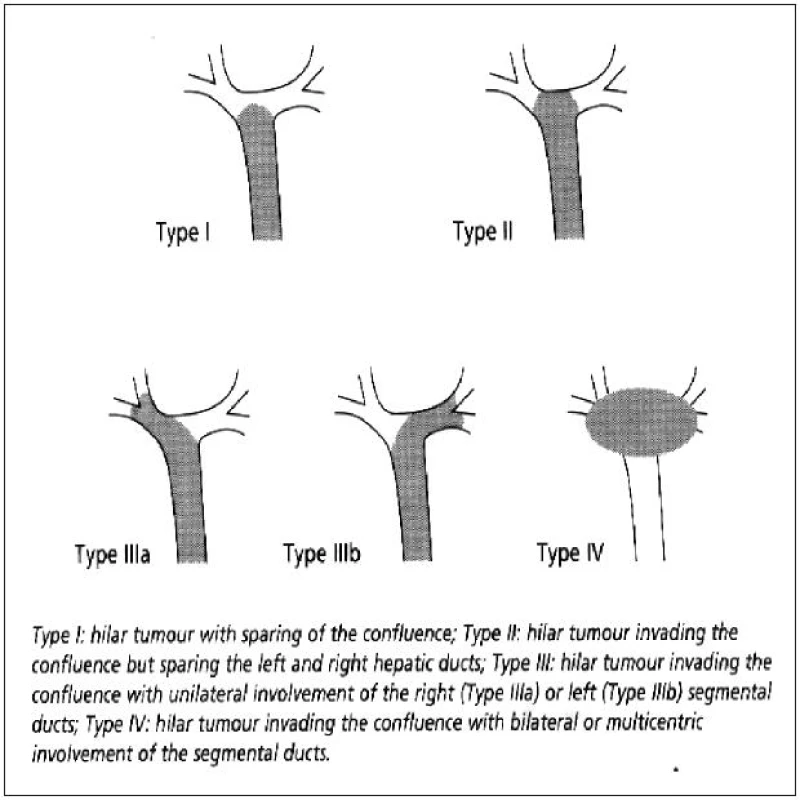
Z tohoto pohledu je přesnější stagingový systém AJCC (American Joint Commission on Cancer) založený na TNM klasifikaci [9]. Jeho aktualizace roku 2010 stratifikuje nemocné s Klatskinovým tumorem do jednotlivých stadií (Tab. 2).
Tab. 2. TNM klasifikace a stagingový systém AJCC (American Joint Commission on Cancer) Tab. 2: TNM classification and staging systém AJCC (American Joint Commission on Cancer) 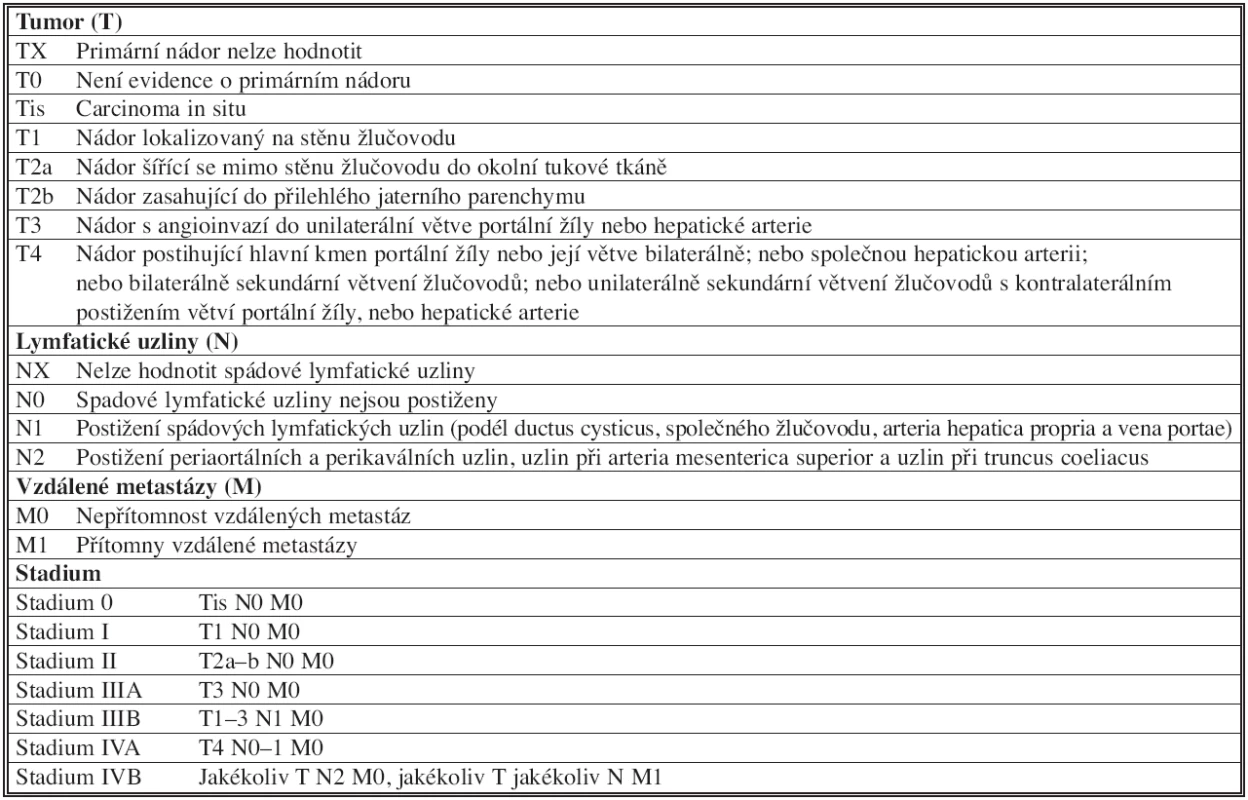
Další stagingový systém byl zaveden v roce 2001 v Memorial Sloan-Kettering Cancer Center [10]. Tato tzv. Blumgartova T – klasifikace hodnotí tři hlavní kritéria: lokalizuje postižení žlučového stromu, přítomnost a stupeň angioivaze portálního systému a přítomnost či nepřítomnost atrofie jaterního parenchymu. Podle sledovaných faktorů rozděluje nádory podle pokročilosti do 3 stupňů a současně, na rozdíl od předchozích stagingových systémů, predikuje i resekabilitu a prognózu jednotlivých stadií (Tab. 3).
Tab. 3. Skórovací systém Memorial Sloan-Kettering Cancer Center Tab. 3: Scoring system of The Memorial Sloan-Kettering Cancer Center 
Jako nedostatky této klasifikace lze uvést:
- nehodnotí angioinvazi do hepatické arterie a jejich větví,
- nehodnotí postižení lymfatických uzlin a vzdálené metastázy,
- složitost při použití v klinické praxi,
- klasifikace vznikla na základě zkušeností jednoho pracoviště.
Ve snaze o vytvoření klasifikace, která by co neobjektivněji zhodnotila pokročilost a typ nádoru a umožnila tak exaktní stanovení léčebného postupu, byl mezinárodní pracovní skupinou v roce 2011 navržen nový stagingový systém a registr nemocných s hilovým cholangiokarcinomem [11].
Předložený stagingový systém vychází z předchozích klasifikací a zahrnuje hodnocení celkem 9 parametrů. Nově klasifikuje a zohledňuje morfologický typ nádorů (sklerotizující, nodulární či papilární forma), přítomnost onemocnění jater (fibróza, steatohepatitida, primární sklerotizující cholangoitida) a velikost ponechané části jater po předpokládaném resekčním výkonu (FLR – future liver remnant). Dle návrhu autorů by klasifikace měla být prováděna před a po chirurgickém výkonu s doplněním o intraoperační údaje a definitivní histologické vyšetření. Součástí návrhu je zavedení centrálního registru nemocných s hilovým cholangiokarcinomem.
Hodnocení celkového stavu nemocného
Jedním z dalších důležitých faktorů limitujících provedení rozsáhlého resekčního výkonu je celkový stav nemocného. Nehledě na lokální operabilitu nádoru mohou být pokročilý věk, závažná komorbidita či nespolupráce nemocného rozhodujícími okolnostmi, které neumožní indikaci k chirurgické léčbě.
Hodnocení jaterních funkcí
Funkční rezervy a stav jaterního parenchymu jsou dalšími z klíčových faktorů, které ovlivňují postup a rozhodování o chirurgické léčbě. Funkční a regenerační kapacitu jater lze odhadnout z předoperačních laboratorních a funkčních testů. Předoperační CT volumetrie je standardní metodou pro kalkulaci objemu ponechaného jaterního parenchymu po resekčním výkonu. U jaterního parenchymu s normální funkcí je kalkulovaný objem FLR > 25–30 % z celkového objemu jater považován za adekvátní a dostatečný k pokrytí metabolických jaterních funkcí. U nemocných s kompromitovanými jaterními funkcemi, například při steatofibróze, chronické hepatitidě apod., je za bezpečný objem považován FRL > 40 % [12].
Z funkčních testů je nejčastěji používaný ICG test (clearence indocyaninové zeleně). Před hodnocením funkční rezervy jaterního parenchymu ICG testem je nutné vyřešit biliární obstrukci s ikterem a eventuální akutní cholangoitidou [13].
Předoperační portální embolizace
Od roku 1990, kdy byla předoperační portální embolizace (PVE – portal vein embolisation) poprvé provedena před resekcí pro hilový tumor, se stala akceptovanou metodou, zvyšující možnosti radikální chirurgické léčby nemocných s Klatskinovým tumorem [14)].
V případě, že CT volumetrie prokáže nedostatečný objem FLR před plánovanou velkou jaterní resekcí (obvykle při rozšířené pravostranné či levostranné hemihepatektomii), lze zvážit provedení předoperační portální embolizace, po které lze očekávat kontralaterální kompenzatorní hypertrofii jaterního parenchymu v průměru o 8–10 % (Obr. 5 a 6).
Obr. 5. CT volumetrie s měřením objemu levého jaterního laloku Fig. 5: CT volumetry of the left liver lobe 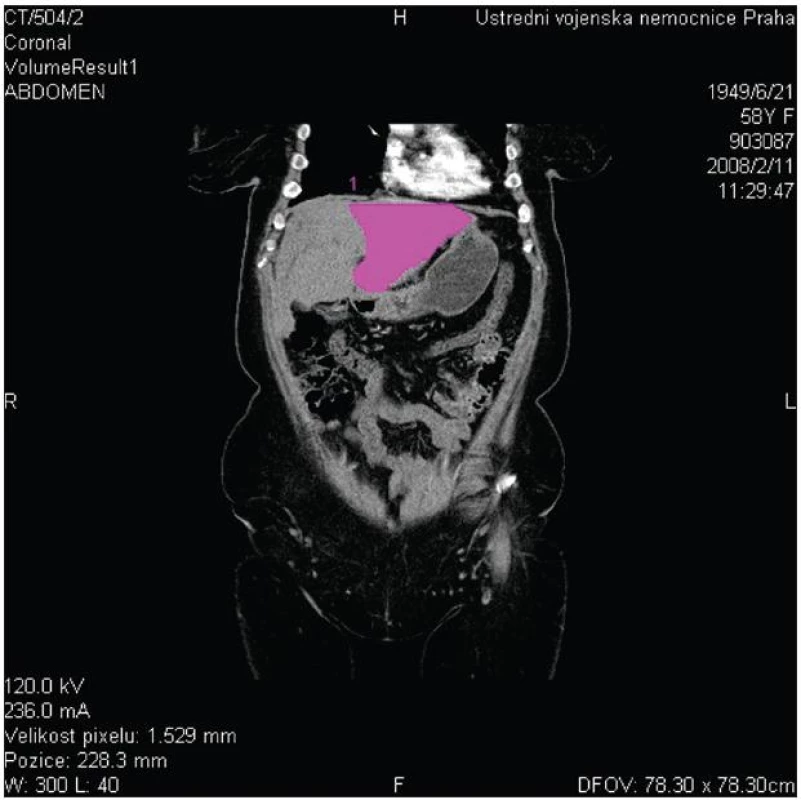
Obr. 6. Předoperační embolizace pravostranných větví (přední a zadní sektor) trifurkace portální žíly Fig. 6: Preoperative embolisation of the right branches of the portal vein trifurcation 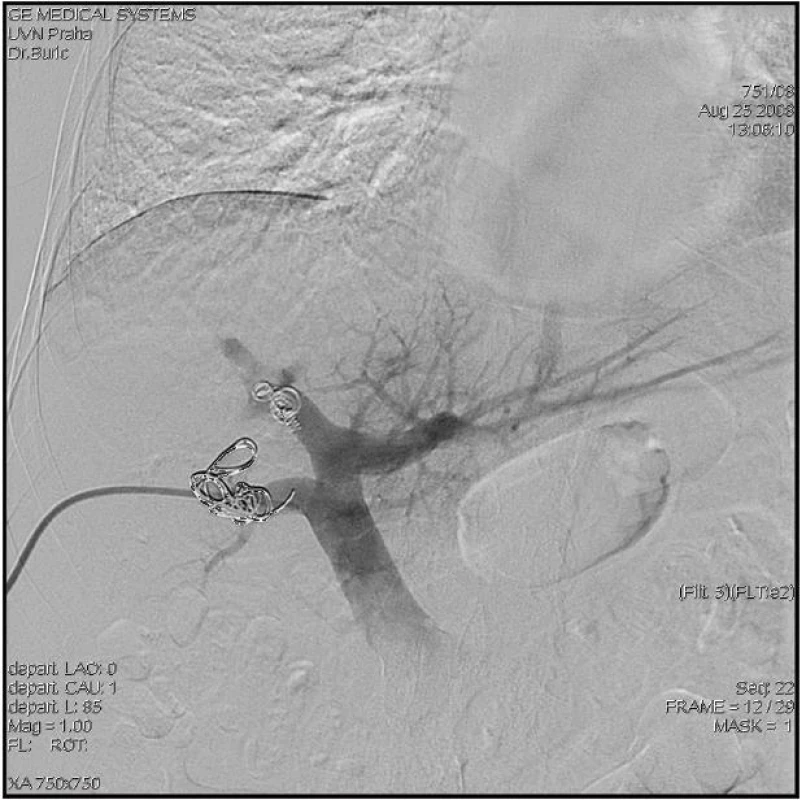
Dostatečný nárůst objemu FLR, ověřený kontrolní CT volumetrií s odstupem 3–5 týdnů po PVE, umožní u řady nemocných provedení plánovaného radikálního výkonu [15].
Nicméně správné rozhodnutí o PVE závisí na přesné předoperační diagnostice a stanovení stagingu. Provedení PVE musí být vždy pečlivě zvažováno pro některé její nevýhody a možné komplikace:
- PVE předurčuje stranu určenou k resekčnímu výkonu, a neumožňuje tak pozdější změnu taktiky při peroperačním nálezu (například změnu resekované části jater při restagingu Bismuth IIIA na IIIB),
- v případě inoperabilního nálezu může být ponechaná embolizovaná část jater s neadekvátně drénovanými žlučovody zdrojem infekčních komplikací,
- riziko nádorové progrese po provedené PVE,
- nedostatečná hypertrofie jaterního parenchymu po PVE,
- dislokace embolizačního materiálu do povodí FLR,
- další méně časté komplikace – pneumothorax, krvácení, trombóza hlavního kmene, portální hypertenze, přechodná jaterní insuficience [16].
Kontroverzním tématem zůstává nadále indikace PVE u nemocných s normálním parenchymem a funkcí jater a rovněž u nemocných s hepatopatií a zhoršenou funkcí jater, kdy odhadovaný objem FLR je větší než 40 % [17]. Určitou alternativou PVE jsou modifikované resekční výkony, které si zachovávají původní radikalitu a zároveň šetří maximum funkčního jaterního parenchymu ve snaze zvýšit objem FLR a snížit tak riziko pooperační jaterní insuficience. Autoři těchto výkonů nepozorovali rozdíl mezi parenchym zachovávajícími a rozšířenými resekcemi ve vztahu k délce přežívání a dosažených R0 resekcí, rovněž zaznamenali pokles mortality z 10 % na 7 %. Předoperační PVE byla indikována pouze u 5 % nemocných [18].
Předoperační biliární drenáž
Na indikaci a způsob provedení předoperační drenáže žlučových cest u hilového cholangiokarcinomu není všeobecně jednotný názor. Odpůrci předoperační drenáže dokumentují, že nezlepšuje výsledky chirurgické léčby, naopak je spojena s vyšší incidencí pooperačních infekčních komplikací, navíc tato intervenční metoda může být příčinou dalších závažných komplikací (akutní pankreatitida, krvácení, bakteriemie a sepse aj.) [19, 20].
Doporučují zavádět biliární drenáž pouze selektivně u nemocných s dlouhotrvajícím ikterem a zhoršenými jaterními funkcemi, při akutní cholangoitidě či při nutnosti odložit chirurgický výkon z jiného důvodu. Drenáž žlučovodů na straně FLR je rovněž indikována před provedením PVE.
Zastánci předoperační drenáže označují biliární obstrukci s ikterem za významný rizikový faktor před velkou jaterní resekcí a uvádějí její nepříznivý vliv na funkci a regeneraci jaterního parenchymu. Považují za důležité před plánovanou velkou jaterní resekcí zabezpečit adekvátní drenáž žlučovodů především na straně FLR [21].
Někteří autoři upřednostňují perkutánní přístup před endoskopickou drenáží pro menší výskyt komplikací a pro výhodu ponechat po resekci jater perkutánně zavedený drén jako pojistnou drenáž přes biliodigestivní anastomózu. Jiná pracoviště mají lepší zkušenosti s předoperačním endoskopickým zavedením duodenobiliárního stentu či nasobiliární drenáže [22].
Radikální léčba
Přes dosažené pokroky onkologické léčby v terapii zhoubných onemocnění zůstává radikální chirurgická léčba stále jedinou potenciálně kurabilní metodou ovlivňující dlouhodobé přežívání nemocných s Klatskinovým tumorem [23].
Předpokladem radikálního chirurgického výkonu je dosažení R0 resekce, tedy dosažení mikroskopicky negativních resekčních okrajů v dostatečné vzdálenosti od nádoru a provedení spádové lymfadenektomie. Exaktní předoperační histologická verifikace tumoru je obtížná a není většinou k dispozici. Nicméně absence histologické verifikace není kontraindikací zvažovaného radikálního řešení, pokud z předoperačních vyšetření vyplývá možnost dosažení R0 resekce a celkový stav nemocného tento výkon umožňuje. Tento postup je opodstatněný i s vědomím, že při definitivním histologickém zpracování resekátu nebude prokázán nádor až v 10–15 % případů [7].
Kontraindikace radikální chirurgické léčby hilového cholangiokarcinomu, tak jak byly definovány ve Memorial Sloan-Kettering Cancer Center, jsou uvedeny v Tab. 4 [10].
Tab. 4. Kontraindikace radikální chirurgické léčby hilového cholangiokarcinomu Tab. 4: Contraindications of the radical surgery procedure 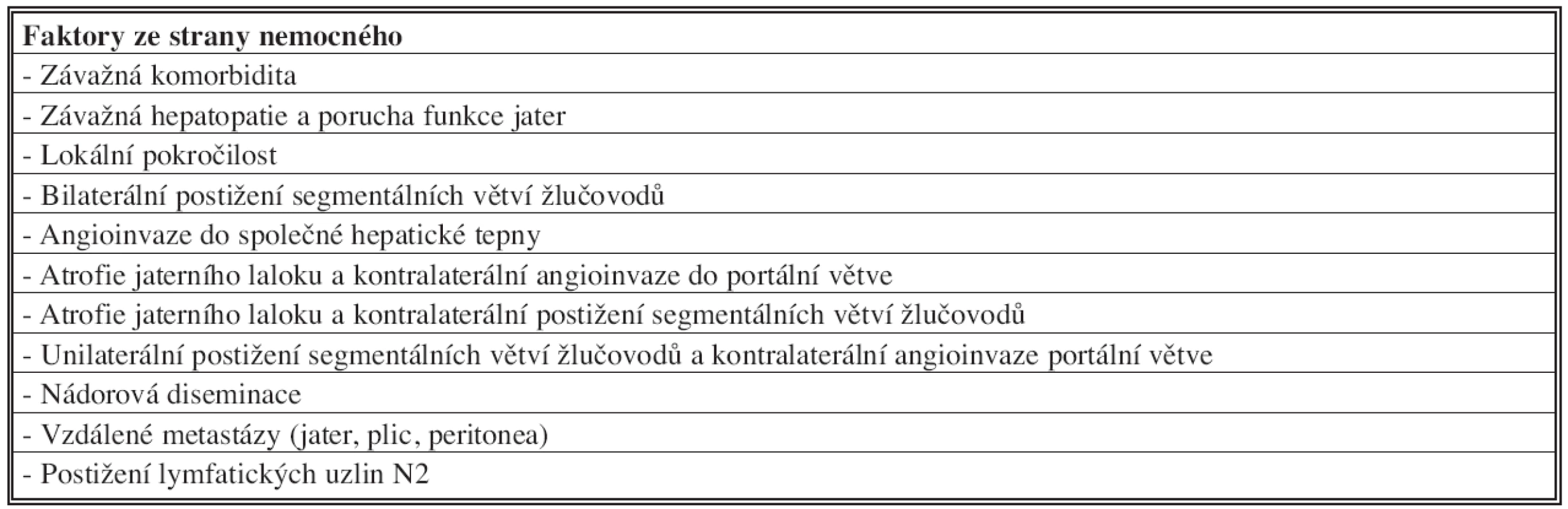
Lokální excize
Lokální excize či exstirpace je lokální výkon odstraňující extrahepatální žlučové cesty s nádorem současně s lymfadenektomií hepatoduodenálního ligamenta. Přestože u méně pokročilých a vhodně uložených nádorů lze při tomto výkonu dosáhnout adekvátních resekčních okrajů a tzv. R0 resekce, není dnes většinou autorů tento výkon považován za dostatečně radikální. Ve srovnání s resekčními výkony je uváděna kratší doba přežívání a kratší „disease free interval“. Nicméně tento lokální výkon má své místo a indikaci při ošetření lokálně nepokročilého nádoru, například neinvazivního papilárního tumoru Tis či Tl N0 typu Bismuth I–II (Obr. 7 a 8). Vzhledem k tomu, že časný nádor tohoto typu je diagnostikován zřídka, je i tento lokální výkon prováděn spíše ojediněle [24].
Obr. 7. Resekát extrahepatálních žlučovodů s papilární formou Klatskinova tumoru typu Bismuth II Fig. 7: Resection extrahepatic biliary duct for papillary type of Klatskin tumor Bismuth II 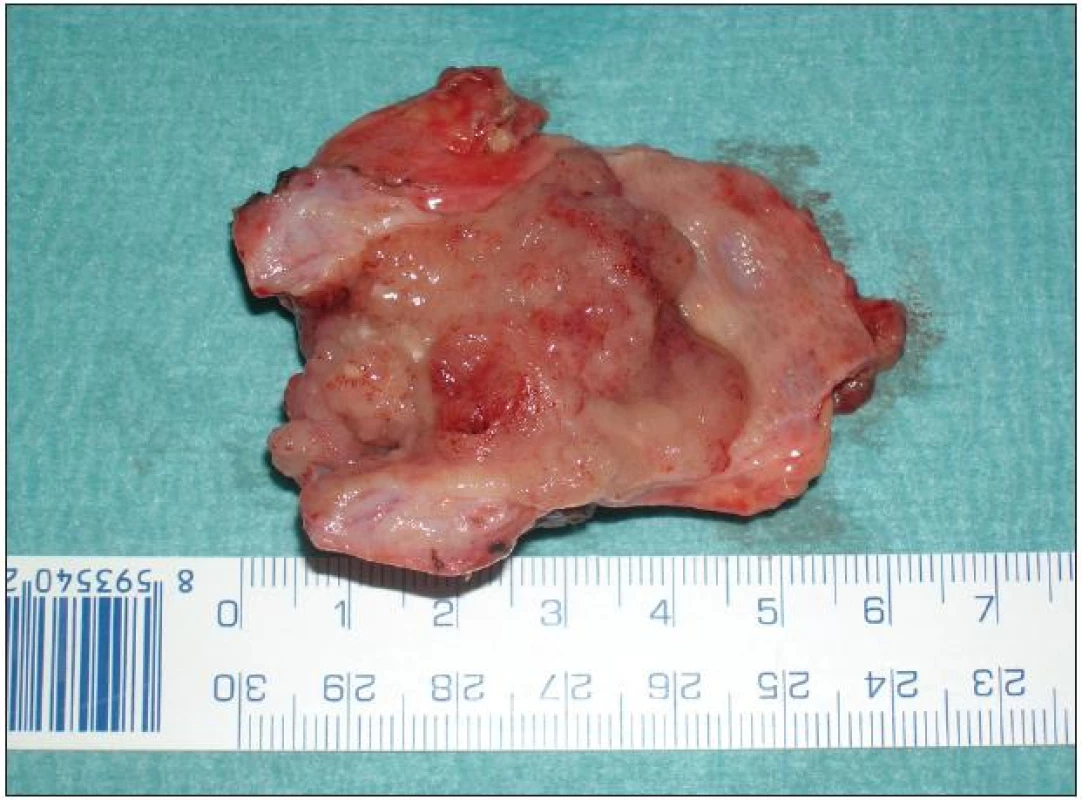
Obr. 8. Resekát extrahepatálních žlučovodů a žlučníku s Klatskinovým tumorem sklerotizujícího typu klasifikace Bismuth I Fig. 8: En bloc resection of extrahepatic biliary duct and cholecystectomy for sclerosing type of Klatskin tumor Bismuth I 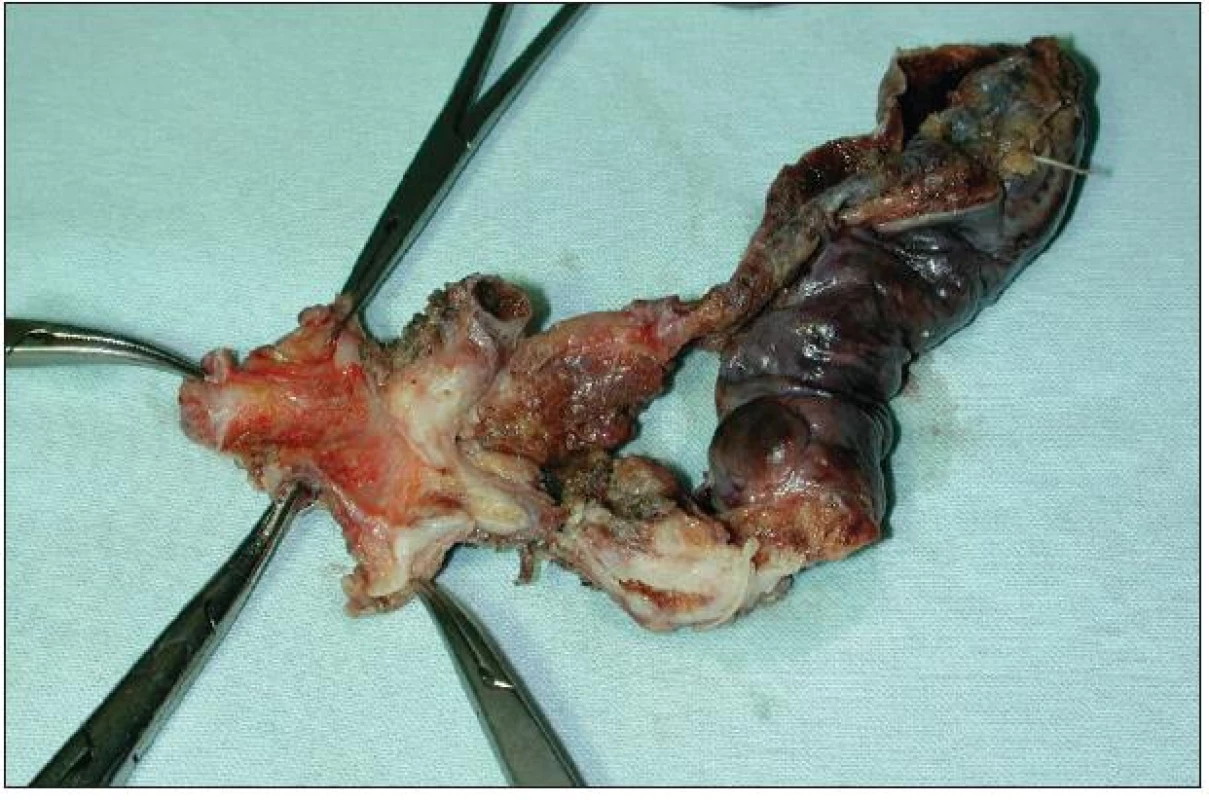
Resekční výkon
Anatomická lokalizace tumoru v hilu jater a jeho možná propagace do okolí a přilehlých struktur jsou hlavní limity k dosažení R0 resekce. Oproti lokálnímu výkonu umožňuje chirurgický výkon spojený s resekcí jater dosáhnout R0 resekce i u pokročilejších stadií Klatskinova tumoru (Bismuth III). Selektivně u některých nemocných umožní tento přístup dosažení R0 resekci i u oboustranného postižení segmetálních větví, tedy stadium Bismuth IV, které bylo původně autory klasifikace označováno za inoperabilní nález.
Resekční výkon odstraní tumor jak z hlediska jeho longitudinálního šíření podél žlučového stromu, tak z hlediska radiálního šíření do okolního jaterního parenchymu a přilehlých cévních struktur. Tento přístup je spojen s prodloužením přežívání nemocných. V současné době je za standardní chirurgický výkon v léčbě Klatskinova tumoru považována velká jaterní resekce (pravostranná či levostranná hepatektomie či rozšířená pravostranná či levostranná hepatektomie) (Obr. 9 a 10). Součástí resekčního výkonu by mělo být odstranění lobus caudatus, vzhledem k jeho anatomické lokalizaci a vztahu k hilu jater [25, 26]. Agresivní chirurgický přístup spojený s jaterní resekcí vede k dosažení mikroskopicky čistých okrajů resekce u vysokého podílu nemocných (75–88 %) s 5letým přežíváním 20–42 % a prodloužením mediánu přežívání z 11 na 37 měsíců. Ve srovnání s lokálními výkony jsou tyto rozsáhlé resekce zatíženy vyšší perioperační letalitou (uváděné v širokém rozmezí 0–15 %) a vyšší pooperační morbiditou (50 až 60 %) [27, 28].
Obr. 9. Resekát po pravostranné rozšířené hepatektomii s lobus caudatus pro Klatskinův tumor typu Bismuth IIIA Fig. 9: Right extended hepatectomy with lobus caudatus for Klatskin tumor type Bismuth IIIA 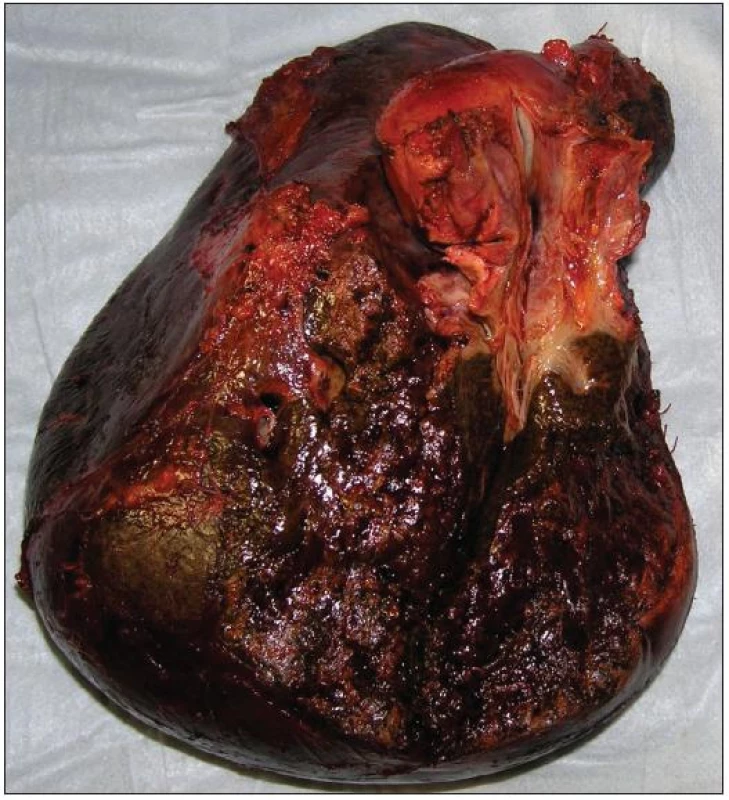
Obr. 10. Resekční plocha po pravostranné rozšířené hepatektomii s našitím exkludované jejunální kličky na levý hepatikus Fig. 10: Resection surface after extended right hepatectomy and anastomosis of jejunal loop with left hepatic duct 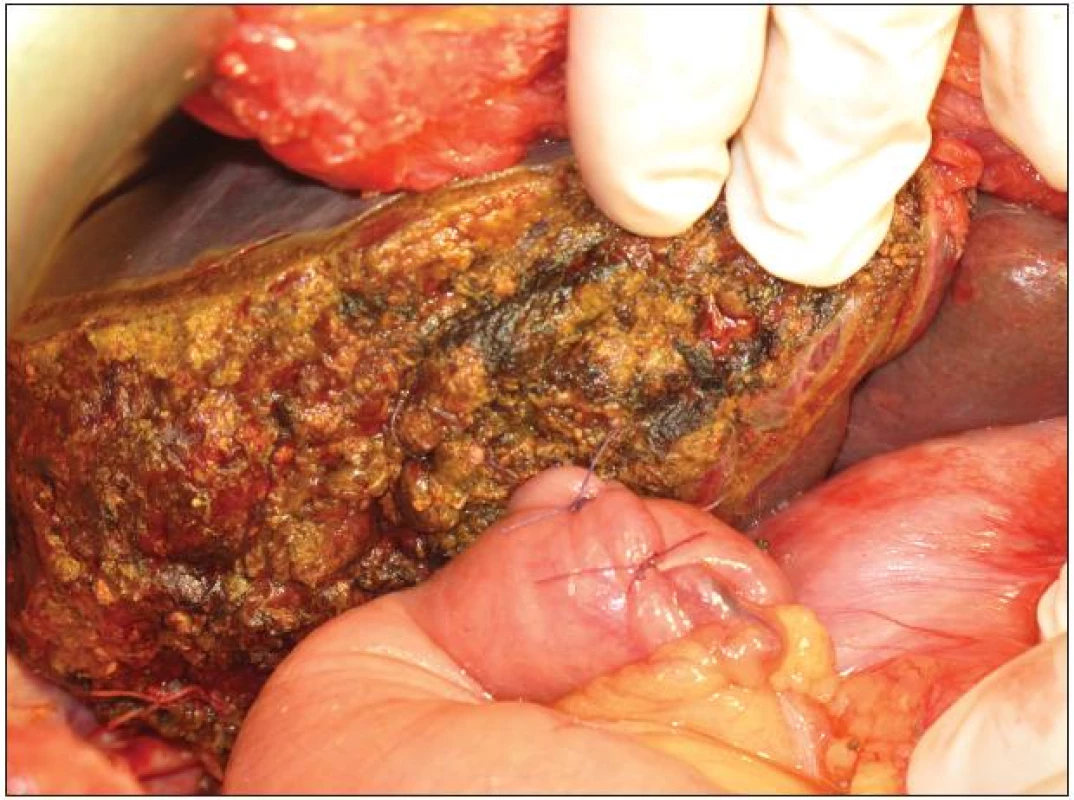
Lymfadenektomie
Nádorové postižení spádových lymfatických uzlin je jedním z hlavních prognostických faktorů ovlivňujících dlouhodobé přežívání nemocných.
Součástí radikálního výkonu je regionální lymfadenektomie N1, kterou je disekce lymfatické tkáně z oblasti hepatoduodenálního ligamenta (Obr. 11).
Obr. 11. Lymfadenektomie hilu jater a hepatoduodenálního ligamenta v rozsahu N1 Fig. 11: Lymphadenectomy of the liver hilus and hepatoduodenale ligament 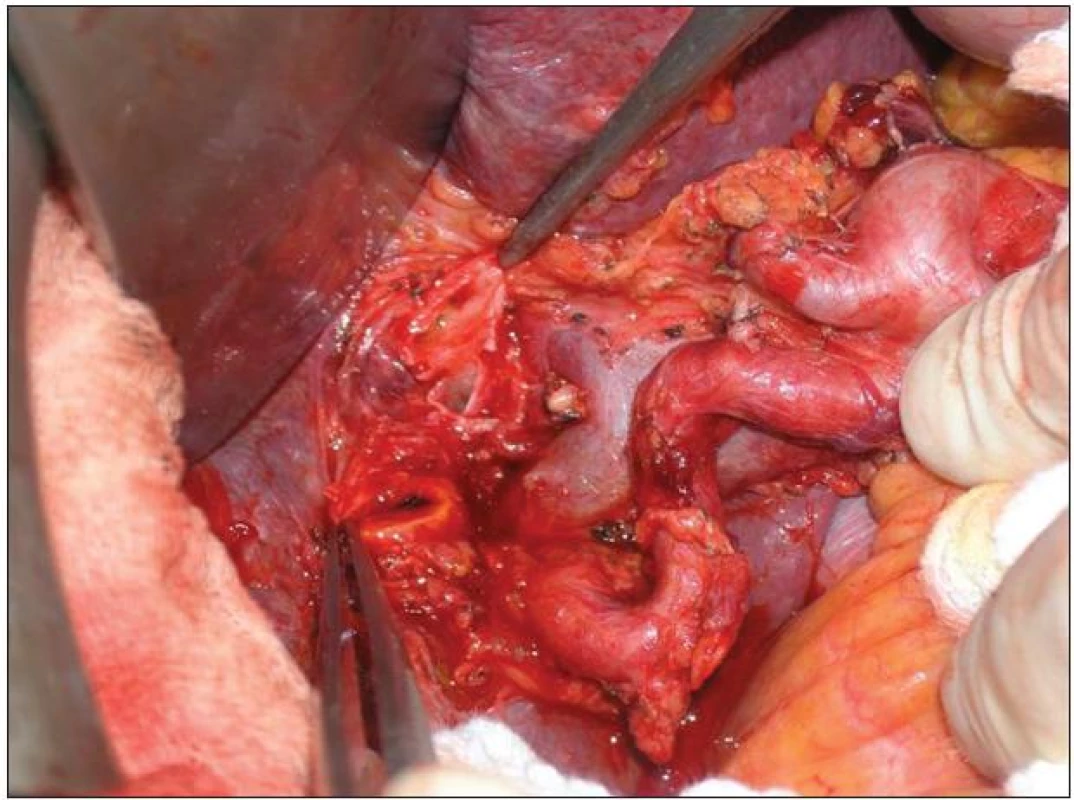
5leté přežívání nemocných s postižením lymfatických uzlin za hranici N1 včetně peripankreatických N2 a paraaortálních uzlin je 0–12 %, a proto provádění rozsáhlejší disekce lymfatických uzlin za hranici N1 většina pracovišť neprovádí [29]. Na rozdíl od Evropy a USA je přístup především japonských pracovišť radikálnější a je standardně prováděna rozsáhlejší lymfadenektomie N2, a dokonce i N3 [30].
Angioinvaze a cévní rekonstrukce
Další problematikou související se snahou o dosažení větší radikality je řešení nádorové angioinvaze portální žíly a hepatické arterie, která je u hilového cholangiokarcinomu nezřídka přítomna. V současné době není nádorová invaze do portální žíly či jejích větví považována za kontraidikaci radikálního výkonu.
Pokud angioinvaze nepostihuje hlavní kmen či kontralaterální stranu, není považována za absolutní kontraindikaci k resekčnímu výkonu.
Současná chirurgická technika a perioperační péče umožňují provedení resekce a rekonstrukce portálního řečiště bez významného ovlivnění morbidity a letality.
Některá centra mají podobný přístup k dosažení R0 resekce i při angioinvazi hepatické arterie. Rekonstrukce hepatické arterie společně s portální žilou je popisována až u 10 % radikálních výkonů [31].
Pro zvýšení radikality chirurgického výkonu a ovlivnění přežívání zavedla některá pracoviště metodu tzv. „no touch“ techniky, kdy resekce a rekonstrukce porty je standardní součástí, „en bloc“ rozšířené jaterní resekce (trisegmentektomie) současně s exstirpací žlučových cest a lymfadenektomií. Tyto výkony jsou však spojeny s výrazným zvýšením morbidity [32, 33]. Nicméně vliv cévní resekce a rekonstrukce na zlepšení prognózy a přežívání není jednoznačný a nebyl dosud v klinických randomizovaných studiích potvrzen. Z tohoto důvodu není na většině pracovišť cévní resekce a rekonstrukce součástí standardního postupu [34].
Transplantace jater
Pouze asi 1/4 nemocných s hilovým cholangiokarcinomem je indikována k radikálnímu chirurgickému výkonu. Přes pokroky v diagnostice a v terapii není 5leté přežívání po radikální chirurgické léčbě uspokojivé a udává se od 11 % do 40 % [35].
Snahou o zlepšení výsledků léčby nemocných s Klatskinovým tumorem bylo koncem 80. let zavedení transplantace jater (TJ) jako klinické metody v léčbě hilového cholangiokarcinomu. Obecně se TJ jeví jako optimální metoda v léčení pokročilých forem hilových tumorů typu Bismuth IV, neresekabilních nádorů s angioinvazí či tumorů v terénu významné hepatopatie. Rovněž je metodou volby v léčbě cholangiokarcinomu komplikující průběh primární sklerozují cholangoitidy (PSC). Nicméně časné výsledky léčby po transplantaci jater pro hilový cholangiokarcinom byly skličující s 5letým přežíváním < 28 % a rekurencí onemocnění v průběhu 2 let téměř u 50 % nemocných [36].
Ani radikálnější přístupy jako multiorgánové „cluster“ transplantace či kombinace transplantace jater s pankreatoduodenektomií výrazně neovlivnily přežívání nemocných s Klatskinovým nádorem [37, 38]. Teprve striktní kritéria zařazení nemocných k transplantaci a zavedení protokolu s neodjuvantní radiochemoterapií přinesla výraznou změnu ve výsledcích léčby nemocných s hilovým cholangiokarcinomem. Jednoleté, dvouleté a 5leté přežívání uváděné ze dvou transplantačních center (na Univerzitě v Nebrasce a v Mayo Clinic) dosahuje 92 %, 82 % a 82 %. Je třeba zdůraznit, že těchto výsledků bylo dosaženo u selektivních skupin nemocných ve specializovaných centrech a TJ nelze zatím považovat za standardní klinickou metodu v léčení nemocných s hilovým cholangiokarcinomem. Její místo a úloha v léčbě cholangiokarcinomu by měla být ještě přesněji definována [39].
Jako výhody transplantace jater proti výkonu resekčnímu lze uvést:
- obecná kritéria resekability nádoru nejsou u transplantace limitující,
- není nutná preparace a manipulace v oblasti tumoru v hilu jater,
- nízké riziko R1 chirurgického výkonu,
- transplantace jater u tumoru v terénu PSC řeší současně nádorové onemocnění i chronické onemocnění jater,
- hepatopatie či hepatotoxicita neoadjuvantní onkologické léčby není v případě transplantace jater rizikovým faktorem.
Nevýhoda transplantační léčby spočívá v současných striktních kritériích zařazení do protokolu s neoadjuvantní léčbou a malý počet nemocných, kteří mohou z této léčby profitovat. Další limitací transplantační léčby je omezená dostupnost kadaverózních jaterních štěpů. Částečným řešením je možnost transplantace části jater odebraných od žijících dárců [40]. Transplantace je rovněž spojena s nutností trvalé imunosupresivní léčby a s tím spojeného zvýšeného rizika rekurence nádorového onemocnění.
Prognostické faktory
Tématem řady obsáhlých studií je identifikace prognostických faktorů ve vztahu k dlouhodobému přežívání nemocných po radikální chirurgické léčbě. Za nejvýznamnější faktory jsou označovány:
- mikroskopicky negativní resekční okraj,
- postižení spádových lymfatických uzlin,
- histologický stupeň diferenciace nádoru.
Některé hodnocené faktory ve vztahu k dlouhodobým výsledkům radikální léčby Klatskinova tumoru jsou uvedeny v Tab. 5 [41].
Tab. 5. Prognostické faktory radikální léčby hilového cholangiokarcinomu Tab. 5: Prognostic factors of the radical surgery procedure 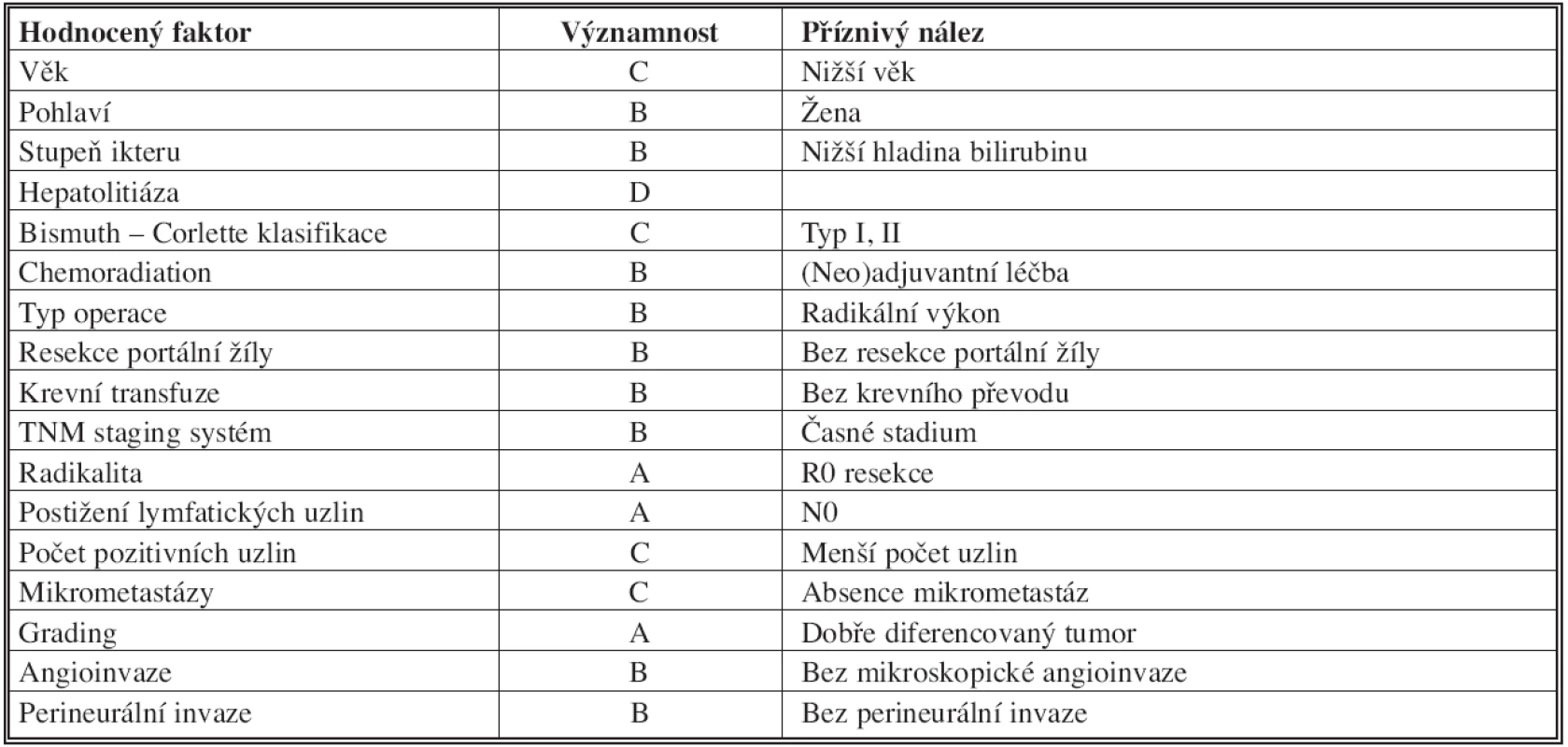
Paliativní léčba
Přes současné diagnostické možnosti a pokroky v chirurgické léčbě je k chirurgickému radikálnímu odstranění tumoru indikována pouze minoritní část nemocných. V důsledku závažné komorbidity, lokální pokročilosti či nádorové diseminace jsou více než 3/4 nemocných s hilovým cholangiokarcinomem odkázány k paliativní léčbě. Hlavním cílem paliativní léčby je zajištění včasné, dostatečné a dlouhodobé biliární drenáže. Prevence bakteriální cholangoitídy a sepse, ovlivnění ikteru, pruritu a bolestí má zásadní význam pro zlepšení kvality života nemocných s inoperabilním nádorovým onemocněním. Drenáž žlučovodů a derivaci žluče lze zajistit endoskopicky, punkční transhepatální cestou nebo chirurgicky. Dalšími paliativními léčebnými modalitami jsou radioterapie, chemoterapie a fotodynamická terapie.
Chirurgické paliativní výkony
Biliodigestivní spojka byla nejčastěji prováděna našitím exkludované jejunální kličky dle Rouxe na intrahepatálně probíhající dilatovaný žlučovod III. segmentu nebo méně často na dilatovaný žlučovod V. segmentu. Z výsledků velkých sestav vyplývá, že tyto výkony byly spojeny s významnou morbiditou 17–51 % a letalitou 6–12 %. Další možností je foráž a dilatace nádorové stenózy se zavedením stentu z choledochotomie. Tyto chirurgické paliativní výkony jsou rovněž zatíženy vysokou letalitou, dosahující 27 %. S rozvojem nechirurgických méně invazivních metod a zavedením metalických stentů (SEMS – self expandible metalic stent) do klinické praxe je indikace k chirurgické drenáži či bypassu ojedinělá. Průměrné přežívání nemocných s neoperabilním hilovým cholangiokarcinomem je menší než 12 měsíců. Z tohoto důvodu by měl být upřednostněn postup spojený s minimálním rizikem pro nemocného a biliární drenáž prováděna endoskopickou či perkutánní cestou [42].
Endoskopická léčba
Endoskopické intervenční metody jsou na většině pracovišť metodou volby při řešení biliární obstrukce jak před plánovanou chirurgickou léčbou, tak i u neoperabilních tumorů v rámci paliativní léčby. Preferována a iniciálně je prováděna endoskopická stentáž a perkutánní transhepatální přístup je rezervován pro případ neúspěšného endoskopického zavedení [43]. Předchozí a probíhající studie nadále usilují o upřesnění nejvhodnějšího diagnostického postupu a způsobu provedení endoskopické intervence, antibiotické profylaxe cholangoitidy, počtu a typů biliárních stentů, provádění unilobární či bilobární drenáže aj. (44). Jednostranné zavedení biliárního stentu se zdá být dostatečné k zajištění adekvátní drenáže. Metalický stent si zachovává delší průchodnost a je upřednostněn u nemocného s delším očekávaným přežíváním (> 6 měsíců). Umělohmotný stent vyžaduje častější reintervence a výměny v intervalech obvykle 2–3 měsíců. Je indikován u očekávaného krátkodobého přežívání (< 6 měsíců) nebo k zajištění biliární drenáže před plánovaným chirurgickým výkonem [45]. Při volbě nejvhodnější drenážní metody je třeba zvažovat i lokalizaci a rozsah obstrukce. Optimálně před intervenčním výkonem by měla předcházet MRCP, která neinvazivně ozřejmí anatomické poměry a charakter obstrukce. Endoskopický přístup je vhodnější u níže lokalizované obstrukce u nádoru typu Bismuth I či II. Perkutánní biliární drenáž bývá primárně indikována u pokročilých hilových nádorů s postižením segmentálních větví. U tumoru typu Bismuth III a IV s patrnou propagací nádoru intrahepatálně má větší naději na úspěšné zavedení stentu perkutánní transhepatální přístup (46). Perkutánní a endoskopické přístupy by neměly být konkurenční, ale spíše vzájemně se doplňující metody Někdy je nezbytné k dosažení adekvátní biliární drenáže zvolit současně kombinaci endoskopického a perkutánního přístupu. Volba určité metody často rovněž závisí na vlastních zkušenostech pracoviště [47].
Další paliativní metody
Radioterapie
Je indikována u lokálně pokročilých tumorů bez známek diseminace. Intenzivnějšího účinku záření a současně omezení nežádoucích účinků a komplikací externí radioterapií je dosaženo cílenou lokální aplikací záření při brachyterapii cestou zavedeného transhepatálního stentu, intraoperační radioterapií či radioterapií v kombinaci s chemoterapií [48]. Léčba je aplikována buď jako neoadjuvantní před chirurgickou revizí, nebo jako definitivní u inoperabilních nádorů. Při léčbě radioterapií je popisován významný výskyt nežádoucích účinků a komplikací (krvácení do GIT, striktury žlučových cest, obstrukce GIT, dekompenzace jaterních funkcí). Publikované výsledky a hodnocení léčby hilového cholangiokarcinomu metodami radioterapie jsou kontroverzní [49].
Chemoradioterapie
Chemoradioterapie je účinná metoda založená na kombinaci chemoterapie, zevní radioterapie a brachyterapie zaměřená na ovlivnění primárně neresekabilního hilového tumoru bez známek diseminace [50].
Fotodynamická terapie
Je metoda lokálního ošetření tumoru se slibnými výsledky dle prezentovaných studií jak z hlediska paliativního ošetření neoperabilních nádorů, tak jako součást neoadjuvantní léčby před radikální chirurgickou léčbou [51].
Chemoterapie
5 – FU a gemcitabin tvoří základ většiny studií a protokolů systémové léčby cholangiokarcinomu. V kombinaci s dalšími preparáty (cisplatina, oxaliplatina, docetaxel, paclitaxel, mitomycin-C, doxorubicin, epirubicin, lomustine a interferon-α) byla jejich účinnost hodnocena v řadě studií. Pro nedostatek randomizovaných studií či absence léčebné odpovědi nelze v současné době označit některý z protokolů či preparátů za léčbu, která výrazným způsobem ovlivňuje přežívání nemocných hilovým cholangiokarcinomem [53].
Závěr
Cholangiokarcinom je u většiny nemocných lokalizovaný do oblasti větvení žlučovodů a problematika léčby těchto perihilózně uložených tumorů je složitá. Radikální chirurgické odstranění nádorů je stále dosud jedinou potenciální léčebnou metodou, která poskytuje nemocnému šanci na dlouhodobé přežívání. Pouze minoritní část nemocných je však v době diagnózy vhodná k radikálnímu chirurgickému řešení a dlouhodobé výsledky léčby jsou stále neuspokojivé. Proto u každého nemocného s bezbolestně vzniklým ikterem a podezřením na obstrukci žlučovodů v oblasti hilu jater je nutné pomýšlet na hilový cholangiokarcinom. Kontakt se specializovaným pracovištěm a včasná diagnostika poskytnou u části těchto nemocných šanci na radikální chirurgické řešení a na dlouhodobé přežívání. Prognóza nemocných s radikálně neodstranitelným tumorem je špatná a průměrné přežití nepřesahuje 12 měsíců. Paliativní léčba je zaměřena na zlepšení kvality života potlačením bolestí, pruritu a ovlivnění obstrukce žlučových cest. Součástí komplexní léčby nemocných s nádorem žlučových cest je onkologická léčba s možností systémové chemoterapie a lokální aplikace radioterapie či fotodynamické terapie.
Naděje na zlepšení výsledků léčby a prognózy nemocných s hilovým cholangiokarcinomem je vkládána do několika oblastí:
- dokonalejší stagingový systém a identifikace prognostických faktorů umožní lepší selekci nemocných a zvolení nejvhodnější léčby,
- zvýšení resekability zlepšením diagnostiky časných stadií onemocnění,
- zavedení nových metod nechirurgické léčby včetně chemoterapie, fyzikální a genové terapie.
Doc. MUDr. František Bělina, CSc.
Chirurgická klinika 2. LF UK a ÚVN, Praha,
U vojenské nemocnice 1200
160 00 Praha 6
e-mail: frantisek.belina@uvn.cz
Zdroje
1. Altemeier WA, Gall EA, Zinninger MM, Hoxworth PI. Sclerosing carcinoma of the major intrahepatic bile ducts. AMA Arch Surg 1957; 75(3):450–461.
2. Klatskin G. Adenocarcinoma of the hepatic duct at its bifurcation within the porta hepatis. An unusual tumour with distinctive clinical and pathological features. Am J Med 1965;38 : 241–256.
3. Dušek L, et al. Czech Cancer Care in Numbers 2008–2009, Praha, Grada Publishing 2009.
4. Blechacz B, Gores JG. Cholangiocarcinoma: Advances in Pathogenesis, Diagnosis, and Treatment. Hepatology 2008; 48 (1): 308–321.
5. Olnes MJ, Erlich R. A review and update on cholangiocarcinoma. Oncology 2004;66 : 167–179.
6. Ebata T, Watanabe H, Ajioka Y, Oda K, Nimura Y. Pathological appraisal of lines of resection for bile duct carcinoma. Br J Surg 2002;89 : 1260–1267.
7. Gerhards MF, Vos, P, van Gulik TM, Rauws EA, Bosma A, Gouma DJ. Incidence of benign lesions in patients resected for suspicious hilar obstruction. Br J Surg 2001;88 : 48–51.
8. Bismuth H, Corlette MB. Intrahepatic cholangioenteric anastomosis in carcinoma of the hilus of the liver. Surg. Gynecol. Obstet 1975;140 : 170-178.
9. Edge SB, Byrd DR, Compton CC, Fritz AG, Greene FL. III A Perihilar Bile Ducts. In: AJCC Cancer Staging Handbook. 7th ed. Chicago, IL: Springer 2010 : 718.
10. Jarnagin WR, Fong Y, DeMatteo RP, Gonen M, Burke EC, Bodniewicz BJ, et al. Staging, resectability, and outcome in 225 patients with hilar cholangiocarcinoma. Ann Surg 2001;234 : 507–517.
11. DeOliveira ML, Richard L, Schulick D, Nimura Y, Rosen Ch, Gores G. New Staging System and a Registry for Perihilar Cholangiocarcinoma. Hepatology 2011;53 : 1363–1371.
12. Kubota K, Makuuchi M, Kusaka K, Kobayashi T, Miki K, Hasegawa K, et al. Measurement of liver volume and hepatic functional reserve as a guide to decision-making in resectional surgery for hepatic tumors. Hepatology 1997;26 : 1176–81.
13. Miyagawa S, Makuuchi M, Kawasaki S, Kakazu T. Criteria for safe hepatic resection. Am J Surg 1995;169 : 589–94.
14. Makuuchi M, Thai BL, Takayasu K, Takayama T, Kosuge T, Gunvén P, Yamazaki S, Hasegawa H, Ozaki H. Preoperative portal embolization to increase safety of major hepatectomy for hilar bile duct carcinoma: a preliminary report. Surgery 1990;107 : 521–527.
15. Nagino M, Kamiya J, Nishio H, Ebata T, Arai T, Nimura Y. Two hundred forty consecutive portal vein embolizations before extended hepatectomy for biliary cancer: surgical outcome and long-term follow-up. Ann Surg 2006; 243 : 364–372.
16. Kodama Y, Shimizu T, Endo H, Miyamoto N, Miyasaka K. Complications of percutaneous transhepatic portal vein embolization. J Vasc Interv Radiol 2002;13 : 1233–7.
17. van Gulik TM, van den Esschert JW, de Graaf W, van Lienden KP, Busch OR, Heger M, van Delden OM, Lameris JS, Gouma DJ. Controversies in the use of portal vein embolization. Dig Surg 2008;25 : 436–444.
18. van Gulik TM, Ruys AT, Busch ORC, Rauws EAJ, Gouma DJ. Extent of Liver Resection for Hilar Cholangiocarcinoma (Klatskin Tumor): How Much Is Enough? Dig Surg 2011;28 : 141–147.
19. Hochwald SN, Burke EC, Jarnagin WR, Fong Y, Blumgart LH. Association of preoperative biliary stenting with increased postoperative infectious complications in proximal cholangiocarcinoma. Arch Surg 1999;134 : 261–266.
20. Sewnath ME, Karsten TM, Prins MH, Rauws EJ, Obertop H, Gouma DJ. A meta-analysis on the efficacy of preoperative biliary drainage for tumors causing obstructive jaundice. Ann Surg 2002;236 : 17–27.
21. Young AL, Igami T, Senda Y, Adair R, Farid S, Toogood GJ, K. Rajendra Prasad KR, Lodge JPA. Evolution of the surgical management of perihilar cholangiocarcinoma in a Western centre demonstrates improved survival with endoscopic biliary drainage and reduced use of blood transfusion. HPB 2011;13,483–493.
22. Kloek JJ, van der Gaag NA, Aziz Y, Rauws EA, van Delden OM, Lameris JS, Busch OR, Gouma DJ, van Gulik TM. Endoscopic and percutaneous preoperative biliary drainage in patients with suspected hilar cholangiocarcinoma. J Gastrointest Surg 2010; 14 : 119–125.
23. Qian-Feng Shi, Ting-Bo Liang, Yun-Sheng Qin, Wei-Lin Wang, Yan Shen Min Zhang and Shu-Sen Zheng. Evaluation of surgical approach for extrahepatic cholangiocarcinoma Hepatobiliary Pancreat Dis Int 2007;6 : 622–626.
24. Ikeyama T, Nagino M, Oda K, Ebata T, Nishio H, Nimura Y. Surgical approach to Bismuth type I and II hilar cholangiocarcinomas: audit of 54 consecutive cases. Ann Surg 2007;246 : 1052–7.
25. Nimura Y, Hayakawa N, Kamiya J, Kondo S, Shionoya S. Hepatic segmentectomy with caudate lobe resection for bile duct carcinoma of the hepatic hilus. World J Surg 1990;14 : 535–43.
26. Kamiya J, Nimura Y, Hayakawa N, Kondo S, Nagino M, Kanai M. Preoperative cholangiography of the caudate lobe: surgical anatomy and staging for biliary carcinoma. J Hepatobiliary Pancreat Surg 1994;4 : 385–9.
27. Jonas S, Benckert C, Thelen A, Lopez-Hänninen E, Rösch T, Neuhaus P. Radical surgery for hilar cholangiocarcinoma. Eur J Surg Oncol 2008;34 : 263–271.
28. Nagino M, Kamiya J, Arai T, Nishio H, Ebata T, Nimura Y. Anatomic right hepatic trisectionectomy (extended right hepatectomy) with caudate lobectomy for hilar cholangiocarcinoma. Ann Surg 2006;243 : 28–32.
29. Weber SM, DeMatteo RP, Fong Y, Blumgart LH, Jarnagin WR. Staging laparoscopy in patients with extrahepatic biliary carcinoma: analysis of 100 patients. Ann Surg 2002;235 : 392–9.
30. Kitagawa Y, Nagino M, Kamiya J, Uesaka K, Sano T, Yamamoto H, Hayakawa N, Nimura Y. Lymph node metastasis from hilar cholangiocarcinoma: audit of 110 patients who underwent regional and paraaortic node dissection. Ann Surg 2001;233 : 385–392.
31. Ebata T, Nagino M, Kamiya J, Uesaka K, Nagasaka T, Nimura Y. Hepatectomy with portal vein resection for hilar cholangiocarcinoma: audit of 52 consecutive cases. Ann Surg 2003;238 : 720–727.
32. Neuhaus P, Jonas S, Settmacher U, Thelen A, Benckert C, Lopez-Hanninen E, et al. Surgical management of proximal bile duct cancer: extended right lobe resectionin creases resectability and radicality. Langenbecks Arch Surg 2003;388 : 194–200.
33. Hirano S, Kondo S, Tanaka E, Shichinohe T, Tsuchikawa T, Kato K. No-touch resection of hilar malignancies with right hepatectomy and routine portal reconstruction. J Hepatobiliary Pancreat Surg 2009;16 : 502–507.
34. Miyazaki M, Kato A, Ito H, Kimura F, Shimizu H, Ohtsuka M, Yoshidome H, Yoshitomi H, Furukawa K, Nozawa S. Combined vascular resection in operative resection for hilar cholangiocarcinoma: does it work or not? Surgery 2007;141 : 581-588.
35. Hemming AW, Reed AI, Fujita S, Foley DP, Howard RJ. Surgical management of hilar cholangiocarcinoma. Ann Surg 2005;241 : 693–702.
36. Meyer CG, Penn I, James L. Liver transplantation for cholangiocarcinoma: results in 207 patients. Transplantation 2000;69 : 1633.
37. Alessiani M, Tzakis A, Todo S, et al. Assessment of 5-year experience with abdominal organ cluster transplantation. J Am Coll Surg 1995;180 : 1.
38. Seehofer D, Thelen A, Neumann U, et al. Extended bile duct resection and liver transplantation in patients with hilar cholangiocarcinoma: long-term results. Liver Transpl 2009;15 : 1499.
39. De Vreede I, Steers JL, Burch PA, Rosen CB, Gunderson LL, Haddock MG, et al. Prolonged disease-free survival after orthotopic liver transplantation plus adjuvant chemoirradiation for cholangiocarcinoma. Liver Transpl 2000;6 : 309–316.
40. Lo CM, Fan ST, Liu CL, Yong BH, Wong Y, Lau GK, et al. Lessons learned from one hundred right lobe living donor liver transplants. Ann Surg 2004;240 : 151–158.
41. Kloek JJ, Ten Kate FJ, Busch ORC, Gouma D J, van Gulik TM. Surgery for extrahepatic cholangiocarcinoma: predictors of survival. HPB, 2008;10 : 190–195.
42. Launois B, Reding R, Lebeau G, Buard J. Surgery for hilar cholangiocarcinoma: French experience in a collective survey of 552 extrahepatic bile duct cancers. J Hepatobiliary Pancreat Surg 2000;7 : 128–34.
43. Singhal D, van Gulik TM, Gouma DJ. Palliative management of hilar cholangiocarcinoma. Surg Oncol 2005;14 : 59–74.
44. Deviere N, Baize M, De Toeuf S, Cremer M. Long-term follow-up of patients with hilar malignant stricture treated by endoscopic biliary stenting. Gastrointest Endosc 1988;34 : 95–101.
45. Kaassis M, Boyer J, Dumas R, Ponchon T, Coumaros D, Delcenserie R, et al. Plastic or metal stents for malignant stricture of the common bile duct? Results of a randomized prospective study. Gastrointest Endosc 2003;57 : 178–182. [PubMed: 12556780].
46. Sang HL, Park JK, Yoon WJ, et al. Optimal biliary drainage for inoperable Klatskin tumor based on Bismuth type. World J Gastroenterol 2007;7 : 3948–55.
47. Madoff D, Wallace M. Palliative treatment of unresectable bile duct cancer. Which stent? Which approach? Surg Oncol Clin N Am 2002;11 : 923–39.
48. Cowling M, Adam A. Internal stenting in malignant biliary obstruction. World J Surg 2001;25 : 355–61.
49. Válek V, Kysela P, Kala Z, Tomášek J, Petera J. Brachytherapy and percutaneous stenting in the treatment of cholangiocarcinoma: A prospective randomised study. European J Radiology 2007;62,2 : 175–179.
50. Czito BG, Anscher MS, Willett CG. Radiation therapy in the treatment of cholangiocarcinoma. Oncology (Williston Park) 2006;20 : 873–884 [discussion: 886-878,893–875].
51. Morganti AG, Trodella L, Valentini V, et al. Combined modality treatment in unresectable extrahepatic biliary carcinoma. International Journal of Radiation Oncology Biology Physics 2000; 46(4):913–9.
52. Ortner ME, Caca K, Berr F, Liebetruth J, Mansmann U, Huster D, et al. Successful photodynamic therapy for nonresectable cholangiocarcinoma: a randomized prospective study. Gastroenterology 2003;125 : 1355–1363.
53. Kiba T, Nishimura T, Matsumoto S, Hatano E, Mori A, Yasumi S, et al. Single-agent gemcitabine for biliary tract cancers. Study outcomes and systematic review of the literature. Oncology 2006;70 : 358–365.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2013 Číslo 1- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Komplikácie vyplývajúce z osteosyntézy suprakondylických zlomenín humeru u detí
- Počet odebíraných axilárních sentinelových uzlin a jeho vliv na diagnostickou přesnost sentinelové biopsie u karcinomu prsu
- K životnímu jubileu profesora Miroslava Rysky
- Primární aortoduodenální píštěl (PADF)
- Blahopřání do nového roku 2013
- Bariatrická chirurgie – přehled stavu problematiky
- Hilový cholangiokarcinom (Klatskinův tumor) – současné možnosti léčby
- Obecné indikace a kontraindikace k bariatrii
- Algoritmus předoperačních vyšetření, follow up v pooperačním období a nutrice v souvislosti s bariatrickou/metabolickou operací
- Intragastrický balon
- Adjustabilní gastrická bandáž
- Laparoskopická plikace žaludku (LGCP)
- Sleeve gastrectomy – tubulizace žaludku
- Roux-Y gastrický bypass
- Biliopankreatická diverze (BPD)
- Duodenální switch
- 100. výročí narození profesora Jaroslava Procházky
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Hilový cholangiokarcinom (Klatskinův tumor) – současné možnosti léčby
- Roux-Y gastrický bypass
- Biliopankreatická diverze (BPD)
- Obecné indikace a kontraindikace k bariatrii
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



