-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
The Use of Flow Cytometry for Analysis of the Mitochondrial Cell Death
Apoptosis is type I programmed cell death, a process that is essential for development and tissue homeostasis. It is a prevalent form of cell death and it proceeds via two signaling pathways – external (receptor pathway) triggered by death receptors and intrinsic (mitochondrial) apoptotic pathway with major involvement of mitochondria. Mitochondria are important cellular organelles producing energy stored in molecules of adenosine triphosphate that are essential for cell survival. The mitochondrial cell death is characterized by permeabilization of the mitochondrial outer membrane and dissipation of the transmembrane potential. Mitochondria are electronegative organelles and depolarization of the mitochondrial membrane is important for the release of proapoptotic signals. Aberrant control of the mitochondrial cell death might contribute to several diseases including cancer. Mitochondria are also a source of reactive oxygen species, Ca2+ ions and other proteins that affect processes important for the initiation and progression of tumors independently of apoptosis. Current studies focus on research of mitochondrial membrane potential and reactive oxygen species modulating various signaling pathways within the cell, their importance in carcinogenesis, and in treatment of oncological patients. Monitoring of the apoptotic markers, such as the mitochondrial membrane potential (MMP), and the level of reactive oxygen species in samples of oncological patients has a predictive value for the output of treatment protocols.
Key words:
mitochondria – flow cytometry – apoptosis – free radicals – mitochondrial membrane potential
This work was supported by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/2.1.00/03.0101) and IntegRECAMO CZ.1.07/2.3.00/20.0097).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
13. 1. 2014Accepted:
11. 4. 2014
Autoři: L. Pekarčíková 1; L. Knopfová 1; E. Ondroušková 2; J. Šmarda 1
Působiště autorů: Ústav experimentální biologie, Přírodovědecká fakulta MU, Brno 1; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 2
Vyšlo v časopise: Klin Onkol 2014; 27(Supplementum): 15-21
Souhrn
Apoptóza je typ programované buněčné smrti (typ I), který je nezbytný pro správný vývoj organizmu a tkáňovou homeostázu. Její průběh může být určen dvěma signálními drahami – vnější (receptorovou) dráhou řízenou receptory smrti a vnitřní (mitochondriální) apoptotickou dráhou, kde klíčovou roli plní mitochondrie. Mitochondrie jsou důležité buněčné organely s nepostradatelnými funkcemi pro život buňky, jako je např. tvorba energie ve formě molekul ATP (adenosintrifosfátu). Mitochondriální buněčná smrt je charakteristická změnou transmembránového potenciálu a permeabilizací vnější mitochondriální membrány. Mitochondrie jsou elektronegativní organely a depolarizace mitochondriální membrány je důležitá pro uvolnění proapoptotických signálů. Narušená regulace mitochondriální buněčné smrti se může podílet na patogenezi různých onemocnění, včetně rakoviny. Mitochondrie jsou také zdrojem reaktivních kyslíkových radikálů, iontů Ca2+ a proteinů ovlivňujících procesy iniciace a progrese nádorů nezávisle na indukci apoptózy. Současné studie se zaměřují na výzkum mitochondriálního membránového potenciálu a kyslíkových radikálů, které modulují různé signální dráhy uvnitř buňky a vymezení jejich významu v kancerogenezi, případně v léčbě onkologických pacientů. Monitorování apoptotických markerů, jako je stav mitochondriálního membránového potenciálu a určení hladiny reaktivních kyslíkových radikálů ve vzorcích nádorových pacientů, má prediktivní hodnotu pro výstup léčebných protokolů.
Klíčová slova:
mitochondrie – průtoková cytometrie – apoptóza – volné radikály – membránový potenciál mitochondriíÚvod
Nádorová onemocnění patří po kardiovaskulárních chorobách k druhé nejčastější příčině úmrtí ve vyspělých zemích. V počtu onkologických pacientů zaujímá Česká republika přední místa v Evropě. Každý rok onemocní nádory v ČR přes 77 000 lidí (data za rok 2010). Statistika ukazuje, že v průběhu života každý třetí obyvatel v ČR onemocní rakovinou a každý čtvrtý na ni zemře [1,2].
Existuje mnoho typů rakoviny, ale nelze říci, že existuje jedna všeobecně použitelná léčba. Společné jsou ovšem principy léčby. Mezi nejčastější protinádorovou léčbu se řadí chirurgický zákrok, radioterapie a chemoterapie. Chemoterapie je léčba založená na podávání cytostatických látek, které jsou toxické pro rychle se dělící buňky. Zdravá buňka zasažena cy-tostatikem má na rozdíl od nádorové buňky díky svým nepoškozeným opravným mechanizmům větší šanci na přežití. Některé typy nádorů nejsou ovšem k působení cytostatických látek z různých důvodů citlivé. Proto je důležité objasnit příčinu chemorezistence nádorových buněk, zaměřit se na správné signální dráhy a tím otevřít nové možnosti léčby rakoviny. Jednou z takových možností, které se mnohé studie věnují s cílem zvýšit protinádorovou aktivitu a selektivitu chemoterapeutických látek a překonat lékovou rezistenci nádorů, je kombinace tradiční chemoterapie s látkami zaměřenými na ovlivnění funkce mitochondrií [3]. Výzkum se zaměřuje na roli mitochondrií a mitochondriálního membránového potenciálu v buněčném přežívání/ smrti. Ovlivněním mitochondrií dochází k permeabilizaci mitochondriální membrány s následným uvolněním superoxidových aniontů a molekul peroxidu vodíku a k indukci buněčné smrti u nádorových buněk rezistentních ke konvenční chemoterapii [4,5]. Studium souvislosti mezi účinností léčby a indukcí mitochondriální buněčné smrti je možné analýzou mitochondriálního membránového potenciálu a hladiny kyslíkových radikálů metodou průtokové cytometrie, která je rutinně využívána v diagnostice mnoha nemocí, ve výzkumu i klinické praxi. Význam průtokové cytometrie spočívá v tom, že umožňuje rychlou analýzu fyzikálních a biochemických parametrů tisíců buněk během několika sekund. Analýza mitochondriálního membránového potenciálu a reaktivních kyslíkových radikálů (reactive oxygen species – ROS) může přispět k prohloubení vědomostí o mechanizmech mitochondriální buněčné smrti a zlepšit strategie léčebných postupů u pacientů s nádorovým onemocněním.
Buněčná smrt
Buněčná smrt je fyziologický proces důležitý pro vývoj organizmu, udržuje tkáňovou homeostázu kontrolou počtu buněk a defenzivní strategií odstraňuje buňky infikované, mutované nebo poškozené. V lidském těle jsou každou vteřinu mitózou produkovány nové buňky v řádu stovek tisíců a podobný počet buněk umírá fyziologickým procesem zvaným apoptóza [6,7]. Apoptóza je evolučně konzervativní u mnohobuněčných organizmů a je striktně regulována genetickým programem. Může být iniciována nebo inhibována širokým spektrem environmentálních stimulů – fyziologických i patologických. Odehrává se ve dvou fázích. První je charakteristická tvorbou apoptotických tělísek. Druhá je jejich fagocytóza a degradace jinými buňkami [8]. Apoptotický proces vede k sérii charakteristických morfologických a biochemických změn. Genetickým programem dochází k aktivaci cysteinových aspartyl ‑ proteáz – tzv. kaspáz, které hrají v apoptóze zásadní roli. Kaspázy jsou syntetizovány jako neaktivní polypeptidy (zymogeny), jež jsou proteolyticky štěpeny jinými proteázami a sestavovány do aktivních tetramerů. Kaspázy štěpí mnoho rozmanitých jaderných a cytoplazmatických substrátů, které vedou k rozkladu buňky [9,10]. Mezi charakteristické morfologické změny apoptotické buňky patří kondenzace chromatinu, fragmentace DNA, smrštění plazmatické membrány spojené s translokací fosfatidylserinu na vnější stranu plazmatické membrány a tvorba apoptotických tělísek následně fagocytovaných makrofágy [8,11,12]. Další skupinou proteinů významných pro apoptotickou signalizaci jsou proteiny rodiny Bcl2, jejíž zástupci apoptózu inhibují nebo podporují. Antiapoptotické proteiny, např. Bcl2 a Bclxl, apoptózu iniciovanou širokým spektrem signálů (např. růstovými faktory, cytokiny, chemoterapeutiky, poškozením DNA, UV zářením) inhibují, zatímco proapoptotické proteiny, např. Bax a Bak, ji stimulují [13 – 15]. Mezi jiné biochemické události, které se účastní apoptotické signalizace, patří změny v mitochondriálním membránovém potenciálu, redistribuci a množství ROS, vápenatých iontů, množství cytochromu c,proapoptotických proteinů a inhibitorů antiapoptotických molekul v cytoplazmě. Deregulace apoptózy vede k imunodeficienci, nádorovým a autoimunitním onemocněním. Možnost modulace apoptotických procesů otevírá nové strategie léčebných postupů a zlepšení chemoterapie.
Mitochondrie a mitochondriální apoptotická dráha
Mitochondrie jsou tvořeny lipidovou dvojvrstvou – vnější a vnitřní mitochondriální membránou, což je dáno jejich endosymbiotickým původem [16]. Skládají se ze tří částí: mitochondriální matrix s DNA, mezimembránového prostoru a mitochondriálních krist. Kompartmentalizace mitochondrií je nezbytná pro správnou lokalizaci dějů, které se v nich odehrávají. Základní funkcí mitochondrií jako hlavních energetických organel je oxidativní fosforylace spojená s produkcí ATP (adenosintrifosfátu). Mitochondrie mají ale také klíčový význam v indukci buněčné smrti. Mitochondriální dráha apoptózy (neboli vnitřní apoptotická dráha) je aktivována hlavně nereceptorovými stimuly, zahrnujícími cytotoxický stres, endoplazmatickoretikulární (ER) stres, poškození DNA, cytokinovou deprivaci, nedostatek růstových faktorů, ale mohou ji aktivovat také receptory smrti (death receptors) (obr. 1). K iniciaci mitochondriální apoptotické dráhy dochází nejméně třemi možnými mechanizmy: 1. uvolněním proapoptotických proteinů iniciujících kaspázovou aktivitu; 2. poškozením elektronového transportu, oxidativní fosforylace a produkce ATP, která může vést k energetické katastrofě; 3. změnou redoxního potenciálu s následkem zvýšení buněčného oxidativního stresu [17]. Následkem iniciace vnitřní apoptotické dráhy dochází k inkorporaci proteinů Bax a Bak z cytosolu do vnější mitochondriální membrány. Aktivovaný protein Bax je translokován do vnější mitochondriální membrány z cytosolu buňky, zatímco aktivovaný protein Bak je již začleněn do vnější mitochondriální membrány, kde se váže na proteiny Mcl1 a Bclxl [18 – 21]. Inkorporace proteinů Bax a Bak do mitochondriální membrány má směrodatný následek – permeabilizaci mitochondriální membrány. Mitochondrie jsou charakteristické membránovým potenciálem okolo 150 mV a mitochondriálním gradientem pH. Tyto biochemické parametry mitochondrií se účastní vzniku protonového elektrochemického gradientového potenciálu na vnitřní mitochondriální membráně. Tento primární bioenergetický parametr přes redukci elektronů prostřednictvím respiračního elektronového transportního řetězce (electron transport chain – ETC) kontroluje produkci mitochondriálního ATP. Narušení membránového potenciálu vede k permeabilizaci mitochondriální membrány s následným uvolněním proapoptotických faktorů, jako jsou cytochrom c, SMAC, DIABLO, z intermembránového mitochondriálního prostoru do cytosolu. Tyto události vedou k sestavení apoptotického proteinového komplexu zvaného apoptozóm tvořeného prokaspázou 9, proteinem Apaf ‑ 1 a cytochromem c, s následnou aktivací kaspázy 3 a dalších exekučních kaspáz. Mimo to protein Bax může také indukovat apoptózu přes mitochondriální poškození i v případě neaktivních kaspáz [22]. Buněčná signalizace indukující apoptózu vede k dalším mitochondriálním změnám, jako otevření permeabilních tranzitních pórů (PT pórů), které je vysoce regulováno iontovými kanály lokalizovanými v kontaktním místě vnitřní a vnější mitochondriální membrány [23]. PT póry jsou velké proteinové komplexy, primárně určené k transportu adeninových nukleotidů, cyklofilinu D a k regulaci aniontových kanálů závislých na napětí (VDAC, poriny), které mohou interagovat s dalšími proteiny [23,24]. Otevření PT pórů umožňuje průchod látek o velikosti až 1 500 Da a vede k depolarizaci mitochondrií. Otevření PT pórů také zvyšuje propustnost molekul vody přes mitochondriální membránu s následným zvyšováním koncentrace vody v mitochondriální matrix a bobtnáním mitochondrií [25,26]. Depolarizace mitochondriální membrány vede k inhibici respirace, tvorbě reaktivních kyslíkových radikálů a ztrátě produkce ATP [23,27].
Obr. 1. Mitochondriální regulace apoptózy. Vnitřní apoptotická signální dráha je charakteristická změnou transmembránového potenciálu a permeabilizací mitochondriální membrány, následkem čehož dochází k uvolnění proapoptotických signálů z mitochondrií. Upraveno dle [65]. ![Mitochondriální regulace apoptózy.
Vnitřní apoptotická signální dráha je charakteristická změnou transmembránového potenciálu a permeabilizací mitochondriální membrány, následkem čehož dochází k uvolnění proapoptotických signálů z mitochondrií. Upraveno dle [65].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1205ebf715c3e4c1bdf07ce96811d184.jpg)
Princip průtokové cytometrie
Průtoková cytometrie je metoda, která umožňuje simultánní měření a analýzu fyzikálních a chemických vlastností buněk nebo jiných biologických částic během jejich průchodu laserovým paprskem. Ve chvíli, kdy buňka prochází paprskem, dojde k rozptylu a lomu světla, jenž je podle směru a úhlu lomu označován jako přímý rozptyl (forward scatter – FSC) a boční rozptyl (side scatter – SSC). FSC je charakterizován lomem světla o malém úhlu (2 – 13°) a je úměrný velikosti buňky, úhel SSC je 90° a charakterizuje vnitřní buněčné struktury, např. granularitu buňky. Dále je průtokovým cytometrem detekována fluorescence procházejících mikroskopických částic. Na analyzované buňky nebo jejich části se váží fluorescenční barviva (fluorochromy), která absorbují světlo určité vlnové délky vyzařované laserem a následně vyzařují (emitují) část takto absorbovaného světla o odlišné vlnové délce.
Průtokový cytometr se skládá z fluidního, optického a elektronického systému (obr. 2). Pomocí fluidního systému jsou buňky nasávány pod tlakem do průtokové komory s nosnou kapalinou, kde dochází k jejich separaci a kde paprsek monochromatického laseru prochází buňkou. Optický systém sestává z excitační části, tvořené laserem a soustavou čoček a hranolů usměrňujících paprsek, a z části sběrné, která se skládá z optických zrcadel a filtrů umožňujících detekci světelných kvant specifické vlnové délky příslušnými optickými detektory. K převodu optického signálu na elektrický a k digitalizaci pro počítačovou analýzu slouží elektronický systém. Analyzovaná data mohou být zobrazena jako tzv. dot plot, dvourozměrný graf, kde každá tečka reprezentuje jednu buňku, nebo ve formě histogramu pro jednoparametrovou analýzu. Výhodná je multiparametrová analýza umožňující výběr různých buněčných populací s různými vlastnostmi a jejich vzájemnou kombinaci. Průtokové cytometry jsou běžně vybaveny 2 – 3 detektory, které měří světlo specifické vlnové délky emitované buňkou. Nejčastějšími fluorochromy se společnou excitační vlnovou délkou 488 nm (dosaženou argonovým modrým laserem) jsou fluorescein izothiokyanát (FITC), phycoerytrin (PE), peridin‑chlorofyl (PerCP), phycoerytrin‑Cy5 (PE ‑ Cy5), Texas red aj. Fluorochromy mohou být konjugovány s různými protilátkami, a být tak využity pro vícebarevné analýzy. Speciální aplikací průtokové cytometrie je buněčné třídění (cell sorting), kdy jsou buňky tříděny do sběrných zkumavek na základě předem známých parametrů.
Obr. 2. Schematické znázornění principu průtokové cytometrie. Průtokový cytometr (fl uidní systém) umožňuje nasávání buněčné suspenze vzorku a její rozdělení do jednotlivých buněk. V optické části jsou buňky ozářeny laserovými paprsky a změny světelných kvant o specifi cké vlnové délce jsou detekovány příslušnými optickými detektory. Světelné signály jsou následně elektronickým systémem převedeny do elektrického signálu a digitalizovány pro počítačovou analýzu. 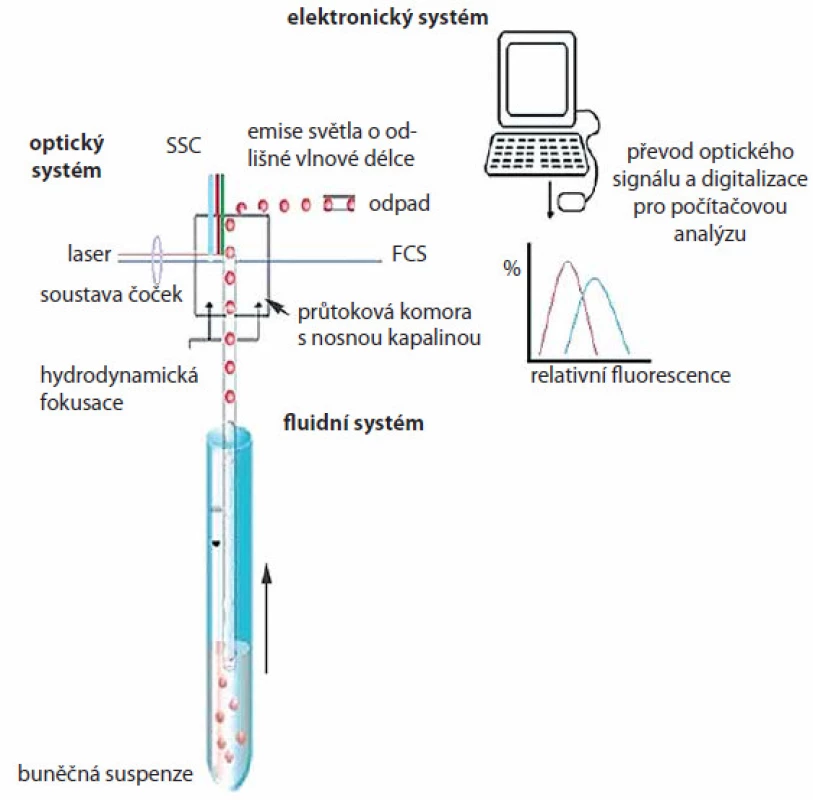
Detekce permeabilizace mitochondriální membrány
Více než půl století je známo, že některá barviva v určitém prostředí agregují. Tvorba agregátu je doprovázena dramatickým posunem v absorpčních i fluorescenčních maximech barviva. Unikátní znak těchto barviv je užitečný při biologických studiích vlastností buněk a charakteristik buněčných struktur. Značná velikost molekul fluorescenčního barviva umožňuje jejich pomalou absorpci do sledovaných struktur, a jsou proto užitečné jako reportérové molekuly pro lokalizaci biochemických událostí [28]. Tyto molekulární sondy jsou schopny detegovat změny mitochondriálního membránového potenciálu průtokovou cytometrií. Mnoho z těchto sond je klasifikováno do třídy lipofilních kationtů. Sondy se akumulují v mitochondriální matrix, což je dáno negativním nábojem mitochondrií. Safranin [29,30], tetrafenylfosfonium (TPP) [31] a rhodamin 123 [32] jsou členy této třídy. Nicméně jejich nevýhodou je absence možnosti kvantifikace. TMRM (tetramethylrhodamine methyl ester) a TMRE (tetramethylrhodamine ethyl ester) jsou fluorescenční deriváty rhodaminu 123, které mohou být užity ke kvantifikaci pomocí fluorescence [33,34], tak jako DiOC6 (3,3’ - dihexyloxacarbocyanine iodide). DiOC6 je jednou z nejčastěji používaných sond pro měření membránového potenciálu průtokovou cytometrií. Nevýhodou DiOC6 je ovšem její vysoká toxicita zasahující respirační řetězec a při použití ultra ‑ nízkých koncentrací vyžaduje přesné měření, což omezuje její využitelnost v porovnání s ostatními sondami. Sonda JC ‑ 1 (5,5’,6,6’ - tetrachloro‑1,1’,3,3’ - tetraethylbenzimidazolcarbocyanin iodid) je považována za nejvýkonnější sondu pro detekci změn mitochondriálního membránového potenciálu. Molekuly sondy JC ‑ 1 existují v monomerní formě a emitují fluorescenci o vlnové délce 527 nm po excitaci světlem o vlnové délce 488 nm. V závislosti na membránovém potenciálu je sonda schopna vytvářet J ‑ agregáty (čím větší polarizace membrány, tím větší akumulace sondy) spojené s emisí světla o vlnové délce 590 nm [35]. Při depolarizaci mitochondriální membrány dochází k následnému uvolňování sondy do cytosolu, které se projeví poklesem intenzity fluorescence.
Volné radikály
Současné výzkumy se ve zvýšené míře zaměřují na volné radikály a jejich roli v nádorovém mikroprostředí. Volné radikály jsou molekuly s vysokou mírou nestability, která je vyvolána přítomností jednoho či více elektronů ve vnějším orbitu jejich atomů. Jejich vysoká reaktivita způsobuje vytrhávání elektronů ze sousedních atomů a následkem toho dochází k poškození funkce dané molekuly. Různé vnitřní a vnější okolnosti a/ nebo biochemická aktivita mohou narušit kontrolu nad udržením rovnováhy mezi vznikem volných radikálů a jejich degradací. Antioxidanty jsou hlavním zdrojem ochrany těla proti volným radikálům. Antioxidanty transformují volné radikály do méně reaktivních a pro organizmus méně škodlivých forem. Příkladem těchto antioxidantů jsou CAT (kataláza), SOD (superoxid dismutáza), GPx (glutation peroxidáza) [36,37]. Nerovnováha mezi hladinou volných radikálů a jejich degradací antioxidanty se nazývá oxidativní stres a může zapříčinit poškození vedoucí k různým onemocněním [38]. Mezi volné radikály se řadí radikály kyslíku a dusíku, které jsou klíčovými regulátory v iniciaci a progresi nádorů. Radikály způsobují poškození genomu, zvyšují genetickou nestabilitu a zprostředkovávají modulaci různých procesů spojených s patogenezí nádorů, jako jsou apoptóza, angiogeneze, buněčný cyklus, invazivita, metastazování, metabolizmus [39]. Různé reaktivní formy kyslíku jsou označovány jako ROS (reactive oxygen species) [40,41] a zahrnují superoxidové anionty (O2 – •), které jsou formovány NADPH oxidázami a jsou produkovány především v mitochondriích. Účinkem SOD (superoxid dismutázy) následně dochází k formování molekul peroxidu vodíku [41]. Další redukční procesy transformující peroxid vodíku cestou Fentonovy reakce do hydroxylových radikálů (•OH) a poté do konečného produktu, kterým je voda, je zprostředkován účinkem katalázy (CAT) a glutation peroxidázy [41]. Když molekuly kyslíku vážou protony jiných volných radikálů, vznikají hydroperoxidové radikály (HO2 – •) [42]. Mezi reaktivní formy dusíku označované RNS (reactive nitrogen species) patří volné radikály oxidu dusnatého (NO•), peroxydusitany (ONOO – ), radikály oxidu dusného (NO2•) a dusitany (NO2 – ) [43]. NO• vzniká prostřednictvím proteinové rodiny NOS (nitric oxide synthetase). ONOO – vzniká reakcí NO• s molekulou O2 – •, s NO2• jako meziproduktem. Tento meziprodukt reaguje s NO• a tím vytváří N2O3 (dinitrogen ‑ trioxid) [42]. NOS zahrnují různé izoformy: neurální (nNOS nebo NOSI), inducibilní (iNOS nebo NOSII), endoteliální (eNOS nebo NOSIII) a mitochondriální (mtNOS), všechny závislé na aktivitě NADPH a kalmodulinu [44]. Buněčné metabolické systémy neustále produkují volné radikály z kyslíku. Kolem 80 % molekul kyslíku je spotřebováno v mitochondriích a asi 5 % z nich je transformováno do superoxidových aniontů a hydroxylových radikálů. Endogenní (prostaglandiny, mastné kyseliny) a exogenní látky (léčiva, barviva, antioxidanty) jsou metabolizovány v hladkém endoplazmatickém retikulu, spotřebovávají 15 % molekul kyslíku, z nichž kolem 2 – 30 % je určeno k transformaci do volných radikálů, hlavně do hydroxylových radikálů. Makrofágy a leukocyty tvoří radikály jako obranný mechanizmus proti bakteriím a virům. Volné radikály jsou užity v syntéze prostaglandinů, cholesterolu a steroidních hormonů. Hydroxylace lysinu a prolinu do hydroxylysinu a hydroxyprolinu je nutná pro biosyntézu kolagenu, což vyžaduje účast hydroxylových volných radikálů [45]. Volné radikály mají význam během metabolických a obranných dějů zdravých buněk. Jejich přítomnost v buňce je ovšem spojena s rizikem hlavně pro přítomné velké molekuly, jako jsou nukleové kyseliny, proteiny, polysacharidy, lipidy, které mohou být poškozeny oxidací volnými radikály [45].
mtROS
Tvorba mitochondriálních ROS (mtROS) se odehrává v místě transportního elektronového řetězce (electron transport chain – ETC) v místě vnitřní mitochondriální membrány během procesu oxidativní fosforylace. Oxidativní fosforylace je důležitý buněčný proces, který využívá kyslíku a jednoduchých cukrů k vytvoření ATP, hlavního zdroje energie pro buňky. Součástí tohoto procesu je pět velkých proteinových komplexů, zvaných komplex I – V. Jednotlivé fáze ETC neprobíhají dokonale. Uvolnění elektronů z komplexu I a III vede k částečné redukci kyslíku na superoxidovou formu. Superoxidový aniont je rychle dismutován na peroxid vodíku dvěma dismutázami – superoxid dismutáza 2 v mitochondriální matrix a superoxid dismutáza 1 v mitochondriálním intermembránovém prostoru. Superoxidové anionty a peroxidy vodíku tvořené v tomto procesu jsou považovány za mitochondriální ROS. Superoxidové anionty mají elektrofilní vlastnosti a krátký poločas rozpadu. Mohou prostupovat přes vnější mitochondriální membránu a ovlivňovat signální cesty v cytosolu buňky [46]. Superoxidové anionty mohou navíc podléhat reakci s jinými radikály, jakými jsou oxidy dusíku (NO), a vytvářet peroxidusitany (ONOO2• – ) uvnitř mitochondrií a indukovat poškození DNA, narušení mitochondriální integrity a nevratné modifikace proteinů. Na rozdíl od superoxidových aniontů je peroxid vodíku nukleofilní a více stabilní. Navíc jeho koncentrace je stonásobně vyšší než u superoxidových aniontů [47]. Teoreticky by produkce mtROS měla být přímo úměrná s množstvím mitochondrií v buňce. Bylo dokázáno, že faktor mitochondriální biogeneze PGC1α (factor peroxisome proliferator‑activated receptor‑γ coactivator 1α) zvyšuje nejen mitochondriální hmotnost, ale také expresi mnoha antioxidantů zahrnujících SOD2 GPx [48]. Mitochondriální hmotnost tedy není důležitý faktor, který reguluje tvorbu mtROS. Mitochondrie jsou dynamické organely, jež často mění svůj počet, velikost, tvar a distribuci v odpovědi na intra ‑ a extracelulární stimuly. Mitochondrie mohou podléhat selektivní autofagické degradaci zvané mitofagie [49]. Narušení těchto procesů je spojováno s neurodegenerativními onemocněními [50]. Procesy mitochondriálního dělení a fúze jsou důležité pro redistribuci jejich proteinů a ochraně proti škodlivým účinkům mutací mtDNA. Tyto procesy jsou regulovány proteiny N ‑ ethylmaleimide ‑ sensitive factor attachment protein receptor (SNARE)‑like, které zahrnují mitofusin‑1 a - 2. Přesná regulace těchto procesů není popsána, ačkoli je doloženo, že mtROS zvyšují mitochondriální fragmentaci [51]. Zdravé, diferencované buňky spoléhají v produkci ATP na mitochondriální respiraci (aerobní fosforylaci) v přítomnosti kyslíku (tvorba 36 mol. ATP/ mol. glukózy). Za podmínek limitního množství kyslíku spoléhají buňky na anaerobní glykolýzu jako zdroj energie (tvorba 2 mol. ATP/ mol. glukózy). Většina nádorových buněk se adaptuje na aerobní glykolýzu jako způsob produkce energie [52]. Tento fenomén je známý jako Warburgův efekt [53]. Ukázalo se, že nádorové buňky mají další energetické požadavky přesahující možnosti aerobní fosforylace, což zvyšuje oxidativní stres [54]. V rychle proliferujících nádorových buňkách podporuje přítomnost onkogenních mutací aberantní metabolizmus a proteosyntézu s následkem zvýšené produkce ROS. Bylo zjištěno, že Warburgův efekt poskytuje výhodu transformovaným buňkám posílením antioxidačního systému k neutralizaci akumulace ROS. Jeden z klíčových glykolytických enzymů – pyruvát ‑ kináza – hraje důležitou roli v tomto procesu, nádorové buňky exprimují přednostně M2 izoformu tohoto enzymu (PKM2) [55] a akutní zvýšení intracelulární hladiny ROS může inhibovat PKM2 oxidací cysteinových zbytků tohoto enzymu [56]. Inhibice PKM2 pak vede k produkci dostatečného redukčního potenciálu, který způsobuje detoxifikaci ROS odklonem glukózového metabolizmu do pentózafosfátového cyklu. Tím, že nádorová buňka reguluje vlastnosti PKM2, poskytuje ochranu proti nadměrné produkci ROS běžně pozorované v nádorech [57].
Detekce mtROS
Přítomnost intracelulárních mtROS může být detegována fluorescenčními barvivy. Mezi nejčastěji používaná patří dichlorodihydrofluorescein (DCF) a dihydroethidium (DHE). Nevýhodou běžně užívaného fluorescenčního indikátoru ROS dichlordihydrofluoresceinu je jeho nespecifičnost (je senzitivní k více typům ROS), nemůže být cílený do specifických intracelulárních kompartmentů a může při expozici světlem produkovat ROS, které mají za následek tvorbu artefaktů amplifikací signálu. DHE je fluorescenční indikátor superoxidových aniontů. Ve spojení s markery specifickými pro mitochondrie, jako je MitoTracker užívaný pro konfokální mikroskopii, můžeme určovat, zdali jsou ROS generovány z mitochondrií [58,59]. HyPer plazmidy jsou první geneticky kódované fluorescenční senzory schopné detegovat intracelulární peroxidy vodíku. Plazmid je vytvořen vložením cDNA kódující žlutý fluorescenční protein do regulační domény proteinu OxyR E. coli [60]. HyPer plazmid vykazuje submikromolární afinitu k molekulám peroxidu vodíku a současně je necitlivý k ostatním druhům ROS. Plazmidy HyPer nezpůsobují artefakty ROS a mohou být užity pro detekci rychlých změn v koncentracích peroxidu vodíku v různých buněčných kompartmentech. Pro minimalizaci signálů přicházejících z ostatních nemitochondriálních organel se k detekci mtROS využívají fluorescenční indikátory modifikované k zacílení přímo na mitochondrie. Jsou založeny na bázi lipofilních kationtů, které jsou přitahovány elektronegativním prostředím mitochondrií způsobeným protonovým gradientem na vnitřní mitochondriální membráně. MitoSOX je DHE spojený s trifenylfosfoniem (TPP+). Využívá prudkého elektrochemického gradientu na vnitřní mitochondriální membráně a hromadí se uvnitř mitochondrií (stonásobně více v porovnání s cytosolem). MitoSox je účinně užíván k přímé detekci mitochondriálních superoxidových aniontů v různých buněčných typech [61]. Přidání motivu TPP+ k fenylboronát esteru tvoří MitoPY1 [62], biologicky kompatibilní sondu pro detekci mitochondriálního peroxidu vodíku. Při zvýšení hladiny H2O2 dochází k významnému nárůstu fluorescence MitoPY1, kterou je možné detegovat konfokální mikroskopií i průtokovou cytometrií. Další sondy používané pro detekci mtROS jsou MitoAR, jež reaguje na •OH a HOCl•, a MitoHR, která je více senzitivní k •OH. Tyto sondy vznikly přidáním fluoroforu podobného rhodaminu k 4 - amino ‑ fenyl aryl etheru, nebo resp. k 4 - hydroxy aryl ether skupině [63]. pHyPer ‑ dMito je savčí expresní vektor obsahující sekvenci MTS (mitochondrial targeting sequence) odvozenou z podjednotky VIII lidské cytochrom c oxidázy, fúzované s HyPer (fluorescenční senzor peroxidu vodíku), který umožňuje detekci molekul peroxidu vodíku tvořených přímo v mitochondriích.
Závěr
Rakovina je velmi heterogenní onemocnění a různorodost mezi buněčnými populacemi nádorů může ovlivňovat jak jejich schopnost expanze a progrese, tak citlivost k protinádorové terapii. Mitochondriální buněčná smrt je důležitá součást života buněk a za patologických podmínek může dojít k narušení průběhu tohoto procesu. V důsledku změn v mitochondriální struktuře a funkci může vznikat chemorezistence nádorových buněk. Rozdíly membránového potenciálu mezi jednotlivými buňkami nádoru odráží buněčnou heterogenitu a prostřednictvím jeho analýzy mohou být identifikovány buňky, které jsou důležité v nádorové progresi. Membránový potenciál tak může být potenciální prediktor odpovědi na protinádorovou léčbu a/ nebo přímý cíl chemoterapie [63]. Studium mitochondriálního potenciálu a detekce ROS může přispět k lepšímu porozumění apoptotického mechanizmu a sestavení efektivnější léčby pro pacienty s nádorovým onemocněním.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101) a IntegRECAMO, CZ.1.07/2.3.00/20.0097).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. RNDr. Jan Šmarda, CSc.
Ústav experimentální biologie
Přírodovědecká fakulta MU
Kotlářská 2
611 37 Brno
e-mail: smarda@sci.muni.cz
Obdrženo: 13. 1. 2014
Přijato: 11. 4. 2014
Zdroje
1. Svod.cz [internetová stránka]. Český národní webový portál epidemiologie nádorů. Masarykova univerzita, Česká republika; [citováno leden 2014]. Dostupný z: http:/ / www.svod.cz.
2. Linkos.cz [internetová stránka]. Česká onkologická společnost ČLS JEP, Česká republika; [aktualizováno 11. srpna 2011; citováno leden 2014]. Dostupné z: http:/ / www.linkos.cz.
3. Hammoudi N, Ahmed KB, Garcia ‑ Prieto C et al. Metabolic alterations in cancer cells and therapeutic implications. Chin J Cancer 2011; 30(8): 508 – 525. doi: 10.5732/ cjc.011.10267.
4. Alvero AB, Montagna MK, Holmberg JC et al. Targeting the mitochondria activates two independent cell death pathways in ovarian cancer stem cells. Mol Cancer Ther 2011; 10(8): 1385 – 1393. doi: 10.1158/ 1535 - 7163.MCT ‑ 11 - 0023.
5. Dong LF, Jameson VJ, Tilly D et al. Mitochondrial targeting of α ‑ tocopheryl succinate enhances its pro‑apoptotic efficacy. A new paradigm for effective cancer therapy. Free Radical Biol Med 2011; 50(11): 1546 – 1555. doi: 10.1016/ j.freeradbiomed.2011.02.032.
6. Horvitz HR. Genetic control of programmed cell death in the nematode Caenorhabditis elegans. Cancer Res 1999; 59 (7 Suppl): 1701S – 1706S.
7. Vaux DL, Korsmeyer SJ. Cell death in development. Cell 1999; 96(2): 245 – 254.
8. Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide ‑ ranging implications in tissue kinetics. Br J Cancer 1972; 26(4): 239 – 257.
9. Earnshaw WC, Martins LM, Kaufmann SH. Mammalian caspases: structure, activation, substrates, and functions during apoptosis. Annu Rev Biochem 1999; 68 : 383 – 424.
10. Thornberry NA, Lazebnik Y. Caspases: enemies within. Science 1998; 281(5381): 1312 – 1316.
11. Kerr JF, Winterford CM, Harmon BV. Apoptosis. Its significance in cancer and cancer therapy. Cancer 1994; 73(8): 2013 – 2026.
12. Martin SJ, Reutelingsperger CP, McGahon AJ et al. Early redistribution of plasma membrane phosphatidylserine is a general feature of apoptosis regardless of the initiating stimulus: inhibition by overexpression of Bcl ‑ 2 and Abl. J Exp Med 1995; 182(5): 1545 – 1556.
13. Cuende E, Alés ‑ Martinez JE, Ding L et al. Programmed cell death by bcl ‑ 2 - dependent and independent mechanisms in B lymphoma cells. The EMBO Journal 1993; 12(4): 1555 – 1560.
14. Adams JM, Cory S. The Bcl ‑ 2 protein family: arbiters of cell survival. Science 1998; 281(5381): 1322 – 1326.
15. Sedlak TW, Oltvai ZN, Yang E et al. Multiple Bcl ‑ 2 family members demonstrate selective dimerizations with Bax. Proc Natl Acad Sci USA 1995; 92(17): 7834 – 7838.
16. Dyall SD, Brown MT, Johnson PJ. Ancient invasions: from endosymbionts to organelles. Science 2004; 304(5668): 253 – 257.
17. Green DR, Reed JC. Mitochondria and apoptosis. Science 1998; 281(5381): 1309 – 1312.
18. Willis SN, Chen L, Dewson G et al. Proapoptotic Bak is sequestered by Mcl ‑ 1 and Bcl ‑ xL, but not Bcl ‑ 2, until displaced by BH3-only proteins. Genes Dev 2005; 19(11): 1294 – 1305.
19. Wolter KG, Hsu YT, Smith CL et al. Movement of Bax from the cytosol to mitochondria during apoptosis. J Cell Biol 1997; 139(5): 1281 – 1292.
20. Hsu YT, Wolter KG, Youle RJ. Cytosol ‑ to ‑ membrane redistribution of Bax and Bcl ‑ X(L) during apoptosis. Proc Natl Acad Sci USA 1997; 94(8): 3668 – 3672.
21. Lindsten T, Ross AJ, King A et al. The combined functions of proapoptotic Bcl ‑ 2 family members bak and bax are essential for normal development of multiple tissues. Mol Cell 2000; 6(6): 1389 – 1399.
22. Xiang J, Chao DT, Korsmeyer SJ. BAX‑induced cell death may not require interleukin 1b‑convertingenzyme‑like proteases. Proc Natl Acad Sci USA 1996; 93(25): 14559 – 14563.
23. Crompton M. The mitochondrial permeability transition pore and its role in cell death. Biochem J 1999; 341(Pt 2):233 – 249.
24. Kroemer G, Dallaporta B, Resche ‑ Rigon M. The mitochondrial death/ life regulator in apoptosis and necrosis. Annu Rev Physiol 1998; 60 : 619 – 642.
25. Gross A, McDonnell JM, Korsmeyer SJ. BCL ‑ 2 family members and the mitochondria in apoptosis. Genes Dev 1999; 13(15): 1899 – 1911.
26. Lemasters JJ, Nieminen A, Qian T et al. The mitochondrial permeability transition in cell death: a common mechanism in necrosis, apoptosis and autophagy. Biochem Biophys Acta 1998; 1366(1 – 2): 177 – 196.
27. Bernardi P, Scorrano L, Colonna R et al. Mitochondria and cell death: mechanistic aspects and methodological issues. Eur J Biochem 1999; 264(3): 687 – 701.
28. Smiley ST, Reers M, Mottola ‑ Hrtshorn C et al. Intracellular heterogeneity in mitochondrial membrane potentials revealed by a J ‑ aggregate ‑ forming lipophilic cation JC ‑ 1. Proc Natl Acad Sci USA 1991; 88(9): 3671 – 3675.
29. Akerman KE, Wikstrom MK. Safranine as a probe of the mitochondrial membrane potential. FEBS Lett 1976; 68(2): 191 – 197.
30. Nicholls DG. The regulation of extramitochondrial free calcium ion concentration by rat liver mitochondria. Biochem J 1978; 176(2): 463 – 474.
31. LaNoue KF, Strzelecki T, Strzelecka D et al. Regulation of the uncoupling protein in brown adipose tissue. J Biol Chem 1986; 261(1): 298 – 305.
32. Emanus RK, Grunwald R, Lemasters JJ. Rhodamine 123 as a probe of transmembrane potential in isolated rat‑liver mitochondria: spectral and metabolic properties. Biochem Biophys Acta 1986; 850(3): 436 – 448.
33. Loew LM, Tuft RA, Carrington W et al. Imaging in five dimensions: time ‑ dependent membrane potentials in individual mitochondria. Biophys J 1993; 65(6): 2396 – 2407.
34. Ehrenberg B, Montana V, Wei MD et al. Membrane potential can be determined in individual cells from the Nernstian distribution of cationic dyes. Biophys J 1988; 53(5): 785 – 794.
35. Cossarizza A, Baccarani ‑ Contri M, Kalashnikova G et al.A new method for the cytofluorimetric analysis of mitochondrial membrane potential using the J ‑ aggregate forming lipophilic cation 5,5‘,6,6‘ - tetrachloro‑1,1‘,3,3‘ - tetraethylbenzimidazolcarbocyanine iodide (JC ‑ 1). Biochem Biophys Res Commun 1993; 197(1): 40 – 45.
36. Shen K, Ji L, Chen Y et al. Influence of glutathione levels and activity of glutathione‑related enzymes in the brains of tumor ‑ bearing mice. Bioscience trends 2011; 5(1): 30 – 37.
37. Schafer FQ, Buettner GR. Redox environment of the cell as viewed through the redox state of the glutathione disulfide/ glutathione couple. Free Radical Biol Med 2001; 30(11): 1191 – 1212.
38. Polidori MC, Stahl W, Eichler O et al. Profiles of antioxidants in human plasma. Free Radical Biol Med 2001; 30(5): 456 – 462.
39. Dudzinski DM, Michel T. Life history of eNOS: partners and pathways. Cardiovasc Res 2007; 75(2): 247 – 260.
40. Jian Liu K, Rosenberg GA. Matrix metalloproteinases and free radicals in cerebral ischemia. Free Radical Biol Med 2005; 39(1): 71 – 80.
41. Griendling KK, Sorescu D, Lasseue B et al. Modulation of protein kinase activity and gene expression by reactive oxygen species and their role in vascular physiology and pathophysiology. Arterioscler Thromb Vasc Biol 2000; 20(10): 2175 – 2183.
42. Cuzzocrea S, Riley DP, Caputi AP et al. Antioxidant therapy: a new pharmacological approach in shock, inflammation, and ischemia/ reperfusion injury. Pharmacol Rev 2001; 53(1): 135 – 159.
43. Mahelkova G, Korynta J, Moravova A et al. Changes of extracellular matrix of rat cornea after exposure to hypoxia. Physiol Res 2008; 57(1): 73 – 80.
44. Singh S, Gupta AK. Nitric oxide: role in tumour biology and iNOS/ NO based anticancer therapies. Cancer Chemother Pharmacol 2011; 67(6): 1211 – 1224. doi: 10.1007/ s00280 - 011 - 1654 - 4.
45. Wright DT, Cohn LA, Li H et al. Interactions of oxygen radicals with airway epithelium. Environ Health Perspects 1994; 102 (Suppl 10): 85 – 90.
46. Madamanchi NR, Runge MS. Mitochondrial dysfunction in atherosclerosis. Circ Res 2007; 100(4): 460 – 473.
47. Cadenas E, Davies KJ. Mitochondrial free radical generation, oxidative stress, and aging. Free Radic Biol Med 2000; 29(3 – 4): 222 – 230.
48. St ‑ Pierre J, Drori S, Uldry M et al. Suppression of reactive oxygen species and neurodegeneration by the PGC ‑ 1 transcriptional coactivators. Cell 2006; 127(2): 397 – 408.
49. Barbour JA, Turner N. Mitochondrial stress signaling promotes cellular adaptations. Int J Cell Biol 2014; 2014 : 156020.
50. Okamoto K, Kondo ‑ Okamoto N. Mitochondria and autophagy: critical interplay between the two homeostats. Biochim Biophys Acta 2012; 1820(5): 595 – 600. doi: 10.1016/ j.bbagen.2011.08.001.
51. Pangare M, Makino A. Mitochondrial function in vascular endothelial cell in diabetes. J Smooth Muscle Res 2012; 48(1): 1 – 26.
52. Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science 2009; 324(5930): 1029 – 1033. doi: 10.1126/ science.1160809.
53. Koppenol WH, Bounds PL, Dang CV. Otto Warburg‘scontributions to current concepts of cancer metabolism. Nat Rev Cancer 2011; 11(5): 325 – 337. doi: 10.1038/ nrc3038.
54. Wellen KE, Thompson CB. Cellular metabolic stress: considering how cells respond to nutrient excess. Mol Cell 2010; 40(2): 323 – 332. doi: 10.1016/ j.molcel.2010.10.004.
55. Christofk HR, Vander Heiden MG, Harris MH et al. The M2 splice isoform of pyruvate kinase is important for cancer metabolism and tumour growth. Nature 2008; 452(7184): 230 – 233. doi: 10.1038/ nature06734.
56. Anastasiou D, Poulogiannis G, Asara JM et al. Inhibition of pyruvate kinase M2 by reactive oxygen species contributes to cellular antioxidant responses. Science 2011; 334(6060): 1278 – 1283. doi: 10.1126/ science.1211485.
57. Hamanaka RB, Chandel NS. Cell biology. Warburg effect and redox balance. Science 2011; 334(6060): 1219 – 1220. doi: 10.1126/ science.1215637.
58. Zmijewski JW, Moellering DR, Le Goffe C et al. Oxidized LDL induces mitochondrially associated reactive oxygen/ nitrogen species formation in endothelial cells. Am J Physiol Heart Circ Physiol 2005; 289(2): H852 – H861.
59. Landar A, Zmijewski JW, Dickinson DA et al. Interaction of electrophilic lipid oxidation products with mitochondria in endothelial cells and formation of reactive oxygen species. Am J Physiol Heart Circ Physiol 2006; 290(5): H1777 – H1787.
60. Choi H, Kim S, Mukhopadhyay P et al. Structural basis of the redox switch in the OxyR transcription factor. Cell 2001; 105(1): 103 – 113.
61. Mukhopadhyay P, Rajesh M, Hasko G et al. Simultaneous detection of apoptosis and mitochondrial superoxide production in live cells by flow cytometry and confocal microscopy. Nat Protoc 2007; 2(9): 2295 – 2301.
62. Dickinson BC, Chang CJ. A targetable fluorescent probe for imaging hydrogen peroxide in the mitochondria of living cells. J Am Chem Soc 2008; 130(30): 9638 – 9639. doi: 10.1021/ ja802355u.
63. Koide Y, Urano Y, Kenmoku S et al. Design and synthesis of fluorescent probes for selective detection of highly reactive oxygen species in mitochondria of living cells. J Am Chem Soc 2007; 129(34): 10324 – 10325.
64. Houston MA, Augenlicht LH, Heerdt BG. Intrinsic mitochondrial membrane potential and associated tumor phenotype are independent of MUC1 over ‑ expression. PloS One 2011; 6(9): e25207. doi: 10.1371/ journal.pone.0025207.
65. Tait SW, Green DR. Mitochondria and cell signalling. J Cell Sci 2012; 125(Pt 4): 807 – 815. doi: 10.1242/ jcs.099234.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2014 Číslo Supplementum- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Nejasný stín na plicích – kazuistika
-
Všechny články tohoto čísla
- Analýza proteinů pomocí hmotnostní spektrometrie
- p‑ SRM, SWATH a HRM – cílené proteomické přístupy na hmotnostním spektrometru TripleTOF 5600+ a jejich aplikace v onkologickém výzkumu
- Analýza fosfoproteínov a signálnych dráh kvantitatívno‑ proteomickými metódami
- Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
- Současné trendy ve využívání PET radiofarmak k onkologické diagnostice
- „Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
- Vitamin D jako významný steroidní hormon u karcinomu prsu
- Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
- Soutěž o nejlepší práci
- Metody studia buněčné migrace a invazivity nádorových buněk
- Možnosti studia transendoteliální migrace in vitro
- Editorial
- Mechanizmy lékové rezistence a nádorové kmenové buňky
- Funkční testy pro detekci nádorových kmenových buněk
- Mikroprostředí nádoru – možnosti výzkumu v podmínkách in vitro
- Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
- Programovaná buněčná smrt v nádorových buňkách
- Metody pro studium protein‑proteinových a protein‑ligandových interakcí
- Detekce protein‑proteinových interakcí metodami FRET a BRET
- Detekce proteinů, proteinových interakcí a modifikací s využitím „proximity ligation assay“ in situ
- Exprese a purifikace proteinů
- Kvantitativní hmotnostní spektrometrie a její využití v onkologii
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Exprese a purifikace proteinů
- Metody studia buněčné migrace a invazivity nádorových buněk
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Analýza proteinů pomocí hmotnostní spektrometrie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



