-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vitamin D jako významný steroidní hormon u karcinomu prsu
Vitamin D as an Important Steroid Hormone in Breast Cancer
Vitamin D is the third steroid hormone playing important biological roles in the development of breast cancer. Decreased plasma levels of its 25 - hydroxyderivative, 25‑OHD, display robust associations with higher incidence of breast cancer and shorter overall survival. Although no consensus exists, most authors agree that optimal plasma levels shall be within 75 – 150 nmol/ l whereas levels higher than 375 nmol/ l can be potentially toxic with higher risk of hypercalcemia. To date, no data are available on the optimal levels of vitamin D related to the risk of breast cancer development, its phenotype features and the course of the disease. Published studies mostly describe associations among higher levels of 25‑OHD and lower biologically aggressiveness of the tumor. The polymorphism of VDR gene coding for the steroid receptor for vitamin Dmay be associated with higher disease incidence and also be of negative prognostic significance in breast cancer. This review presents an overall summary of the current knowledge and publications on vitamin D and breast cancer.
Key words:
vitamin D – 25 - hydroxyvitamin D – vitamin D receptor – breast cancer
This work was supported by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/2.1.00/03.0101) and by MH CZ – DRO (MMCI, 00209805) and BBMRI_CZ (LM2010004).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
29. 1. 2014Accepted:
5. 5. 2014
Autoři: R. Obermannová 1; R. Demlová 2,3; K. Drábová 4; K. Melichárková 4; K. Greplová 3; M. Mrkvicová 3; L. Zdražilová Dubská 3; R. Vyzula 1,3; D. Valík 3
Působiště autorů: Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno 1; Farmakologický ústav, LF MU, Brno 2; Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 3; Klinika dětské onkologie LF MU a FN Brno 4
Vyšlo v časopise: Klin Onkol 2014; 27(Supplementum): 143-149
Souhrn
Vitamin D je vedle estrogenu a progesteronu třetí steroidní hormon, který plní významné biologické funkce při vývoji karcinomu prsu. Snížené plazmatické hladiny jeho hydroxyderivátu 25 - OHD jsou robustně asociovány s vyšší incidencí karcinomu prsu a kratším celkovým přežitím. Ačkoliv neexistuje všeobecný konsenzus, většina autorů udává optimální hladinu 25‑OHD přibližně 75 – 150 nmol/ l (30 ng/ ml) a hladiny nad 375 nmol/ l (150 ng/ ml) jako potenciálně toxické, spojené se zvýšeným rizikem hyperkalcemie. Dosud však nejsou k dispozici data o optimální hladině vitaminu D ve vztahu k riziku vzniku karcinomu prsu, jeho fenotypovým vlastnostem a celkovému průběhu nádorového onemocnění. Publikované práce uvádějí asociaci mezi vyššími hladinami 25‑OHD a nižší agresivitou nádoru. Biologický efekt vitaminu D je ovšem komplexní děj, je závislý na hladině 25‑OHD, ale i na aktivaci celé signální dráhy včetně receptoru pro vitamin D (VDR). Polymorfizmus v genu VDR kódujícím steroidní receptor pro vitamin Dmůže být spojen s vyšší incidencí nádoru prsu a mít negativní prognostický potenciál. Cílem této práce je podat ucelený přehled o současných poznatcích a dosavadních publikovaných datech týkajících se vztahu vitaminu D ke karcinomu prsu.
Klíčová slova:
vitamin D – 25 - hydroxyvitamin D – vitamin D receptor – karcinom prsuÚvod
Karcinom prsu představuje onemocnění s celosvětově vysokou incidencí. V České republice se jedná o nejčastější zhoubný novotvar u žen a v letech 2005 – 2009 představoval 24,3 % všech nově diagnostikovaných malignit v ženské populaci. Incidence v roce 2010 představuje 66,37 nádorů na 100 000 žen s mortalitou 14,59 nádorů na 100 000 žen [1]. V současnosti neexistují preventivní opatření, která by zásadně ovlivňovala incidenci karcinomu prsu. Ve Spojených státech amerických se podává jako chemoprevence pouze u vysoce rizikových jedinců antiestrogen tamoxifen, případně raloxifen či inhibitory aromatáz [2 – 4], ale vzhledem k jejich výrazným nežádoucím účinkům nelze tuto strategii uplatnit plošně. Efekt těchto látek je navíc omezen pouze na hormonálně senzitivní onemocnění, tedy onemocnění s expresí estrogenových (ER) a progesteronových (PR) receptorů. Je tudíž zjevné, že by bylo potřeba najít jednoduché chemopreventivní agens fungující u všech typů karcinomu prsu [5].
Vitamin D je steroidní hormon hrající významnou roli v metabolizmu kalcia, fosfátů a mineralizaci kostí. Pod pojmem vitamin D rozumíme dva ve vodě nerozpustné sekosteroidy – ergokalciferol (vitamin D2) a cholekalciferol (vitamin D3). Tyto dvě formy se vzájemně liší strukturou postranního řetězce, fyziologické účinky obou látek na lidský organizmus se ale významněji neliší, přičemž hladinu vitaminu v séru více ovlivňuje cholekalciferol. Vitamin D je získáván dvěma cestami: majoritní – přeměnou ze 7 - dehydrocholesterolu v kůži vlivem slunečního záření, a minoritní – příjmem potravou. Na aktivní formu je přeměněn dvojitou hydroxylací, v játrech na 25 - hydroxycholekalciferol (25‑OHD), následně v ledvinách cestou enzymu 1‑alfa hydroxylázy na aktivní formu 1,25 - dihydroxycholekalciferol (1,25(OH)2D3 = vitamin D3).Vitamin D se poté váže na vitamin D receptor (VDR), který je fyziologicky přítomný v mnoha tkáních včetně mléčné žlázy [6]. Jeho exprese byla také prokázána u všech forem karcinomu prsu, jak hormonálně senzitivních (estrogen a progesteron citlivých), tak hormonálně neaktivních. Kromě přímého efektu inhibice buněčného cyklu a indukce apoptózy ovlivňuje vitamin D i produkci estrogenů [7 – 9]. Nedostatek vitaminu D je považován za jeden z rizikových faktorů vzniku a rozvoje nádorových onemocnění včetně karcinomu prsu [10]. První zmínky o vztahu vitaminu D a karcinomu prsu se datují do 90. let 20. století, kdy byly publikovány výsledky ekologických studií. Vyšší incidence nádorového onemocnění souvisela se zeměpisnou šířkou, tedy s nižší expozicí slunečnímu svitu [11 – 17]. Některé velké kohortové studie udávají inverzní vztah mezi perorálním příjmem vitaminu D a rizikem karcinomem prsu [18 – 21]. V roce 2013 byla publikována metaanalýza a systematický přehledový článek hodnotící význam suplementace vitaminem D v redukci rizika karcinomu prsu [22]. Souvislost mezi suplementací vitaminem D a kalciem a redukcí rizika karcinomu prsu nebyla prokázána. Limitací této práce byl soubor pouze postmenopauzálních žen, podávání nízkých preventivních dávek cholekalciferolu a kalcia a hodnocené dvě studie, které jediné splnily kritéria analýzy.
Inverzní vztah mezi hladinou 25‑OHD, prekurzorem aktivního vitaminu D, byl potvrzen jen u případových studií. Výsledky doposud provedených prospektivních studií nejsou konzistentní. Metaanalýza čtyř prospektivních studií z roku 2010 nenalezla signifikantní inverzní vztah mezi hladinou 25‑OHD a rizikem vzniku karcinomu prsu [23], zatímco následná metaanalýza, která zahrnovala další dvě prospektivní studie, inverzní stav potvrdila [24,25]. Cílem tohoto sdělení je podat ucelený přehled aktuálních dat týkajících se vztahu metabolizmu vitaminu D a rozvoje karcinomu prsu.
Biologický efekt vitaminu D
Vitamin D hraje kromě zásadní role v homeostáze vápníku významnou úlohu v řadě biochemických procesů. Signalizaci spouští většinou prostřednictvím receptoru vitaminu D, který náleží do rodiny steroidních nukleárních receptorů. Vazbou vitaminu D na VDR je indukována buněčná diferenciace, inhibována proliferace a regulována apoptóza u normálních i nádorových buněk včetně karcinomu prsu, dále je potlačena angiogeneze a iniciovány imunomodulační účinky cestou ovlivnění monocytů a lymfocytů. Aktivní látka, 1,25 - (OH)2D, působí antikarcinogenně cestou regulace VDR ‑ dependentní transkripce až 200 genů včetně CDKN1A, CDKN1B, c ‑ fos a c ‑ myc [26]. Některé studie prokázaly, že 1,25 - (OH)2D inhibuje syntézu i biologický účinek estrogenů [7 – 9]. Aktivní forma 1,25 - (OH)2D pravděpodobně suprimuje tvorbu estrogenů cestou inhibice genu kódujícího aromatázu, enzymu, který je odpovědný za konverzi androgenu na estrogeny. 1,25 - (OH)2D také potlačuje expresi estrogenového receptoru, jaderného receptoru, který zprostředkovává biologický efekt estrogenu [9]. Oba mechanizmy tak přispívají k inhibici signalizace prostřednictvím estrogenů. Vztah perorálního příjmuvitaminu D a exprese ER a PR hodnotila řada studií s nekonzistentními výsledky [19,20,21,27]. Analoga vitaminu Dinhibují růst nádorů prsu (benigních i maligních) a na estrogenu nezávislým mechanizmem redukují proliferativní efekt insulin‑like growth factor 1 (IGF‑1), jenž je významný mitogen [28]. Na zvířecím modelu byl prokázán potencující vliv vitaminu D na účinek tamoxifenu v rámci terapie karcinomu prsu [29].
Tzv. „negenomový“ efekt vitaminu D(efekt zprostředkovaný membránovými receptory) je rychlý a nezávisí na transkripci, ačkoliv transkripci zkříženě ovlivňuje prostřednictvím jiných signálních drah. Zatím neexistuje jednoznačný názor na to, jak je negenomový efekt zprostředkován. Pravděpodobně je závislý na „neklasickém“ membránovém receptoru (memVDR) a 1‑alfa, 25‑OHD membrane‑associated rapid ‑ response steroid binding protein (1‑alfa,25 - (OH)2D ‑ MARRS). Nejznámější pozitivní negenomový efekt vitaminu D je rychlá absorpce vápníku ze střeva a zvýšení intracelulární hladiny vápníku vznikající vazbou na membránový receptor, následnou aktivací proteinkinázy C (PKC) a rychlým otevřením vápníkových kanálů [30]. Bijlsma et al objevili v roce 2011 další významný negenomový efekt vitaminu D – inhibici sonic ‑ hedgehog (SHH) signální dráhy, která je v případě vlastní dysregulace významným stimulátorem karcinogeneze [31]. Tang et al [32] v roce 2011 potvrdili v in vitro i in vivo studiích, že vitamin D inhibuje proliferaci v buňkách bazocelulárního karcinomu prostřednictvím VDR nezávislého mechanizmu. Cestou Wnt dráhy způsobuje downregulaci SHH dráhy v buňkách bazocelulárního karcinomu.
Jaká je optimální plazmatická hladina 25‑OHD ve vztahu ke karcinomu prsu?
Hydroxylovaný metabolit 25‑OHD představuje zásobní frakci vitaminu D a je vhodným cílem k monitorování zejména pro svoje stabilní hladiny v plazmě a dlouhý eliminační poločas. Plazmatická hladina 25‑OHD je výsledkem hydroxylace neaktivní formy vitaminu D získaného endogenně (konverzí v kůži vlivem slunečního svitu) a exogenně (perorálním příjmem). Hydroxylace probíhá v játrech prostřednictvím enzymu 25-hydroxylázy kódovaným genem CYP27A1. Následná hydroxylace v ledvinách prostřednictvím enzymu 1‑alfa‑hydroxylázy, kódovaným genem CYP27B1, vede k vzniku aktivní formy vitaminu D. Řada tkání včetně tkáně mléčné žlázy i karcinomu prsu je schopna přímé konverze cirkulujícího 25‑OHD na aktivní formu 1,25‑OHD prostřednictvím 1‑alfa‑hydroxylázy [29]. Prakticky to znamená, že jsou tkáně samy schopny autokrinní nebo parakrinní sekrecí enzymu 1‑alfa‑hydroxylázy konvertovat dostupný prekurzor 25‑OHD na aktivní metabolit, a tím modifikovat biologickou dostupnost vitaminu D. Analogicky existuje tkáňová overexprese 24 - hydroxylázy, kódované CYP24A1, klíčového enzymu v katabolizmu aktivních forem vitaminu D, jehož vlivem dochází k degradaci aktivního vitaminu D. Z toho vyplývá, že hladina 25‑OHD nemusí nutně odrážet lokální biologické a patofyziologické efekty. Přesto ale zůstává nejjednodušším prostředkem sledování stavu vitaminu D v těle. Snaha definovat optimální plazmatickou hladinu 25‑OHD obecně v souvislosti s incidencí chronických chorob (kardiovaskulárních, neurologických, endokrinních, ale i nádorových onemocnění), v našem případě s prevencí rizika vzniku karcinomu prsu, byla předmětem řady publikovaných studií. Z dosavadních dat vyplývá, že vyšší hladina je obecně asociována s lepším celkovým zdravím [26] a nižší incidencí chronických chorob.
Hodnota hladiny metabolitu v krvi v závislosti na farmakologické suplementaci vitaminem D je těžko předvídatelná. Závisí na individuální variabilitě, dietě, absorpci, metabolizmu, BMI, expozici slunci atd. Ačkoliv neexistuje všeobecný konsenzus, většina autorů udává optimální hladinu 25‑OHD přibližně 50 – 125 nmol/ l (20 – 50 ng/ ml) a hladiny nad 375 nmol/ l (150 ng/ ml) jako potenciálně toxické, spojené se zvýšeným rizikem hyperkalcemie (tab. 1). Dle Goodwin et al [33] jsou pravděpodobně výhodnější hladiny okolo 75 nmol/ l (30 ng/ ml), ideálně pak 90 – 100 nmol/ l (36 – 40 ng/ ml).
Tab. 1. Kritéria hladiny 25-OHD u zdravých dle NHANES 2011 (National Health and Nutrition Examination Survey). 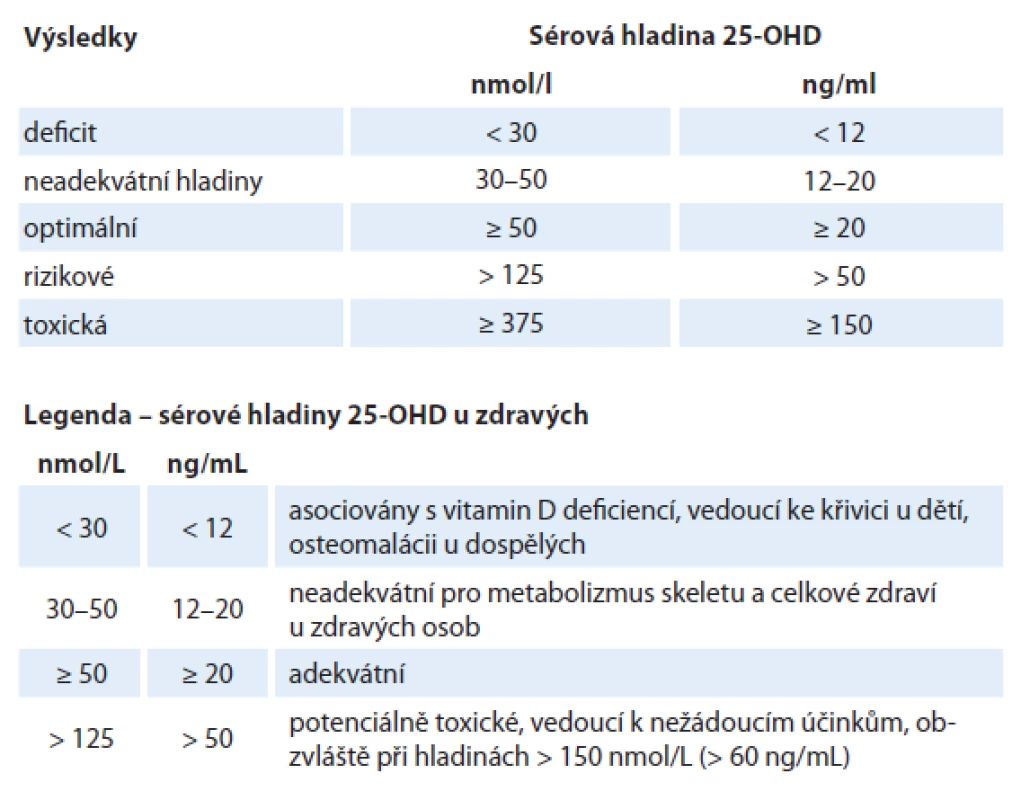
Plazmatické hladiny 25‑OHD v nemoci a předchorobí
Crew et al [34] ve své retrospektivní případové studii porovnali hladiny 25‑OHD u pacientek s karcinomem prsu a zdravé populace. Do analýzy bylo zařazeno 1 508 pacientek, u nichž byl v letech 1996 – 1997 diagnostikován in situ karcinom nebo invazivní karcinom, a 1 556 kontrolních subjektů. Průměrná plazmatická koncentrace 25‑OHD byla naměřena 27,1 nmol/ l (13,0 ng/ ml) u pacientek s karcinomem prsu a 29,7 nmol/ l (15,1 ng/ ml) u zdravých žen (p < 0,0001). Plazmatická hladina 25‑OHD byla inverzně asociována s rizikem karcinomu prsu (OR 0,56; 95% CI 0,41 – 0,78). Ve srovnání s deficitem vitaminu D, (hladinou 25‑OHD < 50 nmol/ l (20 ng/ ml)), byly hladiny > 100 nmol/ l (40 ng/ ml) spojeny s poklesem rizika vzniku karcinomu prsu. Redukce rizika byla větší u postmenopauzálních žen (OR 0,46; 95% CI 0,09 – 0,83) a efekt nebyl závislý na expresi estrogenových a progesteronových receptorů. Hladina 25‑OHD3 ≥ 100 nmol/ l (40 ng/ ml) měla v uvedené studii preventivní vliv na vznik karcinomu prsu. Goodwin et al [33] sledovali mortalitu pacientek s karcinomem prsu v závislosti na hladině vitaminu D. Pacientky (bez suplementace) s hladinou vitaminu D < 50 nmol/ l (20 ng/ ml) v době diagnózy měly 94% pravděpodobnost metastatického onemocnění a 73% pravděpodobnost úmrtí v průběhu 10 let sledování. Pouze 24 % pacientek mělo adekvátní hladinu vitaminu D (> 72 nmol/ l) v době diagnózy. Podle sdružené analýzy prováděné v USA a Velké Británii měly pacientky s hladinou > 125 nmol/ l (50 ng/ ml) o 50 % nižší riziko vzniku nádoru prsu než pacientky s deficiencí 25‑OHD. Denní příjem 1 000 IU vedl k zvýšení hladin 25‑OHD o 25 nmol/ l (10 ng/ ml), optimální denní dávka by mohla být 3 000 – 4 000 IU, tedy vyšší než dávka doporučována Institute of Medicine (IOM). Aplikace denní dávky vitaminu D 4 000 IU po dobu pěti měsíců vedla bez nežádoucích účinků k dosažení požadovaných hladin u 88 % sledovaných osob [35]. V přehledovém článku o klinických datech u zdravých osob byla dokonce uvedena bezpečná denní dávka vitaminu D ≥ 10 000 IU [36].
Podávané vysoké dávky vitaminu Dnemusí být vždy toxické. V jednoramenné studii byla postmenopauzálním pacientkám léčených inhibitory aromatáz podávána dávka vitaminu D50 000 IU týdně [37], ve studii fáze II byla pacientkám s metastatickým karcinomem prsu podávána dávka vitaminu D10 000 IU denně po dobu čtyř měsíců [38]. V rámci ani jedné z nich nebyly zaznamenány projevy toxicity jako hyperkalcemie, hyperkalciurie nebo nefrolithiáza. Přesto zůstává nejasné, zda bude mít substituce vyššími dávkami vitaminu D protektivní vliv na redukci rizika vzniku karcinomu prsu u vysoce rizikových premenopauzálních pacientek. Dodnes nebyla publikována prospektivní studie, která by hodnotila význam substituce v průběhu léčby onkologického onemocnění, a většina doposud publikovaných prací vycházela pouze z prediagnostických hladin vitaminu D.
Stadium onemocnění, grade, hormonální léčba a hladina 25‑OHD
Vitamin D by mohl být užitečnou a levnou součástí léčby pacientek s karcinomem prsu. Neuhouser et al [28] provedli analýzu hladin vitaminu D u populace pacientek s historií karcinomu prsu. U 75,6 % z nich konstatovali insuficienci až deficit 25‑OHD a průměrná hladina byla stanovena na 24,8 ± 10,4 ng/ ml. Nižší hladiny byly nalezeny u afrického a hispánského etnika. Studie hodnotila věk, BMI, etnikum, geografii, sezónní vliv, fyzickou aktivitu, terapii karcinomu prsu a podání tamoxifenu. Po eliminaci všech demografických variabilit a rozdílů vyplývajících ze životního stylu zůstalo stadium onemocnění signifikantním prediktorem nižších hladin 25‑OHD. Ženy s lokalizovaným či lokálně pokročilým onemocněním vykazovaly nižší hladinu 25‑OHD než ty s karcinomem in situ.
Autoři dále studovali efekt tamoxifenu v souvislosti s hladinou 25‑OHD. Historicky pouze jedna práce na zvířecím modelu prokázala vztah vitaminu D a tamoxifenu [29]. Kombinace byla 10 – 100krát efektivnější než monoterapie analogem vitaminu D. Přidáním vitaminu D došlo k navýšení efektu tamoxifenu (současně k redukci dávky a tím poklesu nežádoucích účinků tamoxifenu). V Neuhouserově práci byly u pacientek léčených tamoxifenem naměřeny vyšší hladiny 25‑OHD, tamoxifen byl tedy signifikantní prediktor hladiny 25‑OHD. Vztah k hormonálním receptorům bohužel nelze hodnotit, neboť nebyly vyšetřeny u jedné třetiny zařazených pacientek.
V kanadské studii Goodwina et al [33] naměřili deficitní či insuficientní vstupní hladinu 25‑OHD u 76 % pacientek s karcinomem prsu. Prokázali inverzní vztah mezi hladinou 25‑OHD a BMI, markery inzulinové rezistence (inzulin, C ‑ peptid), přičemž hladiny 25‑OHD byly signifikantně nižší u pacientek s high‑grade tumory. Dále prokázali statisticky významnou souvislost mezi deficitní hladinou vitaminu D a dobou do progrese (disease‑free survival – DFS) a kratším celkovým přežitím (overall survival – OS) (10letý DFS 69 vs 83 % (deficitní vs dostatečné hladiny), 10letý OS 74 vs 85 %). Výsledek nebyl ovlivněn věkem, velikostí tumoru, gradem, stavem estrogenových a progesteronových receptorů adjuvantní chemoterapií, hormonoterapií ani ročním obdobím.
Stejně tak autoři německé studie z roku 2007 [39] uvádějí signifikantní inverzní vztah mezi hladinou 25‑OHD a rizikem vzniku karcinomu prsu u postmenopauzálních žen, přičemž hormonální substituční léčbu a počet těhotenství shledali jako modifikátory shora uvedeného vztahu. Ženy, které podstoupily hormonální substituční léčbu, a ženy s vyšším počtem těhotenství měly vyšší hladiny 25‑OHD a nižší riziko vzniku karcinomu prsu, což pravděpodobně vysvětluje nižší expozice estrogenům.
Plazmatická hladina 25‑OHD a fenotyp karcinomu prsu
Plazmatická hladina vitaminu D je nyní studována v souvislosti s fenotypovými vlastnostmi karcinomu prsu: luminal A, luminal B, HER2+ ER – , triple ‑ negativní (basal‑like). Již na buněčných kulturách odvozených od karcinomu prsu byla in vitro prokázána fenotypová souvislost s hladinou vitaminu D. Nízké hladiny vitaminu D jsou asociovány s progresí více agresivního fenotypu (triple ‑ negativního) [40]. Rainville et al sledovali hladinu 25‑OHD v souvislosti s fenotypem karcinomu prsu (luminal A, luminal B, HER2+ ER – , triple ‑ negativní) [41]. U triple ‑ negativního fenotypu detekovali nejnižší hladiny 25‑OHD a také nejvyšší procento pacientek s deficitem. Pro zajímavost uvádíme hladiny 25‑OHD – zdraví dobrovolníci 90 ± 40 nmol/ l, pacientky s karcinomem prsu 76 ± 50 nmol/ l, luminal A 79 ± 50 nmol/ l, luminal B 75 ± 30 nmol/ l, HER2+ ER – 93 ± 30 nmol/ l, triple ‑ negativní 50 ± 20 nmol/ l. Ve skupině pacientek s karcinomem prsu byla naměřena signifikantně nižší hladina 25‑OHD (p < 0,015), ale nebyl nalezen signifikantní rozdíl v rámci stadia onemocnění. Hladina 25‑OHD u triple ‑ negativního karcinomu prsu byla také statisticky významně nižší oproti skupině zdravých dobrovolníků. Hladina vitaminu D má pravděpodobně významný vliv na nádorový růst, fenotypové vlastnosti a biologické chování karcinomu prsu. Tuto hypotézu podporují i data zjištěná u populace Afroameričanek, tzn. vyšší mortalitu v souvislosti s karcinomem prsu, nižší hladinou 25‑OHD a vysokou incidenci agresivního triple ‑ negativního nebo basal‑like fenotypu (39 %) [41,42].
Laporta et al na zvířecím modelu (potkan) triple ‑ negativního karcinomu prsu testovali význam VDR pro 1,25 - (OH)D zprostředkovanou protinádorovou antiproliferativní aktivitu [43]. Model potvrdil hypotézu, že 1,25 - (OH)2D cestou VDR koordinovaně suprimuje proteiny, jež jsou zásadní k přežití triple ‑ negativních, basal‑like, nádorových buněk karcinomu prsu.
VDR genový polymorfizmus a karcinom prsu
Vitamin D receptor (VDR) je nukleární steroidní receptor, který po navázání ligandu 1,25‑OHD ovlivňuje genovou expresi. VDR je exprimován téměř ve všech tkáních a orgánech lidského těla a signalizace prostřednictvím VDR vede k transkripci řady genů (až 3 % lidského genomu), jež kontrolují buněčný cyklus, ovlivňují apoptózu a metastatický potenciál. Je přítomný v normální mléčné žláze, kde funguje jako protipól estrogeny řízené proliferace a podporuje diferenciaci. Dosavadní publikovaná data ukazují, že vitamin D i polymorfizmus VDR pravděpodobně ovlivňují riziko vzniku karcinomu prsu [44]. Řada klinických studií je věnována polymorfizmu VDR a dosud bylo popsáno více než 470 variant VDR. VDR polymorfizmus je spojen s vyšší incidencí nádorového onemocnění a má negativní prognostický vliv, ačkoliv výsledky studií jsou často rozporuplné. Köstner et al [45] analyzovali relevanci genového polymorfizmu VDR v rámci studia maligních onemocnění. Byla prokázána signifikantní souvislost mezi polymorfizmy VDR (označované jako FokI, BsmI, TaqI, ApaI, poly (A))a vznikem karcinomu prsu. Riziko vzniku karcinomu prsu bylo asociováno s polymorfizmy BsmI, FokI, zatímco prognóza onemocnění souvisela spíše s genovými variantami BsmI a TaqI. V rámci uvedené práce byla provedena metaanalýza 21 studií hodnotících polymorfizmy FokI, BsmI, ApaI a TaqI. FokI polymorfizmus byl spojen se signifikantně zvýšeným rizikem karcinomu prsu. V subanalýze byla signifikantní asociace evidentní v případě FokI polymorfizmu v evropské populaci, naopak u BsmI, ApaI and TaqI nebyla souvislost se vznikem karcinomu prsu signifikantní. FokI polymorfizmus by tak mohl být citlivým biomarkerem rizika vzniku karcinomu prsu, zvláště pak v evropské populaci [45,46].
Ke stejnému závěru pak dospěli i Sinnotte et al [47], studující asociaci polymorfizmu VDR, konkrétně FokI a BsmI, v rámci dvou nezávislých studií na stejné populaci pacientek, navíc hodnotili souvislost s rodinnou anamnézou. V obou studiích i v kombinovaném rameni byla pozorována signifikantní interakce mezi FokI a negativní rodinnou anamnézou (tab. 2). BsmI Bb + bb (heterozygot + recesivní homozygot) varianty byly asociovány s nesignifikantním zvýšením rizika napříč studovanými skupinami bez ohledu na rodinnou anamnézu. Z výsledků vyplývá, že vitamin D jako biologický regulátor pravděpodobně ovlivňuje riziko vzniku karcinomu prsu. Variabilita výsledků u polymorfizmu FokI v rámci více publikovaných dat je pravděpodobně dána proporcionálním zastoupením pacientek s rozdílnou rodinnou anamnézou [45]. Wang et al [48] potvrdili v kavkazské populaci roli TaqI polymorfizmu v riziku vzniku karcinomu prsu. Tato hypotéza nebyla potvrzena u asijské populace. Stejní autoři publikovali negativní výsledky v rámci metaanalýzy v případě polymorfizmu ApaI.
Tab. 2. Souvislost mezi VDR polymorfizmem a rizikem vzniku karcinomu prsu. 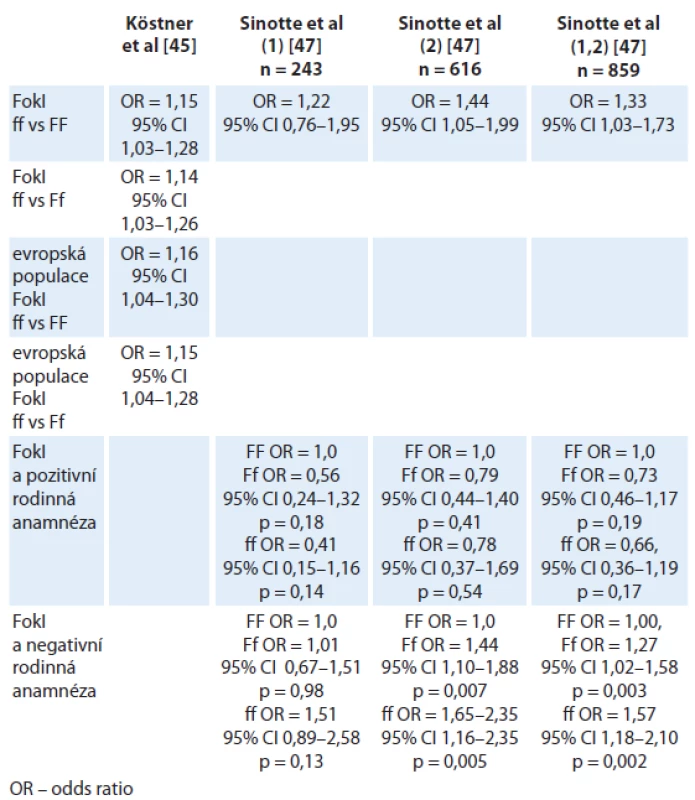
Je současná doporučená dávka vitaminu D dostatečná k prevenci rizika karcinomu prsu?
Současná doporučení v České republice se týkají suplementace optimální v metabolizmu kalcia a terapii osteoporózy. Doporučená dávka v této indikaci je 800 IU/ den, jde tedy o řádově nižší dávku, než je dávka uvedená. Crew et al [34] srovnávali hladinu 25‑OHD u skupiny premenopauzálních pacientek léčených adjuvantní chemoterapií za současné suplementace kalciem (1 000 mg/ den) a vitaminem D3 (400 IU/ den). Před zahájením terapie pouze 6 % pacientek vykazovalo dostatečnou hladinu 25‑OHD ≥ 75 nmol/ l (30 ng/ ml) a po roce suplementace vzrostl tento podíl na 11 %. 74 % pacientek mělo hladiny 25‑OHD v pásmu deficience, tento podíl klesl po roce terapie na 60 %. Ve skupině s neadekvátní hladinou < 30 nmol/ l (12 ng/ ml) se podíl po roční terapii snížil z původních 11 % na 7 %. Na základě dosažených výsledků konstatovali skutečnost, že současná suplementace vitaminem D optimální pro kostní metabolizmus není dostatečná k redukci rizika recidivy karcinomu prsu.
Metaanalýza 18 randomizovaných klinických studií, jejichž cílem bylo zhodnocení incidence fraktur s dávkou k substituci od 300 – 2 000 IU zahrnující 57 000 účastníků, prokázala redukci mortality o 7 % ve skupině léčených vitaminem D [49]. Jiná data – analýzy dvou randomizovaných placebem kontrolovaných studií – tuto skutečnost nepotvrdila. Problém uvedených dat je, že ve srovnávacím rameni byla dovolena substituce kalciem i vitaminem D [50,51].
Aktuální studie
Současně probíhající studie jsou zaměřeny na preventivní podávání derivátů vitaminu D s cílem zhodnocení rizika nejen nádorových, ale i jiných chronických chorob. Bohužel žádná z plánovaných studií neanalyzuje vstupní hladinu 25‑OHD ani neplánuje substituci dle monitorování hladiny 25‑OHD. Navíc je u všech účastníků povolena substituce běžná k prevenci osteoporózy, což metodologicky ztíží interpretaci výsledků. Z plánovaných studií uvádíme americkou studii VITAL (n = 20 000) se zaměřením na kardiovaskulární a nádorové choroby s dávkou vitaminu D 2 000 IU/ den. Výsledky budou k dispozici v roce 2017. Finská studie FIND (n = 18 000) s dávkou 1 600 IU/ den pro muže a 3 200 IU/ den pro ženy zahájená v roce 2013 a cílená na stejné spektrum pacientů včetně diagnózy cukrovky přinese výsledky v roce 2020. Britská studie VIDAL (n = 20 000) je zaměřena na hodnocení vztahu vitaminu D a dlouhověkosti při substituci dávkou 2 000 IU/ den. Její výsledy můžeme očekávat v roce 2017. Studie fáze II (NCT01097278) hodnotí význam suplementace vysokými dávkami vitaminu D u premenopauzálních pacientek s high-risk karcinomem prsu a její výsledky jsou předpokládány v roce 2015.
Z aktivních studií u diagnózy karcinomu prsu jmenujme studii fáze III VITACAL, která srovnává konvenční dávkovou suplementaci s vysokými dávkami vitaminu D3 (aplikovanými dle vstupních hladin 25‑OHD) v průběhu neoadjuvantní a adjuvantní chemoterapie u pacientek s karcinomem prsu (NCT01480869). Studie fáze II ICARUS sleduje klinický efekt a odpověď v biomarkerech u pacientek s karcinomem prsu, u nichž probíhá suplementace vitaminem D 40 000 IU/ den v průběhu časového intervalu mezi stanovením diagnózy a operací (NCT01948128).
Závěr
Ačkoliv počet publikací věnovaných karcinomu prsu a vitaminu D vzrostl v průběhu posledního desetiletí přibližně 7krát, neexistuje konsenzus, který by vedl k doporučení dávky do běžné klinické praxe ve směru k prevenci či i doplňkové terapii maligních chorob. Z uvedených prací jednoznačně vyplývá souvislost mezi dlouhodobými nedostatečnými hladinami vitaminu D a rizikem karcinomu prsu, stejně tak kratší doba progrese i celkového přežití pacientek s již manifestovaným karcinomem prsu. Vitamin D se jeví vedle estrogenu a progesteronu třetím významným steroidním hormonem, který má vliv na rozvoj a průběh karcinomu prsu. Vzhledem k interindividuální variabilitě dané pravděpodobně i genovým polymorfizmem VDR, metabolizmem, etnickým rozdílům i geografickým okolnostem je v rámci suplementace stále striktně doporučováno řídit se hladinou 25‑OHD. Z hlediska chronobiologie vitaminu D je vhodné období ke stanovení hladiny vitaminu D konec zimních měsíců (březen), kdy jsou hladiny 25‑OHD nejnižší; naopak v září je v naší zeměpisné šířce průměrná plazmatická hladina nejvyšší. Ve světle současných poznatků je optimální hladina 75 – 150 nmol/ l (30 – 60 ng/ ml). K jejímu dosažení je ideální týdenní dávka 20 000 – 30 000 IU. Na našem pilotním souboru pacientů s karcinomem prsu a kolorektálním karcinomem léčených první linií paliativní chemoterapie vedla aplikace těchto dávek k bezpečnému vzestupu na cílovou hladinu 90 – 115 nmol/ l při monitorování hladin 1krát za dva měsíce. S ohledem na nízkou expozici slunečnímu svitu v naší zeměpisné šířce je vhodné hladiny monitorovat v průběhu zimních a časných jarních měsíců. Další krok při sledování prognózy pacientů léčených pro diseminované nádorové onemocnění se současnou suplementací vitaminem D dle hladin 25‑OHD je stanovení souvislosti s genovým polymorfizmem typu FokI, BsmI, dále souvislosti s expresí ER a PR, HER2. Dosavadní data neprokázala vztah závislosti efektu vitaminu D na expresi ER a PR, což umožňuje jeho neselektivní použití u všech skupin karcinomu prsu. Z preklinických i klinických dat se jeví nadějně substituce vitaminem D u prognosticky nejméně příznivého fenotypu triple ‑ negativního karcinomu prsu.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101) a MZ ČR – RVO (MOÚ, 00209805) a BBMRI_CZ (LM2010004).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
MUDr. Radka Obermannová
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: obermannova@mou.cz
Obdrženo: 29. 1. 2014
Přijato: 5. 5. 2014
Zdroje
1. Svod.cz [internetová stránka]. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice [online]. Masarykova univerzita, Česká republika; c2005, [citováno 5. února 2014]. Dostupný z: http:/ / www.svod.cz.
2. Fisher B, Costantino JP, Wickerham DL et al. Tamoxifen for prevention of breast cancer: report of the national surgical adjuvant breast and bowel project P ‑ 1 study. J Natl Cancer Inst 1998; 90(18): 1371 – 1388.
3. Vogel VG, Costantino JP, Wickerham DL et al. Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes: The NSABP study of tamoxifen and raloxifene (STAR) P ‑ 2 trial. JAMA 2006; 295(23): 2727 – 2741.
4. Goss PE, Ingle JN, Alés ‑ Martínez JE et al. Exemestane for breast ‑ cancer prevention in postmenopausal women. N Engl J Med 2011; 364(25): 2381 – 2391. doi: 10.1056/ NEJMoa1103507.
5. Crew KD. Vitamin D: are we ready to supplement for breast cancer prevention and treatment? ISRN Oncol 2013; 2013 : 483687. doi: 10.1155/ 2013/ 483687.
6. Holick MF. Vitamin D deficiency. N Engl J Med 2007; 357(3): 266 – 281.
7. Krishnan AV, Swami S, Peng L et al. Tissue selective regulation of aromatase expression by calcitriol: implications for breast cancer therapy. Endocrinology 2010; 151(1): 32 – 42.
8. James SY, Mackay AG, Binderup L et al. Effects of a new synthetic vitamin D analogue, EB1089, on the oestrogen ‑ responsive growth of human breast cancer cells. J Endocrinol 1994; 141(3): 555 – 563.
9. Stoica A, Saceda M, Fakhro A et al. Regulation of estrogen receptor‑alpha gene expression by 1,25 - dihydroxyvitamin D in MCF ‑ 7 cells. J Cell Biochem 1999; 75(4): 640 – 651.
10. Garland FC, Garland CF, Gorham ED et al. Geographic variation in breast cancer mortality in the United States: a hypothesis involving exposure to solar radiation. Prev Med 1990; 19(6): 614 – 622.
11. Apperley FL. The relation of solar radiation to cancer mortality in North America. Cancer Res 1941; 1 : 191 – 195.
12. Studzinski GP, Moore DC. Sunlight – can it prevent as well as cause cancer? Cancer Res 1995; 55(18): 4014 – 4022.
13. Gorham ED, Garland FC, Garland CF. Sunlight and breast cancer incidence in the USSR. Int J Epidemiol 1990; 19(4): 820 – 824.
14. Blot WJ, Fraumeni JF Jr, Stone BJ. Geographic patterns of breast cancer in the United States. J Natl Cancer Inst 1977; 59(5): 1407 – 1411.
15. Chen W, Clements M, Rahman B et al. Relationship between cancer mortality/ incidence and ambient ultraviolet B irradiance in China. Cancer Causes Control 2010; 21(10): 1701 – 1709. doi: 10.1007/ s10552 - 010 - 9599 - 1.
16. Ross C, Taylor CL, Yaktine AL, Del Valle HB (eds). Dietary reference intakes for calcium and vitamin D [monograph on the Internet]. Washington: National Academies Press (US); 2011 [cited 2014 February]. Available from: http:/ / www.ncbi.nlm.nih.gov/ books/ NBK56070/ .
17. Eitenmiller RR, Ye L, Landen WO Jr (eds). Vitamin analysis for the health and food sciences. 2nd ed. Boca Raton, FL, USA: CRC Press 2008.
18. Shin MH, Holmes MD, Hankinson SE et al. Intake of dairy products, calcium and vitamin D and risk of breast cancer. J Natl Cancer Inst 2002; 94(17): 1301 – 1311.
19. Lin J, Manson JE, Lee IM et al. Intakes of calcium and vitamin D and breast cancer risk in women. Arch Intern Med 2007; 167(10): 1050 – 1059.
20. McCullough ML, Rodriguez C, Diver WR et al. Dairy, calcium and vitamin d intake and postmenopausal breast cancer risk in the cancer prevention study II nutrition cohort. Cancer Epidemiol Biomarkers Prev 2005; 14(12): 2898 – 2904.
21. Robien K, Cutler GJ, Lazovich D. Vitamin D intake and breast cancer risk in postmenopausal women: the Iowa women’s health study. Cancer Causes Control 2007; 18(7): 775 – 782.
22. Sperati F, Vici P, Maugeri ‑ Saccà M et al. Vitamin D supplementation and breast cancer prevention: a systematic review and meta‑analysis of randomized clinical trials. PLoS One 2013; 8(7): e69269. doi: 10.1371/ journal.pone.0069269.
23. Mohr SB, Gorham E, Alcaraz JE et al. Serum 25 - hydroxyvitamin D and prevention of breast cancer: pooled analysis. Anticancer Res 2011; 31(9): 2939 – 2948.
24. Fedirko V, Torres ‑ Mejía G, Ortega ‑ Olvera C et al. Serum 25 - hydroxyvitamin D and risk of breast cancer: results of a large population‑based case ‑ control study in Mexican women. Cancer Causes Control 2012; 23(7): 1149 – 1162. doi: 10.1007/ s10552 - 012 - 9984 - z.
25. Yin L, Grandi N, Raum E et al. Meta‑analysis: serum vitamin D and breast cancer risk. Eur J Cancer 2010; 46(12): 2196 – 2205. doi: 10.1016/ j.ejca.2010.03.037.
26. Drábová K, Bienertová ‑ Vašků J, Lokaj P et al. Vitamin D – jeho fyziologie, patofyziologie a význam v etiopatogenezi nádorových onemocnění. Čas Lék Čes 2013; 152(1): 20 – 30.
27. Blackmore KM, Lesosky M, Barnett H et al. Vitamin D from dietary intake and sunlight exposure and the risk of hormone ‑ receptoe ‑ defined breast cancer. Am J Epidemiol 2008; 168(8): 915 – 924. doi: 10.1093/ aje/ kwn198.
28. Neuhouser ML, Sorensen B, Hollis BW et al. Vitamin insufficiency in a multiethnic cohort of brest cancer survivors. Am J Clin Nutr 2008; 88(1): 133 – 139.
29. Anzano MA, Smith JM, Uskokovic MR et al. 1‑alpha,25 - dihydroxy ‑ 16 - ene ‑ 23-yne ‑ 26,27 - hexafluorocholecalciferol, a new delanoid (vitamin D analog) for prevention of brest cancer in the rat. Cancer Res 1994; 54(7): 1653 – 1656.
30. Deeb K, Trump DL, Johnson CS. Vitamin D signalling pathways in cancer: potential for anticancer therapeutics. Nature Rev Cancer 2007; 7(9): 684 – 700.
31. Bijlsma MF, Spek CA, Zivkovic D et al. Repression of smoothened by patched ‑ dependent (pro‑)vitaminD3 secretion. PLoS Biol 2006; 4(8): e232.
32. Tang JY, Xiao TZ, Oda Y et al. Vitamin D3 inhibits hedgehog signaling and proliferation in murine Basal cell carcinomas. Cancer Prev Res (Phila) 2011; 4(5): 744 – 751.
33. Goodwin PJ, Ennis M, Pritchard KI et al. Vitamin D deficiency is common at breast cancer diagnosis and is associated with significantly higher risk of distant recurrence and death in a prospective cohort study of T1 - 3, N0 - 1, M0 breast cancer. J Clin Oncol 2008; 26 (Suppl): 9.
34. Crew KD, Gammon MD, Steck SE et al. Association between plasma 25 - hydroxyvitamin D and breast cancer risk. Cancer Prev Res (Phila) 2009; 2(6): 598 – 604. doi: 10.1158/ 1940 - 6207.CAPR ‑ 08 - 0138.
35. Vieth R, Chan PC, MacFarlane GD. Efficacy and safety of vitamin D3 intake exceeding the lowest observed adverse effect level. Am J Clin Nutr 2001; 73(2): 288 – 294.
36. Hathcock JN, Shao A, Vieth R et al. Risk assessment for vitamin D. Am J Clin Nutr 2007; 85(1): 6 – 18.
37. Khan QJ, Reddy PS, Kimler BF et al. Effect of vitamin D supplementation on serum 25 - hydroxy vitamin D levels, joint pain, and fatigue in women starting adjuvant letrozole treatment for breast cancer. Breast Cancer Res Treat 2010; 119(11): 111 – 118. doi: 10.1007/ s10549 - 009 - 0495 - x.
38. Amir E, Simmons CE, Freedman OC et al. A phase 2 trial exploring the effects of high‑dose (10,000 IU/ day) vitamin D3 in breast cancer patients with bone metastases. Cancer 2010; 116(2): 284 – 291. doi: 10.1002/ cncr.24749.
39. Abbas S, Linseisen J, Slanger T et al. Serum 25 - hydroxyvitamin D and risk of post‑menopausal breast cancer ‑ results of a large case ‑ control study. Carcinogenesis 2008; 29(1): 93 – 99.
40. Nielsen TO, Hsu FD, Jensen K et al. Immunohistochemical and clinical characterization of the basal‑like subtype of invasive breast carcinoma. Clin Cancer Res 2004; 10(16): 5367 – 5374.
41. Rainville CH, Khan Y, Tisman G. Triple negative breast cancer patients presenting with low serum vitamin D levels: a case series. Cases J 2009; 2 : 8390. doi: 10.4076/ 1757 - 1626 - 2 - 8390.
42. Carey LA, Perou CM, Livasy CA et al. Race, breast cancer subtypes, and survival in the Carolina breast cancer study. JAMA 2006; 295(1): 2492 – 2502.
43. Laporta E, Welsh J. Modeling vitamin D actions in triple negative/ basal‑like breast cancer. J Steroid Biochem Mol Biol. In press 2013. doi: 10.1016/ j.jsbmb.2013.10.022.
44. Welsh J, Wietzke JA, Zinser GM et al. Vitamin D ‑ 3 receptor as target for brest cancer prevention. J Nutr 2003; 133 (Suppl 7): 2425S–2433S.
45. Köstner K, Denzer N, Müller CS et al. The relevance of vitamin D receptor (VDR) gene polymorphisms for cancer: a review of the literature. Anticancer Res 2009; 29(9): 3511 – 3536.
46. McKay JD, McCullough ML, Ziegler RG et al. Vitamin Dreceptor polymorphisms and breast cancer risk: results from the National cancer institute breast and prostate cancer cohort consortium. Cancer Epidemiol Biomarkers Prev 2009; 18(1): 297 – 305. doi: 10.1158/ 1055 - 9965.EPI ‑ 08 - 0539.
47. Sinotte M, Rousseau F, Ayotte P et al. Vitamin D receptor polymorphisms (FokI, BsmI) and breast cancer risk: association replication in two case ‑ control studies within French Canadian population. Endocr Relat Cancer 2008; 15(4): 975 – 983. doi: 10.1677/ ERC ‑ 08 - 0056.
48. Wang H, Wang W, Yang D et al. TaqI polymorphism of VDR gene contributes to breast cancer risk. Tumour Biol 2014; 35(1): 93 – 102. doi: 10.1007/ s13277-013 - 1011 - 9.
49. Autier P, Gandini S. Vitamin D supplementation and total mortality: a meta‑analysis of randomized controlled trials. Arch Intern Med 2007; 167(16): 1730 – 1737.
50. Chlebowski RT, Johnson KC, Kooperberg C et al. Calcium plus vitamin D supplementation and the risk of breast cancer. J Natl Cancer Inst 2008; 100(22): 1581 – 1591. doi: 10.1093/ jnci/ djn360.
51. Wactawski ‑ Wende J, Morley Kotchen J, Anderson GL et al. Calcium plus vitamin D supplementation and the risk of colorectal cancer. N Eng J Med 2006; 354(7): 684 – 696.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2014 Číslo Supplementum- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Analýza proteinů pomocí hmotnostní spektrometrie
- p‑ SRM, SWATH a HRM – cílené proteomické přístupy na hmotnostním spektrometru TripleTOF 5600+ a jejich aplikace v onkologickém výzkumu
- Analýza fosfoproteínov a signálnych dráh kvantitatívno‑ proteomickými metódami
- Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
- Současné trendy ve využívání PET radiofarmak k onkologické diagnostice
- „Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
- Vitamin D jako významný steroidní hormon u karcinomu prsu
- Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
- Soutěž o nejlepší práci
- Metody studia buněčné migrace a invazivity nádorových buněk
- Možnosti studia transendoteliální migrace in vitro
- Editorial
- Mechanizmy lékové rezistence a nádorové kmenové buňky
- Funkční testy pro detekci nádorových kmenových buněk
- Mikroprostředí nádoru – možnosti výzkumu v podmínkách in vitro
- Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
- Programovaná buněčná smrt v nádorových buňkách
- Metody pro studium protein‑proteinových a protein‑ligandových interakcí
- Detekce protein‑proteinových interakcí metodami FRET a BRET
- Detekce proteinů, proteinových interakcí a modifikací s využitím „proximity ligation assay“ in situ
- Exprese a purifikace proteinů
- Kvantitativní hmotnostní spektrometrie a její využití v onkologii
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Exprese a purifikace proteinů
- Metody studia buněčné migrace a invazivity nádorových buněk
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Analýza proteinů pomocí hmotnostní spektrometrie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



