-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
Electrochemical Analysis of Nucleic Acids, Proteins and Polysaccharides in Biomedicine
Electrochemical analysis of nucleic acids, proteins and polysaccharides represents an interesting, although not widely spread alternative to current methods based predominantly on optical detection because it offers a relatively inexpensive, fast and instrumentally simple detection of parallel samples on miniaturized chips, ideal for personalized medicine of the 21st century. Nucleic acid electrochemistry enables, for example, detection of specific DNA sequences (for determination of genes or presence of bacteria and viruses, etc.), DNA damage analysis and interaction with other molecules, DNA methylation or detection of microRNAs as potential cancer biomarkers. In the electrochemistry of proteins, great emphasis is put on construction of immunosensors for capturing specific proteins (antigens) using antibodies, suitable for diagnostics. From a biophysical point of view, intrinsic electrocatalytic signal of proteins sensitive to conformational changes could be useful in discrimination of mutant proteins (e. g. p53), native and aggregated forms (α-synuclein in Parkinson‘s disease) or for studies of protein interactions with low molecular ‑ weight ligands and DNA. Due to an increased interest of scientists in glycoproteins, new electrochemical papers emerged aiming at detection of oligosaccharides and polysaccharides (i.e. glycans, when part of the protein). These assays employ for instance electroactive labels specific for saccharides or lectin biosensors using lectins which strongly bind glycans. Electrochemical analysis thus appears as an interesting tool in current genomics, proteomics and glycomics, as well as for cancer diagnostics.
Key words:
electrochemistry – electrodes – nucleic acid hybridization – DNA sensors – electrocatalysis – biological markers
This work was supported by the Czech Science Foundation projects No. P301/11/2055 (to EP) and 14-24931P (to MB), by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/2.1.00/03.0101) and by MH CZ – DRO (MMCI, 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
15. 1. 2014Accepted:
27. 2. 2014
Autoři: M. Bartošík 1; E. Paleček 1,2; B. Vojtěšek 1
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 1; Biofyzikální ústav AV ČR, v. v. i., Brno 2
Vyšlo v časopise: Klin Onkol 2014; 27(Supplementum): 53-60
Souhrn
Elektrochemická analýza nukleových kyselin, bílkovin i polysacharidů představuje zajímavou, i když zatím méně používanou alternativu ve srovnání se stávajícími metodami založenými zejména na optické detekci. Nabízí totiž relativně levnou, rychlou a přístrojově nenáročnou možnost paralelní detekce na miniaturizovaných čipech, ideální pro personalizovanou medicínu 21. století. Elektrochemie nukleových kyselin umožňuje např. detekci konkrétních sekvencí DNA (pro určení genů, stanovení přítomnosti bakterií a virů, atd.), analýzu poškození DNA a interakcí s jinými molekulami, DNA metylaci, nebo detekci mikroRNA jako nádorových biomarkerů. V elektrochemii bílkovin je v současnosti kladen důraz zejména na konstrukci tzv. imunosenzorů schopných detekce konkrétních proteinů (antigenů) pomocí jejich vazby na protilátku, s potenciálem pro diagnostiku. Z biofyzikálního hlediska je zajímavý vlastní elektrokatalytický signál bílkovin citlivý k jejich konformačním změnám, který by mohl nalézt uplatnění při rozlišení mutantních forem proteinů (např. u p53) nebo při jejich agregaci (α - synuklein v případě Parkinsonovy nemoci), popřípadě při studiu interakcí s nízkomolekulárními látkami či DNA. Díky zvýšenému zájmu o glykoproteiny se začínají objevovat elektrochemické práce zabývající se detekcí oligo-sacharidů a polysacharidů (tzv. glykanů, pokud jsou součástí bílkovin), a to pomocí elektroaktivních značek specifických pro sacharidy anebo konstrukcí lektinových biosenzorů využívajících lektinů, které se silně váží právě na glykany. Elektrochemická analýza se tak jeví jako zajímavý nástroj v současném výzkumu na poli genomiky, proteomiky i glykomiky, včetně diagnostiky nádorových onemocnění.
Klíčová slova:
elektrochemie – elektrody – hybridizace nukleových kyselin – DNA senzory – elektrokatalýza – biologické markeryÚvod
V souvislosti s obrovským pokrokem v biomedicíně v posledních letech jsou vyvíjeny nové metody analýzy a detekce nukleových kyselin (NK), bílkovin i polysacharidů – metody, které by byly levnější, vyžadovaly jednodušší vybavení a dokázaly rychle a paralelně analyzovat co nejmenší objemy vzorků. Z těchto důvodů se v biomedicínském výzkumu čím dál víc používají i metody založené na elektrochemické detekci, které mají naději tato kritéria splnit. V současnosti v laboratořích zaměřených na onkologický výzkum převládají zavedené a dobře známé optické techniky (mikroskopie, různé spektroskopické metody atd.) využívající detekci světla nebo jiného elektromagnetického záření. U elektrochemie je princip poněkud odlišný – zjednodušeně řečeno je studován přenos elektronů mezi analyzovanou látkou rozpuštěnou ve vodním prostředí a elektrodou do tohoto prostředí ponořenou. Látka může od elektrody elektrony přijímat (redukovat se) anebo je elektrodě odevzdávat (oxidovat se), přičemž se tento přenos elektronů projeví změnou sledovaného signálu (obvykle vznikem tzv. píku). Na základě toho lze zjistit např. přítomnost dané látky v prostředí (a dle velikosti signálu i její koncentraci) nebo studovat její strukturu či interakci s jinými molekulami. I když je elektrochemie používána spíše pro detekci nízkomolekulárních látek (existuje řada elektrochemických senzorů např. pro detekci etanolu v alkohol testerech, oxidu uhelnatého v plynových detektorech anebo glukózy v glukometrech), čím dál více prací se zabývá i studiem biomakromolekul. Velkou roli ve vývoji elektrochemie sehrál významný český vědec Jaroslav Heyrovský, držitel Nobelovy ceny za objev polarografie, předchůdkyně dnešních moderních elektrochemických technik. Česká elektrochemie má proto velikou tradici a dobré jméno v zahraničí a není náhoda, že mnoho objevů bylo učiněno právě na „domácí půdě“. V následujících řádcích bychom rádi shrnuli historii i současné možnosti a trendy v elektrochemickém výzkumu NK, bílkovin a v neposlední řadě i polysacharidů, zejména v souvislosti s glykoproteiny.
Nukleové kyseliny
Krátce po objevu struktury dvojité šroubovice DNA v roce 1953 [1], kdy vzrostl zájem o chemické i biologické vlastnosti DNA, se zdálo, že DNA a RNA jsou polarograficky inaktivní, a tudíž pro elektrochemii nepoužitelné [2]. V témže roce však jeden z nás (EP), který pracoval jako asistent/ aspirant (dnes Ph.D. student) na Biofyzikálním ústavu ČSAV v Brně, získal výsledky ukazující, že všechny báze, DNA i RNA jsou polarograficky aktivní a lze je elektrochemicky stanovit v relativně nízkých koncentracích [3]. Ukázalo se, že adenin (A) a cytosin (C) poskytují redukční signály, zatímco guanin (G)poskytuje při (cyklické) oscilografické polarografii anodický signál, odpovídající oxidaci redukčního produktu guaninu. V roce 1960 vyšla v časopisu Nature práce ukazující, že za elektrochemické signály DNA jsou odpovědny redukční a oxidační elektrodové děje bází (A, C, G) a že tyto signály reflektují změny ve struktuře DNA, při nichž se mění dostupnost bází pro elektrodové interakce [4]. Možná nebylo překvapivé, že tato práce vyšla rok po udělení Nobelovy ceny J. Heyrovskému a krátce před udělením téže ceny J. Watsonovi, F. Crickovi a M. Wilkinsovi (1962) za objev struktury DNA. Určitě stojí za zmínku, že získané výsledky by nevznikly bez přístroje pro oscilografickou polarografii, který v té době zakoupil Vladimír Morávek, profesor biochemie na Masarykově univerzitě a zakladatel výzkumných laboratoří Masarykova onkologického ústavu v Brně.
Po více než 30 let byla elektrochemie nukleových kyselin poměrně malé vědecké pole, na kterém pracovalo asi 10 laboratoří, převážně v Evropě. Brněnská laboratoř vedená EP představovala v té době světové centrum v dané oblasti, ze kterého vyšla řada důležitých objevů a zjištění [5–10], z nichž mnohé jsou využívány dodnes. Některé z nich jsou uvedeny v tab. 1. Po roce 1990 se začal počet laboratoří zabývajících se elektrochemií DNA zvyšovat a došlo k prudkému nárůstu publikací v této oblasti vědy, dosahujícímu až přibližně 700 článků ročně.
Tab. 1. Některá důležitá zjištění v elektrochemii nukleových kyselin do roku 1990. 
Pravděpodobným důvodem tohoto nárůstu byl výrazný pokrok v genomice související zejména s dokončením projektu lidského genomu (Human Genome Project). Jakmile totiž vědci znali sekvenci mnoha genů odpovědných za vznik dědičných chorob anebo rakoviny (tzv. onkogenů anebo nádorových supresorových genů), nebyl pak problém syntetizovat sondy DNA s komplementární sekvencí, které by tyto cílové geny navázaly (v procesu hybridizace) a tuto hybridizaci detekovali pomocí různých technik právě včetně elektrochemie. Postupně se vyvinulo množství sofistikovaných přístupů cílených na zlepšení citlivosti nebo reprodukovatelnosti analýz (obr. 1) [11]. Jedná se třeba o analogii známé ELISA, kdy cílová NK nejdřív hybridizuje s vazebnou sondou a následně jiná část této cílové NK hybridizuje s další DNA sondou (tzv. detekční nebo reportérovou sondou), která bývá značena antigenem (obr. 1A). Po vytvoření „sendviče“ se do směsi přidává primární protilátka vůči danému antigenu a následně sekundární protilátka konjugovaná s enzymem (jež se váže na primární protilátku) a elektrochemicky se sleduje enzymatická reakce. Signál z enzymatické reakce (obvykle oxidace nebo redukce nějakého vhodného substrátu) pak značí přítomnost cílové NK; nejčastěji používanými enzymy jsou alkalická fosfatáza či křenová peroxidáza.
Obr. 1. Nejčastěji používané strategie pro detekci konkrétních sekvencí nukleových kyselin (NK) v hybridizačních senzorech. A. Sendvičová strategie využívající dvě sondy: vazebnou sondu připevněnou na elektrodu a antigenem značenou detekční sondu pro vazbu protilátky konjugované s enzymem. Elektrochemicky je detekován produkt enzymatické reakce. B. Molekulární „maják“ s jedinou značenou sondou imobilizovanou na povrch elektrody. Cílová NK mění konformaci vazebné sondy a ovlivňuje výsledný signál. C. Sendvičová strategie, kde se namísto protilátky používají nanočástice (nanoparticles – NP); ty mohou katalyzovat reakci za vzniku elektroaktivního produktu, anebo v případě kovových NP je možné detekovat kationty kovů po jejich rozpuštění. 
Poněkud jednodušší je tzv. „molekulární maják“ (molecular beacon), což je speciální značená DNA sonda zahrnující vazebnou i detekční sondu v jednom (obr. 1B). Tato sonda je navázána na povrch elektrody, přičemž před hybridizací je velmi flexibilní. Díky ní se připojená elektroaktivní značka na konci sondy nachází relativně blízko povrchu elektrody a její signál je tudíž vysoký. Po hybridizaci s cílovou NK mění sonda konformaci, je „narovnanější“ a značka se dostává dál od elektrody, čímž signál klesá.
V poslední době se i v elektrochemii NK čím dál častěji uplatňují nanotechnologie (obr. 1C). Oblíbeným přístupem je např. aplikace anorganických nanočástic (kovové, magnetické, polovodičové atd.), které mohou sloužit jako elektroaktivní značky nebo jako katalyzátory chemických reakcí. Pro modifikaci elektrodových povrchů se používají uhlíkové nanotrubky nebo grafén (Nobelova cena, 2010), jejichž výhodou je velký poměr plocha/ objem vedoucí k výrazné amplifikaci signálu (s rostoucí plochou roste i počet přenesených elektronů z/ do elektrody).
Výše zmíněné strategie byly použity pro detekci onkogenů a tumor supresorových genů [12 – 14], jednonukleotidového polymorfizmu (single nucleotide polymorphism, např. u hemachromatózy) [15], repetitivních sekvencí (tzv. tripletová expanze typická pro Huntingtonovu chorobu nebo myotonickou dystrofii) [16,17], virových či bakteriálních NK [18 – 20] anebo geneticky modifikovaných organizmů [21].
Využití v onkologickém výzkumu
Existuje celá řada potenciálních možností použití elektrochemie NK v onkologickém výzkumu. Zajímavá aplikace je třeba studium interakce DNA s protinádorovými léčivy. Léky jako cisplatina, daunomycin anebo mitomycin poškozují DNA, přičemž toto poškození se často projeví změnou elektrochemického signálu DNA [22]. Brabec vyvinul jednoduchý elektrochemický biosenzor na bázi uhlíkových elektrod, který monitoruje pokles oxidačního píku guaninu po navázání platinovaných derivátů [23]. Mnohdy i samotná léčiva (zejména organokovové sloučeniny jako platinované deriváty) dávají výrazný elektrochemický signál a namísto píku DNA je analyzován signál pocházející od léčiv [24]. Tyto přístupy se dají využít např. pro studium molekul, které by mohly být potenciálními léčivy, ale jejich vazba na DNA nebyla doposud prostudována.
Další důležitou oblastí je elektrochemické studium metylace DNA. Metylace představuje epigenetickou modifikaci (metylace cytozinu na 5 - uhlíku; vzniká metylcytozin) hrající roli v genové expresi [25], přičemž změněné metylační vzorce u DNA bývají asociovány s karcinogenezí. Bylo publikováno několik strategií, jak elektrochemicky rozlišit metylovanou a nemetylovanou DNA. Používá se třeba reakce s hydrogensiřičitanem sodným, který deaminuje cytozin na uracil, zatímco metylcytozin zůstává nezměněn. Po vhodné volbě primerů je následně provedena amplifikace metylované nebo nemetylované DNA pomocí polymerázové řetězové reakce (polymerase chain reaction – PCR), u které je uracil amplifikován jako tymin a metylcytozin jako cytozin, a elektrochemická detekce použitím vhodných redoxních značek [14,26]. Jednodušší varianta je přímé rozlišení metylované a nemetylované DNA bez nutnosti PCR amplifikace, pouze na základě rozdílných elektrochemických vlastností cytozinu a metylcytozinu [27,28]. Tento přístup se však v současné době jeví jako málo citlivý, vyžadující mikromolární množství DNA. Nedávno jsme vyvinuli jednoduchou metodu pro rozlišení metylované a nemetylované DNA použitím hydrogensiřičitanu sodného, avšak bez nutnosti PCR [29]. Využili jsme při tom toho, že uracil je na rtuťových elektrodách neredukovatelný, zatímco metylcytozin ano. Metylovaná DNA proto po reakci s hydrogensiřičitanem sodným poskytovala vyšší signál než nemetylovaná DNA.
Mnoho práce bylo vykonáno i na poli RNA. Molekuly jako mRNA a mikroRNA (miRNA) slouží jako biomarkery některých typů nádorů, protože úzce souvisí s expresí onkoproteinů nebo nádorových supresorů [30]. Byla např. vyvinuta metoda elektrochemické detekce mRNA pro interleukin‑8 přímo ve slinách pro včasnou diagnostiku rakoviny ústní dutiny [31]. Detekce byla provedena použitím molekulárního majáku, přičemž detekční limit byl slibných 0,4 fM. Mnohem více prací však existuje pro elektrochemickou detekci miRNA (krátkých RNA molekul) využívajících dva rozdílné mechanizmy posttranskripční regulace genové exprese, které vedou buď k degradaci cílové mRNA, nebo k represi její translace [11,32]. Nejčastější přístup elektrochemické detekce miRNA je již zmíněná sendvičová metoda využívající dvě DNA sondy (obr. 1, stejná strategie, pouze namísto DNA je detekována RNA) a některý ze způsobů značení pro amplifikaci signálu, např. enzymatické [33 – 35] nebo nanočásticové [36]. Existují i další strategie, třeba jednodušší a levnější metoda bez amplifikace signálu využívající značení miRNA pomocí elektroaktivního komplexu na bázi šestimocného osmia [37,38]. U této metody je vazebná sonda DNA připevněna na magnetické kuličky a značená komplementární miRNA je po hybridizaci a důkladném promytí uvolněna z kuliček a elektrochemicky stanovena právě díky osmiové značce, která umožňuje detekci pikomolárních koncentrací miRNA. Tento jednoduchý přístup by se mohl uplatnit v rychlé detekci vybraných miRNA, pokud se povede zvýšit citlivost stanovení.
Bílkoviny
V době, kdy polarograf ještě nebyl komerčně dostupný, se Jaroslav Heyrovský pokoušel popularizovat polarografii tím, že do své laboratoře zval mladé vědce a ti tam na polarografu prováděli své experimenty. Mezi nimi byli i lékaři Herles a Vančura studující polarografickou aktivitu lidských tělních tekutin [39]. V séru, moči i žluči objevili signál bílkovin, který byl potenciálově asi o 300 mV pozitivnější než redukce sodíkových kationtů, a proto dostal název „prenátriová vlna“. Ve výzkumu prenátriové vlny pokračovali Heyrovský a Babička, kteří ukázali, že tento signál souvisí s katalytickým vylučováním vodíku, přičemž se objevoval v přítomnosti albuminů společně s amoniovými ionty [40]. Polarografická prenátriová vlna však byla považována za málo vhodnou pro analytické účely, protože se nacházela příliš blízko vylučování základního elektrolytu a byla špatně vyvinutá. V roce 1933 Brdička zjistil, že bílkoviny obsahující zbytky cysteinu poskytují polarografickou dvojvlnu v pufrovaných roztocích kobaltu, která byla rovněž způsobena katalytickým vylučováním vodíku, ale byla dobře oddělena od křivky základního elektrolytu. Po několik desetiletí byla Brdičkova katalytická reakce (Brdicka’s catalytic reaction – BCR) intenzivně studována, neboť se brzy po jejím objevu jevila jako dobrý nástroj při výzkumu rakoviny, a to zejména pro její diagnostiku [41]. Na výzkumech se podílel i Masarykův onkologický ústav (MOÚ) v Brně, včetně prof. V. Morávka a později A. Kočenta, kteří na MOÚ elektrochemickou analýzu bílkovin zavedli a přispěli k jejímu rozvoji. Koncem 60. let minulého století začal zájem o BCR upadat, neboť se objevily nové, specifičtější metody v diagnostice rakoviny. BCR v kombinaci s moderními elektrochemickými metodami a stacionárními elektrodami se může však i v současnosti uplatnit při analýze bílkovin, např. metalothioneninů [42]. V posledních letech se ukazuje, že Heyrovského „prenátriová vlna“ ve spojení s elektrochemickou technikou, tzv. chronopotenciometrií konstantním proudem (constant current chronopotentiometric stripping – CPS) a se stacionárními rtuťovými chemicky modifikovanými elektrodami, včetně pevných amalgamových elektrod, může být vhodný nástroj analýzy bílkovin. Rtuťové elektrody totiž nabízejí vysokou citlivost, zejména pokud se jedná o zmíněnou elektrokatalýzu, při které elektroaktivní aminokyseliny u studovaného proteinu odevzdávají při záporných potenciálech elektrodě protony, čímž dochází ke vzniku a vylučování molekulárního vodíku. Jedná se zvláště o bazické aminokyseliny lysin, arginin a histidin, a taktéž o cystein, jehož katalytické účinky se využívají právě ve výše popsané BCR. Tyto aminokyseliny následně přijímají protony z vodního prostředí, dochází k jejich regeneraci a katalytický cyklus se může opakovat. Protože jedna molekula proteinu generuje mnoho molekul vodíku, je tato metoda vysoce citlivá, umožňující stanovení až subnanomolárních koncentrací proteinů. Důležitou vlastností tohoto katalytického signálu (nazývaného pík H; obr. 2A) je jeho citlivost ke strukturním či konformačním změnám bílkovin, protože často dochází ke snížení nebo zvýšení přístupnosti elektroaktivních aminokyselin k povrchu elektrody, čímž je ovlivněn přenos elektronů. Pomocí píku Hbyla u bílkovin kupříkladu sledována denaturace [43] nebo agregace [44], interakce s nízkomolekulárními ligandy či DNA [45], strukturní změny v důsledku zavedených mutací [46], či redoxní stav [47] atd.
Obr. 2. Elektrochemická analýza bílkovin. A–B. Vlastní elektroaktivita bílkovin bez nutnosti externího značení na rtuťových (A) a uhlíkových (B) elektrodách. Rtuťové elektrody poskytují elektrokatalytický pík H a jsou vhodné pro rozlišení strukturních změn v bílkovinách (např. denaturace). Uhlíkové elektrody umožňují sledování oxidace tyrozinu (pík Y) a tryptofanu (pík W) u kratších peptidů (v případě proteinů obvykle dochází ke spojení obou píků do jednoho). C. Různé druhy imunosenzorů s imobilizovanou primární protilátkou a hledaným antigenem. Liší se ve způsobu amplifikace signálu přidáním sekundární protilátky značené např. (zleva doprava) enzymem, nanočásticí (NP), kvantovou tečkou, magnetickou kuličkou pokrytou množstvím enzymových molekul, atd. D. Konstrukce aptasenzoru využívající změnu konformace značeného aptameru po navázání proteinu, což vede k zvýšení signálu. 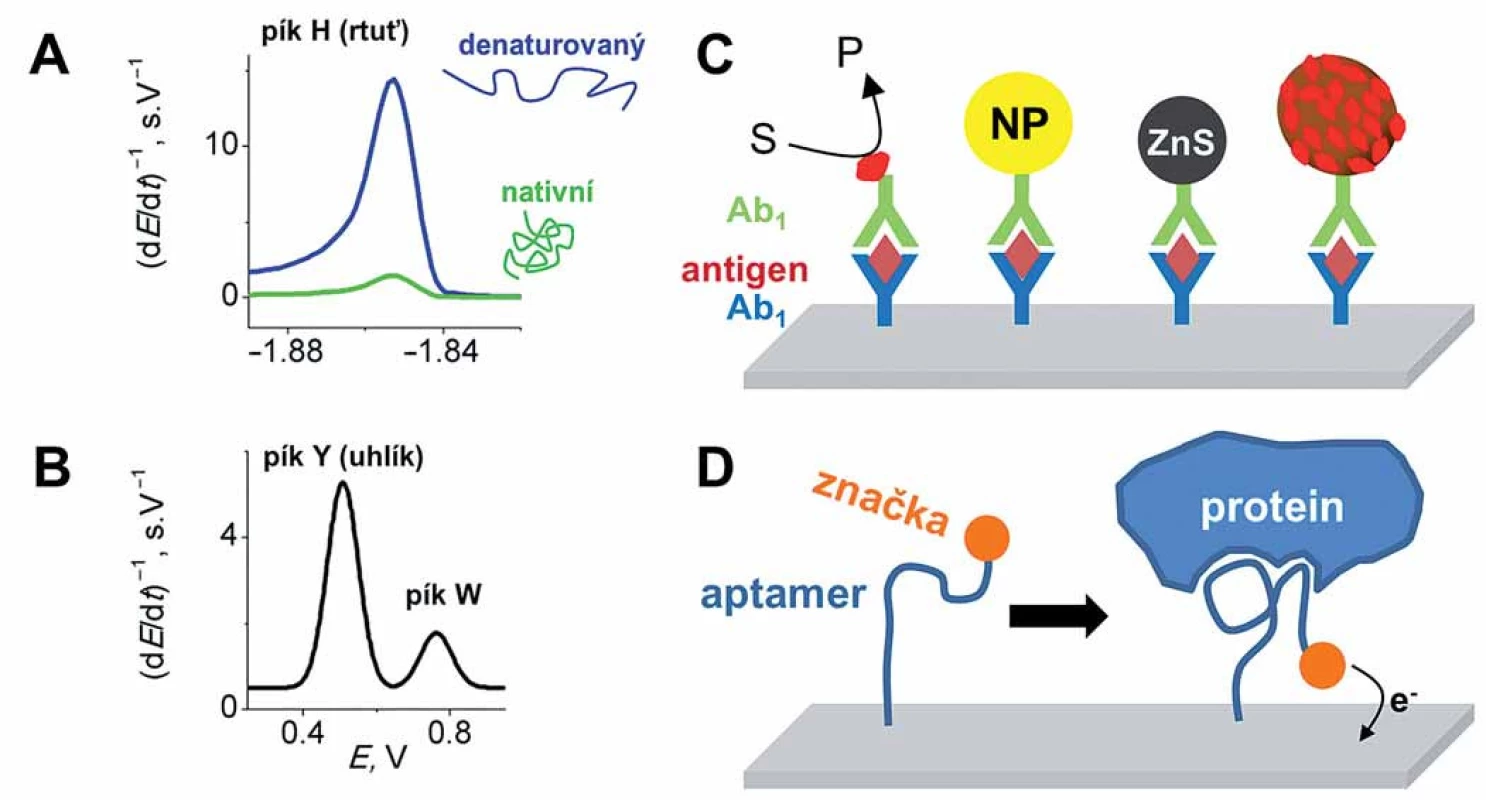
Kromě rtuťových elektrod poskytují bílkoviny signály i na uhlíkových elektrodách. Je možné monitorovat oxidaci aminokyselinových zbytků tyrozinu a tryptofanu (obr. 2B), a to třeba pro studium interakce DNA ‑ protein [48], pro rozlišení fosforylovaných a nefosforylovaných forem [49], pro studium membránové sodíkové ‑ draslíkové pumpy [50], nebo pro stanovení inzulinu [51] či α-synukleinu (proteinu důležitého při vzniku Parkinsonovy nemoci) [52].
Pro zvýšení citlivosti se k bílkovinám často navazují různé externí značky, popřípadě se sledují redoxní děje kofaktorů (zejména iontů kovů u metaloproteinů), a nikoliv redoxní děje samotných aminokyselin. Značení je zejména účinné při citlivé detekci konkrétních bílkovin, obvykle ve směsi jiných molekul. Pro tyto účely se nejčastěji využívají tzv. imunoeseje (immunoassays) ve formátu ELISA, kdy se hledaný protein (sloužící jako antigen) naváže na primární protilátku imobilizovanou na povrchu elektrody (imunosenzoru) a na takto vzniklý komplex se naváže sekundární protilátka konjugovaná s enzymem katalyzujícím elektrochemicky detekovatelnou reakci (obr. 2C) [53 – 55]. Podobně jako u NK se i v detekci bílkovin používají v stále větší míře nanotechnologie (nanočástice, nanotrubky atd.), které ještě více zvyšují citlivost detekce, někdy až na femto ‑ či dokonce attomolární úroveň [56,57].
Existují práce, i když zatím jich je mnohem méně, ve kterých se namísto imobilizace protilátek využívají tzv. aptamery [58 – 61]. Jedná se o syntetické jednořetězové DNA nebo RNA sekvence vázající se s vysokou afinitou (porovnatelnou s protilátkami) k různým biomolekulám (proteinům, peptidům, ale i menším organickým molekulám; obr. 2D). Jejich nespornou výhodou v porovnání s protilátkami je rychlejší i levnější příprava a též jejich menší molekulová hmotnost, jež umožňuje dosáhnout mnohem vyšší povrchové koncentrace aptamerů při imobilizaci na povrch tzv. aptasenzorů. Protože se však jedná o nukleové kyseliny, jsou méně stabilní v biologickém prostředí vzhledem k přítomnosti nukleáz.
Elektrochemie bílkovin by mohla být užitečná i v onkologickém výzkumu, např. při detekci proteinových biomarkerů [62 – 65]. Pozornost se zejména soustředí na vývoj sofistikovaných čipů obsahujících vedle sebe více elektrod, čímž by byla umožněna paralelní detekce různých biomarkerů konkrétního nádorového onemocnění (jeden druh biomarkeru totiž často nestačí). Tyto čipy by měly být spolehlivé a zároveň levné, dostatečně citlivé a selektivní pouze k daným biomarkerům a jejich obsluha by měla být co nejjednodušší. Úkol to zajisté není snadný, postupně se však objevují práce ukazující, kterým směrem postupovat pro dosažení tohoto cíle, jako např. mikrofluidický imunosenzor pro simultánní detekci čtyř biomarkerů – interleukinu 6, interleukinu 8, vaskulárního endoteliálního růstového faktoru (VEGF) a VEGF ‑ C – získaných přímo ze sér pacientů s karcinomem dutiny ústní [66]. Na vzorku 78 pacientů a 49 negativních kontrol autoři detekovali za necelou hodinu velmi nízké koncentrace biomarkerů (řádově fg/ ml), přičemž výsledky dobře korelovaly s výsledky ELISA.
Kromě detekce biomarkerů byla elektrochemie aplikována i pro studium vlivu onkogenních mutací na DNA ‑ vazebnou doménu u nádorového supresoru p53, a to pomocí již zmíněného elektrokatalytického píku H [46]. Výsledky pro wild type i mutantní p53 výborně korelovaly s údaji o struktuře a stabilitě a poskytly hlubší pohled do rozdílného dynamického chování jednotlivých mutantů. Kromě toho pík H umožnil monitorování ztráty nezbytného zinečnatého iontu způsobenou mutací (R175H) nebo chelátovou vazbou s EDTA. Obecně by tato metoda mohla být aplikována pro analýzu prakticky jakékoliv bílkoviny i jako senzor pro konformační přeměny nebo vazbu ligandů, zejména jako doplněk konvenčních technik.
Polysacharidy
V přírodě polysacharidy (PS) a oligosacharidy (OLS) vytvářejí velké a dosti odlišné třídy látek vyskytující se volně nebo vázané na proteiny či lipidy [67]. Díky jejich strukturní flexibilitě, která jim umožňuje nepřeberné množství kombinací vzájemného propojení, jsou bezpochyby ideálními „identifikátory“ v mezimolekulové a mezibuněčné komunikaci [68]. V poslední době se ukazuje, že většina bílkovin se v buňkách savců vyskytuje právě ve formě glykoproteinů. Glykosylace bílkovin často hraje důležitou roli ve zdraví i nemoci člověka, a to včetně rakoviny, u níž bývá např. pozorována abnormální glykosylace bílkovin na povrchu nádorových buněk.
Není proto divu, že v současné době lze pozorovat zvýšený zájem o nové metody analýzy PS, OLS a glykoproteinů. PS neobsahují redoxní skupiny, a byly proto do nedávna považovány za elektrochemicky inaktivní látky. Teprve v roce 2009 bylo zjištěno, že některé sulfátované PS katalyzují vylučování vodíku a poskytují CPS signály na rtuťových elektrodách [69]. Zcela nedávno vyšlo najevo, že daleko intenzivnější signály tohoto typu poskytuji některé PS a OLS obsahující glukosamin [70]. Vedle toho se ukázalo, že PS a OLS lze snadno modifikovat komplexy šestimocného osmia s dusíkatými ligandy (Os(VI)L) [71,72], přičemž vzniklé adukty (obr. 3A) jsou elektrochemicky aktivní (podobně jako výše zmíněné značení miRNA). Použití některých ligandů (např. bipyridinu) umožňuje i vznik aduktů, které mohou navíc poskytnout citlivější signály podmíněné katalytickým vylučováním vodíku [71]. U jiných ligandů (temed) je zase možné stanovení PS a OLS přímo v reakční směsi. Proti některým aduktům PS ‑ Os(VI)L byly generovány vysoce specifické monoklonální protilátky, které je možno použít k analýze Os(VI)L ‑ modifikovaných glykanů přímo v glykoproteinech.
Obr. 3. Elektrochemická analýza cukerné složky pro detekci glykoproteinů. A. Modifikace oligosacharidů a polysacharidů pomocí komplexů šestimocného osmia a dusíkatého ligandu, Os(VI)L. B. Konstrukce lektinového biosenzoru pro detekci glykoproteinů pomocí elektrochemické impedanční spektroskopie (EIS). Velikost půlkruhu je úměrná odporu přenosu elektronů (a naopak nepřímo úměrná propustnosti vrstvy), a tudíž zvýšení odporu signalizuje přítomnost cílové bílkoviny. 
K dynamicky rozvíjející se oblasti patří i tzv. lektinové biosenzory pro detekci glykanů (tj. cukerných zbytků u glykoproteinů či glykolipidů) využívající elektrochemickou impedanční spektroskopii (EIS) [64,68]. Lektiny, což jsou proteiny selektivně vázající různé mono ‑ anebo oligosacharidy, jsou nejdřív imobilizovány na povrch senzoru (obvykle zlaté elektrody) a po přidání vzorku dochází přes glykan k vazbě hledaného glykoproteinu a imobilizovaného lektinu (obr. 3B). Pomocí EIS se pak sleduje změna odporu elektronového přenosu na rozhraní elektroda/ elektrolyt (jinak řečeno změna propustnosti elektrodové vrstvy), přičemž vazba glykoproteinu na lektin (vytvoření komplexu) vede ke snížení propustnosti této vrstvy. Lektinové biosenzory již byly použity pro detekci bílkovin p53 [73], mucinu [74], VEGF [75], nebo karcinoembryonálního antigenu [76], ale i celých nádorových buněk [77,78]. Nesporně skýtají obrovský potenciál pro jednoduchou a rychlou detekci nádorových biomarkerů i jiných bílkovin důležitých v biomedicíně.
Závěr a výhled do budoucnosti
I když v posledních letech nepochybně došlo k výraznému pokroku elektrochemické analýzy biomakromolekul, stále ještě čelíme řadě výzev i překážek. Jednou z nich je aplikovatelnost metody pro analýzu reálných vzorků od pacientů, které bývají mnohem komplexnější než modelové systémy, na nichž jsou jednotlivé strategie vybudovány. Je nesmírně důležité, aby současné studie čím dál více pracovaly i s tak složitým prostředím, jako jsou lidské tělní tekutiny, kde citlivost a selektivita metody budou hrát klíčovou roli. V těchto prostředích je navíc potřebné dostatečně minimalizovat nespecifické adsorpce nežádoucích molekul, aby nedocházelo k falešně pozitivním výsledkům. Elektrodové povrchy se někdy nesnadno obnovují do původního stavu, takže následná měření mohou být zkreslená. Zde by se mohly uplatnit velmi oblíbené levné tištěné elektrody pro jedno použití nevyžadující regeneraci. Aplikace nanotechnologií výrazně napomáhají ke zvýšení citlivosti senzorů. Dovolíme si konstatovat, že díky obrovskému úsilí vědeckých týmu po celém světě se postupně otevírají cesty pro využití elektrochemické analýzy v současné genomice, proteomice i glykomice.
Práce byla podpořena grantem GA ČR P301/11/2055 (EP), GA ČR 14-24931P (MB) a Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101) a MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Martin Bartošík, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: martin.bartosik@mou.cz
Obdrženo: 15. 1. 2014
Přijato: 27. 2. 2014
Zdroje
1. Watson JD, Crick FHC. Molecular structure of nucleic acids – a structure for deoxyribose nucleic acid. Nature 1953; 171(4356): 737 – 738.
2. Berg H. Polarographische Untersuchungen an Nucleinsauren und Nucleasen. I. Mitt. Polarographische Nachweis von Proteinen neben Nucleinsauren. Biochem Z 1957; 329(3): 274 – 276.
3. Palecek E. Oszillographische Polarographie der Nucleinsauren und ihrer Bestandteile. Naturwiss 1958; 45(8): 186 – 187.
4. Palecek E. Oscillographic polarography of highly polymerized deoxyribonucleic acid. Nature 1960; 188 : 656 – 657.
5. Palecek E. Polarographic behaviour of native and denatured deoxyribonucleic acids. J Mol Biol 1966; 20(2): 263 – 281.
6. Palecek E. The polarographic behaviour of double‑helical DNA containing single‑strand breaks. Biochim Biophys Acta 1967; 145(2): 410 – 417.
7. Hillson PJ. Interactions between dye ions and substances of high molecular weight – a polarographic investigation. J Soc Dyers Colour 1967; 83(5): 186.
8. Brabec V, Dryhurst G. Electrochemical oxidation of polyadenylic acid at graphite electrodes. J Electroanal Chem 1978; 91(2): 219 – 229.
9. Lukasova E, Jelen F, Palecek E. Electrochemistry of osmium nucleic ‑ acid complexes – a probe for single‑stranded and distorted double‑stranded regions in DNA. Gen Physiol Biophys 1982; 1(1): 53 – 70.
10. Palecek E, Postbieglova I. Adsorptive stripping voltammetry of biomacromolecules with transfer of the adsorbed layer. J Electroanal Chem 1986; 214(1): 359 – 371.
11. Palecek E, Bartosik M. Electrochemistry of nucleic acids. Chem Rev 2012; 112(6): 3427 – 3481.
12. Lee AC, Dai ZY, Chen BW et al. Electrochemical branched ‑ DNA assay for polymerase chain reaction‑free detection and quantification of oncogenes in messenger RNA. Anal Chem 2008; 80(24): 9402 – 9410. doi: 10.1021/ ac801263r.
13. Horakova P, Simkova E, Vychodilova Z et al. Detection of single nucleotide polymorphisms in p53 mutation hotspots and expression of mutant p53 in human cell lines using an enzyme‑linked electrochemical assay. Electroanalysis 2009; 21(15): 1723 – 1729.
14. Hou P, Ji M, Ge C et al. Detection of methylation of human p16(Ink4a) gene 5‘ - CpG islands by electrochemical method coupled with linker‑PCR. Nucleic Acids Res 2003; 31(16): e92.
15. Ertl P, Emrich CA, Singhal P et al. Capillary electrophoresis chips with a sheath ‑ flow supported electrochemical detection system. Anal Chem 2004; 76(13): 3749 – 3755.
16. Yang IV, Thorp HH. Modification of indium tin oxide electrodes with repeat polynucleotides: electrochemical detection of trinucleotide repeat expansion. Anal Chem 2001; 73(21): 5316 – 5322.
17. Fojta M, Havran L, Vojtiskova M et al. Electrochemical detection of DNA triplet repeat expansion. J Am Chem Soc 2004; 126(21): 6532 – 6533.
18. Ariksoysal DO, Karadeniz H, Erdem A et al. Label‑free electrochemical hybridization genosensor for the detection of hepatitis B virus genotype on the development of lamivudine resistance. Anal Chem 2005; 77(15): 4908 – 4917.
19. Farabullini F, Lucarelli F, Palchetti I et al. Disposable electrochemical genosensor for the simultaneous analysis of different bacterial food contaminants. Biosens Bioelectron 2007; 22(7): 1544 – 1549.
20. Campuzano S, Kuralay F, Lobo ‑ Castanon MJ et al. Ternary monolayers as DNA recognition interfaces for direct and sensitive electrochemical detection in untreated clinical samples. Biosens Bioelectron 2011; 26(8): 3577 – 3583. doi: 10.1016/ j.bios.2011.02.004.
21. Carpini G, Lucarelli F, Marrazza G et al. Oligonucleotide ‑ modified screen ‑ printed gold electrodes for enzyme ‑ amplified sensing of nucleic acids. Biosens Bioelectron 2004; 20(2): 167 – 175.
22. Fojta M. Electrochemical sensors for DNA interactions and damage. Electroanalysis 2002; 14(21): 1449 – 1463.
23. Brabec V. DNA sensor for the determination of antitumor platinum compounds. Electrochim Acta 2000; 45(18): 2929 – 2932.
24. Horakova P, Tesnohlidkova L, Havran L et al. Determination of the level of DNA modification with cisplatin by catalytic hydrogen evolution at mercury‑based electrodes. Anal Chem 2010; 82(7): 2969 – 2976. doi: 10.1021/ ac902987x.
25. Suzuki MM, Bird A. DNA methylation landscapes: provocative insights from epigenomics. Nat Rev Genet 2008; 9(6): 465 – 476. doi: 10.1038/ nrg2341.
26. Sato S, Tsueda M, Kanezaki Y et al. Detection of an aberrant methylation of CDH4 gene in PCR product by ferrocenylnaphthalene diimide‑based electrochemical hybridization assay. Anal Chim Acta 2012; 715 : 42 – 48. doi: 10.1016/ j.aca.2011.12.010.
27. Ioannou A, Alexiadou D, Kouidou S et al. Use of adsorptive transfer stripping voltammetry for analyzing variations of cytosine methylation in DNA. Electroanalysis 2009; 21(24): 2685 – 2692.
28. Kato D, Sekioka N, Ueda A et al. A nanocarbon film electrode as a platform for exploring DNA methylation. J Am Chem Soc 2008; 130(12): 3716 – 3717. doi: 10.1021/ ja710536p.
29. Bartosik M, Fojta M, Palecek E. Electrochemical detection of 5 - methylcytosine in bisulfite‑treated DNA. Electrochim Acta 2012; 78 : 75 – 81.
30. Iorio MV, Croce CM. microRNA involvement in human cancer. Carcinogenesis 2012; 33(6): 1126 – 1133. doi: 10.1093/ carcin/ bgs140.
31. Wei F, Wang J, Liao W et al. Electrochemical detection of low ‑ copy number salivary RNA based on specific signal amplification with a hairpin probe. Nucleic Acids Res 2008; 36(11): e65. doi: 10.1093/ nar/ gkn299.
32. Hamidi ‑ Asl E, Palchetti I, Hasheminejad E et al. A review on the electrochemical biosensors for determination of microRNAs. Talanta 2013; 115 : 74 – 83. doi: 10.1016/ j.talanta.2013.03.061.
33. Kilic T, Topkaya SN, Ariksoysal DO et al. Electrochemical based detection of microRNA, mir21 in breast cancer cells. Biosens Bioelectron 2012; 38(1): 195 – 201. doi: 10.1016/ j.bios.2012.05.031.
34. Wang ZW, Zhang J, Guo Y et al. A novel electrically magnetic ‑ controllable electrochemical biosensor for the ultra sensitive and specific detection of attomolar level oral cancer‑related microRNA. Biosens Bioelectron 2013; 45 : 108 – 113. doi: 10.1016/ j.bios.2013.02.007.
35. Bettazzi F, Hamid ‑ Asl E, Esposito CL et al. Electrochemical detection of miRNA ‑ 222 by use of a magnetic bead‑based bioassay. Anal Bioanal Chem 2013; 405(2 – 3): 1025 – 1034. doi: 10.1007/ s00216 - 012 - 6476 - 7.
36. Wang J, Yi X, Tang H et al. Direct quantification of microRNA at low picomolar level in sera of glioma patients using a competitive hybridization followed by amplified voltammetric detection. Anal Chem 2012; 84(15): 6400 – 6406. doi: 10.1021/ ac203368h.
37. Trefulka M, Bartosik M, Palecek E. Facile end‑labeling of RNA with electroactive Os(VI) complexes. Electrochem Commun 2010; 12 : 1760 – 1763.
38. Bartosik M, Trefulka M, Hrstka R et al. Os(VI)bipy‑based electrochemical assay for detection of specific microRNAsas potential cancer biomarkers. Electrochem Commun 2013; 33 : 55 – 58.
39. Herles F, Vancura A. A research on the cause of a characteristic ‘‘wave’’ on the polarographic curve of human serum. Bull int Acad Sci Boheme 1932; 33 : 119 – 120.
40. Heyrovsky J, Babicka J. Polarographic studies with the dropping mercury cathode. Part XIII. The effect of albumins. Collect Czech Chem Commun 1930; 2 : 370.
41. Palecek E, Heyrovsky M, Janik B et al. From DC polarographic presodium wave of proteins to electrochemistry of biomacromolecules. Collect Czech Chem Commun 2009; 74(11 – 12): 1739 – 1755.
42. Kizek R, Vacek J, Trnkova L et al. Application of catalytic reactions on a mercury electrode for electrochemical detection of metallothioneins. Chem Listy 2004; 98(4): 166 – 173.
43. Ostatna V, Kuralay F, Trnkova L et al. Constant current chronopotentiometry and voltammetry of native and denatured serum albumin at mercury and carbon electrodes. Electroanalysis 2008; 20(13): 1406 – 1413.
44. Palecek E, Ostatna V, Masarik M et al. Changes in interfacial properties of alpha ‑ synuclein preceding its aggregation. Analyst 2008; 133(1): 76 – 84.
45. Bartosik M, Ostatna V, Palecek E. Electrochemistry of riboflavin‑binding protein and its interaction with riboflavin. Bioelectrochemistry 2009; 76(1 – 2): 70 – 75. doi: 10.1016/ j.bioelechem.2009.04.006.
46. Palecek E, Ostatna V, Cernocka H et al. Electrocatalytic monitoring of metal binding and mutation‑induced conformational changes in p53 at picomole level. J Am Chem Soc 2011; 133(18): 7190 – 7196. doi: 10.1021/ ja201006s.
47. Dorcak V, Palecek E. Electrochemical determination of thioredoxin redox states. Anal Chem 2009; 81(4): 1543 – 1548. doi: 10.1021/ ac802274p.
48. Kerman K, Morita Y, Takamura Y et al. Escherichia coli single‑strand binding protein‑DNA interactions on carbon nanotube ‑ modified electrodes from a label‑free electrochemical hybridization sensor. Anal Bioanal Chem 2005; 381(6): 1114 – 1121.
49. Kerman K, Vestergaard M, Chikae M et al. Label‑free electrochemical detection of the phosphorylated and non‑phosphorylated forms of peptides based on tyrosine oxidation. Electrochem Commun 2007; 9(5): 976 – 980.
50. Zatloukalova M, Orolinova E, Kubala M et al. Electrochemical determination of transmembrane protein Na+/ K+ – ATPase and Its cytoplasmic loop C45. Electroanalysis 2012; 24(8): 1758 – 1765.
51. Wang J, Rivas G, Cai XH et al. Trace measurements of insulin by potentiometric stripping analysis at carbon paste electrodes. Electroanalysis 1996; 8(10): 902 – 906.
52. Masarik M, Stobiecka A, Kizek R et al. Sensitive electrochemical detection of native and aggregated a ‑ synuclein protein involved in Parkinson‘s disease. Electroanalysis 2004; 16(13 – 14): 1172 – 1181.
53. Pei XM, Zhang B, Tang J et al. Sandwich‑type immunosensors and immunoassays exploiting nanostructure labels: A review. Anal Chim Acta 2013; 758 : 1 – 18. doi: 10.1016/ j.aca.2012.10.060.
54. Wan Y, Su Y, Zhu XH et al. Development of electrochemical immunosensors towards point of care diagnostics. Biosens Bioelectron 2013; 47 : 1 – 11. doi: 10.1016/ j.bios.2013.02.045.
55. Liu GD, Lin YH. Nanomaterial labels in electrochemical immunosensors and immunoassays. Talanta 2007; 74(3): 308 – 317. doi: 10.1016/ j.talanta.2007.10.014.
56. Dijksma M, Kamp B, Hoogvliet JC et al. Development of an electrochemical immunosensor for direct detection of interferon ‑ γ at the attomolar level. Anal Chem 2001; 73(5): 901 – 907.
57. Munge BS, Coffey AL, Doucette JM et al. Nanostructured immunosensor for attomolar detection of cancer biomarker interleukin‑8 using massively labeled superparamagnetic particles. Angew Chem Int Ed 2011; 50(34): 7915 – 7918. doi: 10.1002/ anie.201102941.
58. Hong P, Li WL, Li JM. Applications of aptasensors in clinical diagnostics. Sensors 2012; 12(2): 1181 – 1193. doi: 10.3390/ s120201181.
59. Mascini M, Palchetti I, Tombelli S. Nucleic acid and peptide aptamers: fundamentals and bioanalytical aspects. Angew Chem Int Ed 2012; 51(6): 1316 – 1332. doi: 10.1002/ anie.201006630.
60. Xu Y, Cheng GF, He PG et al. A review: electrochemical aptasensors with various detection strategies. Electroanalysis 2009; 21(11): 1251 – 1259.
61. Hianik T, Wang J. Electrochemical aptasensors – recent achievements and perspectives. Electroanalysis 2009; 21(11): 1223 – 1235.
62. Rusling JF, Kumar CV, Gutkind JS et al. Measurement of biomarker proteins for point ‑ of ‑ care early detection and monitoring of cancer. Analyst 2010; 135(10): 2496 – 2511. doi: 10.1039/ c0an00204f.
63. Chikkaveeraiah BV, Bhirde AA, Morgan NY et al. Electrochemical immunosensors for detection of cancer protein biomarkers. ACS Nano 2012; 6(8): 6546 – 6561. doi: 10.1021/ nn3023969.
64. Luo X, Davis JJ. Electrical biosensors and the label free detection of protein disease biomarkers. Chem Soc Rev 2013; 42(13): 5944 – 5962. doi: 10.1039/ c3cs60077g.
65. Rusling JF. Multiplexed electrochemical protein detection and translation to personalized cancer diagnostics. Anal Chem 2013; 85(11): 5304 – 5310. doi: 10.1021/ ac401058v.
66. Malhotra R, Patel V, Chikkaveeraiah BV et al. Ultrasensitive detection of cancer biomarkers in the clinic by use of a nanostructured microfluidic array. Anal Chem 2012; 84(14): 6249 – 6255. doi: 10.1021/ ac301392g.
67. Jelinek R, Kolusheva S. Carbohydrate biosensors. Chem Rev 2004; 104(12): 5987 – 6015.
68. Bertok T, Katrlik J, Gemeiner P et al. Electrochemical lectin based biosensors as a label‑free tool in glycomics. Microchim Acta 2013; 180(1 – 2): 1 – 13.
69. Strmecki S, Plavsic M, Cosovic B et al. Constant current chronopotentiometric stripping of sulphated polysaccharides. Electrochem Commun 2009; 11 : 2032 – 2035.
70. Palecek E, Rimankova L. Chitosan catalyzes hydrogen evolution at mercury electrodes. Electrochem Commun 2014. In press.
71. Palecek E, Trefulka M. Electrocatalytic detection of polysaccharides at picomolar concentrations. Analyst 2011; 136(2): 321 – 326. doi: 10.1039/ c0an00681e.
72. Trefulka M, Palecek E. Voltammetry of Os(VI) - modified polysaccharides at carbon electrodes. Electroanalysis 2009; 21(15): 1763 – 1766.
73. Yeo J, Park JY, Bae WJ et al. Label‑free electrochemical detection of the p53 core domain protein on its antibody immobilized electrode. Anal Chem 2009; 81(12): 4770 – 4777. doi: 10.1021/ ac900301h.
74. Zheng GF, Patolsky F, Cui Y et al. Multiplexed electrical detection of cancer markers with nanowire sensor arrays. Nat Biotechnol 2005; 23(10): 1294 – 1301.
75. Sezginturk MK, Uygun ZO. An impedimetric vascular endothelial growth factor biosensor‑based PAMAM/ cysteamine ‑ modified gold electrode for monitoring of tumor growth. Anal Biochem 2012; 423(2): 277 – 285. doi: 10.1016/ j.ab.2011.12.049.
76. Hou L, Cui Y, Xu M et al. Graphene oxide ‑ labeled sandwich‑type impedimetric immunoassay with sensitive enhancement based on enzymatic 4 - chloro‑1 - naphthol oxidation. Biosens Bioelectron 2013; 47 : 149 – 156. doi: 10.1016/ j.bios.2013.02.035.
77. Ertl P, Wagner M, Corton E et al. Rapid identification of viable Escherichia coli subspecies with an electrochemical screen ‑ printed biosensor array. Biosens Bioelectron 2003; 18(7): 907 – 916.
78. Ding L, Ji Q, Qian R et al. Lectin‑based nanoprobes functionalized with enzyme for highly sensitive electrochemical monitoring of dynamic carbohydrate expression on living cells. Anal Chem 2010; 82(4): 1292 – 1298. doi: 10.1021/ ac902285q.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2014 Číslo Supplementum- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Nejasný stín na plicích – kazuistika
- Jak souvisí postcovidový syndrom s poškozením mozku?
-
Všechny články tohoto čísla
- Analýza proteinů pomocí hmotnostní spektrometrie
- p‑ SRM, SWATH a HRM – cílené proteomické přístupy na hmotnostním spektrometru TripleTOF 5600+ a jejich aplikace v onkologickém výzkumu
- Analýza fosfoproteínov a signálnych dráh kvantitatívno‑ proteomickými metódami
- Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
- Současné trendy ve využívání PET radiofarmak k onkologické diagnostice
- „Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
- Vitamin D jako významný steroidní hormon u karcinomu prsu
- Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
- Soutěž o nejlepší práci
- Metody studia buněčné migrace a invazivity nádorových buněk
- Možnosti studia transendoteliální migrace in vitro
- Editorial
- Mechanizmy lékové rezistence a nádorové kmenové buňky
- Funkční testy pro detekci nádorových kmenových buněk
- Mikroprostředí nádoru – možnosti výzkumu v podmínkách in vitro
- Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
- Programovaná buněčná smrt v nádorových buňkách
- Metody pro studium protein‑proteinových a protein‑ligandových interakcí
- Detekce protein‑proteinových interakcí metodami FRET a BRET
- Detekce proteinů, proteinových interakcí a modifikací s využitím „proximity ligation assay“ in situ
- Exprese a purifikace proteinů
- Kvantitativní hmotnostní spektrometrie a její využití v onkologii
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Exprese a purifikace proteinů
- Metody studia buněčné migrace a invazivity nádorových buněk
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Analýza proteinů pomocí hmotnostní spektrometrie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



