-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Metody pro studium protein‑proteinových a protein‑ligandových interakcí
Methods for Analysis of Protein‑protein and Protein‑ligand Interactions
In order to maintain cellular homeostasis, cellular proteins coexist in complex and variable molecular assemblies. Therefore, understanding of major physiological processes at molecular level is based on analysis of protein‑protein interaction networks. Firstly, composition of the molecular assembly has to be qualitatively analyzed. In the next step, quantitative biochemical properties of the identified protein‑protein interactions are determined. Detailed information about the protein‑protein interaction interface can be obtained by crystallographic methods. Accordingly, the insight into the molecular architecture of these protein‑protein complexes allows us to rationally design new synthetic compounds that specifically influence various physiological or pathological processes by targeted modulation of protein interactions. This review is focused on description of the most used methods applied in both qualitative and quantitative analysis of protein‑protein interactions. Co ‑ immunoprecipitation and affinity co ‑ precipitation are basic methods designed for qualitative analysis of protein binding partners. Further biochemical analysis of the interaction requires definition of kinetic and thermodynamic parameters. Surface plasmon resonance (SPR) is used for description of affinity and kinetic profile of the interaction, fluorescence polarization (FP) method for fast determination of inhibition potential of inhibitors and isothermal titration calorimetry (ITC) for definition of thermodynamic parameters of the interaction (∆G, ∆H and ∆S). Besides the importance of uncovering the molecular basis of protein interactions for basic research, the same methodological approaches open new possibilities in rational design of novel therapeutic agents.
Key words:
protein interaction networks – co ‑ immunoprecipitation – pull ‑ down analysis – surface plasmon resonance – fluorescence polarization – isothermal titration calorimetry
This work was supported by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/2.1.00/03.0101) and by MH CZ – DRO (MMCI, 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
31. 1. 2014Accepted:
10. 3. 2014
Autoři: M. Ďurech; F. Trčka; B. Vojtěšek; P. Müller
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno
Vyšlo v časopise: Klin Onkol 2014; 27(Supplementum): 75-81
Souhrn
K udržování buněčné homeostázy je nutné, aby buněčné proteiny vytvářely složité a dynamické molekulární komplexy. Proto je i vysvětlení základních fyziologických procesů na molekulární úrovni založeno na studiu protein‑proteinových interakcí. Nejdříve probíhá kvalitativní analýza proteinových komplexů. Následně jsou identifikované proteinové interakce kvantifikovány po biochemické stránce. Detailní informace o strukturní podstatě daných protein‑proteinových interakcí pak mohou být získány pomocí krystalografických metod. Náhled do uspořádání proteinových komplexů na molekulární úrovni umožňuje racionálně navrhovat nové syntetické látky, které cíleně ovlivňují proteinové interakce a tím i nejrůznější fyziologické nebo patologické procesy. Tato souhrnná práce je zaměřena na popis nejčastěji používaných metod pro kvalitativní i kvantitativní hodnocení proteinových interakcí. Metody koimunoprecipitace (Co ‑ IP) a afinitní koprecipitace je možné využít jako prvotní nástroj pro identifikaci interakčních partnerů studovaného proteinu. Detailní biochemická analýza mezimolekulární interakce pak vyžaduje definování kinetických a termodynamických parametrů. Pro studium afinity dvou interakčních partnerů a kinetiky reakce je možné použít metodu rezonance povrchového plazmonu (surface plasmon resonance – SPR), pro studium afinity a inhibičního potenciálu inhibitorů metodu fluorescenční polarizace (FP) a pro detailní popis afinity a termodynamických parametrů interakce (∆G, ∆H a ∆S) metodu izotermální titrační kalorimetrie (isothermal titration calorimetry – ITC). Výzkum proteinových interakcí na molekulární úrovni je nejen významný pro základní výzkum, ale přináší i nové metodické přístupy, které otvírají další možnosti při racionálním navrhování nových terapeutických látek.
Klíčová slova:
mapy interakcí proteinů – koimunoprecipitace – afinitní koprecipitace – rezonance povrchového plazmonu – fluorescenční polarizace – izotermální titrační kalorimetrieÚvod
Základním zprostředkovatelem buněčných mezimolekulárních interakcí jsou proteiny. Schopnost proteinů vázat pevně a s vysokou specifitou ostatní molekuly jim umožňuje plnit široké spektrum funkcí. Enzymy katalyzují chemické reakce účastnící se metabolismu, replikace, opravy a transkripce DNA. Obdivuhodná je schopnost protonových pump (H+ - ATPáz) vytvářet elektrochemický gradient na plazmatické membráně translokací protonů přes membránu [1]. Některé enzymy kovalentně modifikují jiné proteiny přidáním nebo odebráním funkční skupiny. Rychlost reakce katalyzované enzymem je obrovská – v některých případech dochází až k 1017násobnému urychlení oproti nekatalyzované reakci (pro představivost 18 milisekund trvající reakce katalyzovaná orotát dekarboxylázou by trvala 78 milionů let bez přítomnosti enzymu) [2]. Velké množství proteinů je zapojeno také v procesech buněčné signalizace a transdukce signálu z vnějšího prostředí do nitra buňky. Transmembránové proteiny sloužící jako receptory na povrchu buněk mají schopnost selektivní interakce s extracelulárními signálními molekulami, důsledkem čehož dochází ke specifické odpovědi uvnitř buňky. Příkladem uvedené signalizace je přenos nervového signálu vyvolaný vazbou neurotransmiterů na membránové receptory neuronů. Pro buněčné rozpoznávání je důležitá vysoká specifita lektinů při interakci se sacharidovými strukturami na povrchu buněk [3]. Také uvnitř buňky dochází k nespočtu interakcí receptorů s menšími biomolekulami (ligandy). Vazbu kyslíku v erytrocytech umožňuje hemoglobin, pro adaptivní imunitní odpověď je důležitá interakce protilátek s antigenem. Další velkou skupinu tvoří strukturní proteiny poskytující buňkám strukturní oporu (cytoskeletální proteiny) nebo sloužící jako molekulární motory (myozin, kinezin, dynein) zodpovědné za buněčnou motilitu jednobuněčných organizmů, spermií a taky za kontrakci svalů.
Výše uvedené příklady interakcí se označují jako protein‑proteinové (PP) a protein‑ligandové (PL) interakce. Počet experimentálních metod pro detekci a analýzu PP a PL interakcí je v současnosti natolik vysoký, že jejich popis by přesahoval rozsah vyhrazený pro tuto problematiku. Cílem této práce se proto stává seznámit čtenáře s několika vybranými biochemickými metodami často používanými pro studium biomolekulárních interakcí.
Koimunoprecipitace (Co ‑ IP) a afinitní koprecipitace (pull ‑ down analýzy)
Koimunoprecipitace a afinitní koprecipitace patří mezi kvalitativní metody pro studium PP interakcí. Principem precipitačních metod je separace specifického proteinu a jeho interakčních partnerů na pevné fázi (nosiči). Vybraný protein je imobilizován na nosiči prostřednictvím kovalentní vazby, nebo pomocí specifických intermolekulárních interakcí (protein G – protilátka, glutation – glutation ‑ S ‑ transferáza, streptavidin – biotin, atd.). Základní podmínkou pro studium protein‑proteinových interakcí v komplexních směsích (buněčných lyzátech) je zachování nativní konformace a solubility studovaného proteinu. Z tohoto důvodu je u precipitačních metod kladen důraz na správnou volbu lyzačního pufru, jehož složení musí splňovat požadavky na zachování specifických interakcí a eliminaci nespecificky interagujících molekul. Pro správný výběr iontů je možné použít tzv. Hofmeisterovu řadu, ze které je možné vyčíst efekt různých iontů na stabilitu, agregaci a denaturaci proteinů [4].
K imunoprecipitaci studovaného proteinu a jeho interakčních partnerů jsou využívány protilátky imobilizované na pevný nosič (např. agarózovou matrici) prostřednictvím proteinů A nebo G, které váží Fc fragment protilátky (obr. 1A). K odstranění nespecificky vázaných a nenavázaných proteinů je provedeno několik promývacích kroků. Separované imunokomplexy jsou z nosiče následně uvolněny specifickou elucí, snížením pH nebo denaturačním činidlem (chaotropní látky), aby mohly být následně analyzovány. Elektroforéza a westernový přenos spojený s imunodetekcí je nejčastěji používanou metodou k detekci a kvantifikaci známých interagujících proteinů. Pro hledání dosud neznámých interakčních partnerů lze využít metody hmotnostní spektrometrie.
Obr. 1. Princip koimunoprecipitace (A) a afi nitní koprecipitace (B). A. Protein X spolu s jeho interakčními partnery (proteiny Ya a Yb) je navázán na specifickou protilátku (Ab). Vzniklý imunokomplex je ze směsi vychytán pomocí agarózových kuliček s imobilizovaným proteinem A, který rozeznává Fc fragment protilátek. B. Komplex tří proteinů (X, Ya, Yb) je vychytán ze směsi pomocí silné interakce proteinu GST (fúzovaného s proteinem X) a glutationu (GSH) imobilizovaného na agarózových kuličkách. 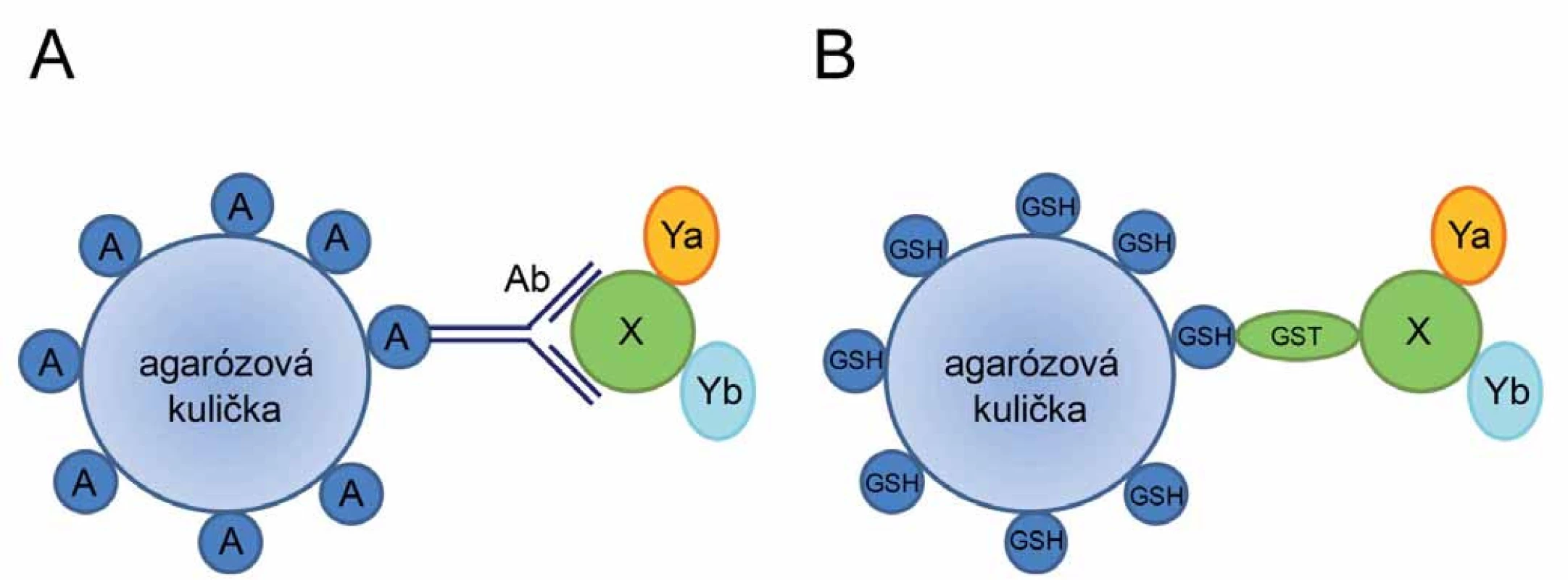
Afinitní koprecipitace se od koimunoprecipitace liší pouze ve způsobu záchytu proteinových komplexů na pevném povrchu (např. agarózové matrici). Namísto systému protein A/ G – protilátka je analyzovaný protein vázán na povrch matrice prostřednictvím interakce krátké fúzované sekvence, tzv. afinitní značky, se specifickým ligandem imobilizovaným na povrchu matrice (obr. 1B). Různé typy afinitních značek a jejich interakčních partnerů jsou shrnuty v tab. 1. Na rozdíl od koimunoprecipitace, kde jsme schopni analyzovat studovaný protein in vivo v jeho přirozené endogenní koncentraci a stavu, metoda afinitní koprecipitace vyžaduje pro studium PP interakcí klonování a přenos cizorodé rekombinantní molekuly DNA do buněk za účelem exprese proteinu fúzovaného s afinitní značkou. Výhodou metody afinitní koprecipitace je ale možnost identifikovat i interakční partnery různých nízkomolekulárních ligandů (např. kofaktorů) po jejich kovalentní modifikaci afinitní značkou.
Tab. 1. Různé systémy afinitních značek a jejich interakčních partnerů využívané pro purifikaci proteinů nebo studium protein-proteinových interakcí (afinitní koprecipitaci). 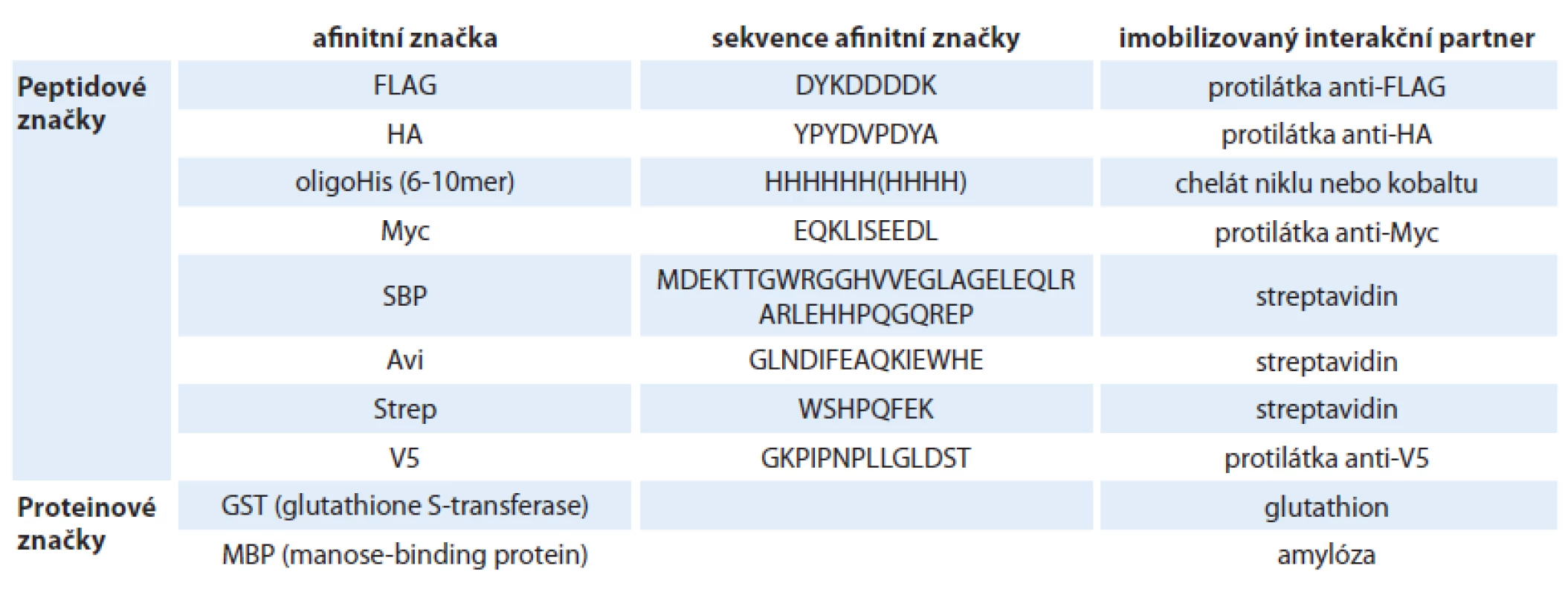
Cílem při charakterizaci PP a PL interakcí je nejenom kvalitativní hledání interakčních partnerů, ale i porozumění strukturní podstatě interakce a kvantitativní definování jejich kinetických a termodynamických parametrů. Pro studium afinity dvou interakčních partnerů a kinetiky reakce je možné použít metodu rezonance povrchového plazmonu (surface plasmon resonance – SPR), pro studium afinity a inhibičního potenciálu inhibitorů metodu fluorescenční polarizace (FP) a pro detailní popis afinity a termodynamických parametrů interakce (∆G, ∆H a ∆S) metodu izotermální titrační kalorimetrie (isothermal titration calorimetry – ITC).
Rezonance povrchového plazmonu (SPR)
Metoda rezonance povrchového plazmonu (surface plasmon resonance – SPR) je založena na optickém jevu rezonance povrchového plazmonu (obr. 2A), což je oscilace hustoty náboje na rozhraní kovu a dielektrika [5]. Fotony polarizovaného světla mohou interagovat s volnými elektrony kovové vrstvy, které se následně mění na vlny povrchového plazmonu. Toto pohlcení záření vede k redukci intenzity odraženého světla. Úhel, při kterém dochází k maximální redukci intenzity odraženého světla, se označuje jako rezonanční nebo SPR úhel. Rezonanční úhel závisí na indexu lomu prostředí na povrchu čipu.
Obr. 2. Princip metody rezonance povrchového plazmonu (A) a grafický výstup SPR experimentu, sensorgram (B). A. Jeden z interakčních partnerů je imobilizován na povrchu čipu a v roztoku proudícím kolem imobilizované molekuly je přítomen druhý interakční partner. Změna indexu lomu na povrchu čipu způsobená jejich vzájemnou interakcí je zaznamenána jako posun SPR úhlu. B. Výstup SPR experimentu zobrazuje vazbu interakčních partnerů na povrchu čipu. V prvním kroku (asociace) dochází k vazbě interakčního partnera přítomného v roztoku na partnera imobilizovaného na povrchu čipu až do stavu saturace. Následná disociace je způsobená použitím reakčního pufru. Dochází k ustálení dynamické rovnováhy interakce závislé na afinitě interakčních partnerů. Užitím regeneračního pufru ve třetím kroku je čip regenerován a připraven k dalšímu použití. Převzato ze semináře BIAcore<sup>®</sup> [10]. ![Princip metody rezonance povrchového plazmonu (A) a grafický výstup SPR experimentu, sensorgram (B).
A. Jeden z interakčních partnerů je imobilizován na povrchu čipu a v roztoku proudícím kolem imobilizované molekuly je přítomen druhý interakční partner. Změna indexu lomu na povrchu čipu způsobená jejich vzájemnou interakcí je zaznamenána jako posun SPR úhlu. B. Výstup SPR experimentu zobrazuje vazbu interakčních partnerů na povrchu čipu. V prvním kroku (asociace) dochází k vazbě interakčního partnera přítomného v roztoku na partnera imobilizovaného na povrchu čipu až do stavu saturace. Následná disociace je způsobená použitím reakčního pufru. Dochází k ustálení dynamické rovnováhy interakce závislé na afinitě interakčních partnerů. Užitím regeneračního pufru ve třetím kroku je čip regenerován a připraven k dalšímu použití. Převzato ze semináře BIAcore<sup>®</sup> [10].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a1ed436162c457bb621a4a4999df6f61.jpg)
Při vlastním experimentu je jeden z interakčních partnerů imobilizován na povrchu čipu [6]. V roztoku proudícím konstantní rychlostí kolem imobilizované molekuly je přítomen druhý interakční partner. Změna indexu lomu na povrchu čipu způsobená interakcí těchto dvou interakčních partnerů je zaznamenána jako posun rezonančního úhlu vyjádřený v tzv. rezonančních jednotkách (resonance units – RU). Kontinuální záznam změny RU jako funkce času se nazývá sensorgram a na jeho průběhu lze sledovat asociační a disociační fázi interakce (obr. 2B). Z průběhu asociační fáze lze vypočítat rychlostní konstantu asociace ka, naopak z průběhu fáze disociační rychlostní konstantu disociace kd. Poměr kd/ka pak definuje rovnovážnou disociační konstantu KD. Metodou SPR je proto možné měřit afinitu [7] i kinetiku interakce [8] v reálném čase. Ve speciálních případech byla tato metoda dokonce využita i pro měření termodynamických parametrů interakce [9].
Fluorescenční polarizace (FP)
Předpokladem pro měření parametrů interakce pomocí FP je označení jednoho z interakčních partnerů fluorescenční značkou (fluoroforem). Molekula fluoroforu je ozářena lineárně polarizovaným světlem (obr. 3A), čímž dojde k její excitaci a následné emisi zčásti depolarizovaného světla [11]. Depolarizace světla je způsobena enormní rotací fluoroforu v čase mezi excitací a emisí. Obecně platí, že stupeň polarizace fluorescence je nepřímo úměrný rotaci fluoroforu v roztoku [12]. Při interakci dvou interakčních partnerů, ze kterých je jeden označen fluoroforem, dochází v důsledku větší velikosti komplexu (V) ke zpomalení rotace fluoroforu a následně ke zvýšení hodnoty polarizace emitovaného světla podle vztahu:
hodnota polarizace
kde η je viskozita,V je velikost komplexu s navázaným fluoroforem,R je univerzální plynová konstanta a T je absolutní teplota. Kvantitativně je hodnota polarizace emitovaného světla získaná měřením intenzity emitovaného světla ve dvou na sebe kolmých rovinách a vypočítaná podle následující rovnice:
hodnota polarizace
kde I je intenzita emitovaného světla v rovině rovnoběžné s rovinou excitačního světla a I⊥ je intenzita emitovaného světla v rovině kolmé na rovinu excitačního světla.
V praxi je možné metodu FP využít pro měření afinity dvou interakčních partnerů [14], nebo také inhibičního potenciálu různých inhibitorů [15,16]. Na rozdíl od metody SPR umožňuje FP měřit interakci bez nutnosti imobilizace, proto získaná hodnota KD je vypočítaná ze skutečných koncentrací interakčních partnerů v roztoku. Na druhé straně měření FP vyžaduje značení interakčního partnera molekulou fluoroforu, která může ovlivnit hodnotu KD interakce. Měření FP většinou probíhá na 96 - nebo 384 - jamkových deskách. Při měření disociační konstanty KD je interakční partner značený fluoroforem titrován vzrůstající koncentrací druhého interakčního partnera. Z výsledné křivky se odečítá hodnota KD, která odpovídá hodnotě koncentrace neznačeného interakčního partnera v inflexním bodu titrační křivky (obr. 3B). Po definování disociační konstanty interakce dvou interakčních partnerů je možné studovat také zapojení třetího interakčního partnera (např. inhibitoru), který kompetuje (soupeří) o vazbu a vytěsňuje jednoho z interakčních partnerů. V praxi se pak fluoroforem značený ligand smíchá s proteinem o konstantní koncentraci a titruje se vzrůstající koncentrací inhibitoru. Z hodnoty koncentrace inhibitoru v inflexním bodu titrační křivky lze odečíst hodnotu IC50, která odpovídá koncentraci inhibitoru schopné inhibovat 50 % vazby daného ligandu na protein (obr. 3C). Hodnota IC50 závisí na koncentraci proteinu a fluoroforem značeného ligandu použitého pro měření FP a taky na KD jejich interakce [17]. Proto není možné porovnat hodnoty IC50pro stejný inhibitor získané při jiných experimentálních podmínkách. Hodnota IC50 se tedy převádí na hodnotu inhibiční konstanty Ki, kterou lze jednoznačně definovat inhibiční potenciál inhibitoru nezávisle na podmínkách měření FP. Propočet IC50 na Ki řeší různé formy Cheng ‑ Prusoffove rovnice [18,19]. V současné době je možné pro propočet použít některou z aplikací volně dostupných na internetu [20].
Obr. 3. Princip metody fluorescenční polarizace (A), měření interakce proteinu s ligandem (B) a inhibice interakce proteinu s ligandem (C) metodou FP. A. Fluoroforem značený ligand (L) je ozářen lineárně polarizovaným světlem. V důsledku jeho vysoké rotace dochází k emisi depolarizovaného světla a k naměření nízké hodnoty fluorescenční polarizace. Interakce ligandu s větší molekulou (proteinem) způsobí zpomalení jeho rotace a emisi polarizovaného světla. Převzato z [13]. B. Titrace fluoroforem značeného ligandu o konstantní koncentraci vzrůstající koncentrací proteinu. C. Měření IC50 inhibitoru protein-ligandové interakce. Směs proteinu a fluoroforem značeného ligandu byla titrována vzrůstající koncentrací inhibitoru. ![Princip metody fluorescenční polarizace (A), měření interakce proteinu s ligandem (B) a inhibice interakce proteinu s ligandem (C) metodou FP.
A. Fluoroforem značený ligand (L) je ozářen lineárně polarizovaným světlem. V důsledku jeho vysoké rotace dochází k emisi depolarizovaného světla a k naměření nízké hodnoty fluorescenční polarizace. Interakce ligandu s větší molekulou (proteinem) způsobí zpomalení jeho rotace a emisi polarizovaného světla. Převzato z [13]. B. Titrace fluoroforem značeného ligandu o konstantní koncentraci vzrůstající koncentrací proteinu. C. Měření IC50 inhibitoru protein-ligandové interakce. Směs proteinu a fluoroforem značeného ligandu byla titrována vzrůstající koncentrací inhibitoru.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/494cef6a5f6d55eb63cbbf9e6f235fb6.jpg)
Izotermální titrační kalorimetrie (ITC)
Izotermální titrační kalorimetrie (isothermal titration calorimetry – ITC) patří mezi metody pro měření termodynamických parametrů interakce dvou interakčních partnerů. Tato metoda vychází z pozorování, že při interakci dvou látek dochází k absorpci nebo k uvolnění tepla [21]. Měřením tohoto tepla je pak možné přesně určit vazebnou konstantu (KD), stechiometrii interakce (n), entalpii (∆H) a entropický příspěvek ( – T∆S) a definovat tak kompletní termodynamický profil interakce bez nutnosti značení.
Kalorimetry používané pro analýzu biomolekul obsahují dvě identické cely, v jedné probíhá interakce (vzorková cela) a druhá slouží jako referenční cela [22]. Obě cely jsou umístěny v adiabatickém plášti a temperovány na stejnou teplotu (obr. 4A). Zkoumaná molekula je pomocí injektoru postupně dávkována do cely se vzorkem za současného měření tepelného rozdílu oproti referenční cele.
Obr. 4. Schematické znázornění přístroje MicroCal<sup>®</sup> (A). Teplo uvolněné při interakci dvou interakčních partnerů je zaznamenáno jako funkce času (B) a po integraci jako závislost entalpie na molárním poměru interakčních partnerů (C). Z výsledního grafu je možné přímo definovat hodnoty změny entalpie, asociační konstantu i stechiometrii interakce. Převzato z manuálu GE Healthcare [23]. ![Schematické znázornění přístroje MicroCal<sup>®</sup> (A).
Teplo uvolněné při interakci dvou interakčních partnerů je zaznamenáno jako funkce času (B) a po integraci jako závislost entalpie na molárním poměru interakčních partnerů (C). Z výsledního grafu je možné přímo definovat hodnoty změny entalpie, asociační konstantu i stechiometrii interakce. Převzato z manuálu GE Healthcare [23].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/4b2e5e0cf5246c686e700ffb46ce264a.jpg)
V případě, že pozorovaná reakce je exotermická (teplo se uvolňuje), bude potřebné dodat vzorkové cele méně tepla k udržení tepelné rovnováhy s referenční celou. Tato změna tepla je měřena a zaznamenána v grafu jako funkce času (obr. 4B) a po integraci jako závislost entalpie na molárním poměru mezi interakčními partnery (obr. 4C). Z grafu na obr. 4C je možné přímo určit hodnotu asociační konstanty (KA), entalpie (∆H) a stechiometrii interakce (n). Pokud během interakce nedochází k jiným entalpickým změnám, lze celkovou změnu volné energie interakce (∆G) a entropický příspěvek interakce ( – T∆S) vyjádřit pomocí následujícího vztahu:
∆G = ∆H – T∆S = – RT lnKA ,
kde T je absolutní teplota a R je univerzální plynová konstanta.
Závěr
Problematika protein‑proteinových a protein‑ligandových interakcí se v poslední době těší stále většímu zájmu vědeckých skupin z nejrůznějších vědeckých oborů od informatiky až po farmakologii. K důkladnému porozumění fungování organizmu jako celku i buněk samotných je totiž popis mezimolekulárních interakcí naprosto klíčový. V současnosti představují nízkomolekulární inhibitory PP a PL interakcí nejčastější strategii v boji proti nejrůznějším chorobám. Tato práce byla proto věnována metodám, kterými je možno problematiku PP a PL interakcí studovat. K hledání interakčních partnerů je možné použít metody koimunoprecipitace nebo afinitní koprecipitace, ke studiu kinetiky interakce metodu SPR, ke studiu inhibičního potenciálu inhibitorů metodu FP a k popisu termodynamických parametrů metodu ITC. Dalším krokem studia PP a PL interakcí je přímý náhled do atomární struktury (např. metodami rentgenové difrakce nebo NMR spektroskopie). Poznání atomární podstaty interakce nám dává možnost porozumět této interakci na úrovni fyzikálních sil, které jsou za interakci odpovědné a přenést tak studium interakcí z úrovně experimentální do úrovně teoretické. Toho se pak využívá při sestavování algoritmů pro simulační programy v oboru počítačového modelování, které zažívá v posledních letech nevídaný rozvoj. Virtuální screening knihovny několika miliónů nízkomolekulárních látek je často prvním krokem při hledání možných inhibitorů potenciálního terapeutického cíle (často proteinu). Experimentální a teoretické přístupy ke studiu mezimolekulárních interakcí jdou v současnosti ruku v ruce a společně napomáhají k porozumění fungování organizmu i buňky jako takové.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101) a MZ ČR – RVO (MOÚ, 00209805).
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Petr Müller, Ph.D.
Regionální centrum aplikované molekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: muller@mou.cz
Obdrženo: 31. 1. 2014
Přijato: 10. 3. 2014
Zdroje
1. Auer M, Scarborough GA, Kuhlbrandt W. Three ‑ dimensional map of the plasma membrane H+–ATPase in the open conformation. Nature 1998; 392(6678): 840 – 843.
2. Radzicka A, Wolfenden R. A proficient enzyme. Science 1995; 267(5194): 90 – 93.
3. Rudiger H, Siebert HC, Solis D et al. Medicinal chemistry based on the sugar code: fundamentals of lectinology and experimental strategies with lectins as targets. Curr Med Chem 2000; 7(4): 389 – 416.
4. Zhang Y, Cremer PS. Interactions between macromolecules and ions: the hofmeister series. Curr Opin Chem Biol 2006; 10(6): 658 – 663.
5. Buijs J, Franklin GC. SPR ‑ MS in functional proteomics. Brief Funct Genomic Proteomic 2005; 4(1): 39 – 47.
6. Torreri P, Ceccarini M, Macioce P et al. Biomolecular interactions by surface plasmon resonance technology. Ann Ist Super Sanita 2005; 41(4): 437 – 441.
7. Myszka DG, Jonsen MD, Graves BJ. Equilibrium analysis of high affinity interactions using BIACORE. Anal Biochem 1998; 265(2): 326 – 330.
8. Morton TA, Myszka DG. Kinetic analysis of macromolecular interactions using surface plasmon resonance biosensors. Methods Enzymol 1998; 295 : 268 – 294.
9. Roos H, Karlsson R, Nilshans H et al. Thermodynamic analysis of protein interactions with biosensor technology. J Mol Recognit 1998; 11(1 – 6): 204 – 210.
10. Protein.iastate.edu [homepage on the Internet]. The Protein Facility of the Iowa State University Office of Biotechnology. BIACore seminar. Available from: http:/ / www.proteomics.iastate.edu/ seminars/ BIACore/ index.html.
11. Jameson DM, Croney JC. Fluorescence polarization: past, present and future. Comb Chem High Throughput Screen 2003; 6(3): 167 – 173.
12. Perrin F. Polarisation de la lumière de fluorescence. Vie moyenne des molécules dans l‘etat excité. J Phys 1926; 7(12): 390 – 401.
13. Hi ‑ techsci.com [homepage on the Internet]. Homepage of TgK Scientific Ltd. Available from: http:/ / www.hi ‑ techsci.com/ techniques/ anisotropy/ .
14. Williamson DS, Borgognoni J, Clay A et al. Novel adenosine ‑ derived inhibitors of 70 kDa heat shock protein, discovered through structure‑based design. J Med Chem 2009; 52(6): 1510 – 1513. doi: 10.1021/ jm801627a.
15. Bolger R, Wiese TE, Ervin K et al. Rapid screening of environmental chemicals for estrogen receptor binding capacity. Environ Health Perspect 1998; 106(9): 551 – 557.
16. Kim J, Felts S, Llauger L et al. Development of a fluorescence polarization assay for the molecular chaperone Hsp90. J Biomol Screen 2004; 9(5): 375 – 381.
17. Cer RZ, Mudunuri U, Stephens R et al. IC50 - to ‑ Ki: a web‑based tool for converting IC50 to Ki values for inhibitors of enzyme activity and ligand binding. Nucleic Acids Res 2009; 37(web server issue): W441 – W445. doi: 10.1093/ nar/ gkp253.
18. Cheng Y, Prusoff WH. Relationship between the inhibition constant (K1) and the concentration of inhibitor which causes 50 per cent inhibition (I50) of an enzymatic reaction. Biochem Pharmacol 1973; 22(23): 3099 – 3108.
19. Munson PJ, Rodbard D. An exact correction to the „cheng ‑ prusoff“ correction. J Recept Res 1988; 8(1 – 4): 533 – 546.
20. Sw16.im.med.umich.edu [homepage on the Internet]. Homepage of professor Shaomeng Wang. University of Michigan. Available from: http:/ / sw16.im.med.umich.edu/ software/ calc_ki/ .
21. Wiseman T, Williston S, Brandts JF et al. Rapid measurement of binding constants and heats of binding using a new titration calorimeter. Anal Biochem 1989; 179(1): 131 – 137.
22. Freyer MW, Lewis EA. Isothermal titration calorimetry: experimental design, data analysis, and probing macromolecule/ ligand binding and kinetic interactions. Methods Cell Biol 2008; 84 : 79 – 113.
23. Milev S. Isothermal titration calorimetry: Principles and experimental design. GE Healthcare manual. Available from: http:/ / bcmp.med.harvard.edu/ sites/ bcmp.med.harvard.edu/ files/ facilities/ ITC200%20training_pdf.pdf.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2014 Číslo Supplementum- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Analýza proteinů pomocí hmotnostní spektrometrie
- p‑ SRM, SWATH a HRM – cílené proteomické přístupy na hmotnostním spektrometru TripleTOF 5600+ a jejich aplikace v onkologickém výzkumu
- Analýza fosfoproteínov a signálnych dráh kvantitatívno‑ proteomickými metódami
- Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
- Současné trendy ve využívání PET radiofarmak k onkologické diagnostice
- „Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
- Vitamin D jako významný steroidní hormon u karcinomu prsu
- Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
- Soutěž o nejlepší práci
- Metody studia buněčné migrace a invazivity nádorových buněk
- Možnosti studia transendoteliální migrace in vitro
- Editorial
- Mechanizmy lékové rezistence a nádorové kmenové buňky
- Funkční testy pro detekci nádorových kmenových buněk
- Mikroprostředí nádoru – možnosti výzkumu v podmínkách in vitro
- Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
- Programovaná buněčná smrt v nádorových buňkách
- Metody pro studium protein‑proteinových a protein‑ligandových interakcí
- Detekce protein‑proteinových interakcí metodami FRET a BRET
- Detekce proteinů, proteinových interakcí a modifikací s využitím „proximity ligation assay“ in situ
- Exprese a purifikace proteinů
- Kvantitativní hmotnostní spektrometrie a její využití v onkologii
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Exprese a purifikace proteinů
- Metody studia buněčné migrace a invazivity nádorových buněk
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Analýza proteinů pomocí hmotnostní spektrometrie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání





