-
Články
Top novinky
Reklama- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
Top novinky
Reklama- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Top novinky
ReklamaSoučasné trendy ve využívání PET radiofarmak k onkologické diagnostice
Current Trends in Using PET Radiopharmaceuticals for Diagnostics in Oncology
Nuclear medicine is an important field of modern medicine, particularly thanks to its role in in vivo imaging of important processes in human organism. This is possible thanks to the use of radiopharmaceuticals, specific substances labeled by radioactive nuclide, its distribution in the body can be visualized by specialized scanners and, based on the knowledge of physiological patterns, diagnosis can be determined. Positron emission tomography (PET) is a modern and in many ways indispensable method of nuclear medicine. The spectrum of radiopharmaceuticals available in recent years is broadening thanks to a coordinated effort of manufacturers of synthesis equipment, chemists and potential users – physicians. This review focuses on the development in the PET radiopharmaceutical field in the last five years, with an emphasis on oncological applications of PET.
Key words:
nuclear medicine – positron-emission tomography – radiopharmaceuticals – gallium-68 – carbon-11 – fluorine-18 – zirconium-89
This work was supported by the European Regional Development Fund and the State Budget of the Czech Republic (RECAMO, CZ.1.05/2.1.00/03.0101) and by MH CZ – DRO (MMCI, 00209805).
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.Submitted:
3. 2. 2014Accepted:
3. 4. 2014
Autoři: Ing. Jan Adam 1,2; J. Kadeřávek 2; F. Kužel 2; J. Vašina 3; Z. Řehák 1,3
Působiště autorů: Regionální centrum aplikované molekulární onkologie, Masarykův onkologický ústav, Brno 1; ÚJV Řež, a. s., Husinec‑ Řež 2; Oddělení nukleární medicíny, Masarykův onkologický ústav, Brno 3
Vyšlo v časopise: Klin Onkol 2014; 27(Supplementum): 129-136
Souhrn
Nukleární medicína je důležitým oborem moderní medicíny, zejména díky své roli v in vivo zobrazování důležitých procesů v lidském organizmu. Toto je možné prostřednictvím využití radiofarmak, specifických látek značených radioaktivním nuklidem, jejichž distribuci v těle lze vizualizovat pomocí speciálních skenerů a na základě fyziologických zákonitostí interpretovat diagnózu. Pozitronová emisní tomografie (PET) je moderní a v mnoha směrech nepostradatelná metoda nukleární medicíny. Spektrum radiofarmak pro tuto metodu dostupných se v posledních letech zvyšuje díky koordinované snaze výrobců syntézních zařízení, chemiků i potenciálních uživatelů – lékařů. Článek se formou přehledového článku zabývá vývojem na poli PET radiofarmak v posledních pěti letech s ohledem na onkologické aplikace PET.
Klíčová slova:
nukleární lékařství – pozitronová emisní tomografie – radiofarmaka – gallium-68 – uhlík-11 – fluor-18 – zirkonium-89Úvod
Pozitronová emisní tomografie (PET) je jedna z nejmodernějších metod molekulárního zobrazování, neinvazivní in vivo metoda umožňující lékařům studovat procesy v lidském těle prostřednictvím radioaktivně značených radiofarmak a velmi přesně tak diagnostikovat rozličné poruchy a neobvyklé úkazy. V kombinaci s výpočetní tomografií (CT) patří již přes 10 let ke stěžejním zobrazovacím metodám nejen onkologické diagnostiky. PET je nikoli pouze v onkologických aplikacích metoda s velmi příznivým poměrem ceny a efektivity, přispívá jak ke stanovení nebo určení diagnóz, tak i k vyhodnocování vhodnosti terapie či odezvy na léčbu, je důležitý faktor pro koncept takzvané personalizované medicíny. Vyniká především na poli určování metabolické aktivity nádorů, zhodnocení proliferace, vyhodnocení hypoxie tkáně, zejména nádorové, a posouzení hustoty receptorů exprimovaných v buňkách. Hnací silou metody PET je bezesporu [18F]fluordeoxyglukóza (FDG), metabolický marker, díky němuž je možno v těle identifikovat místa s nepřirozeně zvýšenou či naopak sníženou metabolickou aktivitou. FDG PET je v současnosti prakticky nenahraditelná diagnostická metoda pro detekci primárních tumorů a metastáz [1 – 4]. FDG nicméně trpí určitou nespecifičností – zvýšený příjem vykazují také např. místa s probíhajícím zánětlivým procesem, někdy je její příjem vyšší v hypoxických oblastech, některé orgány mají přirozeně vyšší příjem energie, atd. Na jedné straně je vysoce citlivá pro lokalizaci lézí, na druhé straně nemusí být nalezené místo s vyšším příjmem vždy tumorem. Omezena je i její schopnost posoudit odezvu na léčbu – nemusí odlišit hojící se tkáň od viabilního, proliferujícího nádoru. I to je důvod, proč byla za posledních 20 let vyvíjena jiná, specifičtější radiofarmaka, která širokospektrálnosti glukózy sice nedosahují, přesto se hodí lépe pro některé specifičtější aplikace. Vhodnou volbou značené látky lze monitorovat prakticky jakýkoli z hlediska onkologického pacienta zajímavý děj v organizmu. Při vývoji nových radiofarmak je však zapotřebí uvážit mnoho dílčích faktorů – vhodně zvolit radionuklid s ohledem na chemizmus látky, její farmakokinetiku, biologické chování, poločas interakce, ale také s ohledem na snadnost a výtěžek syntézy či dostupnost prekurzoru. Těžiště PET radiofarmak spočívalo a spočívat i nadále bude ve značení fluorem ‑ 18 a v menší míře také uhlíkem ‑ 11. Pokrok na poli syntézní a separační instrumentace ovšem otevírá čím dál více dveře značení pomocí kovových a jiných rozměrnějších iontů, např. mědi ‑ 64 (t1/ 2 = 12 h), jodu ‑ 124 (t1/ 2 = 100,32 h), gallia ‑ 68 (t1/ 2 = 68 min) či zirkonia ‑ 89 (t1/ 2 = 78 h). Obecně lze říci, že čím delší je poločas přeměny určitého nuklidu, tím vhodnější je pro značení větších molekul – fluor, gallium a měď se tudíž uplatní u nízkomolekulárních látek, max. peptidů, zatímco zirkonium či jod jsou vhodné i pro značení fragmentů protilátek anebo protilátek.
V roce 2007 bylo v areálu Masarykova onkologického ústavu (MOÚ) uvedeno do provozu druhé produkční PET centrum ÚJV Řež, a. s. Ve spolupráci odborníků z MOÚ a ÚJV byla posléze vyvinuta a implementována metoda syntézy radiofarmaka [11C]metionin, markeru proteosyntézy vhodného zejména pro vizualizaci mozkových nádorů. V současnosti je tato látka v probíhajícím klinickém hodnocení prováděném na Oddělení nukleární medicíny MOÚ. Výzkumná spolupráce se průběžně rozšiřuje i na další PET radiofarmaka. V souvislosti se spoluprací byl v roce 2009 publikován krátký review článek o možnostech metody PET [5]. V následujícím textu bude zhodnocen vývoj na poli PET radiofarmak z hlediska dostupnosti, zdokonalení syntézní instrumentace a dalších.
[11C] - radiofarmaka
Uhlík-11 (11C) má poločas přeměny 20 minut. Radiofarmaka značená 11C jsou ve vědecké obci často ne zcela korektně chápána jako čistě výzkumná. K tomuto postoji nicméně existuje opodstatněný důvod – díky krátkému poločasu je jejich využití možné výlučně v takových zařízeních, která disponují jak výrobní, tak zobrazovací technikou víceméně na jednom místě – transportovatelnost takového radiofarmaka je v řádu jednotek kilometrů, tedy jednoho města. V zahraničí umožňuje smysluplné využití [11C] - radiofarmak poměrně časté uspořádání, kdy (většinou univerzitní) nemocnice vlastní také cyklotronové centrum, díky kterému mohou provádět in‑house produkci a využívat radiofarmaka bez jeho nákladné registrace. Vzhledem k drasticky omezeným možnostem komercializace nemají komerční výrobci radiofarmak většinou ani zájem do jejich registrace investovat. Na poli dostupnosti [11C] - radiofarmak proto žádné zásadní novinky v posledních pěti letech nevzešly, onkologické aplikace využívají [11C]cholin [6 – 8] coby marker proliferace (stavební materiál pro nové biomembrány), který vykazuje v určitých směrech lepší vlastnosti než fluorovaný derivát cholinu, již zmíněný [11C]metionin jako marker proteosyntézy [9,10], a konečně [11C]acetát, marker oxidativního metabolizmu s aplikacemi také v kardiologii [11 – 14]. Pravděpodobně nejpoužívanějším [11C] - radiofarmakem je neonkologický marker [11C]PiB, první radiofarmakum (a první in vivo metoda vůbec), kterým je možno vizualizovat β ‑ amyloidové depozity v mozku a tím posuzovat stav pacientů s Alzheimerovou demencí [15,16].
[18F] - radiofarmaka
U radiofarmak značených fluorem ‑ 18 je situace podstatně jiná. Díky poločasu přeměny 18F, který činí 109 minut, je možno takováto radiofarmaka distribuovat i do vzdálenějších lokací, což podstatně zvyšuje jejich komerční uplatnění a rentabilitu nákladů investovaných do jejich vývoje, zavedení výroby a registrace. Mezi výhody fluordeoxyglukózy mimo již uvedených chemických, biochemických a farmakokinetických vlastností patří také velice propracovaná a odladěná technologie syntézy, dosahující vysokého výtěžku a vysoké čistoty výsledného produktu. Toho bylo možno dosáhnout díky specializovaným, robustním syntézním modulům ušitým na míru právě této syntéze (obr. 1). Vývoj modulů specializovaných na FDG byl vzhledem k poptávce opět finančně snadno odůvodnitelný. U ostatních fluorovaných radiofarmak pak chybělo jednoznačné finanční incentivum pro zavádění do výroby a registraci (poptávka bude vždy výrazně menší). Důvodů bylo několik – syntéza vyžadovala prakticky radiofarmakum od radiofarmaka více či méně složité modifikace komerčně dostupných modulů, což výrazně snižovalo jejich flexibilitu při úmyslu vyrábět více různých radiofarmak bez nutnosti pořizovat na každé další nákladný přístroj. Důsledkem toho pak mohly být problémy s režimem správné výrobní praxe (GMP) v případě úmyslu střídání více radiofarmak na jednom modulu, zejména díky nutnosti důkladného a náročného čištění za účelem zabránění kontaminaci mezi dvěma různými farmaky. Vyvinuté syntézy pak navíc často mívaly nízké výtěžky (5 – 20 % oproti 50 – 60 % u FDG).
Obr. 1. GE Tracerlab FX-FDG, syntézní modul pro přípravu [<sup>18</sup>F]fluordeoxyglukózy. ![GE Tracerlab FX-FDG, syntézní modul pro přípravu [<sup>18</sup>F]fluordeoxyglukózy.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/0cc88ffaefa7bd2ca9595b6a7deb67ff.jpg)
Situace se nicméně změnila s nástupem nové generace syntézních modulů pracujících na kazetovém či cartridgeovém způsobu. Moduly této generace využívají pouze nezbytné minimum součástí pevně usazených v těle modulu – pumpy, detektory, ovládání ventilů, pícky apod. Sama syntéza probíhá na víceméně jednorázové, vyjímatelné části modulu, většinou řešené plastovým rámem (kazetou), do které jsou vsazeny nádobky s reagenciemi, nutné spojovací kapiláry a reakční či sběrné nádobky. Modul takovéhoto uspořádání je při stejném či dokonce menším místě, které zaujímá, schopen vyrábět větší počet radiofarmak v závislosti na použité kazetě a spuštěném programu, je eliminována nutnost náročného čištění a tím mimo jiné usnadněno vyhovění požadavkům GMP. Výrobní místo vybavené modulem tohoto typu je lépe připraveno reagovat na měnící se poptávku. Jedním z prvních modulů tohoto typu byl TracerLab MX výrobce GE Healthcare, v současnosti moduly tohoto typu nabízí již několik výrobců – u GE je to např. další generace FASTLab, dále ModularLab ‑ PharmTracer výrobce Eckert & Ziegler, moduly Synthera výrobce IBA (obr. 2), moduly firmy Scintomics a další. Nástup těchto modulů byl významný faktor pro obecné zvýšení dostupnosti ne ‑ FDG fluorovaných radiofarmak.
Obr. 2. Kazetový syntézní modul IBA Synthera (zdroj: http://iba-industrial.com/synthera). 
V roce 2009 byly hlavními používanými fluorovanými PET radiofarmaky mimo fluordeoxyglukózu zejména proliferační marker [18F]fluor ‑ L ‑ thymidin [17 – 28] a [18F]fluorid sodný [29 – 35], druhý zvláště díky nástupu první techneciové krize, kdy nedostatek technecia způsobil sníženou dostupnost tradičního radiofarmaka pro vizualizaci skeletu (SPECT radiofarmakum [99mTc] - MDP). Následující roky zaznamenaly prudký vzestup zájmu o [18F]fluorcholin, radiofarmakum určené primárně pro diagnostiku karcinomu prostaty prostřednictvím zvýšeného příjmu této látky, eliminující hlavní nevýhody [18F]FDG pro toto použití – blízkost močového měchýře a malé rozměry cílového orgánu [36 – 39]. V tomto případě velmi napomohla syntéza vyvinutá na kazetovém systému GE TracerLab MX. Zastoupení PET vyšetření s pomocí jednotlivých radiofarmak v ČR v roce 2013 demonstruje obr. 3. V současnosti je fluorcholin hlavním PET radiofarmakem pro diagnostiku karcinomu prostaty a počet vyšetření s tímto radiofarmakem se v okolních zemích mezi fluorovanými radiofarmaky zařadil na druhé nejvyšší místo ihned za FDG. Tento trend je dobře patrný i z obr. 4, porovnávajícího počty aplikací PET radiofarmak jiných než FDG v ČR v letech 2011, 2012 a 2013. Jeho možnosti nejsou ovšem limitovány jen na karcinom prostaty, zprávy z nedávné doby naznačují potenciální další zajímavé aplikace [40,41]. Příklad kombinovaného vyšetření pomocí FDG a fluorcholinu ilustruje obr. 5.
Obr. 3. Počty aplikací jednotlivých PET radiofarmak v ČR v roce 2013 (zdroj: doc. MUDr. Otakar Bělohlávek, CSc., PET centrum, Nemocnice Na Homolce). 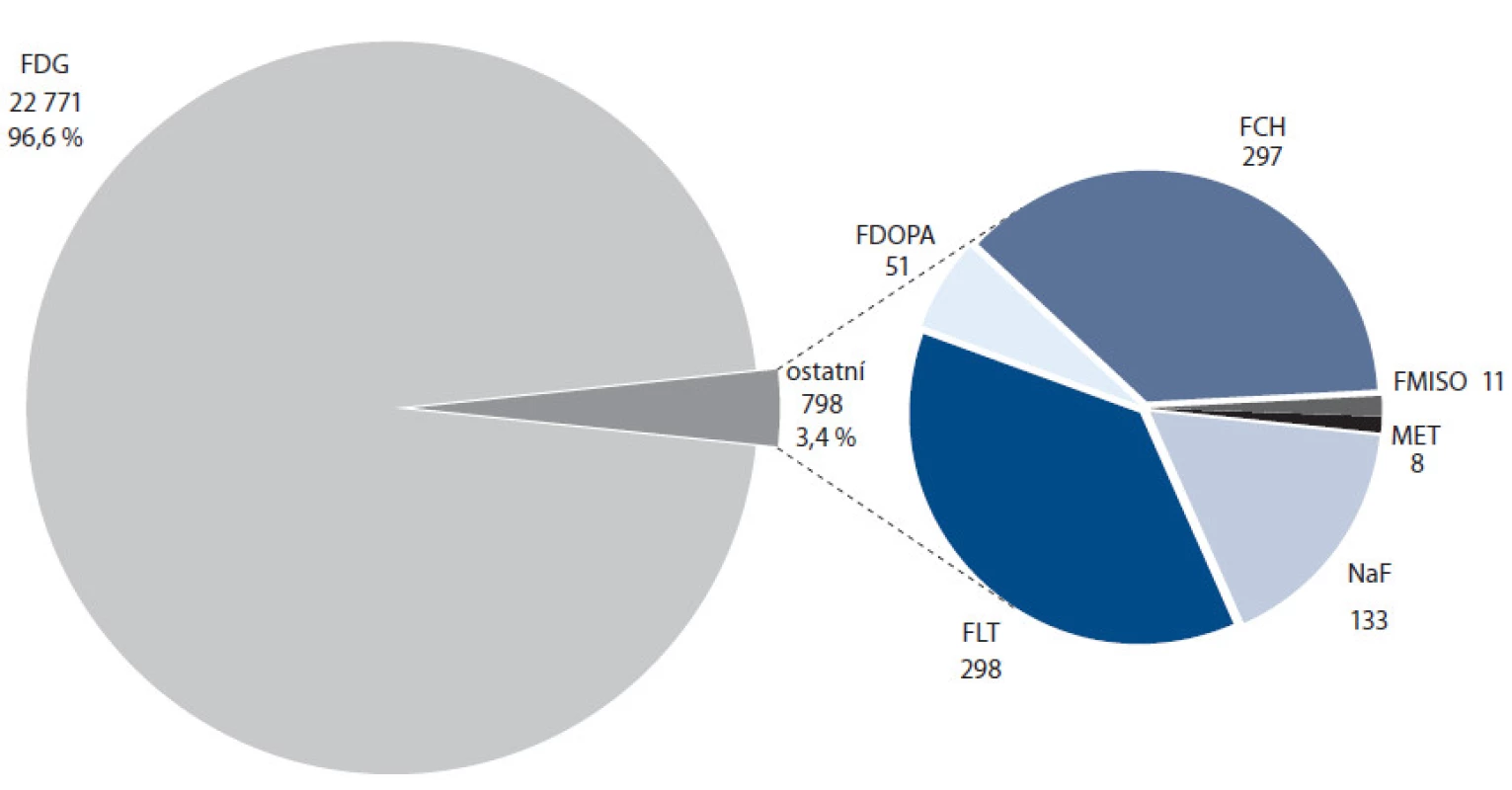
Obr. 4. Srovnání počtů aplikací jednotlivých PET radiofarmak vyjma FDG v ČR v letech 2011 (tmavě modrá), 2012 (šedá) a 2013 (světle modrá) (zdroj: doc. MUDr. Otakar Bělohlávek, CSc., PET centrum, Nemocnice Na Homolce). 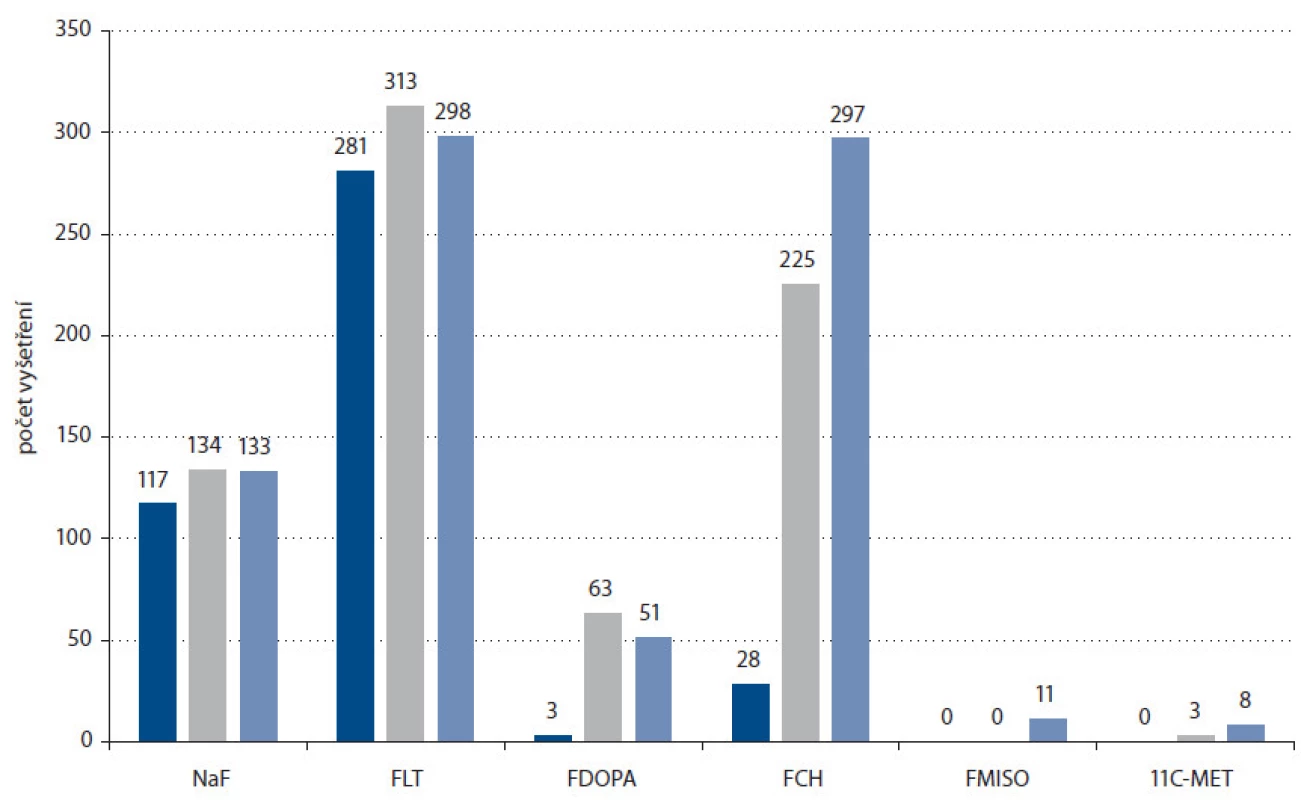
Obr. 5. Srovnání PET/CT vyšetření pomocí [<sup>18</sup>F]FDG (horní řada) a [<sup>18</sup>F]fluorocholinu (spodní řada) – zleva PET sken, CT sken a fúze – u stejného pacienta s duplicitou tumoru ledviny a karcinomu prostaty. Mediastinální lymfatické uzliny vykazují vysokou akumulaci FDG, nejsou však aktivní na vyšetření [<sup>18</sup>F]fl uorocholinu, s vysokou pravděpodobností tedy souvisí s nádorem ledviny a nikoliv s karcinomem prostaty. ![Srovnání PET/CT vyšetření pomocí [<sup>18</sup>F]FDG (horní řada) a [<sup>18</sup>F]fluorocholinu (spodní řada) – zleva PET sken, CT sken a fúze – u stejného pacienta s duplicitou tumoru ledviny a karcinomu prostaty. Mediastinální lymfatické uzliny vykazují vysokou akumulaci FDG, nejsou však aktivní na vyšetření [<sup>18</sup>F]fl uorocholinu, s vysokou pravděpodobností tedy souvisí s nádorem ledviny a nikoliv s karcinomem prostaty.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c27a8befa662873867f7cc42f49e3b86.jpg)
Nové možnosti syntéz na kazetových modulech přispěly ke stabilizaci situace u fluor ‑ L ‑ thymidinu, zásadní vzestup zaznamenaly zejména marker hypoxie [18F]fluormisonidazol (FMISO) [42 – 45] a [18F]fluoretyltyrosin (FET), látka vhodná pro vizualizaci nádorů mozku. Posledně zmíněný fluoretyltyrosin je podobně jako [11C]metionin příkladem radioaktivně značené aminokyseliny [46 – 48]. Aminokyseliny jsou díky zvýšenému metabolizmu tumorových buněk přijímány buňkami skrze energeticky nezávislý L ‑ aminokyselinový transportní systém a posléze metabolizovány nebo inkorporovány do proteinů. Využitím umělých, tedy nepřirozených L ‑ aminokyselin je možné dosáhnout situace, kdy není příjem následován relativně rychlou metabolizací a je tudíž dosaženo vysoké retence vhodné pro imaging. Jedním z produktů tohoto myšlenkového proudu je anti‑1 - amino ‑ 3 - [18F]fluorcyklobutan ‑ 1 - karboxylová kyselina, zkracována jako [18F]FACBC. Podobně jako fluoretyltyrosin vykazuje velmi zajímavé vlastnosti pro vizualizaci nádorů mozku, jeví se také velmi nadějně s ohledem na vizualizaci karcinomu prostaty, kde by mohla podle některých studií konkurovat fluorcholinu [49 – 51].
S návratem techneciové krize, která nastane v horizontu příštích několika let díky uzavření dvou reaktorů produkujících v současnosti kolem 70 % molybdenu-99, matečného nuklidu do techneciových generátorů, lze očekávat jistý nárůst zájmu o PET radiofarmaka schopná zastoupit vyšetření do této doby řešené [99mTc] - SPECT – zejména [18F]fluorid sodný. Další z klasických fluorovaných radiofarmak, [18F]fluor ‑ L ‑ DOPA [52], které je používáno v neurologii a onkologii, zaznamenává také v absolutních číslech určitý vzestup spojený se zlepšením dostupnosti, lze však očekávat opětovný pokles zájmu. V onkologii, kde se jeho aplikace týkala zejména neuroendokrinních tumorů, je důvodem rapidní nárůst dostupnosti alternativ založených z největší části na galliu ‑ 68.
Gallium ‑ 68
Nejvýraznějším novým prvkem na poli PET diagnostiky je neoddiskutovatelně gallium ‑ 68 (68Ga). Tento radionuklid poprvé vešel do povědomí rodícího se oboru nukleární medicíny již v 60. letech 20. století, podruhé pak v letech 90. Tento nuklid se přeměňuje z 89 % β ‑ plus přeměnou, maximální energie 1,92 MeV. Jeho poločas přeměny 68 minut je kompatibilní s farmakokinetikou relativně nízkomolekulárních RF. Opravdového rozvoje se ale aplikace 68Ga dočkaly až v první dekádě třetího tisíciletí. Jednak se metoda PET/ CT stala rutinně používanou zobrazovací modalitou, jednak se podařilo dosáhnout uspokojivé úrovně čistoty a produkce u hlavního zdroje 68Ga – tedy germanium ‑ galliových generátorů. Třetím podstatným faktorem byl přechod k účinnější radiochemii značení, kdy byly nahrazeny doposud používané „otevřené“ chelátory makrocyklickými strukturami (DOTA, NOTA) [53]. Ty odvádějí skvělou práci v odstínění galliového iontu proti sérovému proteinu transferinu, který má k němu vysokou afinitu. V kombinaci s vysokou termodynamickou stabilitou a zvýšenou efektivitou značení se otevřely široké klinické možnosti. Pravděpodobně nejvýznamnější aplikace je v tomto ohledu značení somatostatinových analogů – oktreotidů a oktreotátů – v PET obdobě dlouho využívaného Octreoscanu (SPECT varianta vyšetření s 111In) pro diagnostiku somatostatin‑pozitivních neuroendokrinních nádorů [54 – 61]. Možnost pořízení germanium ‑ galliového generátoru pak dovoluje využití na místech, kam by látka se svým poločasem přeměny 68 minut nebyla v dostatečné aktivitě transportovatelná.
Využití gallia pro rutinní PET diagnostiku musí ještě nicméně překonat několik překážek.
Přes všechna zdokonalení, kterých bylo v technologii Ge ‑ Ga generátorů dosaženo, vyžaduje produkt stále poměrně náročné další zpracování – nejde tedy jako u klasické „molly cow“, tedy Mo ‑ Tc generátoru o prostou eluci roztoku a smíchání s lyofilizovaným kitem. To je dáno zejména dvěma faktory – získaná forma gallia není přímo chemicky použitelná pro spojení s chelátorem a navázání na kýženou biomolekulu, a roztok pořád obsahuje poměrně zásadní množství matečného germania ‑ 68 [62 – 65]. Nutnost dodatečného zpracování eluátu z generátoru může u koncového uživatele – nemocnice – zvyklého na jednoduché zacházení s Tc generátory znamenat zásadní problém i z hlediska potřebného personálu a vybavení nutného k dodržení správné praxe při produkci finální lékové formy. Mnoho výrobců syntézních modulů v uplynulých třech letech uvedlo nebo uvádí na trh moduly (či mikromoduly) specializované právě na úpravu galliového eluátu. Jistou možností by tedy bylo zpracování gallia přímo u výrobce a dodávání již hotového radiofarmaka, viz dále.
Alternativa ke generátoru je výroba 68Ga protonovým bombardováním (reakce 68Zn(p,n)68Ga) na cyklotronu [66]. Reakce probíhá na zinkovém terči za využití klasického biomedicínského cyklotronu (potřebná energie cca 13,2 MeV). Výsledný produkt je možno separovat klasickou iontově‑výměnnou kolonou. Kontaminace germaniem ‑ 68 je z hlediska technologie postupu prakticky vyloučena, naopak zinkové a měděné ionty lze odstranit vhodnou volbou sorbentu, čímž je eliminována nutnost post‑produkčních úprav, které vyžaduje generátorový postup. U takto připraveného 68Ga je ovšem poté logicky nutno řešit logistiku značení a vyšetření s ohledem na krátký poločas přeměny – tento přístup je potenciálně vhodný pro výrobní centra s vysokou okolní hustotou PET kamer, případně s vlastní kamerou.
Potenciální využití 68Ga je nesporné a prakticky nezastupitelné zejména na poli nízkomolekulárních biomolekul, tedy oligopeptidů a proteinových fragmentů [67]. 68Ga oktreotátové skeny jsou již nyní v okolních zemích prováděny ve srovnatelné míře jako skeny s radiofarmaky jinými než FDG, vyjma fluorcholinu. Jeho širšímu rozšíření zatím bránila suboptimální dostupnost spojená s výše zmíněnými problémy. Označitelných a využitelných markerů je nicméně velké množství, v současné době prováděné studie s PSMA (prostate ‑ specific membrane antigen) [68 – 70] či bombesinem [71] (tumorový marker např. pro malobuněčný karcinom plic, neuroblastomy či nádory žaludku) označenými galliem jsou pouhými prvními příklady dynamicky se rozvíjejícího nového pole vysoce specifických PET radiofarmak.
Zirkonium ‑ 89
Vedle 68Ga je vhodné se zmínit ještě o dalším z kovových iontových PET zářičů, a sice o zirkoniu-89 (89Zr). Tento nuklid má ideální parametry ke značení monoklonálních protilátek a jejich následné vizualizaci. Poločas přeměny 78,4 hodin odpovídá biologickému poločasu protilátky a je dostatečný pro to, aby rozložení dosáhlo optimálního poměru mezi cílem a okolím. PET obraz navíc není rušen vedlejšími produkty přeměny jádra (23 % β+ přeměny s doprovodným γ zářením o 909 keV, které neinterferuje s 511 keV anihilačními fotony využívanými k detekci PET kamerou) – čímž se liší např. od pro podobné účely používaného jodu-124, jenž produkuje γ zářením výrazně bližší 511 keV. Zirkonium je navíc po internalizaci protilátky podrženo v buňce, čímž se opět liší např. od jodu ‑ 124.
89Zr je produkováno na terči z přírodního yttria reakcemi 89Y(p,n)89Zr nebo 89Y(d,2n)89Zr. Výhoda této metody spočívá zejména ve faktu, že přírodního yttria není nedostatek a terče jsou i díky tomu komerčně poměrně solidně dostupné. Produkce je možná na standardních biomedicínských cyklotronech (do 18 MeV). Průměrný výtěžek je 6 – 8 GBq 89Zr za 4 – 6 hodin ozařování. Jelikož injektovaná aktivita pro jednoho pacienta je kolem pouhých 37–74 MBq značené protilátky, je takové množství dostačující pro studie zaměřené na imuno ‑ PET aplikace.
Produkt po ozařování obsahuje radiochemické nečistoty. Jedná se zejména o yttrium ‑ 88, zirkonium ‑ 88 a matečné yttrium ‑ 89. Z tohoto důvodu je nutno výsledný produkt podrobit purifikaci, kde jsou tyto nečistoty odstraněny. Většinou se pro tyto účely používá afinitní chromatografie s následnou elucí kyselinou, která poskytuje dostatečně čistý roztok iontu Zr4+ dál využitelný pro značení protilátek [72,73]. Samotná vazba zirkonia na protilátku probíhá pomocí chelátorů schopných na jedné straně pevné koordinace iontu Zr zabraňujícímu jeho uvolnění, na druhé straně nedestruktivní vazby na protilátku samotnou. Původně bylo pro tyto účely využíváno „klasických“ chelátorů pro kovové radioaktivní ionty (EDTA, DTPA, DOTA). Specifická koordinační chemie zirkonia však iniciovala stále probíhající vývoj chelátorů lépe využitelných pro tento iont.
Již bylo uvedeno, že dlouhý poločas 89Zr jej činí ideálním pro využití při protilátkových aplikacích PET a dovoluje jeho transport na poměrně dlouhé vzdálenosti, ať již v podobě přečištěného produktu určeného ke značení či ve formě hotové značené protilátky. Jeho schopnost vázat se prakticky na jakoukoli protilátku z něj dělá velmi účinný nástroj k diagnostice a zejména pro určení potenciální citlivosti daného nádoru na zvolenou biologickou léčbu. Je doloženo poměrně solidní množství preklinických i klinických využití 89Zr, kdy byla tímto nuklidem označena standardně používaná terapeutická protilátka a metoda PET využita k ověření cílení a následnému monitoringu léčby [74 – 80]. Lze konstatovat, že možnosti 89Zr jsou v tomto ohledu limitovány pouze dostupností daných protilátek – a s ohledem na rozvoj na poli produkce protilátek a jejich zpřístupňování širšímu spektru medicínských zařízení je pravděpodobné, že se budou rozšiřovat. Největší komplikací, alespoň v ČR a okolních zemích, tak může být prozatímní absence zařízení s dostatečným zázemím, které by splňovalo požadavky na zacházení jak s radioaktivním, tak s biologickým materiálem za dodržení veškerých platných předpisů, správné výrobní a správné laboratorní praxe.
Závěr
Uplynulých pět let přineslo na poli PET radiofarmak výrazné změny zvláště na poli syntézní techniky. Díky miniaturizaci a narůstající flexibilitě syntézních zařízení by mělo být pro daného výrobce snadnější produkovat více radiofarmak za snížené nutnosti investovat do většího počtu syntézních zařízení. Velký potenciál se nepochybně skrývá v 68Ga. Zde bude velice záležet na vybudování případné distribuční sítě a vyřešení zpracování generátorového materiálu. Je tedy pouze otázkou, nakolik bude schopné na tyto nové možnosti reagovat samo zdravotnictví z hlediska kapacit PET vyšetření, možnosti jejich financování a případných úhrad.
Práce byla podpořena Evropským fondem pro regionální rozvoj a státním rozpočtem České republiky (OP VaVpI – RECAMO, CZ.1.05/2.1.00/03.0101) a MZ ČR – RVO (MOÚ, 00209805)
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Ing. et Ing. Jan Adam, Ph.D.
Regionální centrum aplikovanémolekulární onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: adam@mou.cz
Obdrženo: 3. 2. 2014
Přijato/Accepted: 3. 4. 2014
Zdroje
1. Gallagher BM, Ansari A, Atkins H et al. Radiopharmaceuticals XXVII. 18F ‑ labeled 2 - deoxy ‑ 2 - fluoro‑D ‑ glucose as a radiopharmaceutical for measuring regional myocardial glucose metabolism in vivo: tissue distribution and imaging studies in animals. J Nucl Med 1977; 18(10): 990−996.
2. Schirrmeister H, Kühn T, Guhlmann A et al. Fluorine ‑ 18 2 - deoxy ‑ 2 - fluoro‑D ‑ glucose PET in the preoperative staging of breast cancer: Comparison with the standard staging procedures. Eur J Nucl Med 2001; 28(3): 351 – 358.
3. Votrubova J, Belohlavek O, Jaruskova M et al. The role of FDG ‑ PET/ CT in the detection of recurrent colorectal cancer. Eur J Nucl Med Mol Imaging 2006; 33(7): 779 – 784.
4. Chessin DB, Kiran RP, Akhurst T et al. The emerging role of 18F ‑ fluorodeoxyglucose positron emission tomography in the management of primary and recurrent rectal cancer. J Am Coll Surg 2005; 201(6): 948 – 956.
5. Adam J, Andres P, Bolčák K et al. Nová radiofarmaka a aplikace pozitronové emisní tomografie na Masarykově onkologickém ústavu v Brně. Klin Onkol 2009; 22(3): 94 – 97.
6. Ceci F, Castellucci P, Graziani T et al. 11C ‑ Choline PET/ CT detects the site of relapse in the majority of prostate cancer patients showing biochemical recurrence after EBRT. Eur J Nucl Med Mol Imaging 2014; 41(5): 878−886. doi: 10.1007/ s00259 - 013 - 2655 - 9.
7. Jereczek ‑ Fossa BA, Rodari M, Bonora M et al. [11C]choline PET/ CT impacts treatment decision making in patients with prostate cancer referred for radiotherapy. Clin Genitourin Cancer 2013; doi: 10.1016/ j.clgc.2013.11.002.
8. Umbehr MH, Müntener M, Hany T et al. The role of 11C ‑ choline and 18F ‑ fluorocholine positron emission tomography (PET) and PET/ CT in prostate cancer: a systematic review and meta‑analysis. Eur Urol 2013; 64(1): 106−117. doi: 10.1016/ j.eururo.2013.04.019.
9. Roelcke U, Radü EW, von Ammon K et al. Alteration of blood ‑ brain‑barrier in human brain‑tumors: comparison of [F ‑ 18]fluorodeoxyglucose, [11C]methionine and Rb ‑ 82 using PET. J Neurol Sci 1995; 132(1): 20−27.
10. Hatakeyama T, Kawai I, Nishiyama Y et al. C ‑ 11 - methionine (MET) and F ‑ 18 - fluorothymidine (FLT) PET in patients with newly diagnosed glioma. Eur J Nucl Med Mol Imaging 2008; 35(11): 2009−2017. doi: 10.1007/ s00259 - 008 - 0847 - 5.
11. Grassi I, Nanni C, Allegri V et al. The clinical use of PET with (11)C ‑ acetate. Am J Nucl Med Mol Imaging 2012; 2(1): 33−47.
12. Larsson P, Arvidsson D, Björnstedt M et al. Adding 11C ‑ acetate to 18F ‑ FDG at PET examination has an incremental value in the diagnosis of hepatocellular carcinoma. Mol Imaging Radionucl Ther 2012; 21(1): 6−12. doi: 10.4274/ Mirt.87.
13. Mohsen B, Giorgio T, Rasoul ZS et al. Application of (11) C ‑ acetate positron ‑ emission tomography (PET) imaging in prostate cancer: systematic review and meta‑analysis of the literature. BJU Int 2013; 112(8): 1062−1072. doi: 10.1111/ bju.12279.
14. Orevi M, Klein M, Mishani E et al. 11C ‑ acetate PET/ CT in bladder urothelial carcinoma: intraindividual comparison with 11C ‑ choline. Clin Nucl Med 2012; 37(4): e67−e72. doi: 10.1097/ RLU.0b013e31824786e7.
15. Berti V, Pupi A, Mosconi L. PET/ CT in diagnosis of dementia. Ann N Y Acad Sci 2011; 1228 : 81−92. doi: 10.1111// j.1749 - 6632.2011.06015.x.
16. Rabinovici GD, Furst AJ, O‘Neil JP et al. 11C ‑ PIB PET imaging in Alzheimer disease and frontotemporal lobar degeneration. Neurology 2007; 68(15): 1205−1212.
17. Been LB, Suurmeijer AJ, Cobben DC et al. [18F]FLT ‑ PET in oncology: current status and opportunities. Eur J Nucl Med Mol Imaging 2004; 31(12): 1659−1672.
18. Shields AF, Grierson JR, Dohmen BM et al. Imaging proliferation in vivo with [F ‑ 18]FLT and positron emission tomography. Nat Med 1998; 4(11): 1334−1336.
19. Rasey JS, Grierson JR, Wiens LW et al. Uptake of labeled FLT correlates with thymidine kinase (TK1) activity in human tumor cells. J Nucl Med 2000; 41 : 36−37.
20. Buck AK, Halter G, Schirrmeister H et al. Imaging proliferation in lung tumors with PET: F ‑ 18 - FLT versus F ‑ 18 - FDG. J Nucl Med 2003; 44 : 1426−1431.
21. Vesselle H, Grierson J, Muzi M et al. In vivo validation of 3‘ deoxy ‑ 3‘ - [F ‑ 18]fluorothymidine ([F ‑ 18]FLT) as a proliferation imaging tracer in humans: correlation of [F ‑ 18]FLT uptake by positron emission tomography with Ki ‑ 67 immunohistochemistry and flow cytometry in human lung tumors. Clin Cancer Res 2002; 8(11): 3315−3323.
22. Shields AF, Lawhorn ‑ Crews JM, Briston DA et al. Analysis and reproducibility of 3‘ - deoxy ‑ 3‘ - [F ‑ 18]fluorothymidine positron emission tomography imaging in patients with non‑small cell lung cancer. Clin Cancer Res 2008; 14(14): 4463−4468. doi: 10.1158/ 1078 - 0432.CCR ‑ 07- - 5243.
23. Yap CS, Vranjesevic D, Schiepers C et al. A comparison between [F ‑ 18]fluorodeoxyglucose (FDG) and [F ‑ 18] 3‘ - deoxy ‑ 3‘ - fluorothymidine (FLT) uptake in solitary pulmonary nodules and lung cancer. J Nucl Med 2003; 44 (Suppl): 123.
24. Buck AK, Pitterle K, Schirrmeister H et al. [18F]FLT positron emission tomography for imaging Non ‑ Hodgkin‘s lymphoma and assessment of proliferative activity. J Nucl Med 2003; 44(2): 188−189.
25. Direcks WG, Berndsen SC, Proost N et al. [F ‑ 18]FDG and [F ‑ 18]FLT uptake in human breast cancer cells in relation to the effects of chemotherapy: an in vitro study. Br J Cancer 2008; 99(3): 481−487. doi: 10.1038/ sj.bjc.6604523.
26. Linecker A, Kermer C, Sulzbacher I et al. Uptake of F ‑ 18 - FLT and F ‑ 18 - FDG in primary head and neck cancer correlates with survival. Nuklearmedizin 2008; 47(2): 80−85.
27. Cobben DC, van der Laan BF, Hoekstra HJ et al. Detection of mammary, laryngeal and soft tissue tumors with FLT ‑ PET. J Nucl Med 2002; 43 (Suppl): 278.
28. Francis DL, Visvikis D, Costa DC et al. Potential impact of [F ‑ 18]3‘ - deoxy ‑ 3‘ - fluorothymidine versus [F ‑ 18]fluoro‑2 - deoxy ‑ glucose in positron emission tomography for colorectal cancer. Eur J Nucl Med Mol Imaging 2003; 30(7): 988−994.
29. Schirrmeister H, Guhlmann A, Elsner K et al. Sensitivity in detecting osseous lesions depends on anatomic localization: planar bone scintigraphy versus 18F PET. J Nucl Med 1999; 40(40): 1623−1629.
30. Schirrmeister H, Guhlmann A, Kotzerke J et al. Early detection and accurate description of extent of metastatic bone disease in breast cancer with fluoride ion and positron emission tomography. J Clin Oncol 1999; 17(8): 2381−2389.
31. Petrén ‑ Mallmin M, Andréasson I, Ljunggren O et al.Skeletal metastases from breast cancer: uptake of 18F ‑ fluoride measured with PET in correlation with CT. Skeletal Radiol 1998; 27(2): 72 – 76.
32. Grant FD, Fahey FH, Packard AB et al. Skeletal PET with 18F ‑ fluoride: applying new technology to an old tracer. J Nucl Med 2008; 49(1): 68 – 78.
33. Hetzel M, Arslandemir C, König HH et al. F ‑ 18 NaF PET for detection of bone metastases in lung cancer: accuracy, cost‑effectiveness, and impact on patient management. J Bone Miner Res 2003; 18(12): 2206 – 2214.
34. Even ‑ Sapir E, Metser U, Flusser G et al. Assessment of malignant skeletal disease: initial experience with 18F ‑ fluoride PET/ CT and comparison between 18F ‑ fluoride PET and 18F ‑ fluoride PET/ CT. J Nucl Med 2004; 45(2): 272 – 278.
35. Even ‑ Sapir E, Metser U, Mishani E et al. The detection of bone metastase in patients with high‑risk prostate cancer: 99mTc ‑ MDP Planar bone scintigraphy, single ‑ and multi‑field ‑ of ‑ view SPECT, 18F ‑ fluoride PET and 18F ‑ fluoride PET/ CT. J Nucl Med 2006; 47(2): 287 – 297.
36. Bauman G, Belhocine T, Kovacs M et al. 18F ‑ fluorocholine for prostate cancer imaging: a systematic review of the literature. Prostate Cancer Prostatic Dis 2012; 15(1): 45 – 55.
37. Soyka JD, Muster MA, Schmid DT et al. Clinical impact of 18F ‑ choline PET/ CT in patients with recurrent prostate cancer. Eur J Nucl Med Mol Imaging 2012; 39(6): 936 – 943. doi: 10.1007/ s00259-012 - 2083 - 2.
38. Kwee SA, Coel MN, Lim J. Detection of recurrent prostate cancer with 18F ‑ fluorocholine PET/ CT in relation to PSA level at the time of imaging. Ann Nucl Med 2012; 26(6): 501 – 507. doi: 10.1007/ s12149 - 012 - 0601 - 8.
39. Fabbri C, Galassi R, Moretti A et al. Radiation dosimetry of 18F ‑ flurocholine PET/ CT studies in prostate cancer patients. Phys Med 2014; 30(3): 346 – 351. doi: 10.1016/ j.ejmp.2013.10.007.
40. Quak E, Lheureux S, Reznik Y et al. F18 - choline, a novel PET tracer for parathyroid adenoma? J Clin Endocrinol Metab 2013; 98(8): 3111 – 3112. doi: 10.1210/ jc.2013 - 2084.
41. Bieze M, Klümpen HJ, Verheij J et al. Diagnostic accuracy of 18F ‑ methyl ‑ choline PET/ CT for intra ‑ and extrahepatic hepatocellular carcinoma. Hepatology 2014; 59(3): 996 – 1006. doi: 10.1002/ hep.26781.
42. Cheng J, Lei L, Xu J et al. 18F ‑ fluoromisonidazole PET/ CT: a potential tool for predicting primary endocrine therapy resistance in breast cancer. J Nucl Med 2013; 54(3): 333 – 340. doi: 10.2967/ jnumed.112.111963.
43. Okamoto S, Shiga T, Yasuda K et al. High reproducibility of tumor hypoxia evaluated by 18F ‑ fluoromisonidazole PET for head and neck cancer. J Nucl Med 2013; 54(2): 201 – 207. doi: 10.2967/ jnumed.112.109330.
44. Henriques de Figueiredo B, Merlin T, de Clermont ‑ Gallerande H et al. Potential of [18F] - fluoromisonidazole positron ‑ emission tomography for radiotherapy planning in head and neck squamous cell carcinomas. Strahlenther Onkol 2013; 189(12): 1015 – 1019. doi: 10.1007/ s00066 - 013 - 0454-7.
45. Kobayashi H, Hirata K, Yamaguchi S et al. Usefulness of FMISO ‑ PET for Glioma Analysis. Neurol Med Chir (Tokyo) 2013; 53(11): 773 – 778.
46. Götz I, Grosu AL. [(18)F]FET ‑ PET imaging for treatment and response monitoring of radiation therapy in malignant glioma patients – a review. Front Oncol 2013; 3 : 104. doi: 10.3389/ fonc.2013.00104.
47. Crippa F, Alessi A, Serafini GL. PET with radiolabeled aminoacid. Q J Nucl Med Mol Imaging 2012; 56(2): 151 – 162.
48. Nataf V, Kerrou K, Balogova S et al. Fluoroethylthyrosine 18F PET in the detection of brain tumours. Bull Cancer 2010; 97(5): 495 – 506. doi: 10.1684/ bdc.2010.1078.
49. Schuster DM, Taleghani PA, Nieh PT et al. Characterization of primary prostate carcinoma by anti‑1 - amino ‑ 2 - [(18)F] - fluorocyclobutane ‑ 1 - carboxylic acid (anti‑3 - [(18)F] FACBC) uptake. Am J Nucl Med Mol Imaging 2013; 3(1): 85 – 96.
50. Schiavina R, Brunocilla E, Martorana G. The new promise of FACBC position emission tomography/ computed tomography in the localization of disease relapse after radical treatment for prostate cancer: are we turning to the right radiotracer? Eur Urol 2014; 65(1): 255 – 256. doi: 10.1016/ j.eururo.2013.08.053.
51. Ono M, Oka S, Okudaira H et al. Comparative evaluation of transport mechanisms of trans‑1 - amino ‑ 3 - [18F]fluorocyclobutanecarboxylic acid and L ‑ [methyl ‑ ¹¹C]methionine in human glioma cell lines. Brain Res 2013; 1535 : 24 – 37. doi: 10.1016/ j.brainres.2013.08.037.
52. Imperiale A, Rust E, Gabriel S et al. 18F ‑ fluorodihydroxyphenylalanine PET/ CT in patients with neuroendocrine tumors of unknown origin: relation to tumor origin and differentiation. J Nucl Med 2014; 55(3): 367 – 372. doi: 10.2967/ jnumed.113.126896.
53. Breeman WA, De Jong M, De Blois E et al. Radiolabelling DOTA ‑ peptides with 68Ga. Eur J Nucl Med Mol Imaging 2005; 32(4): 478 – 485.
54. von Falck C, Boerner AR, Galanski M et al. Neuroendocrine tumour of the mediastinum: fusion of 18F ‑ FDG and 68Ga ‑ DOTATOC PET/ CT data sets demonstrates different degrees of differentiation. Eur J Med Mol Imaging 2007; 34(5): 812.
55. Maeke HR, Hofman M, Haberkorn U. 68Ga ‑ labeled peptides in tumor imaging. Nucl Med 2005; 46 (S1): 172S ‑ 178S.
56. Sadeghi M, Kakavand T, Rajabifar S et al. Cyclotron production of 68Ga via proton‑induced reaction on 68Zn target. Nukleonika 2009; 54(1): 25 – 28.
57. Meyer GJ, Maecke H, Schuhmacher J et al. 68Ga ‑ labelled DOTA ‑ derivatised peptide ligands. Eur J Nucl Med Mol Imaging 2004; 31(8): 1097 – 1104.
58. Ocak M, Antretter M, Knopp R et al. Full automation of 68Ga labelling of DOTA ‑ peptides including cation exchange prepurification. Appl Radiat Isot 2010; 68(2): 297 – 302. doi: 10.1016/ j.apradiso.2009.10.006.
59. Roesch F, Riss PJ. The renaissance of the 68Ge/ 68Ga radionuclide generator initiates new developments in 68Ga radiopharmaceutical chemistry. Curr Top Med Chem 2010; 10(16): 1633 – 1668.
60. Zhernosekov KP, Filosofov DV, Baum RP et al. Processing of generator ‑ produced Ga ‑ 68 for medical application. J Nucl Med 2007; 48(10): 1741 – 1748.
61. Afshar ‑ Oromieh A, Haberkorn U, Hadaschik B et al. PET/ MRI with a 68Ga ‑ PSMA ligand for the detection of prostate cancer. Eur J Nucl Med Mol Imaging 2013; 40(10): 1629 – 1630. doi: 10.1007/ s00259 - 013 - 2489 - 5.
62. Buchmann I, Henze M, Engelbrecht S et al. Comparison of 68Ga ‑ DOTATOC PET and 111In ‑ DTPAOC (octreoscan) SPECT in patients with neuroendocrine tumours. Eur J Nucl Med Mol Imaging 2007; 34(10): 1617 – 1626.
63. Di Pierro D, Rizzello A, Cicoria G et al. Radiolabelling, quality control and radiochemical purity assessment of the octreotide analogue 68Ga DOTA NOC. Appl Radiat Isot 2008; 66(8): 1091 – 1096. doi: 10.1016/ j.apradiso.2007.12.001.
64. Decristoforo C, Knopp R, Von Guggenberg E et al.A fully automated synthesis for the preparation of 68Ga ‑ labelled peptides. Nucl Med Commun 2007; 28(11): 870 – 875.
65. Kowalski J, Henze M, Schuhmacher J et al. Evaluation of positron emission tomography imaging using [68Ga] - DOTA ‑ D ‑ Phe1 - Tyr3 - octreotide in comparison to [111In] - DTPAOC SPECT. First results in patients with neuroendocrine tumors. Mol Imaging Biol 2003; 5(1): 42 – 48.
66. Boschi S, Malizia C, Lodi F. Overview and perspectives on automation strategies in (68)Ga radiopharmaceutical preparations. Recent Results Cancer Res 2013; 194 : 17 – 31. doi: 10.1007/ 978 - 3 - 642 - 27994 - 2_2.
67. Schreiter NF, Brenner W, Nogami M et al. Cost comparison of 111In ‑ DTPA ‑ octreotide scintigraphy and 68Ga ‑ DOTATOC PET/ CT for staging enteropancreatic neuroendocrine tumours. Eur J Nucl Med Mol Imaging 2012; 39(1): 72 – 82. doi: 10.1007/ s00259-011 - 1935 - 5.
68. Afshar ‑ Oromieh A, Malcher A, Eder M et al. PET imaging with a [68Ga]gallium ‑ labelled PSMA ligand for the diagnosis of prostate cancer: biodistribution in humans and first evaluation of tumour lesions. Eur J Nucl Med Mol Imaging 2013; 40(4): 486 – 495. doi: 10.1007/ s00259 - 012 - 2298 - 2.
69. Afshar ‑ Oromieh A, Haberkorn U, Eder M et al. [68Ga]Gallium ‑ labelled PSMA ligand as superior PET tracer for the diagnosis of prostate cancer: comparison with 18F ‑ FECH. Eur J Nucl Med Mol Imaging 2012; 39(6): 1085 – 1086. doi: 10.1007/ s00259 - 012- - 2069 - 0.
70. Varshney R, Hazari PP, Fernandez P et al. (68)Ga ‑ labeled bombesin analogs for receptor ‑ mediated imaging. Recent Results Cancer Res 2013; 194 : 221 – 256. doi: 10.1007/ 978 - 3 - 642 - 27994-2_12.
71. Dejesus OT, Nickles RJ. Production and purification of 89Zr, a potential PET antibody label. Int J Radiat Appl Instrum [A] 1990; 41 : 789 – 790.
72. Zweit J, Downey S, Sharma HL. Production of no ‑ carrier ‑ added zirconium ‑ 89 for positron emission tomography. Int J Radiat Appl Instrum [A] 1991; 42 : 199 – 201.
73. Tinianow JN, Gill HS, Ogasawara A et al. Site ‑ specifically 89Zr ‑ labeled monoclonal antibodies for ImmunoPET. Nucl Med Biol 2010; 37(3): 289 – 297. doi: 10.1016/ j.nucmedbio.2009.11.010.
74. Perk LR, Visser GW, Vosjan MJ et al. 89Zr as a PET surrogate radioisotope for scouting biodistribution of the therapeutic radiometals 90Y and 177Lu in tumor ‑ bearing nude mice after coupling to the internalizing antibody cetuximab. J Nucl Med 2005; 46(11): 1898 – 1906.
75. Vugts DJ, Visser GW, van Dongen GA. 89Zr ‑ PET radiochemistry in the development and application of therapeutic monoclonal antibodies and other biologicals. Curr Top Med Chem 2013; 13(4): 446 – 457.
76. Dijkers EC, Oude Munnink TH, Kosterink JG et al. Biodistribution of 89Zr ‑ trastuzumab and PET imaging of HER2 - positive lesions in patients with metastatic breast cancer. Clin Pharmacol Ther 2010; 87(5): 586 – 592. doi: 10.1038/ clpt.2010.12.
77. Gaykema SB, Brouwers AH, Hovenga S et al. Zirconium ‑ 89 - trastuzumab positron emission tomography as a tool to solve a clinical dilemma in a patient with breast cancer. J Clin Oncol 2012; 30(6): e74 – e75. doi: 10.1200/ JCO.2011.38.0204.
78. Nagengast WB, de Korte MA, Oude Munnink TH et al. 89Zr ‑ bevacizumab PET of early antiangiogenic tumor response to treatment with HSP90 inhibitor NVP ‑ AUY922. J Nucl Med 2010; 51(5): 761 – 767. doi: 10.2967/ jnumed.109.071043.
79. Hoeben BA, Kaanders JH, Franssen GM et al. PET of hypoxia with 89Zr ‑ labeled cG250 - F(ab’)2 in head and neck tumors. J Nucl Med 2010; 51(7): 1076 – 1083. doi: 10.2967/ jnumed.109.073189.
Štítky
Dětská onkologie Chirurgie všeobecná Onkologie
Článek vyšel v časopiseKlinická onkologie
Nejčtenější tento týden
2014 Číslo Supplementum- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejasný stín na plicích – kazuistika
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Hojení análních fisur urychlí čípky a gel
-
Všechny články tohoto čísla
- Analýza proteinů pomocí hmotnostní spektrometrie
- p‑ SRM, SWATH a HRM – cílené proteomické přístupy na hmotnostním spektrometru TripleTOF 5600+ a jejich aplikace v onkologickém výzkumu
- Analýza fosfoproteínov a signálnych dráh kvantitatívno‑ proteomickými metódami
- Nové trendy ve studiu glykosylace proteinů u onkologických onemocnění
- Současné trendy ve využívání PET radiofarmak k onkologické diagnostice
- „Techneciová krize“ – příčiny, možná řešení a dopad na diagnostiku planární scintigrafií a SPECT
- Vitamin D jako významný steroidní hormon u karcinomu prsu
- Využití průtokové cytometrie pro analýzu mitochondriální buněčné smrti
- Soutěž o nejlepší práci
- Metody studia buněčné migrace a invazivity nádorových buněk
- Možnosti studia transendoteliální migrace in vitro
- Editorial
- Mechanizmy lékové rezistence a nádorové kmenové buňky
- Funkční testy pro detekci nádorových kmenových buněk
- Mikroprostředí nádoru – možnosti výzkumu v podmínkách in vitro
- Elektrochemická analýza nukleových kyselin, bílkovin a polysacharidů v biomedicíně
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Vývoj metod založených na PCR a jejich aplikace v onkologickém výzkumu a praxi
- Programovaná buněčná smrt v nádorových buňkách
- Metody pro studium protein‑proteinových a protein‑ligandových interakcí
- Detekce protein‑proteinových interakcí metodami FRET a BRET
- Detekce proteinů, proteinových interakcí a modifikací s využitím „proximity ligation assay“ in situ
- Exprese a purifikace proteinů
- Kvantitativní hmotnostní spektrometrie a její využití v onkologii
- Klinická onkologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Exprese a purifikace proteinů
- Metody studia buněčné migrace a invazivity nádorových buněk
- Sekvenování nové generace a možnosti jeho využití v onkologické praxi
- Analýza proteinů pomocí hmotnostní spektrometrie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



