-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
(Ne)tradičně komplikovaná pankreatitida
(Un)conventional complicated pancreatitis
Acute pancreatitis is sudden inflammatory disease of pancreas, which can vary from a mild form to severe life threatening condition. The management of pancreatitis usually consists of intensive care and multidisciplinary approach, often including surgical intervention or digestive endoscopy. In this article, we present a 68-year-old female with recidivous acute pancreatitis who underwent a series of endoscopic examinations and at the end also an unusual surgical intervention due to numerous complications. At first, it seemed that there was an idiopatic etiology because neither an anamnesis of alcohol consumption nor metabolic risks or CT signs of cholelithiasis were found. The condition was complicated by the development of acute necrotic collection, gastrointestinal bleeding and development of walled-off pancreatic necrosis (WOPN). Later, the biliary etiology was revealed after cholecystolithiasis was found on abdominal ultrasound. The WOPN was endoscopically drained because of the local compression syndrome. After the drainage, we noticed two cases of stent migration and the secondary infection of the WOPN. At the end, the migrated stents caused transient bowel obstruction and were stuck in the distal ileum. After three unsuccessful attempts to endoscopic extraction, the condition was solved by surgical intervention and double enterotomy was performed. The postoperative care was not easy anyway, being complicated by the dehiscence of the surgical wound with the need of opening the wound and use the VAC system to heal it up.
Keywords:
acute pancreatitis – walled-off pancreatic necrosis – EUS drainage – stent migration – complications – enterotomy
Autoři: Rybár M. 1; Horný I. 2
Působiště autorů: Gastroenterologická ambulance, Interní oddělení, Nemocnice Český Krumlov, a. s. 1; Gastroenterologické centrum, Interního oddělení, Nemocnice Strakonice, a. s. 2
Vyšlo v časopise: Gastroent Hepatol 2021; 75(1): 61-67
Kategorie: Klinická a experimentální gastroenterologie: kazuistika
doi: https://doi.org/10.48095/ccgh202161Souhrn
Akutní pankreatitida je náhlé zánětlivé onemocnění slinivky břišní, které se může různit od lehké klinické formy až po závažný život ohrožující stav. Řešení pankreatitidy často vyžaduje intenzivní péči a multidisciplinární přístup, včetně chirurgické intervence nebo digestivní endoskopie. V tomto článku prezentujeme případ 68leté pacientky s recidivující akutní pankreatitidou, která pro četné komplikace podstoupila řadu endoskopických vyšetření a na závěr i nezvyklou chirurgickou intervenci. Nejprve se zdálo, že se jedná o idiopatickou etiologii, protože nebyla zaznamenána anamnéza abúzu alkoholu, metabolická rizika ani CT známky cholelitiázy. Stav byl komplikován vývojem akutní pankreatické nekrózy, gastrointestinálního krvácení a vývojem ohraničené pankreatické nekrózy. Později, po nálezu cholecystolitiázy na abdominálním UZ vyšetření, byla etiologie překlasifikována na biliární. Ohraničená pankreatická nekróza byla pro lokální útlakový syndrom endoskopicky drénována. Po drenáži jsme zaznamenali 2× migraci zavedených stentů a sekundární infekci cystické léze. Nakonec migrované stenty způsobily přechodnou poruchu pasáže a uvízly v distálním ileu. Stav si vyžádal po třech neúspěšných pokusech o endoskopickou extrakci chirurgickou intervenci s dvojnásobnou enterotomií. Pooperační průběh byl komplikován dehiscencí operační rány. Bylo nutno rozpustit ránu a užít VAC systému.
Klíčová slova:
akutní pankreatitida – ohraničená pankreatická nekróza – EUS drenáž – migrace stentů – komplikace – enterotomie
Úvod
Akutní pankreatitida je náhle probíhající zánětlivé, primárně neinfekční onemocnění pankreatu způsobené neregulovanou aktivací proteolytických enzymů uvnitř žlázy slinivky s následnou autodigescí a lokální zánětlivou reakcí. Tíže onemocnění je dána rozsahem postižení pankreatu a systémovými projevy. V 80 % má onemocnění mírný průběh s relativně rychlým uzdravením a nízkou mortalitou kolem 1 %, ale zbylých 20 % probíhá jako těžká pankreatitida s podstatně vyšší mortalitou 15–20 % [1]. Těžký průběh je obvykle komplikován známkami orgánového selhání, akutním krvácením do gastrointestinálního traktu (GIT), trombózou v. portae, disrupcí pankreatického vývodu s vývojem pankreatických píštělí nebo lokálních komplikací ve smyslu akutní tekutinové kolekce, akutní pankreatické nekrózy, pseudocysty, abscesů a ohraničené pankreatické nekrózy. Akutní tekutinová kolekce je časnou komplikací vyvíjející se v úvodních fázích onemocnění s tendencí ke spontánní resorpci. V 5–15 % ale kolekce přetrvávají a dochází k rozvoji pseudocyst [2]. Dalším typem brzkých lokálních komplikací je vznik akutních pankreatických nekróz, které během 4 týdnů buď kolikvují a postupně se resorbují, nebo se ohraničují a vznikají ohraničené pankreatické nekrózy, které komplikují 1–9 % akutních pankreatitid [3]. Vznikají především v těle a kaudě slinivky [2]. Nejčastější příčinou vzniku ohraničených pankreatických nekróz je akutní biliární pankreatitida, a to mezi 50 a 70 %. Dalšími častými příčinami jsou alkoholická a idiopatická pankreatitida. Chronická pankreatitida se podílí na vzniku ohraničených nekróz jen v malém počtu, a to přibližně ve 4–16 % [4]. Rozvoj klinických symptomů, jako jsou útlakové symptomy nebo známky infekce, jsou pak indikací k drenáži pseudocyst nebo ohraničených pankreatických nekróz [5]. Metodou volby je nyní EUS navigovaná drenáž pro výrazně nižší morbiditu a mortalitu ve srovnání s konvenčním endoskopickým přístupem [6,7], ale také ve srovnání s perkutánní nebo chirurgickou intervencí [2]. Mezi nejčastější komplikace endoskopické drenáže patří krvácení, perforace, infekce a migrace stentů.
Kazuistika
Pacientka, 68 let, hypertonička bez závažných komorbidit, byla přijata v pozdním odpoledni 1. května 2018 na Chirurgické oddělení Nemocnice Český Krumlov pro bolesti břicha s maximem v epigastriu a zvracením trvajícím několik hodin. Při přijetí byla hemodynamicky stabilní, normotenzní (135/ 75 mm Hg), bez tachykardie (80/ min), bez známek peritoneálního dráždění, s maximem bolesti při palpaci v epigastriu a v pravém hypochondriu. Opulentní jídlo nebo alkoholický exces v anamnéze pacientka negovala. Ve vstupních laboratorních testech byla zachycena elevace á-amyláz na 31,79 μkat/ l a dále ALT v normě, AST 0,74 μkat/ l, GGT 1,84 μkat/ l, ALP 1,79 μkat/ l. Nebyla zachycena hyperbilirubinemie ani známky minerálového rozvratu, kreatinin 76 μmol/ l, CRP 13,5 mg/ l, Ca 2,4 mmol/ l. Lipidogram byl v normě. V krevním obrazu leukocyty 14,5 × 10⁹/ l. Po přijetí byl proveden RTG hrudníku, který byl bez závažných odchylek od normy, a nativní RTG břicha bez známek poruchy pasáže nebo zachyceného pneumoperitonea. Zahájena parenterální tekutinová terapie přípravkem Ringerfundin. Ve večerních hodinách bylo doplněno nativní CT břicha a pánve, kde se potvrdila akutní pankreatitida. Byl prokázán edém pankreatické žlázy s akutní tekutinovou kolekcí peripankreaticky a ve ventrálním pararenálním prostoru bilaterálně, bez známek nekrózy parenchymu (obr. 1). Klinicky bez známek orgánové dysfunkce, což by odpovídalo v úvodu středně závažné pankreatitidě. Cholecystolitiáza ani dilatace žlučových cest nebyly na úvodním CT vyšetření patrny. Pacientka byla přeložena na jednotku intenzivní péče (JIP), kde pokračovala parenterální volumoterapie přípravkem Ringerfundin v objemu 3 000 ml/ 24 hod a profylaktické podání inhibitorů protonové pumpy (PPI) a nízkomolekulárního heparinu (LMWH). Po dobu pobytu na JIP byla v dobrém stavu bez známek multiorgánového selhávání, hemodynamicky stabilní, se zachovalou diurézou v objemu 1 500–2 000 ml/ 24 hod a bez známek minerálového rozvratu. Třetí den hospitalizace se obnovila peristaltika a pasáž trávicím traktem. Byla zahájena postupná perorální realimentace a redukce parenterální terapie. I přes postupnou elevaci C-reaktivního proteinu (CRP) až na 467,6 mg/ l byla pacientka afebrilní, bez systémových známek sepse. Pátý den hospitalizace se transaminázy i GGT normalizovaly, á-amyláza klesla na 1,66 μkat/ l, leukocyty 12 × 10⁹/ l. Kontrolní UZ břicha byl proveden po týdnu od úvodních obtíží. Zaznamenal patrné zbytnění těla pankreatu na 30 mm a objemnou, 70 × 35 × 50 mm velkou tekutinovou kolekci nad pankreatickou žlázou (obr. 2). Stav pacientky se v průběhu hospitalizace nadále zlepšoval, normalizovala se á-amyláza, klesaly zánětlivé markery, pacientka byla postupně vertikalizována, probíhala standardní léčba a perorální realimentace. Desátý den od prvních příznaků bylo doplněno kontrolní CT břicha s aplikací kontrastní látky. Odhalilo rozsáhlou akutní nekrózu v oblasti těla pankreatu s objemnou kolekcí propagující se do omentální burzy o velikosti 85 × 65 × 70 mm.
Obr. 1. Vstupní nativní CT. Edém pankreatické žlázy s akutní peripankreatickou tekutinovou kolekcí bez známek nekróz (šipka).
Fig. 1. Initial native-phase CT. Edema of pancreatic gland with acute peripan creatic fluid collection without the signs of necrosis (arrow).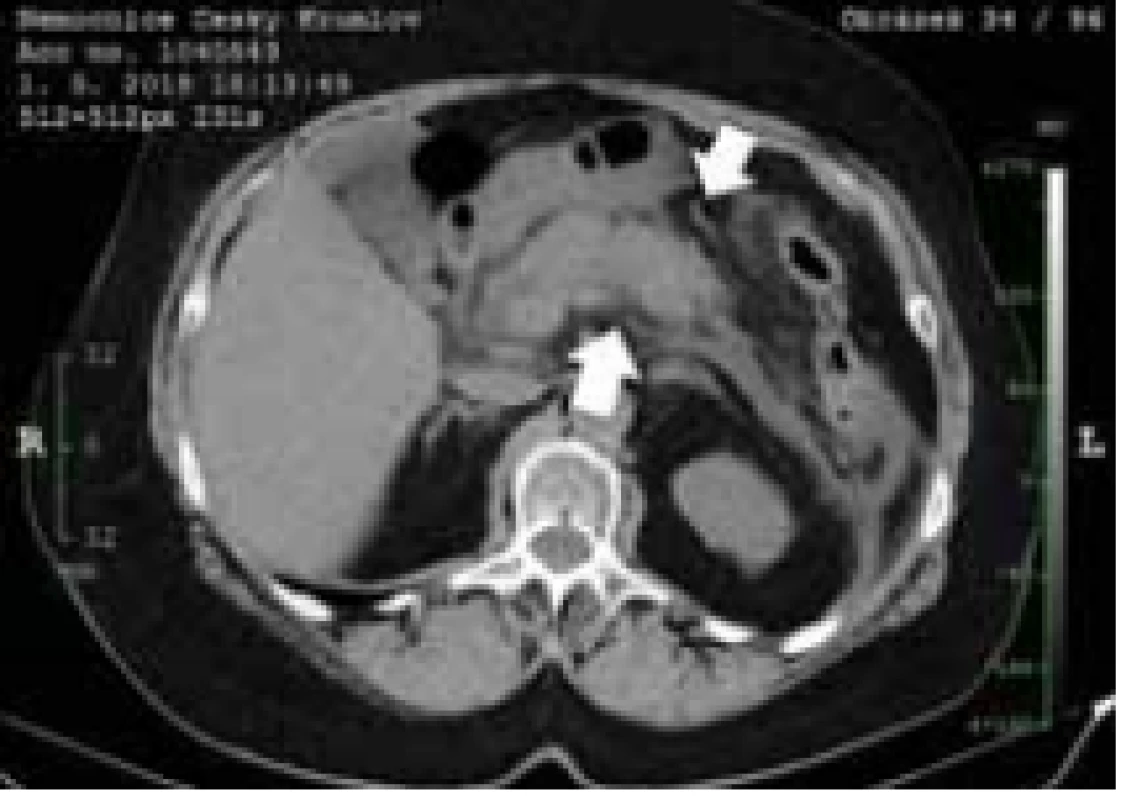
Obr. 2. Abdominální UZ s odstupem týdne s nehomogenním zbytněním těla pankreatu (A) a tekutinovou kolekcí mezi pankreatem a zadní stěnou žaludku (B).
Fig. 2. Abdomminal ultrasound after 1 week with nonhomogenous exuberance of the pancreatic body (A) and fl uid collection inbetween the pancreas and the posterior wall of the stomach (B).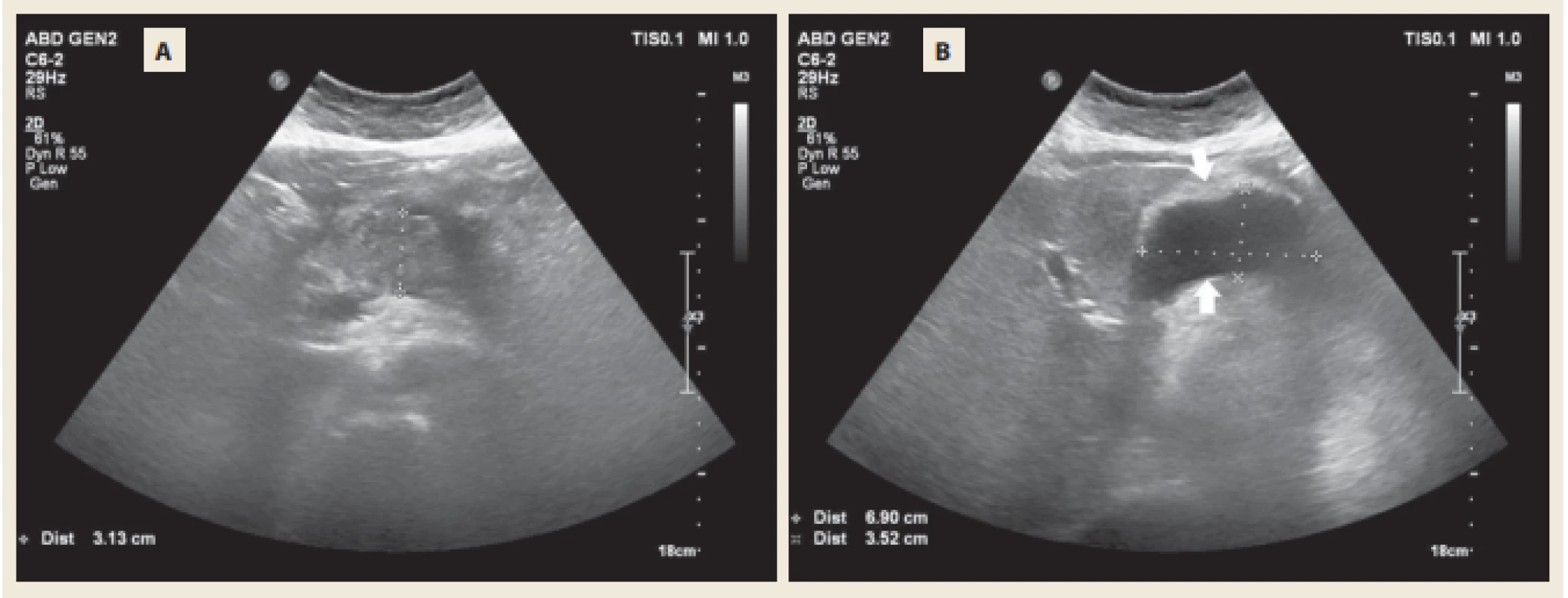
Vzhledem k absenci rizikových metabolických faktorů a k negativnímu CT nálezu stran cholelitiázy bylo uvažováno spíše o etiologii idiopatické. Podle revidovaných Atlantských kritérií se vzhledem k absenci orgánového selhávání jednalo o středně závažnou pankreatitidu s lokálními komplikacemi. Klinický stav pacientky se nadále zlepšoval, nebyly přítomny žádné komplikace. Po 13 dnech od přijetí byla pacientka přeložena na standardní oddělení a 18. května byla na vlastní žádost dimitována.
Následně byla pacientka 6 dní po předchozí dimisi v časných ranních hodinách 24. května opět hospitalizována na chirurgickém oddělení pro bolesti v epigastriu. Ve vstupním laboratorním vyšetření byla patrná elevace zánětlivých markerů – leukocyty 12 × 10⁹/ l, CRP 37 mg/ l, bez známek minerálového rozvratu, á-amyláza 6,2 μkat/ l. Amyláza v moči byla zvýšena na 40 μkat/ l. Po přijetí bylo provedeno nativní CT břicha s nálezem 8 × 7 × 7 cm velké cystické léze těla pankreatu, tedy bez progrese oproti poslednímu CT vyšetření. Léze byla nesprávně popsána jako pseudocysta, ale vzhledem k tomu, že vznikala na podkladě akutní nekrotické kolekce, mělo být užito, a to i s ohledem na časový horizont, termínu ohraničující se akutní nekrotická kolekce. Kolekce se vyklenovala ventrálně pod levý lalok jater a za žaludek. Dále bylo popsáno peripankreatické prosáknutí. Žlučové cesty nebyly dilatovány a cholecystolitiáza opět nebyla zachycena. Stav byl hodnocen jako recidiva idiopatické akutní pankreatitidy.
Pacientka byla umístěna na JIP, tolerovala perorální příjem tekutin do 500 ml denně. Parenterálně byl proto podáván Ringerfundin 2 500 a 2 000 ml denně. Klinicky ani laboratorně nebyly patrny známky multiorgánové dysfunkce, diuréza zůstala zachována cca 0,85 ml/ kg/ hod. Pro dobrý klinický stav a přítomnost peristaltiky byla pacientka za 2 dny zatížena perorální stravou s nízkým podílem tuků a sippingem s dobrou tolerancí. Čtvrtý den hospitalizace, přes profylaktické podávání PPI – Controloc 40 mg 1× denně, se objevuje hemateméza a meléna. Starším chirurgem byla dle zvyklostí zavedena nazogastrická sonda, která odvedla cca 250 ml hematinového obsahu. V kontrolním krevním obraze dominoval obraz těžké normocytární anemie s hematokritem 0,184 a koncentrací Hb 61 g/ l. Byla provedena urgentní gastroskopie s nálezem peptických vředů bulbu a D2 duodena charakteru Forrest IIc–III (obr. 3). Kromě hemosubstituce třemi erymasami stav nevyžadoval rozšířenou terapii hypovolemického šoku. Byla zintenzivněna PPI terapie pantoprazolem na 40 mg 3× denně i.v., což sice není obvyklá dávka při nevarikózním krvácení do horního zažívacího traktu, ale při nízce rizikových lézích stále přípustná [8]. Zbytek hospitalizace již proběhl bez větších komplikací. Pacientka byla dimitována v horizontu dalšího týdne opět na vlastní žádost do domácí péče.
Obr. 3. Mnohočetné akutní vředy bulbu a D2 duodena charakteru Forrest IIc a III.
Fig. 3. Multiple acute ulcers of duodenal bulb and D2 duodenum – Forrest IIc and III.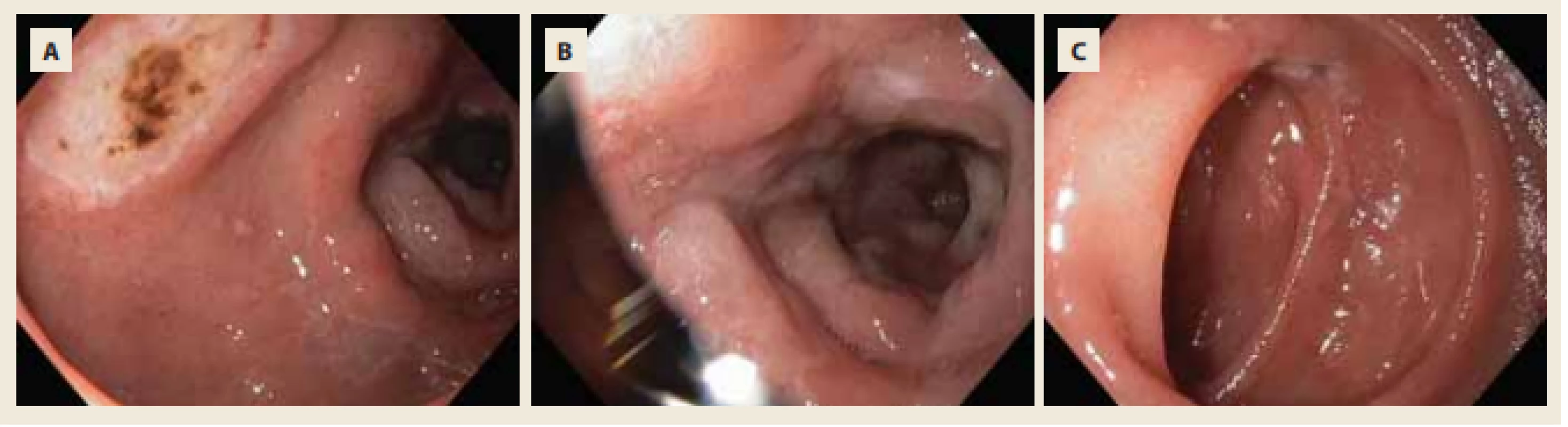
Po dimisi byla vyšetřena v diabetologické ambulanci pro poruchu glukózové tolerance s nálezem sekundárního diabetu, který nevyžadoval inzulinovou terapii a byl dietou dostatečně kompenzován. Vzhledem k nově vzniklé dyspepsii horního typu, k mírné intermitentní bolesti v epigastriu, nauzei a občasnému zvracení bylo provedeno 26. června 2018 ambulantně kontrolní CT břicha s kontrastní látkou. Na CT byla patrna progrese velikosti dobře ohraničené pankreatické nekrózy se spíše homogenním tekutým obsahem bez bublinek plynu. Dle CT byla léze 115 × 85 × 105 mm veliká, dobře ohraničená, utlačující levý jaterní lalok a žaludek ze zadní strany (obr. 4). Z pankreatu byla rozpoznatelná jen malá část hlavy a konec kaudy pankreatu.
Obr. 4. Kontrolní CT s kontrastem. Progrese dobře ohraničené pseudocysty s útlakem zadní stěny žaludku a levého jaterního laloku (šipky).
Fig. 4. Control CT scan with i.v. contrast. Progression of walled-off pseudocyst with compression of posterior wall of stomach and left liver lobe (arrows).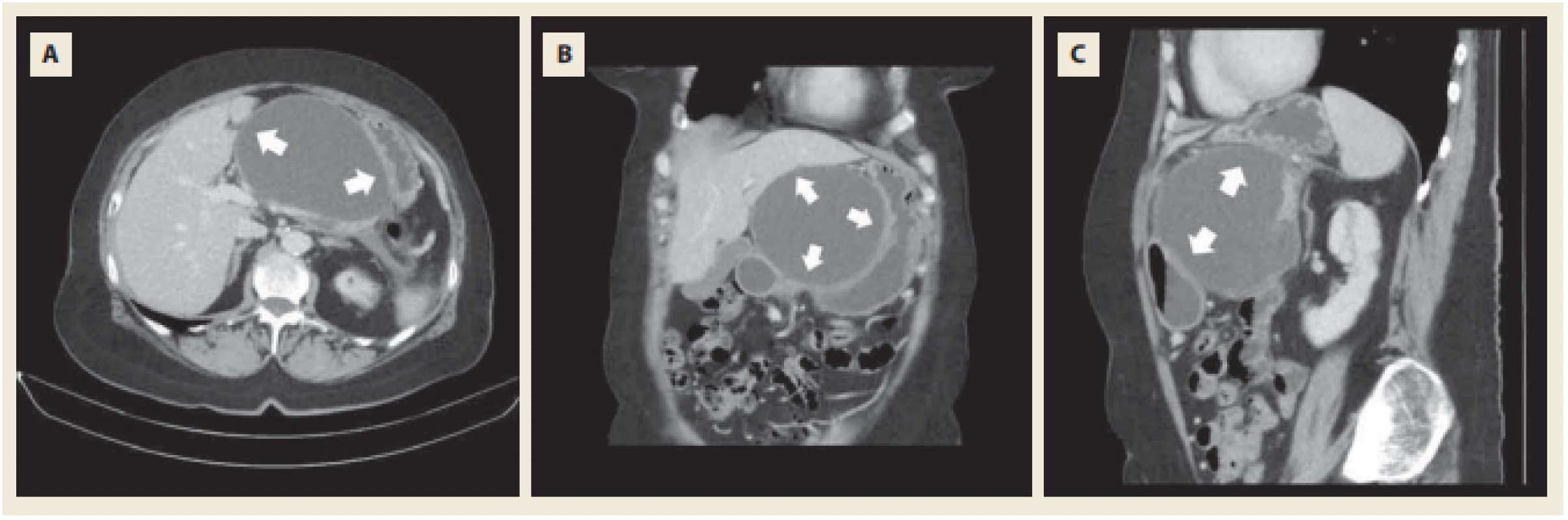
Klinicky ani laboratorně nebyly známky infekce. Pacientka byla afebrilní, bez zimnice nebo třesavky. V laboratorním nálezu byly leukocyty 9 × 10⁹/ l, CRP < 2 mg/ l. Nález progredující vyzrálé ohraničené nekrózy s útlakovým syndromem jsme konzultovali na spřízněném pracovišti ve Strakonicích, kde rutinně provádějí endoskopickou ultrasonografii (EUS). Byla indikována EUS asistovaná drenáž cystické léze. Vzhledem k nevelkým obtížím a časovým preferencím pacientky byla k plánovanému endoskopickému výkonu přijata na interní oddělení ve Strakonicích 30. července 2018. Byla provedena EUS navigovaná drenáž se zavedením dvou pigtailů 7 F a 10 F o délce 5 cm. Výkon proběhl bez komplikací. Profylaktická antibiotická terapie nebyla indikována. Pacientka byla druhý den propuštěna v dobrém stavu domů.
Po 10 dnech, 9. srpna 2018, byla pacientka opět hospitalizována na interním oddělení ve Strakonicích pro febrilie, slabost a diskomfort v epigastriu. Laboratorně byla zjištěna elevace zánětlivých markerů – CRP 250 mg/ l, bez leukocytózy. Proto byla hned úvodem zahájena empirická antibiotická léčba cefotaximem i.v. v celkové denní dávce 6 g, ve třech denních dávkách. Sonograficky byla popsána ohraničená nekróza s nehomogenním obsahem o velikosti 90 × 60 mm – tedy s minimální regresí. Nově byla zachycena a popsána drobná cholecystolitiáza, bez dilatace žlučových cest, ale drenáž při vyšetření patrna nebyla. Doplněno gastroskopické vyšetření s nálezem jednoho stentu zavedeného in situ do oblasti cystické léze a druhého stentu vycestovaného do D2 duodena, který byl neprodleně endoskopicky extrahován. Následně byla provedena endosonografie s nálezem zbývajícího stentu v dobré poloze, po vodiči a dilatátoru byly přidány ke stávající drenáži ještě další dva 10 F pigtaily o délce 5 cm. Při implantaci stentů se objevila hnisavá, putridně páchnoucí tekutina vytékající z ohraničené nekrotické kolekce, která byla odebrána ke kultivačnímu mikrobiologickému vyšetření. Kultivačně prokázáno signifikantní pomnožení Klebsiella pneumoniae produkující â-laktamázu širokého spektra (ESBL), Enterococcus raffinosus, Streptococus anginosus a Prevotella buccae. Po 5 dnech hospitalizace byla cíleně upravena antibiotická terapie dle citlivosti na parenterální dvojkombinaci ciprofloxacin 500 mg 2× denně a linesolid 600 mg 2× denně. Pro přechodnou elevaci transamináz i obstrukčních jaterních enzymů – AST 0,78 μkat/ l, ALT 1,11 μkat/ l, GGT 10,69 μkat/ l a ALP 5,79 μkat/ l – byla doplněna kontrolní endosonografie, která vyloučila obstrukci žlučových cest a ověřila správnou polohu pigtail stentů. Laboratorní elevace v dalších dnech spontánně odezněla, klesly i markery zánětu. Po 9 dnech parenterální cílené antibiotické léčby byla pacientka propuštěna bez obtíží domů a byla jí doporučena ještě pokračující perorální antibiotická terapie ciprofloxacinem 500 mg 2× denně na týden.
I přes doporučení ohledně brzké kontroly se pacientka dostavuje do naší gastroenterologické ambulance až s odstupem 2 měsíců – na začátku října 2018. Po zavedení diety s omezením tuků došlo k mírnému hmotnostnímu úbytku, ale celkově byla pacientka bez obtíží. Byl proveden kontrolní UZ břicha s nálezem regredující reziduální ohraničené nekrotické kolekce, nyní s velikostí 30 mm na hranici těla a kaudy. Vzhledem k průběhu onemocnění a dosavadním nálezům na zobrazovacích vyšetřeních přehodnocujeme etiologii recidivující pankreatitidy na biliární a doporučujeme pacientce cholecystektomii. I přes vysvětlení vhodnosti cholecystektomie si pacientka nepřeje operační výkon ani případné ERCP s papilosfinkterotomií. Dle přání pacientky byla kontrola naplánována s odstupem 2 měsíců s kontrolním UZ a rozvahou o extrakci stentů.
Těsně před plánovanou kontrolou, 29. listopadu 2018, pacientka opět přišla do naší nemocnice pro akutně vzniklou bolest břicha a zvracení. Vstupní laboratorní testy byly, kromě mírné elevace CRP na 25 mg/ l, bez patologie, bez elevace leukocytů, amylázy, transamináz, GMT nebo ALP. Bylo provedeno akutní nativní CT břicha s nálezem stentů dislokovaných do ileocékální oblasti (obr. 5). Nebyly zachyceny známky poruchy pasáže ani cystická léze v oblasti pankreatu. Byla zavedena konzervativní léčba analgetiky a prokinetikem s efektem. Pacientka byla v dalším průběhu hospitalizace bez obtíží a bez známek poruchy pasáže. Po 3 dnech konzervativní léčby byl proveden kontrolní nativní RTG břicha, který ověřil umístění stentů přibližně ve stejné poloze, jako byly na vstupním CT. Následně byla provedena koloskopie s pokusem o endoskopické odstranění stentů koloskopem Pentax EC38-i10L o vnějším průměru 13,2 mm. V céku byla patrna edematózní Bauhinská chlopeň neprostupná pro endoskop, přes chlopeň jsme ale pozorovali uvízlý pigtail stent v terminálním ileu hned za chlopní. Pro nepříznivou polohu se nezdařilo zachytit stent extrakčními kleštěmi a extrahovat. Po 40 min byl výkon ukončen pro intoleranci ze strany pacientky i přes navýšenou analgosedaci. Doporučili jsme pokus o extrakci v celkové anestezii.
Obr. 5. Nativní CT břicha. Topogram s uvízlými stenty v terminálním ileu a distální částí ilea (A). Double pigtail stent v oblasti terminálního ilea obturující orální část Bauhinské chlopně (B).
Fig. 5. Native-phase abdominal CT scan. Topogram with stucked stents in terminal ileum and distal part of ileum (A). Double-pigtail stent in terminal ileum obstructing the oral part of ileocaecal valve (B)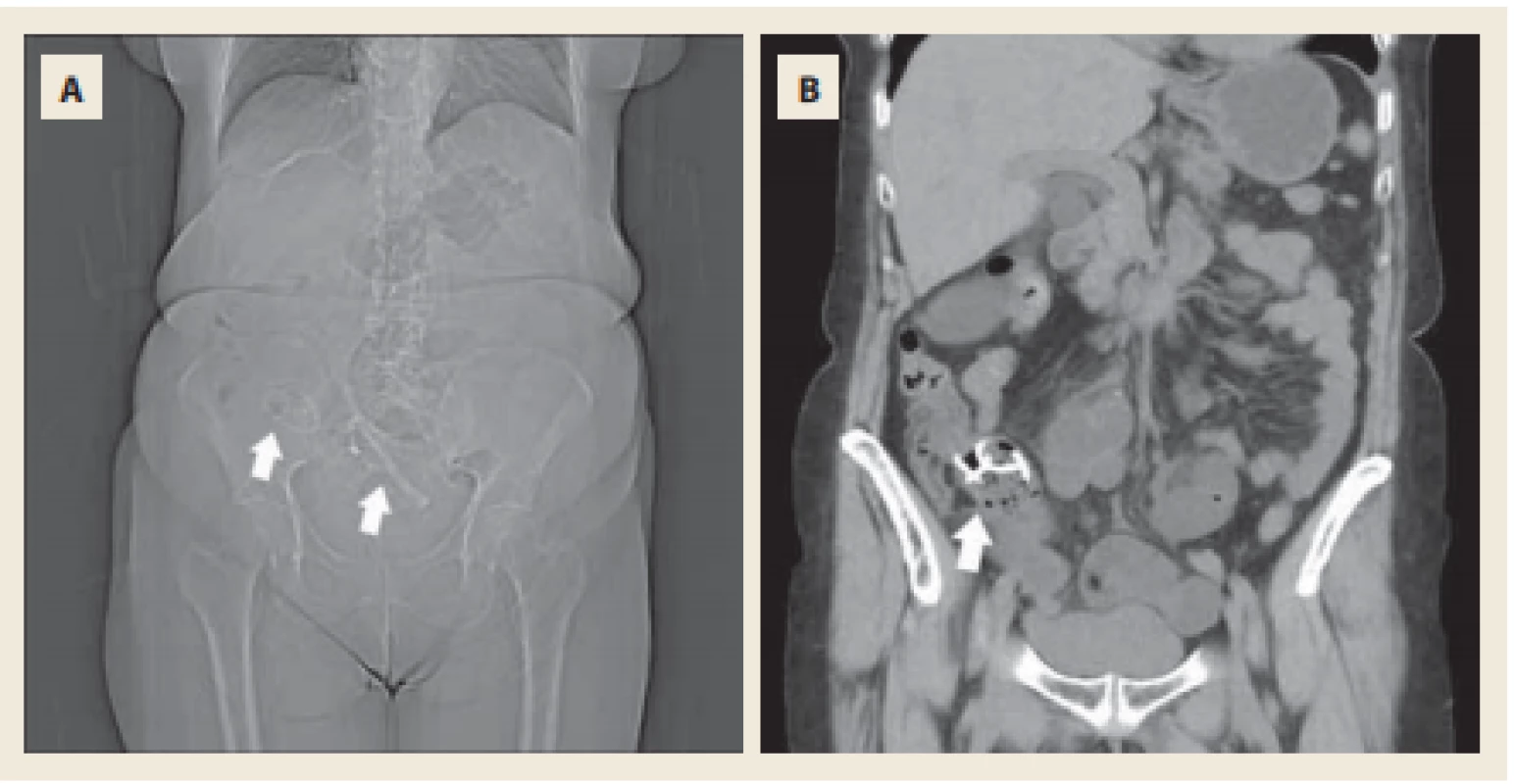
Po domluvě byla pacientka přeložena na Interní oddělení Nemocnice Strakonice, kde byla provedena další koloskopie, tentokrát v celkové anestezii. Za použití standardního endoskopu Olympus CF-H 190 L bylo dosaženo céka s nálezem těžce edematózní Bauhinské chlopně, kterou se po opakovaných pokusech nepodařilo překonat a ani vizualizovat pankreatické stenty v terminálním ileu. Přístroj byl následně vyměněn za enteroskop s užším tubusem, ale ani tím se nepodařilo dosáhnout terminálního ilea.
Pacientka po třech pokusech o endoskopickou extrakci byla nakonec indikována k operačnímu řešení a přeložena zpátky na Chirurgické oddělení Nemocnice Český Krumlov. Po iniciálních vyšetřeních byla 10. prosince provedena nejdříve diagnostická laparoskopie, adheziolýza srůstů a mobilizace kličky ilea se stenty, následně byla provedena konverze na otevřenou transrektální laparotomii s dvojnásobnou enterotomií s extrakcí všech třech plastových pigtailů. Dva dny po operaci si pacientka stěžovala na bolesti v okolí rány, laboratorně byla patrná elevace zánětlivých markerů – CRP 366 mg/ l, leukocyty 16,8 × 10⁹/ l. Byla nasazena empiricky parenterální antibiotika Amoksiklav 1,2 g 2× denně a metronidazol 500 mg 3× denně. Další den byla infikovaná rána rozpuštěna a dezinfikována. Další pooperační průběh byl již bez komplikací. V průběhu několika dalších dní byl naložen VAC systém k urychlení hojení rány. Posléze se celkový klinický i laboratorní nález zlepšil, klesly markery zánětu a pacientka dobře tolerovala zatížení stravou. Rána byla 3 týdny po úvodní operaci resuturována. Byla zahájena mobilizace a rehabilitace pacientky. Začátkem roku 2019 byla pacientka v uspokojivém stavu propuštěna do domácí léčby.
Dne 15. ledna 2019 přišla k ambulantní kontrole do gastroenterologické ambulance v naší nemocnici v dobrém stavu, na kontrolní abdominální sonografii nebyly kromě cholecystolitiázy patrny závažné patologické změny. V průběhu roku 2019 byla pacientka ještě několikrát krátce hospitalizována pro epizodické bolesti břicha, těžká ani středně závažná pankreatitida se již ale neopakovala. Cholecystektomii pacientka nadále odmítá.
Diskuze
Akutní pankreatitida je závažné onemocnění slinivky břišní, které si vyžaduje často multidisciplinární přístup, ale i správné zhodnocení etiologie. V naší kazuistice se ukazuje právě jako klíčové správné určení etiologie akutní pankreatitidy. Vzhledem k absenci rizikových faktorů (hyperlipidemie, hyperkalcemie, užívání rizikových léků) nebo abúzu alkoholu v anamnéze a negativním CT nálezům stran přímých nebo nepřímých známek cholelitiázy se nejdříve zdála být nejpravděpodobnější etiologie idiopatická. Později, po prokázání cholecystolitiázy ultrasonograficky, jsme ale etiologii přehodnotili na biliární. CT není ideální diagnostickou metodou k detekci cholecystolitiázy, neboť žluč a litiáza mohou mít shodnou denzitu [1]. Nabízí se zde zamyšlení o vhodnosti rutinní transabdominální ultrasonografie u každé akutní pankreatitidy. Ultrasonografie břicha je totiž velice dobrým a rychlým pomocným zobrazovacím vyšetřením ať na chirurgické, nebo interní ambulanci. Na druhé straně se zde ukazuje jako zásadní i spolupráce ze strany pacienta. V našem případě byla spolupráce s pacientkou problematická, léčba a organizace vyšetření byly často modifikovány časovými preferencemi pacientky. Cholecystektomie ani ERCP s papilosfinkterotomií nakonec do dnešní doby nebyly provedeny pro nesouhlas pacientky s operačním nebo dalším endoskopickým výkonem. Zde vidíme rezervu v podrobném poučení pacientky ohledně benefitů nabízených výkonů. Edukace by měla být opakovaná a především pro pacienta srozumitelná.
V léčbě lokálních komplikací akutní pankreatitidy došlo v průběhu posledních let k významným změnám. Dříve preferované chirurgické a perkutánní přístupy vystřídaly metody endoskopické drenáže. Zprvu byly drenáže prováděny při příznivých anatomických podmínkách pod přímou vizuální endoskopickou kontrolou, později se drenáže staly výhradní doménou endosonografie [6,7]. Při transmurální endoskopické drenáži je pod EUS kontrolou vytvořena komunikace mezi kolekcí a žaludkem či duodenem. Průchodnost této komunikace a drenáž jsou zajištěny plastovými nebo metalickými stenty.
V našem případě byla EUS navigovaná drenáž plastovými stenty komplikována sekundární infekcí a migrací stentů. Infekce je jedna z komplikací po EUS navigované drenáži, která může prodloužit hospitalizaci, zvýšit počet rehospitalizací nebo endoskopických intervencí [9]. Dle Barona et al je drenáž ohraničených pankreatických nekróz komplikována až v 36 % případů, a to zejména krvácením nebo sekundární infekcí [10]. Avšak v domácí studii udávají autoři výskyt sekundární infekce podstatně nižší, a to přibližně v 10 % drénovaných cystických lézí [11]. Jako rizikové faktory Guo et al označili především velikost cystické léze ≥ 15 cm a léze vzniklé na podkladě akutní pankreatitidy. Dalším možným rizikovým faktorem může být přítomnost diabetes mellitus. Profylaktické podání širokospektrých antibiotik nemělo v této studii signifikantnější dopad na výskyt sekundární infekce po EUS navigované drenáži [9].
Migrace stentů je další běžnou komplikací EUS navigované drenáže cystických lézí, u plastových double-pigtail stentů udávají studie výskyt asi 11 % [12]. Na rozdíl od našeho kazuistického sdělení si většinu chirurgických intervencí vyžadují migrace dovnitř cystické léze.
Yangova multicentrická studie uvádí přibližně stejnou efektivitu krátkodobé drenáže pseudocyst metalickými i plastovými stenty [13]. S tím se ztotožňuje ve své studii i kolektiv česko-slovenských autorů [11]. Rozdílný výsledek však ukázala další studie Sharaihy et al, kde byla drenáž cystických lézí metalickými stenty efektivnější s nižším výskytem komplikací výkonu než drenáž stenty plastovými [14]. Někteří autoři udávají, že drenáž plastovými stenty si vyžaduje opakování drenáže pro migraci nebo obstrukci stentů v 15–34 % [15,16]. Co se týče ohraničené pankreatické nekrózy, uvádějí Siddiqui et al i vyšší efektivitu metalických stentů ve srovnání s plastovými stenty [17]. Nedávná retrospektivní kohortová studie ukázala také rozdíly mezi jednotlivými typy metalických stentů ve prospěch LAMS (lumen apozičních metalických stentů). Byl prokázán signifikantně vyšší počet migrací tubulárních metalických stentů oproti skupině s LAMS [18].
Všeobecné preferenční implantaci LAMS brání především ekonomická náročnost takto poskytované péče.
Závěr
Akutní pankreatitida často vyžaduje intenzivní a multidisciplinární přístup, včetně endoskopických nebo chirurgických intervencí. V našem sdělení jsme prezentovali případ recidivující akutní pankreatitidy provázené řadou komplikací. V úvodu byla etiologie na základě vstupních vyšetření nejasná, později se zjistil biliární původ obtíží. Vývoj symptomatické ohraničené pankreatické nekrózy si vyžádal opakovanou EUS navigovanou drenáž plastovými stenty komplikovanou sekundární infekcí a migrací stentů. Opakované migrace stentů vyústily až v nutnost chirurgické intervence a provedení dvojnásobné enterotomie s extrakcí stentů.
Doručeno/ Submitted: 27. 8. 2020
Přijato/ Accepted: 5. 11. 2020
MU Dr. Michal Rybár
Gastroenterologická ambulance, Interní oddělení
Nemocnice Český Krumlov, a.s.
Nemocniční 429
381 01 Český Krumlov
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašuji, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení. Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Článek není podpořen grantem ani nevznikl za podpory žádné společnosti.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Conflict of Interest: The authors declare that the article/ manuscript complies with ethical standards, patient anonymity has been respected, and they state that they have no financial, advisory or other commercial interests in relation to the subject matter.
Publication Ethics: This article/ manuscript has not been published or is currently being submitted for another review. The authors agree to publish their names and e-mails in the published article/ manuscript.
Dedication: The article/ manuscript is not supported by a grant nor has it been created with the support of any company.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Zdroje
1. Trna J, Kala Z. Klinická pankreatologie. 1. vyd. Praha: Mladá fronta 2016 : 28–91.
2. Kim KO, Kim TN. Acute pancreatic pseudocyst: incidence, risk factors, and clinical outcomes. Pancreas 2012; 41(4): 577–581. doi: 10.1097/ MPA.0b013e3182374def.
3. Stamatakos M, Stefanaki C, Kontzoglou K et al. Walled-off pancreatic necrosis. World J Gastroenterol 2010; 16(14): 1707–1712. doi: 10.3748/ wjg.v16.i14.1707.
4. Ramia JM, de la Plaza R, Quiñones-Sampedro JE et al. Walled-off pancreatic necrosis. Neth J Med 2012; 70(4): 168–171.
5. Baillie J. Pancreatic pseudocysts (Part I). Gastrointest Endosc 2004; 59(7): 873–879. doi: 10.1016/ s0016-5107(04)00354-2.
6. Varadarajulu S, Christein JD, Tamhane A et al. Prospective randomized trial comparing EUS and EGD for transmural drainage of pancreatic pseudocysts (with videos). Gastrointest Endosc 2008; 68(6): 1102–1111. doi: 10.1016/ j.gie.2008.04.028.
7. Kahaleh M, Shami VM, Conaway MR et al. Endoscopic ultrasound drainage of pancreatic pseudocyst: a prospective comparison with conventional endoscopic drainage. Endoscopy 2006; 38(4): 355–359. doi: 10.1055/ s-2006-925249.
8. Gralnek IM, Dumonceau JM, Kuipers EJ et al. Diagnosis and management of nonvariceal upper gastrointestinal hemorrhage: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2015; 47(10): a1–a46. doi: 10.1055/ s-0034-1393172.
9. Guo J, Feng L, Sun S et al. Risk factors for infection after endoscopic ultrasonography-guided drainage of specific types of pancreatic and peripancreatic fluid collections (with video). Surg Endosc 2016; 30(7): 3114–3120. doi: 10.1007/ s00464-015-4557-3.
10. Baron TH, Thaggard WG, Morgan DE et al. Endoscopic therapy for organized pancreatic necrosis. Gastroenterology 1996; 111(3): 755–764. doi: 10.1053/ gast.1996.v111.pm8780582.
11. Poc K, Mačinga P, Štirand P et al. Endosonograficky navigovaná drenáž pankreatických kolekcí – vlastní zkušenosti. Gastroent Hepatol 2017; 71(5): 401–408. doi: 10.14735/ amgh2017401.
12. Fasullo M, Al-Azzawi Y, Kheder J et al. Comparing efficacy of lumen-apposing stents to plastic stents in the endoscopic management of mature peripancreatic fluid collections: a single-center experience. Clin Exp Gastroenterol 2018; 11 : 249–254. doi: 10.2147/ CEG.S167736.
13. Yang D, Amin S, Gonzale S et al. Clinical outcomes of EUS-guided drainage of debris-containing pancreatic pseudocysts: a large multicenter study. Endosc Int Open 2017; 5(2): E130–E136. doi: 10.1055/ s-0042-121666.
14. Sharaiha RZ, DeFilippis EM, Kedia P et al. Metal versus plastic for pancreatic pseudocyst drainage: clinical outcomes and success. Gastrointest Endosc 2015; 82(5): 822–827. doi: 10.1016/ j.gie.2015.02.035.
15. Ang TL, Kongkam P, Kwek ABE et al. A two-center comparative study of plastic and lumen-apposing large diameter self-expandable metallic stents in endoscopic ultrasound-guided drainage of pancreatic fluid collections. Endosc Ultrasound 2016; 5(5): 320–327. doi: 10.4103/ 2303-9027.191659.
16. Ge N, Hu J, Sun S et al. Endoscopic ultrasound-guided pancreatic pseudocyst drainage with lumen-apposing metal stents or plastic double-pigtail stents: a multifactorial analysis. J Transl Int Med 2017; 5(4): 213–219. doi: 10.1515/ jtim-2017-0036.
17. Siddiqui AA, Kowalski TE, Loren DE et al. Fully covered self-expanding metal stents versus lumen-apposing fully covered self-expanding metal stent versus plastic stents for endoscopic drainage of pancreatic walled-off necrosis: clinical outcomes and success. Gastrointest Endosc 2017; 85(4): 758–765. doi: 10.1016/ j.gie.2016.08.014.
18. Yao Y, Zhang D, Guo J et al. A novel self-expanding biflanged metal stent vs tubular metal stent for EUS-guided transmural drainage of pancreatic pseudocyst: a retrospective, cohort study. Medicine (Baltimore) 2019; 98(3): e14179. Doi: 10.1097/ MD.0000000000014179.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Kvíz z klinické praxeČlánek Editorial
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2021 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Kvíz z klinické praxe
- Idiopatické střevní záněty mají negativní dopad na reprodukční chování pacientů: první multicentrický průzkum v České republice
- Obezita a idiopatické střevní záněty
- The influence of microscopic inflammation at resection margins on early postoperative endoscopic recurrence after ileocaecal re-section for Crohn’s disease
- Editorial
- Komentář ke článku „The influence of microscopic in-flammation at resection margins on early postoperative endoscopic recurrence after ileocaecal resection for Crohn’s disease“ (Journal Crohn’s Colitis 2020; 14(3): 361–368
- Psychologické aspekty a možnosti psychologických intervencií u pacientov s nešpecifickými zápalovými ochoreniami čreva
- Posterior reversible encephalopathy syndrom u dítěte s ulcerózní kolitidou
- Rifaximin v terapii idiopatických střevních zánětů
- Vzácná příčina mnohočetných vředů tenkého střeva
- (Ne)tradičně komplikovaná pankreatitida
- Neuroendokrinní tumor periapendikulární oblasti dna céka – kazuistika
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 3
- Dát či nedat vakcínu proti covid-19 pacientům s IBD?
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz Diferenciální diagnóza terminální ileitidy: Meckelův divertikl v atypické lokalizaci
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vzácná příčina mnohočetných vředů tenkého střeva
- Psychologické aspekty a možnosti psychologických intervencií u pacientov s nešpecifickými zápalovými ochoreniami čreva
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 3
- Neuroendokrinní tumor periapendikulární oblasti dna céka – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



