-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Neuroendokrinní tumor periapendikulární oblasti dna céka – kazuistika
Neuroendocrine tumor of the periappendicular area of the cecum bottom – a case report
Neuroendocrine tumors are slow-growing neoplasms, histologically based on enteroendocrine cells. They are tumors with different degrees of differentiation, uncertain biological nature and metastatic ability. Their most common localization is the gastrointestinal tract, with a special group of the neuroendocrine tumors of appendix, which are incidentally found after appendectomy. In case report, we would like to present a case of a patient with neuroendocrine tumors of appendix diagnosed by colonoscopy.
Keywords:
neuroendocrine tumor – appendix – colonoscopy
Autoři: Bača L. 1; Psár R. 2,3; Hanousek M. 1; Fojtík P. 1
Působiště autorů: Centrum péče o zažívací trakt, Nemocnice AGEL Ostrava-Vítkovice a. s. 1; Radiologické oddělení, Nemocnice AGEL Ostrava-Vítkovice a. s. 2; Lékařská fakulta Univerzity Palackého v Olomouci 3
Vyšlo v časopise: Gastroent Hepatol 2021; 75(1): 68-71
Kategorie: Gastrointestinální onkologie: kazuistika
doi: https://doi.org/10.48095/ccgh202168Souhrn
Neuroendokrinní nádory jsou pomalu rostoucí neoplazie, histologicky vycházející z enteroendokrinních buněk. Jedná se o nádory s různým stupněm diferenciace, nejisté biologické povahy a se schopností metastazovat. Nejčastější lokalizací je gastrointestinální trakt, přičemž zvláštní skupinou jsou neuroendokrinní nádory appendixu, na které se přichází náhodně po appendektomii. V kazuistice prezentujeme případ pacienta s neuroendokrinním nádorem appendixu diagnostikovaným koloskopií.
Klíčová slova:
neuroendokrinní nádor – appendix – koloskopie
Úvod
Novotvary appendixu jsou vzácné. Vyskytují se přibližně v 1 % všech appendektomií [1,2]. Neuroendokrinní nádory appendixu tvoří 50 % všech novotvarů vycházejících ze tkáně appendixu a jsou zjištěny nejčastěji náhodně při appendektomii a jejich incidence se pohybuje v rozpětí 3–9 případů na 1 000 appendektomií [3–5]. Diagnostikovány bývají mezi 40. a 50. rokem života [6]. Dobře diferencovaný neuroendokrinní nádor je vzácný novotvar, nicméně incidence v průběhu let stoupá. Dle dat SEER (Surveillance Epidemiology and End Results) z let 1973–2012 u 64 971 pacientů z USA s neuroendokrinním nádorem narostla roční incidence z 1,09 na 6,98 na 100 000 pacientů [7]. Neuroendokrinní nádory appendixu zaujímají 16–38 % všech neuroendokrinních nádorů vyrůstajících z gastrointestinálního traktu [8,9].
Popis případu
Sedmdesátiletý muž léčený s hypertenzí, po přeléčené hluboké žilní trombóze v minulosti, bez další nutnosti antikoagulační léčby, s glaukomem a vertebrogenním algickým syndromem, bez jiných známých komorbidit byl vyšetřován pro hmotnostní úbytek. Počáteční fyzikální a laboratorní vyšetření byla bez pozoruhodností. Následná břišní ultrasonografie bez patologie, gastroskopie prokázala H. pylori pozitivní gastritidu, která byla zaléčena inhibitory protonové pumpy a eradikována antibiotiky. Provedená koloskopie se pro špatnou přípravu nezdařila. Při opakovaném vyšetření po prodloužené přípravě bylo již možné proniknout až do terminálního ilea, kdy byla při extrakci přístroje zachycena v oblasti dna céka v ústí appendixu plochá léze typu 0–IIa dle Pařížské klasifikace, velikosti 6 × 6 mm (obr. 1, 2). Po prohlédnutí v narrow band imaging (NBI) byl proveden pokus o endoskopické snesení. Výkon byl však problematický a v rámci endoskopie nebyla záruka úplného snesení, navíc s nejistotou v podobě invaze do hlubších struktur appendixu.
Obr. 1. Koloskopický obraz léze dna céka při ústí appendixu 0–IIa dle Pařížské klasifikace.
Fig. 1. Colonoscopic image of the cecum bottom lesion at the orifice of appendix 0–IIa according to the Paris classifi cation.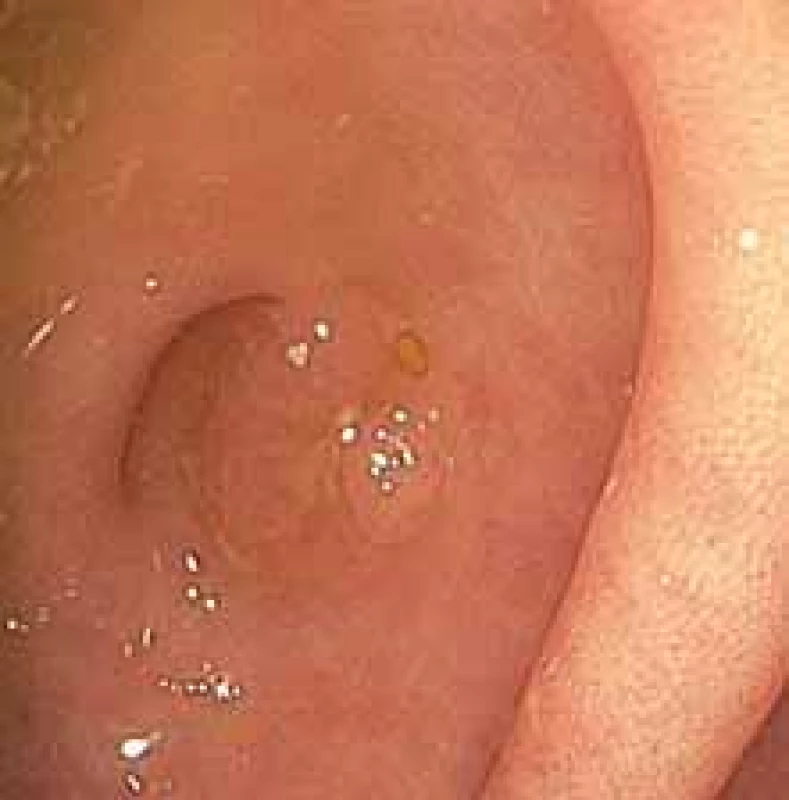
Obr. 2. Koloskopický obraz léze dna céka při ústí appendixu 0–IIa dle Pařížské klasifikace v NBI (Narrow Band Imaging).
Fig. 2. Colonoscopic image of the cecum bottom lesion at the orifice of the appendix 0–IIa according to the Paris classification in the NBI (Narrow Band Imaging).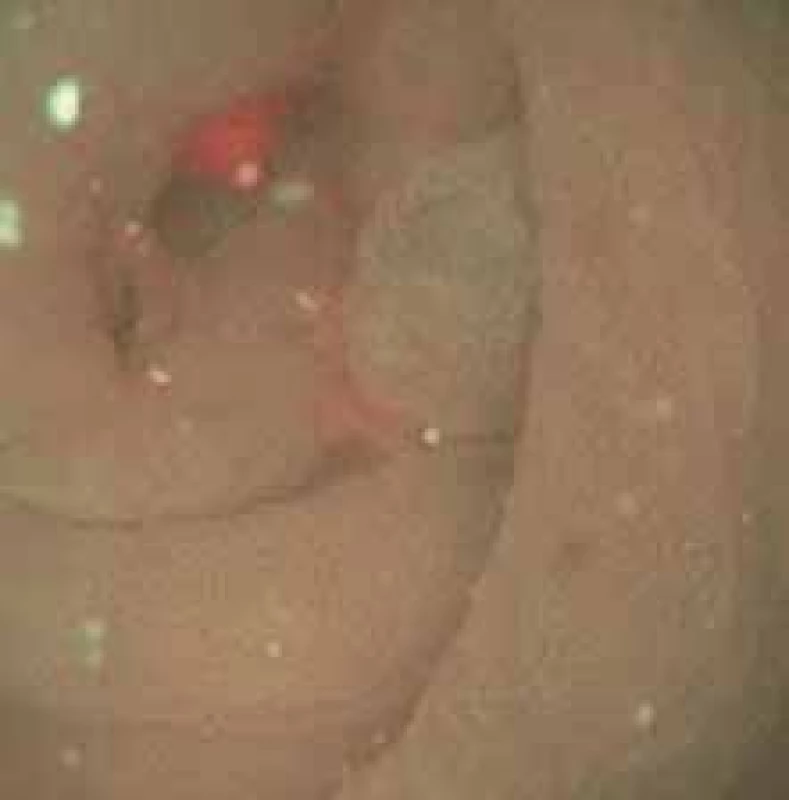
Histologický obraz byl popsán jako fragmenty hyperplastického polypu sliznice tlustého střeva se strukturami nádoru s trabekulární úpravou. Patologem byl nález hodnocen jako neuroendokrinní tumor vycházející z appendixu s pozitivním imunohistochemickým vyšetřením na chromogranin a synaptofyzin, s Ki-67 1 % a mitotickou aktivitou 0. Dle kritérií Světové zdravotnické organizace (WHO) byl proto hodnocen jako grade 1.
Dále byl proveden odběr chromograninu, jehož hodnota 88 ng/ ml byla v referenčních mezích. Prostřednictvím výpočetní tomografie (CT) břicha jsme vyloučili regionální a vzdálená ložiska v břišní dutině. S těmito výsledky byl pak pacient referován na multioborovém onkologickém semináři, kde byl indikován vzhledem k nejistotě R0 kompletního snesení k ileocékální resekci. Samotný operační výkon včetně předoperační přípravy proběhl za standardních podmínek s odesláním resekátu k histologickému vyšetření, kde již nebyly nalezeny struktury neuroendokrinního tumoru, stejně tak bylo bez nálezu malignity 14 odebraných lymfatických uzlin.
Zpětně bylo tedy endoskopické snesení hodnoceno jako kurativní. Nádor byl vzhledem k absenci angioinvaze či lymfangioinvaze hodnocen jako T1M0N0. Pacient je dále dispenzarizován v onkologické ambulanci s pravidelnými koloskopickými kontrolami po 1 roce a kontrolami hladin chromograninu v séru.
Diskuze
Neuroendokrinní nádory vyrůstající v gastrointestinálním traktu, plicích a genitouretrálním traktu byly dříve označovány jako karcinoidy, protože byly morfologicky odlišné a klinicky méně agresivní než gastrointestinální adenokarcinomy. Mikroskopický obraz neuroendokrinních nádorů je relativně pestrý, a i proto, že histologická stavba diferencovanějších neuroendokrinních nádorů nemá vliv na chování nádorů, byla na základě histomorfologické stavby nádoru vydána WHO klasifikace, která dle poslední aktualizace z roku 2019 neuroendokrinní nádory definuje jako dobře diferencované [10]. Nádorové buňky vykazují imunohistologickou pozitivitu znaků neuroendokrinní diferenciace, a proto se využívá detekce chromograninu A a synaptofyzinu. Neuroendokrinní nádory se rozdělují do několika stupňů podle mitotické aktivity, která je hodnocena jako počet mitóz na deset zorných polí mikroskopu při zvětšení 400krát (HPF, High Power Fields) a podle proliferační aktivity hodnocené pomocí imunohistologické detekce nukleárního antigenu Ki-67.
Zahrnují dobře diferencované neuroendokrinní nádory (grade 1–3), špatně diferencovaný neuroendokrinní karcinom (velkobuněčný a malobuněčný) a smíšený neuroendokrinní novotvar (MiNEN) – ty jsou typicky kombinací neuroendokrinního karcinomu a adenokarcinomu (tab. 1).
Tab. 1. Klasifikace neuroendokrinních nádoru dle WHO z roku 2019.
Tab. 1. WHO classifi cation of neuroendocrine tumors from 2019.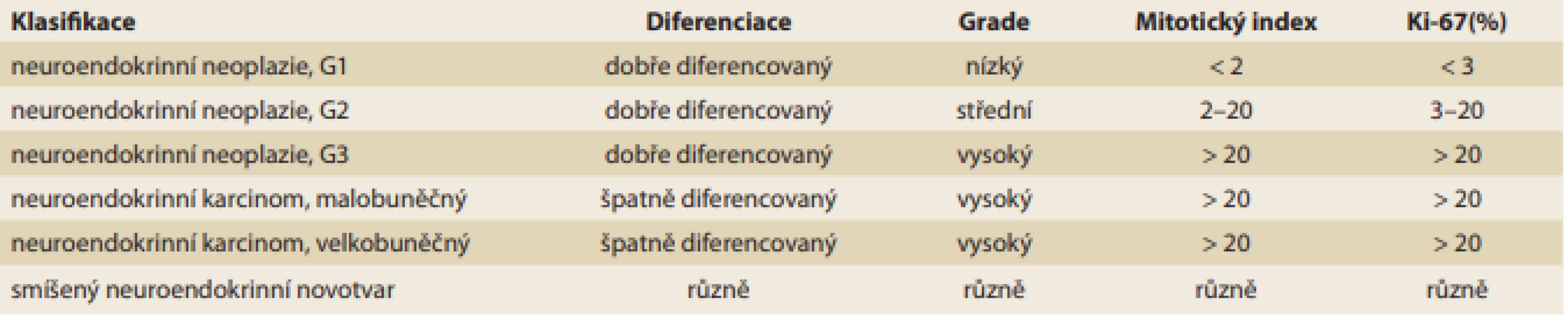
V souhrnu je 70–75 % dobře diferencovaných neuroendokrinních nádorů, zbytek jsou high-grade neuroendokrinní karcinomy [11,12].
Neuroendokrinní nádory appendixu jsou často submukózní a jsou lokalizovány v distální třetině appendixu, kde nezpůsobují obstrukci, a proto je většina pacientů asymptomatických. Symptomy se dostavují až u větších nádorů s metastázami do lymfatických uzlin. Asi 10 % neuroendokrinních nádorů appendixu se vyskytuje v jeho bázi, kde způsobují obstrukci vedoucí následně k zánětlivým změnám [11]. Bylo prokázáno, že velikost tumoru zvyšuje riziko metastatického postižení, které zasahuje především lymfatické uzliny a játra. Neuroendokrinní nádory appendixu mohou produkovat serotonin či jiné vazoaktivní látky, které jsou zodpovědné za karcinoidový syndrom, ten je však u neuroendokrinních nádorů appendixu extrémně vzácný a vyskytuje se pouze při metastatickém postižení [13–15].
Neuroendokrinní nádory appendixu jsou převážně incidentalomy nalezené v rámci pooperační histologie [6]. U našeho pacienta se jednalo také o náhodný nález, nicméně bez proběhlé appendektomie, která většinu doporučení předchází, a může se tak stát metodou kurativní.
Obecně základem diagnostiky neuroendokrinních nádorů je stanovení sekreční aktivity nádoru a jeho lokalizace. Neexistují specifické diagnostické postupy zaměřené na neuroendokrinní nádor appendixu. V rámci posouzení sekreční aktivity může být využit chromogranin A, nicméně jeho validita získává na významu jen u pokročilých diseminovaných lézi [6]. Může být falešně pozitivní při renální insuficienci a také při užívání inhibitorů protonové pumpy (IPP), ty musejí být alespoň na 3 týdny před odběrem vysazeny [16]. Ve vzácných případech může být užitečné u pacientů s projevy karcinoidového syndromu určení hladin kyseliny 5-hydroxyindoloctové v moči [17].
K lokalizaci nádoru a jeho eventuálnímu šíření nám mohou dopomoci metody jako transabdominální ultrasonografie, která je nejméně invazivním postupem, leč limitována zkušenostmi vyšetřujícího. Endoskopické metody našemu případu navzdory jsou zřídka nápomocné, ledaže je nádor lokálně pokročilý a infiltruje cékum [18]. V našem případě byl nádor primárně diagnostikován právě díky kvalitně provedené koloskopii s intubací céka. V rámci stagingu pak bylo přistoupeno k CT, především kvůli nejistotě stran hloubky invaze. Pozitronovou emisní tomografii (FDG PET-CT) či OctreoScan s jednofotonovou emisní výpočetní tomografií (SPECT), kdy je analog somatostatinu značený radioizotopem vychytáván ve tkáních exprimujících somatostatinové receptory, lze využít v případech, kdy není zajištěna kompletní resekce nádoru nebo je podezření na vzdálené metastázy [19–21].
Došetřování rozsahu postižení u neuroendokrinních nádorů appendixu je indikováno u novotvarů větších než 2 cm, u pacientů po nekompletní resekci či u pacientů s rizikem přítomnosti regionálních či vzdálených metastáz. Náš případ je v tomto atypický, protože léze sice měla velikost pouze 6 mm, nicméně byla snesena po částech, a tedy nebyla jistota kompletní resekce. Další dovyšetření a léčba pak byly indikovány po konsenzu multioborového semináře.
Klinické chování a prognóza jsou přímo spojeny s velikostí nádoru. Neoplazie < 2 cm se nacházejí u více než 95 % pacientů a riziko metastatického postižení je velice nízké [6]. Dle databáze SEER (Surveillance Epidemiology and End Results) bylo 5leté přežití u pacientů s neuroendokrinními nádory appendixu velikosti < 3 cm bez metastáz 100 %, u pacientů s neoplazií velikosti 2–3 cm s postižením regionálních lymfatických uzlin a s neoplazií ≥ 3 cm bez metastáz 78 % a pacienti s neoplazií se vzdálenými metastázami 32 % [22].
Neuroendokrinní nádory appendixu jsou diagnostikovány často náhodně při operaci pro appendicitu. Další léčba stejně jako staging se odvíjí od velikosti nádoru, lokalizace v appendixu, od invaze do mezoappendixu či cév a od proliferační aktivity nádoru [6]. Primární metodou u lokalizovaného postižení je radikální resekční výkon. U nádorů < 1,9 cm bez metastatického postižení je appendektomie dostatečnou léčebnou metodou. U dobře diferencovaných neuroendokrinních nádorů > 2 cm je pak metodou volby pravostranná hemikolektomie. U metastazujícího onemocnění je snaha o maximální redukci primárního nádoru radiofrekvenční ablací (RFA) či chemoembolizací jaterních metastáz. U funkčních nádorů s projevy karcinoidového syndromu je nutná hormonální terapie analogy somatostatinu, imunoterapie interferonem alfa, případně systémová chemoterapie [6,23,24].
U pacienta prezentovaného v kazuistice byla zvolena po dohodě lékařů multioborového semináře ileocékální resekce. Bylo přihlédnuto jednak k malým rozměrům nádoru, jednak k nejistotě R0 resekce při endoskopickém snesení, lokalizaci v oblasti dna céka a míře případné invaze do dalších struktur appendixu. V tomto kontextu by byla pouhá appendektomie nedostatečná.
Zpočátku došetřovaný hmotnostní úbytek pak výše diagnostikovaný neuroendokrinní nádor nevysvětluje a byl hodnocen ve světle všech dalších vyšetření spíše jako projev dlouhodobě špatných dietních návyků pacienta, který je dále pravidelně sledován a nebyl u něj další pokles hmotnosti zaznamenán.
Závěr
Neuroendokrinní tumory appendixu jsou relativně vzácné neoplazie, jejichž projev může být různý v závislosti na velikosti, lokalizaci a šíření nádoru. Navzdory doporučením má endoskopie nepopiratelné místo v diagnostice neuroendokrinních nádorů dna céka a báze appendixu. Základem péče je multidisciplinární spolupráce.
Doručeno/ Submitted: 15. 2. 2020
Přijato/ Accepted: 20. 7. 2020
MU Dr. Lukáš Bača
Centrum péče o zažívací trakt
Nemocnice AGEL Ostrava-Vítkovice a. s.
Zalužanského 1192/ 15
703 84 Ostrava
Zdroje
1. Connor SJ, Hanna GB, Frizelle FA. Appendiceal tumors: retrospective clinicopathologic analysis of appendiceal tumors from 7,970 appendectomies. Dis Colon Rectum 1998; 41(1): 75–80. doi: 10.1007/ BF02236899.
2. Unver N, Coban G, Arıcı DS et al. Unusual Histopathological Findings in Appendectomy Specimens: A Retrospective Analysis of 2047 Cases. Int J Surg Pathol 2019; 27(2): 142–146. doi: 10.1177/ 1066896918784650.
3. Sandor A, Modlin IM. A retrospective analysis of 1570 appendiceal carcinoids. Am J Gastroenterol 1998; 93(3): 422–428. doi: 10.1111/ j.1572-0241.1998.00422.x.
4. Mullen JT, Savarese DM. Carcinoid tumors of the appendix: a population-based study. J Surg Oncol 2011; 104(1): 41–44. doi: 10.1002/ jso. 21888.
5. Goede AC, Caplin ME, Winslet MC. Carcinoid tumour of the appendix. Br J Surg 2003; 90(11): 1317–1322. doi: 10.1002/ bjs.4375.
6. Pape UF, Niederle B, Costa F et al. ENETS Consensus Guidelines for Neuroendocrine Neoplasms of the Appendix (Excluding Goblet Cell Carcinomas). Neuroendocrinology 2016; 103(2): 144–152. doi: 10.1159/ 000443165.
7. Dasari A, Shen C, Halperin D et al. Trends in the Incidence, Prevalence, and Survival Outcomes in Patients with Neuroendocrine Tumors in the United States. JAMA Oncol 2017; 3(10): 1335–1342. doi: 10.1001/ jamaoncol.2017.0589.
8. Maggard MA, O‘Connell JB, Ko CY. Updated population-based review of carcinoid tumors. Ann Surg 2004; 240(1): 117–122. doi: 10.1097/ 01.sla.0000129342.67174.67.
9. Ellis L, Shale MJ, Coleman MP. Carcinoid tumors of the gastrointestinal tract: trends in incidence in England since 1971. Am J Gastroenterol 2010; 105(12): 2563–2369. doi: 10.1038/ ajg. 2010.341.
10. Klimstra DS, Kloppell G, La Rosa S et al. Classification of neuroendocrine neoplasms of the digestive system. In: WHO Classification of Tumours: Digestive System Tumours. 5th ed. Lyon: International Agency for Research on Cancer 2019 : 16.
11. Hsu C, Rashid A, Xing Y et al. Varying malignant potential of appendiceal neuroendocrine tumors: importance of histologic subtype. J Surg Oncol 2013; 107(2): 136–143. doi: 10.1002/ jso.23205.
12. Cai W, Tan Y, Ge W et al. Pattern and risk factors for distant metastases in gastrointestinal neuroendocrine neoplasms: a population-based study. Cancer Med 2018; 7(6): 2699–2709. doi: 10.1002/ cam4.1507.
13. Goede AC, Caplin ME, Winslet MC: Carcinoid tumour of the appendix. Br J Surg 2003; 90(11): 1317–1322. doi: 10.1002/ bjs.4375.
14. Groth SS, Virnig BA, Al-Refaie WB et al. Appendiceal carcinoid tumors: predictors of lymph node metastasis and the impact of right hemicolectomy on survival. J Surg Oncol 2011; 103(1): 39–45. doi: 10.1002/ jso.21764.
15. Stinner B, Rothmund M: Neuroendocrine tumours (carcinoids) of the appendix. Best Pract Res Clin Gastroenterol 2005; 19(5): 729–738. doi: 10.1016/ j.bpg.2005.06.003.
16. Šachlová M. Neuroendokrinní nádory v gastroenterologické praxi. Gastroent Hepatol 2016; 70(3); 220–225. doi:10.14735/ amgh2016csgh.info04.
17. O’Toole D, Grossman A, Gross D et al. ENETS consensus guidelines for the standards of care in neuroendocrine tumors: biochemical markers. Neuroendocrinology 2009; 90(2): 194–202. doi: 10.1159/ 000225948.
18. Pape UF, Perren A, Niederle B et al. ENETS consensus guidelines for the management of patients with neuroendocrine neoplasms from the jejuno-ileum and the appendix including goblet cell carcinomas. Neuroendocrinology 2012; 95(2): 135–156. doi: 10.1159/ 000335629.
19. Louthan O. Neuroendokrinní tumory appendixu. Vnitř Lék 2009; 55 (11): 1051–1055.
20. Louthan O. Neuroendokrinní tumory tenkého střeva – jejuna a ilea. Čes a Slov Gastroent a Hepatol 2009; 63(6): 284–291.
14. Landry CS, Woodall C, Scoggins CR et al. Analysis of 900 appendiceal carcinoid tumors for a proposed predictive staging system. Arch Surg 2008; 143(7): 664–670. doi: 10.1001/ archsurg. 143.7.664.
21. Virgone C, Cecchetto G, Alaggio A et al. Appendiceal neuroendocrine tumours in child - hood: Italian TREP project. J Pediatr Gastroenterol Nutr 2014; 58(3): 333–338. doi: 10.1097/ MPG.0000000000000217.
23. Boudreaux JP, Klimstra DS, Hassan MM et al. The NANETS consensus guideline for the diagnosis and management of neuroendocrine tumors: well-differentiated neuroendocrine tumors of the Jejunum, Ileum, Appendix, and Cecum. Pancreas 2010; 39(6): 753–766.
24. Kunz PL, Reidy-Lagunes D, Anthony LB et al. Consensus guidelines for the management and treatment of neuroendocrine tumors. Pancreas 2013; 42(4): 557–577. doi: 10.1097/ MPA. 0b013e31828e34a4.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Kvíz z klinické praxeČlánek Editorial
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2021 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Kvíz z klinické praxe
- Idiopatické střevní záněty mají negativní dopad na reprodukční chování pacientů: první multicentrický průzkum v České republice
- Obezita a idiopatické střevní záněty
- The influence of microscopic inflammation at resection margins on early postoperative endoscopic recurrence after ileocaecal re-section for Crohn’s disease
- Editorial
- Komentář ke článku „The influence of microscopic in-flammation at resection margins on early postoperative endoscopic recurrence after ileocaecal resection for Crohn’s disease“ (Journal Crohn’s Colitis 2020; 14(3): 361–368
- Psychologické aspekty a možnosti psychologických intervencií u pacientov s nešpecifickými zápalovými ochoreniami čreva
- Posterior reversible encephalopathy syndrom u dítěte s ulcerózní kolitidou
- Rifaximin v terapii idiopatických střevních zánětů
- Vzácná příčina mnohočetných vředů tenkého střeva
- (Ne)tradičně komplikovaná pankreatitida
- Neuroendokrinní tumor periapendikulární oblasti dna céka – kazuistika
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 3
- Dát či nedat vakcínu proti covid-19 pacientům s IBD?
- Výběr z mezinárodních časopisů
- Správná odpověď na kvíz Diferenciální diagnóza terminální ileitidy: Meckelův divertikl v atypické lokalizaci
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vzácná příčina mnohočetných vředů tenkého střeva
- Psychologické aspekty a možnosti psychologických intervencií u pacientov s nešpecifickými zápalovými ochoreniami čreva
- Inhibitory protonové pumpy – známe je dobře? Jsou skutečně tak bezpečné? – část 3
- Neuroendokrinní tumor periapendikulární oblasti dna céka – kazuistika
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



