-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Stanovenie hladiny C-peptidu v priebehu glukózového tolerančného testu u pacientov s karcinómom pankreasu
Determination of C-peptide levels during a glucose tolerance test in patients with pancreatic cancer
The mechanism responsible for diabetes mellitus (DM) in patients with pancreatic cancer remains controversial. The aim of our study is to verify that pancreatic cancer patients had lower C-peptide levels during an oral glucose tolerance test (oGTT) than the control subjects, regardless of the presence of diabetes mellitus, since until now only a few similar studies have been published.
Methods:
In our study we analysed C-peptide response at 120 minutes during the oGTT in 29 patients with pancreatic cancer and 23 patients with chronic pancreatitis – control subjects.Results:
C-peptide levels, observed at 120 minutes during the oGTT in patients with pancreatic cancer, were not lower than those of control subjects, and the difference was not statistically significant (p = 0.257). By means of the oGTT, we detected diabetes mellitus in 15 (51%) patients in the pancreatic cancer group and in nine (39%) control subjects. There were no statistically significant differences in C-peptide levels in patients with and without DM, or in the pancreatic cancer group (p = 0.383) or in control subjects with chronic pancreatitis (p = 0.877).Conclusions:
We did not confirm that a characteristic feature of pancreatic cancer patients is decreased C-peptide production during the oGTT in comparison with the control subjects. Further studies are needed in a large number of patients to assess the importance of impaired glucose tolerance or diabetes mellitus in pancreatic cancer detection.Key words:
pancreatic cancer – diabetes mellitus – C-peptide
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.
Submitted:
14. 4. 2014Accepted:
26. 5. 2014
Autoři: T. Novotná; M. Bátovský
Působiště autorů: Gastroenterologická klinika SZU a UNB, UN sv. Cyrila a Metoda, Bratislava
Vyšlo v časopise: Gastroent Hepatol 2014; 68(4): 325-329
Kategorie: Klinická a experimentální gastroenterologie: původní práce
Souhrn
Súvislosti medzi diabetes mellitus (DM) a karcinómom pankreasu zatiaľ nie sú jednoznačne objasnené. V našej práci sme chceli overiť, či pacienti s karcinómom pankreasu majú štatisticky významne nižšiu hladinu C-peptidu v priebehu orálneho glukózového tolerančného testu (oGTT) oproti kontrolnej skupine, bez ohľadu na súčasnú diagnózu diabetes mellitus, keďže takýchto štúdií bolo zatiaľ publikovaných málo.
Metódy:
V našej práci sme analyzovali hodnoty C-peptidu v 120 min oGTT u 29 pacientov s karcinómom pankreasu a 23 pacientov s chronickou pankreatitídou – kontrolný súbor.Výsledky:
Hodnoty C-peptidu v 120 min oGTT u pacientov s karcinómom pankreasu neboli nižšie ako u kontrolného súboru, rozdiel nebol štatisticky významný (p = 0,257). Pomocou oGTT sme u 15 (51 %) pacientov s karcinómom pankreasu a u deviatich (39 %) pacientov v kontrolnej skupine zistili DM. Nezistili sme štatisticky významný rozdiel v hladinách C-peptidu u pacientov s DM a bez neho u pacientov s karcinómom pankreasu (p = 0,383) ani u pacientov s chronickou pankreatitídou (p = 0,877).Záver:
Nepotvrdili sme nižšie hodnoty C-peptidu počas oGTT u pacientov s karcinómom pankreasu v porovnaní s kontrolným súborom. Pre posúdenie významu súvislostí diabetes mellitus a karcinómu pankreasu v diagnostike karcinómu sú potrebné ďalšie štúdie s väčším počtom pacientov.Kľúčové slová:
karcinóm pankreasu – diabetes mellitus – C-peptid
Súčasný výskyt karcinómu pankreasu a diabetes mellitus je tak častý, že dlhodobo vzbudzuje oprávnenú pozornosť. Prevalencia karcinómu pankreasu u diabetes mellitus je udávaná od ôsmich do viac ako 80 %, pritom čím neskôr sú tieto údaje publikované, tým je uvádzané percento spravidla vyššie. Súvislosť medzi diabetes mellitus a karcinómom pankreasu sa zrejme týka len diabetu II. typu. Podľa literárnych údajov bol vzťah medzi týmito ochoreniami rozpoznaný už v roku 1933, ale doteraz sa nepodarilo jednoznačne preukázať, či je diabetes mellitus príčinou alebo následkom karcinómu pankreasu [1]. Jedna časť štúdií podporuje predpoklad, že diabetes mellitus je rizikovým faktorom pre vznik karcinómu pankreasu, ostatné sa skôr prikláňajú k názorom, ktoré vidia v diabete možný včasný symptóm karcinómu pankreasu.
Práca Nakamoriho et al publikovaná v roku 1999, skúmala možnosť využitia poznatkov o vzťahu karcinómu pankreasu a diabetes mellitus v diferenciálnej diagnostike karcinómu pankreasu a chronickej pankreatitídy. Autori sledovali sérové hladiny proinzulínu a C-peptidu u pacientov s karcinómom pankreasu a s chronickou pankreatitídou v priebehu orálneho glukózového záťažového testu. Zistili, že pacienti s karcinómom mali zníženú produkciu C-peptidu a zvýšenú sekréciu proinzulínu pri zaťažení glukózou. Vysvetlením by podľa nich mohla byť abnormálna konverzia proinzulínu na inzulín a C-peptid u pacientov s karcinómom pankreasu [2].
Inzulín je syntetizovaný beta bunkami Langerhansových ostrovčekov pankreasu vo forme proinzulínu. Molekula proinzulínu je zložená z peptidových reťazcov A a B, ktoré sú spojené C-peptidom. Pri sekrécii sa C-peptid odštepuje v ekvimolárnom množstve s inzulínom, ale na rozdiel od inzulínu sa v organizme ďalej nemetabolizuje a v nezmenenej forme sa z neho vylučuje močom. Z toho vyplýva, že množstvo močom vylúčeného C-peptidu za 24 hod zodpovedá za určitých podmienok množstvu syntetizovaného inzulínu, preto je jeho stanovenie výhodné z hľadiska posúdenia produkcie inzulínu.
Cieľom našej práce bolo zistiť, či majú pacienti s karcinómom pankreasu odlišné hodnoty C-peptidu pri perorálnej záťaži glukózou oproti kontrolnej skupine a či sú tieto hodnoty ovplyvnené súčasným výskytom diabetes mellitus.
Pacienti a metodika
Do nášho súboru sme od roku 2006 do roku 2012 postupne zaradili 29 pacientov hospitalizovaných na našom pracovisku s diagnózou karcinómu pankreasu, ktorá bola následne histologicky potvrdená.
Materiál na histologické vyšetrenie bol u pacientov získaný pri laparotómii alebo až pri sekcii. Kontrolný súbor tvorili pacienti s diagnózou chronickej pankreatitídy, stanovenou najmenej tri roky pred zaradením do súboru, ktorí boli od roku 2006 do roku 2012 postupne hospitalizovaní na našom pracovisku za účelom plánovanej výmeny duodenobilárneho drénu pre stenózu d. choledochus pri základnom ochorení. Všetci pacienti v oboch skupinách mali realizované CT vyšetrenie pankreasu. Ani jeden pacient s karcinómom pankreasu v čase zaradenia do súboru nepodstúpil paliatívnu ani radikálnu liečbu základného ochorenia. Všetci pacienti vo vyšetrovanom aj kontrolnom súbore boli v stabilizovanom stave a nemali známu diagnózu diabetu (tab. 1).
Tab. 1. Základné charakteristiky súboru. Tab. 1. Basic characteristics of patients. 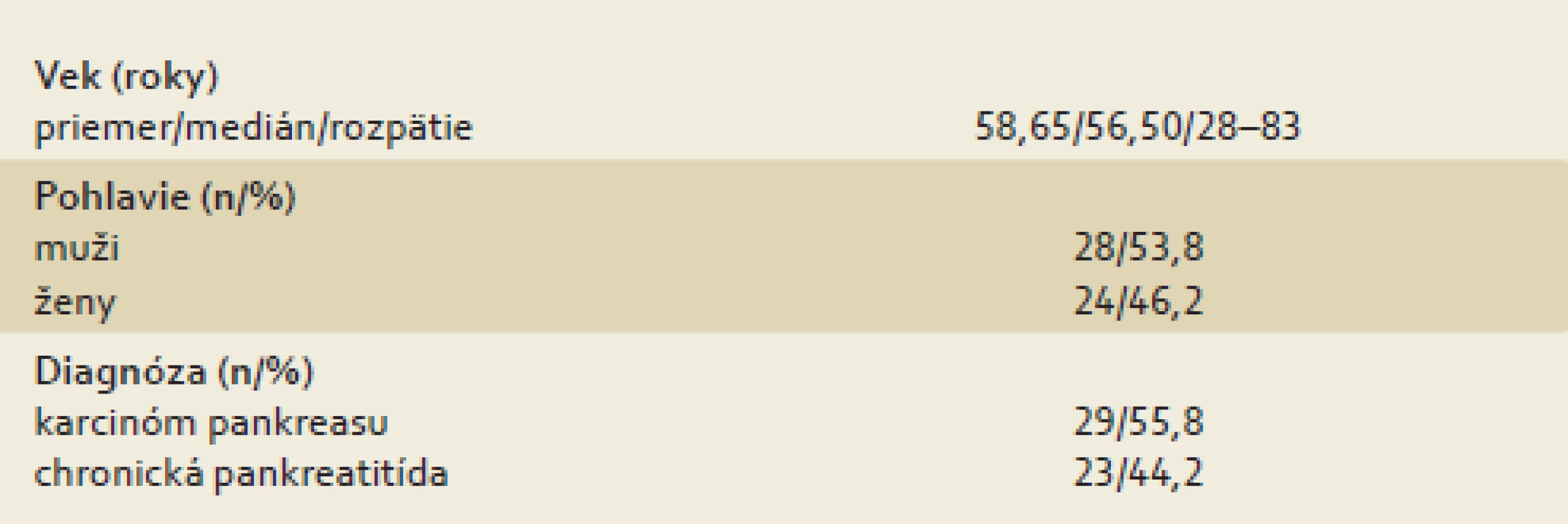
Všetci pacienti z oboch súborov pri prijatí do nemocnice podpísali informovaný súhlas, ktorý zahŕňal aj všetky postupy použité v uvedenej práci.
Metodika vyšetrení
Pacientom sme ráno nalačno štandardným spôsobom odobrali prvú vzorku krvi na stanovenie glykémie, Na, K, Cl, kreatinínu, osmolarity a krvného obrazu. Súčasne sme odobrali vzorku krvi na vyšetrenie C-peptidu 1 (C-peptid pred podaním glukózy), ktorá bola ihneď po odbere uložená do nádoby s ľadom a najviac do 20 min transportovaná do biochemického laboratória na ďalšie spracovanie. Jedna časť séra bola spracovaná v biochemickom laboratóriu Medirex na analyzátore ADVIA Centaur sendvičovou metódou imunochemickou analýzou pomocou priamej elektrochemiluminiscencie (ECLIA) za použitia dvoch monoklonálnych myších protilátok. Druhú časť séra sme uložili v mrazničke pri odporúčanej teplote –20 °C, pretože za týchto podmienok môže byť vzorka skladovaná viac rokov a je možné ju použiť na opakované vyšetrenie C-peptidu aj proinzulínu, ktorý sa zatiaľ na Slovensku štandardne nevyšetruje. Po odbere prvej vzorky krvi bol realizovaný glukózový záťažový test (75 g glukózy podaných per os). Druhá vzorka krvi bola odobratá po hodine od podania glukózy na vyšetrenie glykémie. Tretia vzorka bola odobratá po dvoch hodinách od podania glukózy a vyšetrené boli tie isté parametre ako pri prvom odbere (glykémia, Na, K, Cl, kreatinín, osmolarita, krvný obraz) a vzorka krvi na vyšetrenie C-peptidu 2 (C-peptid 2 hod po podaní glukózy), pričom postup bol identický ako pri odbere a spracovaní prvej vzorky. Hodnoty glykémie po 2 hod po podaní glukózy sme hodnotili ako poruchu glukózovej tolerancie v rozpätí od 7,8 do 11,0 mmol/l, od 11,1 mmol/l vyššie ako diabetes mellitus.
Použité štatistické metódy: vzhľadom na veľkost súboru sme na porovnanie hodnôt C-peptidu 2 u karcinómu pankreasu a chronickej pankreatitídy zvolili Mann-Whitneyho test pre neparametrické premenné.
Výsledky
Na základe glukózového záťažového testu sme diagnostikovali patologický glukózový metabolizmus u 88 % pacientov s karcinómom pankreasu a u 61 % pacientov s chronickou pankreatitídou. Podrobnejšie výsledky uvádza tab. 2.
Tab. 2. Patologický glukózový metabolizmus u pacientov s karcinómom pankreasu a s chronickou pankreatitídou. Tab. 2. Pathological glucose metabolism in patients with pancreatic cancer and chronic pancreatitis. 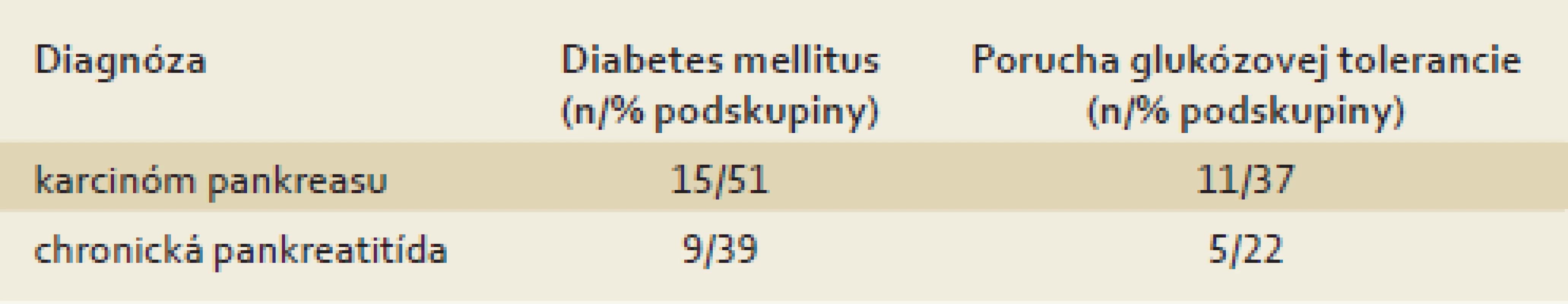
Priemerné hladiny C-peptidu 2 v podskupinách pacientov s karcinómom pankreasu a s chronickou pankreatitídou a v podskupinách pacientov s karcinómom pankreasu a diabetes mellitus a chronickou pankreatitídou a diabetes mellitus uvádza tab. 3.
Tab. 3. Priemerné hladiny C-peptidu 2 u pacientov s karcinómom pankreasu a s chronickou pankreatitídou. Tab. 3. Mean levels of C-peptide 2 in patients with pancreatic cancer and chronic pancreatitis. 
Nepotvrdili sme štatisticky významný rozdiel hladín C-peptidu 2 u pacientov s karcinómom pankreasu oproti kontrolnej skupine pacientov s chronickou pankreatitídou (p = 0,257) (graf 1).
Graf 1. Hladiny C-peptidu 2 u pacientov s karcinómom pankreasu a s chronickou pankreatitídou. Graph 1. C-peptide 2 levels in patients with pancreatic cancer and chronic pancreatitis. 
Nezistili sme ani štatisticky významný rozdiel v hladinách C-peptidu 2 u pacientov s karcinómom pankreasu a diabetes mellitus oproti kontrolnej skupine pacientov s chronickou pankreatitídou a diabetes mellitus (p = 0,411).
Porovnali sme aj priemerné hladiny C-peptidu 2 u pacientov s diabetes mellitus a bez diabetu v oboch podskupinách (u pacientov s karcinómom pankreasu a s chronickou pankreatitídou). Výsledky uvádza tab. 4.
Tab. 4. Priemerné hodnoty C-peptidu 2 u pacientov s diabetes mellitus a bez neho u pacientov s karcinómom pankreasu a s chronickou pankreatitídou. Tab. 4. Mean values of C-peptide 2 in patients with and without diabetes mellitus in patients with pancreatic cancer and chronic pancreatitis. 
Ani v jednej podskupine sa neukázal štatisticky významný rozdiel (pacienti s karcinómom pankreasu p = 0,383, pacienti s chronickou pankreatitídou p = 0,877).
Diskusia
Hladiny C-peptidu v sére dobre odzrkadľujú hladiny inzulínu, ktoré by mali byť podľa práce Nakamoriho et al [2] u pacientov s karcinómom pankreasu štatistiky významne nižšie oproti kontrolnej skupine, čo sa nám ale v našej práci nepodarilo potvrdiť. Naopak, hodnoty C-peptidu 2 boli skôr, aj keď nie štatisticky významne, vyššie. Príčinou môže byť „chyba malých čísiel“, t.j. pomerne malý počet pacientov zaradených do sledovania, aj keď uvedená práca japonských autorov, z ktorej sme vychádzali, nedisponovala s významne vyšším počtom pacientov. Príčiny menšieho počtu zaradených pacientov sú viaceré: z etických dôvodov neboli zaradení pacienti s už diagnostikovaným diabetes mellitus (potreba odberu vzoriek v priebehu glukózového záťažového testu – uvedené vyšetrenie nebolo zahrnuté v podpísanom informovanom súhlase) a nízky počet pacientov s histologicky potvrdeným karcinómom pankreasu, ktorý bol vo významnej miere zapríčinený limitovanými možnosťami odberu materiálu na histologické vyšetrenie. Vo viacerých prípadoch, pokiaľ pacienti nepodstúpili z rôznych dôvodov laparotómiu, sme definitívny histologický nález získali až z pitevného protokolu. Pacienti v kontrolnej skupine nemali diagnózu chronickej pankreatitídy stanovenú histologicky, všetci mali realizované CT a ERCP vyšetrenie, pričom diagnóza musela byť stanovená najmenej tri roky. Týchto pacientov sme sledovali aj nasledujúce, minimálne ďalšie dva roky, pričom sa ani u jedného v tomto čase karcinóm pankreasu nemanifestoval.
Na druhej strane môžeme potvrdiť, že nie je štatisticky významný rozdiel v hodnotách C-peptidu 2 medzi pacientmi s diabetom a bez diabetu v oboch skupinách s karcinómom pankreasu aj s chronickou pankreatitídou.
Publikovaných prác, ktoré sa zaoberajú vzťahom karcinómu pankreasu a diabetes mellitus je pomerne veľké množstvo, podstatne menej je k dispozícii údajov o konkrétnom vyhodnotení laboratórnych parametrov – inzulín//C-peptid, proinzulín a ich zmien v súvislosti s karcinómom pankreasu. Otázka vzájomného vzťahu diabetes mellitus a karcinómu pankreasu tiež nie je v súčasnosti uspokojivo zodpovedaná.
Podľa dvoch prospektívnych kohortových štúdií, ktoré trvali viac ako 20 rokov, je riziko získania karcinómu pankreasu u pacientov s diabetom liečených inzulínom 2,2-krát vyššie ako u populácie, ktorá diabetes nemá [3]. Hyperinzulinémia pri diabetes mellitus druhého typu spôsobuje, že exokrinné bunky pankreasu sú vystavené vysokým koncentráciám inzulínu, čo môže spustiť ich nekontrolovaný rast [2]. Existujú experimentálne práce, ktoré dokazujú, že inzulín má in vitro priamy rastový efekt na pankreatické karcinómové bunky [3]. Viaceré štúdie ale nepotvrdili zvýšené riziko vzniku karcinómu pankreasu u pacientov so zvýšenými koncentráciami inzulínu a inzulínovou rezistenciou ani po vyše desaťročnom sledovaní [4].
Inzulínová rezistencia u karcinómu pankreasu vzniká pomerne skoro, preto sa diabetes mellitus často manifestuje ešte pred zistením samotného nádoru. Experimentálne pozorovania ukázali, že porucha glukózovej tolerancie a periférna inzulínová rezistencia vznikajú už v štádiu karcinómu pankreasu, ktoré je možné diagnostikovať len mikroskopicky. V japonskej štúdii publikovanej v roku 1994 bola porucha glukózovej tolerancie jedinou klinickou abnormalitou u karcinómov pankreasu menších ako 2 cm [5]. Je zaujímavé, že mierny stupeň inzulínovej rezistencie sa potvrdil aj u pacientov s karcinómom pankreasu bez diabetes mellitus alebo poruchy glukózovej tolerancie [6]. Podľa retrospektívnej štúdie z Mayo Clinic novozistený diabetes mellitus odhalil až 22 % karcinómov pankreasu pred klinickou manifestáciou neoplastickej symptomatológie. Do štúdie bolo zahrnutých 100 pacientov s karcinómom pankreasu (od roku 1995 do roku 2007), 40 % z nich malo diabetes mellitus, u 65 % sa diabetes objavil do 36 mesiacov pred diagnózou karcinómu [7]. V poslednej publikovanej štúdii, ktorá zahŕňala 600 pacientov s karcinómom pankreasu, ten istý autor zistil 68 % prevalenciu diabetes mellitus, ktorú hodnotil ako paraneoplastický fenomén [8]. Zaujímavé sú výsledky štúdie Wakasugiho et al z roku 2001, ktorá nepotvrdila výskyt diabetickej angiopatie u pacientov s karcinómom pankreasu a diabetes mellitus [1]. Vzhľadom na to, že vývoj diabetických komplikácii je dlhodobý a prežívanie pacientov s karcinómom pankreasu krátke, komplikácie diabetu sa zrejme nestihnú vyvinúť, čo podporuje hypotézu, že diabetes mellitus je komplikáciou karcinómu pankreasu a nie jeho príčinou [9]. Žiaľ prevalencia nediagnostikovaného diabetu v populácii je vysoká (cca 50 %), takže karcinóm pankreasu sa nie zriedkavo manifestuje ešte pred klinickými príznakmi cukrovky [10].
Vzťah karcinómu pankreasu a diabetes mellitus možno z hľadiska jeho využitia v diagnostike nádorového procesu vidieť v dvoch rovinách. Na jednej strane novozistený diabetes mellitus je často spojený s neresekabilným tumorom pankreasu, čo spochybňuje využitie hyperglykémie ako včasného markera neoplastického procesu, ale na druhej strane, keď sa realizoval scree-ning hyperglykémie u pacientov s operabilnými tumormi, vyše 60 % pacientov malo abnormálny glukózový záťažový test [11]. Vysoká prevalencia inoperabilného karcinómu pankreasu u pacientov s novozisteným diabetom mellitom je podmienená tým, že títo pacienti boli vyšetrovaní za účelom vyhľadania karcinómu pankreasu až vtedy, keď už mali príznaky nádorového procesu (chudnutie, bolesti, ikterus). V štúdiách, kde bola zistená vysoká prevalencia diabetu mellitu u pacientov s resekabilným karcinómom, boli za účelom zistenia diabetu vyšetrovaní len operabilní pacienti. Pannala et al publikovali 50 % prevalenciu diabetu mellitu v súbore 232 pacientov v prvom a druhom štádiu karcinómu pankreasu [6]. Podľa populačnej štúdie malé, ale významné percento (0,85 %) populácie nad 50 rokov s novozisteným diabetes mellitus malo do troch rokov od jeho zistenia diagnostikovaný karcinóm pankreasu, ktorý ešte nemal iné klinické príznaky, čo predstavuje osemnásobne vyššiu incidenciu oproti ostatnej populácii [12]. Štúdie z posledných rokov uvádzajú priemerne desaťmesačný interval medzi vznikom cukrovky a stanovením diagnózy karcinómu pankreasu. Určenie diagnózy karcinómu pankreasu desať mesiacov pred jeho klinickými príznakmi má signifikantný vplyv na jeho resekabilitu, preto by cielené pátranie po potenciálnom tumore u novozisteného diabetes mellitus mohlo pozitívne ovplyvniť prognózu týchto pacientov. Z praktického hľadiska je potrebné si uvedomiť, že využitie uvedených faktov v klinickej praxi naráža na skutočnosť, že počet pacientov vo vyššom veku s cukrovkou je podstatne vyšší ako s karcinómom pankreasu, a odlíšenie diabetes mellitus 2. typu od diabetu asociovaného s karcinómom pankreasu je podľa klinických príznakov veľmi problematické.
Príčiny poruchy glukózového metabolizmu u veľkej časti pacientov s karcinómom pankreasu doteraz nie sú exaktne objasnené. Je pravdepodobné, že dôležitú úlohu má dysfunkcia beta buniek pankreasu, zistená bola nižšia a oneskorená produkcia inzulínu, nie je vylúčená porucha intracelulárneho metabolizmu glukózy. Včasný vznik periférnej inzulínovej rezistencie podmienil úvahy o existencii abnormálnych receptorov alebo o ich obsadení inými hormónmi/sérovými faktormi, ktoré môžu produkovať nádorové bunky [13,14]. Tieto teórie podporuje skúsenosť, že po resekcii karcinómu pankreasu často dôjde k poklesu inzulínovej rezistencie, čo sa klinicky prejaví úpravou alebo zlepšením diabetu. Je možné, že ide o dôsledok odstránenia alterovaných buniek Langerhansových ostrovčekov, ktoré môžu produkovať diabetogénne látky [15].
Uvažovať o využití hyperglykémie pri screeningu karcinómu pankreasu u asymptomatických jedincov by bolo možné len vtedy, keby existovala možnosť, ako odlíšiť diabetes mellitus vyvolaný karcinómom od diabetu mellitu 2. typu, ktorý s ním nesúvisí. Preto je lákavá predstava objavenia sérologického markera indukujúceho diabetes mellitus u karcinómu pankreasu, ktorý by bolo možné využiť pre včasnú diagnózu karcinómu [10]. Druhým závažným problémom zostáva fakt, že v súčasnosti dostupnými neinvazívnymi vyšetrovacími metódami vo väčšine prípadov nediagnostikujeme karcinóm pankreasu u asymptomatických jedincov vo včasnom – operabilnom štádiu ochorenia a prakticky vôbec nie v kurabilnom štádiu. Navyše diabetes mellitus 2. typu často prebieha viac rokov latentne a to isté platí aj pre karcinóm pankreasu, u ktorého dĺžku latentného štádia nepoznáme. Približne u 20–30 % pacientov s karcinómom pankreasu nezistíme diabetes mellitus ani poruchu glukózovej tolerancie. Príčinou môže byť biologická odlišnosť karcinómov pankreasu [16].
Záver
Výsledky nášho sledovania nepotvrdili závery citovanej práce Nakamoriho et al [2] o možnosti využitia C-peptidu pri záťaži glukózou v diferenciálnej diagnóze karcinómu pankreasu a chronickej pankreatitídy. Pre posúdenie významu hodnotenia sledovaných parametrov z hľadiska problematiky zmien glukózového metabolizmu u karcinómu pankreasu je potrebná realizácia ďalších kontrolovaných štúdií.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 14. 4. 2014
Přijato: 26. 5. 2014
MUDr. Tatiana Novotná
Gastroenterologická klinika SZU a UNB
UN sv. Cyrila a Metoda
Antolská 11, 851 07 Bratislava
ta.na@post.sk
Zdroje
1. Wakasugi H, Funakoshi A, Iguchi H. Clinical observations of pancreatic diabetes caused by pancreatic carcinoma, and survival period. Int J Clin Oncol 2001; 6(1): 50–54.
2. Nakamori S, Ishikawa O, Ohigashi H et al. Increased blood proinsulin and decreased C-peptide levels in patients with pancreatic cancer. Hepatogastroenterology 1999; 46(25): 16–24.
3. Gapstur SM, Gann PH, Lowe W et al. Abnormal glucose metabolism and pancreatic cancer mortality. JAMA 2000; 283(19): 2552–2558.
4. Kuang TT, Jin da Y, Wang DS et al. Clinical epidemiological analysis of the relationship between pancreatic cancer and diabetes mellitus: data from a single institution in China. J Dig Dis 2009; 10(1): 26–29. doi: 10.1111/j.1751-2980.2008.00359.x.
5. Ariyama J. Abnormal glucose tolerance in patients with early pancreatic carcinoma. Int J Pancreatol 1994; 91 : 59–67.
6. Pannala R, Leirness JB, Bamlet WR et al. Prevalence and clinical profile of pancreatic cancer-associated diabetes mellitus. Gastroenterology 2008; 134(4): 981–987. doi: 10.1053/j.gastro.2008.01.039.
7. Aggarwal G, Rabe KG, Petersen GM et al. New-onset diabetes in pancreatic cancer: a study in the primary care setting. Pancreatology 2012; 12(2): 156–161. doi: 10.1016/j.pan.2012.02.003.
8. Aggarwal G, Kamada P, Chari ST. Prevalence of diabetes mellitus in pancreatic cancer compared to common cancers. Pancreas 2013; 42(2): 198–201. doi: 10.1097/MPA.0b013e3182592c96.
9. Permert J, Adrian TE, Jacobsson P et al. Is profound peripheral insulin resistance in patients with pancreatic cancer caused by a tumor-assotiated factor? Am J Surg 1993; 165(1): 61–66.
10. Chari ST, Leibson CL, Rabe KG et al. Pancreatic cancer-associated diabetes mellitus: prevalence and temporal assotiation with diagnosis of cancer. Gastroenterology 2008; 134(1): 95–101.
11. Tsuchiya R, Noda T, Harada N et al. Collective review of small carcinomas of the pancreas. Ann Surg 1986; 203(1): 77–81.
12. Chari ST, Leibson CL, Rabe KG et al. Probability of pancreatic cancer following diabetes: a population-based study. Gastroenterology 2005; 129(2): 504–511.
13. Nakamori S, Yashima K, Murakami Y et al. Association of p53 gene mutations with short survival in pancreatic adenocarcinoma. Jpn J Cancer Res 1995; 86(2): 174–181.
14. Basso D, Valerio A, Seraglia R et al. Putative pancreatic cancer-associated diabetogenic factor: 2030 MW peptide. Pancreas 2002; 24(1): 8–14.
15. Eckhauser FE, Colletti LM, Knol JA. Pancreatic carcinoma. Current Opinion in Gastroenterology 1995; 11(5): 414–422.
16. Ishikawa O, Ohigashi H, Imaoka S et al. Minute carcinoma of the pancreas measuring 1 cm or less in diameter – collective review of Japanese case reports. Hepatogastroenterology 1999; 46(25): 8–15.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek Divertikulární chorobaČlánek Autoimunitní pankreatitida u pacientů po resekci pro ložiskový proces pankreatu – první výsledkyČlánek Projekt RISING STARSČlánek Novinka v léčbě akutních i chronických průjmů v České republice – Tammex family a Tammex family plusČlánek Správná odpověď na kvíz
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2014 Číslo 4- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Pozvánka na ESGE Live Demonstration
- Pohled laiků, lékařů a pacientů na novou metodu léčby achalázie (POEM) – dotazníková studie
- Efekt učení perorální endoskopické myotomie (POEM) během prvního roku ověřování metody v České republice
- Efektivní techniky uzávěru transrektálního přístupu NOTES – výsledky experimentální studie
- Kvíz: Recidivující subileózní stav u mladé pacientky
- Divertikulární choroba
- Celiakia – body mass index u pacientov v čase diagnózy a efekt bezlepkovej diéty
- Stanovenie hladiny C-peptidu v priebehu glukózového tolerančného testu u pacientov s karcinómom pankreasu
- High-resolution anorektální manometrie – update v diagnostice anorektálních poruch
- Autoimunitní pankreatitida u pacientů po resekci pro ložiskový proces pankreatu – první výsledky
- Účinnosť a bezpečnosť silymarínu u pacientov s chronickými chorobami pečene – multicentrická, prospektívna, otvorená klinická štúdia IMHOTEP
- Kolorektální screening a projekt adresného zvaní – elegantní řešení přetíženosti kolonoskopických screeningových center
- Projekt RISING STARS
- Dobrodružství českého gastroenterologa v Africe
- Fakultní nemocnice v Plzni přivítala druhý ročník Motilitní akademie
- XXVIIIth Hildebrand Bardejov gastroenterology days 2014
- Ostrava Live Endoscopy, 20. červen 2014 – fenomenální úspěch
- Novinka v léčbě akutních i chronických průjmů v České republice – Tammex family a Tammex family plus
- Správná odpověď na kvíz
- Autodidaktický test: klinická a experimentální gastroenterologie
- Prevenar 13 – vakcína první volby v prevenci pneumokokových infekcí u imunokompromitovaných osob
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Účinnosť a bezpečnosť silymarínu u pacientov s chronickými chorobami pečene – multicentrická, prospektívna, otvorená klinická štúdia IMHOTEP
- High-resolution anorektální manometrie – update v diagnostice anorektálních poruch
- Divertikulární choroba
- Kvíz: Recidivující subileózní stav u mladé pacientky
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



