-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Dysfunkce horní části trávicího traktu u kriticky nemocných: současný pohled a perspektiva
Dysfunction of upper gastrointestinal tract in critically ill patients: current view and prospects
Acute gastrointestinal dysfunction being one of the aspects of multi-organ dysfunction syndrome in critically ill patients is a frequent problem in intensive care and is associated with high morbidity and mortality. In the upper gastrointestinal tract, the dysfunction is manifested as a stress-induced ulcer syndrome and a complex motility disorder leading to intolerance of gastric enteral nutrition and reflux esophagitis in duodenogastroesophageal reflux, with a high risk of aspiration and nosocomial pneumonia. The key pathogenetic mechanisms are (i) splanchnic hypoperfusion leading to breakdown of the barrier function of stomach mucosa that results in mucosal erosions and ulcers, (ii) weakening or loss of lower oesophageal sphincter tonus, and (iii) reduction and loss of effectiveness of prograde gastric evacuation. Complications of this gastrointestinal dysfunction can be reduced by routine support care for critically ill patients, such as basic hemodynamic stabilization, adequate tissue oxygenation, and, if possible, influencing the causal problem. In indicated cases of this dysfunction, prophylaxis of the stress-induced ulcers, prokinetics administration, and potential insertion of a double-luminal probe suitable for both derivation and nutrition, to bypass the motility disorder of the upper gastrointestinal tract in the case of intolerance of gastric enteral nutrition, may be used in treatment.
Key words:
critical illnes – gastroesophageal reflux – esophageal motility disorders – mechanical ventilation – multiple organ dysfunction syndrome
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE „uniform requirements“ for biomedical papers.Submitted:
14. 1. 2013Accepted:
31. 1. 2013
Autoři: K. Balihar; J. Koželuhová; L. Fremundová; M. Matějovič
Působiště autorů: I. interní klinika, Oddělení gastroenterologie a hepatologie a Jednotka intenzivní péče, LF UK a FN Plzeň
Vyšlo v časopise: Gastroent Hepatol 2013; 67(1): 39-44
Kategorie: Klinická a experimentální gastroenterologie: přehledová práce
Souhrn
Akutní gastrointestinální dysfunkce jako jeden z aspektů syndromu multiorgánové dysfunkce u kriticky nemocných je častým problémem v intenzivní péči provázeným vyšší morbiditou a mortalitou. V horní části trávicího traktu (HČTT) zahrnuje především stresem indukovanou vředovou chorobu (Stress-Induced Ulcer Syndrome) a komplexní poruchu motility vedoucí k intoleranci gastrické enterální výživy a refluxní ezofagitidě při duodenogastoezofageálním refluxu s vyšším rizikem aspirace a nozokomiální pneumonie. Klíčovými patogenetickými mechanizmy jsou (i) splanchnická hypoperfuze s podlomením hlavně bariérové funkce žaludeční sliznice, která vede k slizničním erozím až vředům, (ii) oslabení až ztráta tonu dolního jícnového svěrače a (iii) zpomalení a ztráta efektivity prográdní evakuace žaludečního obsahu. Krom rutinní podpůrné péče o kriticky nemocného, jako je základní hemodynamická stabilizace, zajištění adekvátní tkáňové oxygenace a, je-li možné, tak i kauzálního ovlivnění vyvolávající příčiny, lze omezit v indikovaných případech komplikace vyplývající z této dysfunkce profylaxí stresových vředů, aplikací prokinetik a eventuelně zavedením dvojcestné derivačně-výživové sondy k překlenutí poruchy motility HČTT při intoleranci gastrické enterální nutrice.
Klíčová slova:
kriticky nemocný – gastroezofageální reflux – gastoezofageální dysmotilita – umělá plicní ventilace – syndrom multiorgánové dysfunkce
Syndrom multiorgánové dysfunkce/selhání (MODS) byl poprvé popsán Eisemanem u kriticky nemocných v roce 1977 [1]. Tehdy byl tento syndrom považován za fatální průběh nekontrolované infekce. V polovině 80. let byla hypotéza změněna Faistem a Gorisem na teorii autodestruktivní zánětlivé odpovědi organizmu, která může být inciována infekčním, ale i neinfekčním insultem. Jasná definice MODS byla posléze ustanovena až na konferenci ACCP/SCCM v roce 1991 [2]. Poměrně dlouho je trávicí trakt (GIT) považován za klíčový v rozvoji a progresi komplexní šokové reakce organizmu vedoucí k MODS [3]. Jde o velmi komplexní orgán, který je fyziologicky zodpovědný za mnoho složitých procesů, především za digesci a absorpci nutrientů a vody, bariérovou funkci vůči intraluminálním mikrobům a jejich produktům a endokrinní koordinaci trávení a dalších tělesných pochodů. Akutní gastrointestinální dysfunkce (Acute Gastrointestinal Injury – AGI) byla recentně velmi obecně definována jako malfunkce GIT u kriticky nemocných způsobená jejich akutním onemocněním [4]. Zahrnuje velké množství gastrointestinálních symptomů od zvracení, regurgitace a velkých reziduálních objemů žaludku přes poruchy motility a integrity střeva na všech úrovních, krvácení do GIT až po syndrom abdominální hypertenze. Místo jednotlivých symptomů v hodnocení tíže AGI se teprve hledá, ač je tomuto tématu věnována velká pozornost v současné intenzivní medicíně. Především chybí spolehlivé a praktické markery ke kvantifikaci AGI [5]. Tento článek podává souhrnný pohled na problematiku dysfunkce horní části trávicího traktu (HČTT) u kriticky nemocného pacienta.
Význam AGI v intenzivní péči
Více než 60 % pacientů vyvine alespoň jeden ze symptomů AGI v průběhu pobytu na jednotce intenzivní péče (JIP) [6]. AGI je nezávislým prediktorem vyšší mortality v těsné korelaci se zvyklými skorovacími systémy v intenzivní péči jako je APACHE (Acute Physiology And Chronic Health Evaluation Score) či SOFA (Sepsis-Related Organ Failure Assessment), ač v nich nejsou gastrointestinální projevy orgánové dysfunkce zahrnuty. S kumulací výše jednotlivých symptomů také významně roste mortalita pacientů [6,7].
Patogenetické a klinické aspekty dysfunkce HČTT u kriticky nemocných
Dysfunkce HČTT v šokovém stavu má dva základní, především klinicky se projevující aspekty. Prvním aspektem je slizniční ischemie při šokovém stavu s rizikem rozvoje stresových ulcerací a druhým komplexní porucha hybnosti jícnu a žaludku, která je zodpovědná za intoleranci gastrické enterální nutrice, gastroezofageální reflux s rizikem refluxní ezofagitidy a nozokomiální pneumonie.
Stresové ulcerace
Stresem indukovaná vředová choroba (Stress-Induced Ulcer Syndrom – SUS) je definována jako akutní krvácení ze slizničních defektů v HČTT u kriticky nemocného pacienta. Poprvé byla popsána u pacientů s rozsáhlými popáleninami anglickým chirurgem Thomas B. Curlingem před více než 150 lety a do jednoznačné souvislosti s těžkým fyzickým stresem je uvedl Selye v roce 1950 [8,9]. Prekurzorem tohoto klinicky významného syndromu je obvykle klinicky němý slizniční erozivní proces v HČTT, který se vyvíjí dle endoskopických studií časně u 70–100 % kriticky nemocných v šokovém stavu a je označován jako stresem navozené slizniční poškození kriticky nemocných (Stress-Related Mucosal Damage – SRMD) [10]. V patogenezi SUS hraje dominantní roli splanchnická hypoperfuze, na které se dominantně podílí systémová zánětlivá odpověď organizmu s šokovou redistribucí regionálního průtoku splanchnikem [11]. Negativně k hypoperfuzi přispívá také umělá plicní ventilace snížením abdominálního perfuzního tlaku a na JIP rutinně užívané opiáty a katecholaminy [12]. Ischemie střevní sliznice nemusí být doprovázena hemodynamickou nestabilitou, a může tak unikat běžné hemodynamické a laboratorní monitoraci na JIP. Rozvoj SRMD se děje za přítomnosti žaludeční kyseliny, nikoli však při její hypersekreci, jako je tomu u klasické vředové choroby, což poukazuje na dominantní podíl prolomení obranných slizničních mechanizmů při vzniku slizničních erozí. Dopad přítomnosti Helicobacter pylori na rozvoj stresových ulcerací je nejasný. Údaje z klinických i experimentálních studií nejsou jednoznačné, ačkoli určitá pozitivní korelace je z některých studií patrna [13].
Klinicky významné krvácení s hemodynamickou nestabilitou či potřebou krevních transfuzí lze prokázat v důsledku SUS u 0,6–5 % kriticky nemocných bez antiulcerózní profylaxe, ale s 9–13× vyšší mortalitou oproti kriticky nemocným srovnatelné tíže stonání, kteří tuto komplikaci nevyvinou [11]. Endoskopicky je většina lézí mělká, charakteru eroze a nedosahuje pod úroveň lamina muscularis mucosae, a tedy charakteristiky vředu. Jednoznačnými rizikovými faktory pro vznik SUS je umělá plicní ventilace delší než 48 hod a spontánní koagulopatie (INR > 1,5 nebo aPTT > dvojnásobek kontrolní hodnoty nebo počet trombocytů < 50 × 109/l). Dalšími méně významnými rizikovými faktory jsou kraniotrauma, popálení velkého rozsahu (> 30 % tělesného povrchu), stav po velkém chirurgickém zákroku včetně orgánové transplantace, jakýkoli typ šoku, sepse a multiorgánová dysfunkce, renální a jaterní selhání, polytrauma a anamnéza krvácení do HČTT nebo vředové choroby v posledním roce před přijetím na JIP. U léčby vysokými dávkami kortikoidů, konkomitantní léčby nesteroidními antiflogistiky a antiagregancii bylo prokázáno zvýšení rizika klinicky významného SUS jen v kombinaci s dalšími rizikovými faktory [14].
Gastroparéza a gastroezofageální reflux
U zdravých jedinců posunuje jícnová peristaltika sousto kaudálně do žaludku a dolní jícnový svěrač chrání distální jícen v mezidobí před refluxem přijaté potravy, kyseliny a žluče. Proximální žaludek funguje jako rezervoár a tzv. fundické objemové kontrakce vedou k proximodistální redistribuci tráveniny od pevnější po tekutou. Koordinovaná antropyloroduodenální motilita pak hraje hlavní roli ve vlastním vyprazdňování žaludku. Jak se chymus vyprazdňuje do duodena, receptorová zpětná vazba způsobí relaxaci fundu a pokles fundických i antrálních kontrakcí a zároveň zvýšení aktivity pyloru. Po posunu tráveniny dále do tenkého střeva se cyklus opakuje do vyprázdnění žaludku za velmi komplexní neurohumorální koordinace.
U kriticky nemocných je asi v 50 % prokazována refluxní ezofagitida i přes podávanou antiulcerózní profylaxi u pacientů ventilovaných déle než pět dnů [15]. Hlavním patogenetickým mechanizmem je zřejmě duodenogastroezofageální reflux, neboť ezofagitida je asociována především s nekyselým refluxem s obsahem žluči [15]. Hlavními komplikacemi jsou krvácení a mikroaspirace s následným možným rozvojem ventilátorové pneumonie. Z nečetných studií s manometrickými a impedančními systémy je známo, že tonus dolního jícnového svěrače je u mechanicky ventilovaných pacientů snížen až zcela vymizelý. Tato ztráta ochranné bariéry vede k volnému toku žaludečního obsahu spontánně a nebo během epizod zvýšeného intraabdominálního tlaku, jako např. při kašli a zatětí břišního svalstva, které se často děje při odsávání hlenů z trachey [16]. Dále je frekventně přítomno zpomalení žaludečního vyprazdňování, které je důležitou determinantou následného úspěchu, či neúspěchu v zavedení enterální výživy a rizika regurgitace a aspirace [17,18]. Častěji se vyskytuje u pacientů se základní diagnózou polytraumatu, popálenin a těžké sepse a zpomalení je přítomno asi u 80 % pacientů s kraniotraumatem [19]. Jsou zpomaleny jak fundální, tak antrální kontrakce, je zvýšena aktivita pyloru a navíc je významně prodloužena perioda relaxace žaludku navozená nutrienty v tenkém střevě [20]. Duodenální kontrakce jsou poměrně zachovány, ale až 50 % z nich je retrográdních (obr. 1, tab. 1).
Obr. 1. Patofyziologie dysfunkce horní části trávicího traktu u kriticky nemocných. Fig. 1. Pathophysiology of upper gastrointestinal tract dysfunction in critically ill patients. 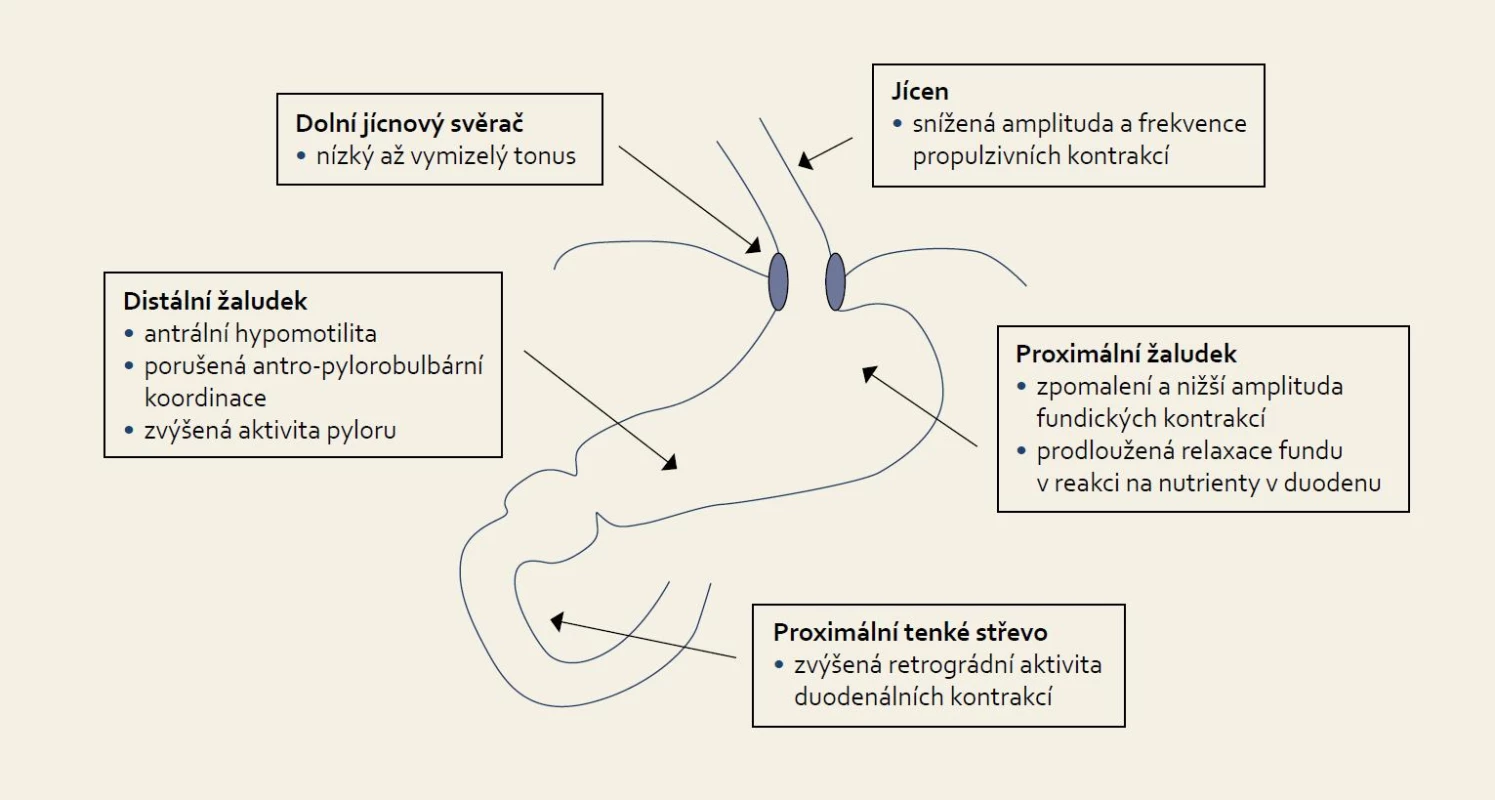
Tab. 1. Klinické projevy dysfunkce HČTT u kriticky nemocných. Tab. 1. Clinical manifestation of upper gastrointestinal tract dysfunction in critically ill patients. 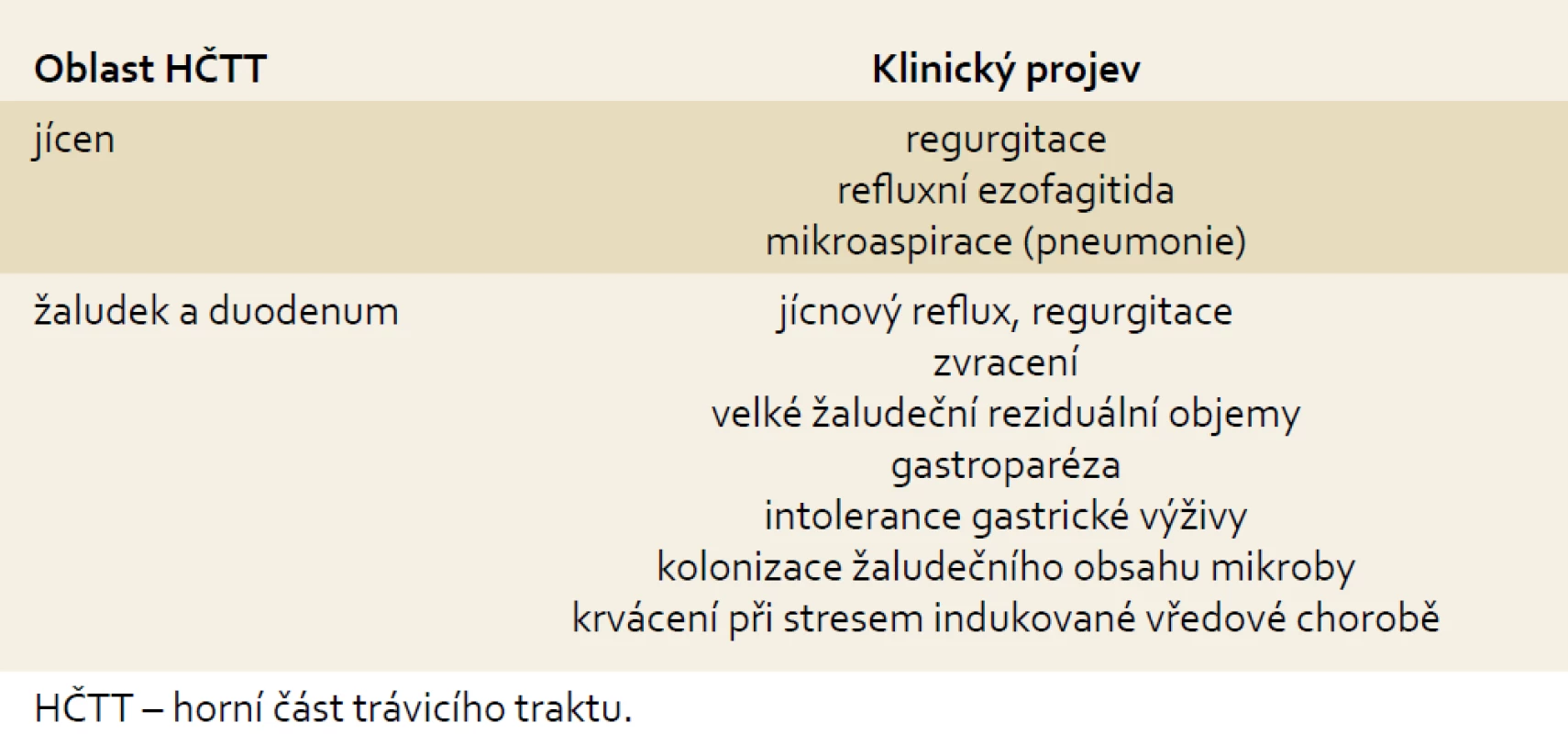
Přímé měření žaludečního vyprazdňování např. scintigraficky, dechovými testy nebo paracetamolovým absorpčním testem je v praxi obtížně proveditelné, proto jako marker intolerance gastrické enterální výživy je užíváno měření gastrických reziduálních objemů. Bohužel tento marker není spolehlivý v detekci ohrožených pacientů aspirační pneumonií ani skutečnou intolerancí výživy a dosud nebyl nalezen funkční a klinicky dostupný mechanizmus, jak tyto pacienty v praxi selektovat přesnějším způsobem [21,22].
U kriticky nemocných není kauzální vztah mezi hyperglykemií a poruchou vyprazdňování žaludku dosud prokázán. Preexistující diabetes mellitus nezvyšuje riziko zpomalení vyprazdňování žaludku u kriticky nemocných, ačkoli hyperglykemie u zdravých pacientů i diabetiků je s touto poruchou asociována [23,24].
Možnosti prevence a terapie
Obecné předpoklady
Prevence rozvoje dysfunkce HČTT u kriticky nemocného zahrnuje časnou a adekvátní léčbu vyvolávající příčiny kritického stavu, zajištění hemodynamické stability a dobré tkáňové oxygenace. Důležitou součástí je uvážlivé užívání analgetik, především opiátů a interupce analgosedace každých 24 hod k omezení kumulace a převisu těchto léčiv. Nezastupitelnou roli hraje také časná rehabilitace s cílem obnovit tonus pomocných dýchacích a břišních svalů a správnou funkci bránice.
Stresové ulcerace
Vzhledem k vysoké mortalitě již rozvinutého krvácení při SUS je nejlepší strategií profylaxe. V praxi jde o aplikaci léčiv s potenciálem redukovat výskyt SUS. K profylaxi lze užít jak blokátory H2 receptorů, tak inhibitory protonové pumpy, mezi kterými není prokazatelného rozdílu v této indikaci [14]. Profylaxe je doporučena u všech pacientů s umělou plicní ventilací delší 48 hod, šokem, sepsí, koagulopatií, kraniotraumatem, popáleninami většího rozsahu, polytraumatem anebo akutním renálním selháním. Se zavedením těchto doporučení se SUS stala nečastou v intenzivní péči s incidencí 0,6–5 % [11]. Profylaxe je doporučena po dobu umělé plicní ventilace nebo po dobu pobytu na jednotce intenzivní péče eventuelně do doby plné tolerance enterální nutrice, kdy ostatní rizikové faktory již pominuly [14]. Hlavní komplikací lékové proxylaxe je ne zcela jednoznačně prokázané vyšší riziko pneumonie při kolonizaci žaludečního obsahu mikroby v nekyselém prostředí s následnou aspirací do dýchacích cest a vyšší riziko Clostridiové enterokolitidy [25,26]. V praxi relativně často dochází k neindikovanému protrahování profylaxe, což vede ke zvýšení rizika výše uvedených nozokomiálních infekcí a nadbytečné ekonomické zatěži [27]. V případě vzniku SUS se diagnostická a léčebná strategie neliší od jakéhokoli jiného akutního krvácení do HČTT.
Gastroparéza a gastroezofageální reflux
V případě selhání gastrické nutrice cestou nazogastrické sondy je v praxi tento problém řešen obvykle aplikací prokinetik anebo změnou cesty v dodávce výživy. Ačkoli se objevují i nové terapeutické možnosti, dosud si nezískaly pevné místo v širší praxi.
K dispozici je řada prokinetických preparátů, ale žádný není ideální. Cisaprid byl stažen z trhu pro závažné nežádoucí účinky. Metoklopramid zrychluje vyprazdňování žaludku u kriticky nemocných a je nejužívanejším lékem v praxi na JIP [28]. Recentní údaje však ukazují, že je méně efektivní než erytromycin, trpí tachyfylaxí při delším užívání a je neefektivní a kontraindikován u pacientů s kraniotraumatem [29,30]. Erytromycin je efektivní preparát, nicméně je v podmínkách České republiky nedostupný a jeho užití je limitováno proarytmogenním účinkem (prodloužení QT intervalu) a rizikem vzniku bakteriální rezistence.
Z nových preparátů to byl tegaserod, agonista 5-hydroxytryptaminových receptorů typu 4, který prokázal zlepšení hybnosti žaludku v malé studii na kriticky nemocných, ale při jeho užívání v postmarketingovém období byly popsány případy ischemické kolitidy a jeho role jako nového prokinetika je velmi nejistá [31]. Opiáty mají významný podíl na zpomalení HČTT u kriticky nemocných. Naloxon, antagonista opiodních receptorů, je-li aplikován přímo enterálně, aby nedošlo k antagonizaci celkového efektu podávaných opiátů, prokazuje zlepšení tolerance enterální výživy a redukci výskytu ventilátorových pneumonií [32]. Podobný preparát Alvimopan, antagonista především µ opiodních receptorů s minimální střevní absorpcí při enterálním podání, prokazuje dobrý efekt na žaludeční vyprazdňování u postoperačních stavů [31]. Jeho efekt u kriticky nemocných však dosud čeká na ověření. Zvýšené hladiny cholecystokininu jsou u kriticky nemocných asociovány s intolerancí enterální nutrice [33]. Dexloxiglumid, selektivní antagonista cholecystokininových receptorů 1, zlepšuje tonus dolního jícnového svěrače, urychluje vyprazdňování žaludku a tranzit střevem u pacientů s dráždivým tračníkem a funkční dyspepsií, jeho efekt u kriticky nemocných však také nebyl dosud studován [31].
Motilitní funkce tenkého střeva jsou u kriticky nemocných relativně zachovány, a proto adekvátní enterální nutrice lze dosáhnout aplikací výživy do jejuna. K tomuto účelu jsou s úspěchem užívány dvojluminální sondy, které umožňují současnou dekompresi žaludečního obsahu gastrickým portem a aplikaci nutrice přes jejunální port. Tento postup je spojen s menším počtem komplikací (především infekčních) a je to i ekonomicky výhodnější oproti parenterální výživě [34]. V současnosti by mělo být zavedení postpylorické enterální výživy rezervováno pouze pro pacienty, kteří netolerují gastrickou výživu a jsou nonresponzivní na prokinetika [35]. Problémem je, že zavedení jejunální sondy naslepo je úspěšné v méně než 50 % a endoskopická či radiologická pomoc při zavedení je obvykle nutná. Úspěšnost endoskopických i skiaskopických metod se pohybuje nad 90 % a jsou ekvivalentní, co se týče délky zavedení a komplikací [36]. Nově se objevují techniky neinvazivního zavedení u lůžka. Jde o systémy schopné detekce pozice distální části sondy bez endoskopie či skiaskopie s možností transpylorického zavedení sondy bedside s vysokou úspěšností (Cortrack; Viasys, Wheeling, Illinois, USA) [37]. Slibné jsou magneticky navigovatelné sondy, které může zavádět i zdravotní sestra po zaškolení [38].
Z alternativních technik vykazuje zajímavé výsledky akupunktura. V jedné studii prokazuje lepší výsledky v ovlivnění tolerance gastrické výživy než standardní prokinetika [39]. Jde o personálně nenáročnou techniku s prakticky žádnými známými nežádoucími účinky a minimálními ekonomickými náklady. Pokud se tato data ověří i z dalších studií, byl by to přínos do zatím omezené škály možností, jak s touto dysfunkcí bojovat.
Vlastní zkušenosti a závěr
Na našem pracovišti jsme ověřili, že endoskopické zavedení dvojcestné sondy je bezpečná metoda s vysokou úspěšností inzerce a minimem periprocedurálních komplikací s výhodou endoskopického zhodnocení horní části zažívacího traktu. Analýza obsahovala 140 endoskopických zavedení u 111 kriticky nemocných pacientů ze dvou JIP ve FN Plzeň s intolerancí gastrické enterální nutrice. Úspěšnost endoskopického zavedení byla 94 %, nebyly zaznamenány žádné vážné komplikace spojené se zavedením a sonda byla zavedena v průměru 11 dnů. Zhodnocením podskupiny 77 pacientů z jedné JIP bylo zjištěno, že adekvátní dodávky enterální nutrice bylo dosaženo u 82 % průměrně za čtyři dny (± 3) od zavedení sondy [40].
Recentně jsme zahájili studii na ventilovaných kriticky nemocných s gastrickou enterální výživou monitorovaných pomocí speciálního high resolution manometrického katétru se zabudovanou impedancí. Studie je plánována k ověření efektu běžně užívaných prokinetik, deskripci patofyziologie poruchy motility jícnu a ozřejmění, které situace při péči o kriticky nemocného jsou nejrizikovější pro reflux. V době tvorby tohoto review je již naměřeno 6 hod záznamu na kriticky nemocných pomocí tohoto systému. Předběžně lze již potvrdit, v souladu s podobně designovanými studiemi se starší technologií, výrazně obleněnou reaktivitu jícnu s nízkými tlaky dolního jícnového svěrače ve srovnání se zkušenostmi na pacientech mimo intenzivní péči a fakt, že epizody kašlání či napínání břišního svalstva při nepohodě či bolesti velmi snadno rezultují v nekyselý proximální reflux do jícnu i u pacientů, kteří mají velmi nízké reziduální gastrické objemy.
Závěrem lze říci, že v posledních deseti letech byl učiněn významný pokrok v pochopení patofyziologie dysfunkce HČTT u kriticky nemocných především díky rozvoji manometrických systémů s možnostmi monitorace hybnosti jednotlivých úseků HČTT za různých okolností a impedančních metod k detekci nekyselých refluxů do jícnu. V současnosti především chybí spolehlivý a v praxi dostupný marker poruchy evakuace žaludku a zvýšeného rizika refluxu a aspirace, neboť měření gastrických reziduálních objemů, které je zatím v praxi užíváno jako zlatý standard, koreluje s touto dysfunkcí jen částečně. Nelze očekávat významnější změnu v současné indikaci k profylaxi stresových vředů, pozornost se spíše zaměřuje k dobrému poznání a eliminaci komplikací, které mohou při podávání antiulceróz vznikat. K terapeutickému ovlivnění motilitní dysfunkce HČTT se objevují nová prokinetika, která čekají na ověření klinickými studiemi. Zda i alternativní techniky jako akupunktura proniknou do širší praxe, zatím těžko předpovídat. Zavedení dvojcestné sondy k překlenutí žaludeční hypomotility HČTT patří mezi rutinní výkony na JIP, nicméně do budoucna lze očekávat i systémy s bedside možností zavedení dvojcestné sondy bez potřeby endoskopie či rentgenové navigace.
Zkratky
MODS – syndrom multiorgánové dysfunkce (Multiorgan Dysfunction Syndrom)
GIT – gastrointestinální trakt (Gastrointestinal Tract)
AGI – akutní gastrointestinální dysfunkce (Acute Gastrointestinal Injury)
JIP – jednotka intenzivní péče (Intensive Care Unit)
HČTT – horní část trávicího traktu (Upper Part of the Gastrointestinal Tract)
SUS – stresem navozená vředová choroba (Stress-Induced Ulcer Syndrom)
SRMD – stresem navozené slizniční poškození (Stress-Related Mucosal Damage)Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00669806 – FN Plzeň.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 14. 1. 2013
Přijato: 31. 1. 2013
MUDr. Karel Balihar
I. interní klinika, Oddělení gastroenterologie a hepatologie a Jednotka intenzivní péče, LF UK a FN Plzeň
Alej Svobody 80, 304 60 Plzeň
balihar@fnplzen.cz
Zdroje
1. Eiseman B, Beart R, Norton L. Multiple organ failure. Surg Gynecol Obstet 1977; 144(3): 323–326.
2. Bone RC, Balk RA, Cerra FB et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. 1992. Chest 2009; 136 (5 Suppl): e28.
3. Moore FA. The role of the gastrointestinal tract in postinjury multiple organ failure. Am J Surg 1999; 178(6): 449–453.
4. Reintam BA, Malbrain ML, Starkopf J et al. Gastrointestinal function in intensive care patients: terminology, definitions and management. Recommendations of the ESICM Working Group on Abdominal Problems. Intensive Care Med 2012; 38(3): 384–394.
5. Khadaroo RG, Marshall JC. Gastrointestinal dysfunction in the critically ill: can we measure it? Crit Care 2008; 12(5): 180.
6. Reintam A, Parm P, Kitus R et al. Gastrointestinal symptoms in intensive care patients. Acta Anaesthesiol Scand 2009; 53(3): 318–324.
7. Reintam A, Parm P, Kitus R et al. Gastrointestinal failure score in critically ill patients: a prospective observational study. Crit Care 2008; 12(4): R90.
8. Curling TB. On acute ulceration of the duodenum, in cases of burn. Med Chir Trans 1842; 25 : 260–281.
9. Selye H. Gastrointestinal system, in The Physiology and Pathology Exposure to Stress: A treatise Based on the Concepts of the General Adaptation Syndrome and the Diseases of Adaptations. Montreal, ACTA 1950; 688.
10. Czaja AJ, McAlhany JC, Pruitt BA Jr. Acute gastroduodenal disease after thermal injury. An endoscopic evaluation of incidence and natural history. N Engl J Med 1974; 291(18): 925–929.
11. Fennerty MB. Pathophysiology of the upper gastrointestinal tract in the critically ill patient: rationale for the therapeutic benefits of acid suppression. Crit Care Med 2002; 30 (6 Suppl): S351–S355.
12. Jakob SM. The effects of mechanical ventilation on hepato-splanchnic perfusion. Curr Opin Crit Care 2010; 16(2): 165–168.
13. Riester KA, Peduzzi P, Holford TR et al. Statistical evaluation of the role of Helicobacter pylori in stress gastritis: applications of splines and bootstrapping to the logistic model. J Clin Epidemiol 1997; 50(11): 1273–1279.
14. ASHP Therapeutic Guidelines on Stress Ulcer Prophylaxis. ASHP Commission on Therapeutics and approved by the ASHP Board of Directors on November 14, 1998. Am J Health Syst Pharm 1999; 56(4): 347–379.
15. Wilmer A, Tack J, Frans E et al. Duodenogastroesophageal reflux and esophageal mucosal injury in mechanically ventilated patients. Gastroenterology 1999; 116(6): 1293–1299.
16. Nind G, Chen WH, Protheroe R et al. Mechanisms of gastroesophageal reflux in critically ill mechanically ventilated patients. Gastroenterology 2005; 128(3): 600–606.
17. Ritz MA, Fraser R, Edwards N et al. Delayed gastric emptying in ventilated critically ill patients: measurement by 13 C-octanoic acid breath test. Crit Care Med 2001; 29(9): 1744–1749.
18. Tarling MM, Toner CC, Withington PS et al. A model of gastric emptying using paracetamol absorption in intensive care patients. Intensive Care Med 1997; 23(3): 256–260.
19. Kao CH, ChangLai SP, Chieng PU et al. Gastric emptying in head-injured patients. Am J Gastroenterol 1998; 93(7): 1108–1112.
20. Nguyen NQ, Fraser RJ, Chapman M et al. Proximal gastric response to small intestinal nutrients is abnormal in mechanically ventilated critically ill patients. World J Gastroenterol 2006; 12(27): 4383–4388.
21. McClave SA, Lukan JK, Stefater JA et al. Poor validity of residual volumes as a marker for risk of aspiration in critically ill patients. Crit Care Med 2005; 33(2): 324–330.
22. Montejo JC, Minambres E, Bordeje L et al. Gastric residual volume during enteral nutrition in ICU patients: the REGANE study. Intensive Care Med 2010; 36(8): 1386–1393.
23. Nguyen NQ, Chapman M, Fraser RJ et al. Long-standing type II diabetes mellitus is not a risk factor for slow gastric emptying in critically ill patients. Intensive Care Med 2006; 32(9): 1365–1370.
24. Fraser R, Horowitz M, Dent J. Hyperglycaemia stimulates pyloric motility in normal subjects. Gut 1991; 32(5): 475–478.
25. Cook D, Guyatt G, Marshall J et al. A comparison of sucralfate and ranitidine for the prevention of upper gastrointestinal bleeding in patients requiring mechanical ventilation. Canadian Critical Care Trials Group. N Engl J Med 1998; 338(12): 791–797.
26. Leonard J, Marshall JK, Moayyedi P. Systematic review of the risk of enteric infection in patients taking acid suppression. Am J Gastroenterol 2007; 102(9): 2047–2056.
27. Wohlt PD, Hansen LA, Fish JT. Inappropriate continuation of stress ulcer prophylactic therapy after discharge. Ann Pharmacother 2007; 41(10): 1611–1616.
28. Jooste CA, Mustoe J, Collee G. Metoclopramide improves gastric motility in critically ill patients. Intensive Care Med 1999; 25(5): 464–468.
29. Deehan S, Dobb GJ. Metoclopramide-induced raised intracranial pressure after head injury. J Neurosurg Anesthesiol 2002; 14(2): 157–160.
30. Marino LV, Kiratu EM, French S. To determine the effect of metoclopramide on gastric emptying in severe head injuries: a prospective, randomized, controlled clinical trial. Br J Neurosurg 2003; 17(1): 24–28.
31. Roberts DJ, Banh HL, Hall RI. Use of novel prokinetic agents to facilitate return of gastrointestinal motility in adult critically ill patients. Curr Opin Crit Care 2006; 12(4): 295–302.
32. Meissner W, Dohrn B, Reinhart K. Enteral naloxone reduces gastric tube reflux and frequency of pneumonia in critical care patients during opioid analgesia. Crit Care Med 2003; 31(3): 776–780.
33. Nguyen NQ, Fraser RJ, Bryant LK et al. The relationship between gastric emptying, plasma cholecystokinin, and peptide YY in critically ill patients. Crit Care 2007; 11(6): R132.
34. Shang E, Kahler G, Meier-Hellmann A et al. Advantages of endoscopic therapy of gastrojejunal dissociation in critical care patients. Intensive Care Med 1999; 25(2): 162–165.
35. Chapman MJ, Nguyen NQ, Fraser RJ. Gastrointestinal motility and prokinetics in the critically ill. Curr Opin Crit Care 2007; 13(2): 187–194.
36. Foote JA, Kemmeter PR, Prichard PA et al. A randomized trial of endoscopic and fluoroscopic placement of postpyloric feeding tubes in critically ill patients. JPEN J Parenter Enteral Nutr 2004; 28(3): 154–157.
37. Young RJ, Chapman MJ, Fraser R et al. A novel technique for post-pyloric feeding tube placement in critically ill patients: a pilot study. Anaesth Intensive Care 2005; 33(2): 229–234.
38. Mathus-Vliegen EM, Duflou A, Spanier MB et al. Nasoenteral feeding tube placement by nurses using an electromagnetic guidance system (with video). Gastrointest Endosc 2010; 71(4): 728–736.
39. Pfab F, Winhard M, Nowak-Machen M et al. Acupuncture in critically ill patients improves delayed gastric emptying: a randomized controlled trial. Anesth Analg 2011; 112(1): 150–155.
40. Balihar K, Novak I, Krouzecky A et al. Feedings of critical care patients by endoscopic three-luminal tube--a retrospective analysis. Cas Lek Cesk 2008; 147(10): 516–520.
Štítky
Dětská gastroenterologie Gastroenterologie a hepatologie Chirurgie všeobecná
Článek vyšel v časopiseGastroenterologie a hepatologie
Nejčtenější tento týden
2013 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
-
Všechny články tohoto čísla
- Sérové protilátky proti zymogenovému glykoproteinu 2 (anti-GP2) u nemocných s idiopatickými střevními záněty
- Recidivující subileózní stavy na tenkém střevě mohou skýtat překvapení
- Hodnocení slizničního hojení v průběhu biologické léčby Crohnovy choroby tenkého střeva pomocí kapslové endoskopie: prospektivní observační studie
- Mesalazin u Crohnovy nemoci: obsolentní nebo neprávem opomíjená léčba?
- Současný pohled na léčbu perianálních píštělí u nemocných s Crohnovou chorobou
- Akutní krvácení do GIT a změny v lipidovém spektru – pilotní projekt
- Perforující gangrenózní cholecystitida
- Dysfunkce horní části trávicího traktu u kriticky nemocných: současný pohled a perspektiva
- 18FDG-PET/CT diagnostika adenokarcinomu pankreatu
- Stenty v liečbe zhubných nádorov kolorekta – prehľad a vlastné skúsenosti
- Metastáza maligního melanomu v bulbu duodena jako vzácná příčina obstrukce výtokového traktu žaludku
- Segmentálna portálna hypertenzia
- Plány a představy redakční rady na rok 2013
-
Imunosupresivní a biologická léčba u CN „šitá na míru“.
Komentář ke studii STORI - Aminosalicyláty v liečbe aktívnej Crohnovej choroby – kedy a prečo nie
- Komentář: Perforující gangrenózní cholecystitida
- UEGW Amsterdam 2012 – pohled z jiné strany
- Gastrofórum – Pankreatofórum v januári 2013
- Správná odpověď na kvíz
- Leading change in IBD
- Pangrol 20000
- Za vším hledej peníze (... a nebo ženu)
- Autodidaktický test: idiopatické střevní záněty
- Gastroenterologie a hepatologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Segmentálna portálna hypertenzia
- Současný pohled na léčbu perianálních píštělí u nemocných s Crohnovou chorobou
- Perforující gangrenózní cholecystitida
- Recidivující subileózní stavy na tenkém střevě mohou skýtat překvapení
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



