-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Multimodální monitorování v intenzivní péči u těžkých neurotraumat
Multimodal monitoring in neurointensive care of severe traumatic brain injury
The therapy of traumatic brain injury consists of prevention and therapy of secondary injury. Proper and early diagnosis is necessary for adequate treatment. Standard monitoring methods in today’s neurointensive care include clinical observation, intracranial pressure monitoring and repeated brain CT scans. During the last 10 years, new methods have been implemented in clinical practice that can improve our understanding of the pathophysiology of brain injury and provide early diagnosis of secondary trauma. These methods include tissue oxymetry, microdialysis and brain tissue blood flow. Their common application constitutes so called multimodal monitoring. In the following review we introduce these methods in neurointensive care. Further, we summarize our experience with 50 patients with multimodal monitoring since 2006.
Keywords:
head trauma – multimodal monitoring – intracranial pressure – tissue oxymetry – microdialysis – cerebral blood flow
Autoři: Hejčl Aleš 1; Bolcha Martin 1; Procházka Jan 2; Hušková Eva 3; Sameš Martin 1
Působiště autorů: Neurochirurgická klinika Univerzity Jana Evangelisty Purkyně, Krajská zdravotní, a. s., Masarykova nemocnice, o. z., Ústí nad Labem 1; Centrální JIP, Krajská zdravotní, a. s., Masarykova nemocnice, o. z., Ústí nad Labem 2; Oddělení ARIM, Krajská zdravotní, a. s., Masarykova nemocnice, o. z., Ústí nad Labem 3
Vyšlo v časopise: Anest. intenziv. Med., 21, 2010, č. 2, s. 104-111
Kategorie: Intenzivní medicína - Přehledový článek
Souhrn
Léčba traumatického poranění mozku spočívá v prevenci a léčbě jeho sekundárního postižení. Správná a časná diagnostika pak může pomoci kvalitní péči o tyto pacienty. Standardní monitorovací metody v neurointenzivní péči jsou v dnešní době založeny na klinické observaci, měření intrakraniálního tlaku a opakovaných CT mozku. Během posledních 10 let se v klinické praxi objevily nové metody, které by mohly zlepšit naše porozumění patofyziologii poranění mozku a zajistit včasnou diagnostiku sekundárního traumatu. Mezi tyto metody patří měření tkáňové oxymetrie, měření metabolismu mozku a průtoku krve mozkem. Jejich společná aplikace pak bývá nazývána tzv. multimodálním monitorováním. V následujícím přehledovém článku představujeme tyto nové metody v neurointenzivní péči. Souhrn doplňujeme i hodnocením našich vlastních zkušeností s 50 pacienty od roku 2006.
Klíčová slova:
kraniocerebrální poranění – multimodální monitorování – intrakraniální tlak – tkáňová oxymetrie – mikrodialýza – průtok krve mozkemÚvod
Těžké poranění mozku patří mezi závažné diagnózy s relativně špatnou prognózou [1, 2]. Zatímco prevence primárního poranění mozku nespadá do kompetence lékařů, ale spíše do oblasti veřejnoprávní sféry a jejich preventivních programů, léčba sekundárního poranění mozku je plně v rukou lékařů, převážně pak intenzivistů, neurochirurgů či traumatologů. Neurointenzivní péče u pacientů s kraniocerebrálním poraněním je tedy založena na terapii sekundárního poranění mozku. Mezi standardní monitorovací metody pacientů s neurotraumatem patří klinická observace, opakovaná CT mozku a měření intrakraniálního tlaku. U pacientů, kteří jsou při vědomí, vycházíme především z monitorování jejich klinického stavu. Hodnotíme stav vědomí pomocí glasgowské škály (GCS – Glasgow coma scale), která by měla být samozřejmostí nejen pro lékaře, ale i pro sestry, neboť ty jako první informují lékaře o změně stavu vědomí pacienta. Pojmy jako sopor, stupor, semikóma apod. by se již v dnešní medicíně neměly používat. Další nezbytností je hodnocení rozvoje či progrese lateralizace u pacienta, tedy např. zhoršení hemiparézy či fatické poruchy, nebo rozvoj jednostranné mydriázy. U pacientů, které je třeba z terapeutických důvodů intenzivně sledovat, a tudíž jsou klinicky obtížně vyšetřitelní (lze hodnotit snad jen rozvoj mydriázy), hodnotíme vývoj poranění mozkové tkáně podle monitorování intrakraniálního tlaku. To by mělo být standardní u pacientů v bezvědomí (GCS < 9) s patologií na nativním CT mozku.
Invazivní monitorování mozku prošlo v posledních 10 letech výrazným vývojem, neboť bylo do kliniky uvedeno několik nových metod. Cílem této práce je shrnout literární data a 3leté zkušenosti s multimodálním monitorováním mozku na našem pracovišti.
Monitorování intrakraniálního a perfuzního tlaku mozku
Zvýšený intrakraniální tlak (ICP) je nejčastější příčinou úmrtí u pacientů s kraniotraumatem (KCP) [3.] Zásadní pro jeho správnou léčbu je monitorování. Monitorování ICP vychází z Monroeho-Kellyho doktríny, jejíž základ byl položen na přelomu 18. a 19. století [4, 5]. Pionýrskou práci, která se zabývala měřením ICP, publikoval Lundberg v roce 1960 [6]. Existuje několik systémů měření ICP, které lze rozdělit podle lokalizace použitého čidla na:
- intraventrikulární,
- intraparenchymové,
- subarachnoidální či epidurální.
Intraventrikulární katétry jsou „zlatým standardem“ monitorování ICP. Jejich zásadní výhodou je přesnost a možnost drenáže mozkomíšního moku. Implantace komorového katétru má však i svá rizika. Riziko infekce u intraventrikulárních katétrů je až 11%, což je velmi pravděpodobně dáno retrográdní kolonizací katétru [7, 8]. Riziko infekce vzrůstá od 5. dne [8], nicméně podle nedávných studií dochází k infekci mozkomíšního moku u významného počtu pacientů také při vlastním zavedení intraventrikulárního katétru [9]. Snížení infekčních komplikací přinášejí antibiotiky impregnované katétry [10]. Může také dojít k obstrukci intraventrikulárního katétru krevním koagulem či bílkovinou. U katétrů s integrovaným měřičem tlaku tak může dojít k podhodnocení reálných hodnot [11].
U pacientů s KCP, kteří jsou v bezvědomí a u nichž monitorujeme ICP, máme standardně k dispozici přímé invazivní monitorování arteriálního tlaku. Tak získáme kontinuálně hodnotu středního arteriálního tlaku (MAP – mean arterial pressure), ze které monitory automaticky generují hodnotu perfuzního tlaku mozku (CPP) podle vztahu CPP = MAP – ICP. V posledních doporučeních Brain Trauma Foundation pro pacienty s těžkým KCP se udává, že hodnota perfuzního tlaku mozku má být udržována v hodnotách 50–70 mm Hg (důkazy III. třídy). Již se nedoporučuje agresivní léčba inotropiky (noradrenalinem) k elevaci CPP > 70 mm Hg (důkazy I. třídy), která byla dříve standardem podle tzv. „CPP-targeted therapy“ prosazované hlavně v amerických centrech. Léčba intrakraniální hypertenze by měla být zahájena u pacientů při ICP > 20 mm Hg [12].
Jak již bylo uvedeno výše, je měření ICP základní metodou monitorování mozku u pacientů v bezvědomí. Existuje mnoho studií, které dokazují přínos monitorování ICP a CPP u pacientů s kraniotraumatem, stejně jako korelaci vysokých hodnot ICP se špatným klinickým výsledkem [12, 13, 14, 15]. Je tedy zřejmé, že k elevaci ICP dochází až v důsledku probíhajících procesů sekundárního traumatu. Vlastní sekundární poranění a jeho příčiny jsme však donedávna monitorovali jen obtížně. Přitom právě prevence rozvoje edému mozku a intrakraniální hypertenze se nabízí jako správnější a logičtější řešení než jejich následná korekce.
Nové monitorovací metody mozku
V posledních 10–15 letech se v klinické praxi objevily nové metody monitorování mozku, které umožňují získání detailnějšího pohledu na činnost mozkové tkáně. Umožňují hodnocení rozvíjejícího se sekundárního poranění mozku a tím nabízejí možnost včasnějšího a cílenějšího terapeutického zásahu. Mezi tyto metody se řadí tkáňová oxymetrie, mikrodialýza, monitorování průtoku krve mozkem.
Tkáňová oxymetrie
Tkáňová oxymetrie umožňuje hodnocení oxygenace mozkové tkáně. Jsou různé metody hodnocení tkáňové oxymetrie. Lze je rozdělit na neinvazivní a invazivní. Mezi neinvazivní metody patří tzv. near-infrared spectroscopy, která umožňuje hodnocení oxygenace mozkové tkáně. Invazivní metody lze rozdělit na globální a fokální. Globální metodou hodnocení oxygenace mozkové tkáně je jugulární oxymetrie, která se v klinické praxi používá nejdéle. Umožňuje monitorování saturace žilní krve kyslíkem v jugulárním bulbu, kam je fibrooptický oxymetr zaveden retrográdně. Její hodnota umožňuje určit množství kyslíku extrahovaného mozkem. Normální hodnoty jsou 55 až 69 % [16]. Mezi výhody jugulární oxymetrie patří monitoracování oxygenace mozku jako celku a také jednodušší zavádění. K nevýhodám se řadí častá selhání systému a nemožnost záchytu lokálních změn v mozkové tkáni. Na našem pracovišti jsme používali jugulární oxymetrii před 10 lety a důvodem k ústupu od této metody byla častá technická selhání.
Mezi relativně nové metody patří fokální metody měření tkáňové oxymetrie [17, 18, 19]. Mezi ty se řadí několik systémů. V literatuře a praxi jsou pak nejznámější: Neurotrend (Codman, Johnson & Johnson, USA), Licox (Integra Neurosciences, Plainsboro, NJ, USA) a Neurovent PTO (Raumedic AG, Münchberg, SRN).
Na principu spektrofotometrie byl založen dříve užívaný systém Neurotrend (Codman & Shurtleff, Inc., Raynham, MA, USA) se čtyřmi senzory měřícími současně parciální tlaky kyslíku a oxidu uhličitého v mozkové tkání, pH a teplotu [20, 21, 22]. Byl založen na principu spektrofotometrie a byl odvozen od systému Paratrend určeného k intraarteriálnímu kontinuálnímu monitorování krevních plynů v intenzivní péči. Počátkem roku 2006 jej přestala firma vyrábět. Spektrofotometrický princip využívá rovněž nejnovější senzor Neurovent PTO (Raumedic AG, Münchberg, Německo) umožňující také měřit současně ptiO2, nitrolební tlak i teplotu.
Dalším systémem, který je v dnes dominantně v neurointenzivní péči používán, je systém Licox. Jedná se o 2 intraparenchymové katétry, které umožňují získat hodnoty tkáňové oxymetrie (ptiO2) a teploty mozkového parenchymu. Tento systém je poměrně spolehlivý a stabilní a poskytuje validní hodnoty po většinu monitorování [22]. Jen v prvních několika hodinách po implantaci jsou hodnoty nízké, což je dáno drobným postimplantačním traumatem. Podle našich zkušeností dochází ke stabilizaci systému přibližně za 5–8 hodin.
Mikrodialýza
Mikrodialýza (CMA Microdialysis AB, Švédsko) je poměrně unikátní metodou, vyvinutou ve Švédsku v 60. letech 20. století. Profesor Urban Ungerstedt zkoumal příčné řezy cév v okolí nervových zakončení a přišel s nápadem vytvořit „umělou kapiláru“, jejíž inzerce do mozkové tkáně by mohla imitovat funkci cévy. Tímto způsobem je možno hodnotit stav tkáňového metabolismu. První článek na téma mikrodialýza vyšel v roce 1974 a od té doby bylo napsáno na její téma přes 12 tisíc publikací jak na úrovni experimentální, tak i na úrovni klinických aplikací [23].
V neurointenzivní péči se hodnotí hlavně intermediární metabolity oxidativního metabolismu glukózy, tzn. glukóza, laktát, pyruvát. Dalším významným metabolitem je pak glycerol, který vzniká rozpadem buněčných membrán. Jeho elevace tak ukazuje na vážné ischemické změny vedoucí k nekróze buněk a s tím související rozpad buněčných membrán.
Princip mikrodialýzy
Katétr mikrodialýzy je tvořen dvojitým lumen s celkovou tloušťkou 0,6 mm (tedy výrazně menší v porovnání s ICP čidlem či zevní komorovou drenáží). Vnější lumen je promýváno perfuzním roztokem (obdoba Ringerova roztoku). Na vnější membráně dochází k výměně metabolitů mezi extracelulárním prostředím centrálního nervového systému (CNS) a perfuzním roztokem. Při standardní rychlosti perfuzní pumpy 0,3 µl . min-1 tak dojde k získání 70 % reálných koncentrací měřených metabolitů extracelulárního prostředí CNS. Vnitřním lumen se pak roztok „obohacený“ o tyto metabolity dostává do druhého katétru, na jehož konci je napojena mikroampulka. Tyto mikroampulky se každou hodinu vyměňují za prázdné. Obsah vyjmuté mikroampulky je hodnocen na „bed-side“ analyzátoru. Do 10 minut tak získáme hodnoty vyšetřovaných metabolitů. Tato rychlost umožní přesun 70 % reálných hodnot koncentrací metabolitů v intersticiu přes membránu. Dalším významným faktorem je horní mez propustnosti (tzv. „cut-off value“ podle velikosti molekul), která je u standardně používaných katétrů 20 kDa. Tyto katétry umožňují propustit běžně vyšetřované markery (glukóza, glycerol, laktát, pyruvát). Nicméně v rámci experimentálních prací se používají i katétry s vyšší hodnotou meze propustnosti, které umožňují hodnocení jiných, převážně experimentálně používaných, látek.
V neurochirurgii se mikrodialýza dominantně využívá u subarachnoidálních krvácení (SAK) a v neurotraumatologii. Existuje i několik prací u pacientů s nádorem mozku, intracerebrálním hematomem či normotenzním hydrocefalem.
Měření průtoku krve mozkem
Hodnotit průtok krve mozkem můžeme buď přímo, nebo nepřímo. Mezi nepřímé metody řadíme xenonové CT (Xe-CT) či transkraniální dopplerometrii (TCD). Mezi přímé metody patří Bowmanův perfuzní monitor (Anspach Companies, Gloucester, MA, USA), LASERFLO (Vasamedics Inc, St. Paul, MN, USA), OxyFlo (Oxford Optronics Inc, Oxford, Velká Británie), SABER series (Flowtronics Inc, Phoenix, AZ, USA), LDF – laser diffusion flowmetry. V České republice se od roku 2008 dostává do popředí v klinické praxi Bowmanův perfuzní monitor [24], který umožňuje zobrazení perfuze tkáně a teploty. Měří průtok krve mozkem pomocí přenosu tepelné energie z proximálního na distální termistor.
Implantace čidel – cílová lokalizace
Jedním ze zásadních faktorů zavedení tzv. multimodálního monitorování je skutečnost, že se – narozdíl od monitorování např. ICP – jedná o metody lokální. Získaná data tedy ukazují situaci v nejbližším okolí sondy. Důležité proto je rozhodnout, co bude cílovou oblastí monitorování. Mozkovou tkáň postiženou fokálním traumatem lze zjednodušeně rozdělit na 3 typy oblastí:.
- Nekróza
- „Biochemická penumbra“ neboli traumatický polostín
- „Zdravá“ mozková tkáň
Nekrotické oblasti mozku zahrnují např. oblast intracerebrálního hematomu či hemoragické kontuze). Při aplikaci čidla můžeme pozorovat vysoce patologické hodnoty: ptiO2 ~ 0 mm Hg, cGlc ~ 0 mmol/l, stovkové hodnoty poměru LP (laktát/pyruvát) a koncentrace glycerolu. Jedná se o mrtvou tkáň a její monitorování tedy nemůže být přínosné v léčbě pacienta. Další oblastí je nejbližší okolí traumatického nekrotického ložiska. Jedná se o tkáň poškozenou, nikoliv však mrtvou. Stahl et al. při monitorování této oblasti pomocí mikrodialýzy použil pojmu „biochemická penumbra“, kterou definoval jako oblast s biochemickými známkami selhávání metabolismu a degradace buněčných membrán, která je schopna obnovy normálního metabolismu, avšak je náchylnější k sekundárnímu poškození. Třetím typem oblasti je pak relativně nedotčená tkáň, např. v jiném laloku či kontralaterální hemisféře. Stahl et al. zavedli 3 mikrodialyzační katétry u pacientů po evakuaci akutního subdurálního hematomu, 2 do parenchymu mozkové tkáně pod evakuovaný hematom a 1 do „zdravé“ kontralaterální hemisféry. Oblasti mozku pod evakuovaným hematomem podle parametrů mikrodialýzy velmi citlivě reagovaly na systémové poruchy (pokles systémového tlaku, perfuzního tlaku či hladin hemoglobinu) narozdíl od oblasti v kontralaterální hemisféře [25]. Jedním z očekávaných přínosů multimodálního monitorování mikrodialýzou je získání delšího „terapeutického okna“ časným záchytem sekundárního traumatu. Ideální lokalizací implantace čidel by proto měla být oblast tzv. biochemické penumbry. Taková oblast je zřejmá u pacientů s fokálním poraněním (kontuze, traumatický intracerebrální hematom) či u pacientů s akutním subdurálním hematomem, kde se nachází pod oblastí hematomu, ať již evakuovaného či nikoliv. Tento fakt reflektuje i mezinárodní konsenzus ke klinickému užití mikrodialýzy z roku 2004 [26]. U fokálních traumat (kontuze) se podle mezinárodního konsenzu doporučuje aplikovat katétr mikrodialýzy právě do oblasti poblíž tohoto ložiska, do oblasti biochemické penumbry. Přesto má tato lokalizace i své nevýhody. Jednou z nich je riziko implantace čidel do oblasti nekrózy, která se nachází velmi blízko. Pro tento případ se nabízí užití navigačních metod, dnes již běžně používaných v neurochirurgické operativě. Navigace pomůže perioperačně přesně zavést čidla na místo cílového určení s minimální chybou (obvykle 1–2 mm). Nevýhodou je náročnější proces implantace vyplývající z nutnosti provedení navigačních snímků na CT a implantace na operačním sále.
Technické aspekty zavádění čidel
Existují dva způsoby zavádění čidel. Můžeme je implantovat na konci operace do blízkosti kontuze či intracerebrálního hematomu. Čidla jsou tunelizována pod kůží a následně vyvedena zevně a napojena na monitory. Tímto způsobem můžeme relativně přesně zaměřit oblast penumbry. Nevýhodou je riziko vytažení čidel při manipulaci s pacientem (během hygieny, převazování rány, transportu na CT apod.). Druhým způsobem je zavedení pomocí trojcestného šroubu, což lze provést na operačním sále nebo u lůžka pacienta na JIP. Provedeme návrt, zavrtáme do kosti šroub a tímto tunelem pak implantujeme trojcestný zavaděč. Zavaděčem postupně implantujeme všechna 3 čidla (čidlo intrakraniálního tlaku, tkáňové oxymetrie, mikrodialýzy). Výhodou zavádění pomocí trojcestného šroubu je možnost zavedení u lůžka pacienta, pevná fixace zavedených čidel i při manipulaci s pacientem (toaleta, kontrolní vyšetření apod). Nevýhodou je menší přesnost při zavádění (hloubka zavedení je fixně dána délkou čidla, problematické zavádění v oblasti temporálního či okcipitálního laloku), chybí přímá kontrola zrakem. Je proto vhodné použít tunelizační aplikaci pro monitorování oblasti penumbry, kde záleží na relativně přesné lokalizaci čidla. Zavedení čidel pomocí šroubu pak můžeme ponechat pro monitorování „zdravé“, referenční hemisféry. Nutností je správná péče o ránu a její okolí a aplikace kostního vosku do oblasti návrtu po extrakci šroubu. Pokud zavádíme čidla tunelizačně, je nezbytná zvýšená opatrnost, abychom zamezili riziku extrakce čidel.
Spolehlivost monitorování
Dings et al. hodnotili spolehlivost čidla systému Licox. Kromě 1. hodiny po aplikaci zjistili vysokou spolehlivost, blížící se 100 % [27]. Naše zkušenost je obdobná. Můžeme částečně srovnávat se systémem Neurotrend (Johnson and Johnson), který jsme aplikovali u 6 pacientů v předcházejícím období. Tento systém měřil více parametrů (pO2, pCO2, pH). Nicméně často se stávalo, že během krátké doby došlo z nejasných důvodů k poklesu hodnot tkáňové oxymetrie na 0 mm Hg. U systému Licox dojde po aplikaci k poklesu hodnot do oblasti ischémie. Je však třeba vyčkat až několik hodin. Hodnoty měřené v prvních hodinách (z naší zkušenosti často > 1 hodinu jak udává Dings, v některých případech až 12 hodin po zavedení) jsou ovlivněny vlastním traumatem způsobeným zavedením čidla. Delší doba v našem případě může souviset s implantací tkáňové oxymetrie pomocí trojcestného katétru (viz výše). Dalším významným faktorem je délka monitorování. Zatímco u čidla Licox jsme nepozorovali, že by i po 14 dnech čidlo vykazovalo známky selhávání, u mikrodialýzy je výdrž menší. Výrobce garantuje 5 dnů stability měření.
Podle našich zkušeností vyžaduje zavádění čidel tkáňové oxymetrie a hlavně mikrodialýzy a interpretace jejich hodnot určité zkušenosti. Z našeho souboru jsme hodnotili prvních 11 pacientů. Zatímco v počátcích našich měření u prvních 5 pacientů došlo často k technickému selhání (u 2 z nich po část doby monitororování a u 1 pacienta došlo k selhání kompletně), u následujících 6 pacientů již probíhalo monitorování standardně, s minimem technických selhání. Při současných zkušenostech s téměř 50 pacienty můžeme konstatovat, že měření tkáňové oxymetrie pomocí systému Licox je poměrně jednoduché a technické problémy jsou minimální. Měření metabolismu pomocí mikrodialýzy je o něco složitější.
On-line sběr dat
Vzhledem k velkému množství sbíraných dat u pacientů s multimodálním monitorováním je vhodné využít software, který tato data sjednotí do 1 programu. Takový program by měl umožnit sledovat vývoj jednotlivých parametrů a jejich vztahů. V našem centru využíváme software ICU Pilot (CMA Microdialysis AB, Švédsko). Tento uživatelsky jednoduchý program dovolí sledovat parametry získané z mikrodialýzy, tkáňové oxymetrie, z Bowmanova perfuzního monitoru a standardního pacientského monitoru. Zároveň umožňuje následně provádět jednoduché statistické výpočty.
Multimodální monitorování u pacientů s KCP a SAK
Zavádění čidel k monitorování tkáňové oxymetrie, průtoku krve mozkem a mikrodialýzy přináší nové informace o stavu mozkové tkáně u pacientů s těžkým poraněním mozku a SAK krvácením [28]. Tyto monitorovací systému jsou v klinické praxi poměrně nové a jejich využití zatím není zcela standardizováno. Nejdále je v tomto smyslu užití tkáňové oxymetrie, které je dnes již součástí doporučení Brain Trauma Foundation u pacientů s těžkým poraněním mozku [29]. Zde je doporučeno udržet tkáňovou oxymetrii > 15 mm Hg (důkazy III. třídy). Jistě lze do značné míry tuto hodnotu „extrapolovat“ i pro pacienty se SAK či intracerebrálním hematomem. Poměrně dobře použitelný se zdá být i systém Hemedex k monitorování průtoku krve mozkem. Z fyziologie mozkové tkáně je známo, že normální průtok krve bílou hmotou mozku (CBF), kam je konec katétru zaveden, je 15–25 ml/100 g tkáně/min. Nicméně v současnosti existuje zatím poměrně málo klinických studií, které hodnotí užití CBF monitorování jak u pacientů s traumatem mozku, či SAK. Relativně nejsložitějším systémem k interpretaci dat je monitorování tkáňového metabolismu pomocí mikrodialýzy, neboť vyhodnocuje v základní sestavě 4 parametry popisující metabolismus glukózy. Jejich zařazení do celkového obrazu monitorování mozku je podle naší zkušenosti nejnáročnější.
Tzv. multimodální monitorování mozkové tkáně je v současné době v rozvoji. Doposud je základem léčby pacientů s traumatem mozku monitorování CPP a ICP. Díky multimodálnímu monitorování získáváme přesnější informace o stavu mozku. Cílem je tak zabránit ischémii mozku včasným terapeutickým zásahem. Například léčba podle hodnot tkáňové oxymetrie v porovnání s léčbou pouze na základě hodnot CPP a ICP vede k redukci příhod mozkové hypoxie (ptiO2< 10 mm Hg). Přestože ve skupině pacientů léčených podle ptiO2bylo 65 % pacientů s dobrým klinickým výsledkem (GOS = 4 nebo 5) v porovnání s 54 % pacientů ve skupině CPP/ICP se nejednalo o statisticky významné zlepšení [30]. Co se týká mikrodialýzy, hlavním přínosem jejího použití v neurotraumatologii by měla být časná informace o rozvoji sekundárního traumatu předcházející klinickým projevům či elevacím ICP. Belli et al. zjistili, že patologická elevace poměru LP (laktát/pyruvát) > 25 v 89 % předpověděla elevaci intrakraniálního tlaku > 20 mm Hg [31].
U pacientů se SAK se využívají tkáňová oxymetrie a mikrodialýza převážně v diagnostice vazospasmů, ale také v perioperačním monitorování při klipáži aneurysmatu. Při klipáži aneurysmat koreluje pokles tkáňové oxymetrie na hodnoty < 8 mm Hg po dobu > 30 minut s rozvoemj ischemického ložiska na pooperačním CT mozku [32]. Takový pokles může být způsoben nadměrnou manipulací s mozkovou tkání a cévami či dlouho naloženými dočasnými klipy. Monitorování tkáňové oxymetrie tak může pomoci zabránit rozvoji mozkové hypoxie časnou změnou taktiky v operační technice [33].
V případě monitorování vazospasmů je podle konsenzu z roku 2004 doporučeno zavést katétr mikrodialýzy do povodí mateřské tepny aneurysmatu, tedy do oblasti s nejvyšším rizikem rozvoje vazospasmů [26, 34]. Skjøth-Rasmussen et al. sledovali u 42 pacientů se SAK parametry mikrodialýzy (LP poměr, poměr mezi laktátem a glukózou – LG poměr, koncentrace glycerolu). Za indikátory ischémie mozkové byly považovány: elevace LP poměru a LG poměru o 20 %, následované zvýšením koncentrace glycerolu o více než 20 % v průběhu 24 hodin. U 17 pacientů z 18, s rozvojem DIND, zjistili, že došlo k elevaci LP a LG poměru více jak 20 hodin a k elevaci koncentrace glycerolu 7 hodin před rozvojem klinických změn. Specificita rozvoje DIND podle mikrodialýzy je 89% a senzitivita 82% [35]. Unterberg et al. porovnávali specificitu mikrodialýzy, transkraniální dopplerometrie (TCD) a digitální substrakční angiografie (DSA) v diagnostice DIND. Jako definici sekundární neurologické deteriorace podle mikrodialýzy považovali hodnoty laktátu > 4 mM a glutamátu > 3 µM po dobu nejméně 6 hodin. Ve studii ukazují, že mikrodialýza má nejvyšší pozitivní prediktivní hodnotu pro rozvoj DIND u pacientů se SAK při ruptuře aneurysmatu, v porovnání s ostatními standardně užívanými diagnostickými metodami [36]. Přesto v současnosti nemáme k dispozici studie, které by jednoznačně ukázaly, že využití těchto nových metod vede ke statisticky významnému klinickému zlepšení léčby našich pacientů.
Naše zkušenosti s multimodálním monitorováním
Od roku 2005 využíváme měření tkáňové oxymetrie a tkáňového metabolismu [37] a od roku 2008 využíváme měření průtoku krve mozkem. Naše databáze zahrnuje 54 pacientů. Základem monitorování je ICP (54 pacientů), dále používáme měření tkáňové oxymetrie (Neurotrend 5 pacientů, Licox 47 pacientů), mikrodialýzu (43 pacientů) a měření průtoku krve mozkem (7 pacientů). U tkáňové oxymetrie jsme začínali se systémem Neurotrend. Zkušenost s tímto systémem jsme měli u 5 pacientů. Během krátké zkušenosti jsme zjistili, že systém měl 2 nevýhody. Jednak byl proces implantace čidla Neurotrend, oproti implantaci čidla Licox®, relativně náročný. Druhou nevýhodou byla častá selhání systému, kdy s odstupem několika hodin či dnů od počátku měření došlo k náhlému a trvalému poklesu tkáňové oxymetrie na nulovou hodnotu mm Hg, která nebyla vysvětlitelná reálným stavem právě monitorované mozkové tkáně. Vzhledem k tomu, že systém Neurotrend byl stažen z trhu, přešli jsme na systém Licox®, který byl od počátku stabilní a jeho implantace je velmi jednoduchá. Jedinou jeho nevýhodou je větší riziko extrakce katétru při perkutánní implantaci vzhledem k objemné spojovací části katétru. Dalším omezením tohoto systému jsou uměle nízké hodnoty tkáňové oxymetrie několik hodin (5–8 hod podle našich zkušeností) od implantace dané implantačním mikrotraumatem. Nicméně v následném období je systém stabilní a hodnoty jsou validní i 14 dnů po implantaci. Měření tkáňové oxymetrie ukazuje on-line hodnoty kyslíku, které jsou mozkové tkáni dodávány. Na patologické hodnoty pak nejčastěji reagujeme korekcí perfuzního tlaku (elevace při nízkých hodnotách), podáním mannitolu (i při hodnotách ICP nad 10 mm Hg), zvýšením inspirační frakce kyslíku FiO2, podáním krevních derivátů při nízkém hemoglobinu.
Obr. 1. Charakteristika 50 pacientů z naší databáze multimodálního monitorování (bez pacientů monitorovaných Neurotrendem) 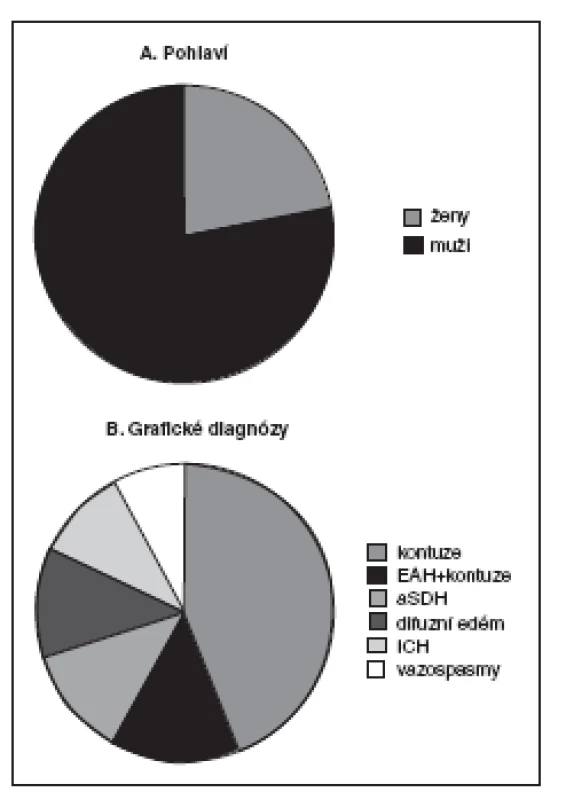
A. Pohlaví pacientů B. Grafické diagnózy EAH – extraaxiální hematom, aSDH – akutní subdurální hematom, ICH – intracerebrální hematom Měření tkáňového metabolismu pomocí mikrodialýzy je podle našich zkušeností interpretačně složitější a naše možnosti přímé intervence jako reakce na patologické hodnoty tkáňového metabolismu často velmi omezené, proto je naše studie ve vztahu k hodnotám mikrodialýzy observační. Dvakrát jsme pozorovali vysoké hodnoty poměru LP, které předcházely rozvoji intrakraniální hypertenze. V naší studii jsme zjistili statisticky významnou korelaci vysokých hodnot glycerolu, spolu s vysokou hodnotou ICP, se špatným klinickým výsledkem 6 měsíců od traumatu mozku (manuskript v přípravě).
Obr. 2. Charakteristika 50 pacientů z naší databáze multimodálního monitorování (bez pacientů monitorovaných Neurotrendem) 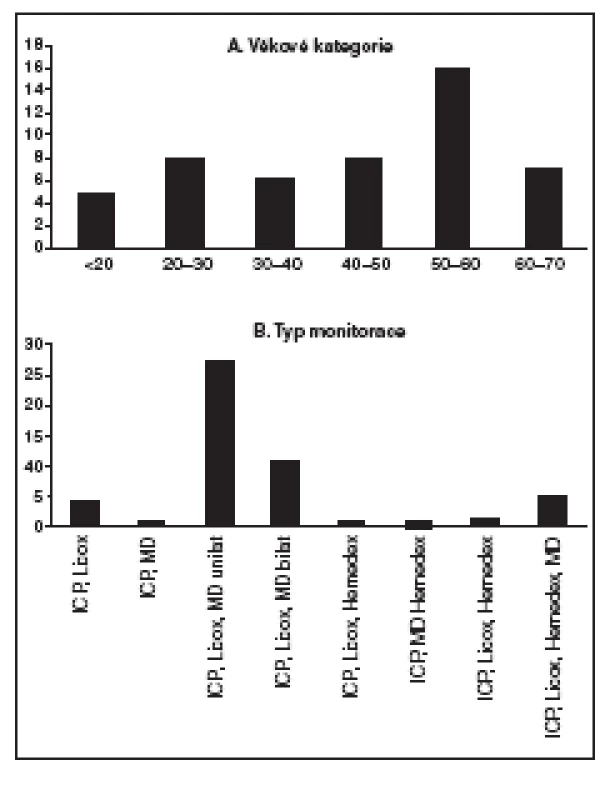
A. Věkové kategorie B. Složení multimodálního monitorování S technikou měření průtoku krve mozkem máme zatím nejmenší zkušenosti (7 pacientů). Je-li nízký průtok krve mozkem, prvním parametrem, který kontrolujeme, je perfuzní tlak. Korekcí nízkého perfuzního tlaku můžeme jeho elevací zlepšit i tok krve mozkem.
Vzhledem k tomu, že se jedná o invazivní techniku, je nutné zmínit se o možných rizicích a komplikacích této metody. Je třeba konstatovat, že v našem souboru pacientů jsme neměli závažnou komplikaci v souvislosti s implantací čidel multimodálního monitorování. Nezaznamenali jsme žádný hematom po implantaci. Ve skupině prvních 10 pacientů jsme u 3 z nich zaznamenali po extrakci návrtového šroubu s čidly likvorovou píštěl. Po těchto zkušenostech aplikujeme při extrakci návrtového šroubu vždy malé množství kostního vosku do návrtu a následně ránu přešíváme 1–2 stehy. Od té doby jsme další likvorovou píštěl nezaznamenali.
Bilaterální nebo multilokální monitorování
Mikrodialýza, tkáňová oxymetrie i měření průtoku krve mozkem jsou lokálními diagnostickými metodami. V doporučení pro užití mikrodialýzy z roku 2004 se udává, že v případě aplikace 1 katétru by tento měl být umístěn do oblasti tzv. biochemické penumbry, tedy oblasti s nejvyšším rizikem sekundární traumatizace [25, 26]. Toto doporučení lze logicky jistě „extrapolovat“ i pro obě další diagnostické metody. Jestliže použijeme více katétrů, pak se doporučuje další zavést do kontralaterální hemisféry („lepší“), eventuálně další do poškozené hemisféry („horší“) opět do oblasti penumbry či dále od místa léze. Tímto získáváme několik reprezentativních oblastí mozku a můžeme získat globálnější obraz stavu mozkové tkáně. Toto multilokální monitorování bylo právě použito u mikrodialýzy, především v Lundu, kde zavedli až 4 katétry mikrodialýzy do mozkové tkáně (ústní sdělení).
Rozdíl v počátečních hodnotách mikrodialýzy mezi „nemocnou“ a „zdravou“ hemisférou nám může pomoci posoudit rozsah postižení „nemocné“ hemisféry. Následující dny a hodiny pak ukážou, zda-li byla naše léčba úspěšná (srovnání hodnot obou hemisfér), nebo zda progreduje sekundární postižení mozku, nejprve patrné v oblasti „nemocné hemisféry“ – penumbry.
Naše databáze zahrnuje 11 pacientů, kterým jsme implantovali tzv. bilaterální monitorování. Provedli jsme implantaci čidel mikrodialýzy a tkáňové oxymetrie do oblasti poblíž dominantního postižení (buď kontuze, nebo do hemisféry po evakuaci akutního subdurálního hematomu) a druhou sadu katétrů, která obsahovala čidlo mikrodialýzy, tkáňové oxymetrie a čidlo intrakraniálního tlaku) do druhostranné hemisféry („lepší“). U 6 pacientů byly hodnoty v „horší“ hemisféře v některé z měřených modalit (oxymetrie, metabolismus) horší v porovnání s „lepší“ hemisférou. Toto platilo hlavně v prvních hodinách či dnech monitorování. V dalších dnech pak často došlo ke zlepšení patologických hodnot v poškozené hemisféře a jejich srovnáním s hodnotami v druhostranné hemisféře.
Praktické poznámky týkající se zavedení systému multimodálního monitorování na JIP či ARO
Implementace systému multimodálního monitorování podle našich zkušeností vyžaduje určitý čas („learning curve“) k zajištění správného a bezchybného fungování. Rychlost kvalitního fungování multimodálního monitorování souvisí s počtem takto monitorovaných pacientů. Čím více pacientů monitorujeme, tím rychleji je možno zajistit hladký průběh monitorování. Dalšímu zlepšení pomůže edukace personálu. Správné fungování několika monitorů a interpretace jejich výsledků vyžaduje týmovou spolupráci, hlavně mezi intenzivisty a neurochirurgy. Je důležité seznámit ošetřující personál s principem a fungováním jednotlivých metod a systémů. Správné pochopení principu a důvod zavedení multimodálního monitorování pomáhá v pozitivním přijetí poměrně složitého systému a jeho maximálním využití. Zásadní – možná nejdůležitější – skupinou personálu jsou sestry. Jejich pozitivní přístup k nově zavedenému multimodálnímu monitorování u pacientů s kraniotraumatem je naprosto nezbytný. Musí chápat, že práce navíc (výměna vzorků, analýza vzorků, dokumentace získaných dat) má svůj význam i v situacích, kdy je obtížné interpretovat získaná data a práce navíc se může zdát zbytečná. Důležité je analyzovat získaná data jak v průběhu monitorování, tak i poté (retrospektivně). Analýze jsou podrobeny všechny parametry CNS, systémové parametry i aplikovaná léčba.
Jistě velmi významným faktorem implementace multimodálního monitorování je i faktor ekonomický. Jestliže používáme standardní monitorování ICP, pak je cena parenchymálního čidla přibližně 20 000 Kč. Jestliže budeme implantovat čidla k měření ICP, ptiO2 a mikrodialýzy a perfuze krve mozkem, pak se cena všech čidel včetně reagencií u mikrodialýzy a trojcestného šroubu pohybuje kolem 100 000 Kč. Samostatnou kapitolou je i nákup vlastních přístrojů, jejichž ceny se pohybují kolem 1 mil. Kč. Náklady tedy nejsou pro běžnou klinickou praxi zanedbatelné a v současné době je nutná grantová podpora. Nicméně vybereme--li si pouze 1 modalitu, např. mikrodialýzu, pak se cena pohybuje kolem 15 000 Kč.
Závěr
Multimodální monitorování nabízí další krok k porozumění patofyziologie u pacientů s těžkým traumatem mozku. Tyto nové poznatky mohou vést k rychlejšímu zavedení nutné léčby (prodloužení „terapeutického okna“) a přímému sledování jejího vlivu na mozkovou tkáň. Dále multimodální monitorování umožní individuálně vedenou léčbu u jednotlivých pacientů a také sledování nových terapeutických postupů v neurointenzivní péči či objevení nových, dosud nevyužívaných biomarkerů poškození mozku. Při zavedení multimodálního monitorování na JIP či ARO je nezbytný vyškolený a oddaný personál, který zvládne počáteční chyby a technická selhání, a umožní tak rychlou standardizaci této metody v běžné klinické praxi.
Seznam zkratek:
- ARO – anesteziologicko-resuscitační oddělení
- cGlc – koncentrace glukózy
- CNS – centrální nervový systém
- CPP – perfuzní tlak mozku (cerebral perfusion pressure)
- CT – počítačová tomografie (computed tomography)
- DIND – delayed ischemic neurological deficit
- FiO2 – inspirační frakce kyslíku
- GCS – glasgowská škála (Glasgow coma scale)
- ICP – intrakraniální tlak
- JIP – jednotka intenzivní péče
- kDa – kilodaltony
- KCP – kraniocerebrální poranění
- LDF – laser diffusion flowmetry
- LP – laktát/pyruvát
- MAP – střední arteriální tlak (mean arterial pressure)
- mm Hg – milimetry rtuťového sloupce
- ptiO2 – parciální tlak kyslíku v tkáni
- ptiCO2 – parciální tlak oxidu uhličitého v tkáni
- SAK – subarachnoidální krvácení
- TCD – transkraniální dopplerometrie
- Xe-CT – xenonová počítačová tomografie (computed tomography)
Práce byla podpořena grantem IGA MZČR NR/8851-4/2006.
Adresa pro korespondenci:
MUDr. Aleš Hejčl
Neurochirurgická klinika UJEP
Krajská zdravotní a.s.
Masarykova nemocnice o.z.
Sociální péče 12A
401 13 Ústí nad Labem
e-mail: ales.hejcl@mnul.cz
Zdroje
1. Smrčka, M. Poranění mozku. 1. vyd. Praha: Grada Publishing, 2001, 278 s. ISBN 80-7169-820-2.
2. Náhlovský, J. Neurochirurgie. 1. vyd. Praha: Galén, 2006, 581 s. ISBN 80-7262-319-2.
3. Miller, J. D., Becker, D. P., Ward, J. D., Sullivan, H. G., Adams, W. E., Rosner, M. J. Significance of intracranial hypertension in severe head injury. J Neurosurg., 1977, 47, p. 503–516.
4. Monro, A. Observation on the Structure and the Function of the Nervous System. Edinburgh: Creek Johnson, 1783.
5. Kellie, G. An account of the appearance observed in the dissection of two of three individuals presumed to have perished in the storm of the 3D and whose bodies were discovered in the vicinity of Leith on the morning of the 4th November 1821, with some reflections on the pathology of the brain. Trans. Med. Chir. Sci. Edinb., 1824, 1, p. 84.
6. Lundberg, N. Continuous recording and control of ventricular fluid pressure in neurosurgical practice. Acta Psychiat Neurol Scand (Suppl), 1960, 149, p. 1–193.
7. Lozier, A. P., Sciacca, R. R., Romagnoli, M. F., Connolly, E. S. Jr. Ventriculostomy-related infections: a critical review of the literature. Neurosurgery, 2002, 51, p. 170–181.
8. Mayhall, C. G., Archer, N. H., Lamb, V. A., Spadora, A. C., Baggett, J. W., Ward, J. D., Narayan, R. K. Ventriculostomy--related infections. A prospective epidemiologic study. N. Engl. J. Med., 1984, 310, p. 553–559.
9. Lo, C. H., Spelman, D., Bailey, M., Cooper, D. J., Rosenfeld, J. V., Brecknell, J. E. External ventricular drain infections are independent of drain duration: an argument against elective revision. J. Neurosurg., 2007, 106, p. 378–383.
10. Zabramski, J. M., Whiting, D., Darouiche, R. O., Horner, T. G., Olson, J., Robertson, C., Hamilton, A. J. Efficacy of antimicrobial impregnated external ventricular drain catheters: a prospective, randomized, controlled trial. J. Neurosurg., 2003, 98, p. 725–730.
11. Birch, A. A., Eynon, C. A., Schley, D. Erroneous intracranial pressure measurements from simultaneous pressure monitoring and ventricular drainage catheters. Neurocrit. Care, 2006, 5, p. 51–54.
12. The Brain Trauma Foundation. The American Association of Neurological Surgeons. The Joint Section on Neurotrauma and Critical Care. Intracranial pressure thresholds. J. Neurotrauma, 2007, 24, p. 55–58
13. Narayan, R. K., Kishore, P. R., Becker, D. P., Ward, J. D., Enas, G. G., Greenberg, R. P., Domingues, Da. S. A., Lipper, M. H., Choi, S. C., Mayhall, C. G., Lutz, H. A., III, Young, H. F. Intracranial pressure: tomonitor or not to monitor? A review of our experience with severe head injury. J. Neurosurg., 1982, 56, p. 650–659.
14. Balestreri, M., Czosnyka, M., Hutchinson, P., Steiner, L. A., Hiler, M., Smielewski, P., Pickard, J. D. Impact of intracranial pressure and cerebral perfusion pressure on severe disability and mortalityafter head injury. Neurocrit. Care, 2006, 4, p. 8–13.
15. Saul, T. G., Ducker, T. B. Effect of intracranial pressure monitoring and aggressive treatment on mortality in severe head injury. J. Neurosurg., 1982, 56, p. 498–503.
16. Gibbs, E., Lennox, W., Nims, L. Arterial and cerebral venous blood: arterial-venous differences in man. J. Bio. Chem., 1942, 144, p. 324.
17. Filaun, M., Horáček, M., Steindler, J., Pekař, L., Cvachovec, K. Monitorování mozkové oxygenace. Ces. Slov. Neurol. N., 2008, 71, s. 657–663.
18. Stieffel, M. F., Udoetuk, J. D., Spiotta, A. M., Gracias, V. H., Goldberg, A., Maloney-Wilensky, E., Bloom, S., Le Roux, P. D. Conventional neurocritical care and cerebral oxygenation after traumatic brain injury. J. Neurosurg., 2006, 105, p. 568–575.
19. Gopinath, S. P., Valadka, A. B., Uzura, M., Robertson, C. S. Comparison of jugular venous oxygen saturation and brain tissue PO2 as monitors of cerebral ischemia after head injury. Crit. Care Med., 1999, 27, p. 2337–2345.
20. Johnston, A. J., Steiner, L. A., Coles, J. P., Chatfield, D. A., Fryer, T. D., Smielewski, P., Hutchinson, P. J., O’Connell, M. T., Al-Rawi, P. G., Aigbirihio, F. I., Clark, J. C., Pickard, J. D., Gupta, A. K., Menon, D. K. Effect of cerebral perfusion pressure augmentation on regional oxygenation and metabolism after head injury. Crit. Care Med., 2005, 33, p. 189–195.
21. Kiening, K. L., Härtl, R., Unterberg, A. W., Schneider, G. H., Bardt, T., Lanksch, W. R. Brain tissue pO2-monitoring in comatose patients: implications for therapy. Neurol. Res., 1997, 19, p. 233–240.
22. Jaeger, M., Soehle, M., Meixensberger, J. Brain tissue oxygen (PtiO2): a clinical comparison of two monitoring devices. Acta Neurochir. Suppl., 2005, 95, p. 79–81.
23. Ungerstedt, U., Pycock, C. Functional correlates of dopamine neurotransmission. Bull. Schweiz. Akad. Med. Wiss., 1974, 30, s. 44–55.
24. Martin, G. T., Bowman, H. F. Validation of real-time continuous perfusion measurement. Med. Biol. Eng. Comput., 2000, 38, p. 319–325.
25. Stahl, N., Schalen, W., Ungerstedt, U., Nordstrom, C. H. Bedside biochemical monitoring of the penumbra zone surrounding an evacuated acute subdural haematoma. Acta Neurol. Scand., 2003, 108, p. 211–215.
26. Bellander, B. M., Cantais, E., Enblad, P., Hutchinson, P., Nordström, C. H., Robertson, C., Sahuquillo, J., Smith, M., Stocchetti, N., Ungerstedt, U., Unterberg, A., Olsen, N. V. Consensus meeting on microdialysis in neurointensive care. Intensive Care Med., 2004, 30, p. 2166–2169.
27. Dings, J., Meixensberger, J., Jäger, A., Roosen, K. Clinical experience with 118 brain tissue oxygen partial pressure catheter probes. Neurosurgery, 1998, 43, p. 1082–1095.
28. Tisdall, M. M., Smith, M. Multimodal monitoring in traumatic brain injury: current status and future directions. Br. J. Anaesth., 2007, 99, p. 61–67.
29. Bratton, S. L., Chestnut, R. M., Ghajar, J., McConnell Hammond, F. F., Harris, O. A., Hartl, R., Manley, G. T., Nemecek, A., Newell, D. W., Rosenthal, G., Schouten, J., Shutter, L., Timmons, S. D., Ullman, J. S., Videtta, W., Wilberger, J. E., Wright, D. W. Guidelines for the management of severe traumatic brain injury. X. Brain oxygen monitoring and thresholds. J. Neurotrauma, 2007, 24 Suppl 1, p. 65–70.
30. Meixensberger, J., Jaeger, M., Väth, A., Dings, J., Kunze, E., Roosen, K. Brain tissue oxygen guided treatment supplementing ICP/CPP therapy after traumatic brain injury. J. Neurol. Neurosurg. Psychiatry, 2003, 74, p. 760–764.
31. Belli, A., Sen, J., Petzold, A., Russo, S., Kitchen, N., Smith, M. Metabolic failure precedes intracranial pressure rises in traumatic brain injury: a microdialysis study. Acta Neurochir. (Wien), 2008, 150, p. 461–469.
32. Kett-White, R., Hutchinson, P. J., Al-Rawi, P. G., Gupta, A. K., Pickard, J. D., Kirkpatrick, J. D. Cerebral oxygen and microdialysis monitoring during aneurysma Sumery: effects of blood pressure, cerebrospinal fluid drainage, and temporary clipping on infarction. J. Neurosurg., 2002, 96, p. 1013–1009.
33. Smrčka, M., Ďuriš, K., Juráň, V., Neumann, E., Kýr, M. Peroperační monitoring tkáňové oxymetrie a pooperační užití hypotermie v chirurgii mozkových aneuryzmat. Česk. Slov. Neurol., 2009, 72, p. 245–249.
34. Rabinstein, A. A., Weigand, S., Atkinson, J. L., Wijdicks, E. F. Patterns of cerebral infarction in aneurysmal subarachnoid hemorrhage. Stroke, 2005, 36, p. 992–997.
35. Skjøth-Rasmussen, J., Schulz, M., Kristensen, S. R., Bjerre, P. Delayed neurological deficits detected by an ischemic pattern in the extracellular cerebral metabolites in patients with aneurysmal subarachnoid hemorrhage. J. Neurosurg., 2004, 100, p. 8–15.
36. Unterberg, A. W., Sakowitz, O. W., Sarrafzadeh, A. S., Benndorf, G., Lanksch, W. R. Role of bedside microdialysis in the diagnosis of cerebral vasospasm following aneurysmal subarachnoid hemorrhage. J. Neurosurg., 2001, 94, p. 740–749.
37. Hejčl, A., Bolcha, M., Procházka, J., Sameš, M. Multimodální monitorování mozku u pacientů s těžkým kraniocerebrálním traumatem a subarachnoidálním krvácením v neurointenzivni peči. Česk. Slov. Neurol., 2009, 72, s. 383–387.
38. Reinstrup, P., Ståhl, N., Mellergård, P., Uski, T., Ungerstedt, U., Nordström, C. H. Intracerebral microdialysis in clinical practice: baseline values for chemical markers during wakefulness, anesthesia, and neurosurgery. Neurosurgery, 2000, 47, p. 701–709.
Štítky
Anesteziologie a resuscitace Intenzivní medicína
Článek vyšel v časopiseAnesteziologie a intenzivní medicína
Nejčtenější tento týden
2010 Číslo 2- Jak souvisí postcovidový syndrom s poškozením mozku?
- Perorální antivirotika jako vysoce efektivní nástroj prevence hospitalizací kvůli COVID-19 − otázky a odpovědi pro praxi
- Neodolpasse je bezpečný přípravek v krátkodobé léčbě bolesti
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
- Léčba akutní pooperační bolesti z pohledu ortopeda
-
Všechny články tohoto čísla
- Multimodální monitorování v intenzivní péči u těžkých neurotraumat
- Memoriál Tomáša Kadlica – kto bol doc. MUDr. Tomáš Kadlic
- Programové prohlášení výboru na období 2009-2012
- Prohlášení Sekce pro ultrazvukové metody ČSARIM
- Zápis ze zasedání Akreditační komise oboru Anesteziologie a resuscitace ze dne 18.11.2009
- Rozhodování o přechodu z intenzivní na paliativní péči u pacientů s postupujícím a nezvratným multiorgánovým selháváním – konsenzuální stanovisko
- Registr pacientů s infekcí H1N1 hospitalizovaných na odděleních typu ARO/JIP 18. 11. 2009
- Zápis z jednání výboru č. 4/2009
- Přínos Johna W. Severinghause anesteziologii a intenzivní medicíně
- John W. Severinghaus – fyzik, elektronik, lékař, vědec
- Translating Basic Science to Clinical Care
- Úspěch na Postgraduate Assembly of Anesthesiology
- Vliv věku na farmakodynamické vlastnosti cisatrakuria, rokuronia a vekuronia u mužů během totální intravenózní anestezie – prospektivní studie
- TAP blok a pooperační bolest – prospektivní audit
- Výuka základní resuscitace rodičů nedonošených dětí – retrospektivní analýza dotazníků
- Kritéria pro zahájení venovenózního ECMO u pacientů s respiračním selháním na základě infekce virem H1N1, platné v Kardiocentru VFN Praha
- Plazmafiltrace spojená s adsorpcí v experimentálním septickém šoku – překlad originálního článku*
- Anesteziologie a intenzivní medicína
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- TAP blok a pooperační bolest – prospektivní audit
- Rozhodování o přechodu z intenzivní na paliativní péči u pacientů s postupujícím a nezvratným multiorgánovým selháváním – konsenzuální stanovisko
- Multimodální monitorování v intenzivní péči u těžkých neurotraumat
- Kritéria pro zahájení venovenózního ECMO u pacientů s respiračním selháním na základě infekce virem H1N1, platné v Kardiocentru VFN Praha
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



