-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Transarteriální chemoembolizace u hepatocelulárního karcinomu jater
Transarterial Chemoembolization in Hepatocellular Carcinoma
Introduction:
Hepatocelullar carcinoma (HCC) is the fifth most common cancer in the world. It mostly occurs in patients with cirrhosis. In the Czech Republic, about 250 new cases are reported per year. Surgery, i.e. liver resection or transplantation, as the only potentially curable method is possible in 15–20% of them. For the rest, palliative treatment is indicated. This includes ablative methods (radiofrequency ablation, alcoholization), transarterial chemoembolization (TACE), systemic chemotherapy or biological treatment by sorafenib. TACE is method of choice in patients unsuitable for surgery and ablative treatment. Another indication is embolization of HCC before liver transplantation to prevent tumour progression. In combination with other methods, down staging of the tumour and curable treatment afterward is possible.Aims:
To assess the outcome of transarterial chemoembolisation in patients with hepatocellular carcinoma.Methods:
Between 2004–2008 we performed 30 TACE. Of that number, 28 TACE were performed in 20 patients with HCC. We super selectively catheterized the tumour via arteria femoralis and used Doxorubicin with Lipiodol as embolic material. In follow up, we carried out laboratory studies and CT.Results:
We have not noticed any major complications. Post-embolization syndrome with fever, nausea and right upper quadrant pain occurred after 10 TACE (33%). One-, two - and three years survival of the patients was 53%, 40% a 20%.Conclusion:
TACE is safe method prolonging patients’ survival with unresectable HCC. For the correct treatment of HCC, its concentration to cancer centres and the cooperation between multiple specialists is necessary.Key words:
hepatocellular carcinoma – transarterial chemoembolization
Autoři: M. Varga; A. Valsamis; I. Matia; J. Peregrin *; E. Honsová **; M. Šafanda ***; M. Oliverius
Působiště autorů: Klinika transplantační chirurgie IKEM, přednosta: prof. MUDr. M. Adamec, CSc. ; Pracoviště radiodiagnostiky a intervenční radiologie IKEM, přednosta: prof. MUDr. J. Peregrin, CSc. *; Pracoviště klinické a transplantační patologie IKEM, přednostka: MUDr. E. Honsová, Ph. D. **; Oddělení klinické onkologie Nemocnice Na Homolce, primář: MUDr. M. Šafanda ***
Vyšlo v časopise: Rozhl. Chir., 2009, roč. 88, č. 8, s. 434-438.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Hepatocelulární karcinom (HCC) je celosvětově pátý nejčastější zhoubný novotvar. Ve většině případů vzniká v terénu jaterní cirhózy. Incidence v České republice je kolem 250 případů za rok. Z toho jen u 15–20 % nemocných je možná kurabilní terapie – jaterní resekce nebo transplantace jater. U ostatních pacientů je indikována paliativní nebo symptomatická léčba. Paliativní terapie zahrnuje perkutánní ablační metody, transarteriální chemoembolizaci (TACE), systémovou chemoterapii a nebo biologickou léčbu sorafenibem. TACE je metodou volby u pacientů nevhodných k resekci a ablační léčbě. Jeho další využití je v zabránění progrese nádoru před transplantací, případně v kombinaci s jinými metodami k dosažení downstagingu nádoru a následného zařazení ke kurabilní léčbě.Cíl:
Cílem práce bylo zjistit přeživání a komplikace u pacientů po transarteriální chemoembolizaci inoperabilního hepatocelulárniho karcinomu.Materiál a metodika:
V období let 2004 až 2008 jsme provedli 30 TACE. Z toho jsme 28 výkonů provedli u 20 pacientů s diagnózou HCC. Chemoembolizace byla prováděná superselektivně cestou arteria femoralis směsí Doxorubicinu a Lipiodolu. Následovala ambulantní dispenzarizace s pravidelnými laboratorními kontrolami a kontrolami počítačovou tomografií (CT).Výsledky:
Po žádném výkonu se nevyskytly závažné komplikace. Po 10 výkonech (33 %) došlo k nezávazným komplikacím a to elevaci jaterních testů 6x, subfebríliím 6x a bolestem v pravém podžebří 4x. Jedno-, dvou - a tříleté přežívání pacientů je 53 %, 40 % a 20 %.Závěr:
Transarteriální chemoembolizace je bezpečná metoda prodlužující přežití pacientů s jinak neléčitelným HCC. Pacienti jsou k léčbě indikováni na základě multioborové spolupráce (chirurg, hepatolog, onkolog a invazivní radiolog). Podmínkou úspěšné léčby HCC je její koncentrace na specializovaném pracovišti s dostupností všech diagnostických a terapeutických metod.Klíčová slova:
hepatocelulární karcinom – transarteriální chemoembolizaceÚVOD
Hepatocelulární karcinom (HCC) je celosvětově pátý nejčastější zhoubný novotvar [1] a nejčastější primární zhoubný jaterní nádor. Až 90 % případů vzniká v terénu jaterní cirhózy. V etiologii existují endemické rozdíly. Zatímco v Evropě je výskyt o něco nižší a významnou roly hraje chronická hepatitida C a etylická jaterní cirhóza [2–4], v Asii a Africe se na jeho etiologii více podílí chronická hepatitida B a svoji roli zde hraje i expozice aflatoxinu z potravy. V České republice je incidence HCC kolem 250 případů za rok (podle údajů ÚZIS bylo v roce 2004 hlášeno 267 nových případů HCC). Z toho jen u 15–20 % nemocných je možná kurativní terapie – jaterní resekce nebo transplantace jater [5, 6]. U ostatních pacientů je indikována léčba paliativní nebo symptomatická. Paliativní terapie zahrnuje perkutánní ablační metody (radiofrekvenční ablaci, perkutánní alkoholizaci), transarteriální chemoembolizaci (TACE), systémovou chemoterapii a nebo biologickou léčbu sorafenibem. Podávání sorafenibu u nepředléčných nemocných mírně,ale statisticky významně prodlužuje čas do progrese i celkové přežití [7]. Neléčený HCC má velmi špatnou prognózu s mediánem přežití 1 až 8 měsíců [8]. TACE je metodou volby, která vede k signifikantnímu prodloužení přežití [9–11], u pacientů nevhodných k resekci nebo ablační léčbě. Další indikací je zabránění progrese tumoru u pacientů zařazených na čekací listinu k transplantaci, zejména když je očekávaná doba do transplantace delší něž půl roku [12].
MATERIÁL A METODA
Od prosince 2004 do prosince 2008 jsme provedli 30 TACE u 21 pacientů. Z toho 28 zákroků u 20 pacientů bylo provedeno pro HCC a u jednoho pacienta, který odmítal transplantaci, byla TACE dvakrát provedena pro hemangioendotheliom [13].
Tumor v terénu etylické cirhózy byl indikací k TACE u 9 pacientů (45 %), v terénu HCV cirhózy u 5 pacientů (25 %), v terénu HBV cirhózy u 5 pacientů (25 %) a primární HCC byl diagnostikován u jednoho pacienta (5 %). Průměrná velikost ložisek byla 7,6 cm (3–14 cm, medián 9 cm). U 5 pacientů byl nádor před TACE histologicky verifikován. U ostatních byla diagnóza stanovena na základě zobrazovacích metod a laboratorních výsledků (AFP). K paliativní TACE jsme indikovali pacienty s neresekabilním tumorem, nevhodným k ablaci, bez známek generalizace, s průchodnou vena portae a s dobrou funkcí jater (max. Child-Pugh B – 8 bodů). Dále byla TACE provedena u 6 pacientů na čekací listině před transplantací jater.
Chemoembolizaci jsme prováděli cestou a. femoralis, přes truncus coeliacus a a. hepatica (Obr. 1). Odtud jsme superselektivně kanylovali tepnu živící tumor. Následně jsme aplikovali směs Lipiodolu (max. 20 ml) s Doxorubicinem (max. 50 mg) (Obr. 2 a 3). Po výkonu následovala observace pacienta na standardním oddělení. Podle potřeby jsme podávali analgetika a antipyretika. Pacienta jsme propustili do domácí péče obvykle první až druhý den po výkonu. Následně byla u ambulantně dispenzarizovaného pacienta provedena s odstupem 2 týdnů kontrola laboratorních parametrů a CT kontrola ložiska za 1 až 3 měsíce. Podle výsledku CT jsme eventuálně indikovali opakování TACE (progrese nálezu, zachovalé arteriální zásobení).
Obr. 1. Angiografie tr. coeliacus – tumor zásobený z levé a. hepatica Fig. 1. Angiography of the tr. coeliacus – a tumor supplied from the left hepatic artery 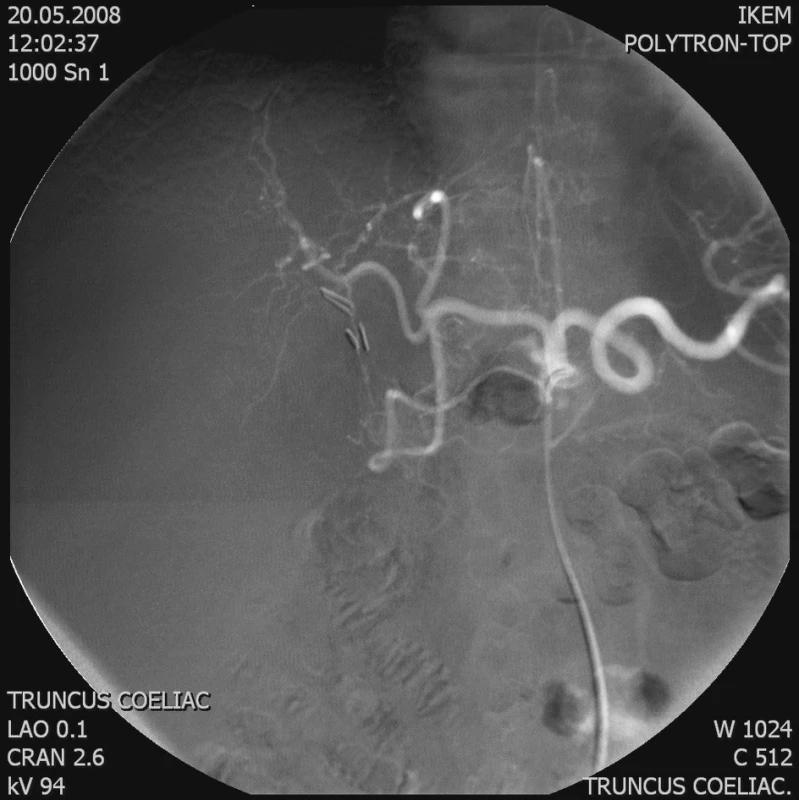
Obr. 2. Po embolizaci je tumor vyplněn Lipiodolem Fig. 2. Following its embolization, the tumor is filled with Lipiodol 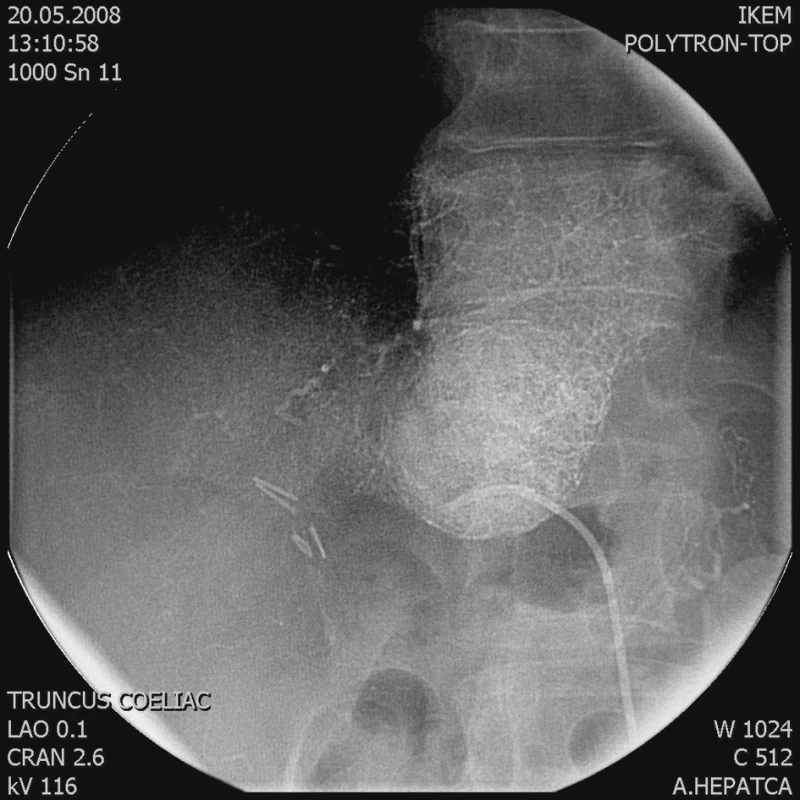
Obr. 3. Kontrolní AG a. hepatica – větve zásobující tumor se neplní Fig. 3. Control AG of the hepatic artery – the branches supplying the tumor do not fill 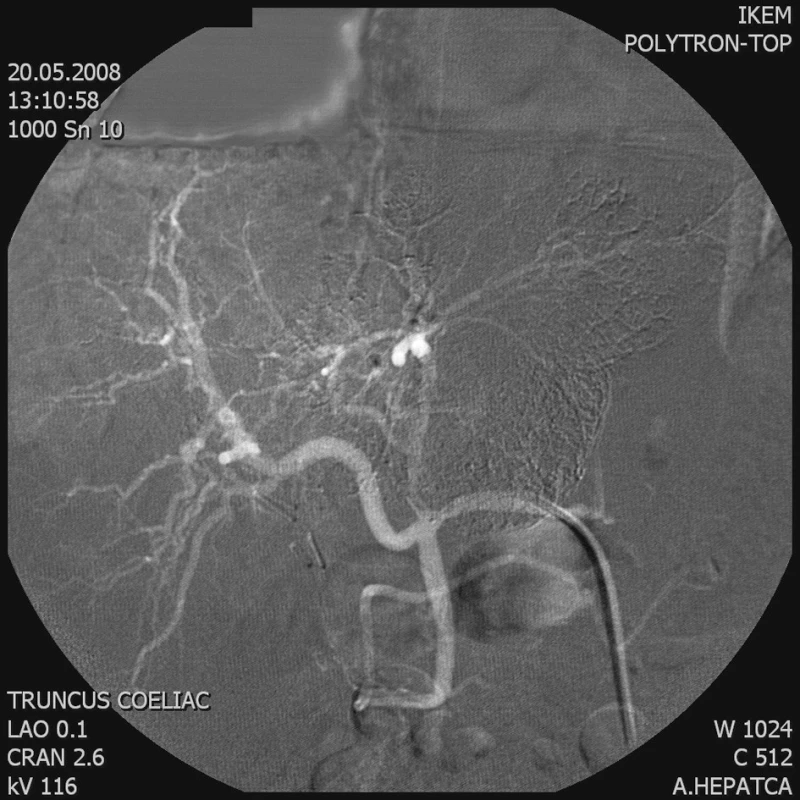
VÝSLEDKY
Závažné komplikace jsme nezaznamenali po žádném výkonu. Po 10 výkonech (33 %) došlo k nezávazným komplikacím a to elevaci jaterních testů 6x, subfebríliím 6x a bolestem v pravém podžebří 4x. U jednoho pacienta došlo k „down stagingu“ a následné resekci tumoru. Osm pacientů zemřelo na progresi onemocnění a šest pacientů žije s dobou sledování 8–42 měsíců. Průměrná doba přežití byla 21 měsíců. Jednoleté přežívání bylo 53 %, dvouleté a tříleté 40 % a 20 % (Graf 1). Výkon jsme opakovali 3x u jednoho pacienta, 2x u jiného a 1x u čtyřech pacientů. U šesti pacientů byla TACE provedena na čekací listině před transplantací jater. Z toho dva pacienti byli úspěšně transplantováni, čtyři na transplantaci čekají. V explantátu jater u obou transplantovaných pacientů se nezměnila velikost nádorového ložiska. Došlo ale k rozsáhlé nekróze nádoru, která tvořila 90 % respektive 75 % nádorové tkáně (Obr. 4, 5, 6).
Graf 1. Křivka přežívání pacientů po TACE v našem souboru. Průměrná doba přežití byla 21 měsíců. Hodnoceno metodou podle Kaplana-Meierové Graph 1. Patient survival curve following TACE in the study group. The mean survival period was 21 months. Assessed using the Kaplan-Meier method 
Obr. 4. Kompletně nekrotický úsek tkáně nádoru (šipka). Nekróza je obklopená reaktivním lemem vazivové tkáně, vlevo nahoře je část cirhotického uzlu bez nádoru (100x, H&E) Fig. 4. Completely necrotized region of the tumor tissue (arrow). The necrosis is surrounded by a reactive rim of fibrous tissue, in the left upper corner, a cirrhotic, tumor-free bundle can be seen (100x, H&E) 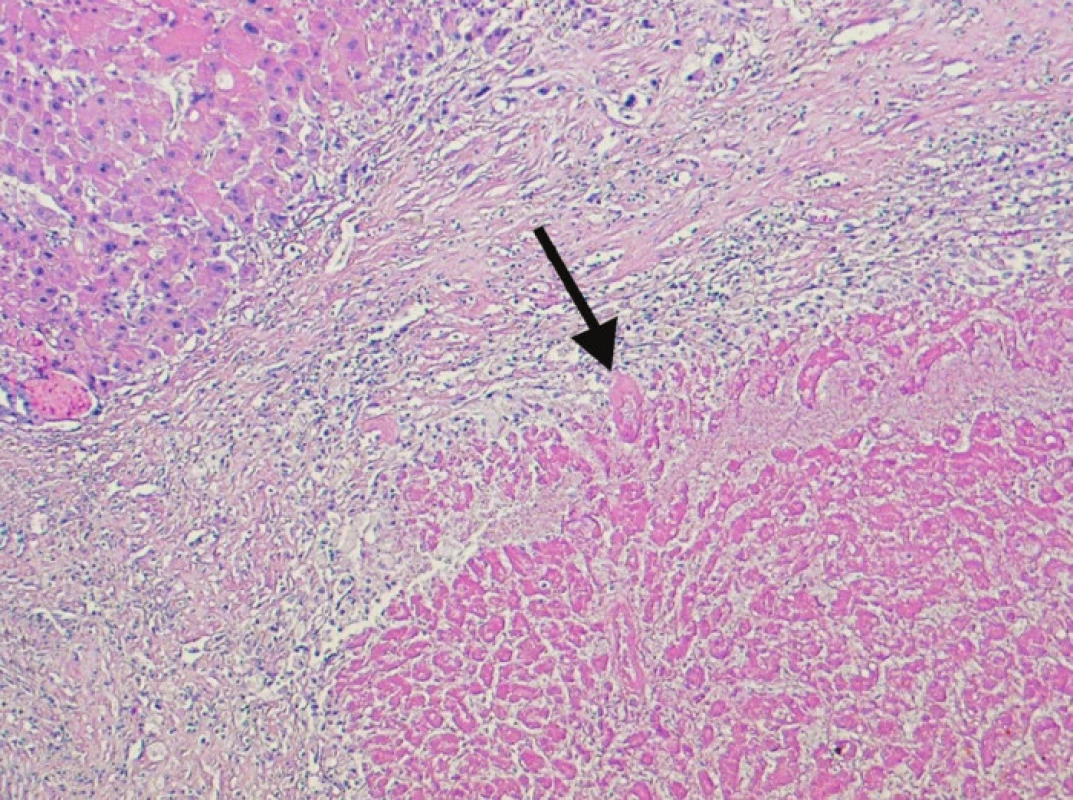
Obr. 5. Detail rozhraní nekrotického nádoru a přilehlého vaziva. Tkáň na nekrózu reaguje obrovsko-buněčnou reakcí, která je součástí regresivně reparativních změn a zahrnuje resorpci nekrotických hmot s ohraničením ložiska (200x, H&E) Fig. 5. A detail view of the boundary between the necrotic tumor and the adjacent fibrous tissue. The necrosis produces a giant-cell reaction within the tissue, which is a part of the reparative changes and includes resorption of the necrotic tissue with the focus demarkation (200x, H&E) 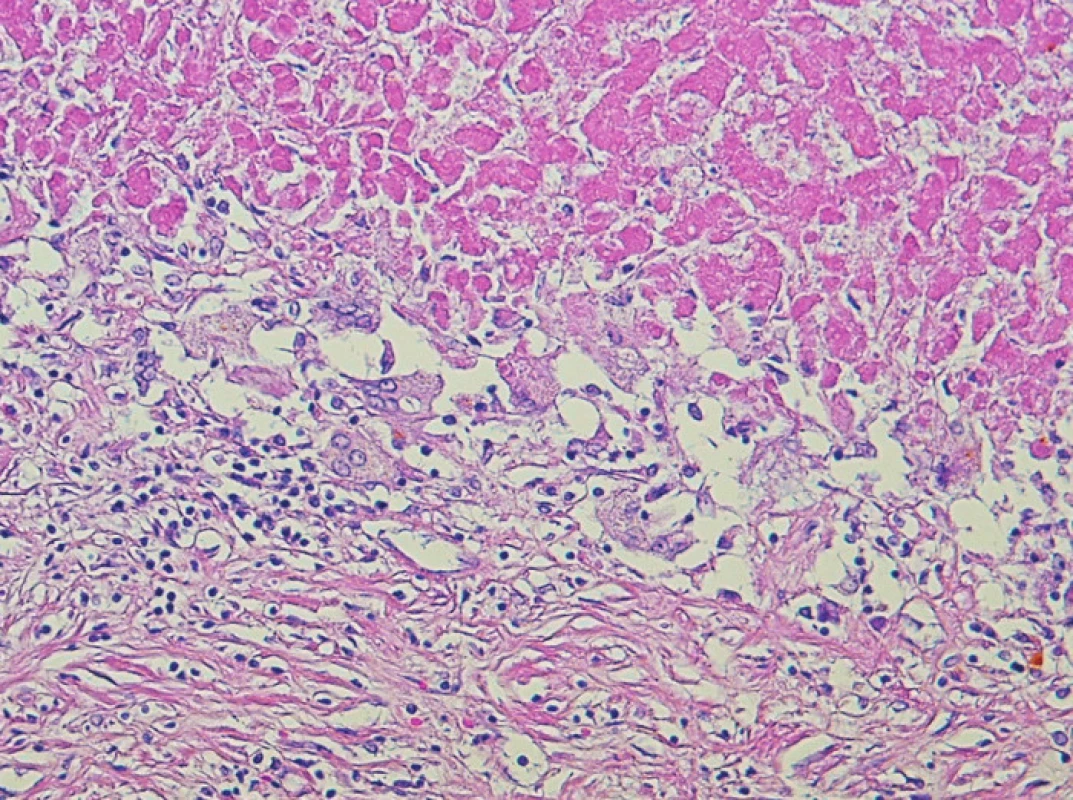
Obr. 6. Nekrotický nádor – makroskopie Fig. 6. The necrotic tumor – macroscopy 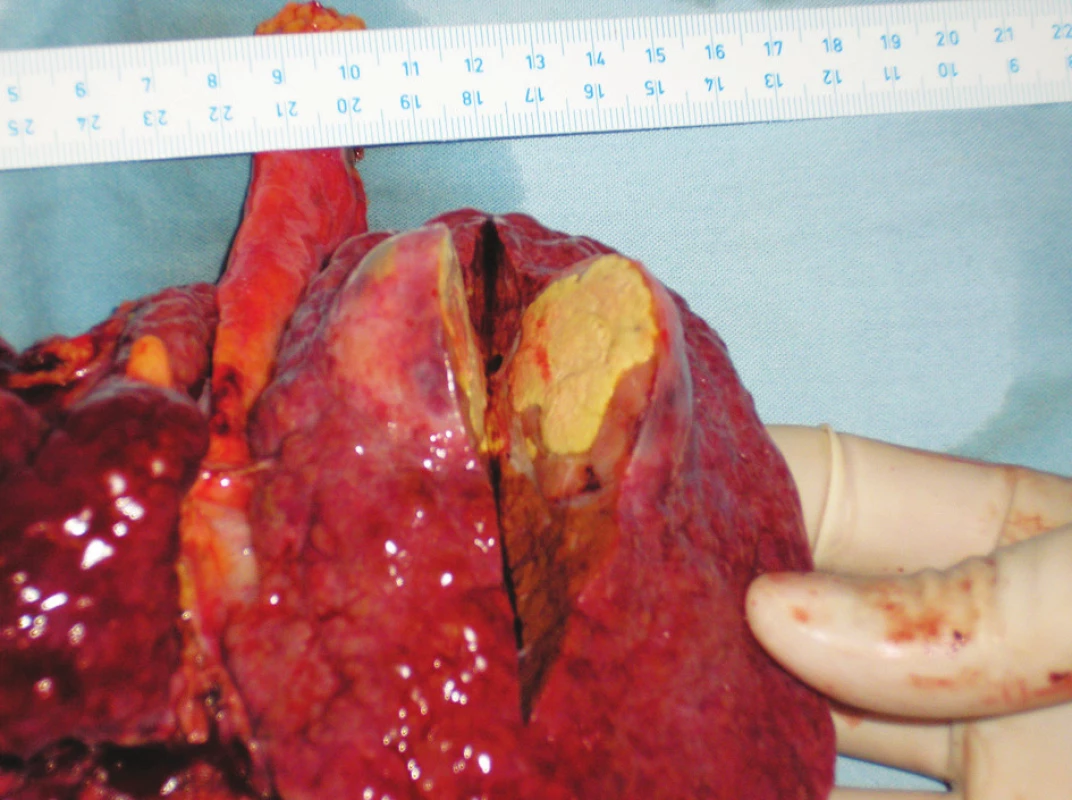
DISKUSE
První TACE byla provedena Doyonem a spolupracovníky v roce 1974 [14]. Princip metody vychází z toho, že HCC je až z 90 % živený tepennou krví z arteria hepatica [15, 16]. Lipiodol Ultra-Fluide je rentgenkontrastní iodizovaný olej který je dlouhodobě deponován v nádorové tkáni jater [17]. Při podání ve směsi s chemoterapeutikem může toto dlouhodobě lokálně působit. Byla prokázána až 40krát vyšší koncentrace chemoterapeutika v tumoru v porovnání s okolní jaterní tkání [18, 19]. Lipiodol postupně proniká až do presinusoidálních větviček v. portae a působí současnou blokádu portálního zásobení tumoru [20]. Následná embolizace nutritivní tepny želatinovou pěnou působí ischemii celého ložiska a dále potencuje terapeutický efekt [21–23].
Většina pacientů s HCC je diagnostikována v pokročilém stadiu onemocnění, které jim neumožňuje podstoupit kurativní léčbu – resekci nebo transplantaci. Pacienti nevhodní ke kurabilní terapii mají velmi špatnou prognózu. Perkutánní ablační metody jsou limitovány zejména rozsahem nádoru. Odpověď na systémovou chemoterapii je nízká (kolem 20 %) [24]. TACE je efektivní paliativní metoda léčby s prokázaným prodloužením přežití pacientů. Naše výsledky potvrzují nízké riziko komplikací a ve dvou případech histologicky verifikované nekrózy téměř celého nádoru. Přežívání pacientů závisí na mnoha faktorech: rozsah onemocnění, grading nádoru, přítomnost vaskulární invaze apod. V našem souboru převažují pacienti s pokročilejším stadiem onemocnění, což ovlivňuje celkové přežívání [9, 10, 25]. Při volbě léčebné strategie je nutná multioborová spolupráce chirurga, hepatologa, patologa, onkologa a intervenčního radiologa. U pacientů zvažovaných k transplantaci jater může TACE zmenšit nádorové ložisko. Indikace k embolizaci pacientů na čekací listině k transplantaci je v kompetenci transplantačních center.
ZÁVĚR
Transarteriální chemoembolizace je bezpečná metoda prodlužující přežití pacientů s jinak neléčitelným HCC. Pacienti jsou k léčbě indikováni na základě multioborové spolupráce (chirurg, hepatolog, onkolog a invazivní radiolog). Podmínkou úspěšné léčby HCC je její koncentrace na specializovaném pracovišti s dostupností všech diagnostických a terapeutických metod.
MUDr. Martin Varga
Ke Krči 1044/19
147 00 Praha 4
e-mail: mavg@medicon.cz
Zdroje
1. Parkin, D. M., Bray, F., Ferlay, J., Pisani, P. Estimating the world cancer burden: Globocan 2000. Int. J. Cancer, 2001; 94(2): 153–156.
2. Donato, F., Tagger, A., Chiesa, R., et al. Hepatitis B and C virus infection, alcohol drinking, and hepatocellular carcinoma: a case-control study in Italy. Brescia HCC Study. Hepatology, 1997; 26(3): 579–584.
3. Llovet, J. M., Burroughs, A., Bruix, J. Hepatocellular carcinoma. Lancet, 2003; 362(9399): 1907–1917.
4. Ryder, S. D. Guidelines for the diagnosis and treatment of hepatocellular carcinoma (HCC) in adults. Gut, 2003; 52 Suppl. 3: iiil–8.
5. Jaeck, D., Bachellier, P., Oussoultzoglou, E., Weber, J. C., Wolf, P. Surgical resection of hepatocellular carcinoma. Post-operative outcome and long-term results in Europe: an overview. Liver Transpl., 2004;10 (2 Suppl. l): S58–63.
6. Llovet, J. M., Bruix, J., Gores, G. J. Surgical resection versus transplantation for early hepatocellular carcinoma: clues for the best strategy. Hepatology, 2000; 31(4): 1019–1021.
7. Llovet, J. M., Ricci, S., Mazzaferro, V., et al. Sorafenib in advanced hepatocellular carcinoma. N. Engl. J. Med., 2008; 359(4): 378–390.
8. Okuda, K., Ohtsuki, T., Obata, H., et al. Natural history of hepatocellular carcinoma and prognosis in relation to treatment. Study of 850 patients. Cancer, 1985; 56(4): 918–928.
9. Takayasu, K., Arii, S., Ikai, I., et al. Prospective cohort study of transarterial chemoembolization for unresectable hepatocellular carcinoma in 8510 patients. Gastroenterology, 2006; 131 (2): 461–469.
10. Lo, C. M., Ngan, H., Tso, W. K., et al. Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology, 2002; 35(5): 1164–1171.
11. Llovet, J. M., Real, M. I., Montana, X., et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet, 2002; 359(9319): 1734–1739.
12. Belghiti, J., Carr, B. I., Greig, P. D., Lencioni, R., Poon, R. T. Treatment before liver transplantation for HCC. Ann. Surg. Oncol., 2008; 15(4): 993–1000.
13. St Peter, S. D., Moss, A. A., Huettl, E. A., Leslie, K. O., Mulligan, D. C. Chemoembolization followed by orthotopic liver transplant for epithelioid hemangioendothelioma. Clin. Transplant., 2003; 17(6): 549–543.
14. Doyon, D., Mouzon, A., Jourde, A. M., Regensberg, C., Frileux, C. [Hepatic, arterial embolization in patients with malignant liver tumours (author_transl)]. Ann. Radiol. (Paris), 1974; 17(6): 593–603.
15. Ackerman, N. B. The blood supply of experimental liver metastases. IV. Changes in vascularity with increasing tumor growth. Surgery, 1974; 75(4): 589–596.
16. Kan, Z., Ivancev, K., Lunderquist, A., et al. In vivo microscopy of hepatic tumors in animal models: a dynamic investigation of blood supply to hepatic metastases. Radiology, 1993; 187(3): 621–626.
17. Bhattacharya, S., Novell, J. R., Winslet, M. C., Hobbs, K. E. Iodized oil in the treatment of hepatocellular carcinoma. Br. J. Surg., 1994; 81(11): 1563–1571.
18. Konno, T. Targeting cancer chemotherapeutic agents by use of lipiodol contrast medium. Cancer, 1990; 66(9): 1897–1903.
19. Nakamura, H., Hashimoto, T., Oi, H., Sawada, S. Transcatheter oily chemoembolization of hepatocellular carcinoma. Radiology, 1989; 170(3 Pt l): 783–786.
20. Gates, J., Hartnell, G. G., Stuart, K. E., Clouse, M. E. Chemoembolization of hepatic neoplasms: safety, complications, and whento worry. Radiographics, 1999; 19(2): 399–414.
21. Ikeda, M., Maeda, S., Shibata, J., et al. Transcatheter arterial chemotherapy with and without embolization in patients with hepatocellular carcinoma. Oncology, 2004; 66(1): 24–31.
22. Maeda, S., Fujiyama, S., Tanaka, M., Ashihara, H., Hirata, R., Tomita, K. Survival and local recurrence rates of hepatocellular carcinoma patients treated by transarterial chemolipiodolization with and without embolization. Hepatol. Res., 2002; 23(3): 202–210.
23. Suzuki, M., Suzuki, H., Yamamoto, T., et al. Indication of chemoembolization therapy without gelatin sponge for hepatocellular carcinoma. Semin. Oncol., 1997; 24(2 Suppl 6): S6-110–S6-115.
24. Nerenstone, S., Friedman, M. Medical treatment of hepatocellular carcinoma. Gastroenterol. Clin. North Am., 1987; 16(4): 603–612.
25. Bronowicki, J. P., Vetter, D., Dumas, F., et al. Transcatheter oily chemoembolization for hepatocellular carcinoma. A 4-year study of 127 French patients. Cancer, 1994; 74(1): 16–24.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2009 Číslo 8- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- O znalcích v oboru chirurgie
- Výsledky jednoročního přežití u nemocných po resekci hlavy slinivky břišní s resekcí žil portomezenterické oblasti (PMO)
- Optimální miniinvazivní přístup při náhradě jícnu žaludkem
- GIST jako příčina invaginace na tenkém střevě
- Význam cytokeratinového markeru TPS v pooperačním sledování nemocných s kolorektálním karcinomem
- Transarteriální chemoembolizace u hepatocelulárního karcinomu jater
- 120 laparoskopických adrenalektomií s harmonickým skalpelem
- PTA krurálnych tepien u diabetikov
- Poúrazová svalová hernia predlaktia
- Léze podkolenní jamky s neurologickou symptomatologií – kazuistiky, diagnostika a léčba
- Léčení seniorů na okresním chirurgickém oddělení
- Přínos magnetické rezonance pro diagnostiku a léčbu poranění torakolumbální páteře
- Přínos ultrasonografie břicha v diagnostice akutní apendicitidy – naše zkušenosti
- PCCP versus standardní proximální femorální hřeb při léčbě pertrochanterických zlomenin femoru
- Operační rizika a význam předoperační péče
- Cévní chirurgie dnes a zítra – reakce České společnosti intervenční radiologie, aneb potrefená husa zakejhala
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Operační rizika a význam předoperační péče
- Léze podkolenní jamky s neurologickou symptomatologií – kazuistiky, diagnostika a léčba
- Transarteriální chemoembolizace u hepatocelulárního karcinomu jater
- O znalcích v oboru chirurgie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



