-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Infekce v rekonstrukční cévní chirurgii
Infection in Vascular Reconstructive Surgery
Purpose:
Infection is one of the most serious complications in vascular surgery.Methods:
We summarize the patients operated on in our clinic during a 3-year period for infection of the arterial reconstruction.Results:
577 primary arterial reconstructions were performed in the region of abdominal aorta and lower limb arteries during the years 2003–2005. In the same period 17 patients were operated on for infection of the arterial reconstruction grade III of Szilagyi (13x aortofemoral, 4x femoropopliteal region). The main agent of infection was Staphylococcus aureus (47.1%). In most cases the therapy involved revision of the infected groin (10x) with subsequent explantation of the reconstruction (7 patients). Eight extraanatomic reconstructions were performed. Three patients died during the follow-up (2 within 30 days of an operation). The one year mortality rate is 17.6%. Amputation was necessary in 6 patients (i.e. 35.3%)Conclusions:
Handling vascular infection still remains a challenging diagnostic and therapeutic problem.Key words:
infection – vascular surgery – prosthesis – sepsis
Autoři: M. Krejčí; Z. Gregor; J. Podlaha; Z. Kříž; P. Gladiš; M. Přívara; M. Dvořák; Z. Konečný
Působiště autorů: II. chirurgická klinika LF MU a FN u sv. Anny v Brně, přednosta: doc. MUDr. Z. Gregor, CSc.
Vyšlo v časopise: Rozhl. Chir., 2007, roč. 86, č. 12, s. 629-634.
Kategorie: Monotematický speciál - Původní práce
Souhrn
Úvod:
Infekce představuje jednu z nejzávažnějších komplikací v cévní chirurgii.Metodika:
Uvádíme souhrn pacientů, operovaných na naší klinice v průběhu 3 let pro infekci tepenné rekonstrukce.Výsledky:
Během let 2003–2005 bylo provedeno 577 primárních tepenných rekonstrukcí v oblasti břišní aorty a tepen dolních končetin. Ve stejném období bylo operováno 17 pacientů pro infekci tepenné rekonstrukce stupně III podle Szilágyiho (13x aortofemorální oblast, 4x femoropopliteální oblast). Hlavním původcem infekce byl Staphylococcus aureus (47,1 %). Terapie zahrnovala ve většině případů revizi infikovaného třísla (10x) s následnou explantací rekonstrukce (7 pacientů). Bylo založeno 8 extraanatomických rekonstrukcí. Tři pacienti zemřeli během dalšího sledování (2 do 30 dnů po operaci). Jednoroční mortalita představuje 17,6 %. Amputace byla nutná u 6 pacientů (35,3 %).Závěr:
Řešení infekce cévních náhrad zůstává nadále obtížným diagnostickým a terapeutickým problémem.Klíčová slova:
infekce – cévní chirurgie – protéza – sepseÚVOD
Infekce představuje jednu z nejzávažnějších komplikací operací v cévní chirurgii. Riziko ztráty končetiny nebo i úmrtí na infekční komplikace je stále vysoké navzdory pokrokům v časné diagnostice a terapii.
Cílem článku je přiblížit současný přístup k diagnostice a léčbě infekce tepenných rekonstrukcí na pracovišti cévní chirurgie II. chirurgické kliniky LF MU FN u sv. Anny v Brně (Česká republika). Diagnostické a terapeutické postupy se opírají o bohaté zkušenosti pracoviště a současné trendy.
Metodika
Shrnujeme počty primárních tepenných rekonstrukcí, provedených na našem pracovišti v průběhu let 2003 až 2005. Do dynamické studie jsme zařadili pacienty, kteří byli naší klinice operováni v tomto období pro manifestaci infekce cévní rekonstrukce, odpovídající typu III podle Szilágyiho klasifikace [15].
Podáváme základní charakteristiky souboru pacientů s infekcí, typ primární cévní rekonstrukce. Uvádíme dobu do projevů infekce, typ její manifestace a použité diagnostické metody. Shrnujeme zjištěné původce infekčních komplikací, terapeutické postupy s důrazem na operační řešení a jeho komplikace. Morbiditu a mortalitu srovnáváme s údaji z dostupné literatury.
VÝSLEDKY
1. Cévní rekonstrukce 2003–2005
Ve sledovaném období bylo na II. chirurgické klinice provedeno 577 primárních tepenných rekonstrukcí v oblasti břišní aorty a tepen dolních končetin. (Tab. 1). K rekonstrukci byla použita autologní véna, pletená cévní protéza (Výzkumný ústav pletařský a.s., Brno), PTFE protéza (B. Braun). Do výčtu nejsou zahrnuty tepenné trombektomie, embolektomie a plastiky anastomóz.
Tab. 1. Počty operací 2003–2005 Tab 1. Numbers of procedures during 2003–2005 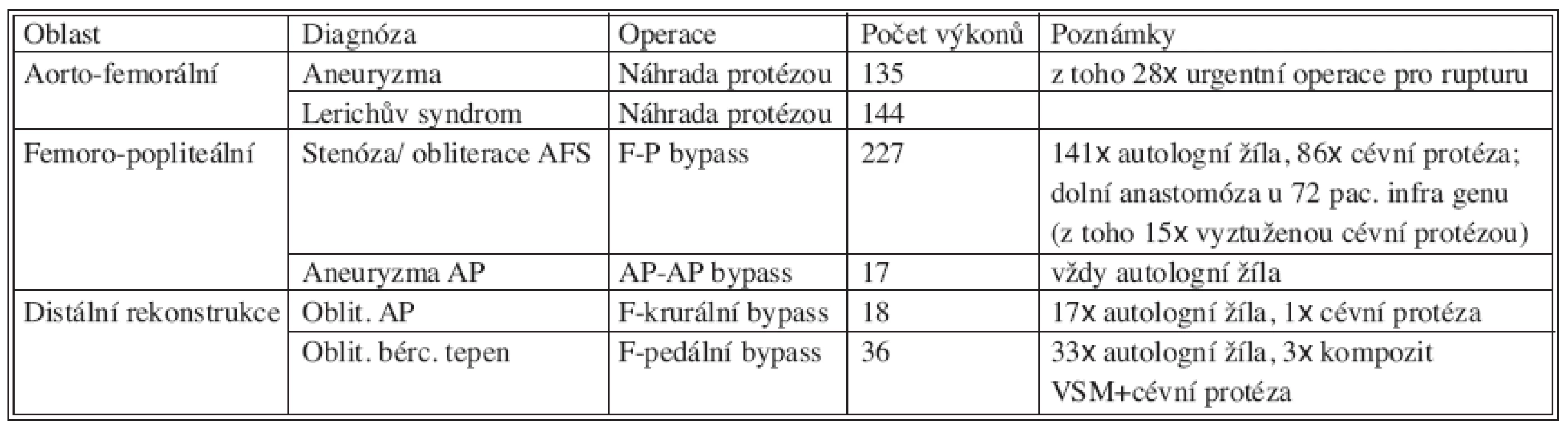
AFS – a. femoralis superficialis AP – a. poplitea VSM – vena saphena magna 2. Soubor pacientů s infekcí
V průběhu sledovaných 3 let byla zjištěna infekce tepenné náhrady u 17 pacientů. Šlo o 15 mužů a 2 ženy, průměrný věk pacientů byl 63,7 roku (46–80). Následující tabulky shrnují základní charakteristiky tohoto souboru pacientů, anamnestické údaje, komorbidity a údaje o typu primární tepenné rekonstrukce (Tab. 2, 3). Položka „Imunitní porucha“ zahrnuje 2x nespecifikovaný imunodeficit, 1x séropozitivní revmatoidní arthritis.
Tab. 2. Charakteristika souboru pacientů s následnou infekcí cévní rekonstrukce Tab. 2. Characteristics of the study group of patients with subsequent infections of venous reconstructions 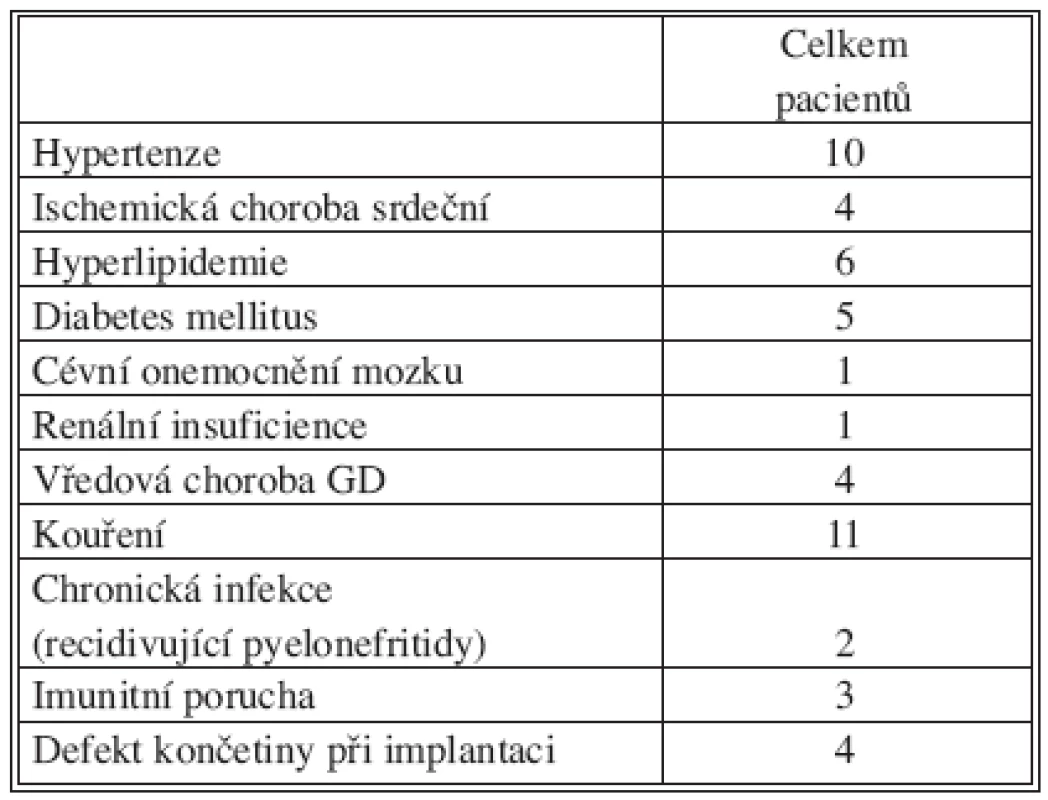
Tab. 3. Primární cévní rekonstrukční operace Tab. 3. Primary vascular reconstruction 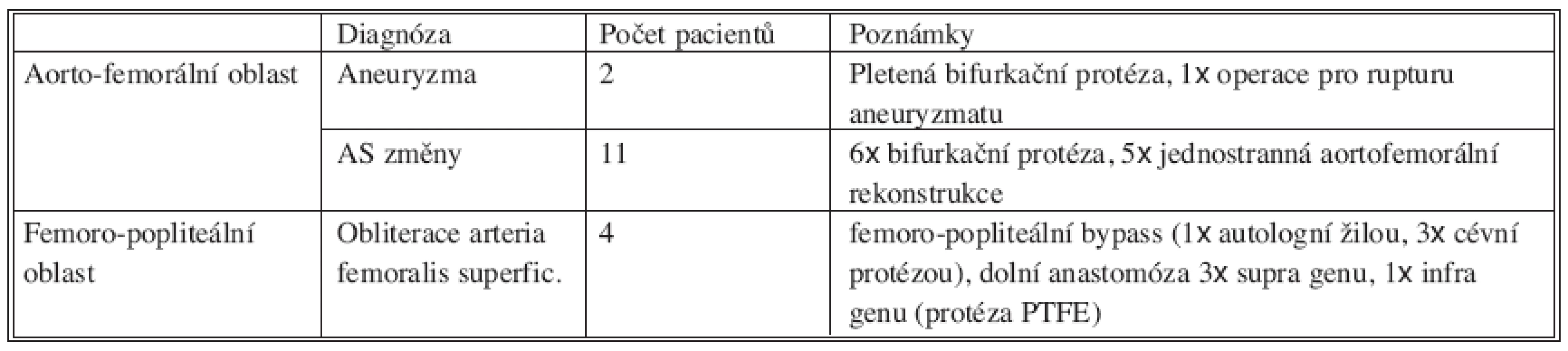
Primární aorto-femorální rekonstrukce byla u 3 pacientů provedena na jiném pracovišti (vždy pro Lerichův syndrom). U 9 pacientů po rekonstrukci v aorto-femorální oblasti byla později provedena revize a plastika v třísle. Podobně u 2 pacientů po femoro-popliteálním bypassu byla nutná operační revize v místě pozdější manifestace infekce.
Všem 17 pacientům bylo při tepenné rekonstrukci podáno profylakticky antibiotikum (12x penicilinová řada, 5x cefalosporin 1. či 2. řady).
3. Známky infekce
V případě aorto-femorální rekonstrukce se infekce projevila 10x retencí purulentní tekutiny v třísle, 2x uzávěrem rekonstrukce a 1x krvácením do trávicího ústrojí. Infekce femoro-popliteálního bypassu byla zjištěna u 1 pacienta při purulentní sekreci v ráně (PTFE protéza), 1x při řešení pseudovýdutě v horní anastomóze, u dalších 2 pacientů při revizi pro uzávěr rekonstrukce.
Dobu od poslední cévní rekonstrukce (primární cévní operace či poslední revize anastomóz) shrnuje tabulka č. 4.
Tab. 4. Doba do manifestace infekce Tab. 4. Time to infection manifestation 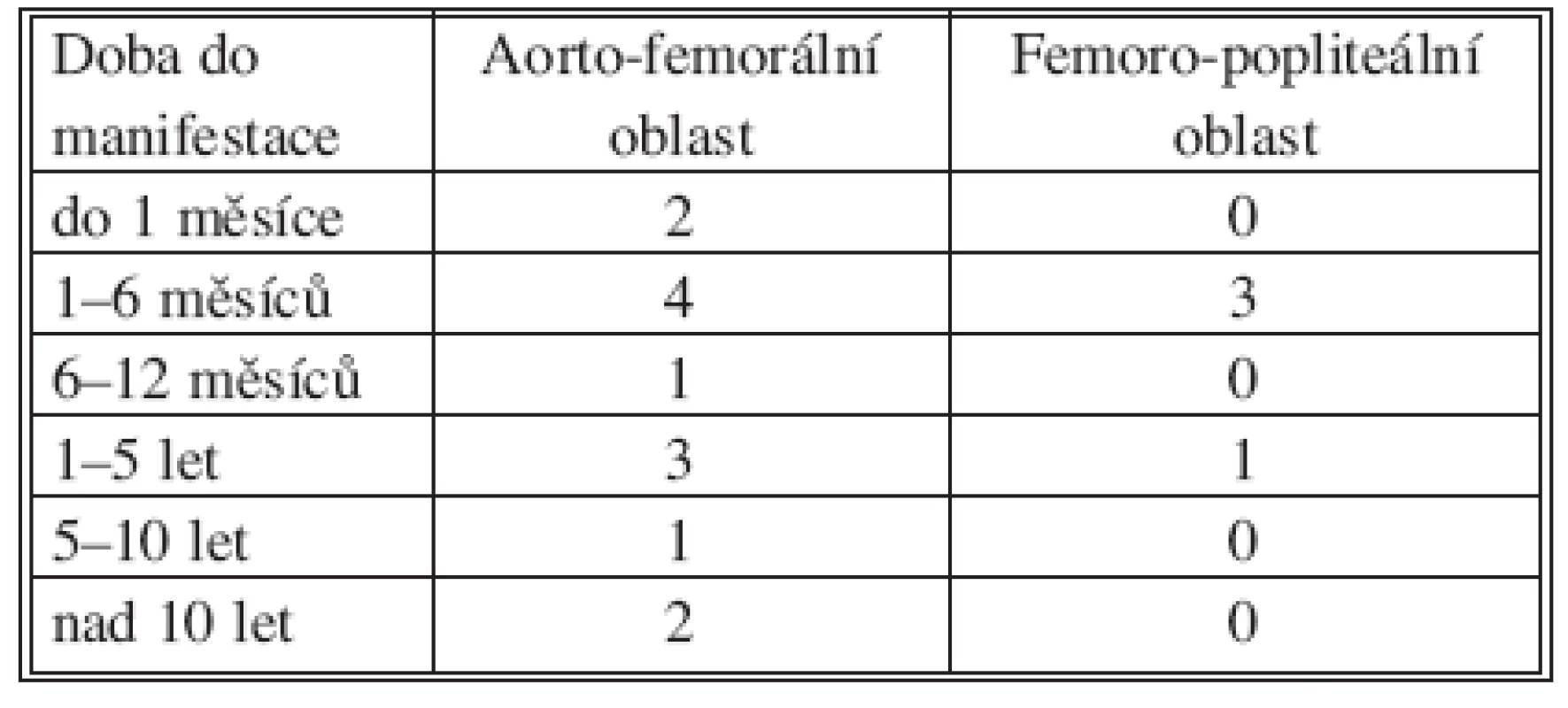
4. Diagnostika infekce
Rutinní klinické vyšetření bylo u 16 pacientů doplněno sonografií. V 7 případech byla provedena angiografie. Další 3 pacienti s podezřením na infekci aorto-femorální cévní náhrady podstoupili angio-CT vyšetření. Ve 2 případech byla pro podezření na infekci provedena – extramurálně – klasická fistulografie píštěle v třísle. U 1 pacienta po implantaci aorto-bifemorální protézy bylo pro podezření na krvácení do trávicího ústrojí provedeno endoskopické vyšetření, které pomohlo odhalit protézo-duodenální píštěl typu I-B podle Vollmara.
U všech pacientů bylo provedeno bakteriologické vyšetření (purulentní tekutina v ráně a/nebo při operačním řešení infekce). V následující tabulce (Tab. 5) uvádíme výsledky kultivace:
Tab. 5. Původci infekce rekonstrukcí Tab. 5. Etiology of reconstruction infections 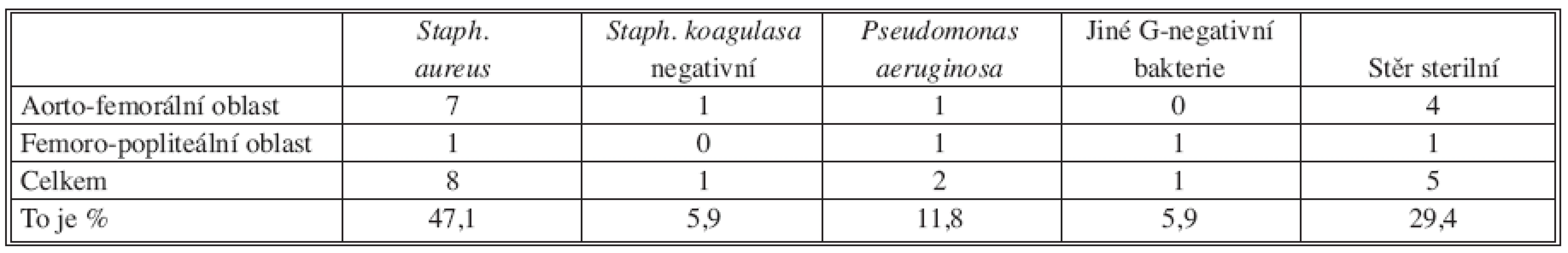
5. Terapie
Terapeutické postupy stanovuje angiochirurgická indikační komise II. chirurgické kliniky ve spolupráci s radiodiagnostiky, anesteziology a antibiotickým střediskem naší nemocnice.
Všem pacientům byla poskytnuta plná intenzivní péče. Všichni byli dlouhodobě léčeni antibiotiky cíleně podle výsledků kultivace a citlivosti.
a) Infekce aorto-femorální rekonstrukce:
Primárním řešením pro 9 pacientů byla revize infikovaného třísla a drenáž. U 3 pacientů byla provedena primární explantace celé rekonstrukce, 6 dalších pacientů podstoupilo explantaci po interním došetření a přípravě (Obr. 1). V 1 případě si těžká ischemie při trombóze rekonstrukce vyžádala ihned vysokou amputaci dolní končetiny. Prokrvení dolních končetin bylo u 8 pacientů zajištěno extra-anatomický bypassem (u 4 pacientů axillo-femorální a u 1 axillo-popliteální bypass, v 7 případech cross-over bypass). Vždy byla použita vyztužená PTFE protéza.
Obr. 1. Infikovaná bifurkační protéza (peroperační foto) Fig. 1. Infected bifurcation prosthesis (peroperative view) 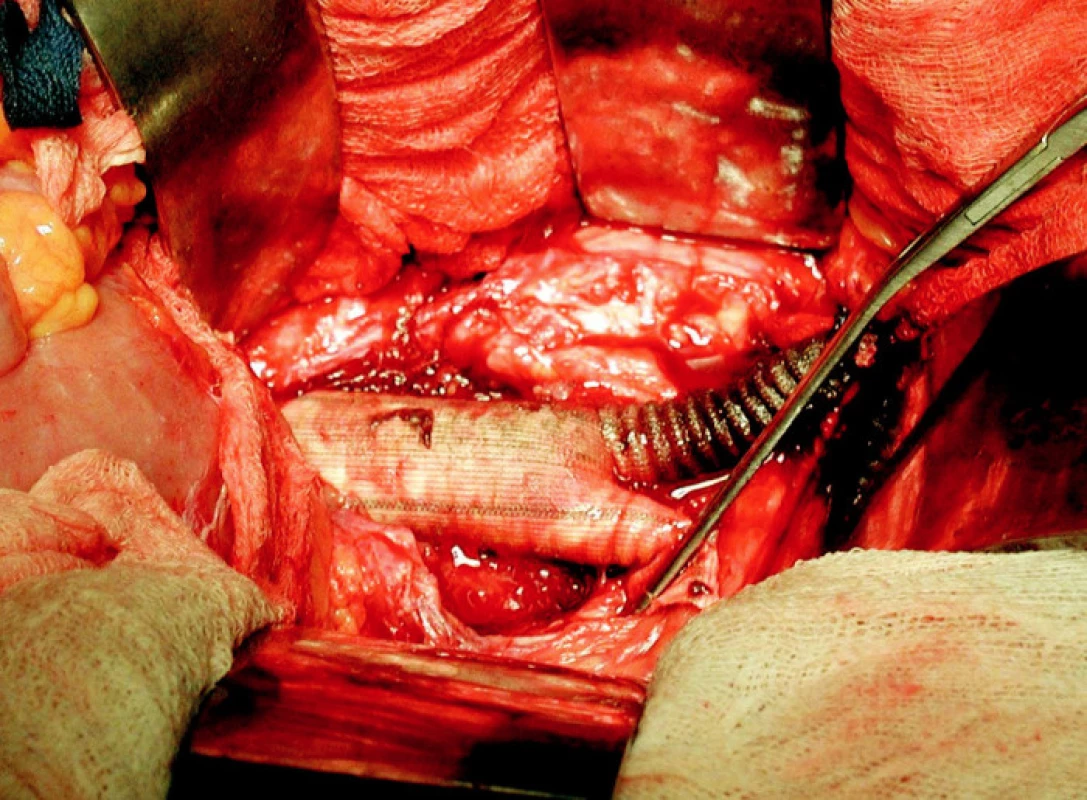
V pooperačním období zemřeli 2 pacienti na následky sepse, třetí odmítl po drenáži třísla další léčbu, zemřel mimo nemocnici.
b) Infekce ve femoro-popliteální oblasti:
U 1 pacienta byla nejprve provedena drenáž infikovaného třísla s následnou explantací. Jedenkrát byla resekována pseudovýduť v horní anastomóze s venózní plastikou (po 2 týdnech ruptura, podvaz a. femoralis communis, následně vysoká amputace). Dvakrát byla provedena primární explantace cévní protézy, z toho u 1 pacienta byla současně nutná amputace ischemické končetiny.
6. Současnost
Ve sledované skupině pacientů pokračuje follow-up 16–49 měsíců. V současnosti žije 14 pacientů, další 3 pacienti s infekcí bifurkační cévní protézy zemřeli.
a) pacienti po infekci v aorto-femorální oblasti:
Ve 3 případech byla nutná do 1 měsíce od manifestace infekce vysoká amputace ischemické končetiny. Z toho u 1 pacienta následně pro progresi ischemie exartikulace obou dolních končetin v kyčelních kloubech. Dále u 1 pacienta byla amputace končetiny vynucena uzávěrem axillo-femorálního bypassu 9 měsíců po jeho implantaci. Zachování končetiny v prvním roce po manifestaci infekce tak dosahuje 84,6 %.
Jednoroční primární průchodnost extra-anatomických rekonstrukcí byla 62,5 % (tj. 5 z 8 pacientů). Ze zbylých 3 pacientů 1 zemřel časně po explantaci infikované protézy, u dalších 2 byla provedena trombektomie, úspěšná v 1 případě. Tomu odpovídá sekundární roční průchodnost 75 %.
V průběhu sledování byla u 2 pacientů nutná explantace infikované extra-anatomické rekonstrukce (tj. 25 %). Infekční agens bylo v obou případech shodné s původcem prvotní protetické infekce (St. aureus resp. St. koagulasa-negativní). U 1 z těchto pacientů byl následně implantován nový axillo-femorální bypass. U 4 pacientů je dnes prokrvení končetin zachováno extra-anatomicky vedenou rekonstrukcí.
V 1 případě byla po laváži třísla s obnaženou cévní protézou provedena po 15 dnech resutura rány, bez recidivy infekce. U dalšího pacienta je po uzávěru axillo-femorálního a cross-over bypassu prokrvení končetin na stupni II-b podle Fontaina.
b) pacienti po infekci ve femoro-popliteální oblasti:
U 1 pacientky byla za 5 měsíců po odstranění infikované protézy a po antibiotické léčbě implantována ePTFE cévní protéza. Pacientka roku 2006 podstoupila trombektomii rekonstrukce a plastiku dolní anastomózy, při perorální antikoagulaci a antiagregaci je rekonstrukce průchodná.
U dalšího pacienta zůstává prokrvení po explantaci rekonstrukce na stupni II-b podle Fontaina. U zbylých 2 pacientů byla nutná amputace ischemické končetiny.
c) poznámky
První rok po manifestaci cévní infekce přežilo 82,4 % pacientů. Jednoroční mortalita je tedy 17,6 %.
Ze 17 pacientů, u nichž došlo v letech 2003–2005 k manifestaci infekce tepenné rekonstrukce, bylo ve sledovaném období primárně operováno 6 (4 bifurkační cévní náhrady – z toho 1x na jiném pracovišti, 2x femoro-popliteální bypass). Ostatní rekonstrukce byly provedeny před sledovaným obdobím. Tomu odpovídá, při celkovém počtu 577 provedených primárních tepenných rekonstrukcí v dané oblasti, incidence infekce 0,86 %.
DISKUSE
V letech 2003 až 2005 bylo na naší klinice provedeno 577 primárních tepenných rekonstrukcí. Stent-graft při aneuryzmatu břišní aorty byl implantován 4x, bez infekčních komplikací. Ducasse [5] uvádí riziko 0,43 %, nejčastěji St. aureus. Roboticky asistovaný výkon nebyl ve sledovaném období proveden. S těmito operacemi začíná naše pracoviště v druhé polovině roku 2006. Dosud bylo provedeno 13 implantací v aorto-femorální oblasti [6]. Infekce nebyla zatím zaznamenána.
Během sledovaných 3 let jsme operovali pro manifestaci infekce cévní rekonstrukce 17 pacientů. Jedná se o polymorbidní pacienty. Převažují muži (88,2 %). U 4 z pacientů byl v době primární rekonstrukce přítomen defekt dolní končetiny (3x řešeno jednostrannou aortofemorální či ilickofemorální protézou). Prager [10] uvádí 149 pacientů s implantovanou aorto-femorální protézou, u 7 z nich (18 %) byla přítomna gangréna končetiny při implantaci, infekce postihla 6 pacientů (4 %), z nichž žádný gangrénu neměl. U 2 pacientů byl přítomen chronický infekt v organismu, u 3 byl anamnestický údaj o imunodeficitu. Ze souboru 17 pacientů bylo na našem pracovišti implantováno 10 aorto-femorálních a 4 femoro-popliteální rekonstrukce, zbylí 3 pacienti byli primárně operováni na jiném pracovišti (vždy pro Lerichův syndrom). 11 operací proběhlo před rokem 2003.
Při primární tepenné operaci nebylo makroskopicky přítomno infekční aneuryzma či aortitida, ačkoliv rutinní stěry prováděny nejsou. Podle Changa [2] není v 8 % operací z různých příčin podána antibiotická profylaxe. Všem pacientům v našem souboru bylo antibiotikum podáno. Jedenáct ze 17 pacientů (64,7 %) podstoupilo vícenásobnou cévní operaci.
K manifestaci infekce dochází v našem souboru nejčastěji mezi 1–3 měsíci (rozsah 8 dní až 15 let), což odpovídá literatuře (Reid [11] 2,5 měsíce až více než 20 let, Gabriel [7] 1 měsíc až 18 let). Infekce se nejčastěji manifestuje purulentní sekrecí v třísle (v našem případě 12 pacientů), 3x uzávěrem rekonstrukce, 1x krvácením do GIT [8, 9].
V diagnostice byly použity běžně dostupné laboratorní a zobrazovací metody, včetně urgentní endoskopie v 1 případě aortoduodenální píštěle [9]. Univerzální metodou je sonografie. Zvláštní postavení má angiografie, sloužící spíše než k diagnostice k plánování další terapie. K ověření diagnózy lze využít vyšetření PET-CT (pozitronová emisní tomografie v kombinaci s CT). Tuto metodu využíváme od roku 2006 [14].
Původce infekce nebyl v 29,4 % vykultivován (Reid uvádí sterilní kultivace až v 50 % případů, Seeger v 23 %) [11, 12]. Nejčastěji byl zjištěn Staphylococcus aureus (8 ze 17 pacientů). Calligaro [1] uvádí ve stěru Staphylococcus aureus u 5 pacientů z 9 v aorto-femorální oblasti, z toho 4x MRSA (Methicilin rezistentní Staphylococcus aureus). V naší sestavě nebyl MRSA nalezen (v souladu s odlišnou mikrobiologickou situací střední Evropy a USA). Reid [11] uvádí jako nejčastější původce infekce stafylokoka koaguláza-negativního.
Operační řešení vychází ze snahy o zachování štěpu [1, 13]. Nejdříve byla u 10 pacientů provedena drenáž infekce v třísle. Po interní přípravě pacienta bylo možno provést radikální výkon s explantací infikované rekonstrukce a podle prokrvení končetin provést současně či později extra-anatomickou rekonstrukci (axillo-femorální a/nebo cross-over bypass). V 1 případě došlo ke zhojení po intenzivní laváži třísla (podobný výsledek udává Calligaro [1] – 4 z 9 pacientů v těžkém stavu, neschopných operace). Extra-anatomická rekonstrukce byla v našem případě 2x komplikována infekcí. Její původce byl shodný s primární infekcí.
U 1 pacientky po explantaci femoro-popliteálního bypassu pletenou protézou byla s odstupem 5 měsíců provedena náhrada protézou PTFE (vzhledem ke špatnému výtoku na bérci dostala tato protéza přednost před stříbrnou protézou). Pacientka je dosud bez rekurence infekce.
Connoly [4] připomíná možnost terapie infekce v aorto-ilické oblasti pomocí endarterektomie. Po 10 letech uvádí průchodnost 89,2 %, zatímco po implantaci bifurkační protézy 78 %. U aorto-ilické endarterektomie uvádí 0% riziko infekce a 0% operační mortalitu.
V řešení infekce se dále nabízí čerstvý nebo zmrazený tepenný allograft. V našem souboru nebyl použit. Jeho možnosti jsou však slibné. Např. Gabriel [7] uvádí 44x použití zmrazeného alloštěpu, 0 % rekurence infekce, zatímco u extra-anatomické rekonstrukce je rekurence 36,8 %. U našich pacientů došlo k infekci extra-anatomické rekonstrukce ve 25 %. Rekonstrukce neo-aorto-ilické, jak doporučuje např. Clagett [3], zatím na pracovišti neprovádíme.
Primární a sekundární průchodnost extra-anatomické rekonstrukce za 1 rok představuje 62,5 a 75 %. Gabriel [7] uvádí tříletou primární a sekundární průchodnost u extra-anatomických rekonstrukcí 31,6 a 52,6 %, u zmraženého alloštěpu 63,6 a 81,8 %.
Mortalita 1 rok po manifestaci infekce dosahuje 17,6 %. Seeger [12] uvádí 9/53, tj. 17 %, podle Gabriela [7] tříletá mortalita 8/63, tedy 12,6 %. Četnost amputace dosahovala 35,3 % (Seeger [12] uvádí zachování končetiny po aorto-femorální infekci 74 %). Incidence infekce v našem souboru představuje 0,86 % (5 z 577 pacientů). Pro srovnání např. Chang [2] udává incidenci 2,6 % (9 z 335 pacientů).
ZÁVĚR
Řešení infekce tepenných rekonstrukcí představuje náročný diagnostický i terapeutický úkol. Stále existují rezervy v oblasti profylaxe a časné diagnostiky. Péči o tyto pacienty je nutno svěřit specializovaným centrům cévní chirurgie.
MUDr. M. Krejčí
II. chirurgická klinika LFMUFN u sv. Anny
Pekařská 53
656 91 Brno
e-mail: miroslav.krejci@fnusa.cz
Zdroje
1. Calligaro, K. D., Veith, F. J., Yuan, J. G., et al. Intra-abdominal aortic graft infection: complete or partial graft preservation in patients at very high risk. J. Vasc. Surg., 2003, roč. 38, č. 6, s. 1199–1205.
2. Chang, J. K., Calligaro, K. D., Ryan, S., et al. Risk Factors Associated with Infection of Lower Extremity Revascularization: Analysis Of 365 Procedures Performed at a Teaching Hospital. Ann. Vasc. Surg., 2003, roč. 17, č. 1, s. 91–96.
3. Clagett, G. P., Bowers, B. L., Lopez-Viego, M. A., et al. Creation of a neo-aortoiliac system from lower extremity deep and superficial veins. Ann. Surg, 1993; roč. 218, s. 239–249.
4. Connoly, J. E., Price, T. Aortoiliac Endarterectomy: A Lost Art? Ann. Vasc. Surg., 2006, roč. 20, č. 1, s. 56–62.
5. Ducasse, E., Calisti, A., Speziale, F., et al. Aortoiliac Stent Graft Infection: Current Problems and Management. Ann. Vasc. Surg., 2004, roč. 18, č. 5, s. 521–526.
6. Dvořák, M., Jeřábek, J., Vlachovský, R., et al. Roboticky asistované laparoskopické cévní rekonstrukce – naše první zkušenosti. In: II. sjezd České společnosti kardiovaskulární chirurgie. Sborník abstrakt s programem. Brno, 2006.
7. Gabriel, M., Pukacki, F., Checinski, P., et al. Current options in prosthetic vascular graft infection: comparative analysis of 63 consecutive cases. Langenbecks Arch. Surg., 2004, roč. 389, s. 272–277.
8. Müller, B. T., Abbara, S., Hennes, N., Sandmann, W. Diagnostik und Therapie von sekundären aortointestinalen Fisteln Ergebnisse von 16 Patienten. Chirurg, 1999, roč. 70, č. 4, s. 415–421.
9. Podlaha, J., Leypold, J. Aorto-enterická píštěl. Rozhl. Chir., 2004, roč. 83, č. 10, s. 506–508.
10. Prager, M. R., Hoblaj, T., Nanobashvili, J., et al. Collagen - versus gelatine-coated Dacron versus stretch PTFE bifurcation grafts for aortoiliac occlusive disease: Long-term results of a prospective, randomized multicenter trial. Surgery, roč. 134, č. 1, s. 80–85.
11. Reid, J. D., MacDonald, P. S. Removing the infected aortofemoral graft using a two-stage procedure with a delay between the stages. Ann. Vasc. Surg., 2005, roč. 19, č. 6, s. 862–867.
12. Seeger, J. M., Back, M. R., Albright, J. L., et al. Influence of Patient Characteristics and Treatment Options on Outcome of Patients with Prosthetic Aortic Graft Infection. Ann. Vasc. Surg., 1999, roč. 13, č. 4, s. 413–420.
13. Seeger, J. M., Pretus, H. A., Welborn, M. B., et al. Long-term outcome after treatment of aortic graft infection with staged extra-anatomic bypass grafting and aortic graft removal. J. Vasc. Surg., 2000, roč. 32, č. 3, s. 451–459.
14. Štádler, P., Bělohlávek, O., Špaček, M., Michálek, P. Diagnosis of vascular prosthesis infection with FDG-PET/CT. J. Vasc. Surg., 2004 , roč. 40, č. 6, s. 1246–1247.
15. Szilagyi, E. D., Smith, R. F., Elliott, J. P., Vrandecic, M. P. Infection in Arterial Reconstruction with Synthetic Grafts. Ann. Surg., 1972, roč. 176, č. 3, s. 321–332.
16. Theis, F. J., Ferdinand, T., Hissen, W. Gefässersatz bei infiziertem aortobifemoralen Bypass – Composite-graft-Bypass aus v. saphena magna und kurzer Rifampicin-getrankter kollagen-beschichteter Y-Prothese. Gefasschirurgie, 2001, č. 1, s. 38–42.
Štítky
Chirurgie všeobecná Ortopedie Urgentní medicína
Článek vyšel v časopiseRozhledy v chirurgii
Nejčtenější tento týden
2007 Číslo 12- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
- Nejlepší kůže je zdravá kůže: 3 úrovně ochrany v moderní péči o stomii
- Stillova choroba: vzácné a závažné systémové onemocnění
- Metamizol v léčbě různých bolestivých stavů – kazuistiky
-
Všechny články tohoto čísla
- Infekce v rekonstrukční cévní chirurgii
- Z akcí výboru ČCHS pro rok 2008
- Léčba hepatocelulárního karcinomu a současný stav v České republice
- Z akcí výboru ČCHS pro rok 2008
- Maligní somatostatinom (stručný přehled a kazuistika)
- Z akcí výboru ČCHS pro rok 2008
- Život ohrožující krvácení – Doporučený postup Konsenzuální stanovisko
- Z akcí výboru ČCHS pro rok 2008
- Nejčastěji se vyskytující neuroendokrinní nádor trávicího ústrojí – karcinoid
- Z akcí výboru ČCHS pro rok 2008
- ACE operace pro dlouhodobou obstipaci u dospělého
- Zápis z jednání schůze výboru ČCHS dne 11. 10. 2007
- Hemipelvektomie, konstantní chirurgické dilema
- Zápis z jednání schůze výboru ČCHS dne 11. 10. 2007
- Ruptury aneuryzmatu abdominální aorty u nemocných vysokého věku – závažnost Hardmanova indexu
- Zápis z jednání schůze výboru ČCHS dne 11. 10. 2007
- Současné možnosti ošetření osteoporotických fraktur torakolumbální páteře
- Zpráva
- Ocenění předávané při příležitosti jednání Valné hromady ČCHS dne 22. 11. 2007
- Longova metoda operace hemoroidů a prolapsu sliznice anorekta (PPH) – zkušenosti 8 let
- Seznam krajských konzultantů schválený výborem ČCHS dne 11. 10. 2007
- Diskusní příspěvek k článku
- Diskusní příspěvek k článku
- Zomrel profesor MUDr. Ivan Šimkovic, DrSc.
- Rozhledy v chirurgii
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Longova metoda operace hemoroidů a prolapsu sliznice anorekta (PPH) – zkušenosti 8 let
- Nejčastěji se vyskytující neuroendokrinní nádor trávicího ústrojí – karcinoid
- Maligní somatostatinom (stručný přehled a kazuistika)
- Současné možnosti ošetření osteoporotických fraktur torakolumbální páteře
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



