-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Biologická léčba v onkologii (I)
Biological therapy in oncology (I)
The incidence of cancer increased substantially during the 20th century. Cancer is the second leading cause of mortality in developed countries. Partially effective therapeutic approaches and medicamentous treatments:
– irradiation,
– chemotherapy, and
– later biological therapy
were developed in the second half of the last century to help combat this cancer epidemic. We review the efficacy of biological therapy based on cell-mediated immunity (BCG vaccination, cancer vaccination, adoptive immunotherapy).
The aim of biological therapy is to optimally target the tumorigenesis process and to reverse it with minimal side effects.Key words:
biological treatment, bacterial adjuvants, cancer vaccination, adoptive immunotherapy.
Autoři: P. Králíčková; J. Krejsek; I. Krčmová
Působiště autorů: ÚSTAV KLINICKÉ IMUNOLOGIE A ALERGOLOGIE ; Fakultní nemocnice Hradec Králové
Vyšlo v časopise: Prakt. Lék. 2011; 91(4): 189-192
Kategorie: Přehledy
Souhrn
Dvacáté století zaznamenalo prudký vzestup výskytu zhoubných nádorů, které se staly druhou nejčastější příčinou úmrtí ve vyspělých zemích. Teprve v druhé polovině minulého století došlo vzhledem k této epidemii k rozvoji částečně účinné medikamentózní léčby (chemoterapii a později i biologické léčby).
Článek dává přehled biologické léčby v onkologii založené na buněčně zprostředkovaných mechanismech:
– bakteriální adjuvans,
– vakcinace,
– adoptivní imunoterapie.
Cílem biologické léčby je optimálně cíleně zasáhnout do procesu tumorigeneze a zvrátit tento proces při současně minimálních nežádoucích vlivech na organismus.Klíčová slova:
biologická léčba, bakteriální adjuvans, nádorová vakcinace, adoptivní imunoterapie.Úvod
Dvacáté století zaznamenalo prudký vzestup výskytu zhoubných nádorů, které se staly druhou nejčastější příčinou úmrtí ve vyspělých zemích. Zatímco v druhé polovině minulého století v medikamentózní léčbě dominovala chemoterapie, v posledních letech se k ní přidala i mílovými kroky se rozvíjející biologická léčba. Cílem biologické léčby je optimálně cíleně zasáhnout do procesu tumorigeneze a zvrátit tento proces při současně minimálních nežádoucích vlivech na organismus. Proti záření a chemoterapii má biologická léčba terapie i další přednost, je schopna ničit nádorové buňky vysoce selektivně a obvykle nezávisle na jejich generačním cyklu.
Z těchto důvodů si je nezbytné připomenout několik zásadních skutečností, které popisují přirozenou odpověď organismu na vznik nádorových buněk.
Imunitní reakci na nádorové buňky je nutné považovat za poslední obrannou bariéru, kterou organismus staví vůči nádorovému bujení. Eukaryotické buňky mají mnoho možností, jak genetickou poruchu (ať již aktivaci onkogenů či inhibici antionkogenů) identifikovat a opravit ještě na úrovni DNA. Došlo-li však i přes tyto opravné mechanismy k maligní transformaci buňky, musí imunitní systém efektivně reagovat s cílem je eliminovat.
Imunitní odpověď organismu na nádorové buňky ideálně probíhá v analogii zánětové reakce. Nádorové buňky však vykazují řadu únikových mechanismů, které významnou měrou znevýhodňují organismus při eliminaci nádorových elementů (10, 14).
Buněčný substrát protinádorové odpovědi
NK buňky (přirození zabíječi):
NK buňky rozpoznávají a zabíjejí buňky, které nenesou v dostatečné denzitě na svém povrchu molekuly HLA I. třídy (8, 10).
T-lymfocyty:
Epitopy vytvořené s TAA (s nádorem asociované antigeny) jsou prezentovány společně s molekulami HLA I. třídy nádorových buněk a jsou rozpoznávány nádorově specifickými cytotoxickými CD8+ T-lymfocyty. Problémem je, že většina TAA jsou přirozené autoantigeny (8).
T-regulační lymfocyty (TREGS):
Regulační T-lymfocyty jsou nástrojem v indukci a udržení periferní tolerance. Většina T-regulačních lymfocytů je specifická pro některý z autoantigenů. S ohledem na fakt, že většina TAA jsou zároveň i autoantigeny, pak je jejich činnost v nádorovém prostředí podporována (9). Ve vztahu počtu T-regulačních lymfocytů a nádorového onemocnění bylo zjištěno, že jejich vyšší zastoupení v oblasti nádorového mikroprostředí představuje negativní prognostický marker (20).
Th-17 lymfocyty:
Th17 lymfocyty produkují skupinu cytokinů (IL-17, 21, 22) hrajících klíčovou úlohu při chemoatarakci neutrofilů. Jejich přítomnost je podporována působením IL-23 (hlavním zdrojem jsou antigen prezentující buňky), IL-6 a TGF-β (produkován zejména naivními CD4+ lymfocyty). Tyto pak působí přes RORγγT a následně přes STAT3.
Ve vztahu k T-regulačním (Foxp3+) lymfocytům jsou pravděpodobně udržovány v rovnováze (28). V časovém průběhu zánětu hrají Th17 lymfocyty úlohu zejména v úvodu, kdy výrazně stoupne jejich množství, následuje pokles asi během jednoho týdne s dominantní produkcí IFN gamma (Th1 lymfocyty). T-regulační lymfocyty pak následně hrají úlohu zejména při reparační fázi (15).
Th17 lymfocyty fyziologicky hrají důležitou úlohu při plísňových infekcích a infekcích vyvolaných extracelulárními patogeny (22). V oblasti primárních imunodeficitů byla nalezena příčinná souvislost mezi deficiencí Th17 lymfocytů a hyper IgE sydromem (geneticky dominantně negativní mutace pro STAT3) (18). Naopak jejich nadměrná aktivita souvisí s některými autoimunitními onemocněními:
- roztroušená skleróza mozkomíšní,
- revmatoidní artritida,
- Crohnova choroba,
- psoriáza (13).
Jejich úloha při nádorových onemocnění není dostatečně objasněna. Na rozdíl od T-regulačních lymfocytů nebyly zaznamenány v nádorových spádových uzlinách. Není zcela jasné, zda Th-17 lymfocyty vytvářejí chronické prozánětlivé podmínky, které napomáhají nádorovému růstu. Pravdou je, že byla nalezena v nádorovém mikroprostředí zvýšená produkce IL-23, klíčového mediátoru pro Th17 buněčnou populaci (29).
Nádorové stroma:
Nádorové stroma obsahuje různé nemaligní buňky:
- makrofágy - TAM (tumor-associated macrophages),
- granulocyty,
- nezralé dendritické buňky,
- plazmocytoidní dendritické buňky,
- endoteliální buňky,
- fibroblasty (8, 10).
S nádorem asociované makrofágy (TAM):
mají řadu schopností, kterými podporují růst vlastního nádoru (exprese růstových faktorů, matrixových proteáz – MMP2 a MMP9). Z nich vyplývá podpora angiogeneze a suprese adaptivní imunity. TAM jsou odvozené od monocytoidních prekurzorů cirkulujících v periferní krvi. Klíčem k jejich akumulaci je chemoatraktant CCL2. Po vzoru Th1/Th2 lymfocytů lze obdobně dělit i makrofágy na M1 a M2 typ.
M1 makrofágy jsou indukovány IFNγ, mikrobiálními stimuly (lipopolysacharidy) či cytokiny TNF αa GM-CSF. Funkčně mají vysokou schopnost prezentovat antigeny, produkují IL-12 a IL-23. Mají toxickou schopnost vůči nádorovým buňkám či buňkám, které pohltily intracelulární parazitický mikroorganismus pomocí uvolnění vysokého množství toxických metabolitů:
- NO, reaktivních kyslíkových radikálů,
- TNFα.
Na druhé straně M2 makrofágy mají funkčně jen nízkou schopnost prezentovat antigeny. Suprimují zánětlivou odpověď Th1 lymfocytů, podporují hojení ran, angiogenezi a tkáňovou remodelaci. Polarizaci ve směru M2 zajišťují v nádorovém mikroprostředí
- M-CSF,
- PGE2,
- TGFβ,
- IL-6,
- IL-10 (8).
Řada produktů makrofágů, které jsou uvolňovány do nádorového stromatu přímo stimuluje růst nádorových buněk, a/nebo podporuje migraci nádorových buněk a tvorbu metastáz (23) ( obr. 1).
Obr. 1. Vzájemný vztah nádoru a s nádorem asociovaných makrofágů (TAM) 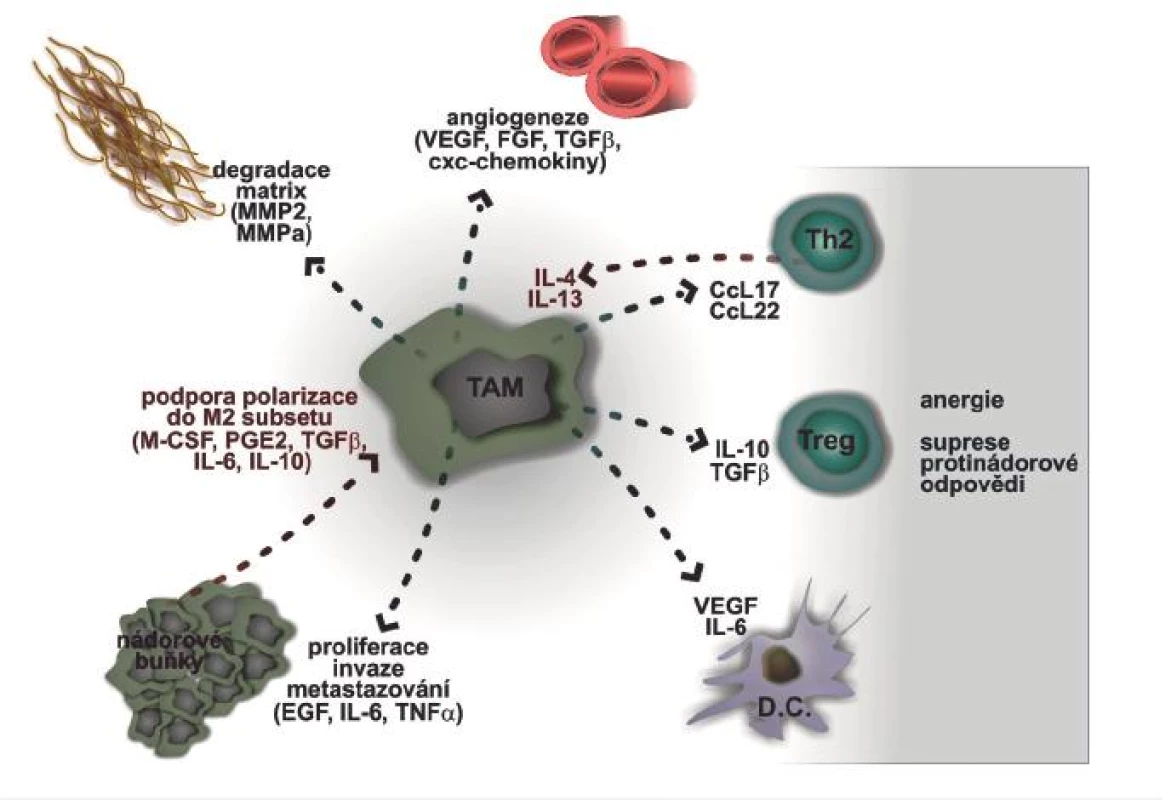
Biologická léčba nádorů
Základními postupy v léčbě nádorových onemocnění zůstávají:
- chirurgické řešení,
- chemoterapie, a
- radioterapie.
V posledních letech se stále více do popředí dostává biologická léčba, a to nejen na poli pokusů in vitro či in vivo, ale u řady nádorových chorob již jako běžný léčebný standard. Je podávána v monoterapii či v kombinaci zejména s chemoterapií. Posiluje či podporuje přirozenou protinádorovou obranu organismu.
V následující části se budeme věnovat biologické léčbě založené na buněčně zprostředkovaných mechanismech.
Bakteriální adjuvans
Lokálně je využíván kmen BCG (Bacillus Calmet-Guerin), instilovaný do močového měchýře při léčbě jeho karcinomu (u pacientů ve vysokém riziku), a to buď v monoterapii, či v kombinaci s chemoterapií (6). V rámci klinických studií pak byla použita vakcinace pomocí kmene Mycobacteriumvaccae (kmene, který byl izolován v Ugandě a již byl zkoušen v klinických zkouškách v léčbě lepry a TBC). Je vysoce pravděpodobné, že tento léčebný postup selektivně zvyšuje Th1 odpověď a naopak snižuje Th2 odpověď (26).
Nádorové vakcíny
Vakcinaci v případě nádorových onemocnění lze rozdělit na
- preventivní, a
- léčebnou.
Z preventivních se v současné klinické praxi používají:
- očkování proti hepatitidě B (prevence hepatocelulárního karcinomu),
- očkování proti papilomavirům (prevence karcinomu děložního čípku a laryngeální papilomatózy).
Na dalších vakcínách se intenzivně pracuje, například proti HIV či Helicobacterupylori (16).
Principem léčebného působení nádorových vakcín obecně je zlepšení antigenní prezentace nádorových buněk. Při výrobě protinádorové vakcíny hrají zásadní úlohu:
- výběr vhodných antigenů,
- použití správného adjuvans, a
- zajištění trvale účinné odpovědi (25).
Rozeznáváme:
- celobuněčné vakcíny –
alogenní, četněji autologní.
Jejich problémem je nízká imunogenicita. Často je totiž přítomna rozdílná antigenní výbava u metastáz a u mateřského tumoru. Nejčastěji jsou používány ozářené nádorové buňky, které tak ztratily schopnost se dělit a následně byly modifikovány, aby získaly co možná největší antigenní potenciál. In vitro je lze i kultivovat s T-lymfocyty pacienta, tím se stimulují nádorově specifické klony, které po vrácení do organismu napadají původní nemodifikované nádorové buňky. Dále mohou být reinfundovány současně s dalšími buňkami např. buněčného stromatu – fibroblasty. Tento postup zajišťuje prodlouženou lokální produkci cytokinů. - peptidové vakcíny (odvozené z nádorových buněk, MHC komplexy odvozené od nádorových lyzátů);
- proteinové vakcíny (epitopy bez MHC restrikce);
- geneticky připravené vakcíny:
v současné době představují hlavní výzkumný směr s použitím plazmidové DNA – tzv. minimální vektory nukleových kyselin MNAV (27). Určité geny mohou být dopraveny do plazmidů, zakódovány společně s virovým vektorem jako promotorem (CMV či Rous sarcoma virus).
Plazmidy jsou odvozeny od bakteriální DNA. Proto obsahují velké množství nemetylovaných CpG úseků, což má za následek zesílení prozánětlivých vlastností. K prodloužení životaschopnosti dendritických buněk v kůži jsou současně přidávány i úseky DNA kódující anti-apoptotické proteiny (11).
Specifickým problémem DNA vakcín může být inkorporace virového genomu do lidského s eventuální další potencí maligní transformace. Tento problém snad vyřeší použití messengerové RNA.
Do organismu jsou vakcíny dopravovány pomocí genové pistole. MNAV jsou precipitovány na mikročástice zlata, do kůže jsou dopraveny výstřelem za pomocí natlakovaného helia. Některé částice přímo zasáhnou antigen prezentující buňky. Pomocí nich jsou pak prezentovány a spustí následně další imunitní děje (11) (obr. 2). - VLP vakcíny (virus-like
particles)
jsou další možností použití částic odvozených od virů, které způsobují maligní transformaci buňky. Jsou neinfekční, nereplikují se, jsou obdobné velikosti, morfologie jako jim odpovídající viry, avšak chybí jim genomický materiál (14, 25). - vakcinace dendritickými buňkami:
myeloidní dendritické buňky, monocyty jsou nejčastěji izolovány z periferní krve aferézou. Diferenciace DC z monocytů je dosaženo kultivací ve speciálních médiích (obsahující např. GM-CSF, IL-4). Takto jsou získávány nezralé DC. Ke zvýšení jejich imunogenicity jsou pak stimulovány pomocí TNFα, CD40L, prostaglandinů. Tyto signály pak indukují expresi CD80, CD86, CD83 a sekreci prozánětlivých cytokinů. Poté následuje dopravení nádorových antigenů do DC (2, 7) (obr. 3).
Obr. 2. Heliová genová pistole 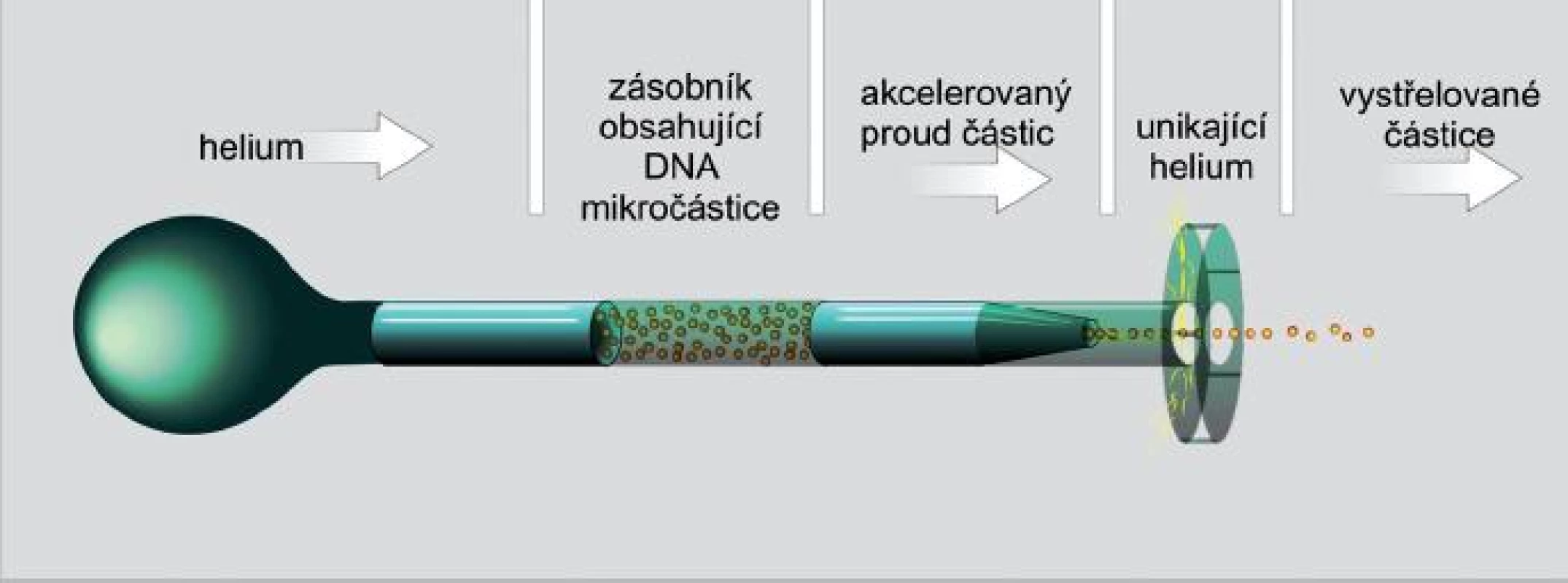
Obr. 3. Schéma přípravy vakcinace dendritickými buňkami stimulovaných autologními apoptotickými nádorovými buňkami 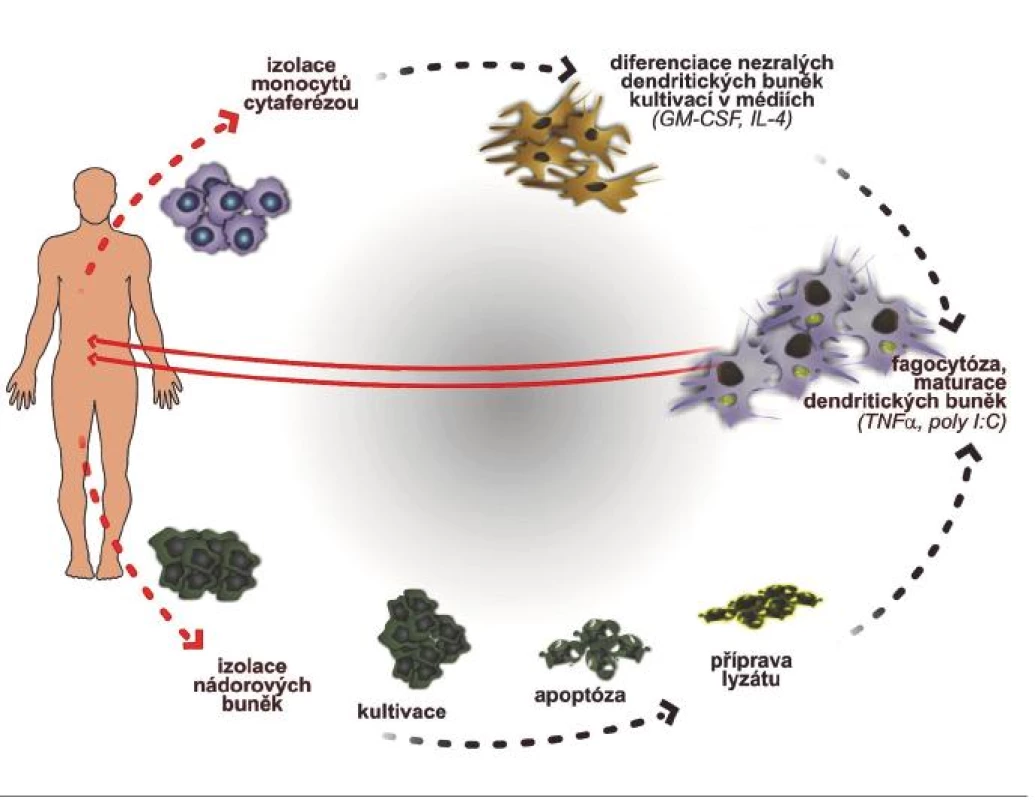
Klinické zkoušky probíhají např. rámci léčby:
- maligního melanomu,
- karcinomu prostaty (12, 24),
- renálního karcinomu (3, 21),
- rakoviny prsu,
- mnohočetného myelomu,
- leukémií, kolorektálního karcinomu či gliomů (25),
- karcinomu děložního čípku (4).
Do studií jsou bohužel z etických důvodů obvykle zařazováni pacienti s pokročilými stádii onemocnění, což jednoznačně omezuje jejich efektivnost. Z teoretických předpokladů vyplývá jejich potenciál zejména při minimální reziduální chorobě (1, 17).
Adjuvans nádorových vakcín
Adjuvans aktivuje antigen-prezentující buňky k účinné buněčné odpovědi, zejména založené na T-lymfocytech. V současné době jsou ve světě v rámci rutinní vakcinace používány pouze dvě adjuvans:
- od AlOH3 odvozené soli, a
- MF56 – squalen-olejovo-vodní emulze.
Pracuje se na řadě dalších molekul. Na poli nádorových vakcín se v experimentech užívá nejčetněji virová adjuvans – vaccinia, Newcastle disease virus, modifikovaný kmen vaccinia – Ankara MVA, ptačí poxviry, alphavirus (11, 27).
Adoptivní imunoterapie
Podstatou adoptivní imunoterapie je reinfúze lymfocytů, které předcházela jejich kultivace se směsí cytokinů. Pokusy s tzv. LAK buňkami však v minulých letech nevykazovaly významnější úspěchy (5). V klinické praxi je tento princip užíván při léčbě relapsu po alogenních transplantacích kostní dřeně za použití infuze dárcovských lymfocytů (10).
Závěr
Tumorigeneze je postupný proces, ve kterém sehrává úlohu velká řada faktorů. Ty pak ovlivňuji imunitní systém člověka, jednak směrem podporujícím nádorové bujení a jednak ve smyslu protinádorového působení. Ve výsledku pak záleží na tom, které síly převáží.
Z výše uvedených patofyziologických mechanismů vyplývá jednoznačná výzva co možná nejlépe porozumět těmto mechanismům, zjistit, jak do těchto pochodů zasahují chemo - či imunoterapeutika. Následně pak musíme najít optimální načasování jejich podání, velikost dávky i vzájemnou kombinaci tak, aby imunitní pochody byly opětovně směrovány protinádorovým směrem s cílem nejen zcela eliminovat nádorové buňky, ale zabránit i následné recidivě.
MUDr. Pavlína Králíčková
Ústav klinické imunologie a alergologie
Fakultní nemocnice
Sokolská tř. 581
500 05 Hradec Králové
E-mail: kralickova.pavlina@fnhk.cz
Zdroje
1. Aarntzen, E.H., Fidor, C.G., Adema, G.J. et al. Dendritic cell vaccination and immune monitoring. Cancer Immunol. Immunother. 2008, 57 (15), p. 1559-1568.
2. Ballestrero, A., Boy, D., Moran, E. et al. Immunotherapy with dendritic cells for cancer. Adv. Drug. Deliv. Rev. 2008, 60 (2), p. 173-183.
3. Berntsen, A., Geertsen, P.F., Svane, I.M. Therapeutic dendritic cell vaccination of patients with renal cell carcinoma. Eur. Urol. 2006, 50, p. 34-43.
4. Bubeník, J., Mikyšková, R., Vonka, V. et al. Interleukin-2 and dendritic cells as adjuvans for surgical therapy of tumours associated with human papillomavirus type 16. Vaccine 2003, 21(9-10), p. 891-896.
5. Escudier, B., Farace, F., Angevin, E. et al. Immunotherapy with IL-2 and lymphokine-activated natural killer cells: Improvement of clinical responses in metastatic renal cell carcinoma patients previously treated with IL-2. Eur. J. Cancer 1994, 30(8), p. 1078-1083.
6. Grange, J.M., Bottaso, O., Stanford, C.A., Stanford, J.L. The use of mycobacterial adjuvants-based agents for immunotherapy of cancer. Vaccine 2008, 26(39), p. 4984-4990.
7. Gregoire, M., Ligeza-Poisson, C., Juge-Morineau, N., Spisek, R. Anti-cancer therapy using dendritic cells and apoptotic tumour cells: pre-clinical data in human mesothelioma and acute myloid leukemia. Vaccine 2003, 21(7-8), p. 791-794.
8. Gross, S., Walden, P. Immunosuppressive mechanisms in human tumors: Why we still cannot cure cancer. Immunol. Lett. 2008, 116(1), p. 7-14.
9. Guiducci, A.P., Vicari, S., Sangaletti, R., et al. Redirecting in vivo elicited tumor infiltrating macrophages and DC towards tumor rejection. Cancer Res. 2005, 65, p. 3437-3446.
10. Hořejší, V., Bartůňková, J. Základy imunologie. 3. vydání, Praha: Triton, 2005, s. 40, 106-118, 128-144, 174-182.
11. Huang, B., Mao, C.H.P., Peng, S. et al. Intradermal administration of DNA vaccines combining a strategy to bypass antigen processing with a strategy to prolong dendritic cell survival enhances DNA vaccine potency. Vaccine 2007, 25(45), p. 7824-7831.
12. Kiessling, A., Fuessel, S. Advances in specific immunotherapy for prostate cancer. Eur. Urol. 2008, 53(4), p. 694-708.
13. Kikly, K., Liu, L., Na, S., Sedgwick, J. D. The IL-23/Th17 axis: therapeutic targets for autoimmune inflammation. Curr. Opin. Immunol. 2006, 18(6), p. 670-75.
14. Krejsek, J., Kopecký, O. Klinická imunologie. 1.vydání, Hradec Králové: Nucleus, 2004, s. 105-109, 197-209, 226-227, 541-566, 802-804 .
15. Lohr, J., Knoechel, B., Caretto, D. et al. Balance of Th1 and Th17 effector and peripheral regulatory T cells. Microb. Infect. 2009, 11, p. 589-593.
16. deMartel, C., Franceschi, S. Infections and cancer: established associations and new hypotheses. Crit. Rev. Oncol. Hematol. 2009, 70(3), p. 183-194.
17. Nencoini, A., Grunebach, F., Schmidt, S.M. et al. The use of dendritic cells in cancer immunotherapy. Crit. Rev. Oncol. Hematol. 2008, 65(3), p. 191-199.
18. Ochs, H.D., Oukka, M., Torgerson, T.R. et al. Th17 cells and regulatory T cells in primary immunodeficiency diseases. Clin. Rev. Allergy Immunol. 2009, 123(5), p. 977-983.
19. Pejawar-Gaddy, S., Finn, O.J. Cancer vaccines: Accomplishments and challenges. Crit. Rev. Oncol. Hematol. 2008, 67(2), p. 93-102.
20. Perrone, G., Ruffini, P.A., Catalano, V. et al. Intratumoural FOXP3-positive regulatory T cells are associated with adverse prognosis in radically resected gastric cancer. Eur. J. Cancer 2008, 44(13), p. 1875-1882.
21. Prenen, H., Gil, T., Awada, A. New therapeutic developments in renal cell cancer. Crit. Rev. Oncol. Hematol. 2009, 69(1), p. 56-63.
22. Sallusto, F., Lanzavecchia, A. Human Th17 cells in infection and autoimmunity. Microb. Infection 2009, 11, p. 620-624.
23. Sica, A., Allavena, P., Mantovani, A. Cancer related inflammation: The macrophage connection. Cancer Lett. 2008, 267(2), p. 204-215.
24. Suckow, M.A., Wolter, W.R., Sailes, V.T. Inhibition of prostate cancer metastasis by administration od tissue vaccine. Clin. Exp. Metastasis 2008, 25(8), p. 913-918.
25. Toloza, E.M., Tyler, D., Yang, Y. How does the immune system attack cancer? Curr. Probl. Surg. 2004, 41(1), p. 1-132.
26. Urdaneta, G., Solsona, E., Palou, J. Intravesical chemotherapy and BCG for the treatment of bladder cancer: evidence and opinion. Eur. Urol. 2008 (Suppl), p. 542-547.
27. Weide, B., Garbe, C., Rammenseem H.G. et al. Plasmid DNA - and messenger RNA-based anticancer vaccination. Immunol. Lett. 2008, 115(1), p. 33-42.
28. Ziegler, S.F., Bruckner, J.H. FOXP3 and the regulation of Treg/Th17 differentiation. Microb. Infection 2009, 11, p. 594-598.
29. Zhang, B., Rong, G., Wei, H. et al. The prevalence of Th17 cells in patients with gastric cancer. Biochem. Biophys. Res. Commun. 2008, 374(3), p. 533-537.
Štítky
Praktické lékařství pro děti a dorost Praktické lékařství pro dospělé
Článek vyšel v časopisePraktický lékař
Nejčtenější tento týden
2011 Číslo 4- Alergie na antibiotika u žen s infekcemi močových cest − poznatky z průřezové studie z USA
- Není statin jako statin aneb praktický přehled rozdílů jednotlivých molekul
- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Magnosolv a jeho využití v neurologii
- Metamizol jako analgetikum první volby: kdy, pro koho, jak a proč?
-
Všechny články tohoto čísla
-
Základy kognitivní, afektivní a sociální neurovědy
IV. Psychopatie - Biologická léčba v onkologii (I)
- Antihypertenzíva, antibiotiká, analgetiká a iné často používané lieky v tehotenstve
- Logoterapie jako prevence burn-out syndromu pro lékaře
- Profesní rinitida jako nemoc z povolání na jižní Moravě v letech 2003–2006
- Lesk a bída kombinovaného financování zdravotnictví
- Zkušenosti praktických lékařů s činností lékařské posudkové služby
- Pozitivní emoce, smích, laskavost a klinická medicína
- Komerční stanovení rizika nemocí – co se pacient dozví za své peníze?
- Tracheální ruptura po endotracheální intubaci
- Akutní koronární syndrom způsobený embolizací myxomu
- Uskutečněné i neprovedené plány na umístění klinik a ústavů pražské lékařské fakulty
- Profesor MUDr. Rudolf Petr – jeden ze zakladatelů české neurochirurgie
- Validita medicínských informací na internetu – věčně visící Damoklův meč?
- Udílení medailí ČLS JEP
- Konference e-Health Day 2011
- Docent Radim Kočvara šedesátníkem
- Mattoni je přátelská k životnímu prostředí
- Současná problematika tuberkulózy
-
Klener P.
Základy klinické onkologie - Ze života odborných společností ČLS JEP
- JUBILEA
-
XXIII. kongres ČLS JEP s mezinárodní účastí
ZOBRAZOVACÍ METODY V MEDICÍNĚ II
-
Základy kognitivní, afektivní a sociální neurovědy
- Praktický lékař
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Antihypertenzíva, antibiotiká, analgetiká a iné často používané lieky v tehotenstve
- Tracheální ruptura po endotracheální intubaci
- Profesor MUDr. Rudolf Petr – jeden ze zakladatelů české neurochirurgie
-
Základy kognitivní, afektivní a sociální neurovědy
IV. Psychopatie
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



