-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Vybraná onemocnění červené krevní řady
Autoři: J. Starý
Působiště autorů: Klinika dětské hematologie a onkologie, UK 2. LF a FN Motol, Praha
Vyšlo v časopise: Čes-slov Pediat 2011; 66 (1): 42-53.
Kategorie: Vybrané kapitoly z nové učebnice Klinická pediatrie
1.0. ANEMIE – DIFERENCIÁLNÍ DIAGNÓZA
Etiologie anemie se tradičně dělí do dvou kategorií:
- porucha tvorby erytrocytů a
- zvýšený rozpad nebo ztráty červených krvinek.
V jejich rozlišení pomůže znalost počtu retikulocytů, indexů červených krvinek a analýza nátěru periferní krve v mikroskopu. Dolní limity normy hemoglobinu a objemu erytrocytů jsou v tabulce 1. Střední objem erytrocytu (MCV) je nejužitečnějším z indexů erytrocytů. Umožňuje klasifikovat anemie podle velikosti červené krvinky na mikrocytární, normocytární a makrocytární. U dětí mladších 10 let je dolní hranice normy MCV rovna 70 fl + věk v letech. Od 6. měsíce je horním limitem normy hodnota MCV 84 + 0,6 fl/rok, dokud není dosažen horní limit pro dospělé 95 fl. Střední obsah hemoglobinu v erytrocytu (MCH = mean corpuscular hemoglobin) a střední koncentrace hemoglobinu (MCHC = mean corpuscular hemoglobin concentration) jsou dalšími analyzátory krevního obrazu, automaticky počítanými indexy. MCH obvykle sleduje změny v MCV. Vysoká hodnota MCHC >35 g/dl je charakteristická pro hereditární sferocytózu, zatímco snížené hodnoty se spojují s deficitem železa. Šíře distribuce objemu erytrocytů (RDW) odráží rozdílnou velikost červených krvinek a poskytuje tak informaci o anisocytóze. Mikroskopická analýza nátěru periferní krve poskytuje informaci o sníženém množství hemoglobinu v erytrocytu (hypochromie), chybějícím centrálním projasněním erytrocytů u hereditární sferocytózy. Polychromasie je projevem retikulocytózy, bazofilní tečkování erytrocytů je typicky nalézáno u talasémie, hypersegmentované neutrofily jsou charakteristické pro deficit vitaminu B12 a folátů.
Tab. 1. Vývoj hodnot hemoglobinu a objemu erytrocytů od narození do dospělosti. 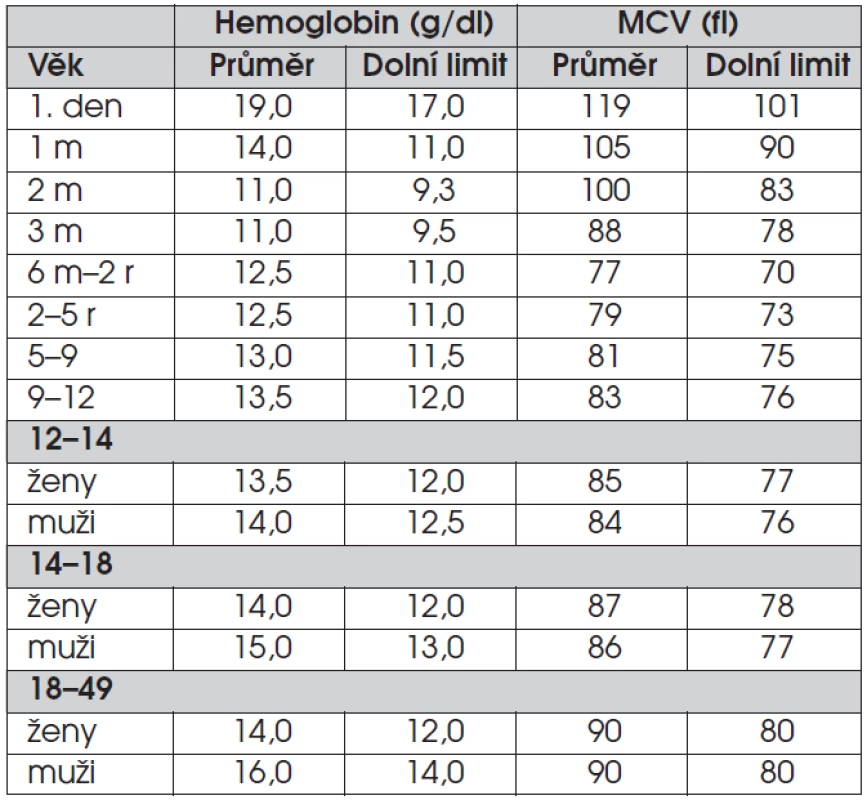
(Převzato z: Dallman PR, J Pediatr 1979; 94: 26; Stockman III JA, Pochedly C, Developmental and Neonatal Hematology, New York: Raven Press, 1988) U kojenců narozených v termínu se sideropenická anemie nemanifestuje před 6. měsícem života. Talasémie beta či srpkovitá anemie se manifestují až kolem šestého měsíce s nárůstem produkce beta globinových řetězců. Naopak alfa talasémie je patrná již při porodu.
1.1. Mikrocytární anemie
Příčinou mikrocytární anemie je v České republice nejčastěji anemie z deficitu železa nebo anemie při zánětu. Alfa talasémie je častá v populaci jihovýchodní Asie, beta talasémie u obyvatel Středomoří, Blízkého východu a jihovýchodní Asie. V české populaci se nachází vzácně heterozygoti beta talasémie. Vzácnými příčinami mikrocytární anemie jsou sideroblastické anemie nebo otrava olovem. Vrchol výskytu sideropenické anemie je v pozdním kojeneckém a batolecím věku jako důsledek rychlého růstu, nízkého příjmu železa v potravě a vyčerpání zásob železa z intrauterinního života. Druhým vrcholem výskytu je období rychlého růstu v pubertě za předpokladu nedostatečného přísunu železa potravou. U děvčat se na vzniku anemie spolupodílí ztráty krve menstruací. V diferenciální diagnóze proti talasémii pomůže typické zvýšení počtu erytrocytů a normální RDW u talasémie a snížení počtu erytrocytů a vysoká RDW u sideropenické anemie. V nátěru periferní krve jsou v obou případech nacházeny malé hypochromní erytrocyty, pro talasémii jsou velmi typické bazofilní tečkování a terčové krvinky. Pro sideropenickou anemii je typická anisocytóza.
Retikulocyty stoupají 3–5 dnů po začátku hemolýzy či krvácení, retikulocytóza vrcholí 7–10 dní od začátku. Normální hodnota retikulocytů je kolem 1 %. Retikulocyty jsou snížené u sideropenické anemie, anemie při zánětu a zvýšené u talasémií.
Feritin je nízký u sideropenické anemie (<10 µl/dl), normální u talasémie a vysoký u anemie při zánětu. Solubilní transferinové receptory (sTFR) jsou zvýšené u anemie z nedostatku železa a talasémie, normální u anemie při zánětu či u nádorového onemocnění.
1.2. Makrocytární anemie
Makrocytární anemie je definována zvýšením MCV o dvě standardní odchylky nad normální hodnotu podle věku. Příčinou zvýšeného MCV může být retikulocytóza, jako je tomu například při hemolytické anemii. Nejčastější příčinou makrocytární anemie je deficit vitaminu B12 a/nebo folátů nebo inefektivní erytropoeza při selhání kostní dřeně (Fanconiho anemie, Diamondova-Blackfanova anemie, myelodysplastický syndrom, získaná aplastická anemie). Deficit folátů nebo vitaminu B12 je doprovázen nálezem hypersegmentovaných polynukleárů (≥5 jaderných segmentů) v nátěru krve. Příčinou deficitu folátů je nesprávná výživa, malabsorpce, zvýšená spotřeba folátů u chronické hemolytické anemie nebo vrozené poruchy metabolismu kyseliny listové či některé léky (metotrexát, fenytoin, cotrimoxazol). Vitamin B12 se nachází v živočišné stravě. K deficitu dochází u veganské diety, malabsorpce, při vrozených poruchách metabolismu. Perniciózní anemie je v dětském věku výjimečná. Vzácně je příčinou makrocytární anemie jaterní onemocnění nebo hypotyreoidismus.
1.3. Normocytární anemie
Je-li v krevním obraze pancytopenie, je nutné aspirací, event. biopsií kostní dřeně vyloučit aplastickou anemii, leukemii, myelodysplastický syndrom (častěji se spojuje s makrocytární anemií), infiltraci kostní dřeně jiným nádorem, osteopetrózu, Gaucherovu nemoc. Příčinou pancytopenie s hypercelulární kostní dření může být hypersplenismus.
Chybí-li pancytopenie a počet retikulocytů je nízký, je často příčinou anemie při zánětu, která může rovněž být mikrocytární. Zvýšený počet retikulocytů je důsledkem krevních ztrát nebo hemolýzy, která může být akutní nebo chronická, vrozená nebo získaná. Extravaskulární hemolýza se odehrává v retikuloendotelovém systému a projevuje se nekonjugovanou hyperbilirubinémií. Intravaskulární hemolýza se spojuje se vzestupem volného hemoglobinu v krvi, poklesem haptoglobinu a hemoglobinurií. Nejčastější vrozenou hemolytickou anemií je ve střední Evropě hereditární sferocytóza s pozitivní rodinnou anamnézou anemie, splenektomie a žlučových kamenů. Jednoduchým diagnostickým nálezem je hodnota MCHC >35,4 při současném nálezu RDW >14. Deficit glukózo-6-fosfát dehydrogenázy (G6PD) je typický pro jedince původem z Afriky nebo Středomoří. Akutní hemolýza je u nich vyvolána infekcí nebo některými léky. Pacienti s vrozenou i získanou hemolytickou anemií jsou ohroženi tranzientní aplastickou krizí při infekci parvovirem B19 a 7–10 dní trvající supresí erytropoezy s retikulocytopenií a anemií.
Získané hemolytické anemie jsou autoimunitní s pozitivním Coombsovým testem nebo sekundární, vyvolané například mechanickým poškozením erytrocytů toxiny nebo fibrinovými sraženinami při DIK, HUS, TTP či kongenitální erytroidní porfyrii. Autoimunitní hemolytická anemie je u dětí ve většině případů spontánně odeznívajícím onemocněním indukovaným virovou infekcí. Mechanické poškození erytrocytů je obvykle intravaskulární spojené s nálezem schistocytů v nátěru krve.
2.0. SIDEROBLASTICKÉ ANEMIE
Sideroblastické anemie tvoří heterogenní skupinu onemocnění charakterizovanou hypochromní mikrocytární, ale i makrocytární chronickou anemií, věnečkovými sideroblasty v kostní dřeni, inefektivní erytropoezou a přetížením železem. Jednotlivé kategorie sideroblastické anemie jsou uvedeny v tabulce 2. Přes významnou klinickou a hematologickou různost sdílí sideroblastické anemie nález věnečkových sideroblastů v kostní dřeni, které jsou projevem hromadění non-feritinového železa v mitochondriích v důsledku selhání tvorby hemu, která v nich probíhá. Věneček granulí železa obkružujících jádro normoblastu při barvení na železo pruskou modří je na obrázku 1. Na anemii vzniklou v důsledku inefektivní hematopoezy reaguje organismus sníženou tvorbou hepcidinu, což má za následek zvýšené vstřebávání železa ze zažívacího traktu a rozvoj přetížení železem.
Tab. 2. Kategorie sideroblastické anemie. 
(Převzato z: Bridges KR. Sideroblastic anaemias. Br J Haematol 2002; 116: 733–743) Obr. 1. Srovnání normálního a věnečkového sideroblastu. 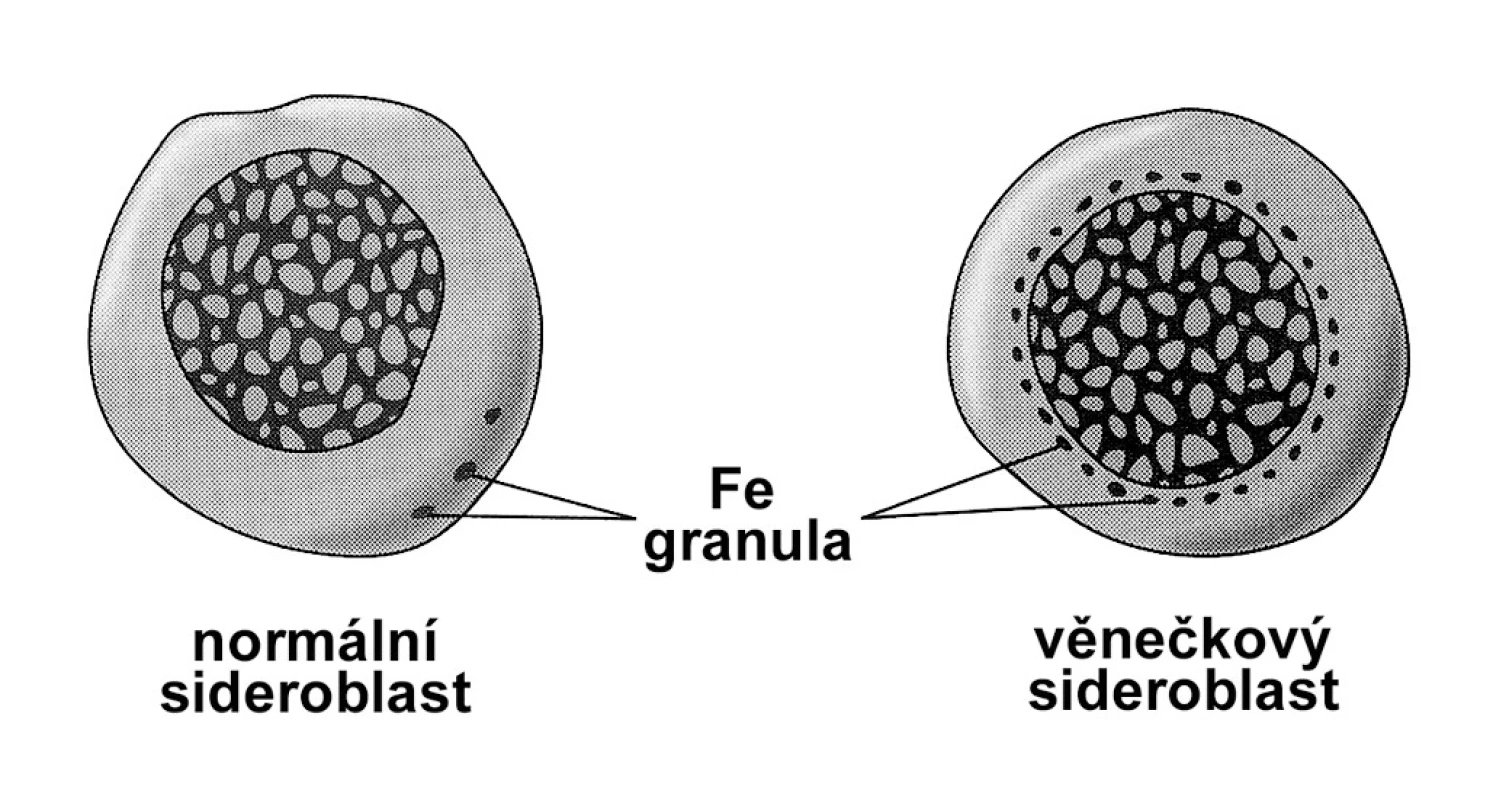
2.1. Vrozené sideroblastické anemie
Jde o vzácné onemocnění, které v 80 % případů postihuje mužské pohlaví. Dominantním typem dědičnosti je gonozomálně recesivní, jsou popsány ale i autozomálně recesivně a dominantně dědičné případy. Anemie je diagnostikována kdykoliv v průběhu dětství, popsány jsou ale i případy diagnostikované v dospělosti. Příčinou hereditární na X-chromozom vázané sideroblastické anemie je mutace genu ALAS2, mající za následek sníženou aktivitu mitochondriálního enzymu 5-aminolevulinát syntázy (ALAS), který je prvním enzymem řetězce syntézy hemu. Substrátem enzymu je glycin a sukcinyl CoA, který je vytvářen v mitochondriích. Důsledkem poruchy syntézy hemu je akumulace železa v mitochondriích. Koenzymem ALAS je pyridoxal-5-fosfát, který je vytvářen z pyridoxinu působením enzymu pyrodoxal kinázy. Zvýšená koncentrace pyridoxal-5-fosfátu normalizuje sníženou aktivitu ALAS a je tak vysvětlením příznivého účinku léčby pyridoxinem u části pacientů. V krvi je přítomna mikrocytární hypochromní anemie, počet retikulocytů je normální nebo snížený. V kostní dřeni je hyperplazie červené řady, která obsahuje při barvení pruskou modří více než 15 % věnečkových sideroblastů s granulemi železa obkružujícími jádro. Hladina sérového železa, sérový feritin a saturace transferinu železem jsou zvýšené.
2.2. Mitochondriální onemocnění
Energetické potřeby organismu jsou zajišťovány syntézou ATP systémem oxidativní fosforylace (OXPHOS) na vnitřní mitochondriální membráně. Mutace mitochondriální DNA vedou k nedostatečné produkci ATP a jsou příčinou mitochondriálních onemocnění, která se manifestují v 80 % případů v prvních 2 letech života. Jejich projevem je nejčastěji encefalomyopatie, jaterní selhání, hypertrofická kardiomyopatie, diabetes mellitus nebo makrocytární anemie. Příčinou vrozené sideroblastické anemie je porucha aktivity cytochrom c oxidázy (COX) – IV. komplexu respiračního řetězce a/nebo delece mitochondriální DNA prokazovaná v prekurzorech kostní dřeně, svalech a kožních fibroblastech, což je dokladem multiorgánového postižení. Nejčastějším mitochondriálním onemocněním s dominující hematologickou symptomatologií je Pearsonův syndrom, který se manifestuje v kojeneckém nebo batolecím věku makrocytární anemií, vyžadující transfuze krve. 60 % dětí má současně poruchu exokrinní funkce pankreatu. Více než 50 % dětí umírá do věku 3 let na multiorgánové selhání. Makrocytární anemie je doprovázena výrazně zvýšeným počtem věnečkových sideroblastů v kostní dřeni, kde je nápadná vakuolizace prekurzorů erytroidní, granulocytární i megakaryocytární řady. Makrocytární anemie se může manifestovat v prvních měsících života a být tak i dlouhou dobu jediným projevem mitochondriálního onemocnění. Výskyt vakuol v krvetvorných prekurzorech je v této situaci vodítkem k určení správné diagnózy.
2.3. Získané sideroblastické anemie
Nejčastější získanou sideroblastickou anemií je refrakterní anemie s věnečkovými sideroblasty (RAS). Jedná se o klonální onemocnění řazené mezi myelodysplastické syndromy. Typicky se vyskytuje u starších lidí a u dětí je zcela výjimečná. Charakterizuje ji makrocytární anemie s přetížením železem a rizikem rozvoje pancytopenie a leukémie. Sideroblastická anemie může komplikovat léčbu isoniazidem nebo chloramfenikolem.
2.4. Terapie
Více než 50 % pacientů s X-chromozom vázanou sideroblastickou anemií reaguje příznivě na léčbu pyridoxinem. Zlepšuje se anemie, mizí potřeba krevních transfuzí. U jiných typů sideroblastické anemie je tato léčba neúčinná. U pacientů je nutné monitorovat stav zásob železa v organismu a včas zahájit chelatační léčbu. Alogenní transplantace kostní dřeně vyléčí nejtěžší formy nemoci.
3.0. HEMOLYTICKÉ ANEMIE
Jedná se o heterogenní skupinu onemocnění. V tabulce 3 jsou rozděleny do dvou velkých skupin. Korpuskulární hemolytické anemie jsou způsobené patologií erytrocytů. Extrakorpuskulární hemolytické anemie jsou způsobené etiologickými faktory, které působí zvenčí na normální erytrocyty.
Tab. 3. Přehled hemolytických anemií. 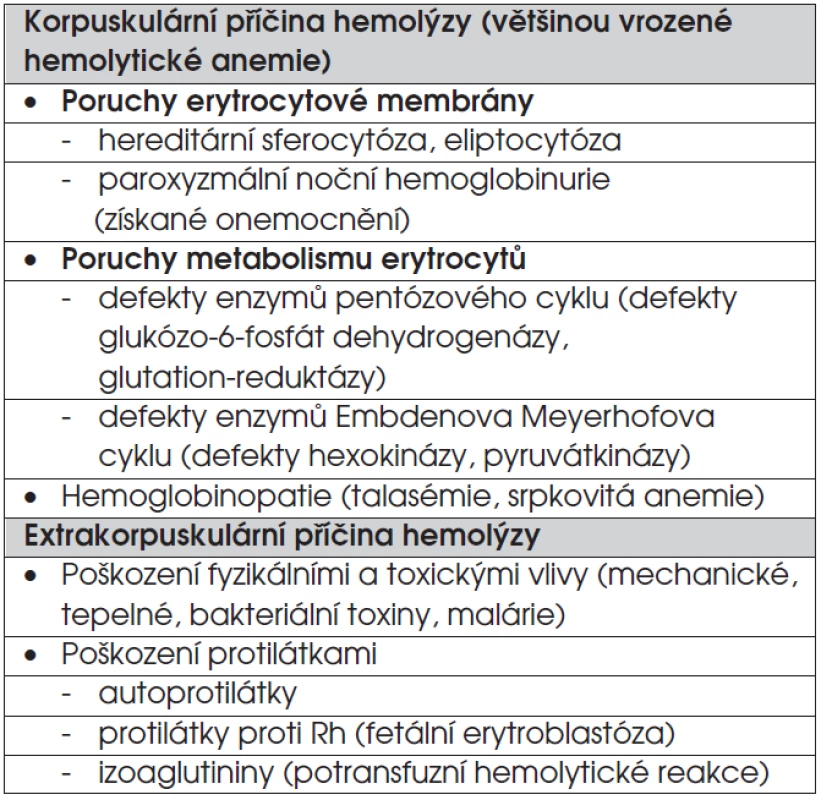
3.1. Vrozená sferocytární hemolytická anemie
Vrozená sferocytární anemie neboli hereditární sferocytóza (HS) je nejčastější vrozenou hemolytickou anemií ve střední a severní Evropě s incidencí 1/5000 porodů. Dědičnost je v 75 % případů dominantní. Jedná se o heterogenní onemocnění tíží klinických projevů, defektem proteinů stěny erytrocytu a typem dědičnosti.
Etiopatogeneze
Integrita membrány erytrocytu je porušena v důsledku mutací některého strukturního proteinu, nejčastěji ankyrinu, spektrinu, proteinu 3 a proteinu 4.1 (obr. 2). Lipidová dvojvrstva je tak nedostatečně zakotvena k spektrinu a dochází v ní k tvorbě vezikul (obr. 3). Při průchodu sinusoidy sleziny dochází k ztrátám části membrány erytrocytu. Povrch erytrocytu se zmenšuje v poměru k jeho vnitřnímu objemu. Erytrocyt ztrácí bikonkávní tvar, stává se sférickým, snižuje se jeho deformabilita a odolnost k opakovaným průchodům sinusy sleziny. Důsledkem je hemolýza.
Obr. 2. Schéma buněčné membrány erytrocytů s přichycením spektrinu k lipidové dvojvrstvě. Převzato z: Nečas F. Patologická fyziologie orgánových systémů. UK v Praze. Nakladatelství Karolinum, 2003. 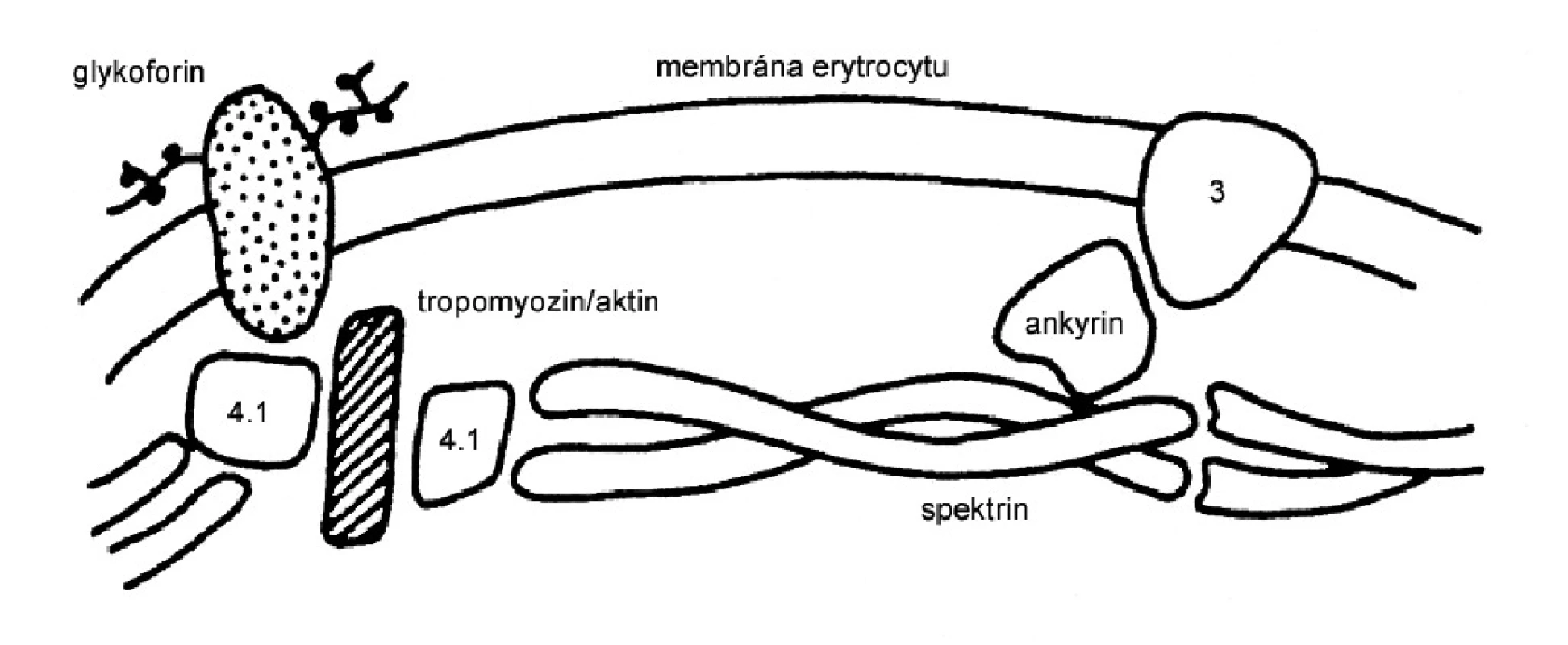
Obr. 3. Schéma vzniku sférocytu. 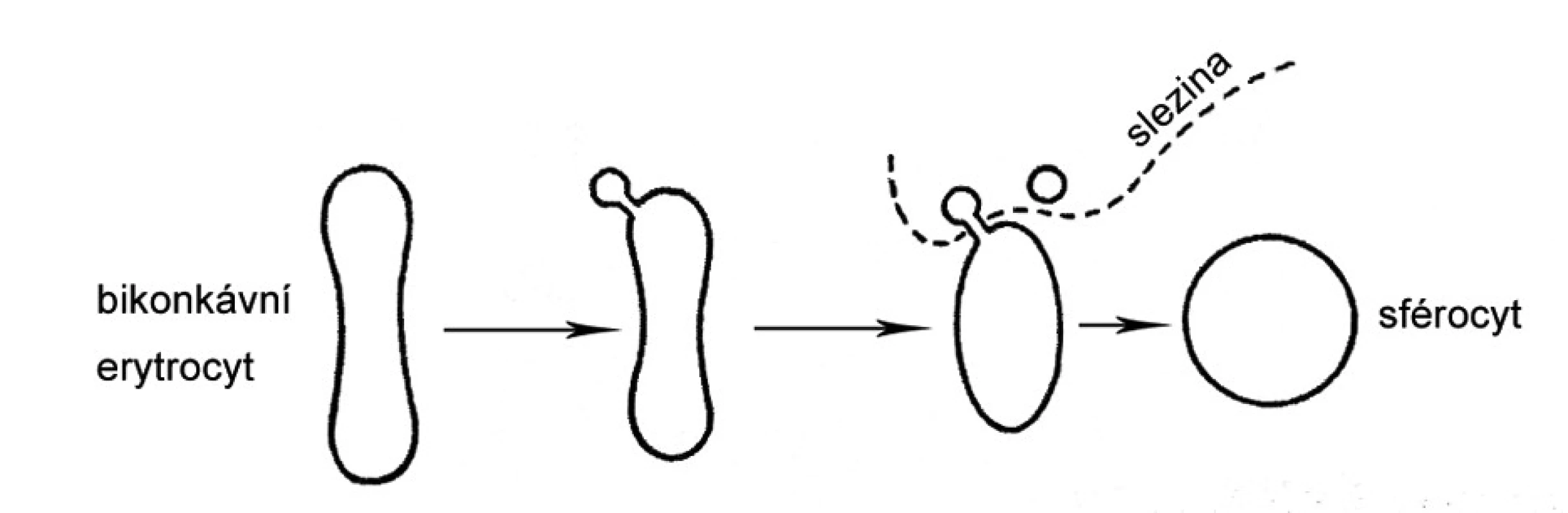
Klinický obraz
Onemocnění se projevuje různě těžkou anemií, ikterem a splenomegalií. Rozlišujeme formu středně těžkou (50–60 % případů) charakterizovanou ne zcela kompenzovanou hemolýzou, lehkou až středně těžkou anemií a ojedinělou potřebou transfuzí. Těžká forma (5–7 %) se projevuje těžkou anemií a závislostí na transfuzích krve, lehká forma (20–30 %) má hemolýzu plně kompenzovanou zvýšenou produkcí erytrocytů kostní dření a anemie chybí.
V novorozeneckém věku je častá významná hyperbilirubinémie s potřebou fototerapie i výměnné transfuze, hemoglobin je při porodu většinou normální, ale rychle klesá. Potřeba transfuzí krve v prvých 6 měsících života je relativně častá. Příčinou je snížená schopnost kojenců kompenzovat hemolýzu zvýšením erytropoezy v kostní dřeni.
U 20–60 % pacientů vznikají žlučníkové kameny, často již před 10. rokem života. Infekce parvovirem B19 vyvolá tranzientní aplastickou krizi, trvající 10–14 dní. Pokles erytropoezy v kostní dřeni má za následek těžkou anemii. Méně výraznou anemii mohou způsobit i jiná virová onemocnění.
Diagnostika
Pozitivní rodinná anamnéza, nekonjugovaná hyperbilirubinémie, splenomegalie a různý stupeň anemie s retikulocytózou a sférocyty v nátěru periferní krve většinou postačí k stanovení diagnózy. Diagnostické obtíže mohou vzniknout u malých kojenců, kteří většinou postrádají sférocyty v nátěru, a v situaci negativní rodinné anamnézy (25 % případů). Zvýšená hodnota indexů červených krvinek (MCHC >35 g/dl spolu s RDW >14) je pro HS typická. Podpůrnými vyšetřeními k průkazu HS jsou test osmotické rezistence (sférocyty jsou méně rezistentní vůči hypotonickému prostředí zředěného fyziologického roztoku), test autohemolýzy (krev se inkubuje při 37 ˚C 48 hodin, v normální krvi hemolyzuje méně než 5 % erytrocytů, v krvi pacientů s HS je hemolýza masivní a postihne 20–40 % erytrocytů), test lýzy s glycerolem (Pink test), test kryohemolýzy či ELFO membránových bílkovin s průkazem deficitního proteinu (SDS-PAGE). Průkaz mutací genů pro proteiny není pro rutinní diagnostiku dostupný.
Diferenciální diagnóza
Autoimunitní hemolytická anemie je vzácnějším onemocněním než HS a má pozitivní průkaz protilátek proti erytrocytům.
Gilbertův syndrom je benigní hyperbilirubinémie v důsledku vrozeně snížené aktivity enzymu nutného pro konjugaci bilirubinu. Postihuje 10–20 % kavkazské rasy. Hemolýza chybí.
Vrozená dyserytropoetická anemie je charakterizována typickými morfologickými abnormitami normoblastů v kostní dřeni.
Hereditární eliptocytóza je charakterizována oválným tvarem erytrocytů v nátěru, který je většinou zachycen jako náhodný nález bez klinické symptomatologie. Těžší formy nemoci se ale mohou vyskytnout.
Terapie a prognóza
Zvýšená spotřeba folátů je substituována denním podáváním kyseliny listové. Od pátého roku života je vhodné vyšetřovat ultrazvukem žlučníkové kameny. Splenektomie je indikována u pacientů s těžkou a středně těžkou formou HS. Provádí se po 5. roce života, děti jsou očkovány pneumokokovou vakcínou, doporučuje se užívat alespoň dva roky po splenektomii penicilin a celoživotně včas zahájit antibiotika při horečce, protože riziko sepse je trvale zvýšené. Splenektomie je prevencí vzniku žlučníkových kamenů, jsou-li již přítomné, je vhodné provést současně cholecystektomii. Parciální splenektomie se někdy provádí u malých dětí, funkce sleziny je částečně zachována, intenzita hemolýzy snížena, riziko vzniku žlučníkových kamenů trvá.
3.2. Hemolytické anemie z poruchy metabolismu erytrocytů
Během dozrávání retikulocytu v erytrocyt dojde ke ztrátě ribozomů a mRNA, mitochondrií a buňka přestane přijímat železo (protože ztratí transferinové receptory). Metabolismus zralého erytrocytu určuje tvar červené krvinky, strukturu a funkci buněčné membrány a transport kyslíku. Cestou anaerobní glykolýzy (Embdenův-Meyerhofův cyklus) se utilizuje 90 % glukózy, která prostoupí erytrocytární membránou. Vzniká ATP a 2,3-difosfoglycerát, regulující afinitu hemoglobinu ke kyslíku. Aerobní glykolýza je zajišťována pentózofosfátovým cyklem, který je zdrojem redukovaného glutationu, antioxidačního činidla, které snižuje poškozování hemoglobinu a erytrocytové membrány kyslíkovými radikály.
Metabolické defekty, které porušují funkci erytrocytů, jsou následkem enzymových poruch glukózového metabolismu erytrocytů. Postižení erytrocytů se nejčastěji projeví jejich hemolýzou, která může být záchvatovitá nebo chronická.
3.2.1. Nedostatek glukózo-6-fosfát dehydrogenázy (G-6-PD)
Z defektů enzymů pentózového cyklu je klinicky nejvýznamnější nedostatek glukózo-6-fosfát dehydrogenázy (G-6-PD). Jedná se o X-chromozom vázané dědičné onemocnění způsobené mutací v G-6-PD genu, mající za následek výskyt různých aktivit enzymu s širokou variabilitou klinických a biochemických projevů. Na přítomnosti G-6-PD závisí ochrana erytrocytu před oxidativním poškozením. Jedná se o nejrozšířenější enzymatický deficit, postihující celosvětově přes 400 milionů lidí, zejména v Africe, jihovýchodní Asii, na Středním východě a v oblasti Středozemního moře. Rozšíření v oblastech současného či do nedávné doby existujícího endemického výskytu malárie potvrzuje, že deficit G-6-PD je spojen s rezistencí vůči těžším formám malárie. Klinické postižení se projevuje častěji u mužů-hemizygotů, heterozygotní ženy tvoří erytrocyty s normální i sníženou hladinou G-6-PD a mají většinou klinicky méně významné projevy deficitu. Stanovení enzymatické aktivity v erytrocytech slouží k průkazu onemocnění, ve screeningu jsou v oblastech s vysokým výskytem deficitu (Sardinie) používány semikvantitativní metody.
Většina jedinců s deficitem G-6-PD je po celý život asymptomatická. Nejčastějšími klinickými projevy jsou novorozenecká žloutenka, ohrožující neléčené děti jádrovým ikterem, a akutní hemolytická anemie spuštěná některými léky, infekcí či požitím favových bobů (favismus). Z léků vyvolávají hemolytické krize u G-6-PD deficitních jedinců některá antimalarika, sulfonamidy, nitrofurantoin. Hemolýza se žloutenkou vzniká do 24–72 hodin po požití léku a projevuje se tmavou močí v důsledku hemoglobinurie. V supravitálním barvení se prokazují četná Heinzova tělíska (sraženiny denaturovaného hemoglobinu) v erytrocytech, která jsou při průchodu slezinou makrofágy odstraňována spolu s částí membrány a cytoplazmy a vznikají tak typické „okousané“ erytrocyty (obr. 4). Záchvaty hemolýzy mají autolimitující průběh. Ve střední a severní Evropě se deficit G-6-PD projevuje jako vrozená nesferocytární hemolytická anemie vzniklá de novo mutací a charakterizovaná chronickou, většinou extravaskulární hemolýzou s exacerbacemi v důsledku oxidativního stresu, retikulocytózou, žlučníkovými kameny a splenomegalií. Splenektomie většinou není přínosem.
Obr. 4. „Okousané“ erytrocyty (bite cells) u pacienta s deficitem glukózo-6-fosfát dehydrogenázy v hemolytické krizi. 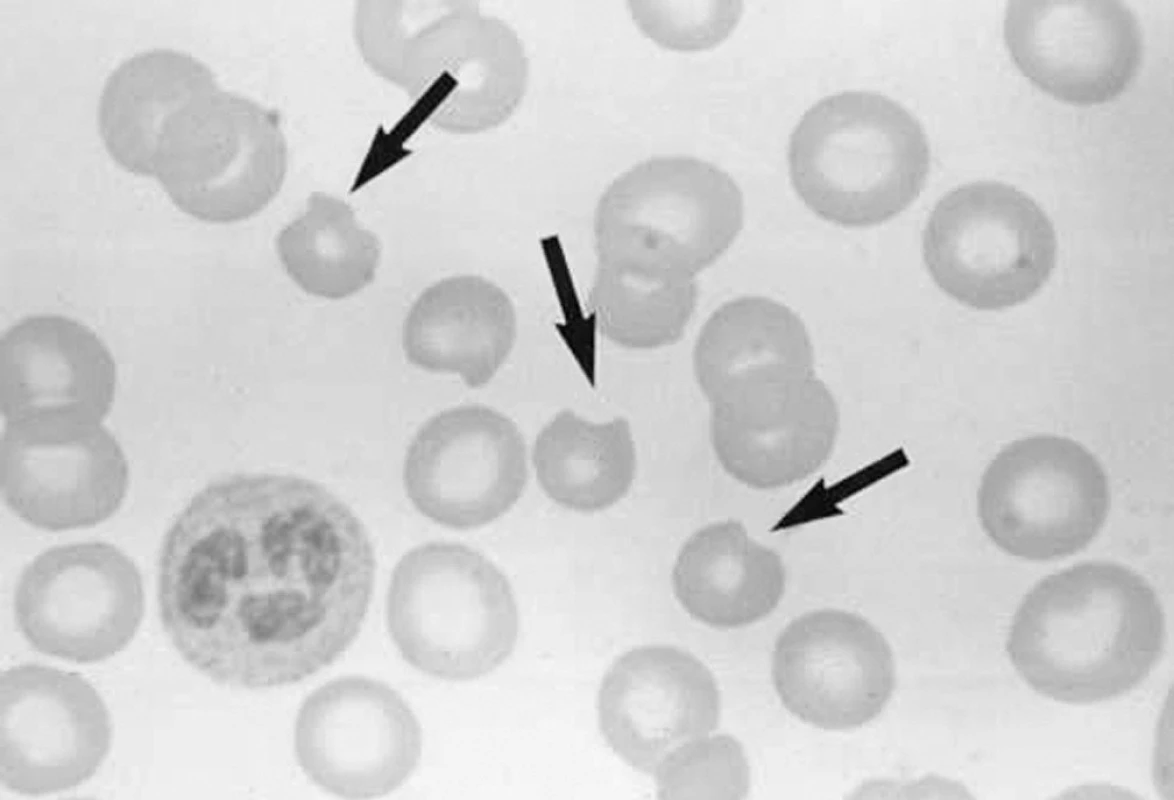
Nejúčinnějším přístupem k léčbě G-6-PD deficitu je prevence hemolýzy vyvarováním se požití potenciálně nebezpečných léků či favových bobů.
3.2.2. Nedostatek pyruvátkinázy
Deficit pyruvátkinázy (PK) je nejčastější enzymovou poruchou Embdenova-Meyerhofova cyklu. Dědičnost je autozomálně recesivní. Erytrocyty trpí nedostatkem ATP, důsledkem jsou zvýšené ztráty K+ z erytrocytů, jejich dehydratace, rigidita a sekvestrace makrofágy sleziny. Následkem je nesferocytární hemolytická anemie s variabilní klinickou manifestací od lehkých forem až po celoživotní závislost na transfuzích krve. Anemie je normocytární nebo makrocytární podle hodnoty retikulocytů, splenomegalie je pravidlem. Významná novorozenecká hyperbilirubinémie je častá, stejně jako tvorba žlučových kamenů. Rozvoj přetížení organismu železem je pravidlem, je výraznější po splenektomii a vyžaduje léčbu chelátory železa. Diagnózu určí stanovení snížené aktivity PK. Splenektomie nezastaví hemolýzu, ale zvýší hodnotu hemoglobinu o 1–3 g/dl, což eliminuje transfuze krve. Jejich podání se řídí spíše klinickými projevy anemie než výší hemoglobinu.
3.3. Hemolytické anemie způsobené poškozením erytrocytů fyzikálními a toxickými vlivy
K mechanickému poškození erytrocytů dochází při průchodu arteriolami a kapilárami deformovanými vlákny fibrinu nebo agregáty trombocytů, jako je tomu při trombotické trombocytopenické purpuře, hemolyticko-uremickém syndromu nebo diseminované intravaskulární koagulaci. V těchto případech se jedná o hemolýzu intravaskulární (mikroangiopatická hemolytická anemie). Jejím znakem je přítomnost deformovaných forem erytrocytů v cirkulaci, označovaných schistocyty (obr. 5).
Obr. 5. Tvary erytrocytů: a) srpkovité erytrocyty u srpkovité anemie; b) terčovité erytrocyty u talasémie; c) schistocyty u trombotické trombocytopenické purpury či diseminované intravaskulární koagulace; d) normální tvar erytrocytu. 
Některé bakteriální toxiny poškozují membránu erytrocytu a vyvolávají jejich zvýšený rozpad. Z bakteriálních infekcí se jedná především o sepsi Clostridium welchii, mírná hemolýza provází sepsi pneumokokovou, stafylokokovou, streptokokovou, E. coli.
Měď může vyvolat hemolýzu erytrocytů u pacientů s Wilsonovou nemocí. Rozsáhlé popáleniny (III. stupně, postihující 15–65 % povrchu těla) jsou provázeny tepelným poškozením erytrocytů způsobujícím hemoglobinémii a hemoglobinurii. K poškození erytrocytové membrány může dojít při jaterní cirhóze (změna složení lipidové membrány má za následek vznik rigidních „trnitých“ erytrocytů). Hemolýzou erytrocytů je provázena malárie, onemocnění většinou ale dominuje řada jiných klinických projevů.
3.4. Hemoglobinopatie
Hemoglobinopatie jsou vrozené defekty syntézy hemoglobinu, které vedou ke vzniku dědičných onemocnění postihujících asi 7 % populace a jsou tak nejrozšířenější monogenní chorobou. Hemoglobinopatie vznikají bodovými mutacemi, delecemi nebo inzercemi nukleotidů v hemoglobinových genech. Dělíme je na:
- Porucha tvorby některého z globinových řetězců, jejímž důsledkem je nerovnováha v poměru globinových řetězců v erytrocytech (talasémie).
- Syntéza strukturálně abnormálních globinových řetězců (srpkovitá anemie, nestabilní hemoglobiny, hemoglobinopatie se změněnou afinitou ke kyslíku, M-hemoglobiny).
Uvedené typy poruch se mohou navzájem kombinovat. Výskyt většiny hemoglobinopatií je soustředěn především do oblastí s vysokou incidencí malárie. Tato onemocnění se však vyskytují ve všech etnických skupinách včetně středoevropských zemí, kde se setkáváme většinou s nosiči talasemické nebo vzácně strukturní hemoglobinové mutace.
Obrázek 6 znázorňuje normální vývojové změny v tvorbě globinových řetězců ve fetálním životě a v průběhu prvního roku postnatálního života. Při porodu je dominantním hemoglobinem fetální hemoglobin (HbF), který se skládá ze dvou α-globinových a dvou γ-globinových řetězců. Produkce γ-globinových řetězců klesá a tvorba β-globinových řetězců stoupá, takže adultní hemoglobin A (dva α řetězce a dva β řetězce) převažuje po 2–4 měsících života. Protože alfa-globin je tvořen v prenatálním i postnatálním životě, poruchy tvorby α řetězců (α-talasémie) se klinicky projevují již u novorozence, zatímco β-talasémie a srpkovitá anemie jsou v prvých 3–4 měsících života asymptomatické a klinické obtíže se projeví až po poklesu produkce γ řetězců a tím i HbF.
Obr. 6. Místa krvetvorby a vývoj syntézy globinových řetězců v průběhu prenatální a postnatální ontogeneze. Převzato z: Neuwirt J, Nečas E, Kornalík F, Šulc K. Patofyziologie krve. Praha: Avicenum, 1983. 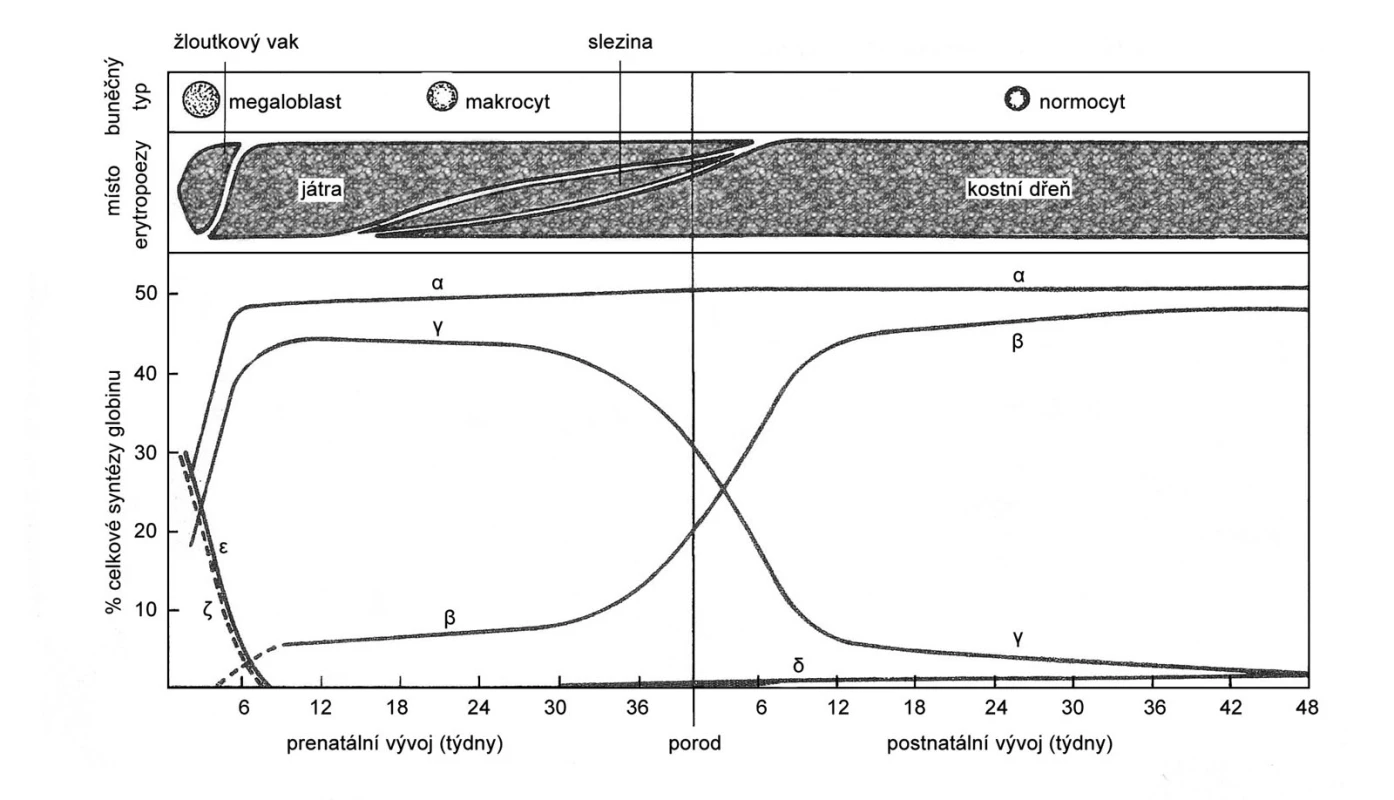
3.4.1. Alfa-talasémie
Alfa-talasémie je výsledkem delece jednoho nebo více α-globinových genů na 16. chromozomu. Normální diploidní buňky mají čtyři α-globinové geny a variabilita klinických projevů α-talasémie závisí na počtu deletovaných genů. Onemocnění se vyskytuje v jihovýchodní Asii, Africe, v oblasti Středozemního moře, na Středním východě. Přehled jednotlivých typů onemocnění je v tabulce 4. Osoby s delecí jednoho genu nemají klinické obtíže a mají normální krevní obraz. Zachytí se novorozeneckým screeningem a průkazem Bartova hemoglobinu – variantního hemoglobinu složeného ze čtyř řetězců γ. Elektroforéza hemoglobinu provedená po šestém měsíci je již normální. Delece dvou genů má za následek normální či sníženou hladinu hemoglobinu, nižší MCV a hypochromii erytrocytů v nátěru u jedinců bez klinických obtíží. Delece tří genů vedou k mírné nebo středně těžké mikrocytární hemolytické anemii (hemoglobin 7–10 g/dl), může se vyvinout hepatosplenomegalie. V krevním obraze se nachází retikulocytóza s hypochromií, mikrocytózou a bazofilním tečkováním erytrocytů. Zastoupení Bartova hemoglobinu je u novorozenců 15–30%, později se nalézá hemoglobin H, který je tvořen čtyřmi řetězci β. Některé léky nebo infekce mohou anemii zhoršit a vyvolat potřebu transfuze. Delece všech čtyř α-globinových genů má za následek těžkou intrauterinní anemii, fetální hydrops a smrt plodu. U plodu se nachází pouze Bartův hemoglobin.
Tab. 4. Alfa-talasémie. 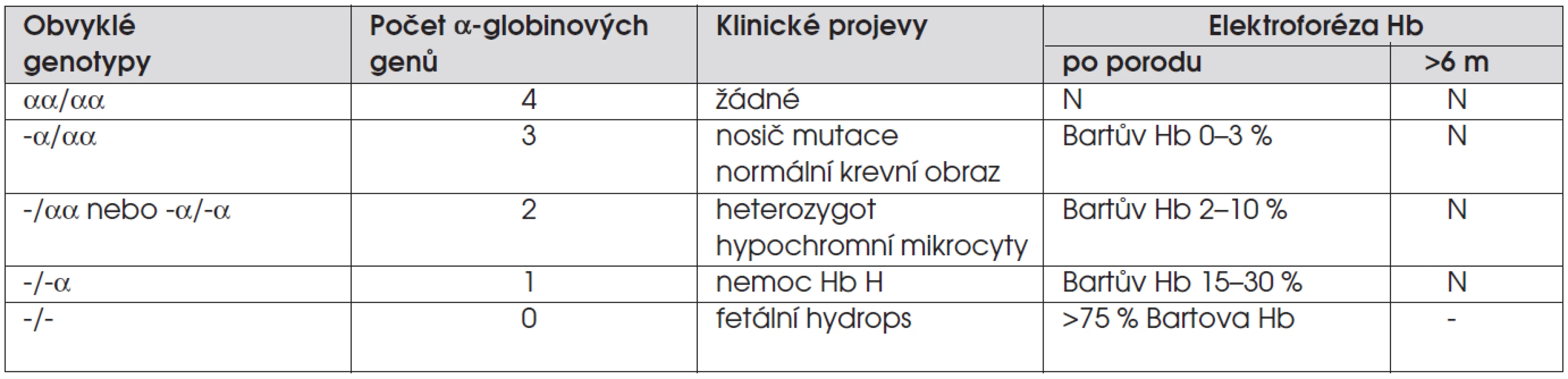
Vysvětlivky: α = přítomnost α-globinového genu, - = delece α-globinového genu, N = normální výsledek, Hb = hemoglobin, Bartův hemoglobin = γ4, hemoglobin H = β4, nemoc Hb H = nemoc hemoglobinu H V diferenciální diagnóze je sideropenická anemie (feritin je u α-talasémie normální) a β-talasémie (na rozdíl od ní mají děti s α-talasémií normální ELFO hemoglobinu po šestém měsíci). Jiné hemolytické anemie mají většinou normální nebo zvýšený MCV a erytrocyty nejsou hypochromní.
3.4.2. Beta-talasémie
Diploidní buňky mají dva β-globinové geny, po jednom na každém 11. chromozomu. Stav, kdy geny neprodukují žádné β-globinové řetězce, se nazývá β-talasémií, produkují-li snížené množství řetězců, mluvíme o β+-talasémii. Osoby postižené β-talasémií jsou buď heterozygoty a jejich onemocnění se nazývá talasémie minor, nebo homozygoty, kteří vyvíjejí talasémii major, těžkou, na transfuzích závislou anemii, nebo talasémii intermedia, která vyžaduje transfuze jen občas. Jednotlivé typy β-talasémie jsou charakterizovány v tabulce 5. Onemocnění se vyskytuje zejména v oblasti Středozemního moře, Středního východu, v Asii, nicméně heterozygoti (talasémie minor) jsou vzácně diagnostikováni i ve střední Evropě.
Tab. 5. Beta-talasémie. 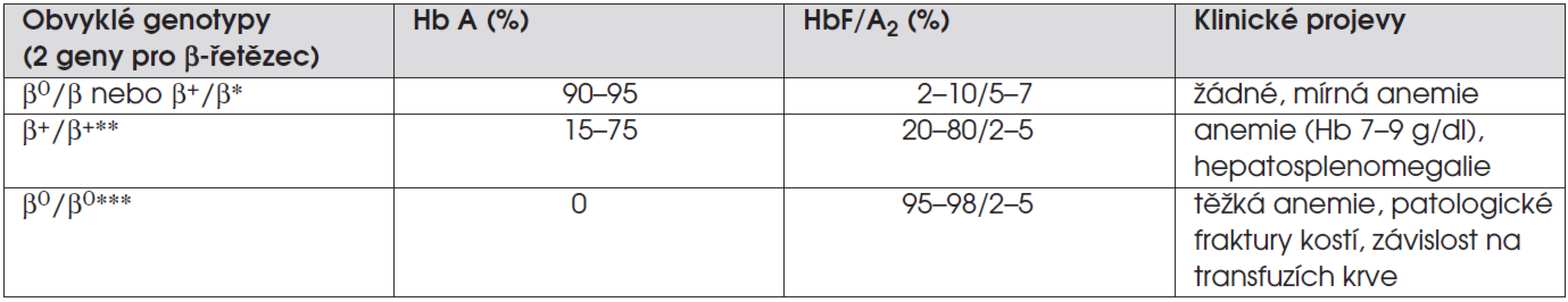
Vysvětlivky: β0 =mutacemající za následek úplné chybění tvorby β-globinu, β+ =mutacemající za následek sníženou tvorbu β-globinu, * = talasémie minor, ** = talasémie intermedia, *** = talasémie major Klinický obraz
Pacienti s talasémií minor jsou asymptomatičtí. Pacienti s talasémií major mají normální krevní obraz při porodu, ale vyvinou těžkou anemii v průběhu prvního roku života. Není-li onemocnění adekvátně léčeno transfuzemi krve, vyvíjí se u postižených dětí hepatosplenomegalie, špatně rostou a rozšíření kostních dřeňových prostorů vede k deformitám obličeje (prominence čela a horní čelisti) a patologickým frakturám.
Diagnostika
Děti s talasémií minor mají snížený MCV, anemie chybí, nebo je jen mírná. V nátěru krve je hypochromie, terčovité erytrocyty (obr. 5) a bazofilní tečkování. Elektroforéza hemoglobinu provedená po šestém měsíci potvrzuje diagnózu (tab. 5) nálezem zvýšeného hemoglobinu A2, hemoglobinu F nebo současně obou. Anemie dětí s talasémií major se vyvíjí po čtvrtém měsíci života, v nátěru je významná hypochromní mikrocytární anemie, terčovité erytrocyty, normoblasty. Hladina hemoglobinu klesá k 5–6 g/dl i méně, retikulocyty jsou zvýšené, stejně jako bilirubin. V elektroforéze hemoglobinu se nachází u dětí s β-talasémií pouze fetální hemoglobin a hemoglobin A2, u β+-talasémie je produkováno určité množství hemoglobinu A. Diagnóza homozygotní β-talasémie může být také potvrzena nálezem talasémie minor u obou rodičů.
Diferenciální diagnóza
V diferenciální diagnóze se nachází sideropenická anemie a α-talasémie. Pacienti s talasémií minor mají ve srovnání s anemií z nedostatku železa zvýšený počet erytrocytů. Diagnózu potvrzuje zvýšená hladina hemoglobinu A2, i když ji současně přítomný deficit železa může snižovat.
Terapie a prognóza
Pacienti s talasémií minor mohou být zbytečně zatíženi léčbou preparáty železa při chybné diagnóze sideropenické anemie. Pacienti s talasémií major jsou léčeni opakovanými transfuzemi krve s cílem neklesat s hladinou hemoglobinu pod 9–10 g/dl. Neléčené děti s talasémií major umírají před desátým rokem života. Transfundovaní pacienti vyvíjejí hemosiderózu, splenomegalii a hypersplenismus. Splenomegalie s hypersplenismem může být indikací k splenektomii. Hemosideróza vyžaduje léčbu chelátory železa. Transplantace kostní dřeně je schopna onemocnění s šancí více než 90 % vyléčit, je-li provedena včas před rozvojem hepatomegalie a jaterní fibrózy.
3.4.3. Srpkovitá anemie
Srpkovitá anemie (HbSS) vzniká záměnou valinu za glutamovou kyselinu v šesté pozici β-globinového řetězce. HbS vytváří v deoxygenové formě polymery, snižuje se rozpustnost hemoglobinu, což způsobuje snížení deformability celých erytrocytů a charakteristickou změnu jejich tvaru (obr. 5). Erytrocyty mění svůj tvar při průchodu kapilárami, protože zde je z hemoglobinu odebírána část kyslíku. Při průchodu plícemi a nasycení kyslíkem se jim vrací normální bikonkávní tvar. Protože k těmto změnám dochází opakovaně, patologický srpkovitý tvar se po určité době fixuje. Srpkovité erytrocyty jsou zvýšeně destruovány makrofágy při průchodu slezinou, což má za následek chronickou hemolytickou anemii. Snížená průchodnost krve mikrocirkulací a reologické problémy způsobené přítomností srpkovitých erytrocytů jsou příčinou náhle vzniklých potíží. V elektroforéze hemoglobinu tvoří HbS 75–95 %, HbF 2–25 %, HbA2 <3,5 % a HbA se nevyskytuje. Onemocnění se vyskytuje v centrální Africe, u Afroameričanů, v oblasti Středozemního moře, na Středním východě, v Indii, Karibiku.
Klinický obraz
Onemocnění se projevuje hemolytickou anemií a vazookluzivními krizemi. První projevy nemoci se manifestují po čtvrtém měsíci života. Splenomegalie je přítomna v raném dětství, později mizí, ale slezina neplní svou roli v imunitě (funkční asplenie). Děti jsou ohroženy sepsí, zejména pneumokokovou. Až 30 % pacientů postihne epizoda akutní splenické sekvestrace, charakterizovaná náhlým zvětšením sleziny v důsledku nahromadění erytrocytů, rozvojem těžké anemie s hrozícím šokem a smrtí. Zhoršení anemie rovněž nastává v době aplastické krize vyvolané parvovirovou infekcí. Opakované epizody vazookluze a následné tkáňové ischémie způsobují akutní i chronické problémy. Opakující se ataky bolestí břicha, kosterního svalstva nebo cévní mozková příhoda jsou nejčastější. Akutní hrudní syndrom je charakterizován horečkou, bolestí na hrudníku, plicními infiltráty a hypoxémií a je způsoben plicním infarktem či infekcí. Důsledkem opakovaných ischemických atak je v dospělosti dysfunkce řady orgánů.
Diagnostika
Hodnota hemoglobinu se pohybuje mezi 7–10 g/dl a klesá k život ohrožujícím hodnotám při splenické sekvestraci či aplastické krizi. Je retikulocytóza, anemie je normocytární či makrocytární, v nátěru krve jsou typické srpkovité erytrocyty a terčovité erytrocyty. Dvojití heterozygoti kombinující srpkovitou anemii s talasémií či hemoglobinopatií E mají v uvedeném obraze odlišnosti. Diagnózu potvrdí elektroforéza hemoglobinu. V některých zemích (např. USA) je srpkovitá anemie diagnostikována novorozeneckým screeningem.
Terapie a prognóza
Pacienti a jejich rodiny jsou v rozvinutých zemích zařazeni do komplexního programu zahrnujícího edukaci, preventivní opatření a léčbu akutních komplikací. Profylaxe penicilinem je zahájena ve dvou měsících a pokračuje nejméně do 5 let. Horečka nad 38,5 °C je indikací k zahájení léčby širokospektrými antibiotiky a observaci pacienta. Léčba bolestivých vazookluzivních krizí zahrnuje dostatečnou hydrataci pacienta, analgezii, zajištění dostatečné saturace organismu kyslíkem, léčbu doprovázející infekce. Transfuze krve jsou indikovány při akutní sekvestraci sleziny či aplastické krizi. V život ohrožujících situacích, jako je například cévní mozková příhoda, se může provést parciální výměnná transfuze k snížení procenta cirkulujících srpkovitých buněk. Někteří pacienti těží ze zavedení chronického transfuzního programu jako prevence opakujících se vazookluzivních krizí. Léčba hydroxyureou zvyšuje hladiny fetálního hemoglobinu, snižuje hemolýzu a redukuje výskyt bolestivých krizí. Vyléčení srpkovité anemie dosáhne transplantace kostní dřeně.
3.4.4. Hemoglobin E
Hemoglobin E je zvláštní strukturní hemoglobinovou variantou s β-talasemickým rysem. Nejčastěji se vyskytuje v jihovýchodní Asii. Heterozygotní, ale i homozygotní postižení probíhá bez výraznějších klinických projevů. Atypicky jiná je situace u dvojitých heterozygotů pro HbE a jinou β-talasemickou mutaci, kde vzniká obraz β-talasémie major. Příčinou je oxidativní nestabilita HbE, zvýšení nepoměru mezi α a β řetězci a urychlení hemolýzy.
3.4.5. Nestabilní hemoglobiny
Příčinou onemocnění je strukturální změna v globinové složce hemoglobinu, která ovlivňuje solubilitu jeho molekuly v erytrocytu. Nestabilita abnormálního hemoglobinu vede k jeho precipitaci uvnitř erytrocytu. Důsledkem je hemolýza erytrocytů různého stupně. Pro anemie vznikající v důsledku nestabilních hemoglobinů je rovněž používán název kongenitální hemolytický syndrom s Heinzovými tělísky. Název je odvozen od přítomnosti precipitovaného nestabilního hemoglobinu v erytrocytech, který je detekovatelný supravitálním barvením jako tmavé lobulární agregáty nazývané Heinzova tělíska. Tyto intracelulární inkluze redukují životnost erytrocytu a vyvolávají hemolýzu různé závažnosti. Hemolytické anemie vznikající na jejich podkladě jsou děděny autozomálně dominantně. Léky s oxidačním potenciálem a infekce mohou u těchto chorob vyprovokovat akutní hemolytickou krizi. Nejčastější variantou nestabilní hemoglobinopatie, která byla popsána u všech etnických skupin, je hemoglobin Köln (β98Val→Met).
Klinické projevy se objevují většinou až po šestém měsíci věku, kdy je ukončen přechod z HbF na HbA. Jejich intenzita je dána stupněm nestability hemoglobinu. U postižených jedinců se nemoc projevuje jako lehká nebo středně těžká hemolytická anemie. Někdy se nemoc může manifestovat až při infekci nebo po podání léků. Nálezy v periferní krvi nejsou pro onemocnění charakteristické. Anemie bývá obvykle normocytární. Pro stanovení diagnózy je nezbytný průkaz Heinzových tělísek briliant kresolovou modří.
3.4.6. Hemoglobiny s abnormální vazbou ke kyslíku
Hemoglobiny s nízkou afinitou ke kyslíku mají minimální klinické projevy, např. cyanózu nebo mírnou anemii. Disociační křivka hemoglobinu ke kyslíku je posunuta doprava. Hemoglobiny se zvýšenou afinitou ke kyslíku mají posun disociační křivky kyslíku doleva. Většina nemocných nemá žádné klinické příznaky. Při fyzikálním vyšetření dominuje pletorické zbarvení celého těla. Diagnóza bývá stanovena na základě náhodně zjištěné erytrocytózy bez známek hyperviskozity či projevů tkáňové hypoxie. Hodnoty hemoglobinu se pohybují kolem 19 g/dl, podezření zvyšuje nález erytrocytózy u několika členů rodiny. Pravidelné kontroly krevního obrazu jsou nutné, aby bylo možno, v případě vzestupu hematokritu nad 0,60 snížit viskozitu krve venepunkcí. Onemocnění se nesmí zaměnit s pravou polycytémií.
3.4.7. M hemoglobiny
Hemoglobinopatie provázené tvorbou methemoglobinu dostaly název HbM. Díky aminokyselinové substituci v oblasti hemové kapsy jednoho z globinových řetězců dochází k oxidaci a stabilizaci ferrohemu (Fe2+) na ferrihem (Fe3+). Přeměnou dvojmocného železa na trojmocné ztrácí atom železa a s ním příslušná hemoglobinová podjednotka schopnost reverzibilní vazby a přenosu kyslíku, to znamená, že ztrácí základní funkční vlastnost hemoglobinu – schopnost oxygenace. Místo čtyř přenáší jen dvě molekuly kyslíku. Následkem je vyšší obsah deoxyhemoglobinu v arteriální krvi nemocných a jejich nápadná cyanóza. Nemocní s hemoglobiny M nevyžadují žádnou léčbu. Zásadní význam má stanovení správné diagnózy a odlišení M hemoglobinů od cyanotických plicních a srdečních chorob, resp. od intoxikací léky či chemikáliemi u novorozenců. Dědičnost je autozomálně dominantní.
3.5. Autoimunitní hemolytické anemie
Autoimunitní hemolytické anemie (AIHA) jsou charakterizovány tvorbou autoprotilátek proti antigenům erytrocytů, což má za následek jejich zrychlený zánik. Klasifikace AIHA je založena na teplotě, při které autoprotilátky vykazují nejvyšší aktivitu (tab. 6). Incidence je udávána 1 : 80 000, což je nižší výskyt než ITP či autoimunitní neutropenie. AIHA s tepelnými protilátkami tvoří 60–70 % všech autoimunitních anemií v dětském věku, častější je u dospívajících, ale vyskytuje se i u kojenců. Paroxyzmálni chladová hemoglobinurie (PCH) tvoří 30 % anemií a je nejčastějším typem AIHA u dětí mezi 1–5 lety věku. Ostatní typy autoimunitních anemií jsou u dětí vzácné.
Tab. 6. Klasifikace autoimunitních hemolytických anemií. 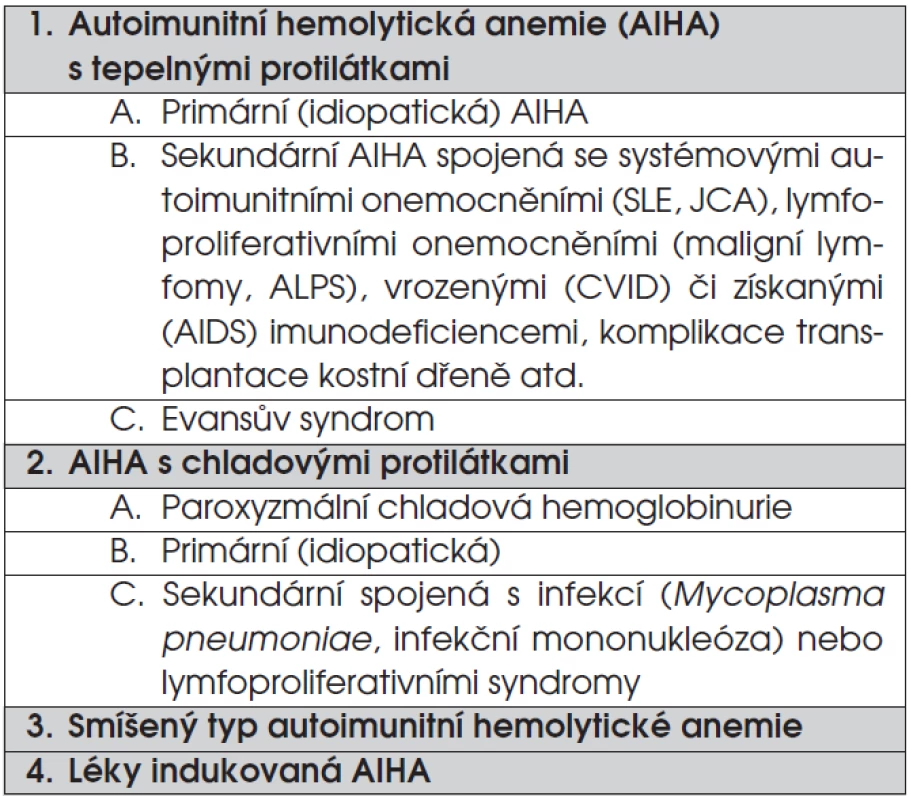
Etiopatogeneze
Tepelné protilátky jsou typu IgG, váží se na erytrocyty optimálně při teplotě 37 ˚C a jsou nespecifické, méně často směřovány proti antigenům Rh systému. Autoprotilátky indukují vazbu C3 komplementu na erytrocyty. Hemolýza červených krvinek je převážně extravaskulární. Makrofágy sleziny a v menší míře i jater fagocytují erytrocyty prostřednictvím vazby jejich receptorů s Fc oblastí IgG protilátky.
PCH je způsobena bifázickými hemolyziny, IgG protilátkami proti P antigenu erytrocytů, které se nazývají Donathovy-Landsteinerovy protilátky. Jejich tvorba je indukována virovou či bakteriální infekcí, váží se na erytrocyty při nízkých teplotách v akrálních částech končetin, následně při zvyšující se teplotě aktivují komplement a samy se z vazby na erytrocyty uvolňují. Komplement hemolyzuje červené krvinky při teplotě 37 °C. Pro PCH je typická intravaskulární hemolýza.
Chladové autoprotilátky primární AIHA jsou typu IgM, stimulují vazbu komplementu a vykazují maximální účinnost při 4 °C. U dětí je jejich nález výjimečný, jejich tvorbu může vyvolat Mycoplasma pneumoniae či EBV virus a jsou směřovány proti I/i antigenu erytrocytů. Vyvolávají intravaskulární hemolýzu.
Klinický obraz
AIHA s tepelnými protilátkami se může rozvíjet během několika dní s těžkou anemií a žloutenkou, ale i pomalu v průběhu týdnů. Častá je splenomegalie, tmavá moč je výjimkou. U dětí jde většinou o akutní onemocnění, které odezní v průběhu týdnů. Chronický průběh je častější u dospívajících a u dětí, kde je AIHA projevem jiného základního onemocnění.
Evansův syndrom je kombinací tepelné AIHA s imunitní trombocytopenickou purpurou a/nebo autoimunitní neutropenií. Jedná se většinou o chronické onemocnění, charakterizované atakami hemolýzy a trombocytopenie.
PCH postihuje typicky děti mladší 5 let, častěji chlapce a navazuje nejčastěji na virovou infekci horních cest dýchacích, není vyvolána expozicí chladu. Ataka hemolýzy se rozvíjí během hodin, dítě je bledé, febrilní, ikterické, má tmavou moč při hemoglobinurii. Akutní onemocnění spontánně odezní během několika dní.
AIHA s chladovými IgM protilátkami je u dětí výjimečná, je indukována infekcí Mycoplasma pneumoniae, EBV či CMV, průběh je akutní a mírný, spontánně odezní.
Léky (cefalosporiny, fludarabin) indukovaná intravaskulární hemolýza následuje rychle po expozici léku, je charakterizována horečkou, zvracením, bolestí břicha, bledostí, tmavou močí. Hrozí selhání ledvin.
Diagnostika
AIHA s tepelnými protilátkami má pozitivní přímý Coombsův test na přítomnost IgG a často i C3 komplementu, retikulocytózu (v prvních dnech může být retikulocytopenie), nekonjugovanou hyperbilirubinémii a zvýšený urobilinogen v moči, sferocytózu v nátěru krve, snížený haptoglobin, zvýšené LDH v séru.
PCH má pozitivní Coombsův test s komplementem a negativní s IgG. Donathův-Landsteinerův test prokazuje bifázické hemolyziny, Vyšetřované sérum se inkubuje s erytrocyty a komplementem za chladu. Pokud je přítomen bifazický hemolyzin, dojde po oteplení k makroskopické hemolýze. Protilátky jsou detekovatelné pouze několik dní. V prvních dnech nemoci je pravidlem retikulocytopenie, retikulocytóza se objevuje s odezníváním nemoci. V neutrofilech je erytrocytofagocytóza, haptoglobin je snížený, LDH zvýšené, v moči je hemoglobinurie.
AIHA s chladovými protilátkami má pozitivní Coombsův test s komplementem. Volné IgM protilátky jsou nacházeny ve vysokých titrech v séru při nízkých teplotách.
Diferenciální diagnóza
AIHA s tepelnými protilátkami má v diferenciální diagnóze hereditární sferocytózu či hemolytickou anemii komplikující Wilsonovu nemoc. Intravaskulární hemolýza se kromě PCH a chladové AIHA vyskytuje u paroxyzmální noční hemoglobinurie, některých vrozených hemolytických anemií z poruchy metabolismu erytrocytu, talasémie, srpkovité anemie, mikroangiopatických hemolytických anemií a léky indukované hemolýzy.
Terapie a prognóza
AIHA s tepelnými protilátkami reaguje příznivě na léčbu kortikoidy, které snižují tvorbu protilátek i fagocytózu erytrocytů makrofágy sleziny. Ukončení léčby se řídí intenzitou reakce Coombsova testu a anemií. Relapsy anemie po jejich vysazení nejsou výjimečné. Chronické případy mohou příznivě odpovědět na léčbu rituximabem (monoklonální protilátka anti-CD20, která je cytotoxická pro B lymfocyty). Účinnými léky u chronických případů jsou i azathioprin či merkaptopurin. Splenektomie je u dětí indikována výjimečně. Těžké akutní ataky může pomoci zvládnout plazmaferéza a vysokodávkované imunoglobuliny. Evansův syndrom vyžaduje často dlouhodobou imunosupresivní léčbu. Sekundární autoimunitní hemolytické anemie vyžadují úspěšnou léčbu základního onemocnění.
PCH je akutním onemocněním s rychlým rozvojem v některých případech až život ohrožující anemie v průběhu hodin. Monitorování krevního obrazu a klinického stavu je nutností, stejně jako dostatečný přísun tekutin při zatížení ledvin hemoglobinurií a pobyt pacienta v teple. Jedná se o spontánně odeznívající onemocnění, kortikoidy nemají na jeho průběh vliv. Podobná je situace u chladové AIHA.
Indikací k transfuzi krve je klinický stav pacienta. Roli hraje rychlost rozvoje anemie. Při poklesu hemoglobinu pod 5 g/dl potřebuje transfuzi většina pacientů. Nálezy senzibilizace krvinek a volných autoprotilátek komplikují předtransfuzní vyšetření. Navázané autoprotilátky mohou být příčinou falešně pozitivních i negativních výsledků určování AB0, Rh i ostatních antigenů. Volné protilátky v séru mohou interferovat se stanovením AB0 protilátek a s křížovou zkouškou s erytrocyty transfuzního přípravku. Je-li transfuze indikována, je nutné neváhat a podat co nejméně rizikový inkompatibilní přípravek. Riziko potransfuzní hemolytické reakce je nízké, doba života transfundovaných erytrocytů je zkrácena. Vždy je nutné vyloučit přítomnost aloprotilátky, která se vyskytuje až u 30 % pacientů s AIHA léčených transfuzemi a způsobuje závažné hemolytické reakce. U pacientů s PCH a chladovou AIHA je nutné podávat krev ohřátou na 37 °C.
4.0. ERYTROCYTÓZY (POLYCYTÉMIE)
Erytrocytózy neboli polycytémie jsou charakterizovány zvýšením erytrocytární masy v periferní krvi, což se projevuje zvýšením počtu erytrocytů, hemoglobinu a hematokritu. V diferenciální diagnóze je nutné vyloučit relativní erytrocytózu v důsledku redukce plazmatického objemu, např. při průjmu či léčbě diuretiky. Erytrocytózy dělíme na primární a sekundární (tab. 7) – primární erytrocytózy jsou charakterizovány zvýšenou citlivostí erytroidních progenitorů na erytropoetin, jehož hladina v krvi je nízká. Pro sekundární erytrocytózy je typická zvýšená sekrece erytropoetinu jako fyziologická reakce na tkáňovou hypoxii, důsledek abnormální autonomní produkce erytropoetinu nebo dysregulace jeho na kyslíku závislé syntézy. Citlivost erytroidních progenitorů na erytropoetin je normální.
Tab. 7. Klasifikace erytrocytóz. 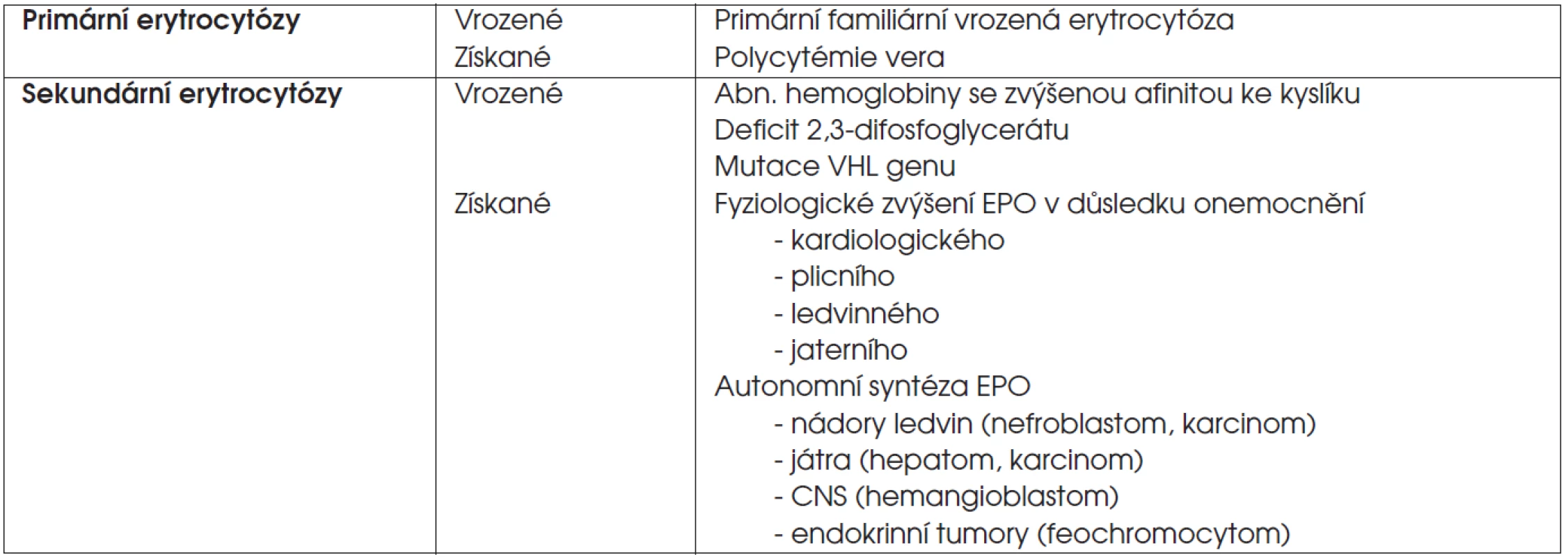
Vysvětlivky: EPO = erytropoetin U dětí je erytrocytóza definována vzestupem hodnot hemoglobinu a hematokritu o dvě směrodatné odchylky nad věkovou normu ve dvou s odstupem provedených krevních obrazech. Snížení saturace arteriální krve kyslíkem pod 92 % vede k nutnosti vyloučit plicní či kardiologické onemocnění. U dětí se jedná nejčastěji o cyanotické srdeční vady a cystickou fibrózu. Klasickou příčinou sekundární erytrocytózy je dlouhodobý pobyt ve vysoké nadmořské výšce. Příčinou zvýšené hladiny erytropoetinu mohou být polycystické ledviny, nádory ledvin, jaterní cirhóza, hepatocelulární karcinom.
Příčinou vrozené erytrocytózy může být primární familiární a vrozená erytrocytóza, abnormální hemoglobiny se zvýšenou vazbou ke kyslíku, mutace VHL genu. V řadě případů je ale příčina onemocnění neznámá.
Komplikací vrozených i získaných erytrocytóz mohou být tromboembolické příhody v důsledku zvýšené viskozity krve. Riziko jejich vzniku stoupá s věkem a s nálezem vrozených nebo získaných trombofilních stavů. Prevencí jejich vzniku je snížení hladiny hematokritu venepunkcemi a léčba základního onemocnění (pokud je možná).
4.1. Primární erytrocytózy
4.1.1. Primární familiární a vrozená erytrocytóza (polycytémie)
Příčinou tohoto onemocnění jsou nejčastěji mutace genu pro erytropoetinový receptor. Dědičnost je autozomálně dominantní, ale i recesivní, a popsán je i sporadický výskyt. Klinickými projevy u dětí bývají pletora a bolesti hlavy, v dospělosti je zvýšený výskyt hypertenze, cévních mozkových příhod, infarktů myokardu. Léčbou je venepunkce, většinou až při objevení se projevů hyperviskozity (bolesti hlavy, závratě, parestézie, hučení v uších).
4.1.2. Polycytémie vera
Je získanou primární erytrocytózou, myeloproliferativním onemocněním charakterizovaným klonální proliferací erytroidních, myeloidních a megakaryocytárních prekurzorů. Saturace arteriální krve kyslíkem je nad 92 %, zvýšená erytropoéza není závislá na stimulaci erytropoetinem, jehož hladina je nízká. V in vitro testech je zvýšená citlivost erytroidních progenitorů BFU-E k erytropoetinu. V zralých granulocytech je zvýšená exprese PRV-1 (polycytémie rubra vera) receptoru prokazatelná polymerázovou řetězovou reakcí. Prakticky všichni pacienti mají mutaci cytoplazmatické tyrosinové kinázy JAK2 (JAK2V617F), kterou lze vyšetřit v periferní krvi a ve spojení s nízkou hladinou erytropoetinu potvrdit diagnózu polycytémie vera. Častá je splenomegalie, trombocytózu má více než 75 % pacientů. Pacienti mají zvýšený výskyt tromboembolických komplikací včetně obávaného Buddova-Chiariho syndromu. Hrozí rozvoj leukémie. U dětí se jedná o vzácné onemocnění, medián věku při diagnóze je 60 let. Léčebnými přístupy jsou venepunkce, hydroxyurea, interferon, anagrelid.
4.2. Sekundární erytrocytózy
Abnormální hemoglobinové varianty se zvýšenou afinitou ke kyslíku jsou diskutovány v kapitole hemoglobinopatie (3.4., s. 47–50). Vrozený deficit 2,3-difosfoglycerátu má za následek zhoršené uvolňování kyslíku ze strukturálně normálního hemoglobinu. Jedná se o velmi vzácné onemocnění. Erytrocytóza je u obou syndromů kompenzačním opatřením bránícím tkáňové hypoxii. Proto je nutné indikaci k venepunkcím pečlivě zvažovat. Mutace tumor supresorového von Hippelova-Lindauova genu (VHL) je příčinou endemické erytrocytózy Čuvašů, národa tatarského původu, obývajícího autonomní oblast ve středním Rusku. Mutace je sporadicky nalézána i u kavkazské rasy. Důsledkem mutace je zvýšená exprese erytropoetinového genu a nadměrná produkce erytropoetinu.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek Diabetes mellitusČlánek Editorial
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2011 Číslo 1- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Stillova choroba: vzácné a závažné systémové onemocnění
-
Všechny články tohoto čísla
- Chuť první cigarety: ovlivňuje vývoj kuřáckého chování?
- Poruchy kŕmenia v detskom veku
- Autoimunitní onemocnění jater v dětském věku – část II
- Editorial
- Diabetes mellitus
- Prof. MUDr. Jan Janda, CSc. – sedmdesátiletý, stále mladý
- Vybraná onemocnění červené krevní řady
- Očkování proti pneumokokům u dětí v ČR v letech 2010–2011
- Screening nutričního stavu při přijetí dětského pacienta k hospitalizaci
- Seznam čtenářů se správnou odpovědí na kontrolní otázky k doškolovacímu článku z č. 10/2010 Hamanová J., Csémy L.: Prenatální účinky alkoholu
- Výsledky pětileté činnosti dětské obezitologické ambulance Dětské polikliniky FN Motol a UK 2. LF, Praha
- Diskusia k článku „Hospitalizácie detí pre bronchiolitídu na Slovensku v rokoch 1996–2006”
- Postrehy z XXI. Izakovičovho memoriálu
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Vybraná onemocnění červené krevní řady
- Poruchy kŕmenia v detskom veku
- Autoimunitní onemocnění jater v dětském věku – část II
- Diabetes mellitus
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



