-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Procedurální bolest novorozence – možnosti prevence a tišení
Procedural Pain in the Newborn: Possible Prevention and Mitigation
International Association for Study of Pain (IASP) defines pain in 1973 as an unpleasant sensorial or emotional experience, connected with immediate or expected damage of tissue or described on the basis of this damage. Pain is a subjectively perceived and expressed experience. This definition is not adoptable for preverbal subjects and is hardly to apply it for neonates.
Anand and Graig published in 1996 a different definition, which is applicable for newborns. Pain is hereditary quality of life, expressed postnatally and serving as a signal system for tissue damage.
Pharmacological prevention of pain is well defined, whereas non-pharmacological prevention is now the dominant a preferred method for procedural pain. It comprises behavioral (sucrose application, sensorial stimulation) and environmental (minimal handling, lights and noise reduction in NICU) procedures. Sensorial saturations seems to be promising for the future, being presently the predominant method of NIDCAP activity.Key words:
pain, stress, pain scale, procedural pain, prevention, NICU, NIDCAP (Newborn Individualized Developmental Care and Assessment Program), intracranial pressure (ICP), necrotizing enterocolitis
Autoři: J. Macko
Působiště autorů: Novorozenecké oddělení, Krajská nemocnice Tomáše Bati, a. s., Zlín primář MUDr. J. Macko
Vyšlo v časopise: Čes-slov Pediat 2010; 65 (10): 584-591.
Kategorie: Přehledový článek
Souhrn
International Association for Study of Pain (IASP, www.iasp-pain.org) definuje v roce 1973 bolest jako nepříjemnou senzorickou či emocionální zkušenost, spojenou s okamžitým či potenciálním poškozením tkání, či popisovanou na základě tohoto poškození a předpokládající předchozí zkušenost.
Bolest je podle této definice subjektivně vnímaná a vyjádřená zkušenost. Tato definice není aplikovatelná na preverbální jedince, a proto pro novorozence obtížně použitelná. Anand a Craig v roce 1996 publikují odlišnou definici, která je již použitelná i pro novorozence – bolest je dědičná kvalita života, projevující se časně po narození a sloužící jako signální systém pro poškození tkání.
Farmakologická prevence bolesti je dobře definována, jsou zpracovány postupy pro jednotlivé kategorie bolestivých stimulů (především peroperační a pooperační bolest).
Nefarmakologická prevence je dnes dominantní metodou, využívanou pro procedurální bolest. Zahrnuje behaviorální postupy (aplikaci cukerných roztoků, senzorickou stimulaci, polohování…) a environmentální postupy (především minimal handling, úprava světelné a hlukové situace na JIRP…). Příslibem je použití metody senzorické saturace.Klíčová slova:
bolest, stres, škála bolesti, procedurální bolest, prevence, JIRP, NIDCAP, nitrolební tlak, nekrotizující enterokolitidaMotto:
„Bolest u novorozence nemůže být zcela eliminována, nicméně lze učinit řadu opatření pro její prevenci a minimalizaci, předcházení bolesti je základním etickým principem péče o dítě. To, co bolí dospělého, bolí i novorozence.“ (Anand KJ, Pediatrics 1990)
Úvod
International Association for Study of Pain (IASP, www.iasp-pain.org) definuje v roce 1973 bolest jako nepříjemnou senzorickou či emocionální zkušenost, spojenou s okamžitým či potenciálním poškozením tkání, či popisovanou na základě tohoto poškození a předpokládající předchozí zkušenost. Bolest je tedy podle této definice subjektivně vnímaná a vyjádřená zkušenost. Tato definice není aplikovatelná na preverbální jedince, a proto pro novorozence obtížně použitelná. Protože novorozenci nejsou schopni verbalizovat bolest, jsou při jejím rozpoznání, zjišťování a léčbě závislí na jiných osobách.
Anand, Hickey a Craig v 80. letech minulého století zahájili sérii prací a prospektivních studií, majících za cíl prokázat, že i novorozenci – včetně předčasně narozených – jsou schopni vnímat, pociťovat a vyjadřovat bolest [1, 2, 3].
V roce 1996 je poté publikována odlišná definice, která je již použitelná i pro novorozence – bolest je dědičná kvalita života, projevující se časně po narození a sloužící jako signální systém pro poškození tkání [4].
Stres je naproti tomu definován jako fyzikální, chemický či emoční faktor, který způsobuje fyzické či duševní napětí a může být kauzálním faktorem nemoci. Stresové odpovědi mohou být specifické pro daný stresový faktor, případně mohou být generalizované a nespecifické. Bolest je vždy stresující, ale stres nemusí být nutně bolestivý [5, 6].
Od 60. let minulého století je známa existence bolesti u dětí, nicméně u novorozenců jako preverbálních jedinců není příliš velká snaha se problematikou bolesti hlouběji zabývat, až do poloviny 80. let je dominantním principem péče o novorozence snaha o přežití, podávaní anestezie není rutinní záležitostí ani na velkých pracovištích.
V uplynulých 25 letech bylo publikováno několik set prací popisujících bolest novorozence a bylo vytvořeno více než 40 schémat, hodnotících projevy bolesti u novorozenců. Společnými znaky těchto hodnotících schémat je implementace behaviorálních, fyziologických a v některých případech i biologických a konceptuálních projevů bolesti u dětí. Prakticky všechna schémata a škály se zaměřují na popis akutní, procedurální bolesti a nevšímají si projevů bolesti chronické (např. zánětlivé). Jen minimum hodnotících kritérií popisuje bolest nezralých, předčasně narozených dětí, zejména narozených před 27. týdnem gestace.
Důsledky bolesti u novorozenců a dětí
Bolest nemůže být u dětí na JIRP zcela eliminována, nicméně lze učinit řadu opatření pro její prevenci a minimalizaci. Expozice bolestivým podnětům nemá jen krátkodobé důsledky, ale i řadu objektivně prokázaných dlouhodobých následků. Okamžité odpovědi na bolest zahrnují změny fyziologických parametrů (srdeční akce, saturace O2, změny intrakraniálního tlaku, systémového krevního tlaku) i zvýšenou incidenci závažných komplikací (intrakraniální krvácení). Dlouhodobé efekty pak představují zhoršení či poruchu percepce bolesti, chronické bolestivé syndromy, opakovaná bolest u nezralého novorozence pak může způsobit poruchy pozornosti, poruchy učení a chování v pozdějším věku, ale i poruchu percepce bolesti, přetrvávající až do adolescence, neuroanatomické abnormality, emoční a behaviorální instabilitu a poruchy učení [7, 8, 9, 10].
Analgezie při operačních výkonech a velkých procedurách je poměrně dobře zvládnuta, méně se ale myslí na opakované, bolestivé podněty při běžné péči – procedurální bolest.
Bolest u nezralých
Léčba a prevence bolesti je důležitá nejen pro zajištění pohodlí dítěte, ale i z etických důvodů, současně ale i jako předcházení akutním a chronickým důsledkům opakované bolesti [11, 12]. Kritickým obdobím vývoje a organizace nervového systému plodu je třetí trimestr gravidity. U dětí předčasně narozených je to období, kdy je dítě vystaveno na JIRP bolestivým podnětům [13, 14].
Opakované bolestivé podněty u nezralých, přicházející ve fázi intenzivního neurologického vývoje, mohou vyvolat v nervovém systému strukturální a fyziologické změny. Možnými důsledky jsou snížení prahu bolesti, hypersenzitivita na bolestivé podněty (hyperalgezie), případně allodynie (vnímání nebolestivých podnětů jako bolestivých) [15].
Bolest v časných fázích vývoje jedince, anatomický a neuroendokrinní substrát bolesti
Nezralí novorozenci mají potenciál vnímat a vyjadřovat bolest [17]. Základními předpoklady tohoto faktu jsou:
- a) hustota nociceptivních vláken a zakončení v kůži novorozence u nezralého je vyšší než u zralého dítěte a dospělého,
- b) nekompletní myelinizace nervových vláken nebrání přenosu bolestivých signálů, respektive netlumí jej,
- c) anatomicky malé vzdálenosti mezi jednotlivými etážemi nervových drah či řetězce kompenzují případné zpomalení vedení bolestivého podnětu,
- d) neurotransmitery jsou přítomny v dostatečné koncentraci,
- e) receptivní pole či plochy neuronů v somatosenzorickém kortexu jsou dostatečně velké.
Přenos bolesti je u novorozence velmi dobře vyvinut, a to i u nezralého, ale nezralé a nedostatečně vyvinuté jsou modulační mechanismy, proto se nezralí obtížně vyrovnávají s aferentními bolestivými impulzy [18, 19].
Důležitým faktem je existence opožděné maturace descendentních inhibičních drah ze supraspinální oblasti, opožděná maturace interneuronů v substantia gelatinosa a možný deficit inhibičních neurotransmiterů.
Excitační neurotransmitery jsou přítomny při porodu v dostatečném množství, jejich aktivita ale není vyvážena deficitním množstvím inhibičních neurotransmiterů. Chybějící či nedostatečná modulační aktivita u nezralých vede ke zvýšené excitabilitě v dorzálních míšních rozích [29].
Intrauterinní vývoj anatomického substrátu bolesti
- Kožní receptory pro bolest se vyvíjejí od 7. týdne gestace.
- Senzorická vlákna okolo úst od 8. gestačního týdne, ve dlaních od 10. gestačního týdne.
- Thalamokortikální spojení jsou prokazatelná od 13. týdne gestace.
- Produkce substance P jako dominantního mediátoru bolesti je prokazatelná ve druhém trimestru.
- EEG aktivita fétu je prokazatelná od 19. gestačního týdne.
- V dorzálních míšních rozích existuje převaha nociceptivních neuronů excitačních nad inhibičními až do porodu.
Nejcitlivější částí těla nezralého novorozence je ploska nohou a dolní končetiny obecně z důvodu fyziologického vyzrávání descendentních inhibičních drah, které se postupně organizují kraniokaudálním směrem.
U extrémně nezralých dětí vede bolestivý podnět k hyperalgezii, trvající více než 60 minut [20, 21].
Procedurální bolest na jednotkách intenzivní péče pro novorozence
Velmi podrobná práce, týkající se bolesti nezralých, byla publikována v roce 2004 [7). Její základní závěry jsou:
- bolest je spolehlivě percipována i dítětem, narozeným ve 23. týdnu gestace,
- na JIRP během prvních 14 dnů pobytu u dětí, narozených před 28. gestačním týdnem, se uskuteční v průměru 2–14 bolestivých procedur denně,
- hodnoceno 151 dětí na NICU v USA a Holandsku – pouze 35 % dětí dostávalo nějakou formu analgezie,
- hodnoceno celkem 31 typů procedur a výkonů, běžných na NICU, z nich bylo 26 vnímáno jako bolestivých podle speciálně pro tuto studii sestavené škály,
- čím nezralejší dítě, čím vyšší frekvence bolestivých stimulů.
V práci bylo zahrnuto celkem 151 nezralých novorozenců, hodnoceno 1375 lůžkodnů a celkově 19 674 procedur.
Tabulka 1 uvádí přehled incidence bolestivých výkonů na jednotce intenzivní péče.
Tab. 1. Bolestivé výkony na jednotce intenzivní péče – incidence. 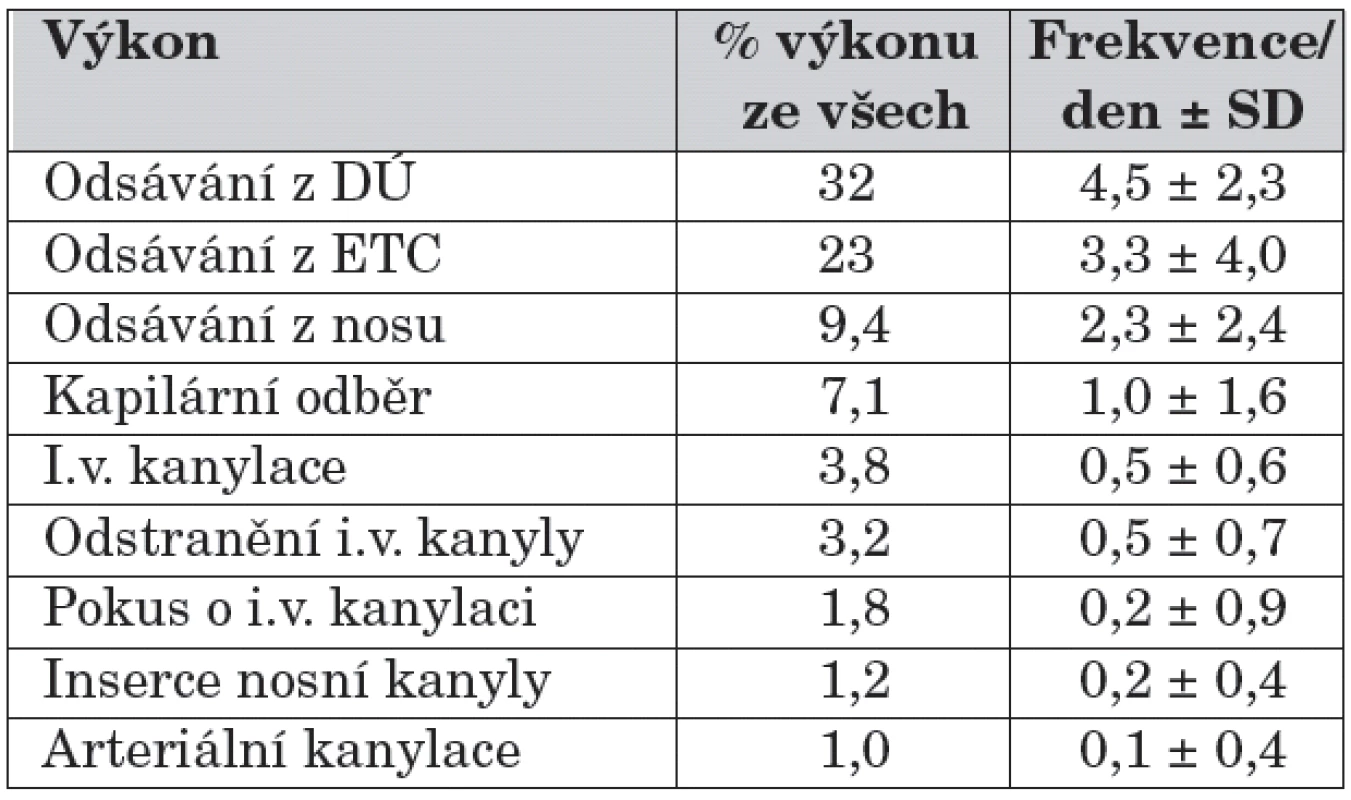
Přibližně 30 % všech bolestivých výkonů na NICU jde na vrub neúspěšných pokusů při zavádění periferních a centrálních katétrů či při odběrech materiálu k vyšetření.
Skórování bolesti – hodnotící škály
V uplynulých 25 letech bylo publikováno více než 40 skórovacích schémat a hodnotících škál bolesti [22]. Jen některé z nich byly obecně uznány jako validní, jejich obecnou charakteristikou je implementace behaviorálních a fyziologických parametrů, některá schémata vřazují navíc biologické a konceptuální faktory (tab. 2).
Tab. 2. Základní indikátory procedurální bolesti. 
Exaktní měření bolesti u neverbálních pacientů je stále nedokonalé. Bolest a agitovanost, stres nejsou někdy ideálně rozlišitelné, agitace je obecný pojem pro dítě, které je neztišitelné, pláče, nespí, naříká. Důvodů je řada – mateřská separace, hlad, ventilační faktory, neznámé faktory, ale i bolest. Ale také zánět, meningitida atd.
Je obtížné doporučovat konkrétní skórovací systém či škálu pro univerzální použití v neonatologii. Všechna existující schémata jsou zatížena jistými nedostatky (nepřesnost, časová náročnost, nemožnost použití u dětí všech gestačních kategorií). Je důležité, pokud se dané pracoviště rozhodne zavést do praxe konkrétní skórovací škálu, aby si personál zásady hodnocení osvojil, aby uměl reagovat na odpovědi dětí na bolestivý podnět a aby se snažil změnit pravidla prevence bolesti ve prospěch dětí.
Stále chybí validní měření pokračující či chronické bolesti, které je obtížné, protože eventuální zjišťování pokračující bolesti je ovlivněno řadou dalších proměnných – hypoxie, abnormální postura, další stresory [23, 24].
I. Behaviorální indikátory
Behaviorální indikátory zahrnují tyto kategorie:
- faciální grimasování a mimika
- pohyby končetin a změny svalového tonu
- pláč (spektrální analýza)
Behaviorální indikátory jsou nejméně ovlivněny medikací, preexistujícím onemocněním, předchozí bolestivou zkušeností [25, 26].
Řada prací potvrzuje, že behaviorální faktory a speciálně faciální změny a mimika jsou nejcitlivějšími indikátory nejen akutní, ale i krátce trvající bolesti u novorozence. Spolehlivou škálou je NCFS (Neonatal Facial Coding System), ten je použitelný pro děti od 30. týdne gestace, má ze všech schémat nejvyšší specificitu a senzitivitu [27]:
- svraštění obočí
- pevné sevření víček
- prohloubení nazolabiální rýhy
- roztažení rtů
- vertikální protažení úst
- horizontální protažení úst
- cupping jazyka
- třes brady
- sešpulení úst
- protruze jazyka
Praktická realizace hodnocení NFCS je poněkud obtížná, vyžadující videodokumentaci reakcí dítěte na bolest, a proto se v praxi JIP tato škála málo využívá.
Některé pohyby rukou a končetin jsou pro bolestivé odpovědi novorozenců (i nezralých) specifické a přispívají k poznání bolestivých reakcí dítěte [28].
Obecné, generalizované pohyby končetin: flexe horních a dolních končetin, extenze horních a dolních končetin, škubnutí, trhnutí končetin
Specifické pohyby končetin: a) ruka na tváři, b) „sezení“ ve vzduchu, c) salutování, d) „letadlo“ (schéma 1).
Schéma 1. Specifické pohyby končetin: a) ruka na tváři, b) „sezení“ ve vzduchu, c) salutování, d) „letadlo“. 
Specifické pohyby rukou: finger splay (dorzální extenze prstů), sevření pěsti – fisting (obr. 1, 2).
Obr. 1. Sevření pěsti. Fig. 1. Fisting. 
Obr. 2. Dorzální extenze prstů. Fig. 2. Finger splay. 
II. Fyziologické indikátory
Nejčastěji hodnocenými indikátory jsou: změny srdeční akce, dechové frekvence, krevního tlaku, saturace kyslíku, variabilita srdeční frekvence, změny nitrolebního tlaku, palmární pocení, stav spánku a bdění, změny svalového napětí [30, 31, 33].
Limitací použití fyziologických indikátorů bolesti je fakt, že všechny indikátory mohou být ovlivněny rovněž preexistujícím onemocněním.
III. Biologické markery bolesti
Jednoznačně klinicky použitelný biologický marker bolesti není zatím definován [16].
International Association for Study of Pain (IASP) považuje za validní tato schémata:
- NIPS (Neonatal Infant Pain Scale)
- PIPP (Premature Infant Pain Profile)
- CRIES (Crying, Requires O2, Increase vital signs, Expression, Sleepless)
- NFCS (Neonatal Facial Coding System)
Schémata NIPS a PIPP především pro akutní procedurální bolest, CRIES pro postoperační bolest.
Pro pokračující či přetrvávající, trvalou bolest se nejlépe hodí škála EDIN (Echelle Douleur Inconfort Nouveau-Né).
Možnosti prevence bolesti na novorozeneckém oddělení
Přehled možností analgetického působení u novorozenců uvádí tabulka 3.
Tab. 3. Přehled možností analgetického působení u novorozenců. 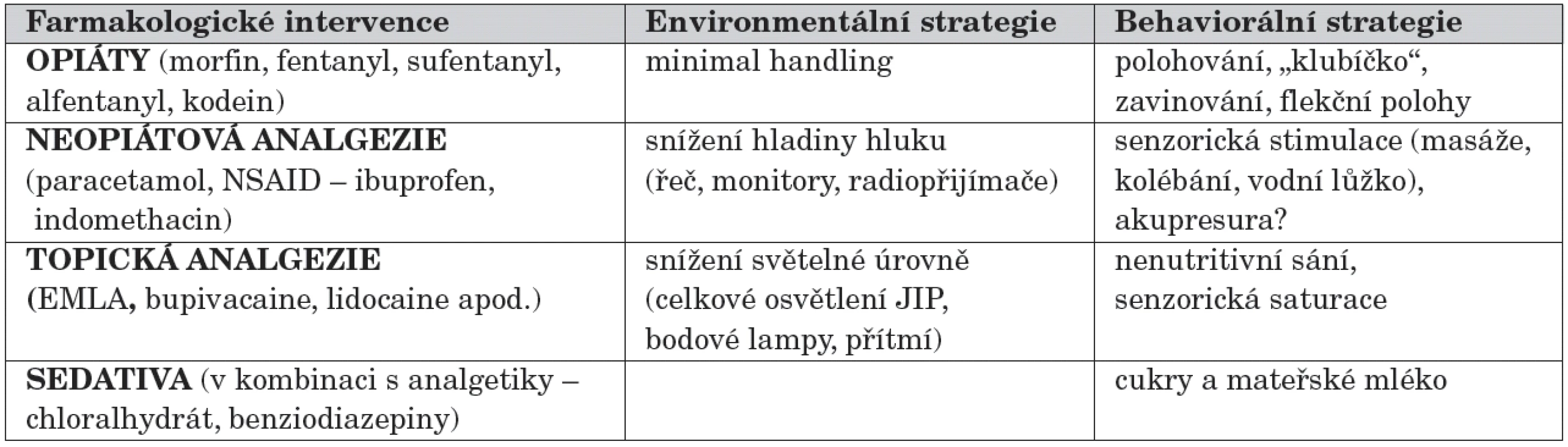
Nefarmakologická prevence je dnes dominantní metodou, využívanou pro procedurální bolest. Zahrnuje behaviorální postupy (aplikaci cukerných roztoků, mateřského mléka, senzorickou stimulaci, polohování…) a environmentální postupy (především minimal handling, úprava světelné a hlukové situace na JIRP apod.) [35].
Cukry
Na novorozeneckých jednotkách a odděleních se obecně používají sacharóza či glukóza v koncentraci od 10 do 66 %, efekt je zřejmý i u dětí do 30. týdne gestace [34, 36].
Bylo publikováno více než 40 prací, spolehlivě prokazujících analgetický efekt cukrů, první randomizovaná práce byla publikována v roce 1995. Cukry se používají v objemech od 0,05 do 1,5 ml jednorázově či opakovaně (před, v průběhu a po bolestivém podnětu), optimálně v kombinaci s nenutritivním sáním.
Mechanismus působení je dán pravděpodobně nejen působením na opiátové receptory se zvýšením hladiny ß endorfinů, ale velmi pravděpodobně i uvolněním inzulinu a jeho následným působením na dopaminergní receptory v CNS, účinek závisí také na gestačním věku a vývoji interakcí mezi chuťovými drahami a drahami bolesti.
Rizika podávání cukrů jsou minimální, dosud byla popsána pouze v jedné studii vyšší incidence lehkých forem nekrotizující enterokolitidy (NEC) u extrémně nezralých novorozenců, nicméně práce nebyla randomizována a výsledek dále nebyl potvrzen další prací.
Kontraindikace podávání cukrů není známa, snad jen existujcí NEC [37].
Protokol novorozeneckého oddělení KNTB Zlín
Návrh protokolu JIRP Zlín vychází z protokolu Texas Children´s Medical Center z roku 2003.
Návrh protokolu – analgezie při bolestivých výkonech – sacharóza či glukóza + nenutritivní sání – JIRP Perinatologického centra Zlín:
Indikace na JIRP a intermediárním oddělení
- kapilární odběry
- venepunkce
- zavádění arteriálních katétrů, pupečních katétrů
- zavádění centrálních žilních katétrů
- odstraňování adhezivních náplastí
- intramuskulární injekce, subkutánní injekce
- další bolestivé výkony (evakuace abscesu, snesení kožního výrůstku, odsávání)
Indikace na úseku fyziologických novorozenců
- kapilární odběry (Astrup, glykémie) a venepunkce
- screening – odběr krve z paty
- perforace boltce při nasazování náušnic
- další bolestivé výkony (evakuace abscesu, snesení kožních výrůstků apod.)
Kontraindikace:
- NEC
Relativní kontraindikace:
- nutnost systémové farmakologické analgetické intervence
Provedení:
- lékarna nachystá námi požadovaný roztok sacharózy v příslušné koncentraci, na oddělení k dispozici 25% roztok sacharózy v 50 či 100ml lahvičce
- objem podané látky během jednoho výkonu 0,1 ml (sladký roztok podáván na šidítku, štětečku, injekční stříkačkou, případně na prstu)
- způsob podání – 1–2 minuty před výkonem (+ v průběhu výkonu + je možno i 1–2 minuty po výkonu)
- současně nenutritivní sání (šidítko, štěteček), cukr lze podat p.o. i pomocí injekční stříkačky či na prstu
Poznámka:
- jedno namočení šidítka do roztoku či na štětečku = cca 0,1 ml roztoku
- během dne maximálně 2–2,5 ml roztoku jednomu dítěti
Součástí analgetického protokolu je:
Environmentální strategie
- snížení hladiny hluku a světelných vjemů
- minimal handling
- tyto aktivity prokazatelně snižují hladinu sérového kortizolu, zabraňují epizodám tachykardie, desaturacím, prodlužují periody spánku, zlepšují růstové parametry a přispívají k normalizaci cirkadiánního rytmu
Behaviorální strategie
- polohování, polštáře, matrace, „klubíčko“, nebolestivé senzorické stimulace
- tyto aktivity stimulují proprioceptivní, termoregulační a senzorické dráhy
- přispívají ke stabilizaci cyklu spánku a bdění, snižují epizody pláče po bolestivých podnětech
Senzorická saturace
Principem senzorické saturace je analgetické působení na více úrovních, zahrnuje taktilní stimulaci, vizuální kontakt, vestibulární stimulaci, chuťovou, čichovou a zvukovou saturaci.
Praktické provedení: dítě v poloze na boku, flekční poloha, zrakový kontakt s dítětem, jemné masáže zad a taktilní kontakt s tváří dítěte, tichá mluva, dezinfekce rukou gely s vůní, p.o. aplikace sacharózy [32, 38].
Senzorická saturace na více úrovních efektivně blokuje nociceptivní transmisi (gate closed theory), jedná se pravděpodobně o jeden z nejúčinnějších způsobů prevence procedurální bolesti.
Závěr a doporučení
I když je problematika bolesti u novorozence dobře známa a popsaná, zůstává řada nevyřešených otázek:
Žádné z používaných schémat hodnocení bolesti není „zlatým standardem“, všechna schémata mají své nedostatky, především nehodnotí chronickou bolest a s výjimkou dvou schémat ani bolest u nezralých novorozenců.
Biologické markery (změny sérové hladiny kortizolu, katecholaminů apod.) nejsou prakticky využitelné, využití vyšetření jiných materiálů než krve (např. sliny) je náročnější a nepříliš použitelné pro procedurální bolest.
Je odhadováno, že postupy prevence bolesti při běžných výkonech má zpracována necelá polovina JIRP v Evropě, nicméně prakticky je používá méně než 30 % pracovišť.
Personál nemá vždy dostatečné znalosti o podstatě bolesti, neidentifikuje běžné výkony denní praxe jako bolestivé.
Lze doporučit, aby JIRP měla zpracován protokol prevence procedurální bolesti, dodržovala jej, případně aplikovala některý z validních, známých a popsaných protokolů bolesti. Je možno doporučit protokol, který je používán na novorozeneckém oddělení nemocnice ve Zlíně, tento protokol je možno modifikovat podle místních podmínek na jednotlivých pracovištích.
Práce je věnována životnímu jubileu doc. MUDr. Františka Bauera, PhD., mim. prof.
Došlo: 26. 7. 2010
Přijato: 3. 8. 2010
prim. MUDr. Jozef Macko
Novorozenecké oddělení
Krajská nemocnice Tomáše Bati, a.s.
Havlíčkovo nábřeží 600
760 01 Zlín
e-mail: macko@bnzlin.cz
Zdroje
1. Anand KJ, Hickey PR. Pain and its effects in the human neonate and fetus. N. Engl. J. Med. 1987; 317(21): 1321–1329.
2. Anand KJ, Carr DB. The neuroanatomy, neurophysiology, and neurochemistry of pain, stress, and analgesia in newborns and children. Pediatr. Clin. North Am. 1989; 36(4): 795–822.
3. Clancy GT, Anand KJ, Lally P. Neonatal pain management. Crit. Care Nurs. Clin. North Am. 1992; 4(3): 527–535.
4. Anand KJ, Craig KD. New perspectives on the definition of pain. Pain 1996; 67(1): 3–6; discussion 209–211.
5. Prevention and Management of Pain and Stress in the Neonate. American Academy of Pediatrics and Canadian Paediatric Society. Pediatrics 2000; 105(2): 454–461.
6. Mitchell A, Boss BJ. Adverse effects of pain on the nervous systems of newborns and young children: a review of literature. J. Neurosci. 2002; 34(5): 228–236.
7. Simons SHP, van Dijk M, Anand KS, et al. Do we still hurt newborn babies? A prospective study of procedural pain and analgesia in neonates. Arch. Pediatr. Adolesc. Med. 2003; 157(11): 1058–1064.
8. Anand KJ, Scalzo FM. Can adverse neonatal experiences alter brain development and subsequent behavior? Biol. Neonate 2000; 77(2): 69–82.
9. Anand KJ. Effects of perinatal pain and stress. Progress in Brain Research 2000; 122 : 117–129.
10. Porter FL, Grunau RE, Anand KJ. Long-term effects of pain in infants. Journal of Developmental and Behavioral Pediatrics (JDBP) 1999; 20(4): 253–261.
11. Porter FL, Wolf CM, Miller JP. The effect of handling and immoblization on the response to acute pain in newborn infants. Pediatrics 1998; 102 (6): 1383–1389.
12. Thompson DG. Utilizing an oral sucrose solution to minimize neonatal pain. Journal for Specialists in Pediatric Nursing 2005; 10(1): 3–10.
13. Chiswick ML. Assessment of pain in neonates. Lancet Jan 2000; 355(9197): 6–8.
14. Holsti L, Grunau RE. Extremity movements help occupational therapists identify stress responses in preterm infants in the neonatal intensive care unit: A systematic review. Can. J. Occup. Ther. 2007; 74(3): 183–194.
15. Rourke DO´. The measurement of pain in infants, children and adolescents – from policy to practice. Phys. Ther. 2004; 84(6): 560–570.
16. Jett PA, Samuels MH, Mc Daniel PA, Benda GI, et al. Variability of plasma cortisol levels in extremely low birth weight infants. J. Clin. Endocrinol. Metabol. 1997; 82(9): 2921–2925.
17. Grunau RE, Oberlander TF, Whitfield MF, Fitzgerald C, Lee SK. Demographis and therapeutic determinantns of pain reactivity in very low bitrh weight neonates at 32 weeks postconceptional age. Pediatrics 2001; 107 : 105–112.
18. Holsti L, Grunau R, Whitfield M. Behavioural responsivenes to pain are heightened after clustered care in preterm infants born between 30 and 32 weeks gestational age. Clin. J. Pain 2006; 22(9): 757–764.
19. Morison SJ, Grunau RE, Oberlander TF, Whitfield MF. Relations between behavoural and cardiac autonomic reactivity to acute pain in preterm infants. Clin. J. Pain 2001; 17(4): 350–358.
20. Lindh V, Wicklund U, Hakansson S. Heel lancing in term newborn infants: an evaluation of pain by frequency domain analysis of heart rate variability. Pain 1999; 80 : 143–148.
21. Hummel P, van Dijk M. Pain assessment: Current status and challenges. Sem. Fetal. Neonat. Med. 2006; 11(4): 237–245.
22. Porter FL., Wolf CM, Miller JP. The effect of handling and immoblization on the response to acute pain in newborn infants. Pediatrics 1998; 102(6): 1383–1389.
23. Thompson DG. Utilizing an oral sucrose solution to minimize neonatal pain. Journal for Specialists in Pediatric Nursing 2005; 10(1): 3–10.
24. Mc Kechnie L, Levene M. Procedural pain guidelines for the newborn i the United Kingdom. J. Perinatol. 2008; 28 : 107–111.
25. Fellman V. Pain in newborn infants - fictions and facts. Acta Paediatr. 2007; 96 : 952–953.
26. Gray PH, Trotter JA, Landbridge P, Doherty CV. Pain relief for neonates in Australian hospitals: A need to improve evidence.based practice. J. Pediatr. Child Health 2006; 42 : 10–13.
27. Stevens B, Gibbins S, Franck LS. Treatment of pain in the neonatal intensive care unit. Pediat. Clin. North Am. 2000; 47(3): 633–650.
28. Bellieni CV, Bagnoli F, Buonocore G. Alone no more: Pain in premature infants. Ethics and Medicine 2003; 19(1): 5–10.
29. Fitzgerald M. The development of nociceptive circuits. Focus on Pain 2005< 6 : 507–520.
30. Bellieni C. Pain definitions revised : newborns not only feel pain, they also suffer. Ethics Med. 2005; 21(1): 5–9.
31. Ranger M, Johnston CC, Anand KJS. Current controversie regarding pain in neonates. Semin. Perinatol. 2007; 31(5): 283–288.
32. Bellieni CV, Buonocore G, Nenci A, Franci N, Cordelli DM, Bagnoli F. Sensorial saturation – an effective analgesic tool for heel prick in preterm infants. Biology of the Neonate 2001; 80(1): 15–18.
33. Stevens BJ, Johnston CC. Physiological responses of premature infants to a painful stimulus. Nursing Research 1994; 43(4): 226–230.
34. Anand KJS. Pain assessment in preterm infants. Pediatrics 2007; 119(3): 605–607.
35. Simons S, van Dijk M, Anand KJS, Roofthooft D, van Lingen R, Tibboel D. Do we still hurt newborn babies? Arch. Pediatr. Adolesc. Med. 2003; 157 : 1058–1064.
36. Anand KJS, Aranda JV, Berde CB, Buckham S, Caparelli EV, Carlo W, Hummel P, et al. Summary proceedings from the neonatal pain control group. Pediatrics 2006; 117: S9–S22.
37. Abu Saad HH, Bours GJJW, Stevens B, Hamers JPH. Assessment of pain in the neonate. Sem. Perinatol. 1988; 22(5): 402–416.
38. Golianu B, Krane E, Seybold J, Almgren Ch, Anand KJS. Non-pharmagological techniques for pain management for pain in neonates. Semin. Perinatol. 2007; 31(5): 318–322.
Štítky
Neonatologie Pediatrie Praktické lékařství pro děti a dorost
Článek vyšel v časopiseČesko-slovenská pediatrie
Nejčtenější tento týden
2010 Číslo 10- Horní limit denní dávky vitaminu D: Jaké množství je ještě bezpečné?
- Isoprinosin je bezpečný a účinný v léčbě pacientů s akutní respirační virovou infekcí
- Syndrom Noonanové: etiologie, diagnostika a terapie
-
Všechny články tohoto čísla
- Editorial
- Doc. MUDr. Oldřich Pozler, CSc., šedesátníkem
- Profylaxia včasnej streptokokovej sepsy novorodencov
- Hospitalizácie detí pre bronchiolitídu na Slovensku v rokoch 1996–2006
- Význam molekulárně genetického vyšetření pro diagnostiku a genetické poradenství v rodinách s hyperamonémií a deficitem ornithin-karbamoyltransferázy
- Fetomaternálne krvácanie ako príčina závažnej anémie novorodenca
- Procedurální bolest novorozence – možnosti prevence a tišení
- Problematika zkrácené podjazykové uzdičky
- Špecifiká vybraných porúch spánku v detskom veku
- Prenatální účinky alkoholu
- Léčba závislosti na tabáku u adolescentních kuřáků – nové, důležité a obtížné téma v medicíně
- Některé kontroverze v gynekologii a porodnictví
- Česko-slovenská pediatrie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Problematika zkrácené podjazykové uzdičky
- Prenatální účinky alkoholu
- Profylaxia včasnej streptokokovej sepsy novorodencov
- Fetomaternálne krvácanie ako príčina závažnej anémie novorodenca
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



