-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Pseudotumory centrálního nervového systému
Pseudotumors of the central nervous system
The histopathological differentiation of the pseudoneoplastic lesions from the tumors of the central nervous system (CNS) is not easy in a proportion of cases and the risk of diagnostic misinterpretation in biopsies of the CNS remains relatively high. Here we discuss selected CNS lesions, which can be easily mistaken for a tumor, particularly in the absence of relevant clinical and neuroradiological data - gliosis, tumefactive demyelination, radionecrosis and focal cortical dysplasia. With the exception of the recently available IDH1 immunohistochemistry, there is a lack of simple and reliable histochemical or molecular markers which could facilitate this differential diagnosis. To avoid a diagnostic error, pathologists have to rely on careful microscopic analysis along with its correlation with clinical data and neuroradiological findings.
Keywords:
pseudotumor – brain biopsy – glioma – gliosis – demyelination – radionecrosis
Autoři: J. Zámečník 1; L. Mrázková 2
Působiště autorů: Ústav patologie a molekulární medicíny, 2. LF UK a FN Motol, Praha 1; Klinika zobrazovacích metod, 2. LF UK a FN Motol, Praha 2
Vyšlo v časopise: Čes.-slov. Patol., 48, 2012, No. 4, p. 184-189
Kategorie: Přehledový článek
Souhrn
Rozlišení pseudotumorózních lézí centrálního nervového systému (CNS) od nádorové proliferace není v některých případech jednoduché a riziko diagnostické chyby je v biopsiích CNS poměrně vysoké. V textu jsou diskutovány vybrané léze CNS, které mohou být snadno chybně označeny za nádorový proces, zvláště při absenci relevantních klinických a neuroradiologických dat – glióza, tumoriformní demyelinizace, radionekróza či fokální kortikální dysplazie. Snad s výjimkou nově dostupného imunohistochemického průkazu mutovaného proteinu IDH-1 zatím nejsou k dispozici histochemické či molekulární markery, které by tuto náročnou diferenciální diagnostiku výrazně usnadnily. Nezbývá než se opřít o pečlivou mikroskopickou analýzu v korelaci s klinickými daty a neuroradiologickým nálezem.
Klíčová slova:
pseudotumor – biopsie mozku – gliom – glióza – demyelinizace – radionekróza
Riziko diagnostické chyby je v biopsiích centrálního nervového systému (CNS) poměrně vysoké. Většinou není možné makroskopické posouzení, bioptický vzorek bývá navíc často hraničně reprezentativní, což však neplatí jen pro stereotaktické punkční biopsie, ale i pro operace s využitím minimálně invazivních operačních technik. Proto je pro neuropatologa důležitá alespoň základní znalost možností MRI zobrazení a samozřejmě úzká spolupráce s neuroradiologiem.
V následujícím textu jsou diskutovány vybrané nejčastější léze CNS, které mohou být snadno chybně označeny za nádorový proces, zvláště při absenci relevantních klinických a neuroradiologických dat – glióza, tumoriformní demyelinizace, radionekróza a fokální kortikální dysplazie. Vzácně se však v diferenciální diagnostice nádorů CNS můžeme setkat i se zánětlivým pseudotumorem (1,2), tzv. kalcifikujícím pseudotumorem CNS (3), meningoangiomatózou (4) nebo lymfocytární hypofyzitidou (5).
GLIÓZA
Rozlišení reaktivní proliferace glie od gliového nádoru patří snad mezi nejnáročnější diferenciální diagnostiku v bioptické neuropatologii. Protože glióza vzniká v důsledku jiného patologického procesu, správná interpretace významu proliferace gliových buněk ve vzorku musí být založena na poměrně podrobných znalostech klinických údajů (věk, trvání symptomů, lokalizace léze atp.) a MRI zobrazení.
Z hlediska diferenciální diagnostiky vůči nádorům CNS je třeba rozlišit subakutní a chronickou gliózu fibrilárního typu, která může mikroskopicky imitovat difúzní fibrilární astrocytom, a dále gliózu piloidní, která může svést k diagnóze pilocytárního astrocytomu.
Fibrilární glióza
V časných fázích rozvoje gliózy z fibrilárních astrocytů dochází k jejich hypertrofii, ke zmnožení a zesílení buněčných výběžků i ke zbytnění cytoplazmy, která je pak často homogenně eozinofilní. Na rozdíl od nádoru je ale počet aktivovaných astrocytů ve tkáni zhruba stejný jako za fyziologických podmínek a jejich distribuce je v oblasti gliózy poměrně rovnoměrná (6). Obojí pomůže ozřejmit imunohistochemický průkaz GFAP. V pozdějších fázích gliózy ubývá cytoplazmy astrocytů a dominují zmnožené gliové výběžky ve formě gliové jizvy. V chronickém stadiu gliového jizvení pak dochází k retrakci tkáně a na rozdíl od subakutní gliózy se mění i MRI obraz, čímž se stává diferenciální diagnostika chronické gliové jizvy vůči gliomu snadnější.
Glióza asociovaná s pseudotumory CNS
Reaktivní glióza doprovází řadu nenádorových lézí včetně demyelinizačních poruch, abscesů, postiradiačních změn nebo hojení hematomu. Význam těchto poruch v diferenciální diagnostice gliomů rozvádíme níže; zde je třeba zdůraznit, že gliózu, která se vyskytuje v rámci demyelinizačních procesů, mohou doprovázet výrazné jaderné atypie reaktivních astrocytů. U progresivní multifokální leukoencefalopatie (PML) může být morfologie virem napadených gliových buněk až bizarní; tyto buňky bývají dokonce výrazně p53 pozitivní (7), což dále zvyšuje riziko interpretace tohoto infekčního onemocnění jako nádorový proces.
Někdy může mikroskopicky astrocytární nádor imitovat i glióza vzniklá v okolí bakteriálních či mykotických abscesů (8) nebo dokonce tuberkulózy (9).
Glióza asociovaná s negliovými nádory CNS
Výrazná glióza se může vyskytnout v okolí mozkových metastáz, ale i v terénu mozkových lymfomů.
Pokus o stereotaktickou biopsii tuhé mozkové metastázy může někdy vést k tomu, že nádor bioptickou jehlu odtlačí stranou a odebrán je vzorek okolní gliózy. Proto je třeba vždy váhat s diagnózou reaktivní gliózy nebo fibrilárního astrocytomu (grade II), pokud je na MRI zobrazení postkontrastně se sytící ohraničené ložisko. Fibrilární astrocytomy mají jednak infiltrativní okraje, jednak se na MRI postkontrastně nesytí – postkontrastní sycení je typické spíše pro high-grade gliomy.
Infiltrace lymfomem způsobuje v mozkové tkáni rovněž hypertrofickou reakci astrocytů, navíc může lymfom svým způsobem růstu infiltrativní gliom napodobit (zejména ve zmraženém řezu)(10). Zvláště nebezpečné jsou případy, kdy byl pacient před biopsií léčen kortikosteroidy, neboť to může vést k transientnímu “vymizení” nádoru na MRI zobrazení, a dokonce i ve tkáni (11). Zde je třeba pátrat po angiocentrickém způsobu šíření lymfomu s perivaskulární a intramurální akumulací lymfoidních buněk v cévní stěně (někdy v tom pomůže znázornění retikulárních vláken) a hlavně po cytologických charakteristikách atypických lymfoidních buněk - velká vezikulární jádra, zářezy jaderné membrány ani výraznější jadérka nejsou pro gliové nádory charakteristické. Konečné slovo má v diferenciální diagnostice samozřejmě imunohistochemie.
Fibrilární glióza versus fibrilární astrocytom
Rozlišení subakutní fibrilární gliózy od difúzního fibrilárního astrocytomu může být na podkladě samotné histologie téměř nemožné, zvláště v malých vzorcích z infiltrativního okraje gliomu nebo z gliózou změněného okraje jiných procesů (12). Jak bylo naznačeno výše, při reaktivní glióze jsou astrocyty rozmístěné poměrně rovnoměrně, nedochází k tvorbě clusterů a po průkazu GFAP lze pozorovat abundantní jemné větvící se výběžky (obr. 1). Buňky difúzních infiltrujících gliomů mají naproti tomu méně uniformní distribuci ve tkáni, vznikají shluky buněk, mají proměnlivé množství perinukleární cytoplazmy i různé množství výběžků (obr. 1). Některé buňky jsou v gliomu vidět jen jako “nahá jádra”. Lze tak najednou pozorovat jak buňky téměř bez cytoplazmy, tak i buňky s bohatou eozinofilní cytoplazmou charakteru gemistocytů. Nádorové astrocyty mají také tendenci shlukovat se kolem neuronů, subpiálně nebo subependymálně (tzv. “sekundární struktury”). Některá jádra v astrocytomu mohou být velká a hyperchromní. Mitózy mohou být přítomny v obou procesech; atypická mitóza však svědčí pro nádorový charakter gliové proliferace.
Dalšími znaky, které jsou vlastní gliomům a v glióze chybějí, jsou přítomnost mikrocystického uspořádání a mikrokalcifikací. Je však třeba nezaměňovat tkáňový edém či mechanické poškození tkáně za mikrocystické uspořádání, zejména ve vzorcích, které prošly zmražením.
Imunohistochemie. Průkaz GFAP neumožní diferencovat mezi gliózou a gliomem, přeci jen lze ale v reaktivní glióze pozorovat rovnoměrněji rozložené buňky i jejich výběžky, často v kontaktu s cévami. Ki67 (MIB-1) rovněž příliš nepomůže, neboť určitý stupeň proliferace lze pozorovat u obou procesů (13). Imunohistochemický průkaz p53 onkoproteinu se zdál být slibným pro tuto diferenciální diagnózu (14), i když i to má svá omezení. p53 se akumuluje v jádrech u asi 60 % fibrilárních astrocytomů a asi v 80 % gemistocytárních astrocytomů (15); glióza je většinou negativní (kromě gliózy u PML). Imunohistochemický průkaz p53 může být tedy nápomocný, i když negativita gliom nevylučuje.
Poměrně nedávno se v této oblasti zablýsklo na lepší časy, i když i to není bez omezení. Část gliomů nese mutaci genu pro NADP+ -dependentní izocitrát dehydrogenázu-1 (IDH-1), která většinou postihuje jediný kodon (IDH132H). Tato mutace byla identifikovaná v části difúzních astrocytomů, oligodendrogliomů i části glioblastomů (sekundárních) a mutovaný protein lze v cytoplazmě i jádrech nádorových buněk identifikovat specifickou protilátkou (obr. 1) – blíže o této problematice viz přehledový článek M. Švajdlera jr. et al. (16). Podobně jako u průkazu p53 je ale i zde omezení - negativita IDH-1 infiltrující gliom nevylučuje. Pozitivita IDH1 také může pomoci odlišit difúzní fibrilární astrocytom od low-grade neinfiltrativních gliomů jako je třeba pilocytární astrocytom nebo gangliogliom. Recentně publikovaná studie ukázala, že kombinace imunohistochemického průkazu p53 a mutantní IDH-1 má senzitivitu pro rozlišení nádorové proliferace glie od reaktivní gliózy 71,4 %, ta se však zvýší na 95 %, pokud je do panelu přidáno vyšetření FISH na průkaz nadbytečného materiálu na chromozomu 7 (17).
Obr. 1. Fibrilární astrocytom versus glióza. 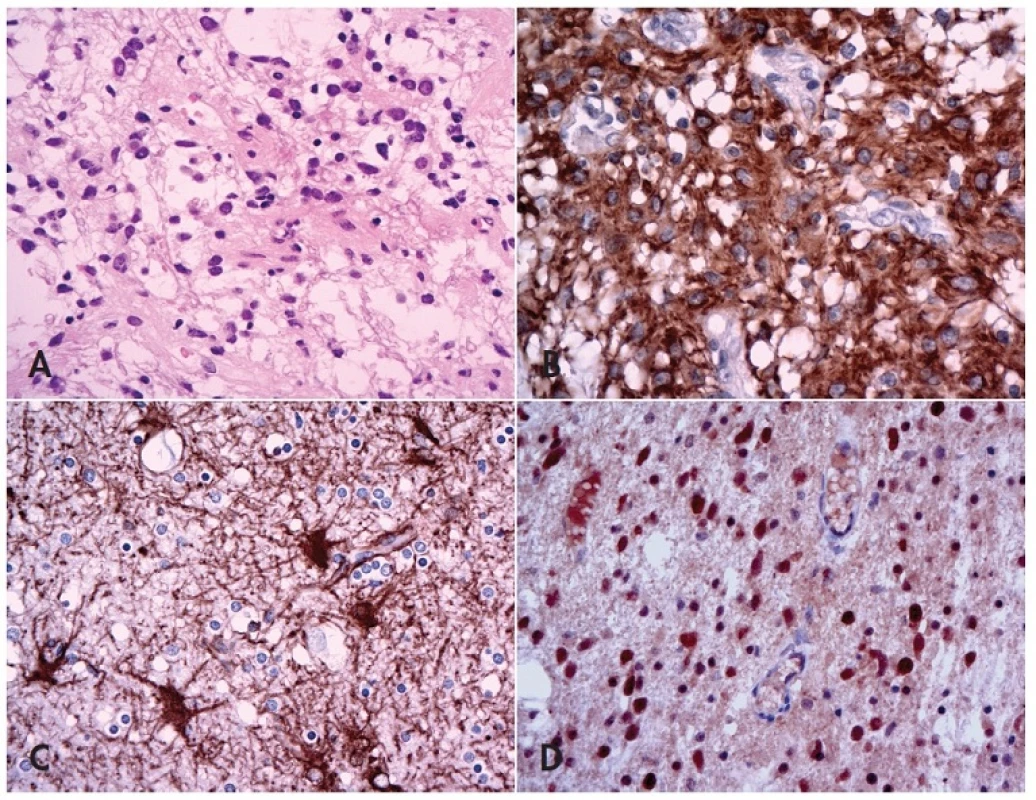
V difúzním fibrilárním astrocytomu lze kromě zvětšené buněčnosti pozorovat výraznější jaderné atypie, tendenci ke shlukování nádorových buněk a tvorbu mikrocystického uspořádání (A, HE, 400x). Na rozdíl od astrocytomu (B, 400x) jsou v imunohistochemickém průkazu GFAP při reaktivní glióze astrocyty rozmístěné poměrně rovnoměrně, nedochází k tvorbě clusterů a po průkazu GFAP lze pozorovat abundantní jemné větvící se výběžky (C, 200x; výřez 400x). Nádorové buňky fibrilárních astrocytomů mohou být (na rozdíl od gliózy) pozitivní v imunohistochemickém průkazu IDH-1 (D, 400x). Velké naděje byly vkládány i do markerů WT-1 a Nogo-A, což se však pozdějším průkazem pozitivity obou markerů jak v gliomech, tak i v reaktivních procesech ukázalo být jako předčasné (12,18). Jedna nová studie také ukazuje, že pro tuto diferenciální diagnostiku by mohla být užitečná imunoexprese receptoru pro epidermální růstový faktor (EGFR)(19), to však bude potřeba ještě ověřit.
Molekulární diagnostika. Odhalením mutací BRAF jako signatury low-grade neinfiltrativních tumorů (pilocytární astrocytom, gangliogliom, pleomorfní xantoastrocytom) nám dává do rukou další důležitý nástroj v diferenciální diagnóze gliomů (16). Spolehlivý a jednoznačný molekulární marker, který by pomohl odlišit astrocytární nádor od reaktivní proliferace gliových buněk, však zatím bohužel k dispozici není.
Piloidní glióza
Piloidní glióza je chronická forma gliózy charakteristická tvorbou protáhlých granulárních hypereozinofilních proteinových depozit složených z GFAP a αB-crystalinu (20), známých jako Rosenthalova vlákna (21). Ta jsou občas mylně považována za téměř diagnostická pro pilocytární astrocytom. Tento typ gliózy se ale typicky vyskytuje i ve stěně cystické komponenty negliových nádorů, jako je mozečkový hemangioblastom nebo supraselární kraniofaryngeom, které však pilocytární astrocytom mohou svými charakteristikami napodobit i na MRI zobrazení (mozeček a hypothalamus jsou dvěma oblastmi CNS, které obecně tímto typem gliózy reagují ochotně). Podobně bývá piloidní glióza přítomna ve stěně pineální cysty nebo v rámci syringomyelie. Rosenthalova vlákna jsou také výrazná v mozkové tkáni při jedné z leukodystrofií – při Alexandrově chorobě, která je způsobena mutacemi genu pro GFAP (22,23).
Tento typ gliového jizvení nenapodobuje difúzní fibrilární astrocytom, spíše je potřeba vyhnout se (pro přítomnost Rosenthalových vláken) chybné diagnóze pilocytárního astrocytomu.
TUMORIFORMNÍ DEMYELINIZACE
Roztroušená skleróza (RS) postihuje zejména bílou hmotu. Existuje však i tzv. leukokortikální varianta s postižením šedé hmoty bazálních ganglií nebo kortikálních perivaskulárních oblastí (24). Při klasické RS bývají na MRI zobrazení přítomny vícečetné dobře ohraničené subkortikálně nebo periventrikulárně lokalizované plaky s postkontrastním sycením na jejich periferii a bez známek expanzivního chování (“mass effect”) (25,26). V některých případech RS však chybí klasické MRI charakteristiky a přítomno může být jen jedno velké solitární ložisko se známkami expanzivního chování a perifokálním edémem (obr. 2). Obecně tyto vzácné formy při MRI zobrazení imitují infiltrativní high-grade gliomy (27,28). Velmi vzácně může být dokonce pozorována motýlovitá distribuce v corpus callosum, čímž léze věrně napodobuje glioblastom (29–31). I mikroskopický obraz těchto lézí může být zavádějící směrem k infiltrativnímu gliomu, zejména pokud je diagnóza stanovena z malého množství materiálu, který prošel zmražením v rámci peroperační biopsie – hypercelularita, pleomorfní astrocyty s různým stupněm jaderných atypií (což je u demyelinizační procesů poměrně častý jev), občasné mitózy a dokonce přítomnost drobných nekróz mohou zmást i zkušeného. Proto můžeme z vlastní zkušenosti doporučit provádění peroperačních nátěrových preparátů (“squash/smear preparation”), které umožní lepší cytologickou diferenciaci jednotlivých buněčných populací ve vyšetřované lézi – kromě astrocytů ozřejmí přítomnost lymfocytů a zejména makrofágů s pěnitou cytoplazmou. Nejlépe je však při pochybnostech peroperačně závěr nečinit a povzbudit neurochirurga k odběru většího množství materiálu, který by jednak neprošel zmražením, jednak by zastihl kromě centra léze i její periferní oblast s přechodem do nepostižené tkáně, což může být pro diagnózu zásadní.
Obr. 2. Tumoriformní demyelinizace. 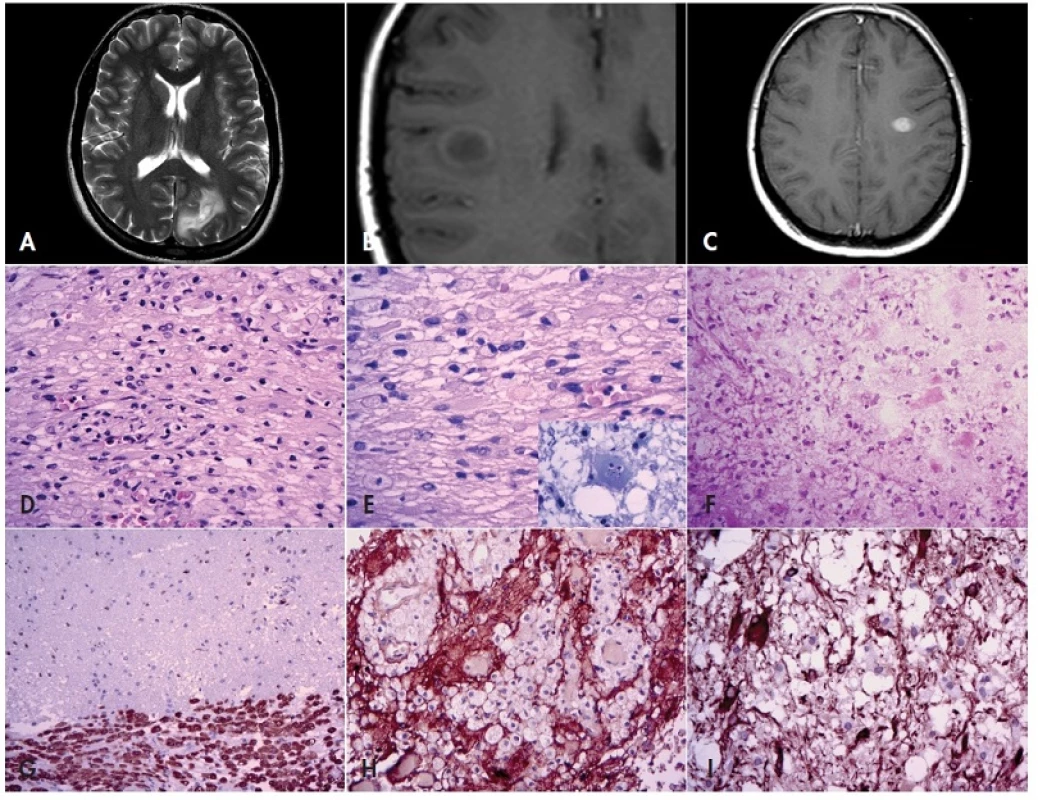
Solitární ložiska demyelinizace mohou na MRI napodobovat nádor (A – sekvence T2, axiální rovina; B - nativní sekvence T1, axiální rovina; C – sekvence T1 po aplikaci kontrastní látky, axiální rovina). Mikroskopicky jsou tyto buněčné léze tvořeny makrofágy s pěnitou cytoplazmou, gliovými buňkami a lymfocyty (D, E). Někdy lze pozorovat atypické buňky s fragmentovanými jádry – tzv. Creutzfeldtovy buňky (E, výřez). Ve zmraženém řezu však mohou pěnité makrofágy uniknout pozornosti, navíc, makrofágy i gliové buňky mohou jevit výrazné atypie (F). V imunohistochemické průkazu makrofágů (anti-CD68) je dobře patrné poměrně ostré ohraničení léze od okolního mozkového parenchymu (G). Imunohistochemický průkaz GFAP ozřejmí jak negativní makrofágy v intersticiu (H), tak i reaktivní astrocyty, které mohou jevit výrazné buněčné i jaderné atypie (I). Zvětšení 200x (D, F, G, H) a 400x (E, I). V definitivních parafinových řezech je pak třeba věnovat pozornost následujícímu (obr. 2)(31): léze obsahuje početné PAS+ pěnité makrofágy, ve kterých lze barvením luxolovou modří ozřejmit zbytky degradovaného myelinu a které jsou smíšeny s reaktivními multipolárními astrocyty. Makrofágy se typicky shromažďují perivaskulárně, společně s lymfocyty, které někdy tvoří perivaskulární pláště. Občas lze na periferii ložiska demyelinizace pozorovat atypické buňky s fragmentovanými jádry (tzv. Creutzfeldtovy buňky), což ale může věrně připomínat atypickou mitózu. Nekróza je velmi neobvyklá, může však být pozorována v rychle se rozvíjejících lézích. Dalším důležitým znakem je poměrně ostré ohraničení léze od sousední intaktní bílé hmoty. Imunohistochemický průkaz CD68 a lymfocytárních antigenů ozřejmí makrofágy a zánětlivé buňky (převážně T lymfocyty); průkaz neurofilament zase prokáže relativně intaktní axony. V průkazu GFAP lze pozorovat nepočetné nahodile lokalizované reaktivní astrocyty a jejich výběžky.
V zatím největší publikované studii 168 případů tumoriformní RS (32) byla zjištěna diagnostická neshoda až v 31 % případů. Nejčastěji byla tumoriformní RS diagnostikována jako low-grade astrocytom (39 %), high-grade astrocytom (15 %), méně často jako oligodendrogliom, mozkový infarkt, infekce nebo dokonce lymfom. Existuje několik mikroskopických znaků, které mohou s diagnostickým závěrem pomoci (viz tabulka č. 1).
Tab. 1. Diferenciální diagnostika tumoriformní demyelinizace. 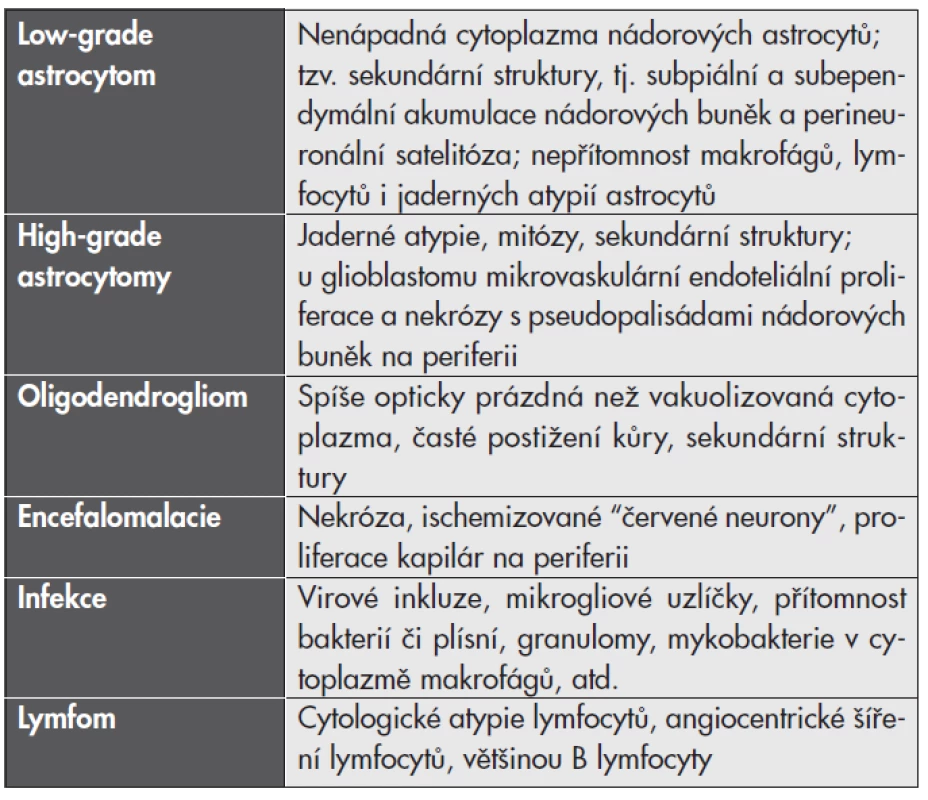
Znaky, kterými se jednotlivé jednotky od demyelinizace liší. I při maximální pečlivosti při mikroskopické analýze se však v hraničních případech neobejdeme bez korelace s klinickými a neuroradiologickými nálezy, nezřídka i s dalším vývojem onemocnění. Odlišení demyelinizace je extrémně důležité hlavně proto, že nesprávně indikovaná radioterapie může zánětlivý demyelinizační proces exacerbovat (31).
Progresivní multifokální leukoencefalopatie (PML) je jediným lidským virovým demyelinizačním onemocněním. Většina postižených jsou imunosuprimovaní jedinci, zejména s HIV infekcí (33), ale i v průběhu orgánových transplantací, při dlouhodobé léčbě kortikosteroidy a samozřejmě u hematologických malignit. Příčinou je JC virus, polyoma virus z rodiny Papoviridae. Klinické příznaky i neurologický deficit bývají pestré v závislosti na distribuci demyelinizovaných ložisek. Ta většinou bývají multifokální, vzácně však může být tendence ke splývání lézí a MRI zobrazení pak dělá dojem jednoho velkého ložiska, které může neuroradiologicky simulovat infiltrativní low-grade gliom.
Histologicky nalézáme všechny známky demyelinizace, ačkoli u HIV+ pacientů na antiretrovirové terapii bývá výrazně méně lymfocytární infiltrace. Cílem virové infekce jsou buňky oligodendroglie, které jeví cytopatický efekt virové infekce – zvětšení jader a přítomnost inkluzí barvy portského vína (34). Navíc, i infikované astrocyty mohou mít až bizarní hyperchromní jádra. Makrofágů zde ale bývá méně než u klasické RS nebo u organizující se encefalomalacie. Diagnózu lze konfirmovat imunohistochemickým průkazem virových antigenů nebo in situ hybridizací (34).
V případě velké splývající léze, která se na MRI jeví jako solitární ložisko, a ve které jsou na mikroskopické úrovni pozorovány výrazné jaderné atypie, může být PML snadno zaměněna za gliom, hlavně za astrocytom nebo oligoastrocytom. Typická silná imunopozitivita p53 v jádrech postižených gliových buněk (7) může být také zavádějící.
Vzácněji se může klinicko-neuroradiologicky prezentovat jako tumoriformní ložisko i akutní demyelinizační encefalomyelitida (ADEM) v dětství (35) či raritní koncentrická skleróza Baló (36).
RADIONEKRÓZA
Mezi komplikace kraniospinální radioterapie patří akutní postiradiační leukoencefalopatie a pak tzv. opožděná radionekróza. S akutní postiradiační leukoencefalopatií, při které dochází k poruše kapilár a degeneraci bílé hmoty (37), se patolog v diagnostické praxi nejspíše nesetká. Větším problémem je opožděná radionekróza, která je naštěstí nepříliš častou komplikací moderní radioterapie. Ve své klasické formě se objevuje po konvenční radioterapii nádorů oblasti hlavy a krku (celková dávka > 50 Gy). Klinicky a radiologicky se projevuje poměrně dramaticky jako postkontrastně se sytící masa s kolaterálním edémem, což věrně napodobuje high-grade gliom (38,39). Radionekróza postihuje převážně bílou hmotu, může ale zahrnout i kůru. Pokud má patolog bez anamnestických informací k dispozici jen drobný vzorek mozkové tkáně s koagulační nekrózou, s atypiemi reaktivních astrocytů (často mohou mít velká hyperchromní jádra) a s hyperplázií endotelu proliferujících kapilár, nemusí být cesta k chybné diagnóze glioblastomu příliš komplikovaná (obr. 3).
Obr. 3. Radionekróza. 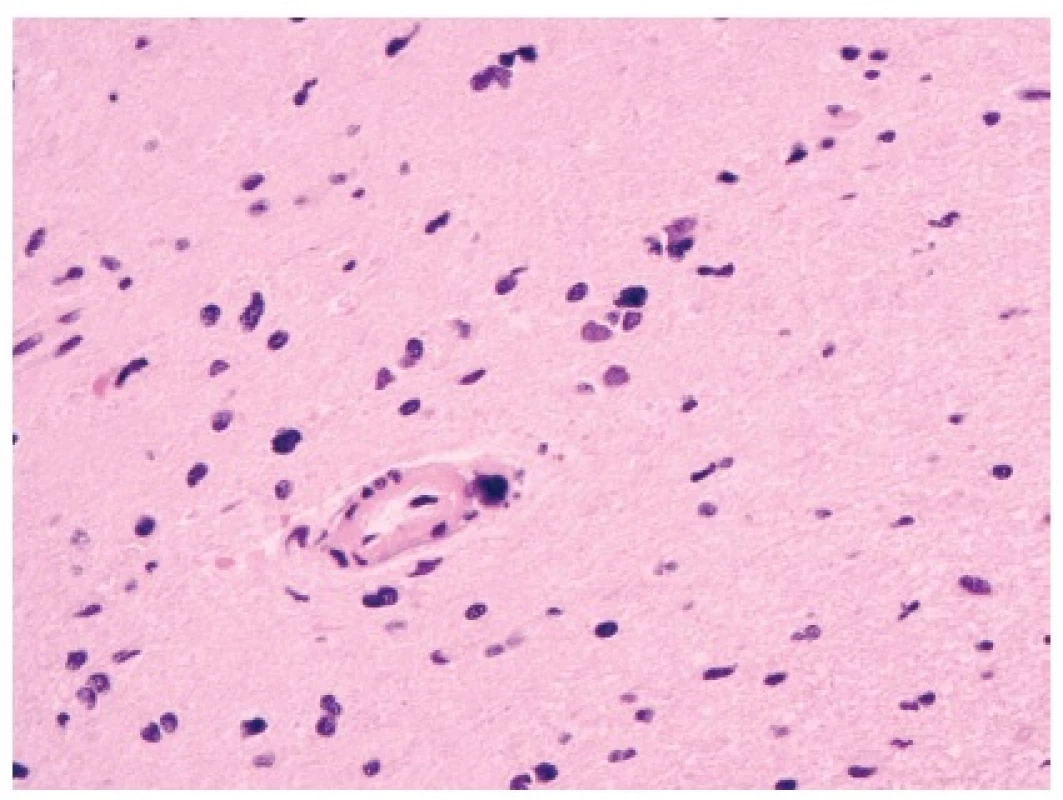
Kromě nekrózy mozkového parenchymu jsou typické změny na drobných cévách (fibrinoidní změna, hyalinizace). Atypie reaktivních astrocytů mohou být velmi výrazné. Proliferační aktivita těchto atypických buněk je ale minimální až nulová (HE, 400x). Existuje však několik nástrojů, jak se chybné diagnóze vyhnout. Nejdůležitější je samozřejmě dostatek klinických informací, zejména o předchozí radioterapii extrakraniálního nádoru oblasti hlavy a krku. Latence, se kterou se radionekróza rozvíjí, může být velmi dlouhá – mezi 1 měsícem až několika lety (!) – a tato doba je závislá na dávce a délce ozařování (40). Kromě několika znaků na MRI zobrazení, kterými se radionekróza od high-grade gliomů liší (např. jiný charakter lemu postkontrastního sycení), je důležité vyšetření pozitronovou emisní tomografií (PET), kde je radionekróza na rozdíl od nádorů hypometabolická (“němá”). V pozdějších fázích rozvoje dochází v radionekróze ke kalcifikacím (což je nejlépe vidět na zobrazení CT), často v hluboké bílé hmotě nebo na hranici mezi kůrou a bílou hmotou.
Mikroskopicky jsou drobná ložiska nekróz centrovaná na cévy (u glioblastomů jsou nekrózy geografické bez angiocentrické distribuce)(38). Na rozdíl od high-grade gliomů radionekróza také nemá pseudopalisády nádorových buněk, nýbrž přechází postupně do nepostiženého parenchymu. V radionekróze (na rozdíl od mozkového infarktu a demyelinizace) nenalézáme makrofágy ani zánětlivé elementy. Často bývají pozorovány nápadně hypertrofické astrocyty až gemistocytárního vzhledu. Cévy jsou při radionekróze změněny fibrinoidní nekrózou, hyalinizací nebo trombózou; u glioblastomu jsou cévy vitální s proliferací hypertrofického endotelu. Z hlediska diferenciální diagnózy vůči glioblastomu se také osvědčila imunohistochemická reakce na průkaz Ki67 (MIB-1) – v radionekróze bývají pozitivní prakticky pouze vitální makrofágy.
FOKÁLNÍ KORTIKÁLNÍ DYSPLAZIE (FCD)
Těmto malformacím spojeným s farmakorezistentní epilepsií jsme se podrobně věnovali v tomto časopise již dříve (41). FCD I. typu většinou postihují pouze kůru a na MRI zobrazení nemusejí být zřetelné. FCD II. typu se naopak na MRI může zobrazit jako kortiko-subkortikální léze se setřením hranice mezi šedou a bílou hmotou. Může tak napodobovat nádor (obr. 4); na rozdíl od demyelinizačních poruch a radionekrózy ale spíše low-grade nádory, hlavně gangliogliom nebo astrocytom.
Obr. 4. Fokální kortikální dysplazie. 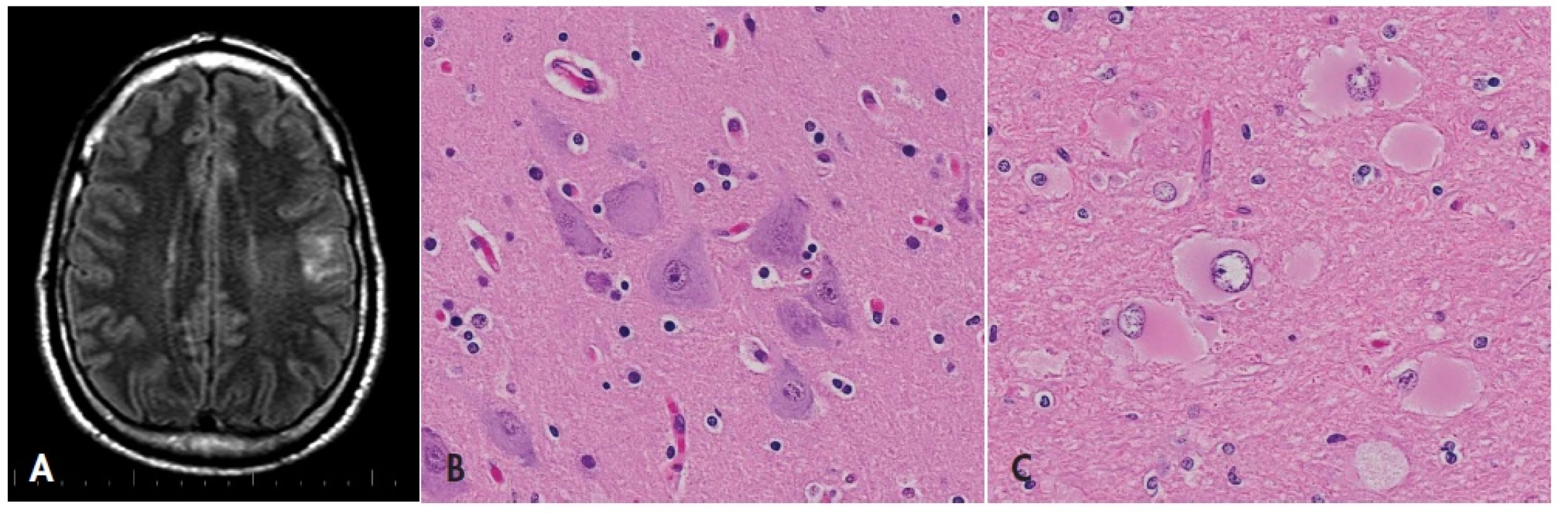
Stacionární tumoriformní ložisko v levém parietálním laloku na MRI (A, sekvence FLAIR, axiální rovina) odpovídá fokální kortikální dysplazii typu 2B – přítomny jsou kromě poruchy laminárního uspořádání kůry typické dysmorfní neurony (B) i balónovité buňky (C). HE, 600x. FCD II. typu má poměrně charakteristický mikroskopický obraz, kde kromě poruchy laminárního uspořádání kůry nalézáme diagnostické aberantní buňky – dysmorfní neurony a balónovité buňky. Nezkušenému by však zejména GFAP pozitivní balónovité buňky s atypickými jádry mohly připomínat gemistocytární astrocytom (obr. 4). Zmnožení GFAP+ astrocytů, které tyto poruchy také doprovází (42), by zase mohly vést k úvaze o fibrilárním astrocytomu. V diferenciální diagnóze je kromě cytologie dysmorfních a balónovitých buněk důležitý i kontext dysplastických změn v okolní kůře, klinická anamnéza farmakorezistentní epilepsie a absence proliferační aktivity.
ZÁVĚR
Rozlišení pseudoneoplastických lézí CNS od nádorové proliferace není v některých případech jednoduché. Snad s výjimkou nově dostupného imunohistochemického průkazu mutovaného proteinu IDH-1 zatím nejsou k dispozici jednoduché a jednoznačné histochemické či molekulární markery, které by tuto náročnou diferenciální diagnostiku usnadnily. Nezbývá než se opřít o pečlivou mikroskopickou analýzu v korelaci s klinickými daty a neuroradiologickým nálezem.
PODĚKOVÁNÍ
Podpora: Projekt (Ministerstva zdravotnictví ČR) koncepčního rozvoje výzkumné organizace 00064203 (FN Motol).
Adresa pro korespondenci:
Doc. MUDr. Josef Zámečník, Ph.D.
Ústav patologie a molekulární medicíny 2. LF UK a FN v Motole
V Úvalu 84, 150 06 Praha 5
tel.: 224 435 635, fax: 224 435 620
e-mail: josef.zamecnik@lfmotol.cuni.cz
Zdroje
1. Swain RS, Tihan T, Horvai AE, et al. Inflammatory myofibroblastic tumor of the central nervous system and its relationship to inflammatory pseudotumor. Hum Pathol 2008; 39(3): 410–419.
2. Hausler M, Schaade L, Ramaekers VT, et al. Inflammatory pseudotumors of the central nervous system: report of 3 cases and a literature review. Hum Pathol 2003; 34(3): 253–262.
3. Bertoni F, Unni KK, Dahlin DC, Beabout JW, Onofrio BM. Calcifying pseudoneoplasms of the neural axis. J Neurosurg 1990; 72(1): 42–48.
4. Wiebe S, Munoz DG, Smith S, Lee DH. Meningioangiomatosis. A comprehensive analysis of clinical and laboratory features. Brain 1999; 122 (Pt 4): 709–726.
5. Beressi N, Beressi JP, Cohen R, Modigliani E. Lymphocytic hypophysitis. A review of 145 cases. Ann Med Interne (Paris) 1999; 150(4): 327–341.
6. Prayson RA, Cohen ML. Practical Differential Diagnosis in Surgical Neuropathology. Totowa, NJ: Humana Press; 2000.
7. Yang B, Prayson RA. Expression of Bax, Bcl-2, and P53 in progressive multifocal leukoencephalopathy. Mod Pathol 2000; 13(10): 1115–1120.
8. Cunliffe CH, Fischer I, Monoky D, et al. Intracranial lesions mimicking neoplasms. Arch Pathol Lab Med 2009; 133(1): 101–123.
9. Giese A, Kucinski T, Hagel C, Lohmann F. Intracranial tuberculomas mimicking a malignant disease in an immunocompetent patient. Acta Neurochir (Wien) 2003; 145(6): 513–517.
10. Utsuki S, Oka H, Miyazaki T, et al. Primary central nervous system large B-cell lymphoma with prolific, mixed T-cell and macrophage infiltrates, mimicking multiple sclerosis. Brain Tumor Pathol 2010; 27(1): 59–63.
11. Singh A, Strobos RJ, Singh BM, et al. Steroid-induced remissions in CNS lymphoma. Neurology 1982; 32(11): 1267–1271.
12. Rivera-Zengotita M, Yachnis AT. Gliosis versus glioma?: don’t grade until you know. Adv Anat Pathol 2012; 19(4): 239–249.
13. Colodner KJ, Montana RA, Anthony DC, et al. Proliferative potential of human astrocytes. J Neuropathol Exp Neurol 2005; 64(2): 163–169.
14. Yaziji H, Massarani-Wafai R, Gujrati M, et al. Role of p53 immunohistochemistry in differentiating reactive gliosis from malignant astrocytic lesions. Am J Surg Pathol 1996; 20(9): 1086–1090.
15. Okamoto Y, Di Patre PL, Burkhard C, et al. Population-based study on incidence, survival rates, and genetic alterations of low-grade diffuse astrocytomas and oligodendrogliomas. Acta Neuropathol 2004; 108(1): 49–56.
16. Švajdler M, Rychlý B, Fröhlichová L, et al. Vybrané biomarkery primárnych nádorov centrálneho nervového systému: krátky prehľad. Cesk Patol 2012; 48(2): 65–71.
17. Camelo-Piragua S, Jansen M, Ganguly A, et al. A sensitive and specific diagnostic panel to distinguish diffuse astrocytoma from astrocytosis: chromosome 7 gain with mutant isocitrate dehydrogenase 1 and p53. J Neuropathol Exp Neurol 2011; 70(2): 110–115.
18. Bourne TD, Elias WJ, Lopes MB, Mandell JW. WT1 is not a reliable marker to distinguish reactive from neoplastic astrocyte populations in the central nervous system. Brain Pathol 2010; 20(6): 1090–1095.
19. Burel-Vandenbos F, Benchetrit M, Miquel C, et al. EGFR immunolabeling pattern may discriminate low-grade gliomas from gliosis. J Neurooncol 2011; 102(2): 171–178.
20. Wisniewski T, Goldman JE. Alpha B-crystallin is associated with intermediate filaments in astrocytoma cells. Neurochem Res 1998; 23(3): 385–392.
21. Dinda AK, Sarkar C, Roy S. Rosenthal fibres: an immunohistochemical, ultrastructural and immunoelectron microscopic study. Acta Neuropathol 1990; 79(4): 456–460.
22. Quinlan RA, Brenner M, Goldman JE, Messing A. GFAP and its role in Alexander disease. Exp Cell Res 2007; 313(10): 2077–2087.
23. Johnson AB, Brenner M. Alexander’s disease: clinical, pathologic, and genetic features. J Child Neurol 2003; 18(9): 625–632.
24. Lassmann H. Mechanisms of inflammation induced tissue injury in multiple sclerosis. J Neurol Sci 2008; 274(1–2): 45–47.
25. Barkhof F, Rocca M, Francis G, et al. Validation of diagnostic magnetic resonance imaging criteria for multiple sclerosis and response to interferon beta1a. Ann Neurol 2003; 53(6): 718–724.
26. Paty DW, Oger JJ, Kastrukoff LF, et al. MRI in the diagnosis of MS: a prospective study with comparison of clinical evaluation, evoked potentials, oligoclonal banding, and CT. Neurology 1988; 38(2): 180–185.
27. Yamada S, Yamada SM, Nakaguchi H, et al. Tumefactive multiple sclerosis requiring emergent biopsy and histological investigation to confirm the diagnosis: a case report. J Med Case Rep 2012; 6(1): 104.
28. Kaeser MA, Scali F, Lanzisera FP, Bub GA, Kettner NW. Tumefactive multiple sclerosis: an uncommon diagnostic challenge. J Chiropr Med 2011; 10(1): 29–35.
29. Annesley-Williams D, Farrell MA, Staunton H, Brett FM. Acute demyelination, neuropathological diagnosis, and clinical evolution. J Neuropathol Exp Neurol 2000; 59(6): 477–489.
30. Sugita Y, Terasaki M, Shigemori M, Sakata K, Morimatsu M. Acute focal demyelinating disease simulating brain tumors: histopathologic guidelines for an accurate diagnosis. Neuropathology 2001; 21(1): 25–31.
31. Zagzag D, Miller DC, Kleinman GM, et al. Demyelinating disease versus tumor in surgical neuropathology. Clues to a correct pathological diagnosis. Am J Surg Pathol 1993; 17(6): 537–545.
32. Lucchinetti CF, Gavrilova RH, Metz I, et al. Clinical and radiographic spectrum of pathologically confirmed tumefactive multiple sclerosis. Brain 2008; 131(Pt 7): 1759–1775.
33. Fong IW, Toma E. The natural history of progressive multifocal leukoencephalopathy in patients with AIDS. Canadian PML Study Group. Clin Infect Dis 1995; 20(5): 1305–1310.
34. Kodetová D, Jirásek A, Briner J, Fales E. Progresivní multifokální leukoencefalopatie (PML): Morfologické možnosti diagnostiky klasickými metodami a in situ hybridizací. Cesk Patol 1999; 35(1): 5–9.
35. Hoche F, Pfeifenbring S, Vlaho S, et al. Rare brain biopsy findings in a first ADEM-like event of pediatric MS: histopathologic, neuroradiologic and clinical features. J Neural Transm 2011; 118(9): 1311–1317.
36. Gavra M, Boviatsis E, Stavrinou LC, Sakas D. Pitfalls in the diagnosis of a tumefactive demyelinating lesion: A case report. J Med Case Rep 2011; 5 : 217.
37. Ball WS, Jr., Prenger EC, Ballard ET. Neurotoxicity of radio/chemotherapy in children: pathologic and MR correlation. AJNR Am J Neuroradiol 1992; 13(2): 761–776.
38. Burger P, Boyko O. The pathology of central nervous system radiation injury. In: Gutin P, Leibel S, Sheline G, eds. Radiation Injury to the Central Nervous System. New York, NY: Raven Press; 1991 : 191–208.
39. Nelson DR, Yuh WT, Wen BC, Ryals TJ, Cornell SH. Cerebral necrosis simulating an intraparenchymal tumor. AJNR Am J Neuroradiol 1990; 11(1): 211–212.
40. Marks JE, Wong J. The risk of cerebral radionecrosis in relation to dose, time and fractionation. A follow-up study. Prog Exp Tumor Res 1985; 29 : 210–218.
41. Zámečník J. Neuropatologie farmakorezistentní epilepsie - strukturální podklad a mechanismy epileptogeneze. Cesk Patol 2012; 48(2): 76–82.
42. Zámečník J, Homola A, Cicanič M, et al. The extracellular matrix and diffusion barriers in focal cortical dysplasias. Eur J Neurosci 2012; 36(1): 2017–2024.
Štítky
Patologie Soudní lékařství Toxikologie
Článek Vždy je co zlepšovatČlánek MĚKKÉ TKÁNĚČlánek Vyšetření HER-2/neu u karcinomu prsu - závěry ze setkání pracovní skupiny patologů a onkologůČlánek Kožní lymfoidní infiltrátyČlánek CYTODIAGNOSTIKAČlánek UROPATOLOGIEČlánek HEPATOPATOLOGIE
Článek vyšel v časopiseČesko-slovenská patologie

2012 Číslo 4-
Všechny články tohoto čísla
- Bitvy vyhrané i (zatím ještě) nevyhrané
- Vždy je co zlepšovat
- Úkoly nového výboru České společnosti patologů ČLS JEP
- NEUROPATOLOGIE, HEMATOPATOLOGIE, GYNEKOPATOLOGIE...
- Pleomorfní adenom slinných žláz: diagnostická úskalí a histologické nálezy budící podezření z malignity
- MĚKKÉ TKÁNĚ
- Pseudotumory centrálního nervového systému
- Pseudotumory a imitátory malignity v patologii hlavy a krku
- Histiocytární nekrotizující lymfadenitida /Kikuchiho-Fujimotova choroba (HNL/K-F) a její diferenciální diagnostika: analýza 19 případů
- Vyšetření HER-2/neu u karcinomu prsu - závěry ze setkání pracovní skupiny patologů a onkologů
- Kožní lymfoidní infiltráty
- CYTODIAGNOSTIKA
- Gliosarkóm s komponentou pripomínajúcou alveolárny rabdomyosarkóm: popis prípadu s doposiaľ nepopísanou sarkómovou zložkou
- UROPATOLOGIE
- Perineurálna diferenciácia v ganglioneurómoch. Súbor 8 prípadov s imunohistochemickou expresiou perineurálnych markerov
- Expresia markeru p57 v diferenciálnej diagnostike kompletnej a parciálnej moly – korelácia s DNA analýzou
- Profesor Andrej Böör sedemdesiatročný
- HEPATOPATOLOGIE
- Česko-slovenská patologie
- Archiv čísel
- Aktuální číslo
- Informace o časopisu
Nejčtenější v tomto čísle- Pleomorfní adenom slinných žláz: diagnostická úskalí a histologické nálezy budící podezření z malignity
- Histiocytární nekrotizující lymfadenitida /Kikuchiho-Fujimotova choroba (HNL/K-F) a její diferenciální diagnostika: analýza 19 případů
- Pseudotumory centrálního nervového systému
- Kožní lymfoidní infiltráty
Kurzy
Zvyšte si kvalifikaci online z pohodlí domova
Autoři: prof. MUDr. Vladimír Palička, CSc., Dr.h.c., doc. MUDr. Václav Vyskočil, Ph.D., MUDr. Petr Kasalický, CSc., MUDr. Jan Rosa, Ing. Pavel Havlík, Ing. Jan Adam, Hana Hejnová, DiS., Jana Křenková
Autoři: MUDr. Irena Krčmová, CSc.
Autoři: MDDr. Eleonóra Ivančová, PhD., MHA
Autoři: prof. MUDr. Eva Kubala Havrdová, DrSc.
Všechny kurzyPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



